Зоологический журнал, 2022, T. 101, № 12, стр. 1384-1393
Возраст, рост и плодовитость у лягушки Терентьева (Pelophylax terentievi, Amphibia, Ranidae)
А. А. Кидов a, *, Р. А. Иволга a, Т. Э. Кондратова a, А. А. Иванов a
a Российский государственный аграрный университет – МСХА имени К.А. Тимирязева
127550 Москва, ул. Тимирязевская, 49, Россия
* E-mail: kidov@rgau-msha.ru
Поступила в редакцию 28.04.2022
После доработки 02.06.2022
Принята к публикации 03.06.2022
- EDN: XTTUJD
- DOI: 10.31857/S004451342211006X
Аннотация
Лягушка Терентьева (Pelophylax terentievi) является одним из наименее изученных представителей рода. В работе впервые представлены результаты изучения возрастной структуры и роста у этого вида при помощи метода скелетохронологии, а также результаты оценки плодовитости. Были изучены 36 экз. из южного Таджикистана (окрестности пос. Шахритуз, Хатлонская область). У всех особей в поперечных сечениях костей были обнаружены линии задержанного роста. Средний возраст составил 3.5 ± 0.98 лет у самок и 4.1 ± 1.38 лет у самцов, а максимальный возраст – 5 и 6 лет соответственно. Взрослые самки и самцы не различались по длине тела, однако первые способны достигать в течение жизни большей длины тела (SVLmax составляет 99.16 мм для самок и 62.84 мм для самцов), при этом их коэффициент роста (k) существенно меньше, чем у самцов (0.182 против 0.549 соответственно). Для самок были характерны более низкие показатели расчетной выживаемости (S 0.72 у самок и 0.77 у самцов) и ожидаемой продолжительности жизни (ESP – 4.11 лет у самок и 4.86 лет у самцов). Лягушки достигают половой зрелости в возрасте 3–4 лет, а их абсолютная плодовитость составляет 138–3317 яиц на особь.
Лягушка Терентьева (Pelophylax terentievi (Mezhzherin 1992)) была описана из южного Таджикистана на основании отличий от озерной лягушки (P. ridibundus (Pallas 1771)), к которой в прошлом относили всех зеленых лягушек Центральной Азии (Банников и др., 1977; Саид-Алиев, 1979; Атаева, 1981), по ряду морфологических признаков (длины тела, морды, внутреннего пяточного бугра) и индексов пропорциональности тела (отношения длины глаза к длине тела, длины бедра к длине голени, длины первого пальца задней конечности к длине внутреннего пяточного бугра) (Межжерин, 1992). Кроме того, для P. terentievi методом электрофореза белков были установлены семь диагностических генетических локусов, аллельные варианты трех из них оказались уникальными для этого вида (Межжерин, 1992). Сейчас видовая самостоятельность P. terentievi признается большинством исследователей (Ананьева и др., 1998; Кузьмин, 2012; Кидов и др., 2021), причем было выявлено, что лягушка Терентьева распространена существенно шире, чем считалось ранее – в Китае, Афганистане и Иране (Fei et al., 2012; Wagner et al., 2016; Кидов, 2022). При этом трудности в соотнесении уже известных литературных сведений по биологии зеленых лягушек Центральной Азии со сведениями о P. terentievi связаны с тем, что в регионе обитают адвентивные популяции еще двух представителей этого рода – P. nigromaculatus (Hallowell 1861) и P. ridibundus (Кузьмин, 2012). Таким образом, несмотря на относительно широкое распространение и высокую численность, биология лягушки Терентьева остается неизученной (Кузьмин, 2012). В частности, до настоящего времени для этого вида не выявлены такие важные демографические характеристики, как возраст достижения половой зрелости, возрастная структура и плодовитость. В настоящем сообщении мы предприняли попытку охарактеризовать эти показатели для популяции, чья принадлежность к P. terentievi не вызывает сомнений, – из окрестностей пос. Шахритус (= Шаартуз) Хатлонской обл. Республики Таджикистан (Межжерин, 1992).
МАТЕРИАЛ И МЕТОДЫ
Материалом для исследований послужили 36 особей лягушки Терентьева, пойманных в пойменных водоемах на левом берегу р. Кафирниган (37°15′ с.ш., 68°09′ в.д., 360 м над ур. м.). Все животные были отловлены 14 апреля 2019 г. – в период массового икрометания.
У зафиксированных в 70%-м растворе этанола лягушек электронным штангенциркулем измеряли длину тела (SVL) и изымали кости голеней для определения возраста. Половозрелыми считали особей с созревшими гонадами. Плодовитость определяли объемно-весовым методом (Правдин, 1958).
При изучении возраста и особенностей роста лягушек использовали стандартный метод скелетохронологии (Смирина, Макаров, 1987; Смирина, 1989). После очистки и декальцинации костей, из середины диафиза голени (этот участок костной ткани подвергается резорбции в наименьшей степени (Rozenblut, Ogielska, 2005)) с помощью санного микротома МС-2, снабженного замораживающим столиком ОЛ-ЗСО 30, изготовляли поперечные срезы толщиной 20–25 мкм. Срезы окрашивали гематоксилином Эрлиха и изучали под электронным микроскопом Микромед P-1 при 100–400-кратном увеличении. Индивидуальный возраст особей определяли путем подсчета тонких темных линий задержанного роста (линии склеивания), сформировавшихся в надкостнице во время гибернаций. Микрофотографии поперечных срезов выполнены при 100-кратном увеличении цифровой камерой Levenhuk M500 BASE.
Статистическую обработку данных производили в программах Microsoft Excel и STATISTIKA 10. Рассчитывали среднее арифметическое и стандартное отклонение (M ± SD), а также размах признаков (min–max). Гипотезы о нормальности и гомогенности распределения выборок проверяли при помощи критериев Лиллиефорса и Левена.
Статистическую значимость наблюдаемых различий по длине тела между особями разных возрастных групп определяли однофакторным дисперсионным анализом, а при попарном сравнении использовали тест Тьюки. Для оценки полового диморфизма применяли t-критерий Стьюдента (tst). При изучении взаимосвязи длины тела и возраста лягушек рассчитывали коэффициент ранговой корреляции Спирмена (r).
Рост лягушек описывали с помощью уравнения Берталанфи (von Bertalanffy, 1938):
Для расчета SVLmet мы использовали данные о длине тела сеголетков, отловленных в ближайшем к Шахритусу локалитете – в заповеднике “Тигровая Балка”, и хранящихся в фондах сектора Герпетологии Научно-исследовательского зоологического музея МГУ имени М.В. Ломоносова (ZMMU А-2112). Мы определили tmet как 0.25 лет; а SVLmet как 28.43 ± 2.712 мм.
Значения SVLmax и k были рассчитаны с помощью нелинейного оценивания.
Годовая оценка выживаемости лягушек была определена по формуле Робсона и Чепмена (Robson, Chapman, 1961):
Ожидаемая продолжительность жизни лягушек была оценена по формуле Себера (Seber, 1973):
где ESP – ожидаемая продолжительность жизни, S – показатель выживаемости. ESP может отличаться от максимального зарегистрированного возраста изученных особей.РЕЗУЛЬТАТЫ
Возрастная структура. Изучение гонад показало, что выборка содержала 24 самки (включая 6 неполовозрелых особей) и 12 самцов (3 неполовозрелые особи).
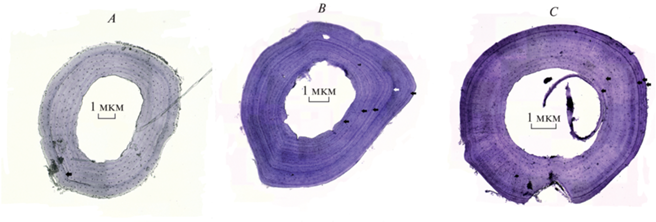
На изготовленных гистологических препаратах первая линия склеивания всегда полностью (у 11 особей) или частично (у 25 особей) сохранялась (рис. 1).
Рис. 1.
Поперечные срезы костей голеней самок Pelophylax terentievi: А – однолетняя особь (42.23 мм), B – четырехлетняя особь с дополнительной линией склеивания (отмечена белой стрелкой) (71.51 мм), C – пятилетняя особь (65.09 мм).
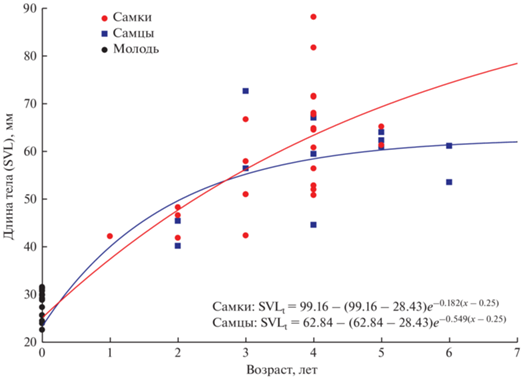
Возраст самок варьировал в диапазоне от 1 до 5 лет (в среднем 3.5 ± 0.98), а самцов – от 2 до 6 лет (4.1 ± 1.38). В группе самок преобладали четырехлетние (54.2%), а в группе самцов – четырехлетние (25.0%) и пятилетние особи (25.0%) (табл. 1).
Таблица 1.
Длина тела Pelophylax terentievi в разных половозрастных группах
| Возрастная группа | n | Пол | Длина тела (SVL), мм | Половозрелые особи, экз./% | ||
|---|---|---|---|---|---|---|
| M | SD | min–max | ||||
| 1+ | 1 | Самки | 42.23 | – | – | 0/0 |
| 2+ | 3 | Самки | 45.54 | 3.273 | 41.90–48.24 | 0/0 |
| 2 | Самцы | 42.69 | 3.705 | 40.07–45.31 | 0/0 | |
| 3+ | 5 | Самки | 53.76 | 9.119 | 42.30–66.70 | 3/60 |
| 2 | Самцы | 64.47 | 11.505 | 56.33–72.60 | 2/100 | |
| 4+ | 13 | Самки | 65.42 | 11.254 | 50.78–88.08 | 13/100 |
| 3 | Самцы | 56.99 | 11.409 | 44.59–67.04 | 2/67 | |
| 5+ | 2 | Самки | 63.19 | 2.694 | 61.28–65.09 | 2/100 |
| 3 | Самцы | 62.39 | 1.546 | 60.88–63.97 | 3/100 | |
| 6+ | 2 | Самцы | 57.32 | 5.431 | 53.48–61.16 | 2/100 |
Рост. Размах длины тела (SVL) у неполовозрелых самок составил 41.90–50.92 мм (в среднем 45.35 ± 3.784), у неполовозрелых самцов – 40.07–45.31 мм (43.32 ± 2.840). Длина тела самок со зрелыми половыми продуктами 50.78–88.08 мм (64.03 ± 10.204), у взрослых самцов 53.48–72.60 мм (61.90 ± 5.650).
Группы половозрелых самок разных возрастов статистически значимо не различались по средним значениям длины тела (F = 0.535, df = 17, p = = 0.596). При анализе всех самок были отмечены достоверные различия среднегрупповых значений длины тела (F = 4.124, df = 22, p = 0.021), но только между двухлетними и четырехлетними особями (Q = 4.41, p = 0.027).
Разные возрастные группы самцов не имели значимых различий по средним значениям длины тела (F = 2.412, df = 11, p = 0.146 – для половозрелых; F = 0.503, df = 8, p = 0.697 – для всей выборки).
Мы не выявили статистически значимых различий между самцами и самками по средним значениям длины тела у половозрелых особей (tst = = 0.578, df = 25, p = 0.094) и у всей выборки лягушек (tst = 0.518, df = 34, p = 0.450). Кроме того, не было обнаружено достоверных различий при сравнении длины тела у разных половозрастных групп взрослых особей (F = 0.368, df = 26, p = = 0.891) и у половозрастных групп всей выборки лягушек (F = 2.654, df = 34, p = 0.051).
Только для всей группы самок была отмечена статистически значимая корреляция между возрастом и длиной тела (r = 0.62, p ≤ 0.05). При этом такая связь не была найдена ни для половозрелых самок (r = 0.09, p > 0.05), ни для половозрелых самцов (r = –0.29, p > 0.05), ни для всей выборки самцов (r = 0.32, p > 0.05).
Согласно уравнению Берталанфи, максимально возможная длина тела (SVLmax), которую особи из изученной популяции способны достичь в течение жизни, была определена как 99.16 мм у самок и 62.84 мм у самцов. Самцы оказались способны достигать предельной длины тела быстрее, чем самки (k составил 0.549 и 0.182 соответственно) (рис. 2).
Половая зрелость и плодовитость. В возрасте трех лет 60% изученных самок и 100% самцов достигли половой зрелости. Всего 12 самок (одна трехлетняя и 11 четырехлетних особей) имели зрелые ооциты; 4 (одна трехлетняя, 2 четырехлетние и одна пятилетняя особи) имели созревающие ооциты; 2 (трехлетняя и пятилетняя особи) не имели яиц и, вероятно, успели размножиться до отлова. Количество зрелых ооцитов варьировало в пределах 138–3317 (1429 ± 1222.2) на особь. Наибольшее число яиц (3317) имела четырехлетняя самка (SVL = 81.64 мм), а наименьшее (138) – трехлетняя (SVL = 57.96 мм).
ОБСУЖДЕНИЕ
В отличие от результатов многих других работ по изучению возрастной структуры зеленых лягушек Pelophylax методом скелетохронологии (Socha, Ogielska, 2010; Клевезаль, Смирина, 2016; Ляпков, 2016), в наших исследованиях у особей P. terentievi было отмечено более сложное формирование слоев в трубчатых костях: на полученных срезах присутствовали дополнительные темные кольца. Эти кольца были трудно отличимы от истинных линий задержанного роста, соответствующих периодам зимней спячки (рис. 1B). Ранее на такой характер роста трубчатых костей у P. ridibundus, населяющих пруды с родниковым питанием в Талышских горах (Азербайджан), обратили внимание Ляпков с соавторами (Lyapkov et al., 2021). Авторы объясняли образование дополнительных линий на срезах наличием нескольких периодов активности и замедления роста в течение года.
В Шахритусе наиболее продолжительные периоды низких температур зимой могли быть настолько холодными, что рост лягушек замедлялся или полностью прекращался. Мы считаем, что именно в этот период образовывались линии задержанного роста, соответствовавшие гибернациям. При этом образование темных участков между этими линиями, по всей видимости, маркирует периоды замедления роста вследствие снижения интенсивности питания в жаркие летние месяцы. Подтверждением этой версии могут служить результаты исследований Смириной с соавторами (1986), согласно которым у бурых лягушек рода Rana под воздействием принудительной двухнедельной голодовки летом образовывались дополнительные линии на срезах трубчатых костей.
Стоит отметить, что наличие дополнительных линий склеивания можно заметить на иллюстрациях, представленных в работах по изучению возрастной структуры и у других бесхвостых (Erismis, 2018; Altunişik et al., 2020) и хвостатых (Houck, Francillon-Vieillot, 1988; Wake, Castanet, 1995; Castanet et al., 1996) земноводных. Вероятно, наблюдаемый характер роста трубчатых костей является распространенным у видов, для которых в течение года характерны гибернация и эстивация, или же голодание в засушливые месяцы.
Отсутствие различий в размерах тела у разных возрастных групп P. terentievi свидетельствует о высокой индивидуальной изменчивости роста и его затухании после достижения половой зрелости. По длине тела лягушки Терентьева из Шахритуса сопоставимы с другими мелкими представителями рода (P. lessonae (Camerano 1882), P. perezi (López-Seoane 1885), P. porosus (Cope 1868), P. saharicus (Boulenger 1913)) или отдельными популяциями относительно крупных видов (P. bedriagae (Camerano 1882) (озеро Сюлюклю, Турция), P. ridibundus (интродуцированная популяция в г. Петропавловск-Камчатский, Россия). В сравнении с P. bedriagae, P. caralitanus (Arikan 1988), P. epeiroticus (Schneider, Sofianidou et Kyriakopoulou-Sklavounou 1984) и P. nigromaculatus (Hallowell 1861), P. ridibundus из большинства изученных популяций P. terentievi заметно мельче (табл. 2).
Таблица 2.
Сравнение размеров тела, возраста и параметров роста у Pelophylax terentievi и родственных видов
| Вид | Локалитет | Пол | n | Средняя длина тела, мм | Предельная длина тела, мм | Максимальный возраст, лет | Возраст половозрелости, лет | Средний возраст, лет | k | Источник |
|---|---|---|---|---|---|---|---|---|---|---|
| P. bedriagae | водохранилище Вали Реджеп Языджиоглу, пров. Денизли, Турция | Самцы | 30 | 63.01 | 80.17 | 9 | 2 | 4.59 | 0.183 | Başkale et al., 2018 |
| Самки | 22 | 71.20 | 83.75 | 9 | 2 | 5.20 | 0.270 | |||
| оз. Сюлейманлы, пров. Денизли, Турция | Самцы | 24 | 68.01 | 73.80 | 11 | 2 | 6.44 | 0.371 | ||
| Самки | 25 | 76.63 | 82.67 | 12 | 2 | 6.46 | 0.219 | |||
| оз. Аджыгёль, пров. Денизли, Турция | Самцы | 15 | 63.09 | 70.04 | 9 | 2 | 5.59 | 0.370 | ||
| Самки | 17 | 71.93 | 80.79 | 9 | 2 | 5.13 | 0.237 | |||
| долина Орназ, пров. Денизли, Турция | Самцы | 14 | 69.49 | 78.64 | 12 | 2 | 5.90 | 0.193 | ||
| Самки | 14 | 81.14 | 96.41 | 12 | 2 | 6.80 | 0.331 | |||
| оз. Сюлюклю, пров. Маниса, Турция | Самцы | 14 | 56.10 | 73.20 | 4 | 2 | 2.50 | 0.300 | Çiçek et al., 2011 | |
| Самки | 22 | 64.50 | 92.40 | 5 | 2 | 2.95 | ||||
| Самцы | 51 | 59.80 | 120.00 | 7 | 2 | 3.45 | 0.220 | İsmail, Çiçek, 2017 | ||
| Самки | 76 | 59.78 | 137.00 | 9 | 2 | 4.33 | 0.360 | |||
| Дёртъёл, пров. Хатай, Турция | Самцы | 20 | 64.70 | – | 11 | 3 | 5.50 | – | Gül et al., 2011 | |
| Самки | 19 | 76.44 | – | 7 | 4 | 5.58 | – | |||
| пров. Лурестан, Иран | Самцы | 26 | 71.14 | – | 11 | 3 | 6.43 | – | Ashkavandi et al., 2012 | |
| Самки | 14 | 74.05 | – | 7 | 3 | 4.50 | – | |||
| P. caralitanus | оз. Ишиклы, пров. Денизли, Турция | Самцы | 34 | 72.62 | 103.00 | 8 | 2 | 4.53 | 0.194 | Arısoy, Başkale, 2019 |
| Самки | 38 | 79.16 | 115.80 | 9 | 2–3 | 5.03 | 0.289 | |||
| оз. Бейшехир, пров. Конья, Турция | Самцы | 35 | 80.63 | 117.20 | 9 | 3 | 4.66 | 0.118 | ||
| Самки | 35 | 89.40 | 128.80 | 10 | 2–3 | 5.43 | 0.180 | |||
| Самцы | 38 | 75.56 | 109.00 | 9 | 3–4 | 5.01 | 0.180 | Erismis, Chinsamy, 2010 | ||
| Самки | 51 | 92.05 | 126.24 | 10 | 3–4 | 6.01 | 0.160 | |||
| Самцы | 96 | 90.41 | 111.35 | 9 | 3 | 5.63 | – | Erismis, 2018 | ||
| Самки | 73 | 98.29 | 126.50 | 10 | 3 | 6.33 | – | |||
| оз. Карамык Батаклыгы, пров. Афьонкарахисар, Турция | Самцы | 66 | 82.33 | 99.48 | 7 | 3 | 4.86 | – | ||
| Самки | 76 | 88.36 | 111.63 | 8 | 3 | 5.30 | – | |||
| оз. Ишиклы, пров. Денизли, Турция | Самцы | 49 | 73.06 | 93.68 | 6 | 2 | 3.69 | – | ||
| Самки | 47 | 82.54 | 106.72 | 8 | 2 | 4.80 | – | |||
| оз. Эгридир, пров. Ыспарта, Турция | Самцы | 90 | 86.44 | 110.12 | 8 | 3 | 5.42 | – | ||
| Самки | 97 | 94.52 | 120.28 | 10 | 3 | 6.21 | – | |||
| P. epeiroticus | оз. Янина, периферия Эпир, Греция | Самцы | 145 | 72.74 | 81.36 | 5 | 1 | 2.82 | 0.880 | Tsiora, Kyriakopoulou-Sklavounou, 2002 |
| Самки | 173 | 83.63 | 106.70 | 5 | 1 | 2.50 | 0.490 | |||
| P. esculentus | Беловарско-Билогорская жупания, Хорватия | Самцы | 23 | – | – | 10 | – | 5.10 | – | Čavlović et al., 2018 |
| Самки | 17 | |||||||||
| P. esculentus complex | заповедник “Остров Брэила”, обл. Валахия, Румыния | Самцы | 7 | 81.50 | 90.50 | 10 | – | 5.00 | 0.220 | Cogălniceanu, Miaud, 2003 |
| Самки | 29 | 95.60 | 108.00 | 10 | – | 6.70 | 0.280 | |||
| заповедник “Милицкие пруды”, Польша | Самцы | 32 | 72.20 | 90.00 | 6 | 2 | 3.70 | 0.760 | Socha, Ogielska, 2010 | |
| Самки | 38 | 79.80 | 102.30 | 7 | 3 | 4.40 | 0.590 | |||
| P. lessonae | Луга, Ленинградская обл., Россия | Самцы | 83 | – | – | 6 | 1–2 | 3.08 | – | Боркин, Тихенко, 1979 |
| Самки | 51 | – | – | 6 | 2 | 3.49 | – | |||
| Беловарско-Билогорская жупания, Хорватия | Самцы | 9 | – | – | 10 | – | 4.80 | – | Čavlović et al., 2018 | |
| Самки | 7 | |||||||||
| Москва, Россия | Самцы | 30 | 59.10 | – | 6 | 2 | 3.4 | – | Степанкова, 2021 | |
| Самки | 12 | 65.80 | – | 6 | 3 | 4.6 | – | |||
| P. nigromaculatus | Наньчун, пров. Сычуань, Китай | Самцы | 79 | 66.00 | 66.63 | 6 | 2 | 2.80 | 17.490 | Mao et al., 2012 |
| Самки | 60 | 71.20 | 83.73 | 7 | 3 | 3.02 | 0.520 | |||
| Баосин, пров. Сычуань, Китай | Самцы | 22 | 66.55 | 70.22 | 4 | – | 2.36 | 0.738 | Liao et al., 2010 | |
| Самки | 24 | 75.74 | 77.97 | 4 | – | 2.75 | 0.498 | |||
| Аньцзи, пров. Чжэцзян, Китай | Самцы | 32 | 72.18 | 78.83 | 4 | – | 2.38 | 0.507 | ||
| Самки | 32 | 83.88 | 100.12 | 5 | – | 2.97 | 0.312 | |||
| P. perezi | Порриньо, пров. Галисия, Испания | Самцы | 345 | – | – | 5 | 1 | – | – | Patón et al., 1991 |
| Самки | 184 | – | – | 6 | 2 | – | – | |||
| Национальный парк Монфрагуэ, пров. Касерес, Испания | Самцы | 34 | 52.00 | – | 4 | 1 | 2.32 | – | Esteban et al., 1996 | |
| Самки | 26 | 65.60 | – | 6 | 2 | 3.54 | – | |||
| P. porosus | префектура Хёго, Япония | Самцы | 32 | 49.20 | 59.40 | 4 | 1 | – | – | Khonsue et al., 2002 |
| Самки | 22 | 57.60 | 81.90 | 4 | 1 | – | – | |||
| Матида, префектура Токио, Япония | Самцы | 107 | 57.50 | 63.00 | 3 | 0 | 1.24 | – | Togane et al., 2018 | |
| Самки | 77 | 67.60 | 72.17 | 4 | 1 | 1.81 | – | |||
| Сагамихава, префектура Канагава, Япония | Самцы | 72 | 57.20 | 62.07 | 3 | 0 | 1.13 | – | ||
| Самки | 46 | 65.90 | 71.00 | 3 | 1 | 1.50 | – | |||
| P. ridibundus | р. Раздан, Ереван, Армения | Самцы | 16 | – | – | 5 | 2 | 2.25 | – | Александровская, Котова, 1986 |
| Самки | 16 | – | – | 6 (7) | 3–4 | 3.50 | – | |||
| р. Хосров, Хосровский заповедник, Араратская обл., Армения | Самцы | 13 | – | – | 8 (9) | 3–4 | 6.92 | – | ||
| Самки | 7 | – | – | 9 | 3–4 | 7.00 | – | |||
| оз. Севан, Гехаркуникская обл., Армения | Самцы | 52 | – | – | 10 | 3–4 | 5.79 | – | ||
| Самки | 25 | – | – | 9 | 3–4 | 5.52 | – | |||
| Боржомский каньон, край Самцхе-Джавахети, Грузия | Самцы | 19 | – | – | 4 | 2 | 2.79 | – | Gokhelashvili, Tarkhnishvili, 1994 | |
| Самки | 13 | – | – | 5 | 2 | 2.92 | – | |||
| Йылдызлы, пров. Трабзон, Турция | Самцы | 38 | 64.58 | – | 7 | 3 | 3.90 | – | Yilmaz et al., 2005 | |
| Самки | 11 | 74.64 | – | 6 | 3 | 3.72 | – | |||
| P. ridibundus | оз. Карагёль, пров. Артвин, Турция | Самцы | 20 | 72.96 | – | 8 | 2 | 5.15 | – | Gül et al., 2011 |
| Самки | 25 | 63.49 | – | 7 | 2 | 4.20 | – | |||
| Лагос, периферия Восточная Македония и Фракия, Греция | Самцы | 52 | 69.03 | 93.40 | 5 | 1 | 2.96 | 0.570 | Kyriakopoulou-Sklavounou et al., 2008 | |
| Самки | 56 | 82.38 | 107.50 | 5 | 1 | 3.73 | 0.540 | |||
| пос. Рефтинский, Свердловская обл., Россия | Самцы | – | – | – | – | – | – | – | Иванова, Жигальский, 2011 | |
| Самки | 79 | 112.90 | – | 8 | 2 | 4.40 | – | |||
| Верхний Тагил, Свердловская обл., Россия | Самцы | – | – | – | – | – | – | – | ||
| Самки | 62 | 92.80 | – | 9 | 2 | 5.40 | – | |||
| Сым, Астаринский район, Азербайджан | Самцы | 9 | 74.55 | – | 7 | 2 | 4.00 | – | Lyapkov et al., 2021 | |
| Самки | 7 | 93.97 | – | 5 | 3 | 4.00 | – | |||
| Паратунка, Камчатский край, Россия | Самцы | 10 | 78.50 | – | 9 | 2–3 | 4.20 | – | Ляпков, 2016; Романова и др., 2020 | |
| Самки | 8 | 86.62 | – | 5 | 2–3 | 4.50 | – | |||
| Петропавловск-Камчатский, Камчатский край, Россия | Самцы | 21 | 62.76 | – | 6 | 2–3 | 3.00 | – | ||
| Самки | 10 | 54.20 | – | 6 | 2–3 | 2.10 | – | |||
| Беловарско-Билогорская жупания, Хорватия | Самцы | 3 | – | – | 13 | – | 8.00 | – | Čavlović et al., 2018 | |
| Самки | 2 | – | – | – | – | |||||
| Москва, Россия | Самцы | 14 | 69.70 | – | 8 | 2 | 5.20 | – | Степанкова, 2021 | |
| Самки | 16 | 93.50 | – | 7 | 2 | 4.20 | – | |||
| P. saharicus | Эрфуд, Марокко | Самцы | 24 | 57.50 | – | 6 | 2 | 3.63 | – | Esteban et al., 1999 |
| Самки | 18 | 49.90 | – | 6 | 2 | 2.91 | – | |||
| Радес, вилайет Бен-Арус, Тунис | Самцы | 47 | – | – | 5 | 3 | – | – | Meddeb et al., 2007 | |
| Самки | 32 | – | – | 7 | 3 | – | – | |||
| Мензель-Бургиба, пров. Бизерта, Тунис | Самцы | 23 | – | – | 5 | 3 | – | – | ||
| Самки | 22 | – | – | 7 | 3 | – | – | |||
| P. terentievi | Шаартуз, Хатлонская обл., Таджикистан | Самцы | 12 | 57.26 | 62.84 | 6 | 3 | 4.08 | 0.549 | Наши данные |
| Самки | 24 | 59.36 | 99.16 | 5 | 3 | 3.50 | 0.182 |
Лягушки Терентьева из Шахритуса относятся к относительно недолгоживущим (схожи по этому показателю с P. epeiroticus, P. nigromaculatus, P. perezi, P. porosus и P. saharicus), но поздносозревающим (такими как P. bedriagae, P. caralitanus, P. esculentus (Linnaeus 1758), P. lessonae, P. ridibundus). Кроме того, ожидаемая продолжительность жизни особей (ESP) P. terentievi составила 4.11 лет для самок (S = 0.72) и 4.86 лет для самцов (S = = 0.77) и была значительно ниже, чем у родственного вида P. caralitanus (6.03–8.20 лет у самок и 5.50–7.52 лет у самцов) (Erismis, 2018; Arısoy, Başkale 2019).
Учитывая, что самки становились половозрелыми только в 3–4-летнем возрасте, а самые старшие имели возраст 5 лет (8.3%), можно утверждать, что большинство из них за свою жизнь размножаются только 1–2 раза.
Несмотря на то, что рядом авторов была отмечена положительная корреляция размеров самок и количества производимых ею яиц (Kupfer et al., 2004; Haddad, Prado, 2005; Gunzburger, 2006), нами не было обнаружено данной зависимости. В целом, абсолютная плодовитость лягушек Терентьева оказалась схожей с таковой у P. lessonae (размер кладок варьирует в пределах 415–4400 яиц) и P. nigromaculatus (600–5000 яиц), но была ниже, чем способны откладывать P. ridibundus (750–12 200 яиц) (Кузьмин, 2012).
Список литературы
Александровская Т.О., Котова Е.Л., 1986. Предварительные данные по возрастной характеристике озерной лягушки (Rana ridibunda Pallas) из трех точек Армении // Труды зоологического института АН СССР. Т. 157. С. 177–181.
Ананьева Н.Б., Боркин Л.Я., Даревский И.С., Орлов Н.Л., 1998. Земноводные и пресмыкающиеся. Энциклопедия природы России. М.: ABF. 576 с.
Атаева А.А., 1981. Земноводные Туркменистана. Дис. … канд. биол. наук. Киев. 144 с.
Банников А.Г., Даревский И.С., Ищенко В.Г., Рустамов А.К., Щербак Н.Н., 1977. Определитель земноводных и пресмыкающихся фауны СССР. М.: Просвещение. 415 с.
Боркин Л.Я., Тихенко Н.Д., 1979. Некоторые аспекты морфологической изменчивости, полиморфизма окраски, роста, структуры популяции и суточной активности Rana lessonae на северной границе ареала // Труды зоологического института АН СССР. Т. 89. С. 18–54.
Иванова Н.Л., Жигальский О.А., 2011. Демографические особенности популяций озерной лягушки (Rana ridibunda Pall.) интродуцированной в водоемы среднего Урала // Экология. № 5. С. 361–368.
Кидов А.А., 2022. Фауна, экология и охрана земноводных и пресмыкающихся Юго-Западного Прикаспия. Дис. … докт. биол. наук. М. 813 с.
Кидов А.А., Иволга Р.А., Кондратова Т.Э., Иванов А.А., Кидова Е.А., 2021. Сравнительная характеристика морфометрических показателей двух видов переднеазиатских зеленых лягушек (Amphibia, Anura, Ranidae, Pelophylax) // Ученые записки Крымского федерального университета имени В.И. Вернадского. Биология. Химия. Т. 7 (73). № 4. С. 48–59.
Клевезаль Г.А., Смирина Э.М., 2016. Регистрирующие структуры наземных позвоночных. Краткая история и современное состояние исследований // Зоологический журнал. Т. 95. № 8. С. 872–896.
Кузьмин С.Л., 2012. Земноводные бывшего СССР. Издание второе, переработанное. М.: Товарищество научных изданий КМК. 370 с.
Ляпков С.М., 2016. Озерная лягушка Pelophylax ridibundus на Камчатке: особенности местообитаний, размерного и возрастного состава популяций // Сохранение биоразнообразия Камчатки и прилегающих морей. Материалы ХVII международной науч. конф., посвященной 25-летию организации Камчатского института экологии и природопользования ДВО РАН. С. 94–98.
Межжерин С.В., 1992 Новый вид зеленых лягушек Rana terentievi sp. nova (Amphibia, Ranidae) из южного Таджикистана // Доклады АН Украины, математические, естественные, технические науки. № 5. С. 154–157.
Правдин И.Ф., 1958. Вопросы методики ихтиологических исследований // Труды Карельского филиала Академии наук СССР. Вып. VIII. С. 167–197.
Романова Е.Б., Рябинина Е.С., Ляпков С.М., 2020. Размерные, возрастные, фенетические, морфофизиологические и цитогенетические характеристики популяций озерной лягушки (Pelophylax ridibundus) (Amphibia, Ranidae) загрязненных термальных водоемов Камчатки // Зоологический журнал. Т. 99. № 8. С. 924–937.
Саид-Алиев С.А., 1979. Земноводные и пресмыкающиеся Таджикистана. Душанбе: Дониш. 146 с.
Смирина Э.М., 1989. Методика определения возраста амфибий и рептилий по слоям в кости // Руководство по изучению земноводных и пресмыкающихся. С. 144–153.
Смирина Э.М., Клевезаль Г.А., Бергер Л., 1986. Экспериментальное исследование формирования годового слоя в костях амфибий // Зоологический журнал. Т. 65. № 10. С. 1526–1534.
Смирина Э.М., Макаров А.Н., 1987. Об установлении соответствия числа слоев в трубчатых костях у амфибий возрасту особей // Зоологический журнал. Т. 66. № 4. С. 599–604.
Степанкова И.В., 2021. Фауна, экология и охрана земноводных Новой Москвы. Дис. … канд. биол. наук. М. 203 с.
Altunışık A., Gül S., Özdemir N., 2020. Impact of various ecological parameters on the life-history characteristics of Bufotes viridis sitibundus from Turkey // The Anatomical Record: Advances in Integrative Anatomy and Evolutionary Biology. V. 304. № 8. P. 1745–1758. https://doi.org/10.1002/ar.24571
Arısoy A.G., Başkale E., 2019. Body size, age structure and survival rates in two populations of the Beyşehir frog Pelophylax caralitanus // Herpetozoa. V. 32. P. 195–201. https://doi.org/10.3897/herpetozoa.32.e35772
Ashkavandi S., Gharzi A., Abbassi M., 2012. Age Determination by skeletochronology in Rana ridibunda (Anuran: Amphibia) // Asian Journal of Biological Sciences. V. 3. № 1. P. 156–162.
Başkale E., Ayşe S., Kaska Y., 2018. Age structures and growth parameters of the Levantine frog, Pelophylax bedriagae, at different localities in Denizli, Turkey // Acta Herpetologica. V. 13. № 2. P. 147–154. https://doi.org/10.13128/Acta_Herpetol-21026
Castanet J., Francillon-Vieillot H., Bruce R.C., 1996. Age estimation in desmognathine salamanders assessed by skeletochronology // Herpetologica. V. 52. № 2. P. 160–171.
Čavlović K., Buj I., Karaika D., Jelić D., Choleva L., 2018. Composition and age structure of the Pelophylax esculentus complex (Anura; Ranidae) population in inland Croatia // Salamandra. V. 54. № 1. P. 11–20.
Çiçek K., Kumaş M., Ayaz D., Mermer A., Engin Ş.D., 2011. Age structure of Levant water frog, Pelophylax bedriagae, in Lake Sülüklü (Western Anatolia, Turkey) // Basic and Applied Herpetology. V. 25. P. 73–80. https://doi.org/10.11160/bah.11012
Cogălniceanu D., Miaud C., 2003. Population age structure and growth in four syntopic amphibian species inhabiting a large river floodplain // Canadian Journal of Zoology. V. 81. № 6. P. 1096–1106. https://doi.org/10.1139/z03-086
Erismis U.C., 2018. Age, size, and growth of the Turkish endemic frog Pelophylax caralitanus (Anura: Ranidae) // The Anatomical Record: Advances in Integrative Anatomy and Evolutionary Biology. V. 301. № 7. P. 1224–1234. https://doi.org/10.1002/ar.23758
Erismis U.C., Chinsamy A., 2010. Ontogenetic changes in the epiphyseal cartilage of Rana (Pelophylax) caralitana (Anura: Ranidae) // The Anatomical Record Advances in Integrative Anatomy and Evolutionary Biology. V. 293. № 11. P. 1825–1837. https://doi.org/10.1002/ar.21241
Esteban M., García-París M., Buckley D., Castanet J., 1999. Bone growth and age in Rana saharica, a water frog living in a desert environment // Annales Zoologici Fennici. V. 36. № 1. P. 53–62.
Esteban M., García-París M., Castanet, J., 1996. Use of bone histology in estimating the age of frogs (Rana perezi) from a warm temperate climate area // Canadian Journal of Zoology. V. 74. № 10. P. 1914–1921. https://doi.org/10.1139/z96-216
Fei L., Ye C., Jiang J., 2012. Colored Atlas of Chinese Amphibians and Their Distributions. Sichuan, China: Sichuan Publishing House of Science & Technology. 620 p.
Gokhelashvili R.K., Tarkhnishvili D.N., 1994. Age structure of six Georgian anuran populations and its dynamics during two consecutive years // Herpetozoa. V. 7. № 1/2. P. 11–18.
Gül S., Özdemir N., Üzüm N., Olgun K., Kutrup B., 2011. Body size and age structure of Pelophylax ridibundus populations from two different altitudes in Turkey. Amphibia-Reptilia. V. 32. № 2. P. 287–292. https://doi.org/10.1163/017353711X559094
Gunzburger M.S., 2006. Reproductive ecology of the green treefrog (Hyla cinerea) in northwestern Florida // The American Midland Naturalist. V. 155. № 2. P. 321–328. https://doi.org/10.1674/0003-0031(2006)155[321:REO-TGT]2.0.CO;2
Haddad C.F.B., Prado C.P.A., 2005. Reproductive modes in frogs and their unexpected diversity in the Atlantic Forest of Brazil // BioScience. V. 55. № 3. P. 207–217.
Houck L.D., Francillon-Vieillot H., 1988. Tests for age and size effects on male mating success in a plethodontid salamander // Amphibia-Reptilia. V. 9. № 2. P. 135–144. https://doi.org/10.1163/156853888X00549
İsmail I.B., Çiçek K., 2017. Population size, age structure and life cycle of Levant water frog, Pelophylax bedriagae (Camerano, 1882) (Amphibia: Anura: Ranidae) in Lake Sülüklü (Manisa) // Ege Journal of Fisheries and Aquatic Sciences. V. 34. № 2. P. 169–177. https://doi.org/10.12714/egejfas.2017.34.2.08
Khonsue W., Matsui M., Misawa Y., 2002. Age determination of Daruma pond frog, Rana porosa brevipoda from Japan towards its conservation (Amphibia: Anura) // Amphibia-Reptilia. V. 23. № 3. P. 259–268. https://doi.org/10.1163/15685380260449144
Kupfer A., Nabhitabhata J., Himstedt W., 2004. Reproductive ecology of female caecilians (genus Ichthyophis): a baseline study // Biological Journal of the Linnean Society. V. 83. № 2. P. 207–217. https://doi.org/10.1111/j.1095-8312.2004.00382.x
Kyriakopoulou-Sklavounou P., Stylianou P., Tsiora A., 2008. A skeletochronological study of age, growth and longevity in a population of the frog Rana ridibunda from southern Europe // Zoology. V. 111. № 1. P. 30–36. https://doi.org/10.1016/j.zool.2007.03.002
Liao W.B., Zhou C.Q., Yang Z.S., Hu J.C., Lu X., 2010. Age, size and growth in two populations of the darkspotted frog Rana nigromaculata at different altitudes in southwestern China // Herpetological Journal. V. 20. № 2. P. 77–82.
Lyapkov S.M., Kondratova T.E., Ivolga R.A., Kidova E.A., Kidov A.A., 2021. Growth layers and its complex structure in a common species under uncommon conditions: Pelophylax ridibundus in the Talysh Mountains // Russian Journal of Herpetology. V. 28. № 5. P. 242–248. https://doi.org/10.30906/1026-2296-2021-28-5-242-248
Mao M., Huang Y., Mi Z., Liu Y., Zhou C., 2012. Skeletochronological study of age, longevity and growth in a population of Rana nigromaculata (Amphibia: Anura) in Sichuan, China // Asian Herpetological Research. V. 3. № 3. P. 258–264. https://doi.org/10.3724/SP.J.1245.2012.00258
Meddeb C., Nouira S., Cheniti T.L., Walsh P.T., Downie J.R., 2007. Age structure and growth in two Tunisian populations of green water frogs Rana saharica: a skeletochronological approach // Herpetological Journal. V. 17. № 1. P. 54–57.
Patón D., Juarranz A., Sequeros E., Pérez R., López-Torres M., de Quiroga G.B., 1991. Seasonal age and sex structure of Rana perezi assessed by skeletochronology // Journal of Herpetology. V. 25. № 4. P. 389–394. https://doi.org/10.2307/1564759
Robson D.S., Chapman D.G., 1961. Catch curves and mortality rates // Transactions of the American Fisheries Society. V. 90. № 2. P. 181–189. https://doi.org/10.1577/1548-8659(1961)90[181:CCAMR]2.0.CO;2
Rozenblut B., Ogielska M., 2005. Development and Growth of Long Bones in European Water Frogs (Amphibia: Anura: Ranidae), With Remarks on Age Determination // Journal of Morphology. V. 265. № 3. P. 304–317. https://doi.org/10.1002/jmor.10344
Seber G.A.F., 1973. The estimation of animal abundance and related parameters. London: Griffin. 506 p.
Socha M., Ogielska M., 2010. Age structure, size and growth rate of water frogs from central European natural Pelophylax ridibundus-Pelophylax esculentus mixed populations estimated by skeletochronology // Amphibia-Reptilia. V. 31. № 2. P. 239–250. https://doi.org/10.1163/156853810791069119
Togane D., Fukuyama K., Takai K., Kuramoto N., 2018. Body size and age structure in two populations of Tokyo daruma pond frog, Pelophylax porosus porosus // Current Herpetology. V. 31. № 1. P. 58–68. https://doi.org/10.5358/hsj.37.58
Tsiora A., Kyriakopoulou-Sklavounou P., 2002. A skeletochronological study of age and growth in relation to adult size in the water frog Rana epeirotica // Zoology. V. 105. № 1. P. 55–60. https://doi.org/10.1078/0944-2006-00049
von Bertalanffy L., 1938. A quantitative theory of organic growth (Inquires on growth laws. II) // Human Biology. V. 10. P. 181–213.
Wagner P., Bauer A.M., Leviton A.E., Wilms T.M., Böhme W., 2016. A checklist of the amphibians and reptiles of Afghanistan. Exploring herpetodiversity using biodiversity archives // Proceedings of the California Academy of Sciences. V. 63. № 13. P. 457–565.
Wake D.B., Castanet J., 1995. A skeletochronological study of growth and age in relation to adult size in a population of the plethodontid salamander Batrachoseps attenuates // Journal of Herpetology. V. 29. № 1. P. 60–65. https://doi.org/10.2307/1565086
Yilmaz N., Kutrup B., Çobanoğlu Ü., Özoran Y., 2005. Age determination and some growth parameters of a Rana ridibunda population in Turkey // Acta Zoologica Academiae Scientiarum Hungaricae. V. 51. № 1. P. 67–74.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал