Зоологический журнал, 2022, T. 101, № 2, стр. 123-144
Моллюски Аральского моря
Н. В. Аладин a, *, И. С. Плотников a, А. О. Смуров a
a Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: nikolai.aladin@zin.ru
Поступила в редакцию 05.12.2020
После доработки 01.05.2021
Принята к публикации 14.05.2021
- EDN: UGXKYC
- DOI: 10.31857/S0044513421120023
Аннотация
На основании литературных данных и проведенных авторами на протяжении более 30 лет исследований выполнен анализ фауны моллюсков Аральского моря. Рассмотрен и уточнен видовой состав моллюсков, обитавших в море в течение голоцена. Показано, что главной причиной изменений видового состава этой группы является уменьшение или увеличение солености среды, связанное с изменением уровня моря. Долговременные изменения солености морской воды, по нашему мнению, стали основной причиной бедности фауны моллюсков Арала. Мы предполагаем, что в пополнении фауны новыми видами большую роль играл перенос молоди моллюсков птицами. Вероятно, это верно для моллюсков семейства Cardiidae и Ecrobia grimmi. Другим источником пополнения фауны Аральского моря были виды, обитающие во впадающих в Арал реках и окрестных озерах. В статье подробно рассмотрен процесс изменений фауны во время последней регрессии моря. Наличие данных по солености, при которой вымерли моллюски, позволило ретроспективно оценить валидность полученных разными методами оценок соленостных границ существования тех же видов. Рассмотрено будущее фауны моллюсков Арала при реализации разных сценариев реабилитации моря.
Аральское море – большое бессточное соленое озеро в пустынной зоне Средней Азии на территории Казахстана и Узбекистана, терминальный водоем рек Сырдарьи на северо-востоке и Амударьи на юге (рис. 1). В Арале выделяются две главные его части: северная – Малое море, или Малый Арал, и южная – Большое море, или Большой Арал, разделявшиеся островом Кокарал. Большой Арал включает глубоководную западную впадину, обширную восточную часть и залив Тщебас (Бортник, Чистяева, 1990). Из-за этого Аральское море при снижении уровня распадается на остаточные водоемы.
Рис. 1.
Аральское море: A – до начала современной регрессии, B – после разделения, C – в настоящее время. Состав фауны моллюсков: 1 – Dreissena polymorpha aralensis, 2 – D. p. obtusecarinata и D. caspia, 3 – Adacna spp., 4 – Cerastoderma spp., 5 – Abra segmentum, 6 – Theodoxus pallasi, 7 – Ecrobia grimmi.
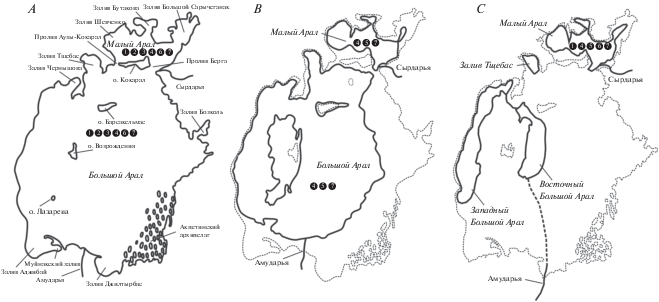
До современной регрессии Арал был солоноватоводным со средней соленостью 10.3‰. На юге и юго-западе Большого моря соленость была снижена благодаря опресняющему влиянию Амударьи. В Малом Арале опресненная зона расположена перед устьем Сырдарьи (Бортник, Чистяева, 1990). Из-за интенсивного испарения и затрудненного водообмена соленость на мелководьях, в заливах восточного побережья и в акватории Акпеткинского (Карабайли) архипелага была повышена и достигала 50‰ и более (Деньгина, 1959; Хусаинова, 1960).
Аральское море в границах, наиболее близких к голоценовому времени, сформировалось в позднем плейстоцене (около 17.6 тысяч лет назад) на рубеже максимума последнего оледенения и раннего дриаса, скорее всего за счет талых вод ледниковых массивов Тянь-Шаня, Памира и менее крупных близких горных систем (Burr et al., 2019). Возникший крупный бессточный водоем уже тогда отличался выраженной соленостью, о чем свидетельствуют находки в донных позднеплейстоценовых отложениях фораминифер Ammonia beccarii и Retroelphidium littorale, а также морских остракод, главным образом Cyprideis torosa.
Нативная, т.е. без учета вселившихся видов, начиная с XX века, вследствие человеческой деятельности, фауна свободноживущих беспозвоночных Аральского моря в сравнении с фауной самого крупного континентального соленого водоема – Каспийского моря – отличается своей бедностью. В позднеголоценовом Арале отсутствовал целый ряд таксонов беспозвоночных, представленных в нативной фауне Каспия. Отсутствовали губки (Porifera) при наличии в Каспии одного их вида и, представленные в Каспии пятью видами, многощетинковые черви (Polychaeta). Из высших ракообразных (Malacostraca) полностью отсутствовали представители таких отрядов, как мизиды (Mysida), кумовые (Cumacea), равноногие (Isopoda) и десятиногие (Decapoda) (Мордухай-Болтовской, 1974), тогда как в аборигенной фауне Каспия в этих группах соответственно насчитывается 5, 22, 18, 2 и 2 вида (Бирштейн и др., 1968; Кияшко, 2013).
В отношении малакофауны: из двустворчатых моллюсков (Bivalvia) семейства Cardiidae обитали только пять общих с Каспием видов, тогда как в Каспии их насчитывается 24. Среди брюхоногих моллюсков (Gastropoda) в Арале полностью отсутствовали такие рода, как Pyrgula (в Каспии 38 видов), Caspia (в Каспии 5 видов), Andrusovia (в Каспии 4 вида), Pseudoamnicola (в Каспии 4 вида) и Tenellia (в Каспии 1 вид) (Бирштейн и др., 1968; Мордухай-Болтовской, 1974; Кияшко, 2013).
Целью настоящей работы было выявить причины бедности фауны моллюсков Арала и проследить изменения в фауне за время его существования. В статье использованы как литературные данные, так и данные, полученные авторами при проведении исследований на Аральском море и в серии лабораторных экспериментов в период 1980–2011 гг.
ИСТОРИЯ ИЗУЧЕНИЯ МОЛЛЮСКОВ АРАЛЬСКОГО МОРЯ
Первые сведения по фауне моллюсков Арала были получены при обработке сборов экспедиции 1874 г., которую организовало Императорское русское географическое общество и Санкт-Петербургское Общество естествоиспытателей. Участвовавший в экспедиции зоолог В.Д. Аленицын собрал коллекции флоры и фауны из различных биотопов. Обработавший эти сборы О.А. Гримм в 1881 г. опубликовал заметку об истории Арала, основываясь на составе его фауны. Он обобщил имевшиеся к тому времени сведения о видовом составе фауны беспозвоночных Аральского моря и указал для нее 7 видов моллюсков (из них 5 видов – по находкам живых экземпляров и 2 вида – по пустым раковинам).
Позднее новые сведения о флоре и фауне (включая моллюсков) Аральского моря были получены в результате работ Л.С. Берга. Собранные им на рубеже XIX–XX веков малакологические материалы были обработаны Остроумовым (Берг, 1908). В результате в монографии Берга (1908) были приведены сведения о следующих видах и подвидах моллюсков11: Dreissena polymorpha Pallas 1771 [D. polymorpha var. obtusecarinata (Andrusov 1897), D. polymorpha var. aralensis (Andrusov 1897)], D. caspia Eichwald 1855, D. caspia pallasi (Andrusov 1897) [D. pallasi], Adacna minima minima Ostroumoff 1907 [Adacna minima], Cerastoderma rhomboids (Lamarck 1819) [Cardium edule var. lamarcki Reeve 1843], Caspiohydrobia eichwaldiana (Golikov et Starobogatov 1966) [Hydrobia pusilla (Eichwald 1838)], Neritina liturata (Eichwald 1855).
В 1920–1921 гг. была организована Аральская научно-промысловая экспедиция. Собранные на Арале в 1920–1921 гг. коллекции моллюсков были обработаны Сидоровым (1929), который указал для моря 37 видов. В состав фауны моря он включил пресноводных моллюсков, встречавшихся только в наиболее опресненных районах. Среди морских и солоноватоводных моллюсков им указаны Dreissensia caspia, D. caspia pallasi [D. pallasi], D. polymorpha [D. polymorpha var. aralensis, D. polymorpha var. obtusecarinata], D. rostriformis (Deshayes in Verneuil et Deshayes 1838), Adacna vitrea (Eichwald 1829), Adacna minima minima Ostroumoff 1907 [Adacna minima], Cerastoderma rhomboids (Lamarck 1819) [Cardium edule Linnaeus 1758, Cardium edule var. lamarcki], Theodoxus pallasi Lindholm 1924 [Neritina liturata Eichwald 1838], Turricaspia spica (Eichwald 1855) [Micromelania spica], Caspiohydrobia eichwaldiana (Golikov et Starobogatov 1966) [Hydrobia pusilla]22. Важным результатом исследования Сидорова (1929) представляется упоминание о достаточно богатой пресноводной фауне в приустьевых участках моря, где соленость Арала была особенно низка. Пресноводные виды моллюсков, упомянутые этим автором, довольно обычны для рек Сырдарья и Амударья и окружающих Аральское море озер. Однако ряд определений видов моллюсков, выполненных Сидоровым, вызывает сомнение. Так, беззубки в приустьевых районах Арала, определенные С.А. Сидоровым как Anodonta piscinalis Nilsson 1822, скорее всего, являются каким-то другим видом. Согласно данным Жадина (1952) A. piscinalis в Приаралье не встречается. Другим недостатком работы С.А. Сидорова является включение в фауну Аральского моря ряда видов по находкам пустых раковин. Так, отнесение к рецентным видам Turricaspia spica было основано на том, что в переданных С.А. Сидорову пробах раковины этого вида отличались прекрасной сохранностью. Между тем, как мы знаем из последующих работ и собственных сборов, этот вид не обитал в Арале в XX веке.
Для Аральского моря в книге Жадина (1952) в разделе “Экология” указаны двустворчатые: Dreissena polymorpha [D. polymorpha var. aralensis, D. polymorpha var. obtusecarinata], D. caspia, D. caspia pallasi [D. pallasi], Adacna vitrea, Cerastoderma rhomboides (Lamarck 1819) [Cardium edule] и 3 вида брюхоногих моллюсков – Ecrobia grimmi (Clessin in Dybowski, 1887) [Hydrobia grimmi], Turricaspia spica [Micromelania spica] и Theodoxus pallasi33. Однако указание T. spica, как характерного для Арала в XX веке вида, по-видимому, ошибочно, так как в части книги, относящейся к определителю, этот вид указан только для Каспийского моря. Интересно, что в определителе Жадина (1952) указано на периодическое исчезновение или существенное сокращение акватории, населяемой пресноводной фауной в приустьевых районах, в зависимости от изменения солености моря. Пресноводные виды моллюсков В.И. Жадин определенно не считал относящимися к фауне Арала.
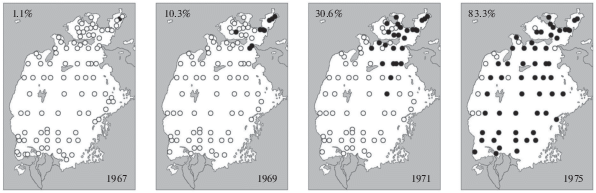
В 1960-х гг. список моллюсков Аральского моря пополнился двустворчатым моллюском Abra segmentum (Recluz 1843). Этот вид завозили и вселяли в Арал из Таганрогского залива и Бердянских лиманов Азовского моря три раза – в 1960, 1961 и 1963 гг. Первая попытка (1960 г.) вселения A. segmentum в опресненный залив Джида Малого Арала оказалась неудачной. Очевидно, первая партия погибла, так как позднее в этом районе моллюски не были обнаружены. В 1961 и 1963 г. этих моллюсков выпускали тоже в Малом море в заливе Большой Сарычеганак с соленостью 10.2‰, причем на этот раз акклиматизация и натурализация прошли успешно. Впервые они были зарегистрированы в пробах зообентоса в 1967 г., в 1970 г. проникли в Большой Арал, и к 1973 г. уже расселились по всему Аральскому морю (рис. 2) (Кортунова, 1970; Карпевич, 1975; Андреева, 1978).
Рис. 2.
Расселение Abra segmentum. ⚫ – станции стандартной сетки, на которых моллюск был найден; ⚪ – станции, на которых объект не был найден. Указана встречаемость, %.
Имеющиеся к началу 1970-х годов данные по фауне моллюсков Аральского моря были обобщены Старобогатовым (1974). В “Атласе беспозвоночных Аральского моря” им было указано для Арала 9 видов и подвидов двухстворчатых и 3 вида брюхоногих моллюсков, “свойственных собственно Аралу”: Dreissena polymorpha aralensis (Andr.), D. polymorpha obtusecarinata (Andr.), D. caspia pallasi (Andr.), Cerastoderma lamarcki (Reeve), C. unbonatum (Wood), Hypanis vitrea bergi Starobogatov, H. minima sidorovi Starobogatov, H. minima minima (Ostr.), Abra ovata (Phil.), Theodoxus pallasi Lindholm, Caspiohydronia conica (Logv. et Star.) и C. husainovae Starobogatov.
После описания Я.И. Старобогатовым нового рода Caspiohydrobia (Starobogatov 1970) дальнейшие таксономические исследования привели к последующему значительному расширению списка видов брюхоногих моллюсков в составе фауны Аральского моря. Если сначала Старобогатов (1974) указал для Аральского моря два вида из этого рода, то впоследствии их число резко увеличилось. По мнению Андреевой (1989), этот род брюхоногих моллюсков представлен в Аральском море 23 видами: Caspiohydrobia chrysopsis (Kolesnikov 1947), C. conica (Logvinenko et Starobogatov 1968), C. convexa (Logvinenko et Starobogatov in Golikov et Starobogatov, 1966), C. curta (Logvinenko et Starobogatov 1968), C. cylindrica (Logvinenko et Starobogatov 1968), C. dubia (Logvinenko et Starobogatov 1968), C. gemmata (Kolesnikov 1947), C. grimmi (Clessin et W. Dybowski in W. Dybowski, 1888), C. oviformis (Logvinenko et Starobogatov 1968), C. parva (Logvinenko et Starobogatov 1968), C. subconvexa (Logvinenko et Starobogatov 1968), C. aralensis Starobogatov et Andreeva 1981, C. behningi Starobogatov et Andreeva 1981, C. bergi Starobogatov et Andreeva 1981, C. husainovae Starobogatov 1974, C. kazakhstanica Starobogatov et Andreeva 1981, C. nikitinskii Starobogatov et Andreeva 1981, C. nikolskii Starobogatov et Andreeva 1981, C. obrutchevi Starobogatov et Andreeva 1981, C. pavlovskii Starobogatov et Izzatullaev 1974, C. sidorovi Starobogatov et Andreeva 1981, C. sogdiana Starobogatov et Izzatullaev 1974, C. tadzhikistanica Starobogatov et Izzatullaev 1974.
Необходимо отметить, что в настоящее время многие авторы считают род Caspiohydrobia невалидным и считают реальным существование одного чрезвычайно морфологически изменчивого вида Ecrobia grimmi (Clessin in Dybowski 1887) (Filippov, Riedel, 2009; Haase et al., 2010; Wesselingh et al., 2019).
Начиная с конца 1970-х годов, вследствие прогрессирующего осолонения моря, началось выпадение отдельных видов из рецентной фауны.
ВИДОВОЙ СОСТАВ МОЛЛЮСКОВ АРАЛЬСКОГО МОРЯ
Род Cerastoderma Poli 1795
В ископаемом состоянии известен с Олигоцена (Keen, 1969). Дивергенцию рода принято связывать с изоляцией Средиземного моря от Атлантического океана в конце миоцена (Hummel et al., 1994). В СССР во взглядах на систематику рода господствовала точка зрения, что существует пять видов: Cerastoderma glaucum Poiret 1789, C. rhomboides Lamarck 1819, C. lamarcki (Reeve 1845), C. umbonatum Wood 1850 и C. clodiense Brocchi 1814 (Скарлато, Старобогатов, 1972). Впоследствии Кафанов (1980) предложил уточненную систему из четырех видов: C. glaucum, C. rhomboides, C. clodiense и C. isthmicum Issel 1869 (= C. umbonatum). В настоящее время в род входит 3 валидных вида – C. glaucum, C. edule и C. rhomboides (http://mussel-project.uwsp.edu/fmuotwaolcb/validgen_1647.html) – и, по-видимому, еще один неописанный вид (Wesselingh et al., 2019).
В начале голоцена моллюсков рода Cerastoderma не было ни в Каспии, ни в Арале. Самые ранние отложения раковин Cerastoderma на Каспии датируются серединой голоцена, т.е. около 6000 лет до н.э., при этом считается, что колонизация была связана с Хвалынской трансгрессией, которая, возможно, совпадала с трансгрессией Черного моря и с самыми ранними послеледниковыми датировками C. glaucum из этого бассейна 9000–8500 лет до н. э. (Mamedov, 1997).
Виды рода Cerastoderma в Аральском море появились около 5000 тыс. лет назад, после того как проникли в Каспийское море из Черного моря. Если в Черное море они могли проникнуть самостоятельно, то в Каспийское и тем более в Аральское моря только путем инвазии. В настоящее время на то, как проходила инвазия, существуют две точки зрения. Согласно первой из них расселение церастодермы произошло при участии человека (Федоров, 1978; Янина, 2009). Недавно с этой точкой зрения согласились многочисленные авторы большого труда: “Mollusc species from the Pontocaspian region – an expert opinion list” (Wesselingh et al., 2019). Другая точка зрения приписывает главную роль в распространении Cerastoderma spp. птицам. То, что птицы участвуют в распространении этого вида, было показано многими авторами (Boyden, Russell, 1972; Rose, 1972; Spenser, Patchett, 1997). Взрослые моллюски могут прикрепляться к ногам птиц, спат может переноситься птицами в оперении, кроме того, спат и ювенильные особи могут переноситься птицами вместе с растениями.
Даже если согласиться с тем, что по соленым озерам вдоль Манычской депресии Cerastoderma распространялась на лодках древнего человека, которые перетаскивались по рекам из моря в озеро (Янина, 2009; Янина и др., 2011), то все равно остается неясным, как моллюски могли попасть из Каспия в Аральское море, так как существовавший в то время сток Амударьи по Узбою был недостаточно соленым для их выживания. Вероятно, в данном случае распространение Cerastoderma происходило с помощью птиц. Известно, что во времена с влажным климатом в прикаспийских пустынях существовали многочисленные бессточные озера (Мамедов, Трофимов, 1986). Они были как олигогалинными, так и полигалинными и гипергалиными. Для C. glaucum было показано, что медианное летальное время выживания молоди вне воды составляет от 80 до 43 час в зависимости от температуры среды (Tarnowska et al., 2012). Этого времени вполне достаточно для распространения по цепочке полигалинных озер вплоть до Аральского моря.
Образ жизни двустворчатых моллюсков рода Cerastoderma – донный; они являются эндобионтами, зарывающимися в поверхностный слой грунта. По способу питания это фильтраторы, подвижные сестонофаги. Взмучивая током воды из выводного сифона поверхностный слой грунта, они втягивают вводным сифоном используемые в пищу легкие частицы (Невесская, 1965). Размножение происходит в теплый сезон. Развитие происходит через планктонную личиночную стадию.
Благодаря осолонению Аральского моря, приведшему к вымиранию дрейссен, стал возможным выход Cerastoderma на поверхность грунта. В результате естественного отбора моллюски C. glaucum в конце 1980-х гг. оказались представлены в Арале тремя жизненными формами: 1) типичной, обитающей в песчаном грунте; 2) с уплощенной раковиной, обитающей в жидком илистом грунте (к 1989 г. она выпала из-за резкого изменение характера грунтов); 3) обитающей на поверхности песчано-илистого или илисто-ракушечного грунта и фильтрующей, как дрейссены, из толщи воды (Андреева, 2000; Андреева, Андреев, 2003).
Cerastoderma sp. A [non C. rhomboides (Lamarck 1819)] (рис. 3A)
Рис. 3.
Двустворчатые моллюски: A – Cerastoderma sp. A, B – Cerastoderma glaucum (фото П.В. Кияшко), C – Adacna minima minima, D – Adacna (Adacna) vitrea bergi (фото П.В. Кияшко, А.О. Смуров), E – Abra segmentum (рисунок П.В. Кияшко), F – Dreissena polymorpha aralensis (фото П.В. Кияшко), G – Dreissena polymorpha obtusecarinata, H – Dreissena caspia pallasi (фото П.В. Кияшко, А.О. Смуров).

Первоначально этих моллюсков из Аральского моря считали Cardium edule var. lamarcki Reeve 1843 (Берг, 1908). В дальнейшем они (Старобогатов, 1974) были отнесены к виду C. lamarcki (Reeve 1845) как подвид C. l. lamarcki (Reeve 1845), но затем их переопределили (Андреева, 1989, 2000) как C. rhomboides rhomboides (Lamarck 1819). Согласно же Wesselingh et al. (2019) ни C. lamarcki, ни C. rhomboids в Арале нет.
Длина раковины обычно до 30 мм (Старобогатов, 1974).
До начала осолонения Аральского моря этот вид населял всю его акваторию, кроме сильно осолоненных районов. В настоящее время в Аральском море не встречается, так как вследствие осолонения выпал из фауны моря к 1976 г. (Андреева, 1989, 2000).
Cerastoderma glaucum Bruguière 1789 (рис. 3B)
Синонимы: Cardium rusticum Eichwald 1829; Cardium rusticum Eichwald 1829, non Linnaeus 1758; Cardium edule var. umbonatum Wood 1850; Cardium glaucum Poiret 1789; Cerastoderma umbonatum Wood 1850; Cerastoderma isthmicum Issel 1869.
Длина раковины обычно до 30 мм (Старобогатов, 1974).
Распространение – средиземноморско-атлантический морской вид; обитает также в Каспийском и Аральском морях (Старобогатов, 1970). В Арале исходно встречался только в его осолоненных районах (култуки восточного побережья), но с повышением солености основной акватории расселился по всему морю (Андреева, 1989, 2000).
В ходе осолонения Большого Арала вид выпал из его фауны во 2-й половине 1990-х гг. при солености превысившей 60‰, но еще не приблизившейся к верхней границе соленостного толерантного диапазона взрослых особей. При этой солености размножение этих моллюсков было уже невозможным, о чем свидетельствовало отсутствие их личинок в планктоне (Стуге, 2002), а остававшиеся двухстворки постепенно отмерли. В Малом Арале этот вид оставался в числе основных представителей донной фауны (Филиппов, 1994; Гришаева, 2010). Значительное снижение солености Малого Арала, по-видимому, стало неблагоприятным, что в настоящее время привело к существенному снижению его численности (Toman et al., 2015; Plotnikov et al., 2016). При дальнейшем распреснении моря этот вид может выпасть из фауны Арала.
Род Adacna Eichwald 1838
Эндобионты, зарывающиeся в поверхностный слой грунта и выставляющие наружу длинные сросшиеся сифоны. По способу питания фильтраторы, подвижные сестонофаги. Используют в пищу одноклеточные водоросли и относительно крупные диатомовые, а также детрит. Размножаются в теплый период. Имеется стадия планктонной личинки.
В настоящее время все виды Adacna в Аральском море больше не встречаются. Вследствие осолонения они вымерли к концу 1970-х гг. (Андреева, 1989).
Adacna minima minima Ostroumov 1907 (рис. 3C)
Синоним: Hypanis minima minima Ostroumov 1907.
Длина раковины до 20 мм (Старобогатов, 1974).
Эндемичный аральский подвид представленного также и в Каспии вида Adacna minima Ostroumov 1907. Был распространен по всему Аральскому морю (Старобогатов, 1974).
Adacna minima sidorovi (Starobogatov 1974)
Синоним: Hypanis minima sidorovi Starobogatov 1974.
Длина раковины до 20 мм (Старобогатов, 1974).
Эндемичный аральский подвид представленного также и в Каспии вида Adacna minima. Обитал в прибрежье до глубины 10 м (Старобогатов, 1974). В настоящее время высказано сомнение (Wesselingh et al., 2019) в реальности существования этого подвида.
Adacna (Adacna) vitrea bergi (Starobogatov 1974) (рис. 3D)
Синоним: Hypanis vitrea bergi Starobogatov 1974.
Длина раковины до 20 мм (Старобогатов, 1974).
Эндемичный аральский подвид представленного и в Каспии вида Adacna vitrea (Eichwald 1829). Известен по единичным находкам (Старобогатов, 1974). В настоящее время есть сомнения (Wesselingh et al., 2019) в обоснованности выделения аральской A. vitrea в отдельный подвид.
Abra segmentum Récluz 1843 (рис. 3E)
Синонимы: Erycina ovata Philippi 1836 non Gray 1825; Amphidesma lactea Krynicki 1837; Syndosmya apelina Récluz 1843; Abra segmentina H. et A. Adams 1856; Scrobicularia fabula Brusina 1865; Syndesmya segmentum var. brevis Fischer 1867; Syndesmya segmentum var. incrassata Fischer 1867; Syndesmya segmentum var. subrostrata Fischer 1867; Syndesmya caillaudii Fischer 1867.
Длина раковины до 25 мм (Старобогатов, 1974).
Распространение – Атлантическое побережье Европы (на север до Англии), Средиземное, Черное, Азовское моря, акклиматизирован в Каспийском море (Кияшко, 2013). В Аральское море вселен в 1960–1963 гг. Образ жизни – донный. Представитель инфауны; зарывается в грунт, выставляя наружу длинные сифоны. По способу питания – детритофаг (Карпевич, 1962; Невесская, 1965). Моллюски захватывают вводным сифоном со дна частицы детрита. Размножение происходит в теплое время года. В развитии имеет стадию пелагической личинки.
Dreissena polymorpha aralensis (Andrusov 1897) (рис. 3F)
Распространение – бассейн Аральского моря, эндемичный аральский подвид Dreissena polymorpha (Pallas 1771). Длина раковины до 25 мм. Моллюск обитал в низовьях Сырдарьи и Амударьи и в связанных с ними озерах; в море встречался только в опресненных акваториях у речных устьев (Старобогатов, 1974; Андреева, 1989).
Вследствие осолонения выпал из фауны моря в 1970-х гг. (Андреева, 1989), сохранившись в реках и связанных с ними озерах (Гришаева, 2010).
В настоящее время благодаря значительному снижению солености Малого Арала происходит возвращение этого моллюска (рис. 1C) из р. Сырдарьи в опресненную зону вблизи ее дельты (Toman et al., 2015; Plotnikov et al., 2016).
Dreissena polymorpha obtusecarinata (Andrusov 1897) (рис. 3G)
Распространение – этот эндемичный аральский подвид Dreissena polymorpha обитал в открытом море в его прибрежной зоне в зарослях. Длина раковины до 17 мм (Старобогатов, 1974).
Из-за возросшей солености этот подвид выпал из фауны Аральского моря в 1970-х гг. (Андреева, 1989). По-видимому, его следует считать вымершим.
Dreissena caspia pallasi Andrusov 1897 (рис. 3H)
Известны два подвида Dreissena caspia: каспийский подвид D. caspia caspia Eichwald 1855 и аральский подвид D. caspia pallasi Andrusov 1897.
Длина раковины до 8–10 мм. Распространение – аральский подвид эндемичного для Каспийского и Аральского морей вида Dreissena caspia Eichwald 1855. Был распространен на мягких грунтах по всему Аралу (Старобогатов, 1974).
В Аральском море этот вид перестал встречаться к концу 1980-х гг. (Андреева, 1989). По-видимому, его следует считать вымершим вследствие осолонения. Следует заметить, что и в Каспийском море D. caspia в настоящее время были вытеснены вселившимися Mytilaster lineatus (Gmelin 1791) и считаются вымершими (Кияшко, 2013).
Ecrobia grimmi (Clessin in Dybowski 1887) (рис. 4A)
Рис. 4.
Брюхоногие моллюски: A – Ecrobia grimmi, B – Turricaspia spica, C – Theodoxus pallasi (фото П.В. Кияшко).

Синонимы: Hydrobia grimmi Clessin in W. Dybowski 1888; Caspiohydrobia grimmi (Clessin et W. Dybowski in W. Dybowski 1888).
Высота раковины до 4 мм (Старобогатов, 1974).
В прошлом аральских гидробий относили к различным видам рода Hydrobia W. Hartmann 1821 (Берг, 1908; Деньгина, 1959) – H. stagnalis Baster, H. pusilla Eichwald, H. ventrosa (Montagu). После работы Старобогатова и Логвиненко (1966) аральские и каспийские виды моллюсков, ранее относимые к роду Hydrobia, стали считаться представителями рода Caspiohydrobia. В настоящее время ряд исследователей считает, что все каспийские виды этого рода являются морфотипами одного вида (Filippov, Riedel, 2009; http://www.marinespecies.org/aphia.php?p=taxdetails&id=575789; Neubauer et al., 2018) – Ecrobia grimmi. Однако остаются приверженцы прежней точки зрения: существует род Caspiohydrobia, представленный многочисленными видами (Андреева и др., 2020). Недавно, после появления молекулярно-генетических методов, стало ясно, что надежно идентифицировать этот вид можно только с помощью этих методов (Haase et al., 2010). Однако молекулярно-генетические исследования каспийских и аральских гидробий до настоящего момента не проводились. Тем не менее после публикации данных Филиппова и Риделя (Filippov, Riedel, 2009) мы считаем, что в Аральском море обитает именно E. grimmi.
Понтокаспийская Ecrobia grimmi широко распространена по всей Центральной Азии и встречается в солоноватых водоемах от гор Центрального Урала на севере до Персидского залива на юге и озера Иссык-Куль на востоке (Vandendorpe et al., 2019). Образ жизни – донный. Растительноядный вид.
Turricaspia spica (Eichwald 1855) (рис. 4B)
Синонимы: Micromelania spica (Eichwald 1855); Hydrobia pusilla (Eichwald 1838); Paludina pusilla Eichwald 1838.
В Атласе беспозвоночных Аральского моря (1974) в разделе, посвященном моллюскам, Старобогатов (1974) утверждал, что встречающиеся в озере пустые раковинки этого вида были вымыты из четвертичных или верхнеплиоценовых отложений. Однако существует иная точка зрения на то, когда Turricaspia spica обитала в Аральском море. Так, согласно Филиппову и Риделю (Filippov, Riedel, 2009), вероятно, вымерла в Аральском море примерно в 1300–1350 годах нашей эры. В этот период, согласно данным по изотопам углерода и кислорода в соответствующих участках керна, происходило значительное распреснение центральной акватории Аральского моря.
Turricaspia spica была найдена на глубине 0–30 м в Западной и Северной частях Центрального Каспия (Логвиненко, Старобогатов, 1968), что свидетельствует о приуроченности к солоноватой воде. В настоящее время является эндемиком Каспийского моря.
Theodoxus pallasi Lindholm 1924 (рис. 4C)
Neritina pallasi Lindholm, 1924c: 34 (nom. n. pro Neritina liturata Eichwald 1838 non Schultze 1826).
Синонимы: Nerita pupa Pallas 1771, non Linnaeus 1758; Neritina liturata Eichwald 1838, non Schultze 1826; Neritina schirazensis var. major Issel 1865; Theodoxus pallasi var. aralensis Sidorov 1929 Theodoxus astrachanicus Starobogatov 1994.
Высота раковины до 8.5 мм, ширина до 7.5 мм (Старобогатов, 1974).
Распространение – Каспийское, Черное, Азовское и Аральское моря, приникает в реки. В Арале был обычным видом в прибрежной зоне до глубин 5–10 м (Старобогатов, 1974). Образ жизни – донный. Растительноядный вид. Моллюски раздельнополы, после оплодотворения самки откладывают яйца в форме небольших капсул, кладка прикрепляется к субстрату.
Из-за осолонения Theodoxus pallasi исчез из Аральского моря в 1980-е гг. (рис. 1B, 5). Так как моллюск обитает в нижнем течении р. Сырдарьи и связанных с ней озерах (Гришаева, 2010), то со снижением солености Малого Арала стало возможным возвращение его обратно в Малый Арал (рис. 1C). Он проник в опресненную зону этого остаточного водоема как минимум к 2001 г., где теперь встречается в небольшом количестве (Аладин, Плотников, 2008; Krupa et al., 2019; Krupa, Grishaeva, 2019).
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ СОЛЕНОСТНЫХ ПРЕДЕЛОВ СУЩЕСТВОВАНИЯ МОЛЛЮСКОВ АРАЛА
Исследователей соленостных адаптаций гидробионтов Аральского моря прежде всего интересовал диапазон изменения данного показателя морской воды, при котором возможно существование определенных видов. Такой диапазон, который ограничивается “пределами фенотипической адаптации, очерчивающими генотипически определенную норму реакции”, согласно Хлебовичу (1981), было предложено называть потенциальным толерантным диапазоном (Филиппов, 1995).
Оценка потенциальной соленостной толерантности у разных видов водных организмов и ее сопоставление затруднены тем, что в настоящее время не существует общепринятых методов определения этого показателя. За последние 30 лет вышло большое количество статей, посвященных определению соленостной потенциальной толерантности многоклеточных организмов. Согласно Филиппову (Filippov, 1998), который провел критический анализ методики этих исследований, можно выделить несколько основных приемов: прямой перенос, физиологическая адаптация, ступенчатая акклимация, экспресс-метод, основанный на изучении солеустойчивости изолированных тканей. Можно указать еще один метод, широко применяющийся зарубежными исследователями при изучении температурных адаптаций, – построение полигона толерантности, который представляет собой график зависимости границ толерантности от соленостных условий обитания. Этот метод при исследовании соленостных пределов существования моллюсков Арала не применялся.
Особенность всех методов, кроме последнего – исследователя в итоге интересуют только две величины: значения верхней и нижней потенциальной границы, по достижении которых организмы исследуемой популяции погибают. Изменение толерантных границ в процессе эксперимента не учитывается.
Метод прямого переноса состоит в резком изменении солености в экспериментальных аквариумах с подопытными организмами. Состояние животных в различных соленостных условиях оценивается по проценту смертности, функциональной активности и иным показателям. Способы обработки полученных таким образом данных и конечный результат не отличаются от данных, полученных при использовании аналогичных методов оценки толерантности. Соответственно, указанный метод плохо пригоден для оценки потенциальной толерантности, однако имеет достоинства. В полевых условиях он позволяет быстро понять, что исследуемый вид может жить в условиях с определенным показателем солености воды.
Методом прямого переноса было показано, что Dreissena polymorpha aralensis, D. polymorpha obtusecarinata могут выживать до 14–15‰, D. caspia, Adacna spp. и Theodoxus pallasi при солености более 20‰ (табл. 1). Cerastoderma glaucum, Abra segmentum и Ecrobia grimmi с помощью этого метода показали солеустойчивость не более 45‰ (Андреев, 1999).
Таблица 1.
Солеустойчивость моллюсков Аральского моря
| Вид | Метод | Автор | Тестирование | Оптимальный соленостный диапазон, г/л | Летальные соленостные границы, г/л | Соленость, при которой исчезли, г/л | Год исчезновения в Арале (Большом Арале) |
|---|---|---|---|---|---|---|---|
| Dreissena polymorpha aralensis | Физиологическая адаптация | Карпевич, 1947 | Взрослые | 0–14 | ? | 1978 (Андреева, Андреев, 1989) |
|
| Прямой перенос из 4 г/л | Андреев, Андреева, 1990 | Жабры | 3.6–5.8 | 3.1–10.6 | |||
| Прямой перенос из 4 г/л | Андреев, Андреева, 1990 | Взрослые | 0–9.3 | ||||
| Dreissena polymorpha obtusecarinata | Прямой перенос из 11 г/л |
Карпевич, 1953 | Взрослые | 12.5–15 | ~15.5 (Андреев, 1999) |
1980 (Андреева, Андреев, 1989) |
|
| Прямой перенос из 11 г/л |
Хусаинова, 1958 | Взрослые | 12.5–15 | ||||
| Хусаинова, 1958 | Нерест | 5–12.3 | 13–16 | ||||
| Dreissena caspia | Прямой перенос из 11 г/л | Карпевич, 1947 | Взрослые | 5–15 | 17–20 | 1983–1989 (Андреева, Андреев, 1989) |
|
| Физиологическая адаптация | Карпевич, 1947 | Взрослые | 2–20 | 0–27 | |||
| Прямой перенос из 11 г/л | Карпевич, 1953а | Взрослые | 8–15 | 5–20> | |||
| Прямой перенос из 11 г/л | Андреев, Андреева, 1990 | Жабры | 5–15 | 7.1–16.6 | |||
| Adacna spp. | Прямой перенос из 11 г/л | Карпевич, 1947 Карпевич, 1953а | Взрослые | 6–16 | 2–20 | 22 (Аладин, 1991) | A. vitrea bergi (1980) A. minima minima (1978) A. sidorovi (1978) (Андреева, Андреев, 1989) |
| Физиологическая адаптация | Карпевич, 1947 | Взрослые | 5–17 | 2–22 | |||
| Физиологическая адаптация | Хусаинова, 1958 | Взрослые | 4.8–14 | 2.5–21.9 | |||
| Прямой перенос из 11 г/л | Хусаинова, 1958 | Нерест, оплодотворение, метаморфоз | 4.8–14 | 4.8–14 | |||
| Cerastoderma glaucum | Прямой перенос из 11 г/л | Карпевич, 1947 | Взрослые | 9–20 | 6–27 | 67 | Конец 1990-х (Большой Арал) (Аладин, Плотников, 2008) |
| Физиологическая адаптация | Карпевич, 1947 | Взрослые | 5–40 | 5–45 | |||
| Прямой перенос 11 г/л |
Хусаинова, 1958 | Нерест | 8.1–27.3 | 6.1–32.2 | |||
| Прямой перенос 11 г/л |
Хусаинова, 1958 | Метаморфоз | ?–32.2 | ||||
| Прямой перенос 11 г/л |
Хусаинова, 1958 | Оплодотворение | ?–44 | ||||
| Прямой перенос из 20 г/л |
Андреев, Андреева, 1990 | 7–38 | |||||
| Прямой перенос из 20 г/л |
Андреев, Андреева, 1990 | 7–39 | |||||
| Прямой перенос из 35 г/л | Филиппов, 1995 | ?–90 | |||||
| Ступенчатая акклимация | Филиппов, 1995 | ?–80–90 | |||||
| Abra segmentum | Физиологическая адаптация | Бекмурзаев, 1971 | Взрослые | 8–30 | >85 (Завьялов и др., 2004; Завьялов, 2012) | 2003 Западная котловина Большого Арала |
|
| Прямой перенос из 17 г/л |
Андреев, Андреева, 1990 | Жабры | 7–32 | 5–42 | |||
| Прямой перенос из 17 г/л |
Андреев, Андреева, 1990 | Нерест | 7–40 | 5–35 | |||
| Прямой перенос из 17 г/л |
Андреев, Андреева, 1990 | Взрослые | 5–43 | ||||
| Ступенчатая акклимация | Андреев, Андреева, 1990 | Взрослые | ?–52.5> | ||||
| Ступенчатая акклимация | Филиппов, 1995 | Взрослые | ?–80–85 | ||||
| Прямой перенос из 35 г/л |
Филиппов, 1994 | Жабры | 20<–90> | ||||
| Ecrobia grimmi | Физиологическая адаптация | Карпевич, 1953а | Взрослые | 8–30 | >60 (Аладин, Плотников, 2008) | Конец 1990-х | |
| Физиологическая адаптация | Бекмурзаев, 1971 | Взрослые | ?–30 | ||||
| Прямой перенос из 20 г/л |
Андреев, Андреева, 1990 | Взрослые | 6–42 | ||||
| Ступенчатая акклимация | Филиппов, 1995 | Взрослые | ?–110 | ||||
| Theodoxus pallasi | Физиологическая адаптация | Бекмурзаев, 1970 | Взрослые | 5–20 | 4–25 | 22 (Аладин, 1991) |
1984 |
| Прямой перенос | Андреев, Андреева, 1990 | Взрослые | 4–30 |
Другое достоинство метода прямого переноса – он оказывается единственным пригодным для оценки соленостных границ, при которых происходит вымет половых продуктов и метаморфоз. Согласно нашим наблюдениям, даже незначительное изменение солености (порядка 5–7‰ в пределах толерантного диапазона) воды, в которой содержатся взрослые особи беломорских моллюсков, способно существенно сдвинуть сроки нереста и повлиять на жизнеспособность гамет. Оценка соленостных границ, при которых возможен нерест, выполнена для Dreissena polymorpha aralensis и Adacna spp. Значения солености, при которой был возможен нерест, оказались существенно ниже, чем значение солености, при которой выживали взрослые особи. Впоследствии, в процессе осолонения Арала, данные опытов были подтверждены природой: дрейссены и адакны прекратили размножаться раньше, чем исчезли из моря.
Метод физиологической адаптации базируется на наблюдении, что многие физиологические процессы организма стабилизируются при небольших изменениях солености в течение двух суток. Было предложено изменять соленость на 2‰ каждые двое суток (Карпевич, 1947). Полученные таким образом результаты показали, что диапазон солености оказывается существенно шире, чем полученный по методу прямого переноса (Карпевич, 1953, 1958; Бекмурзаев, 1970, 1971). Этим методом были получены потенциальные соленостные границы, как для двухстворчатых моллюсков, так и для брюхоногих моллюсков. Были исследованы Dreissena polymorpha aralensis, D. caspia, Cerastoderma glaucum, Abra segmentum, Adacna spp., Ecrobia grimmi и Theodoxus pallasi (табл. 1). При этом метод физиологической адаптации дал значительно более точные результаты в оценке солености, при которой вышеуказанные виды должны были исчезнуть из Арала. Так, мы можем констатировать “попадание в яблочко” результатов экспериментов для Dreissena spp. и Adacna spp. В то же время, оценки границ, документированные для A. segmentum, T. pallasi и E. grimmi, имели мало общего с реальностью.
Существенным недостатком этого метода является утверждение о том, что для завершения акклимации необходимо именно 2 суток. Проведенными позднее исследованиями неоднократно было показано, что необходимый срок, как правило, больше (Хлебович, Кондратенков, 1971; Хлебович, 1981; Филиппов, 1995 и др.).
Наиболее современным методом оценки потенциальной толерантности является разработанная в начале 70-х годов ступенчатая акклимация (Хлебович, Кондратенков, 1971; Khlebovich, Kondratenkov, 1973). В ходе ступенчатой акклимации продолжительность акклимации к каждой последующей солености составляет не менее двух недель, а при определении шага солености на каждой ступени учитывается величина толерантного диапазона на предыдущей стадии эксперимента. Исследования последующих лет подтвердили, что этот метод наиболее пригоден для изучения потенциальной соленостной толерантности организмов (Филиппов, 1995). В основе метода лежат факты, полученные на значительном экспериментальном материале на различных таксонах Metazoa и Protista. Этот метод дает надежные оценки потенциальной толерантности организмов и на настоящий момент является одним из лучших инструментов оценки последствия вселения организмов в новые условия. Главным его недостатком является значительное время (иногда до 2–3 мес), требующееся для завершения лабораторных экспериментов.
Методом ступенчатой акклимации были оценены летальные соленостные границы для 3 видов: Ecrobia grimmi, Abra segmentum и Cerastoderma glaucum.
Вызывает сомнения полученная А.А. Филипповым для E. grimmi верхняя соленостная граница 100–110 г/л (табл. 1). Нами проводились исследования соленостной толерантности беломорской E. ventrosa (неопубликованные данные), близкого к E. grimmi вида. Согласно недавно опубликованному исследованию, эти виды разошлись около 2.7 млн лет назад (Vandendorpe et al., 2019). По нашим данным, потенциальный толерантный диапазон E. ventrosa составил 2–62‰, но при солености среды выше 62‰ моллюски закрывают оперкулюм и в таком состоянии способны выживать до трех недель. На сходный с E. ventrosa потенциальный толерантный диапазон указывает гораздо более низкая соленость исчезновения этого вида в Большом Арале (табл. 1). Интересен и другой факт – способность E. ventrosa существовать в очень распресненной воде (2‰). В условиях Белого моря представители этого вида в ходе конкуренции с Peringia ulvae оттесняются в более опреснённые местообитания (Бергер, Горбушин, 2001). Если соленостные реакции E. grimmi и E. ventrosa сходны, то можно предположить, что при дальнейшем распреснении Малого Арала этот вид здесь не исчезнет, так как по краям моря из-за испарения воды останутся сколько-нибудь соленые места.
Оценка потенциальной соленостной границы для Abra segmentum в 80–85‰ (Филиппов, 1994) практически совпала с соленостью, при которой этот вид исчез из фауны Большого Арала.
Ступенчатую акклимацию Cerastoderma glaucum проводили как Андреев и Андреева (1990), так и Филиппов (1995а). В первом случае было показано, что моллюски могут выживать при не менее чем 52.5‰ (выживаемость в более высоких соленостях не тестировалась). Во втором случае в экспериментах моллюски начинали гибнуть при 80–90‰. В действительности этот вид исчез из Большого Арала при солености, немного превышающей 60‰. Несовпадение результатов экспериментов и выживания C. glaucum в Арале может быть связано с тем, что моллюск потерял способность размножаться при меньшей солености среды, подобно тому, как было показано для Dreissena spp. и Adacna spp.
Метод оценки потенциальной толерантности на основе исследования солеустойчивости изолированных тканей применим только для многоклеточных животных, находящихся на тканевом уровне организации. Исследователями изучалась соленостная устойчивость жаберных препаратов, согласно методу, разработанному Ярославцевой (1976).
Оценка летальных соленостных границ по жаберным препаратам была выполнена для Dreissena polymorpha aralensis, D. caspia, Cerastoderma glaucum и Abra segmentum (табл. 1). Во всех случаях полученные этим методом границы были меньше, чем полученные методами физиологической адаптации и ступенчатой акклимации. Как видно из таблицы, достигнутые на изолированном эпителии соленостные границы зависят от того, при какой солености жили организмы. Впоследствии было показано в экспериментах на беломорских моллюсках и аральской A. segmentum, что границы клеточной устойчивости во всех случаях были линейно связаны с условиями акклимации (Филиппов, Филиппова, 2006). Кроме того, характер этой зависимости существенно отличался от такового, выявленного для интактных организмов. Очевидно, что показатели клеточной активности, по крайне мере в том виде, в каком они определялись в ходе обсуждаемых здесь экспериментов, не могут быть использованы для корректной оценки возможностей адаптации на уровне организма (Филиппов, Филиппова, 2006).
В Сырдарье живут 9 видов двухстворчатых моллюсков, относящихся к четырем семействам и двум отрядам (Baymurodov, 2015), и 19 брюхоногих гребнежаберных моллюсков из трех семейств (Андреева и др., 2016), которые, однако, практически не встречаются в Аральском море даже при невысокой солености воды. Причиной этого является, с одной стороны, история регрессий и трансгрессий самого Аральского моря, а, с другой стороны, – рапический фактор действия солей. Понятие рапического фактора попало в настоящее время в учебники по гидробиологии благодаря усилиям румынского исследователя Поры, который обратил внимание, что определенные соотношения ионов в солоноватой воде могут резко обеднять фауну (Pora, 1969). В частности, им было показано, что Черное море, при тех же соленостях, что и Балтийское море, более бедно в отношении видового состава из-за нарушения определенных соотношений ионов.
Все соли, растворенные в воде современного Аральского моря, имеют речное происхождение. Они появились в результате испарения речной воды, о чем свидетельствует химический состав солевых отложений. Этот состав значительно отличается от химического состава вод океана и Каспия. Ранее, на примере ракушковых и жаброногих ракообразных было показано, что барьер критической солености (5–8‰) в континентальных водах смещен в большую сторону, нежели таковой для океана (Аладин, 1983, 1988, 1989). Недавно подобный результат был получен для инфузорий (Smurov et al., 2017). Это явление связано с изменением пропорций натрия и хлора. Однако и при низких значениях солености, не сильно отличающихся от значений солености пресной воды, соотношения ионов нарушены. Прежде всего это касается двухвалентных ионов, и эти соотношения для пресноводных организмов неблагоприятны.
При этом минерализация вод Сырдарьи в 1981–1985 гг., по сравнению с периодом 1911–1960 гг., увеличилась в 3.4 раза. Рост минерализации речных вод сопровождался резким изменением их ионного состава. Так, относительное содержание карбонатов в воде Сырдарьи снизилось в 4 раза. Относительное уменьшение карбонатов в речном стоке было компенсировано увеличением абсолютного и относительного содержания хлоридов и значительным возрастанием абсолютного и относительного содержания сульфатов (Андреева, Андреев, 2003). Соответственно, это привело к изменению соотношений ионов в приустьевых участках моря.
В настоящее время факт негативного действия низко минерализованных вод Аральского моря на различных животных почти не изучен. Однако даже в очень опресненных водах Арала мы редко встретим Valvatidae, Unionidae и Lymneidae, которые населяют прилегающие к Аралу водоемы.
СОВРЕМЕННАЯ РЕГРЕССИЯ АРАЛЬСКОГО МОРЯ
Главной причиной изменений в фауне моллюсков Аральского моря, произошедших с начала 1960-х гг., является его современная антропогенная регрессия (рис. 1B, 1C), в результате которой произошло изменение гидрологического режима водоема и солености воды.
На протяжении нескольких веков состояние Аральского моря оставалось условно стабильным. С 1961 г., главным образом из-за начавшегося увеличения безвозвратного изъятия стока рек, в первую очередь на орошение, а также наступившего периода естественного маловодья, речной сток стал сокращаться, что стало причиной регрессии. Уровень Арала начал снижаться, а соленость начала расти (Бортник, Чистяева, 1990). В течение 1961–1970 гг. высыхание Арала и сопровождавший его рост солености шли медленно, и к 1971 г. средняя соленость повысилась незначительно – только на 1.5‰, т.е. до 11.5‰. Аральское море все еще оставалось солоноватоводным.
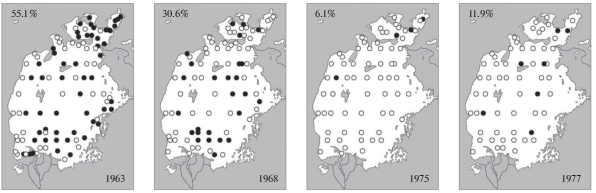
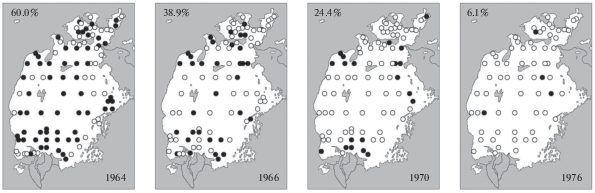
В рассматриваемый период произошло быстрое снижение суммарной численности и биомассы всех видов и подвидов обитавших в Арале солоноватоводных двустворчатых моллюсков рода Dreissena. С 1963 г. эти показатели сократились к 1970 г. примерно в 10 раз. Снизилась и встречаемость (рис. 6) дрейссен (Плотников, 2016). К сожалению, из-за отсутствия данных по отдельным их формам осталось неизвестным, в какой степени это коснулось каждой из них. Повышение солености и сокращение площади опресненных зон перед дельтами рек должны были в первую очередь сказаться на менее резистентной к солености D. polymorpha aralensis, но вряд ли так существенно повлияли на более резистентные к солености (Деньгина, 1959; Андреева, 1989) D. p. obtusecarinata и D. caspia pallasi.
Аналогичная ситуация наблюдалась и с двустворчатыми моллюсками рода Adacna, представленными в Арале тремя формами. Их суммарные численность и биомасса быстро уменьшились (Андреева, Андреев, 1987; Андреева, 1989) с 1963 г. к 1970 г. также на порядок. Снизилась и их встречаемость (рис. 7). Как и в случае с Dreissena, остается неизвестным, в какой степени это затронуло каждый из видов и подвидов этих двустворок (Плотников, 2016).
Сокращение численности Dreissena spp. и Adacna spp. в зообентосе Арала нашло свое отражение в снижении общей численности личинок двустворчатых моллюсков в планктоне, которое наблюдалось в 1967–1969 гг. (Андреева, 1989), т.е. до того, как вселенная Abra segmentum распространилась по всему морю.
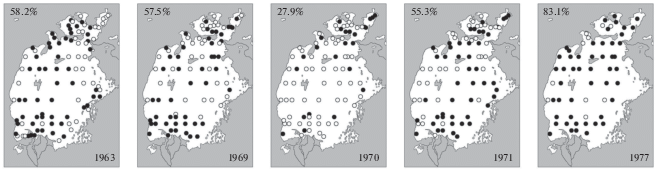
В Аральском море двустворчатые моллюски Cerastoderma sp. A, ранее считавшийся C. rhomboides, и C. glaucum исходно были малочисленными по сравнению с Dreissena spp. и Adacna spp. Эти два вида рода Cerastoderma имели различные соленостные оптимумы и встречались в разных районах моря. Основную часть акватории Арала населяла Cerastoderma sp. A. Распространение C. glaucum было ограничено осолоненными районами моря (култуки Акпеткинского архипелага и заливы восточного побережья Большого моря). С продвижением в эти осолоненные районы и по мере роста солености численность Cerastoderma снижалась вплоть до исчезновения этих моллюсков, но при дальнейшем увеличении солености в этом градиенте вновь появлялась Cerastoderma. Ее численность росла, достигая своего максимума при 24–28‰. Таким образом, первый вид сменялся вторым (Деньгина, 1959; Старобогатов, 1974; Андреева, 1989). В 1964–1970 гг. рост солености моря вызвал только сокращение ареала Cerastoderma sp. A (рис. 8), но не привел к выпадению этого вида из состава фауны (Андреева, 1989).
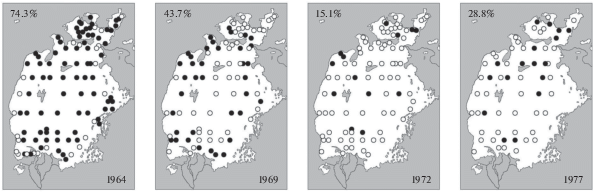
После 1965 г. произошло резкое и быстрое сокращение к 1967 г. численности и биомассы брюхоногого моллюска Theodoxus pallasi, снизилась и его встречаемость (рис. 5) (Плотников, 2016).
В 1970-е гг. началось резкое сокращение стока Амударьи и Сырдарьи, уже существующий дефицит водного баланса Аральского моря увеличивается, ускоряя процесс его высыхания и осолонения. Усиливается влияние непрекращающегося роста солености его вод на фауну Арала. С достижением до 12–13‰ – верхней границы первой барьерной солености – и последующим переходом через нее Аральское море перестало быть солоноватоводным водоемом.
На 1971–1976 гг. приходится первый кризисный период, и начинается сокращение видового разнообразия (Плотников и др., 1991). Дальнейший рост солености в этот кризисный период по-разному повлиял на обитавшие в Аральском море виды и подвиды двустворчатых моллюсков рода Dreissena. С одной стороны, этот период был неблагоприятным уже не только для Dreissena polymorpha aralensis, но становится таковым и для D. p. obtusecarinata, и численность этого вида тоже снижается. Оба моллюска выпадают из фауны в 1978–1979 гг. C другой стороны, благодаря угнетению и последующему исчезновению этих двух видов, создались условия для повышения численности более галофильной D. caspia pallasi, выдерживающей соленость до 17–20‰ (Деньгина, 1959; Андреева, 1989). В результате вышеупомянутых процессов, а также из-за снижения численности других двустворчатых моллюсков, в 1974–1976 гг. наблюдались некоторая стабилизация общего ареала и даже рост суммарной численности дрейссен (Плотников, 2016).
Численность обитавших в море двустворчатых моллюсков рода Adacna, уже уменьшившаяся в 1960-е гг., продолжила свое снижение под влиянием увеличивающейся солености (Андреева, Андреев, 1987; Андреева, 1989), сокращался и их ареал (рис. 7). Все 3 подвида этих моллюсков – Adacna vitrea bergi, A. minima minima и A. m. sidorovi – окончательно выпали из фауны Арала в 1978–1979 гг. (Андреев, Андреева, 1981; Андреева, 1989).
Продолжавшийся рост солености Аральского моря способствовал дальнейшему сокращению ареала и снижению численности двустворчатого моллюска Cerastoderma sp. A, начавшимся в 1960-е гг., и, наоборот, был благоприятным для C. glaucum. С 1971 г., благодаря продолжающемуся росту солености, более галотолерантный C. glaucum начинает активно расселяться из осолоненных районов на востоке Арала по всей акватории моря, быстро увеличивая свою численность (рис. 8). С 1978 г., когда соленость достигла 15‰, Cerastoderma sp. A в Арале уже не встречается, а C. glaucum не только занимает ее место, но даже становится видом более многочисленным, чем его предшественник (Андреева, Андреев, 1987; Андреева, 1989).
Повышение солености выше 12–14‰ также благоприятствовало и недавно вселенному эвригалинному двустворчатому моллюску Abra segmentum, расселение которого по всему Аральскому морю в основном завершилось к 1976 г. Рост солености благоприятствовал также галофильному брюхоногому моллюску Ecrobia grimmi, и его численность увеличивалась (Андреева, 1989).
После первого кризиса в малакофауне Арала сохранялись только Dreissena caspia pallasi, Cerastoderma glaucum, Abra segmentum, Ecrobia grimmi и Theodoxus pallasi (Плотников, 2016).
При продолжавшемся росте солености первый кризисный период сменился периодом относительной стабилизации. Следует отметить, что эта стабилизация не означала абсолютной неизменности фауны моллюсков Арала: в 1980-х гг. исчезли последний сохранившийся и наиболее солеустойчивый вид дрейссен – Dreissena caspia pallasi и брюхоногий моллюск Theodoxus pallasi (рис. 1B) (Андреева, 1989; Андреева, Андреев, 2003; Плотников, 2016).
К 1987 г. соленость Аральского моря повысилась до 27‰, что соответствует нижней границе второй барьерной солености (27–32‰) (Plotnikov, Aladin, 2011). Перейдя ее, фауна моллюсков этого водоема в конце 1980-х гг. вступила во второй кризисный период (Плотников и др., 1991), во время которого вновь произошло быстрое сокращение ее видового разнообразия.
К концу 1980-х гг., в результате продолжавшегося снижения уровня Аральского моря и пересыхания проливов между Малым и Большим Аралом, они превратились в два остаточных водоема с разным гидрологическим режимом (рис. 1B). Т.к. сток Сырдарьи в Малый Арал превышал испарение с его поверхности, падение уровня воды прекратилось и его состояние стабилизировалось, а избыток воды стал перетекать в Большой Арал. Испарение с поверхности Большого Арала превышало сток Амударьи и поступление воды из Малого Арала, и водоем продолжил высыхать и осолоняться (Аладин, Плотников, 1995). С этого времени все изменения в Малом и Большом Арале протекают разнонаправлено.
В 1992 г. для того чтобы удержать стекающую в Большой Арал воду, а также поднять уровень Малого Арала и снизить его соленость, бывший пролив Берга был перекрыт дамбой. В 2004–2005 гг. на замену ей была построена новая капитальная Кокаральская плотина. Это создало все условия не только для сохранения Малого Арала, но и для восстановления его биологического разнообразия (Плотников, 2016). К настоящему времени эта часть Арала вновь стала солоноватоводной.
Уровень Малого Аральского моря после зарегулирования плотиной в проливе Берга повысился и стабилизировался. Соленость вод этого остаточного водоема, благодаря его положительному водному балансу и сезонной проточности (в зимне-весеннее время), постепенно снизилась, и к настоящему времени средний показатель стал даже ниже, чем до начала современной регрессии и вызванного ею осолонения. При этом, если вблизи устья Сырдарьи, благодаря опреснению речным стоком, соленость снижена, то в заливах Большой Сарычеганак и Бутакова она все еще выше, чем на основной акватории Малого Арала.
Сейчас наиболее многочисленным видом среди моллюсков является Abra segmentum, которая относится и к видам-доминантам зообентоса. По сравнению с первой половиной 1990-х гг. (Филиппов, 1995а) численность всех моллюсков сократилась значительно. В случае Cerastoderma glaucum и Ecrobia grimmi это можно объяснить неблагоприятным для этих моллюсков снижением солености (Plotnikov et al., 2016). Другой причиной сокращения численности моллюсков, в первую очередь A. segmentum, стало возвращение в Малый Арал генеративно-пресноводных видов рыб, в большинстве своем бентофагов, исходно составлявших основу его ихтиофауны и исчезнувших в конце 1970-х гг. из-за осолонения моря (Ermakhanov et al., 2012).
Снижение средней солености Малого Арала и образование обширной опресненной зоны перед дельтой Сырдарьи сделало возможной естественную реинтродукцию многих видов беспозвоночных, в том числе и моллюсков, выпавших из фауны Аральского моря при его осолонении, но обитающих в рефугиумах – Сырдарье и пойменных озерах ее низовий (Гришаева, 2010). Из числа моллюсков это Dreissena polymorpha aralensis и Theodoxus pallasi. К 2000-м годам T. pallasi вновь появился в Малом Арале. В настоящее время сюда вернулась и D. polymorpha aralensis (рис. 1C). Однако распространение этих моллюсков ограничено приустьевой опресненной зоной, и встречаются они здесь редко (Krupa et al., 2019; Toman et al., 2015; Plotnikov et al., 2016).
После отделения Большого Аральского моря рост его солености продолжился и ускорился, и в конце 1990-х гг. эта обособившаяся часть Арала превратилась в гипергалинный водоем, что вызвало резкое сокращение биоразнообразия. Полностью исчезают последние сохранившиеся 3 вида моллюсков (рис. 1C). К 2001 г. из фауны выпадает двустворчатый моллюск Cerastoderma glaucum, а с 2004 г. больше не встречается Abra segmentum. В 2000-х гг. брюхоногий моллюск Ecrobia grimmi в Большом Арале уже не встречался (Аладин, Плотников, 2008; Завьялов и др., 2012; Плотников, 2013), он исчез во 2-й половине 1990-х гг., но, когда конкретно это произошло, остается неизвестным.
БУДУЩЕЕ ФАУНЫ МОЛЛЮСКОВ АРАЛЬСКОГО МОРЯ
Моллюски в настоящее время населяют из всех остаточных водоемов Арала только Малое море. Будущее его малакофауны будет определяться в первую очередь тем, как далее изменится соленость воды.
При существующем сейчас гидрологическом режиме Малого Арала его соленость, благодаря сезонной проточности, может продолжать снижение до тех пор, пока не установится равновесие между поступлением солей с речным стоком и их выносом с водой, уходящей через Кокаральскую плотину. Какой в итоге станет соленость, будет зависеть от объемов достигающего моря стока Сырдарьи.
Дальнейшее снижение солености Малого Арала может вызвать новые изменения в составе фауны моллюсков – исчезнут те их виды, которые будут неспособны выжить в новых условиях. Сильное распреснение моря негативно отразится на морских видах и выходцах из осолоненных водоемов аридной зоны, которым осолонение Арала благоприятствовало, а также на солоноватоводных видах, вплоть до того, что приведет к их выпадению из фауны. Распреснение основной акватории Малого Арала ниже 7‰ приведет к исчезновению из нее аборигенного морского двустворчатого моллюска Cerastoderma glaucum; при солености ниже 6‰ (Андреев, Андреева, 1990) из основной акватории моря могут исчезнуть брюхоногие моллюски Ecrobia grimmi – выходцы из осолоненных водоемов аридной зоны. Эти виды уже стали малочисленными и близки к исчезновению. Если соленость станет меньше 5‰, то может исчезнуть вселенец – морской двустворчатый моллюск Abra segmentum, все еще входящий в число доминирующих видов (Plotnikov et al., 2016) донной фауны Малого моря. Но это не должно затронуть обособленные заливы Бутакова и Большой Сарычеганак, где соленость из-за ограниченного водообмена с основной частью Малого Арала повышена. Моллюски, сохранившись в этих заливах, не выпадут из фауны моря.
Существует возможность дальнейшего увеличения объема и площади Малого Аральского моря за счет той воды, которая сейчас сбрасывается через Кокаральскую плотину в бывшем проливе Берга.
Если будет реализован проект, предполагающий создание в горле залива Большой Сарычеганак плотины с водосбросом в основную акваторию Малого Арала и прокладку канала от гидроузла Аклак на Сырдарье для перенаправления части стока в этот залив, то Малое море станет каскадом из двух водоемов, которые будут различаться гидрологическим и соленостным режимом. На месте обводненного залива сформируется проточный слабоминерализованный водоем, а основная часть Малого моря останется солоноватоводной. В заливе Большой Сарыченагак, вода которого в возможном будущем времени будет иметь очень низкую соленость, за счет гидробионтов из Сырдарьи сформируется фауна пресноводного типа, которая сменит существующую. Обитающие сейчас здесь Cerstoderma glaucum, Abra segmentum и Ecrobia grimmi не сохранятся, но в залив проникнут Dreissena polymorpha aralensis и Theodoxus pallasi.
Если будет реализован альтернативный проект, предполагающий только реконструкцию плотины в проливе Берга с увеличением ее высоты, то повысится уровень и увеличится площадь всего Малого Арала. В этом случае все Малое море будет солоноватоводным с соленостью не ниже современной и с опресненной зоной перед дельтой Сырдарьи.
Реализация любого из этих двух вариантов позволит предотвратить дальнейшее распреснение Малого Арала (и даже несколько повысить его соленость по сравнению с современной) и новые изменения его фауны.
Представляется целесообразным вселить в Малый Арал из Каспия вымерших при осолонении моря солоноватоводных моллюсков Adacna minima и A. vitrea, которые могут служить хорошей пищей для населяющих в настоящее время водоем бентосоядных рыб.
ПРЕДЫДУЩИЕ РЕГРЕССИИ АРАЛА
История Аральского моря – это история его неоднократных регрессий и трансгрессий, происходивших на протяжении всего времени его существования. На уровень и, соответственно, соленость Арала влияли только природные факторы, определявшие объем стока рек Амударьи и Сырдарьи, который достигал этого бессточного озера. Во-первых, объем стока зависел климата, более сухого или более влажного в области формирования этих рек (Памир и Тянь-Шань). Во-вторых, если воды Сырдарьи всегда текли в Арал, то Амударья могла поворачивать в Сарыкамыш и далее по своему древнему руслу – Узбою – в Каспий (как это было в плиоцене) и даже могла течь одновременно в оба водоема. И только в античное время к этим двум природным факторам добавился антропогенный – появление и развитие орошаемого земледелия в бассейне Аральского моря. В древнем Хорезме люди могли направить реку не в Арал, а в Каспий, или наоборот. Контроль над Амударьей можно было поддерживать только в периоды относительной социальной стабильности. Социальные потрясения и войны в регионе могли привести при разрушении защитных дамб и оросительных систем к утрате контроля над рекой, и тогда она по воле случая поворачивала в том или ином направлении (Аладин, Плотников, 1995). Недостаток объемов стока впадающих в Арал рек приводил к регрессии моря. С падением уровня единое тело водоема распадалось на отдельные, заполненные высокоминерализованной водой, озера, а в местах впадения рек – на опресненные мелководья – плавни (Свиточ, 2009).
Так как регрессии Аральского моря сопровождались повышением солености, а сменявшие их трансгрессии – ее снижением, то это отражалось на фауне. Ее изменения возможно проследить по остаткам таких гидробионтов, как моллюски, обладающие хорошо сохраняющимися в донных отложениях раковинами. Если известен диапазон соленостей, в котором может существовать конкретный вид, то можно примерно определить, какая была соленость в то время, когда жила данная особь. Если при этом можно установить и возраст этих остатков, то возможна привязка изменений солености к временно́й шкале.
В начале своей истории последнее Аральское море, по-видимому, первоначально наполнялось ледниковой талой водой и, соответственно, было малосоленым. Об этом свидетельствуют как характер осадконакопления, так и состав фауны остракод (Burr et al., 2019). В период 15.3–13.8 тыс. лет назад характер осадконакопления в Арале изменился и в озерном бентосе стали доминировать солелюбивый вид остракод Cyprideis torosa и фораминиферы Retroelphidium littorale и Ammonia beccarii. Этот период можно отнести к морской стадии развития Арала (Burr et al., 2019).
К началу голоцена озеро перешло в озерно-солончаковую стадию, которая характеризуется тем, что в понижениях рельефа существовали озера разной степени засоления, которые при пересыхании превращались в солончаки. Для осадков этого времени характерны наличие гипса и раковин ультраэвригалинных и пресноводных моллюсков (Свиточ, 2009). Эта стадия закончилась в момент вселения в Аральское море C. glaucum около 5000 лет назад. Следующую стадию развития Арала предложено называть морской (Свиточ, 2009). Этот этап начался с трансгрессии Аральского моря. В период 4.9–3.6 тыс. лет назад уровень моря достигал отметок 56–57 м над уровнем океана. В отложениях были встречены пресноводные виды моллюсков Limnaea auricularia, Planorbis sieversi, солоноватоводные Dreissena polymorpha obtusicarinata и D. caspia pallasi, а также морские Cerastoderma glaucum.
Следующая трансгрессия Арала пришлась на период 3.0–1.6 тыс. лет назад (Хрусталев и др., 1977; Маев и др., 1983). В это время уровень моря достигал отметки 54.5 м, а соленость составляла 8–9‰. Для фауны моллюсков этого времени характерно обилие каспийских видов Adana minima и Theodoxus pallasi (Свиточ, 2009).
Последние 2000 лет истории озера изучены гораздо лучше предшествуюших периодов его существования. Еще до современной антропогенной регрессии Арал пережил две регрессии, которые можно сравнить с антропогенной по масштабам (уровень моря опускался до отметки +29 м абс.) и которые сменялись трансгрессиями. Датировка регрессий основывается на геолого-геоморфологических, археологических данных и на результатах исследования фоссилизированных остатков гидробионтов в донных отложениях. Первая датируется примерно временем I век до н.э.–IV век до н.э. Вторая, средневековая, регрессия, пришедшаяся на XII–XV века, датируется точнее, и о ней имеются документальные свидетельства ее современников (Krivonogov et al., 2010, 2014).
Филипповым и Риделем (Filippov, Riedel, 2009) были проанализированы изменения в фауне моллюсков по их распределению и встречаемости во взятых со дна Арала колонках донных отложений, охватывающих последнюю тысячу лет.
Наиболее постоянным элементом в этих отложениях является широко эвригалинная Ecrobia grimmi. В нижних частях колонок донных отложений присутствуют раковины солоноватоводного брюхоногого моллюска Turricaspia spica, на основании чего авторами было высказано предположение, что этот вид обитал в Арале до середины XIV века. По мнению Филиппова и Риделя (Filippov, Riedel, 2009), эти раковины были не переотложены из обнажений древних пород, а принадлежат реально жившим в это время в Арале моллюскам. Эти раковины присутствуют в кернах, начиная с самых древних слоев и до слоя, соответствующего, по их датировке, ~1300–1350 гг. По мнению этих авторов, можно сделать вывод о вымирании T. spica из-за сильного снижения солености до почти пресноводных условий в ~1250–1400 гг. после направления всего стока Амударьи в Арал и увеличения водности Сырдарьи. Тогда же из-за низкой солености, как они полагают, исчез и двустворчатый моллюск Adacna minima. Эти авторы считают, что в дальнейшем, около 1350–1400 гг. по их датировке, соленость вновь начала расти в результате снижения притока пресной воды, продолжавшегося до 1500–1550 гг. Об этом свидетельствует распространение предпочитающих более высокую соленость моллюсков E. grimmi и Ceractoderma glaucum при снижении численности Dreissena spp., предпочитающей пониженную соленость. По мнению этих авторов, около 1500 г. в Арале вновь появляется A. minima, возможно, вселившаяся при участии человека (Filippov, Riedel, 2009). Следует отметить, что есть сильные сомнения в правильности данных датировок (Krivonogov et al., 2014).
О ПРИЧИНАХ БЕДНОСТИ ФАУНЫ МОЛЛЮСКОВ АРАЛЬСКОГО МОРЯ
Вопрос о причинах бедности фауны Арала одним из первых был озвучен Бергом (1908). Им было указано, что причина бедности заключается не в физических условиях современного бассейна водоема. Он заметил, что из общего состава арало-каспийской фауны в озере сохранились “только такие элементы, которые могли вынести совершенное опреснение”. Эта его цитата относится не только к моллюскам, а ко всей фауне Аральского моря. Таким образом, причину бедности видового разнообразия моллюсков надо искать в причине бедности всей фауны Арала.
Главной такой причиной, на наш взгляд, следует считать небольшой возраст моря, который едва превышает 17 тысяч лет. Этого времени оказалось недостаточно, чтобы сформировать свою эндемичную фауну (Плотников, 2016). Известно, что в Каспийском море, которое несколько миллионов лет назад потеряло связь с океаном, существует многочисленная собственная эндемичная фауна (Богуцкая и др., 2013). Регрессии и трансгрессии Каспия, по-видимому, привели к ускорению процесса эволюции моллюсков. Ранее на примере Cerastoderma glaucum и Abra segmentum было показано значительное возрастание морфологической изменчивости в процессе регрессии Арала, которое в перспективе может привести к появлению новых видов (Андреева, Андреев, 2003).
Вновь образованное озеро должно было, в первую очередь, заселиться моллюсками из близлежащих водоемов. В первую очередь Dreissena spp., Theodoxus pallasi и Ecrobia grimmi. Эти виды могли как исчезать в море во время регрессий, так и сохраняться в остаточных водоемах с подходящей для них соленостью. Недавнее вселение в море после вымирания D. polymorpha aralensis и T. pallasi показывает, что препятствий для пополнения фауны моллюсков из соседних водоемов не существует и в настоящее время.
Мы предполагаем, что в пополнении фауны новыми видами большую роль играл перенос молоди моллюсков птицами. Вероятно, это верно для моллюсков семейства Cardiidae – Ecrobia grimmi и Turricaspia spica. В Арал смогли проникнуть только наиболее эврибионтные виды моллюсков. Можно предположить, что, если бы соленость Арала стабилизировалась на длительное время, число видов-вселенцев из Каспия было бы значительно больше. Однако долговременные изменения солености воды, по своему размаху превышающие таковые в Каспийском море, стали причиной плохой представленности каспийских видов в фауне моллюсков Арала.
Список литературы
Аладин Н.В., 1983. О смещении барьера критической солености в Каспийском и Аральском морях на примере жаброногих и ракушковых ракообразных // Зоологический журнал. Т. 62. № 5. С. 689–694.
Аладин Н.В., 1988. Концепция относительности и множественности зон барьерных соленостей // Журнал общей биологии. Т. 49. № 6. С. 825–833.
Аладин Н.В., 1989. Критический характер биологического действия каспийской воды соленостью 7–11‰ и аральской воды соленостью 8–13‰ // Труды Зоологического института АН СССР. Т. 196. С. 12–21.
Аладин Н.В., 1991. Танатоценозы исчезающих и отчленяющихся заливов Аральского моря // Труды Зоологического института АН СССР. Т. 237. С. 60–63.
Аладин Н.В., Плотников И.С., 1995. Изменения уровня Аральского моря: палеолимнологические и археологические доказательства // // Труды Зоологического института РАН. Т. 262. С. 17–46.
Аладин Н.В., Плотников И.С., 2008. Современная фауна остаточных водоемов, образовавшихся на месте бывшего Аральского моря // Труды Зоологического института РАН. Т. 312. № 1/2. С. 145–154.
Андреев Н.И., 1999. Гидрофауна Аральского моря в условиях экологического кризиса. Омск: Изд. ОмГУ. 455 с.
Андреев Н.И., Андреева С.И., 1981. Некоторые закономерности изменения фауны беспозвоночных Аральского моря // Биологические основы рыбного хозяйства водоемов Средней Азии и Казахстана. Тезисы докладов XVII научной конференции (г. Балхаш, 22–26 сентября 1981 г.). Фрунзе: Илим. С. 219–220.
Андреев Н.И., Андреева С.И., 1990. Соленостная резистентность некоторых массовых беспозвоночных Аральского моря // Труды Зоол. института АН СССР. Т. 223. С. 85–104.
Андреева С.И., 1978. Зообентос Аральского моря // Биологические основы рыбного хозяйства водоемов Средней Азии и Казахстана: Материалы XVI конференции. Фрунзе: Илим. С. 13–14.
Андреева С.И., 1989. Макрозообентос Аральского моря в начальный период его осолонения // Труды Зоологического института АН СССР. Т. 199. С. 53–82.
Андреева С.И., 2000. Современные Cerastoderma (Bivalvia, Cardiidae) Аральского моря: Систематика, изменчивость, эволюция. Омск: ОГПУ. 240 с.
Андреева С.И., Андреев Н.И., 1987. Донные биоценозы Аральского моря при изменении его режима // Гидробиологический журнал. Т. 23. № 5. С. 81–86.
Андреева С.И., Андреев Н.И., 2003. Эволюционные преобразования двустворчатых моллюсков Аральского моря в условиях экологического кризиса. Омск: ОГПУ. 382 с.
Андреева С.И., Андреев Н.И., Гребенников М.Е., 2016. К фауне гребнежаберных моллюсков Северного Приаралья // Фауна Урала и Сибири. № 1. С. 7–16.
Андреева С.И., Андреев Н.И., Михайлов Р.А., 2020. Находки моллюсков рода Caspiohydrobia Starobogatov 1970 (Gastropoda, Hydrobiidae) в соленых реках Прикаспийской низменности // Зоологический журнал. Т. 99. № 3. С. 253–260.
Бекмурзаев Б., 1970. Распространение, выживание и дыхание некоторых беспозвоночных юга Арала в воде различной солености // Труды ВНИРО. Т. 76. Вып. 3. С. 185–191.
Бекмурзаев Б., 1971. Донные беспозвоночные прибрежной части юга Арала и влияние на них среды обитания. Автореф. дис. … канд. биол. наук. М. 21 с.
Берг Л.С., 1908. Аральское море. Опыт физико-химической монографии // Известия Туркестанского отд. Русского географического общества. Т. 5. Вып. 9. 580 с.
Бергер В.Я., Горбушин А.М., 2001. Толерантность и резистентность брюхоногих моллюсков Hydrobia ulvae и H. ventrosa из Белого моря к абиотическим факторам среды // Биология моря. Т. 27. № 5. С. 357–362.
Бирштейн Я.А., Винградов Л.Г., Кондаков Н.Н., Кун М.С., Астахова Т.В., Романова Н.Н. (ред.), 1968. Атлас беспозвоночных Каспийского моря. М.: Пищевая промышленность. 416 с.
Богуцкая Н.Г., Кияшко П.В., Насека А.М., Орлова М.И., 2013. Определитель рыб и беспозвоночных Каспийского моря. Т. 1. Рыбы и моллюски. СПб.– М.: Товарищество научных изданий КМК. 543 с.
Бортник В.И., Чистяева С.П. (ред.), 1990. Аральское море. Гидрометеорология и гидрохимия морей СССР. Т. 7. Л.: Гидрометеоиздат. 196 с.
Гришаева О.В., 2010. Современное состояние макрозообентоса Малого Аральского моря и водоемов нижнего течения реки Сырдарья. Автореф. дис. … канд. биол. наук. Алматы: Институт зоологии КН МОН РК. 41 с.
Деньгина Р.С., 1959. Бентос архипелага Карабайли Аральского моря // Труды лаборатории озероведения АН СССР. Т. 8. С. 23–83.
Завьялов П.О. Гинзбург А.И., Сапожников Ф.В. и др., 2004. Комплексные экспедиционные исследования в западной части Аральского моря в 2003 г. // Океанология. Т. 44. № 1. С. 632–635.
Завьялов П.О., Арашкевич А.Г., Бастида И. и др., 2012. Большое Аральское море в начале XXI века: физика, биология, химия. М.: Наука. 229 с.
Жадин В.И., 1952. Моллюски пресных и солоноватых вод СССР. М.–Л.: Изд-во акад. наук СССР. 376 с.
Карпевич А.Ф., 1947. Предпосылки к акклиматизации новых форм в Аральском море // Доклады ВНИРО. № 6. С.13–17.
Карпевич А.Ф., 1953. Отношение двустворчатых моллюсков Северного Каспия и Арала к изменению солености среды. Автореф. дис. … докт. биол. наук. М. 20 с.
Карпевич А.Ф., 1953а. Состояние кормовой базы южных морей после зарегулирования стока рек // Труды совещания ихтиологической комиссии АН СССР. Вып. 1. С. 124–150.
Карпевич А.Ф., 1958. Выживание, размножение и дыхание мизиды Mesomysis kowalevskyi (Paramysis lacustris kowalevskyi Czern.) в водах солоноватых водоемов СССР // Зоологический журнал. Т. 37. Вып. 8. С. 1121–1135.
Карпевич А.Ф., 1962. Влияние вод с увеличенным количеством Ca на азовских моллюсков (материалы к акклиматизации Syndesmia ovata и Corbulomya maeotica в Аральском море) // Труды Всесоюзного гидробиологического общества. Т. 12. С. 42–54.
Карпевич А.Ф., 1975. Теория и практика акклиматизации водных организмов. М.: Пищевая промышленность. 432 с.
Кафанов А.И., 1980. К номенклатуре азово-черноморских Cardiidae (Bivalvia) // Зоологический журнал. Т. 59. Вып. 4. С. 623–626.
Кортунова Т.А., 1970. Некоторые данные по акклиматизированным морским беспозвоночным Аральского моря // Труды ВНИРО. Т. 76. Вып. 3. С. 178–184.
Кияшко П.В., 2013. Моллюски Каспийского моря // Определитель рыб и беспозвоночных Каспийского моря. Том 1. Рыбы и моллюски. СПб.–М.: Товарищество научных изданий КМК. С. 298–425.
Логвиненко Б.М., Старобогатов Я.И., 1968. Тип моллюски, Mollusca // Атлас беспозвоночных Каспийского моря. М.: Пищевая промышленность. С. 308– 385.
Маев Е.Г., Маева С.А., Николаев С.Д., 1983. Новые данные по голоценовой истории Аральского моря // Палеогеография Каспийского и Аральского морей в кайнозое. Т. 2. С. 119–133.
Мамедов Э.Д., Трофимов Г.Н., 1986. Голоценовые плювиальные озера Закаспия // Бюллетень Комиссии по изучению четвертичного периода. № 55. М.: Наука. С. 102–107.
Мордухай-Болтовской Ф.Д. (ред.), 1974. Атлас беспозвоночных Аральского моря. М.: Пищевая промышленность. 272 с.
Невесская Л.А., 1965. Позднечетвертичные двустворчатые моллюски Черного моря, их систематика и экология // Труды Палентологического института АН СССР. Т. 105. 391 с.
Плотников И.С., 2013. Изменение видового состава фауны свободноживущих беспозвоночных (Metazoa) Аральского моря // Пятьдесят лет концепции критической солености. Труды ЗИН РАН. Приложение № 3. С. 41–54.
Плотников И.С., 2016. Многолетние изменения фауны свободноживущих водных беспозвоночных Аральского моря. СПб.: ЗИН РАН. 168 с.
Плотников И.С., Аладин Н.В., Филиппов А.А., 1991. Прошлое и настоящее фауны Аральского моря // Зоологический журнал. Т. 70. № 4. С. 5–15.
Свиточ А.А., 2009. История последнего Аральского моря // Аридные экосистемы. Т. 15. № 2. С. 5–17.
Сидоров С.А., 1929. Моллюски Арала и его ближайших окрестностей // Русский гидробиологический журнал. Т. 8. № 1–3. С. 13–37.
Скарлато О.А., Старобогатов Я.И., 1972. Класс двустворчатые моллюски // Определитель фауны Чёрного и Азовского морей. Свободноживущие беспозвоночные. Т. 3. Киев: Наукова думка. С. 178–250.
Старобогатов Я.И., 1970. Фауна моллюсков и зоогеографическое районирование континентальных водоемов земного шара. М.: Наука. 372 с.
Старобогатов Я.И., 1974. Тип моллюски, Mollusca // Атлас беспозвоночных Аральского моря. М.: Пищевая промышленность. С. 237–257.
Стуге Т.С., 2002. История исследования зоопланктона Аральского моря гидробиологами Казахстана // Tethys Aqua Zoological Research. V. 1. С. 137–142.
Федоров П.В., 1978. Плейстоцен Понто-Каспия. М.: Наука. 165 с.
Филиппов А.А., 1994. Макрозообентос прибрежных вод северной части Аральского моря в современных полигалинных условиях. Автореф. дис. … канд. биол. наук. СПб.: ЗИН РАН. 24 с.
Филиппов А.А., 1995. К вопросу о солеустойчивости донных организмов Аральского моря // Труды Зоологического института РАН. Т. 262. Ч. 1. С. 65–102.
Филиппов А.А., 1995а. Макрозообентос прибрежных вод северной части Аральского моря в современных полигалинных условиях: численность, биомасса, пространственное распределение // Труды Зоологического института РАН. Т. 262. Ч. 1. С. 103–166.
Филиппов А.А., Филиппова Н.А., 2006. Зависимость соленостной толерантности от условий акклимации и определение потенциальной соленостной толерантности водных беспозвоночных // Вестник СПбГУ. Сер. 3. Вып. 4. С. 25–32.
Хлебович В.В., 1981. Акклимация животных организмов. Л.: Наука. 136 с.
Хлебович В.В., Кондратенков А.П., 1971. Потенциальная эвригалинность беломорского моллюска Hydrobia ulvae // Моллюски. Пути, методы и итоги их изучения. Л.: Наука. С. 37–38.
Хрусталев Ю.П., Резников С.А., Туровский Д.С., 1977. Литология и геохимия донных осадков Аральского моря. Ростов-на-Дону: изд. Ростовского гос. ун-та. 134 с.
Хусаинова Н.З., 1958. Биологические особенности некоторых массовых донных кормовых беспозвоночных Аральского моря. Алма-Ата. 116 с.
Хусаинова Н.З., 1960. Култуки восточного побережья Аральского моря и их жизнь // Вестник АН Казахской ССР. № 6. С. 34–42.
Янина Т.А., 2009. Формирование и эволюция малакофауны каспийских бассейнов в раннем и среднем неоплейстоцене // Древнейшие миграции человека в Евразии. Новосибирск: Институт археологии и этнографии СО РАН. С. 207–214.
Янина Т.А., Свиточ А.А., Весселинг Ф.П., 2011. Биоразнообразие малакофауны Каспийского моря в голоцене // Вестник Московского университета. Сер. 5. География. № 2. С. 38–48.
Ярославцева Л.М., 1976. Устойчивость к опреснению клеток некоторых моллюсков и влияние на нее тоничности солевого раствора // Биология моря. № 1. С. 36–40.
Baymurodov K.T., 2015. The development and extension of bivalves in the basin of the Amudarya and Syrdarya rivers // Научно-исследовательские публикации: природа, экология и народное хозяйство. Т. 1. № 7 (27). С. 35–42.
Boyden C.R., Russell P.J.C., 1972. Distribution and habitat range of brackish water cockle (Cardium (Cerastoderma) glaucum) in British Isles // The Journal of Animal Ecology. V. 41. P. 719–734.
Burr G.S., Krivonogov S.K., Gusskov S.A., Cruz R.J., 2019. A history of the modern Aral Sea (Central Asia) since the Late Pleistocene // Quaternary Science Reviews. V. 206. P. 141–149.
Ermakhanov Z.K., Plotnikov I.S., Aladin N.V., Micklin P., 2012. Changes in the Aral Sea ichthyofauna and fishery during the period of ecological crisis // Lakes and Reservoirs: Research and Management. № 17. P. 3–9.
Filippov A.A., 1998. On the Methods for Estimating the Salinity Tolerance of Water Invertebrates // Russian Journal of Ecology. V. 29. № 4. P. 253–257.
Filippov A., Riedel F., 2009. The late Holocene mollusc fauna of the Aral Sea and its biogeographical and ecological interpretation // Limnologica. V. 39. P. 67–85.
Haase M., Naser M.D., Wilke T., 2010. Ecrobia grimmi in brackish Lake Sawa, Iraq: indirect evidence for long-distance dispersal of hydrobiid gastropods (Caenogastropoda: Rissooidea) by birds // Journal of Molluscan Studies. V. 76. P. 101–105.
Hummel H., Wolowicz M., Bogaards R.H., 1994. Genetic variability and relationships for populations of Cerastoderma edule and of the C. glaucum complex // Netherlands Journal of Sea Research. V. 33. № 1. P. 81–89.
Keen A.M., 1969. Superfamily Cardiacea Lamarck, 1809 // Treatise on invertebrate paleontology, part № 6. Mollusca, Bivalvia. University of Kansas Press, Lawrence. P. 583–594.
Khlebovich V.V., Kondratenkov A.P., 1973. Stepwise acclimation – a method for estimating the potential eurychalinity of the gastropod Hydrobia ulvae // Marine Biology. V. 18. P. 6–8.
Krivonogov S.K., Kuzmin Y.V., Burr G.S. et al., 2010. Environmental changes of the Aral Sea (Central Asia) in the Holocene: major trends // Radiocarbon. V. 52. № 2–3. P. 555–568.
Krivonogov, S.K., Burr, G.S., Kuzmin, Y.V. et al., 2014. The fluctuating Aral Sea: a multidisciplinary-based history of the last two thousand years // Gondwana Research. V. 26. P. 284–300.
Krupa E.G., Grishaeva O., 2019. Impact of water salinity on long-term dynamics and spatial distribution of benthic invertebrates in the Small Aral Sea // International Journal of Oceanography and Hydrobiology. V. 48. № 4. P. 355–367.
Krupa E.G., Grishaeva O.V., Balymbetov K.S., 2019. Structural variables of macrozoobenthos during stabilization and increase of the Small Aral Sea’s level (1996–2008) // Journal of Fisheries Research. V. 3. I. 1. P. 1–6.
Mamedov A.V., 1997. The Late Pleistocene-Holocene history of the Caspian Sea // Quaternary International. V. 41. P. 161–166.
Neubauer T.A., S. van de Velde., Yanina T., Wesselingh F.P., 2018. A late Pleistocene gastropod fauna from the northern Caspian Sea with implications for Pontocaspian gastropod taxonomy // Zoo keys. V. 770. P. 43–103.
Plotnikov I.S., Aladin N.V., 2011. An overview of hybrid marine and lacustrine seas and saline lakes of the world // Lakes & Reservoirs: Research and Management. V. 16. P. 97–108.
Plotnikov I.S., Ermakhanov Z.K., Aladin N.V., Micklin P., 2016. Modern state of the Small (Northern) Aral Sea fauna // Lakes and Reservoirs: Research and Management. № 21. P. 315–328.
Pora E.A., 1969. L’importance du facteur rhopique (equilibre ionique) pour la vie aquatique // Verhandlungen des Internationalen Verein Limnologie. № 17. P. 970–986.
Rose K.D., 1972. A mollusc new to Lake Birket Qarun, Egypt // Nautilus. V. 85. № 4. P. 141–143.
Smurov A.O., Aladin N.V., Keyser D., 2017. The effect of marine and Aral Sea water on the salinity tolerance of three Paramecium species (Ciliophora) // Lakes and reservoirs: Research and Management. V. 22. № 3. P. 241–246.
Spencer J.E., Patchett P.J., 1997. Sr isotope evidence for a lacustrine origin for the upper Miocene to Pliocene Bouse Formation, lower Colorado River trough, and implications for timing of Colorado Plateau uplift // Geological Society of America Bulletin. V. 109. P. 767–778.
Tarnowska K., Verney A., Wolowicz M., Féral. J.P., Chenuil A., 2012. Survival of male and female Cerastoderma glaucum (Bivalvia) during aerial exposure // Vie et milieu – life and environment. V. 62. № 1. P. 23–28.
Toman M.J., Plotnikov I., Aladin N., Micklin P., Ermakhanov Z., 2015. Biodiversity, the present ecological state of the Aral Sea and its impact on future development // Acta Biologica Slovenica. V. 58. № 1. P. 45–59.
Vandendorpe J., Baak C., Stelbrink B., Delicada D., Wilk T., 2019. Historical faunal exchange between the Pontocaspian Basin and North America // Ecology and Evolution. V. 9. № 18. P. 10816–10827.
Wesselingh F.P., Neubauer T.A., Anistratenko V.V., Vinarski M.V., Yanina T. et al., 2019. Mollusc species from the Pontocaspian region – an expert opinion list // ZooKeys. V. 827. P. 31–124.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал