Зоологический журнал, 2022, T. 101, № 2, стр. 228-240
Сезонные изменения концентрации тестостерона и тироксина у самцов белогрудого ежа (Erinaceus roumanicus, Erinaceidae, Eulipotyphla)
М. В. Рутовская a, *, М. Е. Диатроптов a
a Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: desmana@yandex.ru
Поступила в редакцию 15.12.2020
После доработки 05.07.2021
Принята к публикации 10.07.2021
- EDN: XLQQLX
- DOI: 10.31857/S0044513421120114
Аннотация
Динамика концентрации тестостерона и тироксина в сыворотке крови 9 самцов белогрудого ежа (Erinaceus roumanicus) была исследована в течение года при естественном сезонном цикле (зимой ежи были в состоянии гибернации в неотапливаемом помещении, летом в вольере 100 м2, в условиях, приближенных к естественным). Взятие образцов крови проводили каждые 12 сут, концентрацию гормонов определяли в сыворотке крови методом иммуноферментного анализа. Концентрации тестостерона и тироксина имели четкую сезонную изменчивость. Максимальные значения тестостерона наблюдали сразу после весеннего пробуждения, затем через 2 нед регистрировали резкое снижение до среднего уровня, который поддерживался до конца июня. С августа до начала декабря обнаруживали следовые количества этого гормона. Статистически значимое повышение концентрации тестостерона по сравнению с осенним уровнем наблюдали с середины декабря. Динамика концентрации тироксина в некоторой степени повторяла изменения концентрации тестостерона, но с запаздыванием на 12‒24 дня. Выявлено два коротких периода, когда на фоне снижения концентрации тестостерона наблюдали повышение концентрации гормонов щитовидной железы: через 12‒20 дней после пробуждения, когда происходил переход от активного поиска полового партнера к активизации пищедобывательного поведения и умеренному набору веса, и в начале июля, по окончании репродуктивного сезона и при переходе к активному запасанию жира.
Белогрудый еж (Erinaceus roumanicus Barrett-Hamilton 1900) относится к насекомоядным животным, обитающим в лесной зоне, и имеет выраженную годовую цикличность, обусловленную зимней спячкой. Зимняя спячка у лесных ежей (род Erinaceus) начинается в сентябре‒ноябре, в зависимости от географической широты местности, погодных условий и степени запасания жира животного (Темботова, 1997; Кучерук, Карасёва, 1980). Заканчивается в марте‒апреле, в зависимости от схода снегового покрова. Зимняя спячка характеризуется понижением температуры тела в среднем до 6.3 ± 0.4°С (Rutovskaya et al., 2019), замедлением сердцебиения (с 128‒ 210 до 2‒12 уд/мин) и снижением частоты дыхания (с 50 до 4‒5 дыхательных актов в минуту) (Калабухов, 1985). Общая продолжительность сезона спячки составляет от 103 до 210 сут. Во время спячки отмечены периодические пробуждения (периоды нормотермии), во время которых зверьки разогреваются до 32–34°С (Rutovskaya et al., 2019). Во время спячки у ежей останавливается развитие сперматозоидов на стадии первичных сперматоцитов (Allanson, 1934; Saure, 1969). Реактивация семенников возобновляется с середины гибернации (Saboureau, Peyre, 1970), а активная деятельность половых желез ‒ через некоторое время после пробуждения (Калабухов, 1985).
Период гона начинается сразу после выхода животных из зимней спячки (Кучерук, Карасёва, 1980). Для ежей характерен промискуитет. Процесс спаривания у них занимает 3‒10 мин. После успешного спаривания самец не охраняет самку от повторных спариваний с другими самцами. Поэтому за сезон размножения самка, как и самец, может спариваться с большим числом разных партнеров (Reeve, 1994).
Выводки рождаются в начале лета, но при потере выводка самка может снова прийти в эструс и будет покрыта (Огнев, 1928). Однако выживаемость ежат из поздних выводков на севере ареала может быть низкой, поскольку для успешной спячки они должны успеть набрать необходимый вес (Карасева и др., 1979). При этом на юго-западе Франции обычны два успешных помета в год (Saboureau, Castaing, 1985).
Сезонность размножения и гетеротермия сопровождаются изменением концентрации стероидных и тиреоидных гормонов в плазме крови. Пик концентрации тестостерона у европейских ежей (Erinaceus erinaceus) отмечен в феврале‒марте, затем концентрация гормона плавно снижается к июлю, а резкое снижение до следовых количеств наблюдается в августе (Fowler, 1988). Пик концентрации тироксина у самцов приходится на апрель‒июль (Fowler, 1988). Фоулер (Fowler, 1988), сравнивая результаты, полученные на европейских ежах, содержащихся в Шотландии на 57° с.ш., с подобными данными из Франции на 46° с.ш., отмечал, что в более северных районах высокий уровень концентрации тестостерона держится на 2 мес меньше, а подъем и спад его концентрации происходят на месяц раньше и позже соответственно. Поздняя реактивация и ранняя инволюция семенников связаны с более коротким летом на 57° с.ш., а период сперматогенеза короче (Saboureau, Boissin, 1978; Saboureau, Dutourné, 1981; Fowler, 1988). Годовые циклы тироксина в плазме крови европейских ежей были схожи на двух широтах (Saboureau, Boissin, 1978). Однако, как и в случае с тестостероном, концентрация тироксина начинала снижаться раньше (с сентября по январь), чем на юго-западе Франции (с октября по январь), а пиковые уровни наблюдали на 2 мес позже. На обеих широтах концентрации тестостерона и тироксина в плазме крови тесно коррелировали между собой. Годовой цикл тестостерона коррелировал (r < 0.001) с фотопериодом, и только июльские значения (конец сезона размножения) не имели от него прямую зависимость (Fowler, 1988). Корреляцию концентраций тестостерона в плазме крови европейского ежа с продолжительностью светового дня отмечал и Омари с коллегами (Omari et al., 1989).
В филогенетическом отношении белогрудый еж близок европейскому ежу и может образовывать с ним гибриды (Банникова и др., 2003; Bogdanov et al., 2009). Белогрудый еж активно распространяется к северу, вытесняя европейского: в начале ХХ века северная граница ареала белогрудого ежа совпадала с южной границей ареала европейского (Огнев, 1928). К концу ХХ века‒началу ХХI века ареал белогрудого ежа расширился до северных границ Белоруссии, а также в Костромскую и Кировскую области (Гуреев, 1979), а на востоке появился в Мордовии (Андрейчев и др., 2010). На западе белогрудый еж образовал две зоны симпатрии с европейским ежом (Bolfıkova, Hulva, 2012). В середине XX веке в Московской обл. отмечали только европейского ежа, но в настоящее время по большей ее части распространился белогрудый еж, образовав зону симпатрии и гибридизации с европейским ежом (Банникова и др., 2010; Zolotareva et al., 2021).
Причины этого явления можно искать как в изменении экологических условий, так и в особенностях поведения и социальной структуры лесных ежей. Данных о социальной структуре и поведении этих видов недостаточно. Есть отдельные исследования по агрессивному поведению европейского ежа (Лозан, 1978), его оборонительному поведению (Morris, 1997). Работы по распространению, передвижению и социальной структуре представлены в основном по результатам радио прослеживания за европейским ежом. Показано, что участки обитания самцов и самок частично перекрываются (Morris, 1997), но агрессивные взаимодействия между ежами редки, чаще всего ежи избегают контактов (Reeve, 1994).
Для самцов белогрудого ежа, напротив, характерны мягко-агрессивные контакты. Для самок ‒ опознавательные. Белогрудые ежи могут скапливаться на небольшой территории с высокой плотностью (18 особей на 1 га), в то время как для европейского ежа высокой плотностью считается уже 2.5 особи на 1 га (Morris, 1997). Высокая плотность белогрудого ежа предполагает высокую социальную активность. В отличие от европейского, белогрудый еж охотно вступал во взаимодействия: была отмечена высокая степень толерантности и персонификации взаимодействий особей, без установления ясно выраженных иерархических отношений (Берлизов и др., 2008).
Все работы по сезонной динамике уровня стероидных и тиреоидных гормонов были проведены на европейском еже (Saboureau, Boissin, 1978; Saboureau, Dutourné, 1981; Dutourné, Saboureau, 1983; Fowler, 1988). Аналогичных данных по белогрудому ежу нет. Однако в связи с высокой социальной активностью и толерантностью белогрудых ежей, что позволяет им активно расширять свой ареал, замещая европейского ежа, гормональная регуляции их поведения и обмена веществ может иметь свои особенности, в том числе в сезонной динамике концентраций гормонов.
Цель настоящей работы ‒ определить годовой цикл изменения концентрации тестостерона и тироксина в сыворотке крови у белогрудого ежа в связи с сезонной половой активностью самцов и изменениями обмена веществ и сравнить с аналогичными данными по европейскому ежу.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на научно-экспериментальной базе “Черноголовка” ИПЭЭ РАН с использование коллекции животных и оборудования ЦКП “Живая коллекция диких видов млекопитающих” в 2018‒2020 гг. Все ежи были отловлены в Спасском р-не Рязанской обл. Исследования годового цикла концентрации гормонов и массы тела проведены на 9 половозрелых самцах белогрудого ежа (Erinaceus roumanicus Barrett-Hamilton 1900) (табл. 1, группа 1). В летний период ежей содержали в вольере общей площадью 100 м2. Ежедневно ежи получали сырой куриный фарш (мышечная ткань и кости) с добавлением сырого яйца. Вода была в свободном доступе постоянно. С осени до весны животные, у которых регулярно брали образцы крови, зимовали в неотапливаемом помещении, в котором не допускали падение температуры воздуха ниже нуля, подключая при необходимости электрические обогреватели. Ежей содержали в отсеках площадью 1 м2 при естественном освещении. В качестве подстилки использовали опилки, в качестве гнездового материала – сено. В зимний период все ежи находились в состоянии гибернации, которое контролировали как визуально – животные не демонстрировали ночную активность, так и с помощью термонакопителей (логгеров). Всем животным внутрибрюшинно были имплантированы логгеры ДТН3-28 (ЭМБИ РЕСЕРЧ, Новосибирск) (Петровский и др., 2008). Имплантацию осуществляли под наркозом препаратом “Золетил” (Франция), в дозе 15–20 мкг/кг веса. Животные уходили в спячку с 8 сентября по 4 декабря, а выходили из нее с 27 февраля по 10 апреля. Ежи выходили из состояния спячки естественным образом, им начинали давать корм, когда они демонстрировали ночную активность вне гнезда.
Таблица 1.
Число животных, использованных в разных экспериментах и условия их содержания
| № группы | Задача исследования | Период наблюдений | Число животных | Место зимовки | Частота взятия крови |
|---|---|---|---|---|---|
| 1 | Основная: изучение годового цикла гормонов | 6.04.2018–6.04.2019 | 9 | Помещение | 12 сут |
| 2 | Проверка влияния на уровень тестостерона частых искусственных пробуждений | Зима 2018–2019 | 3 | Помещение | 36 сут |
| 3 | Проверка влияния на уровень тестостерона зимовки в помещении | Зима 2019–2020 | 6 | Открытая вольера | Только два раза: 27.11.2019 и 20.01.2020 |
Процедура взятия крови у всех животных была приурочена к суточному пику показателя тестостерона в период с 15:10 до 16:30 (Rutovskaya et al., 2020), а также к 4- и 12- дневному циклу инфрадианного ритма (Диатроптов и др., 2014; Rutovskaya et al., 2020). Концентрация тестостерона у ежей имеет высокоамплитудные колебания: показатели в акрофазе и батифазе различаются в 2‒4 раза (Rutovskaya et al., 2020). Следовательно, при взятии крови на анализ не в период акрофазы концентрация тестостерона может быть очень низкой и может не отражать реальный индивидуальный уровень этого гормона.
Взятие крови проводили из поверхностных вен бедра в количестве около 0.5 мл в пробирки Эппендорфа под наркозом того же препарата “Золетил”, но в дозе 10 мкг на 1 кг веса животного. Процесс взятия крови продолжался не более 7‒10 мин. Кровь центрифугировали через 30 мин после взятия при 300 g дважды в течение 15 мин. Полученную сыворотку хранили не более месяца при температуре –20°С.
В зимний период во время спячки, перед взятием крови ежей заносили в теплое помещение, и перед процедурой массировали конечности для возобновления кровообращения. Процедура взятия крови могла приводить к кратковременному пробуждению животного.
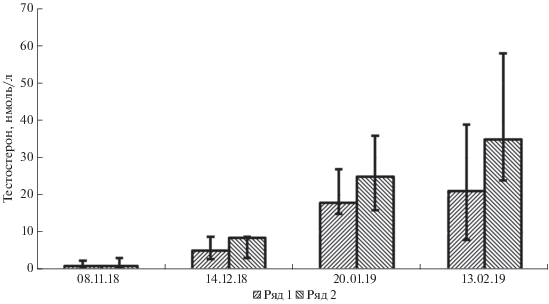
С целью оценки влияния в период гибернации частых (1 раз в течение 12 сут) искусственных пробуждений, вызванных процедурой взятия крови, на сроки начала увеличения концентрации тестостерона параллельно с основной группой животных (табл. 1, группа № 1) была использована контрольная группа животных из 3 особей (табл. 1, группа № 2), образцы крови у которых брали 1 раз в течение 36 дней. Как видно на рис. 1, достоверных различий в уровне тестостерона у исследованных групп не выявляется. Во все временны́е точки исследования, когда уже наблюдается рост концентрации тестостерона, медиана этого показателя не отличается от основной группы (для 8 ноября р = 0.97, z = 0.02; для 14 декабря р = 0.89, z = –0.12; для 20 января р = 0.52, z = = ‒0.64; для 13 февраля р = 0.30, z = –1.01, критерий Манна–Уитни).
Рис. 1.
Концентрация тестостерона в сыворотке крови у самцов ежей двух групп: Ряд 1 ‒ группа (n = 9), взятие крови у которой проводили каждые 12 суток, Ряд 2 ‒ группа (n = 3), взятие крови у ежей из которой проводили каждые 36 суток. Планки погрешностей отражают интерквартальный размах (25‒75%).
Также для проверки влияния многократных искусственных пробуждений и зимовки в помещении на время начала сезонного повышения концентрации тестостерона и его уровень зимой 2018‒2019 г. мы двукратно провели взятие крови у ежей, зимующих в условиях, максимально приближенных к естественным (табл. 1, группа № 3). Животные этой группы (n = 6) зимовали в вольерах 100 м2, в искусственных укрытиях, расположенных ниже уровня почвы на 40‒50 см, с сеном в качестве гнездового материала, слоем лапника сверху укрытия и под естественным снеговым покровом. У этих 6 особей взятие крови проводили дважды ‒ 27 декабря 2019 и 20 января 2020 г., для чего животных выкапывали из-под снега, а после процедуры возвращали в укрытия и засыпали снегом. Показатели концентрации тестостерона у этой группы животных 27 декабря 2019 составляли 6.8 (3.0‒15.4) нмоль/л (здесь и далее: Me (25%‒75%)), а 20 января 2020 – 15.1 (10.3‒ 23.4) нмоль/л. Полученные результаты не отличались от показателей основной группы животных (группа № 1, n = 9), которые зимовали в неотапливаемом помещении и подвергал каждые 12 дней процедуре взятия крови, концентрация тестостерона у этих особей основной группы 27 декабря 2018 и 20 января 2019 составила 5.0 (4.6‒5.2) нмоль/л и 18.0 (15.0‒27.1) нмоль/л, соответственно (р = 0.74, z = –0.32 и р = 0.81, z = 0.20, критерий Манна–Уитни). На основании этого можно сделать вывод, что многократные искусственные пробуждения, вызванные процедурой взятия крови, не влияют на время начала сезонного повышения концентрации тестостерона и его уровень.
Мы не исключаем возможного влияния на концентрацию гормонов процедуры отогревания гибернирующего животного и массирования его конечности для возобновления кровообращения, необходимого при взятии крови. Однако начиная с середины декабря по середину января у животных, момент взятия крови у которых случайно приходился на кратковременное состояние нормотермии, концентрация тестостерона была примерно в два раза выше 16.7 (12.3‒24.5) нмоль/л, чем у насильно пробуждаемых животных 8.8 (3.4‒ 10.3) нмоль/л (р = 0.012, z = 2.48 критерий Манна–Уитни, число случаев взятия проб при нормотермии 8, а гипотермии – 31). Следовательно, если искусственное пробуждение животного и влияет на концентрацию гормонов, то в очень незначительной степени.
Концентрацию тестостерона и тироксина в сыворотке крови определяли методом иммуноферментного анализа, используя наборы “НВО Иммунотех”, Россия. Чувствительность метода определения тестостерона составляла 0.18 нмол/л, кросс-реактивность антител к 5-дигидротестостерону – 9%, к 11-гидрокситестостерону – 1%, 5-андростендиолу – 1% и менее чем 0.1% к другим стероидам. Чувствительность набора для определения общего тироксина ‒ 5 нмоль/л, перекрестная реакция с трийодтиронином ‒ 0.9%, тирозином – 0.001%. Концентрацию гормонов определяли в дублях и для дальнейшего анализа использовали их среднее значение. Если показатели концентрации дублей различались более чем на 5%, выполняли повторное определение. Регистрацию цветной реакции проводили при помощи многоканального ИФА ридера ANTHOS 2010, Австрия.
Статистическую обработку данных проводили с помощью программного пакета Statistica Ultimate Academic 13 for Windows En. Учитывая характер распределения данных и небольшое число исследуемых животных (n = 9), использовали методы непараметрической статистики. Полученные данные выражали в виде медианы и интерквартильных размахов Me (25‒75%). Для множественного сравнения использовали критерий Фридмана (Friedman ANOVA), использующийся для связанных выборок. Также было проведено множественное сравнение методом скользящего окна протяженностью в 2 месяца. Анализируемый временнóй интервал, равный 60 суткам включал в себя данные по 6 смежным точкам исследования, заключающим в себя пять 12-суточных отрезков (12 сут × 5 сут = 60 сут). Последовательно анализировали двухмесячные участки с шагом 1 мес: апрель‒май, май‒июнь, июнь‒ август, август‒сентябрь, сентябрь‒октябрь, октябрь‒декабрь, декабрь‒январь, январь‒февраль, февраль‒март. Участок март‒апрель, включающий в себя данные полученные в разные годы, анализу не повергали. В случае сравнения двух не связанных групп значений использовали непараметрический тест Манна–Уитни (сравнение опыт/контроль). С целью выявления корреляционных связей рассчитывали ранговый коэффициент корреляции Спирмена.
Работу с животными проводили согласно рекомендациям национального стандарта по принципам надлежащей лабораторной практики Российской Федерации ГОСТ З 53 434–2009, причем было получено положительное заключение Комиссии по биоэтике ИПЭЭ РАН № 14 от 15.01.2018 г.
РЕЗУЛЬТАТЫ
Тестостерон. Концентрация тестостерона в сыворотке крови имела четкую сезонную изменчивость (Friedman ANOVA df = 29, T = 111.5, p < < 0.0001, здесь и далее число особей равно 9). Изменения уровня гормонов, выявленные методом скользящего окна, представлены в табл. 2. Максимальные значения тестостерона наблюдали сразу после весеннего пробуждения животных 59.1 (32.2‒68.0) нмоль/л (здесь и далее: Me (25%‒ 75%)). К концу апреля концентрация тестостерона достоверно снижалась и к концу июня уровень тестостерона был стабильным и составлял 13.8 (8.0‒24.6) нмоль/л. Значимое снижение концентрации тестостерона отмечено в начале июля с 16.7 (7.7‒27.8) до 0.76 (0.6‒6.6) нмоль/л. В период с начала августа по ноябрь уровень тестостерона значимых изменений не имел, и мы обнаруживали следовые количества гормона 0.9 (0.6‒1.8) нмоль/л (рис. 2). Статистически значимое повышение концентрации гормона наблюдали с середины декабря: 2 декабря 1.7 (0.9‒2.8) нмоль/л, а 14 декабря 5.1 (2.8‒8.8) нмоль/л. В период 20 января–13 февраля, когда животные находились в спячке, концентрация тестостерона составляла 21.1 (12.1‒ 37.0) нмоль/л. В период пробуждения от спячки (26 февраля ‒ 7 марта) концентрации тестостерона увеличилась до 61.7 (30.0‒66.4) нмоль/л. В период с 26 марта по 7 апреля концентрация тестостерона резко упала и составила 15.0 (9.1‒ 17.0) нмоль/л (табл. 2).
Таблица 2.
Коэффициенты значимости различий показателей концентрации тестостерона и тироксина в сыворотке крови белогрудых ежей при множественном сравнении анализируемого двухмесячного интервала
| Временнóй интервал | df | Концентрация тестостерона | Концентрация тироксина | ||
|---|---|---|---|---|---|
| Т | р | Т | р | ||
| Апрель–май | 5 | 14.3 | 0.014 | 10.6 | 0.031 |
| Май–июнь | 5 | 5.7 | 0.33 | 10.1 | 0.072 |
| Июнь–июль | 5 | 14.7 | 0.011 | 4.6 | 0.45 |
| Июль–август | 5 | 9.9 | 0.088 | 12.1 | 0.034 |
| Август–сентябрь | 5 | 4.1 | 0.54 | 21.3 | 0.001 |
| Сентябрь–октябрь | 5 | 8.3 | 0.14 | 16.5 | 0.005 |
| Октябрь–ноябрь | 5 | 3.7 | 0.29 | 10.1 | 0.07 |
| Ноябрь–декабрь | 5 | 12.6 | 0.027 | 2.6 | 0.76 |
| Декабрь–январь | 5 | 16.9 | 0.005 | 4.5 | 0.34 |
| Январь–февраль | 5 | 16.6 | 0.005 | 22.0 | 0.001 |
| Февраль–март | 5 | 8.4 | 0.13 | 12.3 | 0.015 |
Рис. 2.
Годовая динамика концентрации тестостерона в сыворотке крови самцов белогрудых ежей (n = 9) с апреля 2018 по апрель 2019. Планки погрешностей отражают интерквартальные размахи (25‒75%). Заштрихованная область – период гибернации ежей.

В 2018 г. выход ежей из спячки отмечался в последних числах марта–начале апреля, а в 2019 – в начале марта, поэтому нам удалось установить, что максимальный уровень тестостерона у ежей связан не с определенной календарной датой, а со временем пробуждения от спячки. Последующее снижение концентрации тестостерона также связано не с календарной датой, а с продолжительностью периода после пробуждения. Так, в 2019 г. по сравнению с 2018 г. ежи пробудились примерно на 24 сут раньше и снижение концентрации тестостерона у ежей в 2019 г. наблюдали также на 24 дня раньше.
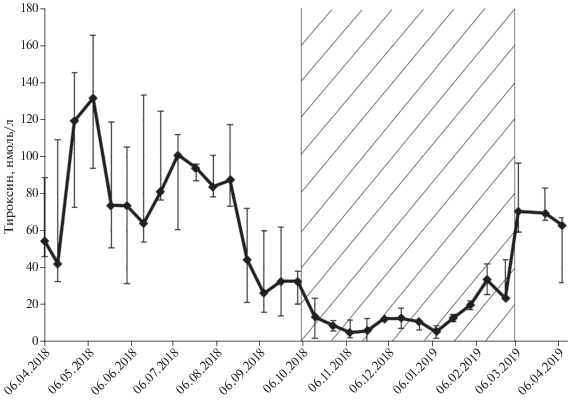
Тироксин. Динамика концентрации в сыворотке крови тироксина, как и тестостерона, имела выраженные сезонные изменения (Friedman ANOVA df = 29, T = 113.6, p < 0.0001) (рис. 3). Концентрация тироксина имела статистически значимый максимум в конце апреля–начале мая. Максимальные концентрации тироксина весной как 2018, так и 2019 гг. наблюдали на 12‒20 дней позже, чем тестостерона. Затем к середине мая показатели достоверно снижались и составляли 71.5 (51.8‒105.5) нмоль/л, а затем значимо повышались по 15 августа и оставались на уровне 87.5 (73.4‒117.3) нмоль/л. Резкое снижение концентрации тироксина наблюдали с середины августа к началу сентября – 44.4 (21.4‒72.2) нмоль/л и следующее резкое понижение концентрации тироксина наблюдали к середине октября (2 октября 32.9 (20.7; 38.3), а 14 октября 13.6 (2.0‒ 23.7) нмоль/л). Минимальное значение концентрации тироксина отмечали с 27 октября по 20 января, и оно составило 11.2 (5.5‒13.0) нмоль/л. С 20 января, за месяц до окончания гибернации, концентрация тироксина постепенно, но достоверно повышалась и в период окончания спячки составила 23.8 (23.0‒44.6) нмоль/л, только через 10 дней после окончания спячки резко увеличивалась и достигала уровня 70.6 (59.3‒96.6) нмоль/л (26 февраля 23.8 (23.0‒44.6) нмоль/л, а 7 марта 70.6 (59.3‒99.6) нмоль/л.
Рис. 3.
Годовая динамика концентрации тироксина в сыворотке крови самцов белогрудых ежей (n = 9) с апреля 2018 по апрель 2019. Планки погрешностей отражают интерквартальные размахи (25‒75%). Заштрихованная область – период гибернации ежей.
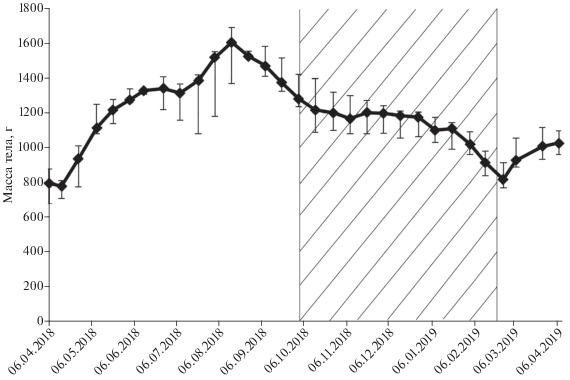
Масса тела. Сразу после зимовки медиана массы тела животных составляла 808 (716‒879) г. Резкое увеличение массы тела ежей наблюдали в период с середины апреля по середину мая, когда ежи начинали активно кормиться. Затем, до середины июля, вес животных держался на стабильном уровне 1250‒1320 г. Начиная с середины июля, масса ежей начала резко повышаться и достигла своего максимума 1600 г в середине августа. После этого масса тела стала снижаться вплоть до середины октября. Этот временнóй интервал характеризовался снижением активности ежей и началом зимней спячки с кратковременными понижениями температуры и длительными периодами нормотермии. В период глубокой спячки с длительными снижениями температуры и короткими периодами нормотермии масса ежей снижалась незначительно. Резкое снижение массы тела начиналось с начала февраля, когда периоды нормотермии снова становились более длительными. Резкое увеличение массы тела отмечено с начала марта (рис. 4).
ОБСУЖДЕНИЕ
Сезонные изменения концентрации тестостерона у самцов белогрудых ежей сходны с таковыми у европейского ежа (Omari et al., 1989; Fowler, 1988), у которого как на юге Франции (46° с.ш.), так и в более северных районах в Шотландии (57° с.ш.) повышение концентрации тестостерона начинается во время глубокой спячки в декабре. Пик концентрации тестостерона у самцов белогрудых ежей приходился на март (2019 г.) или апрель (2018 г.), что зависело от начала активности ежей. Повышение уровня тестостерона у европейского ежа коррелирует с развитием семенников, увеличением их массы, объема и началом интенсивного сперматогенеза, хотя зрелых сперматозоидов в это время еще не наблюдается (Saboureau, Dutourné, 1981). Пик концентрации тестостерона в крови у европейского ежа связан с выходом из спячки и активным гоном, о чем свидетельствует на 2 мес более короткий пик уровня тестостерона в плазме крови ежей, живущих севернее (Saboureau, Boissin, 1978; Saboureau, Dutourné, 1981). С апреля по август‒сентябрь концентрация тестостерона в крови белогрудых ежей ниже практически в 4 раза, по сравнению с концентрацией гормона весной, однако остается на более высоком уровне, чем в начальный период спячки и подготовки к спячке. Это характерно и для европейского ежа (Omari et al., 1989; Fowler, 1988), и для южноафриканского лесного ежа (Atelerix frontalis) (Colf, Aarde, 1992), у которого динамика концентрации тестостерона в крови сходна с таковой у европейского и белогрудого ежей, однако сдвинута на 6 месяцев, поскольку этот еж живет в южном полушарии земли. Высокий уровень тестостерона в крови у самцов белогрудых ежей в середине лета, по-видимому, поддерживает активность тестикул и возможность самцов покрыть самок, которые либо потеряли первый выводок, либо поздно пришли в эструс.
Повышением уровня тестостерона характеризуются многие виды зимоспящих млекопитающих только после окончания спячки: соня полчок (Glis glis) (Jallageas, Assenmacher, 1983), восточный бурундук (Tamias striatus) (Scott et al., 1981), летучие мыши, например рыжая вечерница (Nyctalus noctula) (Racey, 1974), суслик Уинта (Spermophilus armatus) (Ellis et al., 1983), золотистый суслик (Spermophilus lateralis) (Barnes et al., 1988) и лесной сурок (Marmota monax) (Concannon et al., 1989). Другие виды ‒ европейский суслик (Spermophilus citellus) (Strauss et all., 2008), садовая соня (Eliomys quercinus) (Ambid, Berges, 1981), хомяк Брандта (Mesocricetus brandti) (Darrow et al., 1987) ‒ демонстрируют повышение концентрации тестостерона за 1‒2 мес до окончания периода гибернации. Ежи являются облигатными гибернаторами, у которых концентрация тестостерона повышается с середины декабря, т.е. за 2‒3 месяца до окончания спячки. Таким образом, у разных видов облигатных гибернаторов начало повышения концентрации тестостерона наблюдается в разное время относительно пробуждения.
Было высказано предположение, что тестостерон играет определенную роль в прекращении спячки и препятствует впадению в торпор после окончания гибернации (Darrow et al., 1987; Barnes et al., 1988). Интересными представляются данные по изучению влияния тестостерона на спячку у хомяка Брандта. У этих животных концентрация тестостерона начинает повышаться задолго до пробуждения и, вероятно, определяет продолжительность зимней спячки (Hall, Goldman, 1980). Гонадэктомированные хомяки проводили в спячке по 8‒9 месяцев, тогда как обычно она длится около 6 мес, и, напротив, импланты, содержащие тестостерон, вызывали досрочное пробуждение животных (Hall et al., 1982).
Сокращение продолжительности баутов гибернации и увеличение периода нормотермии (Rutovskaya et al., 2019) у ежей наблюдаются только в феврале. В этот период отмечено и начало повышения концентрации тироксина. Уровень тестостерона значительно повышается уже в январе. Вероятно, сокращение продолжительности баутов гибернации и увеличение периодов нормотермии определяются повышением концентрацией тироксина. Однако уменьшение длительности баутов гибернации и увеличение длительности нормотермии могут быть вызваны и дальнейшим увеличением концентрации тестостерона до эффективного уровня. Искусственное увеличение уровня тестостерона подавляет гибернацию у золотистых сусликов (Lee et al., 1990), хотя и не может полностью препятствовать их впадению в спячку.
Барнес с коллегами (Barnes et al., 1988) также отмечал, что рост концентрации тестостерона не коррелирует с ростом семенников после выхода из спячки, и поэтому тестостерон, видимо, играет основную роль в регуляции полового и агрессивного поведения. У некоторых видов, например у американского суслика (Spermophilus parryi) (Barnes, 1996) калифорнийского суслика (Spermophilus beecheyi) (Holekamp, Talamantes, 1992), садовой сони (Ambid, Berge, 1981), есть второй пик тестостерона в июле‒августе, что связывают с агрессивным поведением самцов во время расселения молодых особей (Barnes, 1996; Holekamp, Talamantes, 1992). У ежей повторного пика концентрации тестостерона в конце лета не отмечено, как и у некоторых грызунов, например у суслика каскадных гор (Spermophilus saturates) (Barnes, 1996), суслика Уинта (LeGrande et al., 1983), что возможно связано с особенностями их социальной структуры. Так, у ежей распадение выводка происходит практически сразу после окончания молочного вскармливания и это не сопровождается демонстрацией агрессивного поведения молодых ежей (Morris, 1997; Reeve, 1994). У летучих мышей пик уровня тестостерона приходится на август перед началом спячки, но у них это связано, по-видимому, с подготовкой к спариванию во время спячки (Gustafson, Shemesh, 1976).
Динамика концентрации тироксина у самцов белогрудых ежей схожа с таковой у европейского ежа (Fowler, 1988). Повышение уровня тироксина начинается с конца февраля, примерно за месяц до выхода ежей из спячки, однако пик концентрации гормона мы отмечаем в мае‒июле, когда основное время гона проходит и у самцов начинается период нажировки. Ежегодные циклы изменения концентрации тироксина в плазме крови европейских ежей были сходными в Шотландии и на юге Франции (Saboureau, Boissin, 1978), хотя и разными по длительности (на севере ‒ с сентября по январь, на юге ‒ с октября по январь). Однако важно, что на обеих широтах концентрации тестостерона и тироксина в плазме крови ежей положительно коррелировали. Положительная корреляция концентрации в крови тестостерона и тироксина на протяжении всего годового цикла была выявлена и у сони полчка (Jallageas, Assenmacher, 1983). Экспериментальные исследования групп тироидэктомированных животных и особей, получающих дополнительно тироксин, показали, что стимулирующее влияние щитовидной железы на уровень половых гормонов наблюдается не на всем протяжении годового цикла, а только в отдельные его периоды (Jallageas et al., 1992).
В отличие от тестостерона, высокий уровень которого отрицательно влияет на возможность ухода в спячку, уровень тироксина в крови ежей в период подготовки к спячке и во время самой спячки сохраняется на пониженном, но не нулевом уровне. Такая концентрация тироксина обеспечивает поддержание метаболизма гибернирующего животного. Относительно высокий уровень тироксина во время спячки также отмечен у суслика Ричардсона (Spermophilus richardsoni) (Demeneix, Henderson, 1978) и лесного сурка (Young et al., 1979). Возможно, и для ежей в это время тироксин особенно важен для регуляции температуры при периодическом пробуждении и возврате к нормотермии на короткий срок (Rutovskaya et al., 2019).
Интересно сопоставить динамику уровня исследованных гормонов с массой тела животных. Сразу после пробуждения, в период максимальных значений уровня тестостерона масса животных либо снижалась (февраль 2019 г.), либо оставалась примерно на одном уровне (6‒15 апреля 2018 г.). Животные быстро набирали массу при резком увеличении концентрации тироксина. В конце мая–начале июня, на фоне стабильного среднего уровня тироксина масса животных также стабилизировалась. С 10-х чисел июля, когда концентрация тестостерона резко снизилась до фоновых значений, а уровень тироксина вырос, животные снова начали набирать массу. С 15 августа на фоне постепенного снижения уровня тироксина масса тела ежей также снижалась, что наблюдали до середины октября, когда концентрация тироксина достигла своего минимального значения. В период глубокой спячки у ежей наблюдали минимальные потери массы тела на фоне низкого уровня тироксина. С начала февраля концентрация тироксина стала повышаться и одновременно увеличились потери массы тела ежей, что, вероятно, связано с увеличением уровня метаболизма. В марте при значительном увеличении уровня тироксина ежи стали набирать массу, вероятно, за счет стимуляции аппетита. Таким образом, в осенне-зимний период на фоне низкого уровня тироксина потеря массы тела минимальна, тогда как более высокие концентрации тироксина вызывают более быструю потерю массы. В этот период корреляция между концентрацией тироксина в сыворотке крови и потерей веса животных достоверна (r = 0.72, p = 0.005).
Динамика концентрации тироксина в некоторой степени повторяет изменения концентрации тестостерона, но с запаздыванием на 12‒24 дня. Корреляции между показателями тестостерона и сдвинутыми на 12 или 24 сут назад относительно него значениями концентрации тироксина достоверна (r = 0.36, p = 0.047 и r = 0.54, p = 0.002 соответственно). Через 2–3 нед после пробуждения в период резкого снижения уровня тестостерона наблюдается увеличение до максимальных значений концентрации тироксина. Также в июле сезонное резкое снижение уровня тестостерона в крови совпадает по времени с локальным максимумом концентрации тироксина. Оба этих момента являются ключевыми в сезонном половом цикле. Первый момент заключается в переходе от активного поиска полового партнера к активизации пищедобывательного поведения и умеренного набора веса после зимней спячки при поддержании репродуктивной способности. Второй момент – окончание репродуктивного сезона и переход к активному жироотложению. В эти периоды на фоне снижения концентрации тестостерона наблюдается повышение уровня гормонов щитовидной железы. Такие врéменные реципрокные взаимоотношения между тестостероном и тироксином нами отмечены благодаря частому (1 раз в течение 12 сут) взятию образцов крови.
Гормоны щитовидной железы играют решающую роль в координации сезонных состояний. У скворцов Sturnus vulgaris и овец Ovis aries увеличение фотопериода вызывает увеличение гонад, но длинный фотопериод вызывает окончание размножения. Однако удаление щитовидной железы предотвращает прекращение размножения, определяемое длинным фотопериодом (Wieselthier, Van Tienhoven, 1972; Dardente, 2012). На джунгарских (сибирских) хомячках Phodopus sungorus было показано, что помещенные в срединно-базальный гипоталамус микроимпланты, выделяющие Т3 (трийодтиронин), препятствуют инактивации гонадотропной функции, обусловленной коротким фотопериодом (Barrett et al., 2007). Импланты Т3 также вызывают отсутствие таких феноменов, как: сезонное снижение аппетита, потеря веса и способность впадать в торпор (Murphy et al., 2012). Даже у не сезонных животных – крыс Rattus norvegicus – инъекции Т3 в область срединно-базального гипоталамуса стимулируют аппетит (прием пищи) и вызывают увеличение веса (Kong et al., 2004). Нужно отметить, что ежедневные подкожные инъекции Т3 хомячкам, подвергшимся воздействию короткого фотопериода, приводят к отмене эффектов действия короткого фотопериода (снижение аппетита, потеря веса и способность впадать в торпор) (Freeman et al., 2007). У птиц введение больших доз тироксина вызывает преждевременное прекращение размножения и начало послебрачной линьки (Дольник и др., 1982). Большинство эндокринных систем свертываются перед спячкой, а нормально функционировать начинают перед окончанием спячки. Но те гибернаторы, у которых повышена активность эндокринных систем, особенно щитовидной железы, либо не уходят в спячку, либо спячка у них становится короче (Popovic, 1960).
Регуляцию сезонных изменений концентраций гормонов многие авторы традиционно связывают с сезонным изменением фотопериода (Saboureau, 1981). Омари с коллегами (Omari et al., 1989) отмечал, что у ежей концентрация лютеинизирующего гормона (ЛГ) повышается с декабря по февраль, следуя параллельно с увеличением уровня тестостерона. Резкое снижение концентрации ЛГ наблюдается в августе. Учитывая, что в период спячки у ежей нет световых ориентиров времени года, возможно, реактивация гонад у ежей происходит через определенное время после резкого снижения концентрации тестостерона в июле‒августе, а основным синхронизатором годового цикла является снижение продолжительности фотопериода. Однако у зимоспящих млекопитающих выявлен эндогенный годовой цикл потребления пищи, массы тела и обмена веществ, который проявляется при постоянном фотопериоде и стабильной температуре среды (Davis, 1976; Ward, Armitage, 1981). Таким образом, сезонный цикл ЛГ у ежа может быть эндогенным и может регулироваться внешними (например, фотопериодом, температурой) факторами. Чтобы установить, так ли это, необходимо проведение экспериментов по определению влияния фотопериода на продолжительность репродуктивного периода ежей и выявлению связи времени реактивации гонад в зависимости от момента их инактивации.
Таким образом, тиреоидные гормоны интегрируют и координируют сезонные физиологические изменения, в том числе прекращение размножения и адаптивное накопление жировых запасов, что подтверждают и наши данные. Выявленные в настоящей работе закономерности показывают, что сезонные репродуктивные, поведенческие и метаболические программы у ежей, также как у других млекопитающих, впадающих в спячку, скоординированы, а тиреоидные гормоны играют ключевую роль в их контроле (Hanon et al., 2009; Dardente et al., 2014). Динамика уровня исследуемых гормонов у европейского и белогрудого ежей сходна, что, видимо, допускает межвидовую гибридизацию.
Список литературы
Андрейчев А.В., Кузнецов В.А., Лапшин А.С., 2010. Еж белогрудый в фауне млекопитающих Мордовии // Фундаментальные науки и практика. Т. 1. № 3. Сборник научных работ с материалами трудов 2-й международной телеконференции. Томск. С. 55.
Банникова А.А., Лебедев В.С., Рутовская М.В., Хляп Л.А., Рожнов В.В., 2010. Генетическая идентификация и гибридизация обыкновенных ежей Центральной России // Целостность вида у млекопитающих: изолирующие барьеры и гибридизация. Материалы конференции 12-17 мая 2010 г. Петергоф. С. 9.
Банникова А.А., Крамеров Д.А., Василенко В.Н., Дзуев Р.И., Долгов В.А., 2003. Полиморфизм ДНК ежей рода Erinaceus и политипичность таксона E. concolor (Insectivora, Erinaceidae) // Зоологический журнал. Т. 82. № 1. С. 1‒11.
Берлизов А.В., Рутовская М.В., Рожнов В.В., 2008. Социальное поведение самцов белогрудого ежа в экспериментальных условиях // Молодежная конференция “Актуальные проблемы экологии и эволюции в исследованиях молодых ученых”. М.: Товарищество научных изданий КМК. С. 54‒60.
Гуреев А.А., 1979. Фауна СССР. Млекопитающие. Т. 4. Вып. 2. Насекомоядные. Труды ЗИН АН СССР. Л.: Наука. 502 с.
Диатроптов М.Е., Макарова О.В., Диатроптова М.А., 2014. Закономерности инфрадианных биоритмов митотической активности эпителия пищевода у японских перепелов (Coturnix japonica) и крыс Вистар // Геофизические процессы и биосфера. Т. 13. № 4. С. 82‒96.
Дольник В.Р., Виноградова Н.В., Гаврилов В.М., Ильина Т.А., Люлеева Д.С. и др., 1982. Популяционная экология зяблика. Л.: Наука. 301 с.
Калабухов Н.И., 1985. Спячка млекопитающих. М.: Наука. 264 с.
Карасева Е.В., Готфрид А.Б., Дубинина Н.В., 1979. Образ жизни обыкновенных ежей (Erinaceus europaeus) и их роль в природном очаге лептоспироза в Ярославской области (по наблюдениям за мечеными особями) // Зоологический журнал. Т. 58. № 5. С. 705–715.
Кучерук В.В., Карасева Е.В., 1980. Ежи // Итоги мечения млекопитающих. М.: Наука. С. 47–57.
Лозан А.М., 1978. Территориальное агрессивное поведение ежа (Erinaceus europaeus L.) //Фауна, экология и физиология животных. Кишинев. С. 46–53.
Огнев С.И., 1928. Звери Восточной Европы и Северной Азии. Т. 1 Насекомоядные и Летучие мыши. М.-Л.: Госиздат. 631 с.
Петровский Д.В., Новиков Е.А., Мошкин М.П., 2008. Динамика температуры тела обыкновенной слепушонки (Ellobius talpinus, Rodentia, Cricetidae) в зимний период // Зоологический журнал. Т. 87. № 12. С. 1504–1508.
Темботова Ф.А., 1997. Ежи Кавказа. Нальчик: Изд-во КБНЦ РАН. 80 с.
Allanson M., 1934. The reproductive processes of certain Mammals. Vll-Seasonal variation in the reproductive organs of the male hedgehog // Philosophical Transactions of the Royal Society, London. V. 223. P. 277–303.
Ambid L., Berges R., 1981. Seasonal rhythm in plasma testosterone levels and gonadal activity in the hibernating garden dormouse // Cryobiology. V. 18. P. 88–89.
Barnes B.M., 1996. Relationships between hibernation and reproduction in male ground squirrels // In: Adaptations to the cold: tenth international hibernation symposium. F. Geiser, A.J. Hulbert and S.C. Nicol, eds]. Armidale: University of New England Press. P. 71–80.
Barnes B.M., Kretzmann M., Zucker I., Licht P., 1988. Plasma androgen and gonadotropin levels during hibernation and testicular maturation in Golden-mantled ground squirrels // Biology of Reproduction. V. 38. P. 616–622.
Barrett P., Ebling F.J., Schuhler S., Wilson D., Ross A.W., Warner A., et al., 2007. Hypothalamic thyroid hormone catabolism acts as a gatekeeper for the seasonal control of body weight and reproduction // Endocrinology. V. 148. P. 3608–3617. https://doi.org/10.1210/en.2007-0316
Bogdanov A.S., Bannikova A.A., Pirusskii Yu.M., Formozov N.A., 2009. The first genetic evidence of hybridization between west european and northern white-breasted hedgehogs (Erinaceus europaeus and E. roumanicus) in Moscow Region // Biology Bulletin. V. 36. № 6. P. 647–651.
Bolfıkova B., Hulva P., 2012. Microevolution of sympatry: landscape genetics of hedgehogs Erinaceus europaeus and E. roumanicus in Central Europe // Heredity. V. 108. P. 248–255.
Colf W.J., Aarde R.J., 1992. Seasonal changes in plasma testosterone levels in the male South African hedgehog (Atelerix frontalis) // South African Journal of Zoology. V. 27. № 1. P. 11–13.
Concannon P.W., Fullam L.A., Baldwin B.H., Tennant B.C., 1989. Effects of induction versus prevention of hibernation on reproduction in captive male and femal woodchucks (Marmota monax) // Biology of Reproduction. V. 41. P. 255–261.
Dardente H., 2012. Melatonin-dependent timing of seasonal reproduction by the pars tuberalis: pivotal roles for long daylengths and thyroid hormones // Journal of Neuroendocrinology. V. 24. P. 249–266. https://doi.org/10.1111/j.1365-2826.2011.02250.x
Dardente H., Hazlerigg D.G., Ebling F.J.P., 2014. Thyroid hormone and seasonal rhythmicity // Frontiers in Endocrinology. V. 5. 26 February 2014. https://doi.org/10.3389/fendo.2014.00019
Darrow J.M., Yogev L., Goldman B.D., 1987. Patterns of reproductive hormone secretion in hibernating Turkish hamsters // The American Journal of Physiology. V. 253. P. R329–336.
Davis D.E., 1976. Hibernation and circannual rhythms of food consumption in marmots and ground squirrels // The Quarterly Review of Biology. V. 51. № 4. P. 477–514. https://doi.org/10.1086/409594
Demeneix B.A., Henderson N.E, 1978. thyroxine metabolism in active and torpid ground squirrels, Spermophilus richardsoni // General and comparative endocrinology. V. 35. P. 86‒92.
Dutourné B., Saboureau M., 1983. An endocrine and histophysiology study of the testicular annual cycle in the hedgehog (Erinaceus europaeus L.) // General and comparative endocrinology. V. 50. P. 324‒332.
Ellis L.C., Palmer R.A., Balph D.F., 1983. The reproductive cycle of male Uinta ground squirrels: some anatomical and biochemical correlates // Comparative Biochemistry and Physiology. V. 74A. P. 239‒245.
Hanon E.A., Routledge K., Dardente H., Masson-Pe’vet M., Morgan P.J., Hazlerigg D.G., 2009. Effect of photoperiod on the thyroid-stimulating hormone neuroendocrine system in the european hamster (Cricetus cricetus) // Journal of Neuroendocrinology. V. 22. P. 51–55.
Hall V., Goldman B., 1980. Effects of gonadal steroid hormones on hibernation in the Turkish hamster (Mesocricetus brandti) // Journal of comparative physiology. V. 135 P. 107–114.
Hall V.D., Bartke A., Goldman B.D., 1982. Role of the testis in regulating the duration of hibernation in the turkish hamster, Mesocricetus brandti’ // Biology of reproduction. V. 27. P. 802‒810.
Holekamp K.E., Talamantes F., 1992. Seasonal fluctuations in hormones and behavior of freeliving male california ground squirrels (Spermophilus beecheyi) // Hormones and behavior. V. 26. P. 7–23.
Gustafson A.W., Shemesh M., 1976. Changes in plasma testosterone levels during the annual reproductive cycle of the hibernating bat, Myotis lucifugus lucifugus with a survey of plasma testosterone levels in adult male vertebrates // Biology of Reproduction. V. 15. P. 9–24.
Fowler P.A., 1988. Seasonal endocrine cycles in the European hedgehog, Erinaceus europaeus // Journal of Reproduction and Fertility. V. 84. P. 259–272.
Freeman D.A., Teubner B.J., Smith C.D., Prendergast B.J., 2007. Exogenous T3 mimics long day lengths in Siberian hamsters // The American Journal of Physiology – Regulatory, Integrative and Comparative Physiology. V. 292. P. 2368–2372. https://doi.org/10.1152/ajpregu.00713.2006
Jallageas M., Assenmacher I., 1983. Annual plasma testosterone and thyroxine cycles in relation to hibernation in the edible dormouse Glis glis // General and comparative endocrinology. V. 50. P. 452–462.
Jallageas M., Mas N., Gautron J-P., Saboureau M., Roussel J.-P., 1992. Seasonal changes in thyroid-gonadal interactions in the edible dormouse, Glis glis // Journal of Comparative Physiology B. V. 162. P. 153–158.
Kong W.M., Martin N.M., Smith K.L., Gardiner J.V., Connoley I.P., Stephens D.A, et al., 2004. Triiodothyronine stimulates food intake via the hypothalamic ventromedial nucleus independent of changes in energy expenditure // Endocrinology. V. 145. P. 5252–5258. https://doi.org/10.1210/en.2004-0545
Lee T.M., Pelz K., Licht P., Zucker I., 1990. Testosterone influences hibernation in Golden-mantled ground squirrels // The American Journal of Physiology. V. 259. P. 760–767.
LeGrande C.E., Palmer R.A., Balph D.F., 1983. The reproductive cycle of male uinta ground squirrels: some anatomical and biochemical correlates // Comparative Biochemistry and Physiology. V. 74A. № 2. P. 239–245.
Morris P.A., 1997. The Hedgehog. Mammals. Shire Natural History Series. P. 1–32.
Murphy M., Jethwa P.H., Warner A., Barrett P., Nilaweera K.N., Brameld J.M., et al., 2012. Effects of manipulating hypothalamic triiodothyronine concentrations on seasonal body weight and torpor cycles in Siberian hamsters // Endocrinology. V. 153. P. 101–112. https://doi.org/10.1210/en.2011-1249
Omari B. El., Lacroix A., Saboureau M., 1989. Daily and seasonal variations in plasma LH and testosterone concentrations in the adult male hedgehog (Erinaceus europaeus) // Journal of Reproduction and Fertility. V. 86. P. 145–155.
Popovic V., 1960. Endocrines in hibernation // Bull. Mus. comp. Zool. Harv. Univ. P. 124, 105–130.
Racey P.A., 1974. The reproductive cycle in male noctule bats, Nyctalus noctula // Journal of Reproduction and Fertility. V. 41. P. 169–182.
Reeve N.J., 1994. Hedgehogs. London: T. and A.D. Poyser. 313 p.
Rutovskaya M.V., Diatroptov M.E., Kuznetzova E.V., Anufriev A.I., Feoktistova N.Y., Surov A.V., 2019. The dynamics of body temperature of the eastern european hedgehog (Erinaceus roumanicus) during winter hibernation // Biology Bulletin. V. 46. № 9. P. 1136–1145.
Rutovskaya M.V., Kosyreva A.M., Diatroptov M.E., 2020. Ultradian and infradian rhythms in the dynamic of testosterone concentration in the serum of white-breasted hedgehog Erinaceus roumanicus // Scientific Reports. V. 10. № 1. P. 6334. https://doi.org/10.1038/s41598-020-63399-5
Saboureau M., 1981. Environmental factors and regulation of the annual testicular cycle in a breeding hibernating mammal: the hedgehog // In Photoperiodism and Reproduction in Vertebrates. Eds Ortavant R., Pelletier J. & Ravault J.P. Les colloques de n.N.R.A. INRA, Nouzilly. P. 319–337.
Saboureau M., Boissin J., 1978. Variations saisonnières de la testosteronemie et de la thyroxinemie chez le hérisson (Erinaceus europaeus L.) // Comptes rendus de l’Académie des Sciences. V. 286. P. 1479–1482.
Saboureau M., Castaing L., 1985. Hibernation and reproduction in the female hedgehog // In Endocrine Regulations as Adaptive Mechanisms to the Environment. Eds Assenmacher I. & Biossin J., CNRS, Paris. P. 191–208.
Saboureau M., Dutourné B., 1981. The reproductive cycle in the male hedgehog (Erinaceus europaeus L.): a study of endocrine and exocrine testicular functions // Reproduction Nutrition Development. V. 21. P. 109–126. https://doi.org/10.1051/rnd:19810110
Saboureau M., Peyre A., 1970. Le decalage des activités endocrine et spermatogenique du testicule au cours du réveil printanier chez le hérisson male // Comptes Rendus des Seances de la Societe de Biologie. V. 164. P. 2364–2367.
Saure L., 1969. Histological studies on the sexual cycle of the male hedgehog (Erinaceus europaeus L.) // Aquilo. Ser. Zool. V. 9. P. 1–43.
Scott I., D’Agostino G., Cernova T., Becker L., Giovinazzo L., 1981. Seasonal testosterone in the eastern chipmunk, Tamius striatus // Cryobiology. V. 18. P. 89.
Strauss A., Hoffmann I.E., Vielgrader H., Millesi E., 2008. Testis development and testosterone secretion in captive European ground squirrels before, during, and after hibernation // Acta Theriologica. V. 53. № 1. P. 47–56.
Ward J.M. Jr., Armitage K.B., 1981. Circannual rhythms of food consumption, body mass, and metabolism in yellow-bellied marmots // Comparative Biochemistry and Physiology. Part A: Physiology. V. 69. № 4. P. 621–626.
Wieselthier A.S., Van Tienhoven A., 1972. The effect of thyroidectomy on testicular size and on the photorefractory period in the starling (Sturnus vulgaris L.) // Journal of Experimental Zoology. V. 179. P. 331–338. https://doi.org/10.1002/jez.1401790306
Zolotareva K.I., Belokon M.M., Belokon Y.S., Rutovskaya M.V., Hlyap L.A., Starykov V.P., et al., 2021. Genetic diversity and structure of the hedgehogs Erinaceus europaeus and Erinaceus roumanicus: evidence for ongoing hybridization in Eastern Europe // Biological Journal of the Linnean Society. V. 132. P. 174‒195. https://doi.org/10.1093/biolinnean/blaa135
Young R.A., Danforth E., Vagenakis A.G., Krupp P.P., Frink R., Sims E.A.H., 1979. Seasonal variation and the influence of body temperature on plasma concentrations and binding of thyroxine and triiodothyronine in the woodchuck // Endocrinology. V. 104. № 4. P. 996–999.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал