Зоологический журнал, 2022, T. 101, № 3, стр. 262-274
Первые сведения о населении мезостигматических клещей (Parasitiformes, Mesostigmata) на берегах Восточного Причерноморья (полуостров Абрау, Краснодарский край)
М. С. Бизин a, *, О. Л. Макарова a, **
a Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: microtus@list.ru
** E-mail: ol_makarova@mail.ru
Поступила в редакцию 24.10.2021
После доработки 06.11.2021
Принята к публикации 06.11.2021
- EDN: WUHLPF
- DOI: 10.31857/S0044513422030047
Аннотация
Осенью 2019–2020 гг. в береговых биотопах полуострова Абрау (окрестности мыса Малый Утриш), Северо-Восточное Причерноморье, обнаружено 39 видов мезостигматических клещей, в том числе 4 вида – новые для фауны России, а три литоральных вида впервые найдены на побережье Черного моря. Наиболее разнообразно представлены семейства Laelapidae (7 видов), Halolaelapidae (4), Uropodidae (3), Ascidae (3), Phytoseiidae (3) и Pachylaelapidae (3). Преобладают виды с европейскими или западнопалеарктическими ареалами (46%). Большинство обнаруженных видов (54%) распространены в пределах температного или температно-субтропического пояса. Доля специализированных литоральных видов в фауне штормовых выбросов (81%) выше, чем в береговых грунтах (19%). Видовой состав литорального комплекса значительно отличается от такового на севере Европы (коэффициент Жаккара 11–18%), но сходен с составом комплексов, описанных с Балканского полуострова и из Крыма (43–55%). Среди изученных береговых местообитаний наиболее разнообразная группировка Mesostigmata заселяет грунты верхней супралиторали, где обитает не менее 28 видов. Наибольшая плотность мезостигматических клещей обнаружена в нижних слоях штормовых выбросов на глубине 10–20 см (1900–2200 экз./л), где температура достигала 39–41°С (при температуре воздуха 13–14°С). Вертикальное распределение массовых видов по профилю водорослевого вала соответствует их термопреферендуму.
Свободноживущие почвенные клещи доминируют в комплексе наземных членистоногих морских побережий (Halbert, 1920; Schuster, 1962, 1979; Pfingstl, 2017). Среди них наиболее разнообразны представители отряда Mesostigmata, которые заселяют широкий спектр приморских местообитаний, достигая особенно высокой плотности в скоплениях гниющих водорослей (Strenzke, 1962; Bellido, 1982; Авдонин, Петрова-Никитина, 1999; Авдонин, Стриганова, 2004; Макарова, Петрова-Никитина, 2008). Несмотря на повсеместную встречаемость на морских берегах, мезостигматические клещи литоральной зоны изучены недостаточно в целом и весьма неоднородно в региональном отношении (Prosheş, Marshall, 2001). Только для берегов морей Северной и Западной Европы опубликованы подробные списки видов, охарактеризована структура акароценозов и описаны особенности биологии массовых литоральных видов (Luxton, 1967; Pugh, King, 1985, 1988; Ernst et al., 1993; Salmane, Heldt, 2000 и др.).
Побережье Черного моря в этом отношении практически не изучено, так как имеющиеся сведения зачастую включают лишь отметки наиболее обычных и широко распространенных видов (Брегетова и др., 1977; Коюмджиева, 1982; Авдонин, Петрова-Никитина, 1999; Авдонин, Стриганова, 2004; Маслов, 2013), две работы посвящены описанию отдельных новых видов (Mašán et al., 2013; Trach, 2016), а результаты других исследований опубликованы лишь частично и практически недоступны для ознакомления (Воробьева, Кулакова, 1988; Авдонин, 1999). Таким образом, любые сведения о почвенных клещах черноморского побережья представляют большой интерес.
В конце сезонов 2019–2020 гг. мы провели количественные сборы мезостигматических клещей, населяющих скалисто-галечную литораль Черного моря в окрестностях мыса Малый Утриш (Краснодарский край). Экологические сведения о литоральных клещах Восточного Причерноморья до настоящего времени отсутствовали.
Цель данной работы – анализ фауны и характеристика структуры населения клещей подотряда Mesostigmata, населяющих берега Черного моря в окрестностях мыса Малый Утриш (п-ов Абрау).
МАТЕРИАЛ И МЕТОДИКА
Район сбора материала (рис. 1) расположен на северо-восточном побережье Черного моря (п-ов Абрау, 44°42′ с.ш., 37°27′ в.д.). Рельеф берега сильно расчленен: крутые обрывы чередуются с широкими галечными пляжами в устьях рек, встречаются небольшие псевдолиманы, отделенные от моря неширокими косами. Собственно берег моря практически лишен растительного покрова, встречаются только отдельные растения катрана приморского (Crambe maritima), полыни высокой (Artemisia abrotanum), ситников Жерара (Juncus gerardii) и морского (Ju. maritimus), осоки расставленной (Carex distans), астры солончаковой (Tripolium pannonicum), торичника морского (Spergularia marina).
К устьям рек и берегам псевдолиманов приурочены небольшие заросли тростника обыкновенного (Phragmites australis), астры (T. pannonicum) и ситника (Ju. gerardii). Почвенный покров развит слабо.
Климат п-ова Абрау соответствует средиземноморскому типу. Средняя температура самого теплого месяца (июль) 22–23°С, а самого холодного (январь) от –1.5 до –2.5°С. В течение года выпадает 724 мм осадков, большая часть – в период с ноября по март. Лето сухое и жаркое, с большим числом солнечных дней (Добровольский, Залогин, 1982; Леонтьева и др., 2015).
Отбор проб выполнен осенью (конец октября 2019 г. и начало ноября 2020 г.), когда на берегах наиболее обильны штормовые выбросы. Отсутствие настоящей приливно-отливной зоны на Черном море, гористый рельеф побережья, а также однотипность условий каменистого берега не позволили различить большое число местообитаний (табл. 1, рис. 2). На открытой супралиторали мы выделяем только две вертикальные зоны – нижнюю, в которой отсутствует почвенный покров, но имеются большие скопления гниющих морских водорослей (Cystoseira spp., Ulva spp., Zostera marina и др.), в которых и взяты послойно серии проб; и верхнюю, где имеется фрагментарный слаборазвитый почвенный покров. На верхней супралиторали пробы отбирали в скоплениях выброшенного штормами на берег плавника и в почве под отдельными растениями.
Таблица 1.
Характеристика обследованных местообитаний береговой зоны Черного моря в окрестностях мыса Малый Утриш (п-ов Абрау, Краснодарский край; октябрь 2019 и ноябрь 2020)
| Биотоп | Субстрат | Т, °С* | Координаты | Число проб | Доминирующие виды растений | |
|---|---|---|---|---|---|---|
| Нижняя супралитораль | Свежие выбросы водорослей | – | 44°41′40.8′′ с.ш., 37°28′56.5′′ в.д. | 5 | Cystoseira barbata, C. crinita |
|
| Гниющие водоросли | 0–5 см | 14.4–18.4 | 44°41′41.5′′ с.ш., 37°29′20.0′′ в.д. | 8 | ||
| 5–10 см | 20.4–21.1 | 8 | ||||
| 10–15 см | 21.0–38.8 | 8 | ||||
| 15–20 см | 33.7–41.4 | 8 | ||||
| Верхняя супралитораль | Грунт под отдельными растениями и плавником, мелкий плавник | – | 44°42′25.0′′ с.ш., 37°27′24.4′′ в.д. | 9 | Crambe maritima, Artemisia abrotanum, Cynodon dactylon, Astrodaucus orientalis, Poa spp. |
|
| Берег соленого озера | Почва в куртинах растений | – | 44°41′42.3′′ с.ш., 37°29′13.4′′ в.д. | 5 | Juncus gerardii | |
| – | 44°41′42.9′′ с.ш., 37°29′14.4′′ в.д. | 5 | Tripolium pannonicum | |||
| – | 44°41′42.9′′ с.ш., 37°29′04.0′′ в.д. | 5 | Phragmites australis | |||
Рис. 2.
Береговые местообитания в окрестностях мыса Малый Утриш (п-ов Абрау, Краснодарский край, октябрь 2019 и ноябрь 2020): a, b – общий вид побережья (I – нижняя супралитораль, II – верхняя супралитораль); c – скопление гниющих водорослей на нижней супралиторали; d–f – доминирующие виды растений на берегах соленого озера, соединяющегося с морем (d – куртина Phragmites australis, e – заросли Juncus gerardii, f – заросли Tripolium pannonicum).

В дополнение к местообитаниям открытой супралиторали обследовали ряд биотопов на берегу соленого озера (соединяется протокой с морем), в том числе: заросли тростника, ситника и морской астры.
Серии образцов, размером 5 × 5 × 5 см каждый, собирали с помощью почвенного ножа и рамки; повторность – 5–9 проб в серии. При этом в каждом слое водорослевого бурта с помощью термометра-щупа (Luazon LTR-05, Китай) измеряли температуру в трехкратной повторности. Пробы в гниющих водорослях взяты в октябре 2019 г., а пробы на верхней супралиторали и побережье озера – в начале ноября 2020 г. Выгонка микроартропод из образцов проведена в лабораторных условиях в Москве, с помощью эклекторов Тульгрена в 96% раствор этанола. Длительность экстракции 10 дней. Дополнительные освещение и подогрев не применялись.
Определение клещей выполняли в постоянных препаратах с жидкостью Фора–Берлезе. Всего идентифицировано 6126 экз. Mesostigmata. Плотность отдельных видов (табл. 3) пересчитана на 1 л в случае выбросов водорослей и на 1 дм2 – для почвенных проб.
РЕЗУЛЬТАТЫ
Всего в пробах из скоплений водорослей, почвы и штормового мусора обнаружено 39 видов гамазовых клещей, относящихся к 30 родам и 18 семействам (табл. 2). Среди них наиболее богаты видами семейства Laelapidae и Halolaelapidae, насчитывающие по 7 и 4 видов соответственно, а также Uropodidae, Ascidae, Phytoseiidae и Pachylaelapidae, к каждому из которых относятся по три вида.
Таблица 2.
Видовой состав мезостигматических клещей, отмеченных в береговых биотопах окрестностей мыса Малый Утриш (п-ов Абрау, Краснодарский край; октябрь 2019 и ноябрь 2020)
| Вид | Экологическая характеристика | Местообитания на морских побережьях | Ареал |
|---|---|---|---|
| сем. Urodinychidae | |||
| Dendrouropodapetiti Coineau et Travé 19641,2 | Л | В | Испания, Краснодарский край |
| сем. Nenteriidae | |||
| Nenteria sp. | ? | В | ? |
| сем. Uropodidae | |||
| Uropoda (Uropoda) mazsalakiae Kontschán 20051,2 | Л | В, Пл, Пч | Хорватия, Греция, Краснодарский край |
| U. (Phaulodinychus) mitis (Leonardi 1899) | Л | В, Пл, Пч | Е, Т-сТ |
| U. (Phaulodinychus) repleta Berlese 19031 | Л | В, Пч | E, Пз |
| сем. Zerconidae | |||
| Prozercon satapliae Petrova 1977 | Э | Пч | Малая Азия, Крым, Кавказ |
| Zercon sp. aff. hispanicus Sellnick 1968 | ? | Пч | ? |
| сем. Parasitidae | |||
| Pergamasus falculiger (Berlese 1906) | Лс | Пч | зП, Т |
| Phorytocarpais kempersi (Oudemans 1902) | Л | В, Пл, Пч | П, Пз |
| Vulgarogamasus hyalinus (Willmann 1949) | Лг, К | Пч | П, T |
| сем. Veigaiidae | |||
| Cyrthydrolaelaps incisus Evans 1955 | Л | В, Пч | E, T-сТ |
| сем. Rhodacaridae | |||
| Rhodacarus olgae Shcherbak 1975 | Лг | Пч | Одесская область, Днепропетровская область, Крым, Краснодарский край |
| сем. Digamasellidae | |||
| Dendrolaelaspis lobatus (Shcherbak et Cheleviev 1977) | К | Пл, Пч | Крым, Краснодарский край, Грузия, Казахстан |
| сем. Halolaelapidae | |||
| Halolaelaps (Halolaelaps) celticus Halbert 1915 | Л | В | E, Пз |
| H. (Halolaelaps) orientalis Ishikawa 1979 | Л | В | П, T |
| H. (Saprogamasellus) cf. similis Blaszak et Ehrnsberger 1993 | Л | В | Е, сТ |
| Leitneria pugio (Karg 1961) | Лг | Пч | зП, T-сТ |
| сем. Ascidae | |||
| Arctoseius cetratus Sellnick 1940 | Э | Пч | сК, Пз |
| Gamasellodes bicolor (Berlese 1918) | Э | Пч | П, Пз |
| Protogamasellus mica (Athias-Henriot 1961) | Лг | Пч | зП, Т-сТ |
| сем.Melicharidae | |||
| Proctolaelaps pygmaeus (Müller 1860) | Э | Пч | К, Пз |
| сем. Podocinidae | |||
| Podocinum pacificum Berlese 1895 | Лс | Пч | К, сТ-Тр |
| сем. Phytoseiidae | |||
| Neoseiulus cf. aurescens (Athias-Henriot 1961) | Лг | Пч | К, Пз |
| N. conterminus (Kolodochka 1990) 2 | Лг | Пч | Израиль, Саудовская Аравия, Краснодарский край, Узбекистан |
| Proprioseiopsis messor (Wainstein 1960) | Э | Пч | К, Пз |
| сем. Ameroseiidae | |||
| Ameroseius furcatus Karg 1971 | Э | Пч | E, T |
| сем. Macrochelidae | |||
| Macrochelesglaber (Müller 1860) | К | В, Пч | К, Пз |
| Macrocheles sp. aff. scutatus (Berlese 1904) | ? | Пч | Румыния, Турция, Краснодарский край |
| сем. Pachylaelapidae | |||
| Onchodellus euparadactylifer Mašán, Maslov et Khaustov 2013 | Л | В | Крым, Краснодарский край |
| O. karawaiewi (Berlese 1920) | Э | Пч | зП, T-сТ |
| Pachylaelaps littoralis Halbert 1915 | Э | Пч | зП, Т |
| сем. Eviphididae | |||
| Thinoseius spinosus (Willmann 1939) | Л | В, Пл, Пч | Г, Пз |
| сем. Laelapidae | |||
| Androlaelaps shealsi2 Costa 1968 | Лс | Пч | Израиль, Иран, Краснодарский край |
| Cosmolaelaps vacua (Michael 1891) | М, Лс | Пч | К, Пз |
| C. cf. lutegiensis (Shcherbak 1971) | Лс | Пч | Украина, Краснодарский край, Иран, Казахстан |
| Euandrolaelaps cf. karawaiewi (Berlese 1903) | М, Лг, Лс | Пч | зП, Пз |
| Gaeolaelaps aculeifer (Canestrini 1883) | Э | Пч, Пл | К, Пз |
| G. minor (Costa 1968) | Лс | Пч | Передняя Азия, Краснодарский Край |
| Laelaspis sp. | M? | Пч | ? |
Примечания. 1 – вид впервые найден на побережье Черного моря (для литоральных видов), 2 – вид впервые найден в России. “?” – сведения отсутствуют. Экологическая характеристика: Л – литоральный, Лс – лесной, Лг – луговой, К – компостный, М – мирмекофильный, Э – эврибионт. Местообитания на морских побережьях: В – выбросы водорослей, Пл – плавник и мелкий штормовой мусор, Пч – почва засоленных лугов. Ареал: Е – европейский, зП – западно-палеарктический, П – палеарктический, Г – голарктический, сК – семикосмополитный, К – космополитный, Пз – полизональный, Т – температный, сТ – субтропический, Тр – тропический. Экологические и географические характеристики даны, главным образом, по: Coineau, Travé, 1964; Athias-Henriot, 1967; Costa, 1968; Брегетова и др., 1977; Щербак, 1971, 1980; Колодочка, 1990, 2006; Karg, 1993; Blaszak, Ehrnsberger, 1993, 1998; Kontschán, 2005, 2013; Макарова, 2009, 2012; Хаустов и др., 2010; Маслов, 2013; Mašán et al., 2013; Sara et al., 2014; Mašán, 2017; Jocharchi, Trach, 2019.
Таблица 3.
Плотность населения мезостигматических клещей в береговых местообитаниях п-ова Абрау (окрестности мыса Малый Утриш; октябрь 2019 и ноябрь 2020)
| Вид | Нижняя супралитораль, экз./л | Верхняя супралитораль, грунт, экз./дм2 | Берег соленого озера, почва, экз./дм2 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| свежие выбросы водорослей | бурт гниющих водорослей, слои | Ph. australis | Ju. gerardii | T. pannonicum | |||||
| 0–5 см | 5–10 см | 10–15 см | 15–20 см | ||||||
| Uropoda mitis | 4.8 | 221.0 | 502.0 | 961.2 | 750.2 | 0.9 | − | − | − |
| Cyrthydrolaelaps incisus | 1.6 | 69.0 | 139.0 | 744.0 | 802.6 | 0.4 | 52.0 | 9.6 | − |
| Phorytocarpais kempersi | 1.6 | 33.0 | 143.0 | 224.0 | 157.4 | − | − | − | 0.8 |
| Halolaelaps celticus | 1.6 | 33.0 | 28.0 | 52.6 | 6.2 | 2.7 | − | − | − |
| Halolaelaps cf. similis | − | 62.0 | 95.0 | 36.6 | 5.4 | 0.4 | − | − | − |
| Uropoda mazsalakiae | − | 39.0 | 48.0 | 163.4 | 124.4 | 12.9 | − | − | − |
| Pachylaelaps littoralis | − | 1.0 | 1.0 | 4.6 | 8.8 | 0.4 | − | − | − |
| Dendrouropoda petiti | − | − | − | 2.2 | 8.8 | − | − | − | 0.8 |
| Halolaelaps orientalis | − | − | − | − | 1.8 | − | − | − | − |
| Onchodellus euparadactylifer | − | 5.0 | 11.0 | 9.2 | 32.8 | − | − | − | − |
| Macrocheles glaber | − | 2.0 | 14.0 | 13.8 | 0.8 | − | 2.0 | − | − |
| Macrocheles sp. aff. scutatus | − | − | − | − | − | − | − | − | 17.6 |
| Gaeolaelaps aculeifer | − | − | − | − | − | 7.6 | − | 0.8 | 25.6 |
| Thinoseius spinosus | − | − | − | − | − | 0.4 | − | − | − |
| Vulgarogamasus hyalinus | − | − | − | − | − | 16.9 | − | 3.2 | 144.0 |
| Dendrolaelaspis lobatus | − | − | − | − | − | 3.1 | − | − | − |
| Leitneria pugio | − | − | − | − | − | 9.8 | − | − | − |
| Prozercon satapliae | − | − | − | − | − | 0.4 | − | − | − |
| Nenteria sp. | − | − | − | − | − | 0.4 | − | − | − |
| Rhodacarus olgae | − | − | − | − | − | 2.7 | − | − | − |
| Euandrolaelaps cf. karawaiewi | − | − | − | − | − | 1.3 | − | − | − |
| Zercon sp. aff. hispanicus | − | − | − | − | − | 3.6 | − | − | − |
| Gamasellodes bicolor | − | − | − | − | − | 4.5 | − | − | − |
| Proprioseiopsis messor | − | − | − | − | − | 0.4 | − | − | − |
| Onchodellus karawaiewi | − | − | − | − | − | 0.9 | − | − | − |
| Pergamasus falculiger | − | − | − | − | − | 0.4 | − | − | − |
| Cosmolaelaps vacua | − | − | − | − | − | 2.3 | − | − | − |
| Laelaspis sp. | − | − | − | − | − | 1.3 | − | − | 6.4 |
| Podocinum pacificum | − | − | − | − | − | 0.9 | − | − | − |
| Gaeolaelaps minor | − | − | − | − | − | 0.9 | − | − | − |
| Arctoseius cetratus | − | − | − | − | − | 0.9 | − | − | − |
| Protogamasellus mica | − | − | − | − | − | 0.4 | − | − | − |
| Proctolaelaps pygmaeus | − | − | − | − | − | 0.4 | − | − | − |
| Androlaelaps shealsi | − | − | − | − | − | 0.4 | − | − | − |
| Neoseiulus conterminus | − | − | − | − | − | − | − | 18.4 | 44.8 |
| Uropoda repleta | − | − | − | − | − | − | − | 0.8 | 0.8 |
| Cosmolaelaps cf. lutegiensis | − | − | − | − | − | − | − | − | 21.6 |
| Neoseiulus cf. aurescens | − | − | − | − | − | − | − | − | 0.8 |
| Ameroseius furcatus | − | − | − | − | − | − | − | − | 0.8 |
| Число видов | 4 | 9 | 9 | 10 | 11 | 28 | 2 | 5 | 11 |
| Всего | 9.6 | 465.0 | 981.0 | 2211.6 | 1899.2 | 80.0 | 54.0 | 32.8 | 264.0 |
Среди выявленных видов четыре (Dendrouropoda petiti, Uropoda mazsalakiae, Neoseiulus conterminus, Androlalelaps shealsi) – новые для фауны России, три литоральных вида (D. petiti, U. mazsalakiae, Uropoda repleta) впервые найдены на побережье Черного моря.
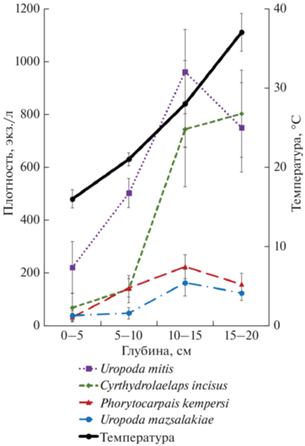
Распределение числа видов по отдельным биотопам неравномерно (табл. 3): оно минимально в скоплениях свежевыброшенных на берег водорослей и в зарослях тростника (4 и 2 вида соответственно), но достигает 28 видов в грунтах верхней супралиторали (большинство отмеченo только в этом биотопе). Собственно выбросы водорослей населяют 11 видов, из них 9 – встречаются во всей толще водорослевого бурта до глубины 20 см, а два вида – только в нижних слоях, где отмечена очень высокая температура (39–41°С, табл. 1).
Плотность населения клещей в почвенных местообитаниях колеблется в пределах от 32.8 (заросли ситника) до 264.0 экз./дм2 (под морской астрой). В прибрежных скоплениях водорослей обилие минимально в свежих выбросах (9.6 экз./л) и достигает значений 1899.2–2211.6 экз./л в нижних слоях водорослевой массы (табл. 3, рис. 3).
ОБСУЖДЕНИЕ
Географическая структура фауны
Опубликованные работы, содержащие списки гамазовых клещей из береговых биотопов Черного моря, не отличаются достаточной полнотой, поскольку были связаны с изучением отдельных субстратов. Так, с побережья Болгарии указаны 10 видов гамазид, которые населяют различные варианты штормовых выбросов (Коюмджиева, 1982). Это соответствует числу видов, которое мы отмечаем в гниющих водорослях на п-ове Абрау (11 видов). Воробьева и Кулакова (1988), изучавшие вблизи Севастополя население клещей песчаных пляжей различного гранулометрического состава на разных глубинах, также указывают 11 видов.
Единственный подробный список клещей с черноморской супралиторали, включающий обитателей и грунтов, и выбросов, приведен в дипломной работе В.В. Авдонина (кафедра энтомологии МГУ, 1999)11. В этом списке, опубликованном лишь частично, в виде тезисов (Авдонин, Петрова-Никитина, 1999), с побережья бухты Круглая (Севастопольский п-ов) приведены находки 27 видов мезостигматических клещей, которые относятся к 13 семействам, что сопоставимо с нашими данными. В то же время, для скалистой супралиторали Британских о-вов известно 24 вида Mesostigmata (Pugh, King, 1988, обобщенные данные по нескольким районам), для каменистой литорали Кельтского моря на востоке Ирландии – 27 видов (Halbert, 1920), с песчаных пляжей Прибалтики – 18–55 видов (Salmane, 2000, 2001; Salmane, Heldt, 2000), с каменисто-песчаного побережья Кольского залива – 32 вида (Makarova, Bizin, 2020), для литоральных биотопов различных районов Беломорья – 49–61 вид (Петрова-Никитина, Макарова, 2008; Makarova, Bizin, 2020). Различия в числе видов по регионам зачастую объясняются как разной степенью изученности фаун, так и различиями в методиках отбора проб. Тем не менее, в Субарктике и Арктике литоральный комплекс явно обеднен по сравнению с бореальным поясом (Makarova, Bizin, 2020; Бизин и др., 2021). Судя по материалам данной работы, а также данным Коюмджиевой (1982) и Авдонина (1999), локальные литоральные фауны южных морей также редуцированы по сравнению с таковыми в умеренных широтах. При более низких температурах валы штормовых выбросов разлагаются дольше и нередко являются постоянным элементом приморского ландшафта (Кузнецов, 1960), что позволяет проследить сукцессионные и сезонные смены их населения (Strenzke, 1962; Макарова, Петрова, 2008).
Все новые для фауны России виды (Dendrouropoda petiti, Uropoda mazsalakiae, Neoseiulus conterminus, Androlaelaps shealsi) до сих пор были известны из южных районов западной Палеарктики (табл. 2). Для субтропического Neoseiulus conterminus находка в Северо-Восточном Причерноморье – самая северная. Этот вид отмечался до сих пор на сельскохозяйственных полях и лугах в Узбекистане, Израиле и Саудовской Аравии (Колодочка, 1990; Palevsky et al., 2009; Negm et al., 2012).
Интересна находка в нашем материале Macrocheles sp. aff. scutatus. Экземпляры с очень сходной морфологией были отмечены в Турции (Özbek et al., 2015; приведен как M. scutatus) и Румынии (Călugăr, 2008; указан как предположительно новый для науки).
Набор наиболее разнообразных семейств (Laelapidae, Halolaelapidae, Uropodidae, Ascidae, Phytoseiidae, Pachylaelapidae) согласуется с установленной ранее схемой широтных изменений фауны свободноживущих Mesostigmata и, в целом, характерен для юга Западной Палеарктики (Макарова, 2009). Ареалогическая структура изученной фауны также отражает ее южно-европейское положение. Ареалы 46% видов ограничены Европой или Западной Палеарктикой. Большинство обнаруженных видов (54% от общего списка) обитают в умеренном и/или субтропическом поясе. Распространение целого ряда видов (26%) связано с областью Древнего Средиземноморья (Dendrouropoda petiti, Uropoda mazsalakiae Prozercon satapliae, Neoseiulus conterminus, Dendrolaelaspis lobatus, Halolaelaps cf. similis, Macrocheles sp. aff. scutatus, Onchodellus euparadactylifer, Androlaelaps shealsi, Gaeolaelaps minor). Широкораспространенные (семикосмополитные, голарктические и палеарктические) виды составляют всего 33% от общего списка видов, обнаруженных на побережье. Это заметно меньше, чем приводится для хорошо изученных арктических и бореальных фаун Палеарктики: 48% – на Северо-Восточном Алтае (Марченко, 2007), 48% – на побережье Кольского залива (Makarova, Bizin, 2020), 53% – в Гренландии (Макарова, 2014), 54% – в Европейской Арктике (Макарова, 2012).
Выявленный набор видов-талассобионтов сходен (коэффициент Жаккара порядка 43–55%) с литоральными комплексами, обнаруженными в других приморских районах Южной Европы: на Балканах (Коюмджиева, 1982; Kontschán, 2005, 2013) и в Крыму (Авдонин, 1999; Маслов, 2013; Mašán et al., 2013; Trach, 2016), но в то же время имеет лишь единичные общие виды со списками, приведенными для Северной Европы, например для Ирландии (Halbert, 1920) и Великобритании (Pugh, King, 1988) – значения коэффициента Жаккара 11 и 18% соответственно.
Экологическая структура фауны
Специализированные обитатели морских литоралей (талассобионты в терминологии Шустера (Schuster, 1979)) составляют около четверти видового списка (11 видов, табл. 2), причем их доля в фауне штормовых выбросов существенно выше (81%), чем в прибрежных грунтах (19%). Это, главным образом, уроподовые клещи (в том числе 3 вида рода Uropoda) и представители рода Halolaelaps (также 3 вида). Самостоятельность отмеченного в настоящей работе, а также известного из штормовых выбросов на побережье Крыма H. orientalis, судя по опубликованным данным (Маслов, 2013), требует дополнительного изучения.
Выявленная фауна включает комплексы собственно почвенных видов, тяготеющих к различным луговым местообитаниям (в т.ч. сельскохозяйственным полям) или к лесным биотопам; они насчитывают по 6 и 5 видов соответственно. Экологическое разнообразие изученной прибрежной группировки Mesostigmata подчеркивает также наличие нескольких характерных компостных (Vulgarogamasus hyalinus, Dendrolaelaspis lobatus, Macrocheles glaber) и мирмекофильных элементов (Cosmolaelaps vacua, Euandrolaelaps cf. karawaiewi, Laelaspis sp.).
Структура населения
Группировки мезостигматических клещей, которые населяют отдельные местообитания изученного участка побережья, различаются как по видовому богатству, так и по плотности населения (табл. 3). Наибольшее число видов отмечено на верхней супралиторали (28), что, вероятно, связано с бо́льшим числом обследованных субстратов (скопления плавника, растительная дернина, мелкозем между камнями) и с пограничным положением самого биотопа, что отражается в разнообразии представленных здесь экологических групп. В других исследованиях приморских акароценозов наибольшее видовое богатство также регистрировали в самой удаленной от уреза воды части берегового профиля, где влияние моря минимально (Luxton, 1967; Макарова, Петрова-Никитина, 2008; Weigmann, 2008; Рожнов и др., 2019; Makarova, Bizin, 2020; Бизин и др., 2021 и др.).
Структура акароценозов в скоплениях водорослей во многом зависит от их положения на профиле берега, степени разложения (времени экспозиции), а также расстояния до фоновых (не литоральных) биотопов (Evans et al., 1961; Strenzke, 1962; Pugh, King, 1988; Макарова, Петрова-Никитина, 2008). В тех случаях, когда выбросы лежали на растительной дернине приморских лугов или в верхней части берегового профиля на границе с лесом, их население было обогащено большим числом неспецифичных компостных и луговых видов или даже обитателями лесной подстилки (Макарова, Петрова-Никитина, 2008; Makarova, Bizin, 2020). На открытых берегах Черного моря травянистый растительный покров, если он имеется, сильно разрежен, что определяет низкое разнообразие и высокую специализацию группировок мезостигматических клещей. Как и в нашей работе, предшествующие исследователи отмечали размножение в выбросах 10–11 видов, преимущественно талассобионтов (Коюмджиева, 1982; Авдонин, 1999).
Наличие большой массы штормовых выбросов позволило изучить особенности вертикального распределения клещей в толще гниющего бурта (табл. 3). Доминантный комплекс образуют 6 видов (Uropoda mitis, U. mazsalakiae, Cyrthydrolaelaps incisus, Phorythocarpais kempersi, Halolaelaps celticus, H. cf. similis), у большинства из которых отсутствует строгая трофическая специализация (Schuster, 1962; Pugh, King, 1985; Авдонин, 2002). Считается, что частичная пространственная сегрегация клещей в массе гниющих водорослей (рис. 3) происходит из-за видовых различий в тепловой резистентности (Авдонин, Стриганова, 2004). В начале ноября температура в нижней части водорослевой массы может достигать в отдельных локусах 43°С при дневной температуре окружающего воздуха 13–14°С (собственные данные). Uropoda mitis и Cyrthydrolaelaps incisus имеют самые высокие значения термопреферендума, которые превышают 40°С для обоих видов (Авдонин, Стриганова, 2004), что, вероятно, и позволяет им достигать очень высокой плотности в нижней части профиля (табл. 3).
В экспериментах клещи Phorythocarpais kempersi и Cyrthydrolaelaps incisus демонстрировали сходное трофическое поведение (Авдонин, 1999, 2002), однако последний, обладая большей устойчивостью к высокой температуре (и меньшими размерами), по-видимому, избегает прямой конкуренции с Ph. kempersi, активно заселяя более прогретые нижние слои водорослевого бурта (рис. 3).
Заросли разных видов растений на берегу соединенного с морем соленого озера не образуют последовательно сменяющих друг друга зон, но располагаются на разном расстоянии от уреза воды в порядке: тростник – ситник – астра. В сырых плотных почвах тростниковых зарослей отмечены всего два вида гамазид – Cyrthydrolaelaps incisus и Macrocheles glaber с низкой плотностью (54.0 экз./дм2). Население этого местообитания представляет собой “остатки” комплекса обитателей штормовых выбросов и не включает собственно почвенных видов. Это явно контрастирует с результатами детального изучения акароценозов пресноводных тростниковых зарослей в Словакии, в местах массового гнездования околоводных птиц, где обнаружено очень высокое разнообразие Mesostigmata (Fenďa, Schniererová, 2004, 2005).
Комплекс мезостигматических клещей под ситником отличается минимальной плотностью (32.8 экз./дм2). Помимо малочисленных обитателей морских выбросов (Cyrthydrolaelaps incisus и Uropoda repleta), в биотопе отмечен субтропический вид – Neoseiulus conterminus, характерный для широкого спектра луговых местообитаний (Колодочка, 1990; Negm et al., 2012).
Куртины морской астры образуют небольшой пояс в самой отдаленной от воды части берега, на границе с окружающим лесом. Сформированное здесь сообщество отличается относительно большим числом видов (11) и сравнительно высокой плотностью населения (264.0 экз./дм2). Участие в нем специализированных обитателей побережья невелико (3 вида). В доминантном комплексе преобладают луговые и лесные виды (Vulgarogamasus hyalinus, Neoseiulus conterminus, Cosmolaelaps cf. lutegiensis).
ЗАКЛЮЧЕНИЕ
Выявленный комплекс гамазовых клещей, обитающих на каменистой супралиторали и прилежащем соленом лугу в окрестностях мыса Малый Утриш (п-ов Абрау), включает ряд новых находок для России и черноморского побережья, что подчеркивает слабую изученность территории в целом. В составе фауны имеется значительное число видов, основной ареал которых расположен в пределах области Древнего Средиземноморья, а для некоторых субтропических элементов настоящая отметка, по всей видимости, может считаться наиболее северной из известных. Состав видов-талассобионтов п-ова Абрау обнаруживает высокое сходство с литоральными комплексами, выявленными в других районах черноморского побережья (Балканы и Крым).
Структура населения Mesostigmata в морских выбросах, грунтах супралиторали и почвах засоленных лугов принципиально различна как в таксономическом, так и в экологическом отношении. Таксоцен клещей в морских выбросах практически полностью состоит из специализированных талассобионтов и характеризуется очень высокой плотностью. Распределение массовых видов по профилю водорослевого бурта, вероятно, связано с различиями их термопреферендумов, что согласуется с высказанной ранее гипотезой о “температурном механизме” разделения ниш у клещей морских выбросов (Авдонин, Стриганова, 2004).
Список литературы
Авдонин В.В., 2002. Трофические предпочтения литоральных гамазид (Acarina, Mesostigmata) // Проблемы почвенной зоологии: Биоразнообразие и жизнь почв. системы: Материалы 3-го (13-го) Всероссийского совещания по почвенной зоологии. Йошкар-Ола, 1–5.8.2002. М.: Товарищество научных изданий КМК. С. 6–7.
Авдонин В.В., Петрова-Никитина А.Д., 1999. Таксономический состав, пространственное распределение и трофические отношения клещей (Acariformes, Parasitiformes) на каменистой супралиторали Черного моря // Проблемы почвенной зоологии: Биоразнообразие и жизнь почв. системы: Материалы 2-го (12-го) Всероссийского совещания по почвенной зоологии (Москва, 1999). М.: Товарищество научных изданий КМК. С. 11–12.
Авдонин В.В., Стриганова Б.Р., 2004. Температура как фактор разделения ниш свободноживущих мезостигматических клещей (Mesostigmata, Parasitiformes) штормовых выбросов // Известия РАН. Серия биологическая. № 5. С. 589–596.
Бизин М.С., Борисенко Г.В., Макарова О.Л., 2021. Роль факторов среды в формировании населения почвенных клещей (Acari) на береговых маршах о. Шокальского, Карское море // Сибирский экологический журнал. Т. 28. № 2. С. 144–161.
Брегетова Н.Г., Вайнштейн Б.А., Кадите Б.А., Королева Е.В., Петрова А.Д. и др., 1977. Определитель обитающих в почве клещей Mesostigmata. Л.: Наука. 718 с.
Воробьева Л.В., Кулакова И.И., 1988. Пространственное распределение Acarina в интерстициали песчаных пляжей. Одесса: Ин-т биологии южных морей им. А.О. Ковалевского АН УССР. 24 с.
Добровольский А.Д., Залогин Б.С., 1982. Моря СССР. М.: Изд-во МГУ. 192 с.
Колодочка Л.А., 1990. Три новых вида клещей семейства Phytoseiidae (Parasitiformes) // Новости фаунистики и систематики. Киев: Наукова думка. С. 158–163.
Колодочка Л.А., 2006. Клещи-фитосейиды Палеарктики (Parasitiformes, Phytoseiidae): фаунистика, систематика, экоморфология, эволюция // Вестник зоологии. Вып. 21 (отд.). 250 с.
Коюмджиева М.И., 1982. Гамазови кърлежи (Gamasoidea, Parasitiformes) в изхвърлен от морето детрит по Българското Черноморско крайбрежие // Acta Zoologica Bulgarica. V. 20. P. 77–80.
Кузнецов В.В., 1960. Белое море и биологические особенности его флоры и фауны. М.-Л.: Издательство АН СССР. 322 с.
Леонтьева О.А., Суслова Е.Г., Кожин М.Н., Гонгальский К.Б., Кадетов Н.Г. и др., 2015. Летняя практика по биогеографии на Западном Кавказе: учебное пособие. М.: Географический факультет МГУ. 227 с.
Макарова О.Л., 2009. Фауна свободноживущих гамазовых клещей (Parasitiformes, Mesostigmata) северной тайги: анализ зональной специфики // Зоологический журнал. Т. 88. № 9. С. 1039–1054.
Макарова О.Л., 2012. Гамазовые клещи (Parasitiformes, Mesostigmata) европейской Арктики и их ареалы // Зоологический журнал. Т. 91. № 8. С. 907–927.
Макарова О.Л., 2014. Фауна свободноживущих клещей (Acari) Гренландии // Зоологический журнал. Т. 93. № 12. С. 1404–1427.
Макарова О.Л., Петрова-Никитина А.Д., 2008. Сукцессии гамазовых клещей (Parasiriformes, Mesostigmata) в штормовых выбросах на литорали Белого моря (пролив Великая Салма) // Материалы научной конференции, посвященной 70-летию Беломорской биологической станции им. Н.А. Перцова. 9–10 августа 2008 года. М.: Гриф и К. С. 75–79.
Маслов С.И., 2013. Клещи рода Halolaelaps (Acari: Mesostigmata: Halolaelapidae), обитающие в морских штормовых выбросах на природоохранных территориях Крыма // Материалы международной научной конференции “40 лет природному заповеднику “Мыс Мартьян”. 14–17 мая 2013 года. Ялта. С. 136.
Марченко И.И., 2007. Гамазовые клещи (Parasitiformes, Mesostigmata) Алтайского государственного природного заповедника // Евразиатский энтомологический журнал. Т. 6. № 4. С. 373–378.
Петрова-Никитина А.Д., Макарова О.Л., 2008. Отряд Parasitiformes Zachvatkin 1952 // Каталог биоты Беломорской биологической станции МГУ. Ред. Чесунов А.В., Калякина Н.М., Бубнова Е.Н. М.: Товарищество научных изданий КМК. С. 324–327.
Рожнов В.В., Лавриненко И.А., Разживин В.Ю., Макарова О.Л., Лавриненко О.В. и др., 2019. Ревизия биоразнообразия крупного арктического региона как основа его мониторинга и охраны в условиях активного хозяйственного освоения (Ненецкий автономный округ, Россия) // Nature Conservation Research. Заповедная наука. Т. 4. № 2. С. 1–28.
Хаустов А.А., Сергеенко А.Л., Кузнецов Н.Н., 2010. Состояние изученности акарофауны заповедника “Мыс Мартьян” // Научные записки природного заповедника “Мыс Мартьян”. Вып. 1. С. 165–170.
Щербак Г.И., 1971. Новые вид гамазид рода гипоаспис – Hypoaspis Canestrini (Acarina, Gamasoidea) // Вестник зоологии. Вып. 5. С. 76–79.
Щербак Г.И., 1980. Клещи семейства Rhodacaridae Палеарктики. Киев: Наукова думка. 216 с.
Athias-Henriot C., 1967. Observations sur les Pergamasus. I. Sous-genre Paragamasus Hull, 1918 (Acariens Anactinotriches: Parasitidae) // Mémoires du Muséum national d’Histoire naturelle: Nouvelle série. Série A, Zoologie, t. XLIX. Paris: Editions du Museum. 198 S.
Bellido A., 1982. Les biocenoses du littoral rocheux aux iles Kerguelen // Colloque sur les Ecosystѐmes Subantarctiques. V. 51. P. 81–92.
Błaszak C., Ehrnsberger R., 1993. Beiträge zur Kenntnis von Halolaelaps (Saprogamasellus) Götz, 1952 (Acari: Gamasida: Halolaelapidae) // Genus. V. 4. Fasc. 3. P. 143–267.
Błaszak C., Ehrnsberger R., 1998. Beiträge zur Kenntnis von Halolaelaps (Halolaelaps s. str.), (Acari: Gamasida: Halolaelapidae) // Osnabrücker Naturwissenschaftliche Mitteilungen. V. 24. P. 159–181.
Călugăr A., 2008. New and rare species of mites (Acari: Gamasina) from some forest ecosystems of the Danube delta biosphere reserve // Integrative Acarology. Proceedings of the 6th European Congress. Bertrand M., Kreiter S., McCoy K.D., Migeon A., Navajas M., Tixier M-S., Vial L. (Eds) Montpellier: European Association of Acarolgists. P. 167–174.
Coineau Y., Travé J., 1964. Dendrouropoda petiti sp. n. (Acariens, Mésostigmates), espèce nouvelle du littoral Catalan // Vie et Milieu. V. 17. P. 345–354.
Costa M., 1968. Little known and new litter-inhabiting laelapine mites (Acari, Mesostigmata) from Israel // Israel Journal of Zoology. V. 17. P. 1–30.
Ernst H., Siemer F., Backing J., Witte H., 1993. Die litorale Milbenzönose auf Uferbefestigungen des Weserästuars in Abhängigkeit von Substrat und Salzgehaltsgradient // Informationen zu Naturschutz und Landschaftspflege in Nordwestdeutschland. V. 6. P. 401–416.
Evans G.O., Sheals J.G., Macfarlane D., 1961. The terrestrial Acari of the British Isles. An introduction to their morphology, biology and classification. I. Introduction and biology. London: British Museum (Natural History). 219 p.
Fenďa P., Schniererová E., 2004. Mites (Acarina: Mesostigmata) in the nests of Acrocephalus spp. and in neighboring reeds // Biologia. V. 59 (suppl. 15). P. 41–47.
Fenďa P., Schniererová E., 2005. Mites (Acarina, Gamasida) in littoral zone of Jakubov fishponds (Slovakia) // Contributions to Soil Zoology in Central Europe I. Tajovský K., Schlaghamerský J., Pižl V. (Eds) České Budějovice: Institute of Soil Biology Academy of Sciences of the Czech Republic. P. 11–14.
Halbert J.N., 1920. The Acarina of the seashore // Proceedings of the Royal Irish Academy. V. 35B. P. 106–149.
Jocharchi O., Trach V.A., 2019. A new species of Cosmolaelaps Berlese (Acari: Laelapidae) from Ukraine // Zootaxa. V. 4647. № 1. P. 486–494.
Karg W., 1993. Acari (Acarina), Milben. Parasitiformes (Anactinochaeta). Cohors Gamasina Leach. Raubmilben (2nd edn.). Die Tierwelt Deutschlands. 59. Jena–Stuttgart–New York: Gustav Fisher Verlag. 523 p.
Kontschán J., 2005. On some little known and new Uropodina species (Acari, Mesostigmata) from Croatia, Serbia-Montenegro, Slovenia and Macedonia // Acta Zoologica Bulgarica. V. 57. № 2. P. 153–160.
Kontschán J., 2013. Uropodina mites of the Balkan Peninsula (Acari: Mesostigmata) // Opuscula Zoologica (Budapest). V. 44. № 1. P. 97–131.
Luxton M., 1967. The ecology of saltmarsh Acarina // Journal of Animal Ecology. V. 36. № 2. P. 257–277.
Makarova O.L., Bizin M.S., 2020. Littoral mesostigmatic mites (Acari, Parasitiformes) from the Kola Peninsula // Polar Biology. V. 43. P. 1503–1518.
Mašán P., 2017. A revision of the family Ameroseiidae (Acari, Mesostigmata), with some data on Slovak fauna // ZooKeys. V. 704. P. 1–228.
Mašán P., Maslov S.I., Khaustov A.A., 2013. A new species of the genus Onchodellus (Acari: Mesostigmata: Pachylaelapidae) from Crimea, Ukraine // Acarina. V. 21. № 2. P. 96–99.
Negm M.W., Alatawi F., Aldryhim Y.N., 2012. A new species of Neoseiulus Hughes, with records of seven species of predatory mites associated with date palm in Saudi Arabia (Acari: Phytoseiidae) // Zootaxa. V. 3356. P. 57–64.
Özbeck H.H., Bal D., Doğan S., 2015. The genus Macrocheles Latreille (Acari: Mesostigmata: Macrochelidae) from Kelkit Valley (Turkey), with three newly recorded mite species // Turkish Journal of Zoology. V. 39. P. 1–13.
Palevsky E., Gal S., Ueckermann E.A., 2009. Phytoseiidae from date palms in Israel with descriptions of two new taxa and a key to the species found on date palms world-wide (Acari: Mesostigmata) // Journal of Natural History. V. 43. P. 1715–1747.
Pfingstl T., 2017. The marine-associated lifestyle of ameronothroid mites (Acari, Oribatida) and its evolutionary origin: a review // Acarologia. V. 57. № 3. P. 693–721.
Prosheş Ş., Marshall D.J., 2001. Global distribution patterns of non-halacarid marine intertidal mites: Implications for their origins in marine habitats // Journal of Biogeography. V. 28. № 1. P. 47–58.
Pugh P.J.A., King P.E., 1985. Feeding in intertidal Acari // Journal of Experimental Marine Biology and Ecology. V. 94. P. 269–280.
Pugh P.J.A., King P.E., 1988. Acari of the British supralittoral // Journal of Natural History. V. 22. № 1. P. 107–122.
Salmane I., 2000. Fauna of soil-dwelling predatory Gamasina mites (Acari, Mesostigmata) in seashore habitats of the Kurzeme coast, Latvia // Ekológia (Bratislava). V. 19. Suppl. 4. P. 87–96.
Salmane I., 2001. Fauna of soil Gamasina mites (Acari, Mesostigmata) along the Latvian seacost and the relation to respective habitats // Norwegian Journal of Entomology. V. 48. P. 223–230.
Salmane I., Heldt S., 2000. Predatory soil mites (Acari, Mesostigmata, Gamasina) from the Western Baltic coast of Latvia // Acarologia. V. 41. № 3. P. 295–301.
Sara R., Hajizadeh J., Joharchi O., 2014. Two new species of Cosmolaelaps Berlese (Acari: Laelapidae) from Iran // Zootaxa. V. 3847. № 4. P. 533–544.
Schuster R., 1962. Das marine Litoral als Lebensraum terrestrischer Kleinarthropoden // Internationale Revue der Gesamten Hydrobiologie. V. 47. № 3. 359–412.
Schuster R., 1979. Soil mites in the marine environment // Recent Advances in Acarology. J.G. Rodriguez (Ed.). V. 1. New York: Academic Press. P. 593–602.
Strenzke K., 1962. Experimentell-biozönotische Untersuchungen über die Arthropoden-Sukzession des marinen Anwurfs // Zoologischer Anzeiger. V. 25. S. 446–455.
Trach V.A., 2016. New and little known species of Halolaelaps (Acari: Mesostigmata: Halolaelapidae) from Ukraine // Zootaxa. V. 4154. № 4. P. 436–452.
Weigmann G., 2008. Oribatid mite communities in Atlantic salt marshes: an ecological and biogeographical comparison between German and Portuguese seashores // Integrative Acarology. Proceedings of the 6th European Congress. Bertrand M., Kreiter S., McCoy K.D., Migeon A., Navajas M., Tixier M-S., Vial L. (Eds). Montpellier: European Association of Acarologists. P. 275–283.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал