Зоологический журнал, 2022, T. 101, № 3, стр. 275-293
Масштабирование органов чувств насекомых. 1. Введение. Сложные глаза
А. А. Макарова a, *, А. В. Дьякова a, С. Ю. Чайка a, А. А. Полилов a
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: amkrva@gmail.com
Поступила в редакцию 03.08.2020
После доработки 25.10.2021
Принята к публикации 26.10.2021
- EDN: KSKDVQ
- DOI: 10.31857/S0044513422030096
Аннотация
Размер тела – один из важных параметров, определяющих биологию, морфологию и физиологию животных. Несмотря на крайне малый размер тела, мельчайшие насекомые сохраняют общий план строения, функциональность и разнообразие органов чувств. Сложные глаза и сенсорные органы антенн являются основными органами чувств насекомых и исследованы у широкого круга объектов. При уменьшении размера тела наблюдается существенное уменьшение размера антенн и числа антеннальных сенсилл. Уменьшение размера сложных глаз сопровождается также рядом количественных и структурных изменений: сокращением числа и размеров омматидиев, сильной компактизацией клеточных элементов и целым рядом морфологических адаптаций, уникальных для разных групп насекомых. Данный обзор состоит из двух частей и включает не только систематизацию всей литературы по масштабированию органов чувств насекомых, но и анализ основных количественных данных по органам зрения и антеннальной сенсорной системе насекомых. Первая часть включает общую характеристику органов чувств и обзор влияния масштабирования на сложные глаза насекомых. На основании собранных данных о числе и размере фасеток сложных глаз 370 видов из 16 отрядов проведен аллометрический анализ. Установлено, что число омматидиев в сложном глазу положительно коррелирует с размером тела у насекомых и значительно уменьшается при уменьшении размеров тела. При сравнении этих параметров у крупных и мельчайших насекомых разброс величин составил три порядка. Линейные размерные характеристики омматидиев также коррелируют с размером тела, разброс значений составил один порядок. По всей видимости, сложность строения органов чувств ограничивает уменьшение размеров отдельных сенсорных единиц, вследствие чего оптимизация сенсорного аппарата насекомых происходит при миниатюризации в первую очередь за счет уменьшения числа структурных элементов.
Сенсорные структуры играют важную роль в жизни насекомых как единственный источник информации об окружающей среде, они поставляют информацию при поиске полового партнера, хозяина или пищевых ресурсов, обнаружении врагов, ориентации и навигации во время полета, внутривидовой коммуникации (Tibbetts, 2002; Guerenstein et al., 2004; Krishnan et al., 2012; Rossi, Romani, 2013; Stürzl et al., 2016 и др.). Органы чувств насекомых по физиологическим свойствам могут быть сравнимы с органами чувств позвоночных, вместе с тем состоят из значительно меньшего числа рецепторных клеток (Иванов, 2000). Компактность и дискретность органов чувств насекомых обеспечивают значительные преимущества для решения фундаментальных задач сенсорной физиологии и нейрофизиологии, и, вследствие этого представляют интерес для бионики. Органы чувств насекомых могут быть рассмотрены в следующих основных модальностях: зрение, обоняние, вкус, механорецепция, гигрорецепция и терморецепция. За некоторым исключением, сложными глазами обладают почти все насекомые (Meyer-Rochow, Nilsson, 1999), антенны же имеются у всех насекомых (кроме первичнобескрылых отряда Protura), и даже у пещерных и не имеющих органов зрения видов.
Изучение органов чувств членистоногих неотрывно связано с развитием микроскопии. В начале 20 века были получены первые данные о клеточном строении органов чувств насекомых (Заварзин, 1913, 1941; Snodgrass, 1926). Значительный вклад в изучение эволюции, рецепции, клеточного и субклеточного уровня организации внесли электронно-микроскопические исследования хеморецепторов и механорецепторов (Иванов, 1969, 1978, 2000; Елизаров, 1977, 1978; Жантиев, 1977), термо- и гигрорецепторов (Елизаров, 1977а), слуха (Жантиев, 1977а), зрения (Мазохин-Поршняков, 1965, 1980, 1983), выполненные отечественными учеными.
На сегодняшний день написано множество обзоров, посвященных эволюции, строению и функциональной организации органов чувств в целом (перечислены лишь некоторые из них) (Slifer, 1961; Bate, 1978; Иванов, 2000; Merritt, 2006) и отдельным модальностям: зрению (Horridge, 1975; Snyder, Menzel, 1975; Autrum et al., 1979; Stavenga, Hardie, 1989; Eguchi, Tominaga, 1999), обонянию (Amoore et al., 1971; Hansson, 1999; Hansson, Stensmyr, 2011), слуху (Жантиев, 1977а, 1981; Michelsen, Larsen, 1985), хемо- и механорецепторам (Wigglesworth, 1972; Keil, Steinbrecht, 1984; McIver, 1985; Ryan, 2002), термо- и гигрорецепторам (Altner, Prillinger, 1980; Altner, Loftus, 1985) и хордотональным органам (Field, Matheson, 1998; Yack, 2004).
Современное изучение органов чувств насекомых, благодаря колоссальному арсеналу световых, электронно-микроскопических, физиологических, генетических, поведенческих и математических методов включает разностороннее исследование структурной организации, развития, биохимии и моделирования органов чувств как важных компонентов нейронных сетей.
Размер тела во многом определяет морфологию, физиологию и биологию животных (Hanken, Wake, 1993), которые в значительной степени регулируются законами масштабирования11 (Шмидт-Ниельсен, 1987). Особенности миниатюризации систем органов освещены в ряде исследовательских работ (Novotny, Wilson, 1997; Beutel, Haas, 1998; Grebennikov, Beutel, 2002; Beutel et al., 2005; Полилов, 2007; Grebennikov, 2008; van der Woude, Smid, 2016 и др.) и обзоров (Niven, Farris, 2012; Minelli, Fusco, 2019), в том числе сотрудников нашей лаборатории (Макарова, Полилов, 2013, 2013а; 2017, 2017а; Polilov, 2015, 2016; Polilov, Makarova, 2017). Миниатюризация является одним из направлений эволюции животных (Четвериков, 1915). Миниатюрные формы были описаны во многих группах животных, как позвоночных (саламандры (Hanken, 1983), безногие ящерицы (Bhullar, Bell, 2008), хамелеоны (Glaw et al., 2021), лягушки (Rittmeyer et al., 2012), летучие мыши (Pereira et al., 2006), колибри (Dial, 2003)), так и различных членистоногих (насекомые (Polilov, 2016), паукообразные (Quesada et al., 2011), клещи (Сильвере, Штейн-Марголина, 1976), ракообразные (Корнеев, Чесунов, 2005 и другие)) и множества других беспозвоночных.
Миниатюрные формы находятся под дополнительным давлением оптимизации функционирования нервных тканей и сенсорных структур, которые являются метаболически затратными конструкциями (Niven, Laughlin, 2008) и обычно увеличиваются в относительном размере с уменьшением размера тела (Rensch, 1948).
Эволюция миниатюрных форм включает в себя преодоление этих ограничений законов масштабирования (Minelli, Fusco, 2019). Огромный разброс размеров тела у насекомых является хорошей базой для исследования масштабирования в биологических структурах и процессах. Наряду с этим, в век технологических инноваций и миниатюризации возникает интерес к сенсорным системам насекомых из-за их дискретности и компактности. Например, оптика сложных глаз насекомых, конечно, уступает в разрешении камерным глазам позвоночных, но идеально подходит для проектирования биомиметических зрительных систем (Voelkel, 2015).
За последние пять лет внесен значительный вклад в изучение влияния миниатюризации на строение органов чувств насекомых. Изучено строение сложных глаз мельчайших паразитических перепончатокрылых (Fischer et al., 2010, 2019; Makarova et al., 2015), проведен масштабный анализ влияния размера тела на строение глаз жесткокрылых (Макарова, Полилов, 2018; Makarova et al., 2019). Изучено влияние миниатюризации на сенсиллярное вооружение антенн паразитических наездников (Diakova et al., 2018) и жесткокрылых (Diakova, Polilov, 2020).
Изучение влияния масштабирования на строение и функционирование органов чувств является одним из актуальных вопросов морфологии и инженерии. Существующие сегодня миниатюрные формы животных – продукт миллионов лет эволюции и борьбы с законами масштабирования (Четвериков, 1915). Последствия миниатюризации проявляются в редукциях, упрощениях и морфологических адаптациях и сходны для всех животных (Hanken, Wake, 1993). Миниатюризация отражается на размере скелетных и локомоторных структур (Hanken, 1983; Polilov, 2015), мозга (Roth et al., 1990; Макарова, Полилов, 2013, 2013а; 2017, 2017а; van der Woude, Smid, 2016) и органов чувств (Rensch, 1959; Linke et al., 1986; Meyer-Rochow, Gál, 2004; Fischer et al., 2010, 2012, 2014; Ramirez-Esquivel et al., 2014, 2017; Makarova et al., 2015, 2019; Diakova et al., 2018; Diakova, Polilov, 2020).
Влияние размера тела индивида на размер и количество органов чувств называют сенсорными аутоадаптациями, которые возникают в ответ на несенсорные адаптации, например изменения общего размера тела (Jander, Jander, 1994, 2002). Впервые Барлоу (Barlow, 1952) провел измерения глаз 27 видов перепончатокрылых и показал, что существует взаимосвязь между диаметрами их омматидиев и значением квадратного корня высоты глаза. Позже размерные и количественные параметры сложных глаз и их связь с размером тела неоднократно рассматривались в литературе в аспекте постэмбрионального роста (Jander, Jander, 1994; Meyer-Rochow, Keskinen, 2003) и биологии видов (Bauer, Kredler, 1993; Jander, Jander, 2002 и другие). Изучение ультраструктурной организации сложных глаз у групп насекомых разного размерного класса показало, что глаза суперпозиционного типа плохо поддаются миниатюризации, а аппозиционные глаза являются характерным признаком мелких форм (Caveney, 1986; Gokan, Meyer-Rochow, 2000; Meyer-Rochow, Gál, 2004). Интерес к влиянию размера тела на строение глаз насекомых поддерживается уже более 30 лет, однако среди объектов все чаще фигурируют насекомые, размер тела которых составляет более 2 мм (Meyer-Rochow, Gál, 2004; Honkanen, Meyer-Rochow, 2009; Fischer et al., 2014; Palavalli-Nettimi et al., 2019), и лишь за последние 10 лет стали появляться работы о морфофункциональных особенностях строения сложных глаз истинных микронасекомых (длина тела менее 1 мм) (Fischer et al., 2010, 2012, 2019; Makarova et al., 2015, 2019; Макарова, Полилов, 2018; Meyer-Rochow, Yamahama, 2019). Несмотря на растущий интерес к масштабированию нервной системы и органов чувств, число работ, включающих количественный анализ различных параметров, невелико.
Сложные глаза
Общая характеристика сложных глаз и краткий обзор основных работ
Сложные глаза играют очень важную роль в жизни насекомых, не только для летающих видов, как инструмент для ориентации во время полета (Srinivasan et al., 1999; Egelhaaf, Kern, 2002; Floreano, Zufferey, 2010), но также для навигации и панорамного ориентирования у бескрылых особей (McLeman et al., 2002; Graham, Cheng, 2009; Reid et al., 2011), и при обнаружении и обходе препятствий (Palavalli-Nettimi, Narendra, 2018). Даже у видов, использующих феромонную коммуникацию, зрение играет важную роль (Willis et al., 2011).
Первыми организмами, обладающими сложными глазами, были трилобиты (палеозойская эра, 540–252 млн лет назад) (Clarkson et al., 2006; Schoenemann et al., 2017). Cложные глаза и по настоящее время являются основными фоторецепторными органами многоножек, ракообразных и насекомых, а также архаичных мечехвостов (Мазохин-Поршняков, 1965). За пределами Arthropoda сложными глазами обладают отдельные представители полихет и моллюсков (Беклемишев, 1952). У Hexapoda сложные глаза имеют почти все взрослые формы Pterygota (за исключением Phthiraptera и Siphonaptera) и их нимфальные стадии у видов с неполным превращением (Мазохин-Поршняков, 1965).
Сложный глаз насекомых состоит из повторяющихся единиц, называемых омматидиями (рис. 1А). Поверхность глаза образована прозрачной хитиновой роговицей. Роговица сложена шестигранными фасетками, которые служат линзами для омматидиев. Каждый омматидий образован тремя аппаратами: 1) диоптрическим (= светопреломляющим), состоящим из роговичной линзы (хрусталик) и кристаллического конуса; 2) светочувствительным (= фоторецепторный), состоящим из фоторецепторных клеток (= зрительные, ретинальные); 3) светоизолирующим, состоящим из первичных (= главные, ирисовые) и вторичных (= придаточные, дополнительные) пигментных клеток (Мазохин-Поршняков, 1965). Диоптрический аппарат окружен первичными пигментными клетками, а вторичные пигментные клетки, в норме, окружают весь омматидий вдоль всей длины (от линзы до базальной мембраны). Число вторичных пигментных клеток (ВПК) варьирует у разных видов. Эти клетки содержат пигментные гранулы и служат для оптической изоляции смежных омматидиев. Микровиллярные выросты фоторецепторных клеток (рабдомеры) образуют светочувствительный элемент омматидия – рабдом. Рабдом может быть замкнутого (= закрытого) типа (все рабдомеры смыкаются и образуют единый “стержень”); он описан для большинства насекомых: Hymenoptera, Lepidoptera, Blattoptera, Hemiptera, часть Coleoptera и др. Рабдом открытого типа (рабдомеры остаются разделенными по всей своей длине) характерен для Diptera и некоторых подсемейств Coleoptera. Число фоторецепторных клеток, формирующих рабдом у большинства крупных отрядов, составляет 8 (Coleoptera, Lepidoptera, Hemiptera, Diptera), у всех Hymenoptera – 9 клеток. Однако есть и ряд исключений: 7 у Atalophlebia (Ephemeroptera, Leptophlebiidae) (Horridge, McLean, 1978), до 11 у Lucanus maculofemoratus (Coleoptera, Lucanidae) (Gokan et al., 1998), 14 у Operophthera brumata (Lepidoptera, Geometridae) (Meyer-Rochow, Lau, 2008), 21 у Aceraius grandis (Coleoptera, Passalidae) (Gokan, Meyer-Rochow, 2000), 24 у Drosicha stebbingi (Hemiptera, Margarodidae) (Мазохин-Поршняков, 1965).
Рис. 1.
Схема строения омматидия аппозиционного типа: A – крупные насекомые (на примере Apis mellifera) (рисунок адаптирован из Stavenga, Hardie, 1989), B – мельчайшие насекомые (на примере Megaphragma), C – схема омматидия мельчайших насекомых в едином масштабе со схемой крупных насекомых; bc – базальная клетка, bm – базальная мембрана, spc – вторичные пигментные клетки, cc – кристаллический конус, ls – линза, ppc – первичные пигментные клетки, rbd – рабдом, retc – ретинальные клетки, nuc – ядро.
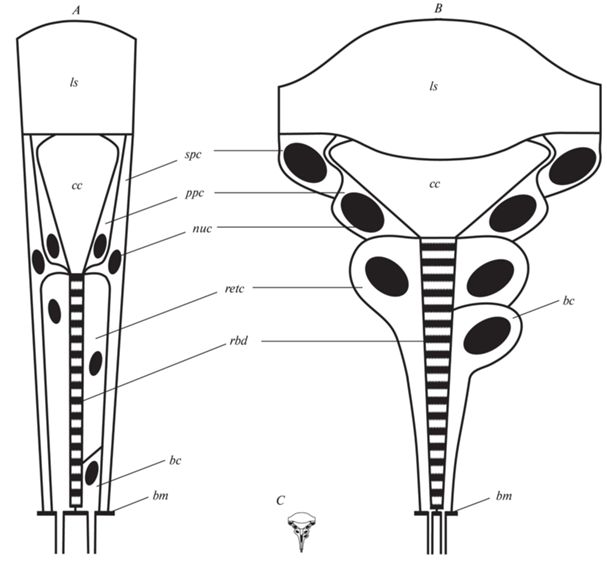
Выделяют три основных типа сложных глаз: аппозиционный, оптикосуперпозиционный и нейросуперпозиционный (Чайка, 2010). Аппозиционный тип (= фотопический), в котором при полной оптической изоляции соседних омматидиев на рабдом каждого омматидия попадает только свет, прошедший через его собственную линзу, характерен по большей части для дневных насекомых, чешуекрылых (Yagi, Koyama, 1963), перепончатокрылых (Perrelet, 1970; Greiner et al., 2007), части жесткокрылых (Caveney, 1986), скорпионниц (Chen, Hua, 2016). Оптикосуперпозиционный тип (= скотопический), где свет, прошедший как через собственную линзу, так и через соседние, из-за отсутствия оптической изоляции омматидиев, попадает на рабдом каждого омматидия, характерен для ночных видов чешуекрылых (Yagi, Koyama, 1963), некоторых групп жесткокрылых (Caveney, 1986), сетчатокрылых (Belušič et al., 2013). В нейросуперпозиционных глазах двукрылых суперпозиция световых лучей на сетчатке отсутствует, а имеется суперпозиция сигналов зрительных клеток разных омматидиев в первом оптическом ганглии, но именно тех зрительных клеток, рабдомеры которых воспринимают одну и ту же точку пространства. За счет нейрональной суперпозиции достигается повышенная светосила, необходимая для ориентации насекомых при низкой освещенности. Нейрональная суперпозиция рассматривается как характерная особенность эволюционно продвинутых двукрылых (Calyptratae) (Kirschfeld, 1967), Scarabaeidae (Caveney, 1986), Hesperiidae (Horridge et al., 1972), Lampyridae (Horridge, 1969), Ephemeroptera (Wolburg-Buchholz, 1977), Sphingidae и Noctuidae (Yagi, Koyama, 1963), а также ряда ракообразных (Nilsson, 1990). Однако подобная функциональная классификация глаз все же имеет исключения: аппозиционные глаза могут также иметь некоторые ночные перепончатокрылые (Halictidae, Megalopta genalis; Formicidae: некоторые виды рода Myrmecia) (Greiner et al., 2004, 2007), а суперпозиционные глаза были описаны для ряда дневных чешуекрылых (Horridge et al., 1972; Warrant et al., 1999; Lau et al., 2007).
Отправной точкой изучения сложных глаз считается исследование диоптрического аппарата (Exner, 1891). Затем последовали разносторонние комплексные исследования сложных глаз и зрения насекомых и членистоногих в целом: открытие цветового зрения (von Frisch, 1914) и его трихроматичности (Daumer, 1956), использование поляризованного света для навигации (von Frisch, 1949); роль дифракции световых волн (Barlow, 1952). С появлением электронной микроскопии описаны тонкая структура рабдома (Danneel, Zeutzschel, 1957; Goldsmith, Philpott, 1957) и его роль в восприятии поляризованного света (Miller, 1957). Важное значение имели открытия нейральной суперпозиции у двукрылых (Kirschfeld, 1967), спектральной (Burkhardt, 1962) и поляризационной чувствительности фоторецепторов (Shaw, 1969), а также формулирование теории волновода в рабдомах замкнутого типа (Snyder et al., 1973; Snyder, 1979). Были проведены первые исследования в области электрофизиологии (Hartline, 1928; Hartline, Graham, 1932) и первые внутриклеточные регистрации в фоторецепторах (Kuwabara, Naka, 1959). Осуществлены исследования в области фотохимии пигментов (Stavenga, 1975; Hamdorf, 1979 и другие), открыт сенсибилизирующий пигмент у двукрылых (Kirschfeld et al., 1977), хромофор (Vogt, 1983) и другие пигменты. Основателем отечественной школы по изучению биофизики и физиологии зрения насекомых был Г.А. Мазохин-Поршняков, чьи труды до сих пор составляют основу тематической литературы. Комплексные исследования глаз членистоногих, от морфологии до физики зрения, освещены в ряде обзоров и монографий (Мазохин-Поршняков, 1965; Horridge, 1975; Snyder, Menzel, 1975; Францевич, 1979, 1980; Грибакин, 1981, 1983; Stavenga, Hardie, 1989; Warrant, Nilsson, 2006 и многие другие). Несмотря на фактически исчерпывающие данные о функциональной анатомии сложных глаз, ряд пробелов в понимании их эмбриологии, функционирования и физиологии все еще существует (Meyer-Rochow, 2014). Одним их таких пробелов до недавнего времени была не изученность миниатюризации сложных глаз и тех морфологических и ультраструктурных изменений, которыми сопровождается этот процесс.
Масштабирование сложных глаз насекомых
Среди сенсорных органов насекомых сложные глаза занимают особое место, поскольку на зрительной информации базируются такие поведенческие акты как дальняя и ближняя ориентация, поиск источников пищи и конспецифических особей. Разрешающая способность и контрастная чувствительность влияют на восприятие этой пространственной информации и ограничены размером глаз (Palavalli-Nettimi et al., 2019). С уменьшением размера тела площадь, доступная для размещения глаз, уменьшается, что влияет на число омматидиев, размер линзы и возможности обработки информации. Это делает размер тела одним из важных параметров, во многом определяющих строение и функционирование органов зрения.
Первые признаки структурных и функциональных специализаций в миниатюрных глазах были выявлены благодаря исследованиям на мелких пластинчатоусых жесткокрылых (Gokan, Meyer-Rochow, 2000) и чешуекрылых (Honkanen, Meyer-Rochow, 2009) (длина тела от 2 до 5 мм). Было показано, что существует минимальный размер прозрачной зоны (широкая оптически прозрачная зона между роговичными линзами и сетчаткой), ограничивающий принцип суперпозиции (Gokan, Meyer-Rochow, 2000; Meyer-Rochow, Gál, 2004; Honkanen, Meyer-Rochow, 2009). Наряду с этим, было показано, что уменьшение или утрата прозрачных зон коррелируют со сменой суточной активности у чешуекрылых (Fischer et al., 2012, 2014). Вторичная утрата суперпозиции в связи с малым размером тела в определенных таксонах (например, пластинчатоусые) (Gokan, Meyer-Rochow, 2000) объясняет, почему все миниатюрные формы и все изученные по сей день микронасекомые (длина тела менее 1 мм) (Fischer et al., 2010; Makarova et al., 2015, 2019) обладают аппозиционной оптикой, в то время как крупные формы имеют суперпозиционный тип глаз.
Несмотря на крошечные размеры тела, все миниатюрные и мельчайшие насекомые, исследованные до сих пор (Fischer et al., 2010, 2012; Makarova et al., 2015, 2019; Макарова, Полилов, 2018; Meyer-Rochow, Yamahama, 2019), демонстрируют общий план клеточной организации омматидиев, свойственный крупным насекомым (рис. 1A, 1B). Однако изменения касаются ряда структурных компонентов, которые, уменьшаясь, теряют свои физико-оптические свойства. Описанные в литературе закономерности, связанные с миниатюризацией сложных глаз, можно разделить на две группы: количественные и структурные. Количественные касаются числа и размера отдельных фасеток. Структурные включают различные морфологические адаптации к миниатюризации, а также оптические свойства такой микрооптики.
Количественные параметры
Корреляция размера глаз с размерами тела (Jander, Jander, 2002), головы (Palavalli-Nettimi, Narendra, 2018), грудного отдела (Döring, Spaethe, 2009), расстоянием между тегулами (Streinzer et al., 2013), длиной крыла (Yagi, Koyama, 1963), а также различных отношений этих параметров (Gronenberg, Hölldobler, 1999) отмечена уже довольно давно для разных групп насекомых.
Число омматидиев в составе сложного глаза коррелирует с размером тела и головной капсулы, но также во многом зависит и от среды обитания, особенностей биологии, суточной активности (Gokan, Meyer-Rochow, 2000) и пола насекомого (Yagi, Koyama, 1963; Gronenberg, 2008; Meyer-Rochow, Lau, 2008; Fischer et al., 2010 и др.). Например, у мирмекофильных видов и пещерных форм число омматидиев редуцировано (или глаза вовсе отсутствуют) (Assing, 2013; Parker, 2016 и др.), а у Ptiliidae того же размера (около 1 мм) в составе глаза насчитывается порядка 50 омматидиев (Makarova et al., 2019). Количество омматидиев в глазу колеблется от нескольких единиц у сеноедов (Макарова, Полилов, 2017) или нескольких десятков у миниатюрных жесткокрылых и перепончатокрылых (Makarova et al., 2015; Makarova et al., 2019), до нескольких тысяч у среднеразмерных двукрылых (Sukontason et al., 2008) и крупных перепончатокрылых (Jander, Jander, 2002) и десятков тысяч в глазах стрекоз (Sherk, 1978), бражников (Мазохин-Поршняков, 1965) и крупнейших жесткокрылых (Rensch, 1959; Gokan et al., 1986).
Так, число омматидиев в составе сложного глаза у крупных насекомых в 1000 раз больше, чем у мельчайших летающих насекомых: у Anax junius (Odonata, Aeschnidae) насчитывается до 29 247 омматидиев в каждом глазу (Sherk, 1978), а у мельчайшего летающего насекомого Kikiki huna (Hymenoptera, Mymaridae) (Huber, Noyes, 2013) в составе каждого глаза насчитывается всего 25 омматидиев. Если сравнивать масштабирование внутри отрядов, то число омматидиев для перепончатокрылых: у самых крупных представителей в 640 раз больше, чем у мельчайших представителей (у Xylocopa latipes (Apidae) – 16 000 (Jander, Jander, 2002) и 25 омматидиев у Kikiki huna (Huber, Noyes, 2013); для жесткокрылых: в 920 раз (у Augosoma centaurus (Scarabaeidae) – 29 450 (Rensch, 1959) и 32 омматидия у Scydosella mysawasensis (Ptiliidae) (Makarova et al., 2019); для чешуекрылых: в 219 раз (порядка 27 000 у Sphinx convolvuli (Sphingidae) (Мазохин-Поршняков, 1965) и 123 у Stigmella microtheriella (Nepticulidae) (Fischer et al., 2012).
Хотя количество фасеток может использоваться как параметр для оценки разрешения глаз (Land, 1997), малое число не обязательно напрямую связано с ограниченной функциональностью. Показано, что способность к навигации у насекомых сохраняется даже при небольшом числе фасеток (50–60) в составе глаза (McLeman et al., 2002), несмотря на то что важнейшие поведенческие акты в пространстве базируются на оптической информации (Францевич, 1980).
Диаметр фасетки и кривизна линзы играют наиболее важную роль в глазах аппозиционного типа (Barlow, 1952). Уменьшение диаметра фасеток неизбежно приводит к уменьшению чувствительности и пространственного разрешения (Yagi, Koyama, 1963; Rutowski et al., 2009). Поэтому диаметр фасетки не может уменьшаться неограниченно.
Диаметр фасеток у мельчайших насекомых в 30 раз меньше, чем у крупных, и в 4–6 раз меньше, чем у среднеразмерных насекомых (рис. 1A–1C, 2С). У одного из самых крупных жесткокрылых Titanus giganteus (Cerambycidae) диаметр фасетки составляет порядка 180 мкм (Dvořáček et al., 2020). А у среднеразмерных Creophilus erythrocephalus (Coleoptera, Staphylinidae) (Meyer-Rochow, 1972) и Apis mellifera (Hymenoptera, Apidae) (Streinzer et al., 2013) – 20–35 мкм. Фасетки самого малого диаметра (5.9 мкм) выявлены пока только у самца Trichogramma evanescens (Hymenoptera, Trichogrammatidae) (Fischer et al., 2010). Минимальный диаметр фасетки, встречающийся у многих мельчайших насекомых (длина тела менее 0.4 мм) (Scydosella musawasensis, Cylindrosella sp. (Coleoptera, Ptiliidae) (Makarova et al., 2019), Kikiki huna (Hymenoptera, Mymaridae) (измерены на микрофотографиях по: Huber, Noyes, 2013), Megaphragma carribea (Hymenoptera, Trichogrammatidae), также составляет порядка 6 мкм, что намного меньше теоретического предела (Barlow, 1952).
Длина омматидия в среднем в 16 раз меньше у микронасекомых, чем у крупных насекомых (рис. 1C): так, у крупного Creophilus erythrocephalus (Coleoptera, Staphylinidae) (Meyer-Rochow, 1972) она составляет 300 мкм, а наименьшая известная длина омматидия составляет 20.2 мкм у Nanosella sp. (Coleoptera, Ptiliidae) (Makarova et al., 2019).
Структурные параметры
Выпуклость глаза. Миниатюрные насекомые характеризуются довольно выпуклыми глазами, что является следствием уменьшения радиуса кривизны глаз и, вероятно, способствует увеличению поля зрения (Makarova et al., 2015). Уменьшение радиуса глаза в свою очередь отражается на увеличении межомматидийных углов (Fischer et al., 2014).
Форма фасетки и кривизна линзы. Форма фасеток в глазу насекомых может варьировать от ромбовидных до шестиугольных. Однако привычная гексагональная форма фасетки, свойственная крупным насекомым, приобретает все более округлые черты у миниатюрных форм, и связано это также с изменением кривизны линзы (Makarova et al., 2015, 2019) (рис. 2). Уменьшение радиуса кривизны увеличивает силу линзы и играет важную роль в достижении короткого фокусного расстояния, и рассматривается как адаптация для поддержания функции короткого диоптрического аппарата (Caveney, McIntyre, 1981). Радиус кривизны наружной поверхности линз определяет степень преломления света на кристаллический конус (Makarova et al., 2015). Сильно выпуклые линзы позволяют свету проходить под большим углом, в плоских фасетках такой свет был бы поглощен первичными пигментными клетками. Таким образом, потребность в более коротком фокусном расстоянии для линзы вероятно обусловлена необходимостью увеличения количества фотонов, поступающих в омматидии.
Рис. 2.
Структура поверхности глаз насекомых на примере жесткокрылых (СЭМ): A – Titanus giganteus (Cerambycidae) (длина тела 155 мм) (Dvořáček et al., 2020), B – Neotriplax lewisi (Erotylidae) (длина тела 5 мм) (Mishra, Meyer-Rochow, 2006), C – Nanosella sp. (Ptiliidae) (длина тела 0.48 мм).

Перекрестное положение ядер, дистальная позиция. Клеточная организация омматидия задает очень строгие границы для перестроек в сложном миниатюрном глазу. У ряда изученных микронасекомых в целях более эффективного использования пространства в фоторецепторных клетках ядра располагаются в разных плоскостях вдоль рабдома в верхней трети омматидия (Fischer et al., 2010, 2019; Makarova et al., 2015) (рис. 2B), что отличается от расположения ядер у более крупных перепончатокрылых (Perrelet, 1970; Skrzipek, Skrzipek, 1971). Перекрестное расположение ядер фоторецепторных и даже пигментных клеток позволяет сохранить конусовидную форму омматидиев и более плотно и компактно упаковать омматидии с небольшими диаметрами фасеток (рис. 2B). В этом случае размер ядер фоторецепторов, очевидно, будет влиять на миниатюризацию в небольших сложных глазах. С этой точки зрения интерес представляет Megaphragma amalphitanum (Hymenoptera, Trichogrammatidae), которая, несмотря на лизис 95% ядер нервной системы (Polilov, 2012), сохраняет все ядра клеток в омматидиях глаза.
Редукция вторичных пигментных клеток. В миниатюрных глазах ВПК подвергаются ряду модификаций. Так, у миниатюрных чешуекрылых тела ВПК сохраняются лишь в дистальной части омматидиев, а к базальному матриксу устремляются тонкие проксимальные отростки, которые к тому же фактически утрачивают пигментные гранулы (Fischer et al., 2012). Подобная организация не влияет на вертикальную миграцию пигмента и механизм свето-темновой адаптации, но приводит к значительному увеличению доступного пространства для фоторецепторных клеток у более мелких видов.
У микроперепончатокрылых и микрожесткокрылых ВПК не распространяются ниже уровня кристаллического конуса (Fischer et al., 2010; Makarova et al., 2015, 2019) (рис. 2B). Наши данные, полученные в результате трехмерной реконструкции сложного глаза M. amalphitanum показывают, что сокращается также и число ВПК. В глазу M. amalphitanum насчитывается всего 24 ВПК на 29 омматидиев, при этом каждый из диоптрических аппаратов контактирует с четырьмя ВПК (а не 6-ю, как было предположено ранее (Makarova et al., 2015)). Таким образом, ВПК, вместе с первичными пигментными клетками, у M. amalphitanum выполняют экранирующую функцию для диоптрических аппаратов соседних омматидиев, не принимая участия в оптической изоляции омматидия целиком. Последняя, по-видимому, достигается за счет более плотной упаковки пигментных гранул в фоторецепторных клетках, а также дополнительного слоя базальных пигментных клеток.
Рабдом. Увеличение диаметра рабдома. Для мельчайших чешуекрылых из семейства Nepticulidae характерно увеличение диаметра дистального рабдома по сравнению с более крупными видами. С одной стороны, больший диаметр дистального рабдома увеличивает общий объем рабдома, с другой, увеличение диаметра приводит к изменению оптической функции волновода (диаметры <2) на световод (диаметр >2 мкм (Snyder, 1979; Warrant, McIntyre, 1993). С увеличением диаметра дистальной части рабдома у миниатюрных видов происходит увеличение поглощения фотонов. По сравнению с длинным и тонким рабдомом у крупных жесткокрылых (Gokan, Meyer-Rochow, 1984; Mishra, 2013), у микрожесткокрылых Ptiliidae рабдом короткий, расширен в дистальной части и сужен на самом проксимальном конце (рис. 2B). Широкая дистальная часть рабдома, вероятно, позволяет захватывать больше света (Stavenga, 2003) и, следовательно, может быть признаком большей чувствительности. Для микроперепончатокрылых также отмечено относительное увеличение диаметра рабдома (Makarova et al., 2015).
Рабдом миниатюрных чешуекрылых Nepticulidae, помимо увеличения диаметра дистальной части приобретает форму песочных часов (Fischer et al., 2014). Разделение области дистального и проксимального рабдома перетяжкой (тонкий промежуток, где отсутствуют микроворсинки), обеспечивает дополнительное пространство для размещения некоторых ядер фоторецепторных клеток и позволяет пигментным гранулам образовывать экранирующий щит над проксимальным рабдомом при световой адаптации (Fischer et al., 2012).
Увеличение межомматидийного угла. В результате уменьшения длины омматидия у микронасекомых наблюдается увеличение межомматидийного угла. Межомматидийные углы изученных микронасекомых длиной тела до 2 мм имеют следующие величины: перепончатокрылые: Megaphragma mymaripenne (Trichogrammatidae) – 21.5°, Anaphes flavipes (Mymaridae) – 15° (Makarova et al., 2015), T. evanescens (Trichogrammatidae) – 10° (Fischer et al., 2010); жесткокрылые: Nephanes titan – 14.8°, Acrotrichis grandicollis – 17.6°, Porophila mystacea –21.2°, Nanosella sp. – 21.5° (Ptiliidae) (Makarova et al., 2019); чешуекрылые: S. microtheriella (Nepticulidae) – 11.2° (Fischer et al., 2012); они относительно велики в сравнении с величиной межомматидийного угла у крупных видов (Apis mellifera – 0.8°–1.3° (Land, 1997); Bombus hortorum – 2.5° (Hymenoptera, Apidae) (Meyer-Rochow, 1981); C. erythrocephalus – 2°–4° (Meyer-Rochow, 1972); Paysandisia archon (Lepidoptera, Castniidae) 0.8° (Pirih et al., 2018), Parthenos sylvia – 0.9°–1.5°, Araschnia levana – 4°–2° (Lepidoptera, Nymphalidae) (Rutowski et al., 2009)). Большое значение межомматидийного угла также коррелирует с предельно малым диаметром линз в миниатюрных глазах. Увеличение межомматидийного угла приводит к сжатию омматидия и, таким образом, к уменьшению размеров диоптрического аппарата и общей площади ретины. Следовательно, значение угла между омматидиями, по-видимому, является консервативным признаком при миниатюризации сложных глаз и устанавливает предел визуального разрешения у насекомых небольших размеров.
Форма пигментных гранул фоторецепторных клеток. В фоторецепторных клетках микроперепончатокрылых пигментные гранулы имеют эллипсоидную форму (Fischer et al., 2010; Makarova et al., 2015), а не сферическую, как у крупных перепончатокрылых (Perrelet, 1970; Skrzipek, Skrzipek, 1974). Гранулы, расположенные параллельно оси омматидия, формируют плотную светоизолирующую структуру, что является адаптацией к уменьшенному пространству в фоторецепторных клетках (Fischer et al., 2010). Сходная упаковка пигментных гранул в фоторецепторных клетках выявлена нами и у микрожесткокрылых (Makarova et al., 2019).
Сокращение числа рабдомеров в составе рабдома. Эта уникальная особенность описана пока лишь у S. microtheriella (Lepidoptera, Nepticulidae). Из семи фоторецепторных клеток, в формировании дистального рабдома у S. microtheriella принимают участие лишь пять. Эти пять рабдомеров ориентированы в трех направлениях, смещенных друг относительно друга на 120° вдоль всей оси омматидия, удовлетворяя основным требованиям для восприятия линейно поляризованного света (Fischer et al., 2012). Клетки, чьи рабдомеры не участвуют в формировании дистального рабдома, однако входят в состав проксимального, и характеризуются меньшей плотностью пигментных гранул. Вероятно, такая организация рабдома у S. microtheriella способствует фильтрации падающего света (Fischer et al., 2014).
Отсутствие рабдомера у базальной фоторецепторной клетки. У микрочешуекрылых Ectoedemia argyropeza и S. microtheriella (Nepticulidae) 8-я (базальная) клетка лишена рабдомера. Причина этого возможно связана с уменьшением диапазона воспринимаемого спектра длин волн (Fischer et al., 2014). Но это лишь предположение, так как данные о спектральной чувствительности у миниатюрных чешуекрылых отсутствуют.
Диаметр микроворсинок рабдома. Несмотря на уменьшение длины и диаметра рабдома, не было обнаружено различий в диаметре микроворсинок (60 ± 10 нм) у микронасекомых (Fischer et al., 2010, 2014; Makarova et al., 2015, 2019) по сравнению с более крупными насекомыми (Varela, Porter, 1969; Perrelet, 1970; Mishra, 2013; Lau et al., 2007). В отличие от некоторых ракообразных (Meyer-Rochow, Reid, 1996), диаметр микроворсинок у насекомых не изменяется в течение постэмбрионального развития и свето-темновой адаптации (Meyer-Rochow, Keskinen, 2003). Немасштабируемое значение диаметра микроворсинок, по-видимому, зависит от размера молекул фотопигмента, а также его количества, размещенного на мембране.
Диаметр пигментных гранул. Морфометрический анализ диаметра пигментных гранул (на электронных микрофотографиях) ряда микроперепончатокрылых показал, что их пигментные гранулы фоторецепторных клеток (Fischer et al., 2010; Makarova et al., 2015) значительно меньше, чем у крупных насекомых (Perrelet, 1970; Skrzipek, Skrzipek, 1974). Однако согласно данным трехмерных реконструкций различных типов пигментосодержащих клеток у Trichogramma brassicae (Hymenoptera, Trichogrammatidae) средний объем/диаметр этих гранул находится в диапазоне размеров гранул крупных перепончатокрылых (Fischer et al., 2019). Таким образом, данных, свидетельствующих об изменении размеров пигментных гранул с изменением размера тела, пока недостаточно.
Оптические параметры
Теоретические исследования оптических свойств сложных глаз показали, что неограниченное уменьшение размера глаза невозможно (Warrant, McIntyre, 1993; Meyer-Rochow, Gál, 2004). Чувствительность и пространственное разрешение всегда будут противоречить друг другу (Land, 1997), а баланс между разными оптическими параметрами для глаз заданного размера будет индивидуальным для насекомых с разной экологией. Так, в аппозиционном глазу уменьшение диаметра фасетки и величины межомматидийного угла будут способствовать более высокому разрешению, но при этом чувствительность фоторецепторов снизится из-за меньшего количества проникающего к ним света.
У миниатюрных видов чувствительность будет иметь приоритет над разрешением, поэтому уменьшение размера тела прежде всего приведет к уменьшению числа фасеток в составе глаза у мелких видов. Минимальный размер линзы будет ограничивать дифракция (Land, 1981). Глаза с ограниченным разрешением будут пригодны для фототаксиса, но уменьшение диаметра линзы ниже определённого предела отразится на чувствительности и может привести в итоге к потере функции (Fischer et al., 2010; Land, Nilsson, 2012). Компромисс будет заключаться в поддержании такого количества фасеток меньшего размера, которые бы сохраняли разрешение на необходимом и достаточном уровне. Например, у более крупной T. evanescens число омматидиев в составе глаза в 4.5 раза больше, чем у M. mymaripenne (Fischer et al., 2010; Makarova et al., 2015), а диаметр фасеток меньше. Больший диаметр фасеток у M. mymaripenne может рассматриваться как фактор, компенсирующий малое число фасеток в составе глаза. Независимо от диаметра рабдома и размера диоптрического аппарата, больший диаметр фасетки будет уменьшать влияние дифракции и, следовательно, улучшит разрешение.
Еще одним из факторов, ограничивающих миниатюризацию, являются оптические свойства диоптрического аппарата и рабдома. Диоптрический аппарат выполняет функцию фокусировки света на рабдоме. Чем короче становится кристаллический конус, тем значительнее должна быть сила линзы, чтобы поддерживать фокус на вершине рабдома. Сила линзы определяется внешним радиусом кривизны, который тем меньше, чем более выпуклы фасетки (Fischer et al., 2010). Размер рабдома, в свою очередь, определяет минимальные пределы чувствительности сложных глаз (Meyer-Rochow, Gál, 2004). Поскольку длина рабдома в миниатюрных глазах ограничена общей длиной сетчатки, уменьшение размеров омматидия компенсируется относительным увеличением диаметра рабдома. Подобные адаптации наблюдаются у некоторых видов ночных насекомых с аппозиционным типом оптики как приспособление к более низким уровням освещенности (Greiner et al., 2004, 2007). Уменьшение диоптрического аппарата (фокусного расстояния) и увеличение диаметра рабдома в миниатюрных глазах способствуют увеличению их чувствительности.
Аллометрический анализ основных количественных характеристик сложных глаз насекомых
Нами проанализированы данные по числу и диаметру фасеток у 370 видов насекомых из 16 отрядов: Odonata (Sherk, 1978); Plecoptera (Nagashima, Meyer-Rochow, 1995); Orthoptera (Anderson, 1978; Goulet et al., 1981; Egelhaaf, Dambach, 1983; Huber et al., 2019); Phasmatodea (Meyer-Rochow, Keskinen, 2003); Blattodea (Mishra, Meyer-Rochow, 2008; Butler, 1973); Thysanoptera (Moritz, 1989); Hemiptera (Shelton, Lawrence, 1974; Jander, Jander, 1994; Döring, Spaethe, 2009; Mishra, 2015; Farnier et al., 2015; Jia, Liang, 2015); Embioptera (Мазохин-Поршняков, Казякина, 1982); Psocoptera (Мазохин-Поршняков, Казякина, 1983; Meyer-Rochow, Mishra, 2007; Yang et al., 2012); Hymenoptera (Ribi, 1975; Huber, Fidalgo, 1997; Gronenberg, Höldobler, 1999; Huber, Naiquan, 1999; Jander, Jander, 2002; Baker, Ma, 2006; Nieves-Aldrey et al., 2007; Gronenberg, 2008; Li et al., 2009; Schwarz et al., 2011; Vilhemsen, 2011; Fisher, 2010; Huber, 2013; Huber, Noyes, 2013; Narendra et al., 2013; Streinzer et al., 2013, 2016; Yefremova et al., 2014; Somanathan et al., 2017; Palavalli-Nettimi, Narendra, 2018; Palavalli-Nettimi et al., 2019; Ramadan et al., 2019;); Neuroptera (Yang et al., 1998); Strepsiptera (Buschbeck, 2005); Coleoptera (Rensch, 1959; Мазохин-Поршняков, 1965; Meyer-Rochow, 1972, 1977, 1978; Chapman, 1972; Meyer-Rochow, Horridge, 1975; Kuster, 1980; Gokan et al., 1982, 1986, 1987, 1998; Meyer-Rochow, Gokan, 1988; Gokan, Meyer-Rochow, 1984, 1990, 2000; Labhart et al., 1992; Mishra, Meyer-Rochow, 2006, 2006a; Grebennikov, 2008; Schomann et al., 2008; Irmler, 2010; Talarico et al., 2011; Mishra, 2013; Del, Mora, 2014; Jia, Liang, 2014; Assing, 2013, 2017; Makarova et al., 2015, 2019); Lepidoptera (Yagi, Koyama, 1963; Мазохин-Поршняков, 1965; Horridge et al., 1977; Yack et al., 2007; Meyer-Rochow, Lau, 2008; Honkanen, Meyer-Rochow, 2009; Fischer et al., 2012, 2014); Mecoptera (Chen, Hua, 2016); Diptera (Satô, 1953, 1953a, 1957, 1959, 1960, 1961; Rensch, 1959; Wada, 1974; Meyer-Rochow, Waldvogel, 1979; Williams, 1980; Meyer-Rochow, Reid, 1994; Land et al., 1997; Sukontason et al., 2008; Posnien et al., 2012; Singh, Mohan, 2013; Jia, Liang, 2017; Meyer-Rochow, Yamahama, 2019).
В анализ также вошли количественные характеристики, измеренные на 68 видах микронасекомых (длина тела <1.5 мм) из следующих отрядов и семейств: Coleoptera (Ptiliidae, Corylophidae, Staphylinidae), Hymenoptera (Trichogrammatidae, Mymaridae), Diptera (Cecidomyiidae, Sphaeroceridae), а также измеренные на электронных микрофотографиях из Морфобанка (Morphbank: Biological Imaging (http://www.morphbank.net), Florida State University, Department of Scientific Computing, Tallahassee, FL32306-4026 USA).
На основе обширных литературных и собственных данных проведен масштабный анализ зависимости количественных характеристик сложных глаз от размеров тела (рис. 3). Анализ был выполнен в пакете SMATR в среде R (Warton et al., 2006). Для описания аллометрии использовано уравнение y = axb, где y – исследуемое значение, a – коэффициент пропорциональности (elevation) (далее коэффициент), x – длина тела, b – аллометрический показатель (slope) (далее показатель). В анализе использовано два типа регрессии: SMA – анализ главных компонент (приводится по умолчанию), OLS – метод наименьших квадратов (приводится в тех случаях, когда a и b значительно отличаются от SMA). Для всех показателей проведён анализ всех насекомых вместе, выборок самцов и самок, насекомых с полным и неполным превращением, крупных (длина тела ≥1.5 мм) и мелких (длина тела <1.5 мм) насекомых по отдельности, а также по основным отрядам, для которых достаточно данных для анализа.
Рис. 3.
Зависимость основных характеристик сложного глаза от размера тела насекомых: A – число и диаметр фасеток, B – число фасеток, C – диаметр фасеток для отдельных отрядов, D – число фасеток для отдельных отрядов, E – диаметр фасеток у жесткокрылых, F – число фасеток у жесткокрылых.
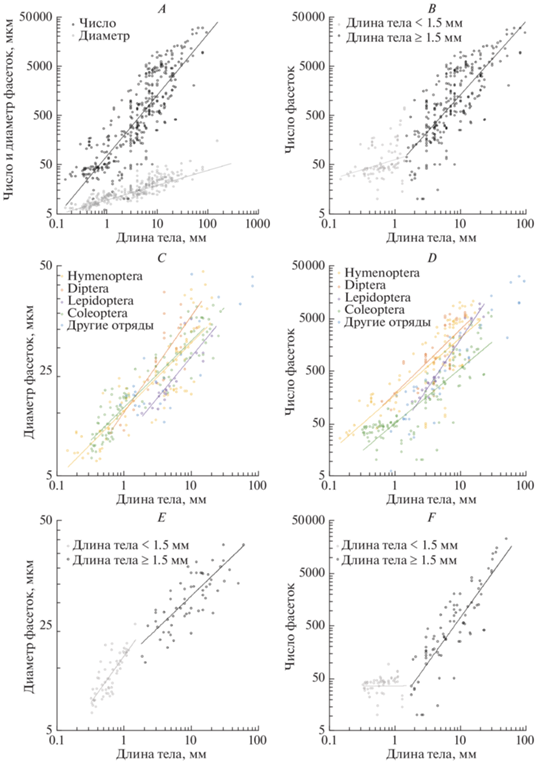
В результате анализа было установлено, что число фасеток и их диаметр коррелируют с размерами тела и увеличиваются при увеличении размеров тела, как для всех насекомых (число 56.89x1.46 (OLS 77.98x1.23), диаметр 9.84x0,36 (OLS 10.33x0.32)), так и для всех выборок по отдельности (b для числа 1.30–1.92 (OLS 0.42–1.65), для диаметра 0.34–0.51 (OLS 0.32–0.39)) (рис. 3А–3D). При этом число фасеток при изменении размеров тела меняется значительно сильнее, чем диаметр: число – на четыре порядка, а диаметр – на один порядок. При попарном сравнении выборок насекомых с неполным и полным превращением выявлены достоверные различия по коэффициенту пропорциональности для числа фасеток (а = 33.34 и 59.98 соответственно, p < 0.001). Мелкие и крупные насекомые достоверно различаются по коэффициенту и показателю для числа фасеток (121.9x1.57 (OLS 63.9x0.42) и 20.46x1.92 (OLS 43.15x1.50) соответственно, p < 0.001 для a, p < 0.05 для b), а также по коэффициенту для диаметра фасеток (a = 11.27 и 7.67 соответственно, p < 0.001). Разницу в характеристиках линий регрессии между исследованными мелкими и крупными насекомыми подтверждает сегментированный регрессионный анализ, который также показывает, что длина тела 1.5 мм разграничивает выборки по размеру тела (рис. 3B). Особенно выражена разница между мелкими и крупными видами для исследованных жесткокрылых (число фасеток у мелких 77.44x0.955 (OLS 36.21x0.0077), у крупных 11.27x1.989; диаметр фасеток у мелких 11.27x0.545, у крупных 9.68x0.380; p < 0.001) (рис. 3E, 3F). По числу фасеток аллометрический анализ показывает, что коэффициент у Coleoptera и Lepidoptera достоверно ниже, чем у Hymenoptera и Diptera (a = = 39.54, 33.65, 122.1, 108.3 соответственно, p < 0.001), а показатель у Coleoptera и Hymenoptera достоверно ниже, чем у Lepidoptera и Diptera (b = 1.34, 1.30, 1.69, 1.52 соответственно, p < 0.01). По диаметру фасеток коэффициент у Lepidoptera достоверно ниже, чем у Coleoptera, Hymenoptera и Diptera (a = 6.79, 10.35, 9.66, 9.25 соответственно, p < 0.001) (рис. 3C, 3D).
В рамках масштабирования отдельные омматидии имеют меньшие ограничения по размеру. Это подтверждается тем, что даже в случае экстремальной миниатюризации клеточный состав сложных глаз не меняется (Makarova et al., 2015, 2019). За этими пределами (длина тела более 1 мм) уменьшение размеров тела приводит лишь к уменьшению числа омматидиев. Другими словами, при уменьшении размера тела сперва сокращается число анализаторов, и лишь после определенного предела наблюдаются структурные изменения омматидиев. Это полностью подтверждается данными, полученными в ходе анализа масштабирования сложных глаз жесткокрылых (Makаrova et al., 2019). У жесткокрылых в целом наблюдается достоверное разделение на две выборки с различными линиями регрессии (достоверно различающиеся по аллометрическому показателю) как по числу фасеток, так и по диаметру (число меняется на четыре порядка, диаметр – на один порядок) (рис. 3C, 3D). Границей служат особи с длиной тела в 1.5 мм. Интересно, что в других отрядах такого разделения не наблюдается.
Отдельные морфологические адаптации, связанные с малым размером тела, появляются у насекомых, длина тела которых составляет от 2 до 5 мм (например, смена типичного для таксона суперпозиционного типа глаз на аппозиционный тип у мелких форм пластинчатоусых (Meyer-Rochow, Gál, 2004) и миниатюрных чешуекрылых (Honkanen, Meyer-Rochow, 2009; Fischer et al., 2012, 2014)). В крайних случаях миниатюризации (длина тела менее 500 мкм) наблюдаются клеточные и субклеточные реорганизации, затрагивающие размер и положение клеток и ядер, форму и структуру рабдома, форму и положение пигментных гранул, изменение кривизны линз и др. (Fischer et al., 2010, 2012; Makarova et al., 2015, 2019).
ЗАКЛЮЧЕНИЕ
В первом сообщении обзора рассмотрено влияние размера тела на строение сложных глаз насекомых. Несмотря на то, что число омматидиев в составе сложного глаза демонстрирует положительную корреляцию с размерами тела, их структурная организация характеризуется крайней консервативностью, сохраняя общий план клеточного состава омматидия. В экстремальных случаях миниатюризации обнаруживаются уникальные морфологические адаптации и клеточные редукции, однако некоторые структурные компоненты не меняются, сохраняя свои размеры независимо от размера сложных глаз и тела насекомого.
Список литературы
Беклемишев В.Н., 1952. Основы сравнительной анатомии беспозвоночных. М.: Советская наука. 700 с.
Грибакин Ф.Г., 1981. Механизмы фоторецепции насекомых. Л.: Наука. 213 с.
Грибакин Ф.Г., 1983. Функциональная эволюция фоторецепторов // Руководство по физиологии: Эволюционная физиология. Ч. 2. Л.: Наука. С. 211–228.
Елизаров Ю.А., 1977. Хеморецепция // Руководство по физиологии органов чувств насекомых. М.: МГУ. С. 81–135.
Елизаров Ю.А., 1977а. Терморецепция и гигрорецепция // Руководство по физиологии органов чувств насекомых. М.: МГУ. С. 136–141.
Елизаров Ю.А., 1978. Хеморецепция насекомых. М.: МГУ. 232 с.
Жантиев Р.Д., 1977. Механорецепция // Руководство по физиологии органов чувств насекомых. М.: МГУ. С. 31–48.
Жантиев Р.Д., 1977а. Слух // Руководство по физиологии органов чувств насекомых. М.: МГУ. С. 49–80.
Жантиев Р.Д., 1981. Биоакустика насекомых. М.: МГУ. 256 с.
Заварзин А.А., 1913. Гистологические исследования чувствительной нервной системы и оптических ганглиев насекомого. СПб.: Тип. Стасюлевича. 192 с.
Заварзин А.А., 1941. Очерки по эволюционной гистологии нервной системы. М.- Л.: Медгиз. 379 с.
Иванов В.П., 1969. Ультраструктурная организация хеморецепторов насекомых // Труды Всесоюзного энтомологического общества. Т. 53. С. 301–333.
Иванов В.П., 1978. Электронномикроскопическое исследование мехарецепторных волосков насекомых // Труды Зоологического Института АН СССР. Т. 77. С. 5–15.
Иванов В.П., 2000. Органы чувств насекомых и других членистоногих. М.: Наука. 279 с.
Корнеев П.Н., Чесунов А.В., 2005. Тантулокариды –микроскопические обитатели Белого моря // Природа. № 2. С. 13–18.
Мазохин-Поршняков Г.А., 1965. Зрение насекомых. М.: Наука. 263 с.
Мазохин-Поршняков Г.А. 1980. Зрение и визуальная ориентация насекомых. М.: Знание. 63 с.
Мазохин-Поршняков Г.А., 1983. Руководство по физиологии органов чувств насекомых. М.: МГУ. 261 с.
Мазохин-Поршняков Г.А., Казякина В.И., 1982. Морфология сложных глаз туркестанской эмбии (Embia tartara Sausc.) // Зоологический журнал. Т. 61. С. 455–457.
Мазохин-Поршняков Г.А., Казякина В.И., 1983. Морфологическое описание сложных глаз и теменнных глазков трипсов (Thysanoptera) // Биологичекие науки. Т. 1. С. 57–60.
Макарова А.А., Полилов А.А., 2013. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. I. Мельчайшие жесткокрылые – жуки-перокрылки (Coleoptera, Ptiliidae) // Зоологический журнал. Т. 92. С. 523–533.
Макарова А.А., Полилов А.А., 2013а. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. II. Мельчайшие перепончатокрылые (Нymenoptera, Mymaridae, Trichogrammatidae) // Зоологический журнал. Т. 92. С. 695–706.
Макарова А.А., Полилов А.А., 2017. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. III. Сеноеды (Psocoptera, Liposcelididae) // Зоологический журнал. Т. 96. С. 275–288.
Макарова А.А., Полилов А.А., 2017а. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. IV. Трипсы (Thysanoptera, Thripidae) // Зоологический журнал. Т. 96. С. 410–417.
Макарова А.А., Полилов А.А., 2018. Строение и ультраструктурная организация сложных глаз Acrotrichis grandicollis (Coleoptera: Ptiliidae) и их особенности, связанные с миниатюризацией // Доклады Академии Наук. Т. 480. С. 250–252.
Полилов А.А., 2007. Морфологические особенности Mymaridae связанные с миниатюризацией // Исследования по перепончатокрылым насекомым. М.: Товарищество научных изданий КМК. С. 50–64.
Сильвере А.П., Штейн-Марголина В., 1976. Tetrapodili — четырехногие клещи: Электронномикроскопическая анатомия, проблемы эволюции и взаимоотношения с возбудителями болезней растений. Таллин: Валгус. 165 с.
Францевич Л.И., 1979. Зрение беспозвоночных // Руководство по физиологии: Эволюционная физиология. Ч. 1. Л.: Наука. С. 473–498.
Францевич Л.И., 1980. Зрительный анализ пространства у насекомых. Киев: Наукова думка. 288 с.
Чайка С.Ю., 2010. Нейроморфология насекомых. М.: Типография Россельхозакадемии. 396 с.
Четвериков С.С., 1915. Основной фактор эволюции насекомых // Известия Московского энтомологического общества. Т. 1. С. 15–24.
Шмидт-Ниельсен К., 1987. Размеры животных: почему они так важны. М.: Мир. 259 с.
Altner H., Loftus R., 1985. Ultrastructure and function of insect thermo- and hygroreceptors // Annual Review of Entomology. V. 30. P. 273–295.
Altner H., Prillinger L., 1980. Ultrastructure of invertebrate chemo-, thermo-, and hygroreceptors and its functional significance // International Review of Cytology. V. 67. P. 69–139.
Amoore J.E., Beets M.G.J., Davies J.T., Engen T., Garcia J. et al., 1971. Chemical Senses. 1. Olfaction // Handbook of Sensory Physiology. Beidler L.M. (Ed.). V. 4. Berlin–Heidelberg–New York: Springer-Verlag. 543 p.
Anderson H., 1978. Postembryonic development of the visual system of the locust, Schistocerca gregaria the retina-lamina projection // Journal of Embryology and Experimental Morphology. V. 46. P. 147–170.
Assing V., 2013. New species and records of Lathrobium from China and Nepal (Coleoptera: Staphylinidae: Paederinae) // Linzer Biologische Beiträge. V. 45. P. 1643–1655.
Assing V., 2017. On the Geostiba fauna of Armenia (Coleoptera: Staphylinidae: Aleocharinae) // Linzer Biologische Beiträge. V. 49. P. 1075–1092.
Autrum H., Bennet M.F., Diehn B., Hamdorf K., Heisenberg M. et al., 1979. Invertebrate photoreceptors. Comparative Physiology and Evolution of Vision in Invertebrates // Handbook of sensory physiology. Autrum H. (Ed.). V.7/6/6A. Berlin–Heidelberg: Springer-Verlag. 729 p.
Baker G.T., Ma P.W.K., 2006. Morphology and number of ommatidia in the compound eyes of Solenopsis invicta, Solenopsis richteri, and their hybrid (Hymenoptera: Formicidae) // Zoologischer Anzeiger. V. 245. P. 121–125.
Barlow H.B., 1952. The size of ommatidia in apposition eyes // Journal of Experimental Biology. V. 29. P. 667–674.
Bate C.M., 1978. Development of Sensory Systems // Handbook Sensory Physiology. Jacobson M. (Ed.). V. 9. Berlin–Heidelberg–New York: Springer-Verlag. 469 p.
Bauer T., Kredler M., 1993. Morphology of the compound eyes as an indicator of life-style in carabid beetles // Canadian Journal of Zoology. V. 71. P. 799–810.
Belušič G., Pirih P., Stavenga D.G., 2013. A cute and highly contrast-sensitive superposition eye – the diurnal owlfly Libelloides macaronius // Journal of Experimental Biology. V. 216. P. 2081–2088.
Beutel R.G., Haas A., 1998. Larval head morphology of Hydroscapha natans (Coleoptera, Myxophaga) with reference to miniaturization and the systematic position of Hydroscaphidae // Zoomorphology. V. 118. P. 103–116.
Beutel R.G., Pohl H., Hünefeld F., 2005. Strepsipteran brains and effects of miniaturization (Insecta) // Arthropod Structure & Development. V. 34. P. 301–313.
Bhullar B.A.S., Bell C.J., 2008. Osteoderms of the california legless lizard Anniella (Squamata: Anguidae) and their relevance for considerations of miniaturization // Copeia. V. 2008. № 4. P. 785–793.
Burkhardt D., 1962. Spectral sensitivity and other response characteristics of single visual cells in the arthropod eye // Symposia of the Society for Experimental Biology. V. 16. P. 86–109.
Buschbeck E.K., 2005. The compound lens eye of Strepsiptera: morphological development of larvae and pupae // Arthropod Structure & Development. V. 34. P. 315–326.
Butler R., 1973. The anatomy of the compound eye of Periplaneta americana L. 1. General Features // Journal of Comparative Physiology. V. 83. P. 223–238.
Caveney S., 1986. The phylogenetic significance of ommatidium structure in the compound eyes of polyphagan beetles // Canadian Journal of Zoology. V. 64. № 9. P. 1787–1819.
Caveney S., McIntyre P., 1981. Design of graded-index lenses in the superposition eyes of scarab beetles // Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. V. 294. P. 589–632.
Chapman J.A., 1972. Ommatidia numbers and eyes in scolytid beetles // Annals of the Entomological Society of America. V. 65. P. 550–553.
Chen Q.X., Hua B.Z., 2016. Ultrastructure and morphology of compound eyes of the scorpionfly Panorpa dubia (Insecta: Mecoptera: Panorpidae) // PLOS ONE. V. 11. e0156970.
Clarkson E., Levi-Setti R., Horváth G., 2006. The eyes of trilobites: The oldest preserved visual system // Arthropod Structure & Development. V. 35. P. 247–259.
Danneel R., Zeutschel B., 1957. Uber den Feinbau der Retinula bei Drosophila melanogaster // Zeitschrift für Naturforschung. Bd. 12b. S. 580–583.
Daumer K., 1956. Reizmetrische Untersuchungen des Farbensehens der Bienen // Zeitschrift für vergleichende Physiologie. Bd. 38. S. 413–478.
Del A.A., Mora A.D.R., 2014. A preliminary comparative study on structure and main characteristics of compound eyes in four Mexican cone borers Conophthorus spp. (Coleoptera: Scolytinae) // Arthropods. V. 3. № 3. P. 147–160.
Diakova A.V., Makarova A.A., Polilov A.A., 2018. Between extreme simplification and ideal optimization: antennal sensilla morphology of miniaturized Megaphragma wasps (Hymenoptera: Trichogrammatidae) // PeerJ. V. 6. e6005.
Diakova A.V., Polilov A.A., 2020. Sensation of the tiniest kind: the antennal sensilla of the smallest free-living insect Scydosella musawasensis (Coleoptera: Ptiliidae) // PeerJ. V. 8. e1040.
Dial K.P., 2003. Evolution of avian locomotion: correlates of flight style, locomotor modules, nesting biology, body size, development, and the origin of flapping flight // The Auk. V. 120. P. 941–952.
Döring T.F., Spaethe J., 2009. Measurements of eye size and acuity in Aphids (Hemiptera: Aphididae) // Entomologia Generalis. V. 32. P. 77–84.
Dvořáček J., Sehadova H., Weyda F., Tomčala A., Hejníková M., Kodrík D., 2020. First comprehensive study of a giant among the insects, Titanus giganteus: Basic facts from its biochemistry, physiology, and anatomy // Insects. V. 11. P. 1–22.
Egelhaaf A., Dambach M., 1983. Giant rhabdomes in a specialized region of the compound eye of a cricket: Cycloptiloides canariensis (Insecta, Gryllidae) // Zoomorphology. V. 102. P. 65–77.
Egelhaaf M., Kern R., 2002. Vision in flying insects // Current Opinion in Neurobiology. V. 12. P. 699–706.
Eguchi E., Tominaga Y., 1999. Atlas of Arthropod Receptors–Dynamic Morphology in Relation to Function. Tokyo: Springer Verlag. 220 p.
Exner S., 1891. Die Physiologie der facettirten Augen von Krebsen und Insekten. Leipzig: Franz Deuticke Verlag. 246 s.
Farnier K., Dyer A.G., Taylor G.S., Peters R.A., Steinbauer M.J., 2015. Visual acuity trade-offs and microhabitat-driven adaptation of searching behaviour in psyllids (Hemiptera: Psylloidea: Aphalaridae) // Journal of Experimental Biology. V. 218. P. 1564–1571.
Field L.H., Matheson T., 1998. Chordotonal Organs of Insects // Advances in Insect Physiology. V. 27. Elsevier. 230 p.
Fischer S., Lu Z., Meinertzhagen I.A., 2019. Three-dimensional ultrastructural organization of the ommatidium of the minute parasitoid wasp Trichogramma evanescens // Arthropod Structure & Development. V. 48. P. 35–48.
Fischer S., Müller C.H.G., Meyer-Rochow V.B., 2010. How small can small be: The compound eye of the parasitoid wasp Trichogramma evanescens (Westwood, 1833) (Hymenoptera, Hexapoda), an insect of 0.3- to 0.4-mm total body size // Visual Neuroscience. V. 28. P. 295–308.
Fischer S., Meyer-Rochow V.B., Müller C.H.G., 2012. Challenging limits: Ultrastructure and size-related functional constraints of the compound eye of Stigmella microtheriella (Lepidoptera: Nepticulidae) // Journal of Morphology. V. 273. P. 1064–1078.
Fischer S., Meyer-Rochow V.B., Müller C.H.G., 2014. Compound eye miniaturization in Lepidoptera: A comparative morphological analysis // Acta Zoologica. V. 95. P. 438–464.
Floreano D., Zufferey J.C., 2010. Insect vision: A few tricks to regulate flight altitude // Current Biology. V. 20. P. R847–R849.
Glaw F., Köhler J., Hawlitschek O., Ratsoavina F.M., Rakotoarison A., Scherz M.D., Vences M., 2021. Extreme miniaturization of a new amniote vertebrate and insights into the evolution of genital size in chameleons // Scietific Reports. V. 11, 2522.
Gokan N., 1982. The compound eye of the soybean beetle, Anomala rufocuprea Motschulsky (Coleoptera: Scarabaeidae) // Journal Applied Entomology and Zoology. V. 17. P. 227–237.
Gokan N., Meyer-Rochow V.B., 1984. Fine-structure of the compound eye of the buprestid beetle Curis caloptera (Coleoptera, Buprestidae) // Zeitschrift für mikroskopisch-anatomische Forschung. V. 98. P. 17–35.
Gokan N., Meyer-Rochow V.B., 1990. The compound eye of the dung beetle, Onthophagus posticus (Coleoptera: Scarabaeidae) // New Zealand Entomologist. V. 13. P. 7–15.
Gokan N., Meyer-Rochow V.B., 2000. Morphological comparisons of compound eyes in Scarabaeoidea (Coleoptera) related to the beetles’ daily activity maxima and phylogenetic positions // The Journal of Agricultural Science. V. 45. P. 15–61.
Gokan N., Meyer-Rochow V.B., Nagashima T., 1987. Fine structure of the compound eye of the skin beetle Trox mitis (Coleoptera, Scarabaeidae) // Japanese Journal of Entomology. V. 55. P. 587–600.
Gokan N., Meyer-Rochow V.B., Nakazawa A., Iida K., 1998. Compound eye ultrastructures in six species of ecologically diverse stag-beetles (Coleoptera, Scarabaeoidea, Lucanidae) // Journal Applied Entomology and Zoology. V. 33. P. 157–169.
Gokan N., Nagashima T., Narita R., 1986. Ultrastructure of the compound eyes of the Dynastine Beetles, Allomyrina dichotomus and Eqphileurus chinensis (Coleoptera, Scarabaeidae) // Japanese Journal of Entomology. V. 54. P. 386–395.
Goldsmith T.H., Philpott D.E., 1957. The microstructure of the compound eyes of insects // The Journal of Biophysical and Biochemical Cytology. V. 3. P. 429–440.
Goulet M., Campan R., Lambin M., 1981. The visual perception of relative distances in the wood-cricket, Nemobius sylvestris // Physiological Entomology. V. 6. P. 357–367.
Graham P., Cheng K., 2009. Ants use the panoramic skyline as a visual cue during navigation // Current Biology. V. 19. P. R935–R937.
Grebennikov V.V., 2008. How small you can go: Factors limiting body miniaturization in winged insects with a review of the pantropical genus Discheramocephalus and description of six new species of the smallest beetles (Pterygota: Coleoptera: Ptiliidae) // European Journal of Entomology. V. 105. P. 313–328.
Grebennikov V.V., Beutel R.G., 2002. Morphology of the minute larva of Ptinella tenella, with special reference to effects of miniaturisation and the systematic position of Ptiliidae (Coleoptera: Staphylinoidea) // Arthropod Structure & Development. V. 31. P. 157–172.
Greiner B., Cronin T.W., Ribi W.A., Wcislo W.T., Warrant E.J., 2007. Anatomical and physiological evidence for polarisation vision in the nocturnal bee Megalopta genalis // Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. V. 193. P. 591–600.
Greiner B., Ribi W.A., Warrant E.J., 2004. Retinal and optical adaptations for nocturnal vision in the halictid bee Megalopta genalis // Cell and Tissue Research. V. 316. P. 377–390.
Gronenberg W., 2008. Structure and function of ant (Hymenoptera: Formicidae) brains: strength in numbers // Myrmecological News. V. 11. P. 25–36.
Gronenberg W., Hölldobler B., 1999. Morphologic representation of visual and antennal information in the ant brain // Journal of Comparative Neurology. V. 412. P. 229–240.
Guerenstein P.G., A.Yepez E., van Haren J., Williams D.G., Hildebrand J.G., 2004. Floral CO2 emission may indicate food abundance to nectar-feeding moths // Naturwissenschaften. V. 91. P. 329–333.
Hamdorf K., 1979. The physiology of invertebrate visual pigments // Handbook of Sensory Physiology. Autrum H. (Ed.). V. 7/6A. Berlin–Heidelberg–New York: Springer. P. 145–224.
Hanken J., 1983. Miniaturization and its effects on cranial morphology in plethodontid salamanders, genus Thorius (Amphibia, Plethodontidae): II. The fate of the brain and sense organs and their role in skull morphogenesis and evolution // Journal of Morphology. V. 177. P. 255–268.
Hanken J., Wake D.B., 1993. Miniaturizatio of body size: Organismal consequences and Evolutionary significance // Annual Review of Ecology and Systematics. V. 24. P. 501–519.
Hansson B.S., 1999. Insect Olfaction. Berlin–Heidelberg: Springer. 458 p.
Hansson B.S., Stensmyr M.C., 2011. Evolution of insect olfaction // Neuron. V. 72. P. 698–711.
Hartline H.K., 1928. A quantitative and descriptive study of the electric response to illumination of the Arthropod eye // American Physiological Society. V. 83. P. 466–483.
Hartline H.K., Graham C.H., 1932. Nerve impulses from single receptors in the eye // Journal of Cellular and Comparative Physiology. V. 1. P. 277–295.
Honkanen A., Meyer-Rochow V.B., 2009. The eye of the parthenogenetic and minute moth Ectoedemia argyropeza (Lepidoptera: Nepticulidae) // European Journal of Entomology. V. 106. P. 619–629.
Horridge G.A., 1969. The eye of the firefly Photuris // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 17. P. 445–463.
Horridge G.A., 1975. The Compound Eye and Vision of Insects. Oxford: Clarendon Press. 595 p.
Horridge G.A., Giddings C., Stange G., 1972. The superposition eye of skipper butterflies // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 182. P. 457–495.
Horridge G.A., McLean M., 1978. The dorsal eye of the mayfly Atalophlebia (Ephemeroptera) // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 200. P. 137–150.
Horridge G.A., McLean M., Stange G., Lillywhite P.G., 1977. A diurinal moth superposition eye with high resolution Phalaenoides tristifica // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 196. P. 233–250.
Huber F., Moore E., Loher W., 2019. Cricket Behavior and Neurobiology. Ithaca–London: Cornell University Press. 536 p.
Huber J.T., Noyes J., 2013. A new genus and species of fairyfly, Tinkerbella nana (Hymenoptera, Mymaridae), with comments on its sister genus Kikiki, and discussion on small size limits in arthropods // Journal of Hymenoptera Research. V. 32. P. 17–44.
Huber J.T., 2013. Redescription of Mymarilla Westwood, new synonymies under Cremnomymar Ogloblin (Hymenoptera, Mymaridae) and discussion of unusual wings // Zookeys. V. 345. P. 47–72.
Huber J.T., Fidalgo P., 1997. Review of the genus Stephanodes (Hymenoptera: Mymaridae) // Proceedings of the Entomological Society of Ontario. V. 128. P. 27–63.
Huber J.T., Naiquan L., 1999. World review of the Camptoptera group of genera (Hymenoptera: Mymaridae) // Proceedings of the Entomological Society of Ontario. V. 130. P. 21–65.
Irmler U., 2010. New species of the genera Mimogonus and Mimogonia (Coleoptera: Staphylinidae: Osoriinae) from the Neotropical Region // Acta Entomologica Musei Nationalis Pragae. V. 50. P. 483–494.
Jander U., Jander R., 1994. Numerical allometric growth of the ommatidia, antennal sensilla, and teeth of foretibial combs in the milkweed bug Oncopeltus fasciatus Dallas (Heteroptera: Lygaeidae) // International Journal of Insect Morphology and Embryology. V. 23. P. 329–344.
Jander U., Jander R., 2002. Allometry and resolution of bee eyes (Apoidea) // Arthropod Structure & Development. V. 30. P. 179–193.
Jia L.P., Liang A.P., 2014. An apposition-like compound eye with a layered rhabdom in the small diving beetle Agabus japonicus (Coleoptera, Dytiscidae) // Journal of Morphology. V. 275. P. 1273–1283.
Jia L.P., Liang A.P., 2015. Fine structure of the compound eyes of Callitettix versicolor (Insecta: Hemiptera) // Annals of the Entomological Society of America. V. 108. P. 316–324.
Jia L.P., Liang A.P., 2017. An apposition compound eye adapted for nocturnal vision in the moth midge Clogmia albipunctata (Williston) (Diptera: Psychodidae) // Journal of Insect Physiology. V. 98. P. 188–198.
Keil T., Steinbrecht R.A., 1984. Mechanosensitive and Olfactory Sensilla of Insects // Insect Ultrastructure. King R.C., Akai H. (Eds). Boston: Springer. P. 477–516.
Kirschfeld K., 1967. Die Projektion der optischen Umwelt auf das Raster der Rhabdomere im Komplexauge von Musca // Experimental Brain Research. V. 3. P. 248–270.
Kirschfeld K., Franceschini N., Minke B., 1977. Evidence for a sensitising pigment in fly photoreceptors // Nature. V. 269. P. 386–390.
Krishnan A., Prabhakar S., Sudarsan S., Sane S.P., 2012. The neural mechanisms of antennal positioning in flying moths // Journal of Experimental Biology. V. 215. P. 3096–3105.
Kuster J.E., 1980. Fine structure of the compound eyes and interfacetal mechanoreceptors of Cicindela tranquebarica Herbst (Coleoptera: Cicindelidae) // Cell and Tissue Research. V. 206. P. 123–138.
Kuwabara M., Naka K., 1959. Response ofa single retinula cell to polarized light // Nature. V. 184. P. 455–456.
Labhart T., Meyer E.P., Schenker L., 1992. Specialized ommatidia for polarization vision in the compound eye of cockchafers, Melolontha melolontha (Coleoptera, Scarabaeidae) // Cell and Tissue Research. V. 268. P. 419–429.
Land M.F., 1981. Optics and vision in invertebrates // In Handbook of Sensory Physiology. Autrum H. (Ed.). Vol. 7/6C. Berlin, Germany: Springer Verlag. P. 471–592.
Land M.F., 1997. Visual Acuity in Insects // Annual Review of Entomology. V. 42. P. 147–177.
Land M.F., Gibson G., Horwood J., 1997. Mosquito eye design: conical rhabdoms are matched to wide aperture lenses // Proceedings of the Royal Society B: Biological Sciences. V. 264. P. 1183–1187.
Land M.F., Nilsson D.E., 2012. Animal Eyes. Oxford: Oxford University Press. 288 p.
Lau T.F., Gross E.M., Meyer-Rochow V.B., 2007. Sexual dimorphism and light/dark adaptation in the compound eyes of male and female Acentria ephemerella (Lepidoptera: Pyraloidea: Crambidae) // European Journal of Entomology. V. 104. P. 459–470.
Li Z., Yang P., Peng Y., Yang D., 2009. Ultrastructure of antennal sensilla of female Ceratosolen solmsi marchali (Hymenoptera: Chalcidoidea: Agaonidae: Agaoninae) // The Canadian Entomologist.V. 141. P. 463–477.
Linke R., Roth G., Rottluff B., 1986. Comparative studies on the eye morphology of lungless salamanders, family Plethodontidae, and the effect of miniaturization // Journal of Morphology. V. 189. P. 131–143.
Makarova A.A., Meyer-Rochow V.B., Polilov A.A., 2019. Morphology and scaling of compound eyes in the smallest beetles (Coleoptera: Ptiliidae) // Arthropod Structure & Development. V. 48. P. 83–97.
Makarova A.A., Polilov A.A., Fischer S., 2015. Comparative morphological analysis of compound eye miniaturization in minute hymenoptera // Arthropod Structure & Development. V. 44. P. 21–32.
McIver S.B., 1985. Mechanoreception // Comprehensive insect physiology, biochemistry and pharmacology. Kerkut G.A., Gilbert L.I. (Eds). Oxford: Pergamon Press. P. 71–132.
McLeman M.A., Pratt S.C., Franks N.R., 2002. Navigation using visual landmarks by the ant Leptothorax albipennis // Insectes Sociaux. V. 49. P. 203–208.
Merritt D.J., 2006. The organule concept of insect sense organs: sensory transduction and organule evolution // Advances in Insect Physiology. Simpson S.J. (Ed.). Oxford, U.K.: Academic Press. V. 33. P. 192–241.
Meyer-Rochow V.B., 1972. The eyes of Creophilus erythrocephalus F. and Sartallus signatus sharp (Staphylinidae: Coleoptera) - Light-, interference-, scanning electron- and transmission electron microscope examinations // Zeitschrift für Zellforschung und mikroskopische Anatomie. Bd. 133. S. 59–86.
Meyer-Rochow V.B., 1977. Structure and possible function of the unusual compound eye of Sericesthis geminata (Coleoptera : Scarabaeidae) // New Zealand Natural Sciences. V. 4. P. 21–34.
Meyer-Rochow V.B., 1978. Retina and dioptric apparatus of the dung beetle Euoniticellus africanus // Journal of Insect Physiology. V. 24. P. 165–179.
Meyer-Rochow V.B., 1981. Electrophysiology and histology of the eye of the bumblebee Bombus hortorum (L.) (Hymenoptera: Apidae) // Journal of the Royal Society of New Zealand. V. 11. P. 123–153.
Meyer-Rochow V.B., 2014. Compound eyes of insects and crustaceans: Some examples that show there is still a lot of work left to be done // Insect Science. V. 22. P. 461–481.
Meyer-Rochow V.B., Gál J., 2004. Dimensional limits for arthropod eyes with superposition optics // Vision Research. V. 44. P. 2213–2223.
Meyer-Rochow V.B., Gokan N., 1988. The eye of the tenebrionid Lepispilus sulcicollis (Coleoptera) and some ecophysiological predictions based on eye anatomy // New Zealand Natural Sciences. V. 15. P. 79–89.
Meyer-Rochow V.B., Horridge G.A., 1975. The eye of Anoplognathus (Coleoptera, Scarabaeidae) // Proceedings of the Royal Society B: Biological Sciences. V. 188. № 1090. P. 1–30.
Meyer-Rochow V.B., Keskinen E., 2003. Post-embryonic photoreceptor development and dark/light adaptation in the stick insect Carausius morosus (Phasmida, Phasmatidae) // Applied Entomology and Zoology. V. 38. P. 281–291.
Meyer-Rochow V.B., Lau T.F., 2008. Sexual dimorphism in the compound eye of the moth Operophtera brumata (Lepidoptera, Geometridae) // Invertebrate Biology. V. 127. P. 201–216.
Meyer-Rochow V.B., Mishra M., 2007. Structure and putative function of dark- and light-adapted as well as UV-exposed eyes of the food store pest Psyllipsocus ramburi Sélys-longchamps (Insecta: Psocoptera: Psyllipsocidae) // Journal of Insect Physiology. V. 53. P. 157–169.
Meyer-Rochow V.B., Nilsson H.L., 1999. Compound eyes in polar regions, caves and the deep-sea // Atlas of Arthropod Sensory Receptors. Eguchi E., Tominaga Y. (Eds). Berlin–Tokyo –New York: Springer Verlag. P. 125–142.
Meyer-Rochow V.B., Reid A.W., 1994. Male and Female Eyes of the Antarctic Midge Belgica antarctica (Diptera: Chironomidae) : A Scanning Electron Microscope Study // Applied Entomology and Zoology. V. 29. P. 439–442.
Meyer-Rochow V.B., Reid W.A., 1996. Does age matter in studying the crustacean eye? // Journal of Comparative Physiology B. Biochemical, Systems, and Environmental Physiology. V. 166. P. 319–324.
Meyer-Rochow V.B., Waldvogel H., 1979. Visual behaviour and the structure of dark and light-adapted larval and adult eyes of the New Zealand glowworm Arachnocampa luminosa (Mycetophilidae: Diptera) // Journal of Insect Physiology. V. 25. P. 601–613.
Meyer-Rochow V.B., Yamahama Y., 2019. Consequences of extreme miniaturization: The ultrastructure of the compound eyes of a 0.65 mm long “three-eyed” gall midge (Diptera; Cecidomyiidae) // Entomologie heute. Bd. 31. S. 57–72 .
Michelsen A., Larsen O.N., 1985. Hearing and sound // Comprehensive Insect Physiology, Biochemistry and Pharmacology. Kerkut G. A., Gilbert L. I., (Eds). V. 6. Oxford: Pergamon Press. P. 495–555.
Miller W.H., 1957. Morphology of the ommatidia of the compound eye of Limulus // The Journal of Biophysical and Biochemical Cytology. V. 3. P. 421–428.
Minelli A., Fusco G., 2019. No limits: Breaking constraints in insect miniaturization // Arthropod Structure & Development. V. 48. P. 4–11.
Mishra M., 2013. Eye Ultrastructure Investigation of Scaphidium japonum Reitter (Coleoptera : Staphylinidae: Scaphidiidae) // Journal of Entomology and Zoology Studies. V. 1. P. 8–16.
Mishra M., 2015. An eye ultrastructure investigation of a plant pest Acyrthosiphon pisum (Harris) (Insecta: Hemiptera: Aphididae) // Open Access Insect Physiology. V. 5 P. 41–46.
Mishra M., Meyer-Rochow V.B., 2006. Fine structure of the compound eye of the fungus beetle Neotriplax lewisi (Coleoptera, Cucujiformia, Erotylidae) // Invertebrate Biology. V. 125. P. 265–278.
Mishra M., Meyer-Rochow V.B., 2006a. Eye ultrastructure in the pollen-feeding beetle, Xanthochroa luteipennis (Coleoptera: Cucujiformia: Oedemeridae) // Journal of Electron Microscopy. V. 55. P. 289–300.
Mishra M., Meyer-Rochow V.B., 2008. Fine structural description of the compound eye of the madagascar “hissing cockroach” Gromphadorhina portentosa (Dictyoptera: Blaberidae) // Insect Science. V. 15. P. 179–192.
Moritz G., 1989. Die Ontogenese der Thysanoptera unter besonderer Berücksichtigung des Fransenflüglers Hercinothrips femoralis (O.M. Reuter 1891) 4. Imago-Kopf // Zoologische Jahrbücher für Anatomie. Bd. 118. S. 273– 307.
Nagashima T., Meyer-Rochow V.B., 1995. Ommatidial structure of the adult stonefly, Oyamia lugubris (McLachlan) (Plecoptera: Perlidae) // Japanese Journal of Entomology. V. 63. P. 503–514.
Narendra A., Alkaladi A., Raderschall C.A., Robson S.K.A., Ribi W.A., 2013. Compound eye adaptations for diurnal and nocturnal lifestyle in the intertidal ant, Polyrhachis sokolova // PLOS ONE. V. 8. e76015.
Nieves-Aldrey J.L., Gómez J.F., Askew R.R., 2007. Two new species of Idiomacromerus (Hymenoptera: Torymidae) from the stem gall wasp on Papaver somniferum, with notes on the parasitoid community // Annals of the Entomological Society of America. V. 100. P. 381–389.
Nilsson D.E., 1990. Three unexpected cases of refracting superposition eyes in crustaceans // Journal of Comparative Physiology A. Neuroethology, Sensory, Neural, and Behavioral Physiology. V. 167. P. 71–78.
Niven J.E., Farris S.M., 2012. Miniaturization of nervous systems and neurons // Current Biology. V. 22. P. R323–R329.
Niven J.E., Laughlin S.B., 2008. Energy limitation as a selective pressure on the evolution of sensory systems // Journal of Experimental Biology. V. 211. P. 1792–1804.
Novotny V., Wilson M.R., 1997. Why are there no small species among xylem-sucking insects? // Evolutionary Ecology. V. 11. P. 419–437.
Palavalli-Nettimi R., Narendra A., 2018. Miniaturisation decreases visual navigational competence in ants // Journal of Experimental Biology. V. 221. jeb177238.
Palavalli-Nettimi R., Ogawa Y., Ryan L.A., Hart N.S., Narendra A., 2019. Miniaturisation reduces contrast sensitivity and spatial resolving power in ants // Journal of Experimental Biology. V. 222. jeb203018.
Parker J., 2016. Myrmecophily in beetles (Coleoptera): evolutionary patterns and biological mechanisms // Myrmecological News. V. 22. P. 65–108.
Pereira M.J.R., Rebelo H., Teeling E.C., O’Brien S.J., Mackie I. et al., 2006. Status of the world’s smallest mammal, the bumble-bee bat Craseonycteris thonglongyai, in Myanmar // Oryx. V. 40. P. 456–463.
Perrelet A., 1970. The fine structure of the retina of the honey bee drone – An electron microscopical study // Zeitschrift für Zellforschung und mikroskopische Anatomie. Bd. 108. S. 530–562.
Pirih P., Ilić M., Rudolf J., Arikawa K., Stavenga D.G., Belušič G., 2018. The giant butterfly-moth Paysandisia archon has spectrally rich apposition eyes with unique light-dependent photoreceptor dynamics // Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. V. 204. P. 639–651.
Polilov A.A., 2012. The smallest insects evolve anucleate neurons // Arthropod Structure & Development. V. 41. P. 29–34.
Polilov A.A., 2015. Small Is Beautiful: Features of the Smallest Insects and Limits to Miniaturization // Annual Review of Entomology. V. 60. P. 103–121.
Polilov A.A., 2016. At the Size Limit - Effects of Miniaturization in Insects. Springer. 325 p.
Polilov A.A., Makarova A.A., 2017. The scaling and allometry of organ size associated with miniaturization in insects: A case study for Coleoptera and Hymenoptera // Scientific Reports. V. 7. P. 1–7.
Posnien N., Hopfen C., Hilbrant M., Ramos-Womack M., Murat S. et al., 2012. Evolution of eye morphology and Rhodopsin expression in the Drosophila melanogaster species subgroup // PLOS ONE. V. 7. e37346.
Quesada R., Triana E., Vargas G., Douglass J.K., Seid M.A. et al., 2011. The allometry of CNS size and consequences of miniaturization in orb-weaving and cleptoparasitic spiders // Arthropod Structure & Development. V. 40. P. 521–529.
Ramadan R.H., Abd-El A.M.F., El Ghandour S.S., 2019. Morphological characters of fig wasps (Hymenoptera: Chalcidoidea) associated with Ficus nitida (Moraceae) in Qalyubia Governorate, Egypt // Journal of Basic and Environmental Sciences. V. 6. P. 243–256.
Ramirez-Esquivel F., Leitner N.E., Zeil J., Narendra A., 2017. The sensory arrays of the ant, Temnothorax rugatulus // Arthropod Structure & Development. V. 46. P. 552–563.
Ramirez-Esquivel F., Zeil J., Narendra A., 2014. The antennal sensory array of the nocturnal bull ant Myrmecia pyriformis // Arthropod Structure & Development. V. 43. P. 543–558.
Reid S.F., Narendra A., Hemmi J.M., Zeil J., 2011. Polarised skylight and the landmark panorama provide night-active bull ants with compass information during route following // Journal of Experimental Biology. V. 214. P. 363–370.
Rensch B., 1948. Histological changes correlated with evolutionary changes of body size // Evolution. V. 2. P. 218–230.
Rensch B., 1959. Trends towards progress of brains and sense organs // Cold Spring Harbor Symposia on Quantitative Biology. V. 24. P. 291–303.
Ribi W.A., 1975. The first optic ganglion of the bee. I. Correlation between visual cell types and their terminals in the lamina and medulla // Cell and Tissue Research. V. 165. P. 103–111.
Rittmeyer E.N., Allison A., Gründler M.C., Thompson D.K., Austin C.C., 2012. Ecological guild evolution and the discovery of the world’s smallest vertebrate // PLOS ONE. V. 7. e29797.
Rossi S.M.V., Romani R., 2013. The Johnston’s organ of three homopteran species: A comparative ultrastructural study // Arthropod Structure & Development. V. 42. P. 219–228.
Roth G., Rottluff B., Grunwald W., Hanken J., Linke R., 1990. Miniaturization in plethodontid salamanders (Caudata: Plethodontidae) and its consequences for the brain and visual system // Biological Journal of the Linnean Society. V. 40. P. 165–190.
Rutowski R.L., Gislén L., Warrant E.J., 2009. Visual acuity and sensitivity increase allometrically with body size in butterflies // Arthropod Structure & Development. V. 38. P. 91–100.
Ryan M.F., 2002. Insect Chemoreception: Fundamental and Applied. Dordrecht, The Netherlands: Kluwer Academic Publishers. 330 p.
Satô S., 1953. Structure and development of the compound eye of Aedes (Finlaya) japonicus Theobald // The Science Report of Tohoku University Series. V. 4. № 20. P. 33–44.
Satô S., 1953a. Structure and development of the compound eye of Anopheles hyrcanus sinensis Wiedemann // The Science Report of Tohoku University Series. V. 4. № 20. P. 46–53.
Satô S., 1957. On the dimensional characters of the compound eye of Culex pipiens var. pallens Coquillett // The Science Report of Tohoku University Series. V. 4. № 23. P. 83–90.
Satô S., 1959. Structure and development of the compound eye of Culex (Lutzia) vorax Edwards // The Science Report of Tohoku University Series. V. 4. № 25. P. 99–110.
Satô S., 1960. Structure and development of the compound eye of Armigeres (Armigeres) subalbatus (Coquillett) // The Science Report of Tohoku University Series. V. 4. № 6. P. 227–238.
Satô S., 1961. Structure and development of the compound eye of Megarhinus towadensis Matsumura // The Science Report of Tohoku University Series. V. 4. № 27. P. 7–18.
Schoenemann B., Pärnaste H., Clarkson E.N.K., 2017. Structure and function of a compound eye, more than half a billion years old // Proceedings of the National Academy of Sciences. V. 114. P. 13489–13494.
Schomann A., Afflerbach K., Betz O., 2008. Predatory behaviour of some Central European pselaphine beetles (Coleoptera: Staphylinidae: Pselaphinae) with descriptions of relevant morphological features of their heads // European Journal of Entomology. V. 105. P. 889–907.
Schwarz S., Narendra A., Zeil J., 2011. The properties of the visual system in the Australian desert ant Melophorus bagoti // Arthropod Structure & Development. V. 40. P. 128–134.
Shaw S. R., 1969. Sense-cell structure and interspecies comparisons of polarized light absorption in arthropod compound eyes // Vision Research. V. 9. P. 1031–1041.
Shelton P.M.J., Lawrence P.A., 1974. Structure and development of ommatidia in Oncopeltus fasciatus // Journal of Embryology and Experimental Morphology. V. 32. P. 337–353.
Sherk T.E., 1978. Development of the compound eyes of dragonflies (Odonata). III. Adult compound eyes // Journal of Experimental Zoology. V. 203. P. 61–80.
Singh S.P., Mohan L., 2013. Variations in the ommatidia and compound eyes of three species of mosquito vectors // Journal of Entomology and Zoology Studies. V. 1. P. 16–21.
Skrzipek K.H., Skrzipek H., 1971. Die Morphologie der Bienenretina (Apis mellifica L.) in elektronenmikroskopischer und lichtmikroskopischer Sicht // Zeitschrift für Zellforschung und mikroskopische Anatomie. Bd. 119. S. 552–576.
Skrzipek K.H., Skrzipek H., 1974. The ninth retinula cell in the ommatidium of the worker honey bee (Apis mellifica L.) // Zeitschrift für Zellforschung. Bd. 147. S. 589–593.
Slifer E.H., 1961. The fine structure of insect sense organs // International Review of Cytology. V. 11. P. 125–159.
Snodgrass R.E., 1926. The morphology of insect sense organs and the sensory nervous system // Smithsonian miscellaneous collections. V. 77. P. 1–80.
Snyder A.W., 1979. Physics of vision in compound eyes // Comparative Physiology and Evolution of Vision in Invertebrates. A: Invertebrate Photoreceptors. Autrum H. (Ed.). Berlin: Springer Verlag. V. 7/6A. P. 225–313.
Snyder A.W., Menzel R., 1975. Photoreceptor Optics. Berlin–Heidelberg–New York: Springer Verlag. 526 p.
Snyder A.W., Menzel R., Laughlin S.B., 1973. Structure and function of the fused rhabdom // Journal of Comparative Physiology. V. 87. № 2. P. 99–135.
Somanathan H., Borges R.M., Warrant E.J., Kelber A., 2017. Visual adaptations for mate detection in the male carpenter bee Xylocopa tenuiscapa // PLOS ONE. V. 12. e0168452.
Srinivasan M.V., Poteser M., Kral K., 1999. Motion detection in insect orientation and navigation. Vision Research. V. 39. P. 2749–2766.
Stavenga D.G., 1975. Derivation of photochrome absorption spectra from absorbance difference measurements // Photochemistry and Photobiology. V. 21. P. 105–110.
Stavenga D.G., 2003. Angular and spectral sensitivity of fly photoreceptors. II. Dependence on facet lens F-number and rhabdomere type in Drosophila // Journal of Comparative Physiology A. Neuroethology, Sensory, Neural, and Behavioral Physiology. V. 189. P. 189–202.
Stavenga D.G., Hardie R.C., 1989. Facets of Vision. Berlin–Heidelberg: Springer-Verlag. 454 p.
Streinzer M., Brockman, A., Nagaraja N., Spaethe J., 2013. Sex and Caste-Specific Variation in Compound Eye Morphology of Five Honeybee Species // PLOS ONE. V. 8. P. 1–9.
Streinzer M., Huber W., Spaethe J., 2016. Body size limits dim-light foraging activity in stingless bees (Apidae: Meliponini) // Journal of Comparative Physiology A. Neuroethology, Sensory, Neural, and Behavioral Physiology. V. 202. P. 643–655.
Stürzl W., Zeil J., Boeddeker N., Hemmi J.M., 2016. How wasps acquire and use views for homing // Current Biology. V. 26. P. 470–482.
Sukontason K.L., Chaiwong T., Piangjai S., Upakut S., Moophayak K., Sukontason K., 2008. Ommatidia of blow fly, house fly, and flesh fly: Implication of their vision efficiency // Parasitology Research. V. 103. P. 123–131.
Talarico F., Brandmayr P., Giglio A., Massolo A., Zetto Brandmayr T., 2011. Morphometry of eyes, antennae and wings in three species of Siagona (Coleoptera, Carabidae) // ZooKeys. V. 100. P. 203–214.
Tibbetts E.A., 2002. Visual signals of individual identity in the wasp Polistes fuscatus // Proceedings of the Royal Society B: Biological Sciences. V. 269. P. 1423–1428.
van der Woude E., Smid H.M., 2016. How to escape from Haller’s rule: Olfactory system complexity in small and large Trichogramma evanescens parasitic wasps // Journal of Comparative Neurology. V. 524. P. 1876–1891.
Varela F.G., Porter K., 1969. Fine structure of the visual system of the honeybee (Apis mellifera). I. The retina // Journal of Ultrastructure Research. V. 29. P. 236–259.
Vilhelmsen L., 2011. Head capsule characters in the hymenoptera and their phylogenetic implications // Zookeys. V. 130. P. 343–361.
Voelkel R., 2015 Biomimetic Vision Systems // Biologically Inspired Computer Vision: Fundamentals and Applications. Weinheim: Wiley-VCH. 480 p.
Vogt K., 1983. Is the fly visual pigment a rhodopsin? // Zeitschrift für Naturforschung C: A Journal of Biosciences. V. 38. P. 329–333.
von Frisch K., 1914. Der Farbensinn und Formensinn der Biene // Physiological and Biochemical Zoology. V. 37. P. 1–238.
von Frisch K., 1949. Die Polarisation des Himmelslichtes als orientierender Faktor bei den Tanzen der Bienen // Experientia. V. 5. P. 142–148.
Wada S., 1974. Spezielle randzonale ommatidien von Calliphora erythrocephala Meig. (Diptera: Calliphoridae) Architektur der zentralen rhabdomeren-kolumne und topographie im komplexauge // International Journal of Insect Morphology and Embryology. V. 3. P. 397–424.
Warrant E., Bartsch K., Günther C., 1999. Physiological optics in the hummingbird hawkmoth: A compound eye without ommatidia // Journal of Experimental Biology. V. 202. P. 497–511.
Warrant E., Nilsson D.E., 2006. Invertebrate Vision. Cambridge: Cambridge University Press. 570 p.
Warrant E.J., McIntyre P.D., 1993. Arthropod eye design and the physical limits to spatial resolving power // Progress in Neurobiology. V. 40. P. 413–461.
Warton D.I., Wright I.J., Falster D.S., Westoby M., 2006. A review of bivariate line-fitting methods for allometry // Biological Reviews. V. 81. P. 259–291.
Wigglesworth V.B., 1972. Sense Organs: Mechanical and Chemical Sense // The Principles of Insect Physiology. V. 8. Netherlands: Springer. 827 p.
Williams D.S., 1980. Organisation of the compound eye of a tipulid fly during the day and night // Zoomorphologie. V. 95. P. 85–104.
Willis M.A., Avondet J.L., Zheng E., 2011. The role of vision in odor-plume tracking by walking and flying insects // Journal of Experimental Biology. V. 214. P. 4121–4132.
Wolburg-Buchholz K., 1977. The superposition eye of Cloeon dipterum: The organization of the lamina ganglionaris // Cell and Tissue Research. V. 177. P. 9–28.
Yack J.E., 2004. The structure and function of auditory chordotonal organs in insects // Microscopy Research and Technique. V. 63. P. 315–337.
Yack J.E., Johnson S.E., Brown S.G., Warrant E.J., 2007. The eyes of Macrosoma sp. (Lepidoptera: Hedyloidea): A nocturnal butterfly with superposition optics // Arthropod Structure & Development. V. 36. P. 11–22.
Yagi N., Koyama N., 1963. The Compound Eye of Lepidoptera: Approach from Organic Evolution. Tokyo: Shinkyo Press. 319 p.
Yang I.F., Lin J.T., Wu C.Y., 1998. Fine structure of the compound eye of Mallada basalis (Neuroptera: Chrysopidae) // Annals of the Entomological Society of America. V. 91. P. 113–121.
Yang Q., Kučerová Z., Li Z., Kalinović I., Stejskal V. et al., 2012. Diagnosis of Liposcelis entomophila (Insecta: Psocodea: Liposcelididae) based on morphological characteristics and DNA barcodes // Journal of Stored Products Research. V. 48. P. 120–125.
Yefremova Z., González-Santarosa G., Lomeli-Flores J.R., Bautista-Martínez N., 2014. A new species of Tamarixia Mercet (Hymenoptera, Eulophidae), parasitoid of Trioza aguacate Hollis & Martin (Hemiptera, Triozidae) in Mexico // Zookeys. V. 368. P. 23–35.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


