Зоологический журнал, 2022, T. 101, № 4, стр. 461-470
Преодоление водных преград мелкими млекопитающими лесной зоны (количественные характеристики)
А. А. Калинин *
Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: benguan@yandex.ru
Поступила в редакцию 19.01.2021
После доработки 26.03.2021
Принята к публикации 26.03.2021
- EDN: WDMKLZ
- DOI: 10.31857/S0044513422020040
Аннотация
Способность мелких млекопитающих лесной зоны к преодолению водных преград была исследована на западном макросклоне Северного Урала в верхнем течении р. Илыч (ширина реки 80 м). В августе 2013–2020 годов проводили учеты ловушками, установленными на плотиках в 15–25 м от берега. Всего отловлено 100 экз. мелких млекопитающих 10 видов. На воде зафиксирован практически полный состав мелких млекопитающих данного региона за исключением редких видов. Получены количественные характеристики расселения, проведено сравнение с численностью на открытом берегу и в массиве леса. Количество плывущих мелких млекопитающих составило в среднем 11.3 особи на 1 км береговой линии в сутки. Количество зверьков, пересекающих водные преграды, зависит от общего уровня нерезидентной активности в популяции. У разных видов реакция избегания открытой воды разная, что приводит к изменению соотношения видов на воде и на берегу. Обсуждаются риски, связанные с форсированием водных преград. Показано, что даже крупные реки не являются непреодолимым барьером и способность мелких млекопитающих преодолевать водные преграды может обеспечивать эффективный обмен особями между двумя берегами.
Расселение (dispersal) является важнейшим фактором, обеспечивающим жизнеспособность популяций в гетерогенной среде (Lidicker, 1999). За счет расселения осуществляются перераспределение особей в пространстве и освоение всей доступной территории. Во фрагментированных ландшафтах значительную экологическую роль играют различные барьеры, формирующие пространственные связи между элементами ландшафта (Clobert et al., 2009; Cote et al., 2017). При этом роль как физических, так и экологических барьеров неоднозначна. Они могут ограничивать расселение, что не позволяет видам заселять все пригодные местообитания и приводит к усилению изоляции между популяциями. С другой стороны, барьеры могут играть роль своеобразных экологических коридоров, перенаправляя поток расселяющихся зверьков между различными участками. Расселение – один из основных механизмов, влияющих на экологические и эволюционные процессы, но количественных эмпирических данных, к сожалению, недостаточно (Whitmee, Orme, 2013). Несмотря на большое количество теоретических исследований, все еще делаются упрощенные предположения относительно процесса расселения. Технические трудности не позволяют детально изучить расселение для многих видов, однако включение нереалистичных предположений о расселении в пространственных популяционных моделях может привести к неточным и дорогостоящим прогнозам (Bowler, Benton, 2005). Имеющихся эмпирических данных явно недостаточно, и теория далеко обогнала практику. В настоящее время слишком много теорий остаются не обеспеченными доказательствами (Lambin et al., 2012).
Животных, находящихся на территории своего домашнего участка, обычно рассматривают как оседлых, или “резидентов”, противопоставляя их особям, которые находятся по тем или иным причинам за пределами домашнего участка или не имеют его и которых было предложено объединить под общим понятием «нерезиденты» (Щипанов, Купцов, 2004). Существует несколько видов тесно связанных между собой вариантов перемещений: кочевой образ жизни, исследования ближайших территорий (краткосрочные экскурсии), сдвиги участков и собственно расселение. Обычно расселение определяют как движение особи от места рождения к месту воспроизводства (натальное расселение) или движение между последовательными местами воспроизводства (расселение после размножения или смена участка) (Greenwood, 1980; Matthysen, 2005). Таким образом, говоря о “нерезидентах”, мы имеем в виду любую особь, находящуюся за пределами своего домашнего участка, а под термином “расселение” подразумеваем именно переселенцев (dispersers), находящихся в процессе поиска или смены участка.
О способности мелких млекопитающих преодолевать в процессе расселения различные средовые барьеры, такие как дороги, железнодорожные насыпи или водные преграды, обычно судят по конечному результату, сравнивая выборки с разных сторон барьеров. Такие исследования проводили с помощью индивидуального мечения (Savidge, 1973; McGregor et al., 2008; Bohdal et al., 2016), массового мечения красителями (Brehme et al., 2013) или тетрациклином (Толкачёв, 2016). Во многих работах влияние барьеров оценивается при анализе генетической структуры популяций (Aars et al., 1998; Gerlach, Musolf, 2000; Kozakiewicz et al., 2009; Rico et al., 2009; Ćosić et al., 2013; Brunke et al., 2019). Ряд работ посвящен роли барьеров, в том числе и водных, при формировании границ между различными хромосомными расами обыкновенной бурозубки (Moulin et al., 1996; Narain, Fredga, 1996; Wierzbicki et al., 2011; Щипанов и др., 2019; Fedyk et al., 2019). В этих работах показано, что не всегда барьеры являются абсолютно изолирующим фактором, и они могут регулярно преодолеваться мелкими млекопитающими. Оценивая распределение млекопитающих на островах, в разной степени удаленных от берега и друг от друга, была показана их способность преодолевать значительные водные пространства (Hanski, 1986; Lomolino, 1988, 1993).
Имеющиеся данные показывают, что мелкие млекопитающие способны преодолевать водные препятствия, но отсутствуют количественные показатели этого процесса. Ранее была предложена методика количественного учета мелких млекопитающих, форсирующих водные преграды (Калинин, Куприянова, 2015). Задачи данной работы – получение количественных характеристик пересечения водных преград мелкими млекопитающими лесной зоны, анализ многолетней динамики и выявление состава расселяющихся зверьков при форсировании водных барьеров.
МАТЕРИАЛ И МЕТОДЫ
Материал собран в верхнем течении р. Илыч в Печоро-Илычском государственном природном биосферном заповеднике на участке между впадением притоков Большая Ляга и Укью (62.6° с.ш., 58.9° в.д.) в августе 2013–2020 гг. Ширина реки в месте проведения работ составляла около 80 м. Была использована методика, описанная ранее (Калинин, Куприянова, 2015), но с изменениями. При учетах на воде ловушки устанавливали на плотиках (рис. 1), изготовленных из различных материалов: досок, связанных жердей или пенопропилена (ширина полосы 60 мм, толщина 8 мм). При изготовлении плотиков из пенопропилена на концах закреплялись обрезки досок 0.5 м для предотвращения переворачивания ветром. Длина плотиков составляла 3–5 м. Плотики выставляли в линию на расстоянии 15–25 м от берега. В качестве ловчих устройств использовали беспружинные живоловки с проволочным трапиком (Щипанов, 1986), хорошо зарекомендовавшие себя при учетах широкого спектра видов мелких млекопитающих, в том числе землероек (Щипанов и др., 2008). Ловушки устанавливали с двух концов плотика. Использование давилок (малые металлические ловушки Геро с трапиком), даже после того как их поместили в корпуса, аналогичные корпусу живоловки, показало их низкую эффективность. При параллельном использовании живоловок и давилок, с помощью живоловок было отловлено 47 особей различных видов, а в давилки – только 9. Материал плотика и расположение ловушки (сверху или снизу по течению) не влияли на эффективность учетов.
Ранее в эксперименте было показано (Калинин, Куприянова, 2015), что плавающие доски и жерди не отпугивают, но и специально не привлекают плывущих зверьков. Случайно наткнувшись на плотик, зверьки вылезают на него, некоторое время обследуют плотик и заходят в ловушку, которая, скорее всего, привлекает их в качестве убежища. За единицу учета принимали суммарную длину всех ловчих устройств (плотиков), умноженную на время учета, рассчитывали количество особей на 1 км за сутки. Всего за 8 лет отработано 1495 плотико-суток, отловлено100 особей мелких млекопитающих 10 видов.
При падении уровня воды вдоль берега появляются каменистые пляжи шириной 1–5 м. Такие пляжи открываются только при низком уровне воды в реке и существуют непродолжительное время. Выше, до опушки леса, идет травянистый склон 5–10 м, периодически, во время половодья, заливаемый водой. На пляжах нет постоянного населения, но часть зверьков, перемещающихся внутри лесного массива, может покидать его, пересекать травяной склон и выходить на открытые пляжи. Сюда попадают только расселяющиеся особи (one way extra home range movements) – дальние переселенцы (Stenseth, Lidicker, 1992). Для сравнения численности и состава расселяющихся зверьков на берегу и на воде проведены учеты на каменистых пляжах вдоль уреза воды.
Ловушки выставляли в линию через 5 или 7.5 м, по урезу воды вблизи места проведения учетов на воде. Эти живоловки были аналогичны живоловкам, установленным на плотиках. Учеты проводили только в годы с низким уровнем воды, когда прибрежный пляж был хорошо выражен (2013, 2016, 2017, 2018 и 2020 гг.). Для количественного сравнения результаты учетов по берегу рассчитывали в тех же единицах что и на воде – число особей на 1 км береговой линии за сутки, принимая за единицу учета длину учетной линии и относя количество пойманных зверей к общей длине учетных линий. Предполагается, что, попадая на границу суша–вода, зверьки некоторое время передвигаются вдоль берега (т.е. вдоль линии учета), и результат учета по урезу воды отражает общее количество зверьков, попадающих на учетную линию. Всего отработано 650 ловушко-суток, отловлено 149 зверьков 10 видов.
Для характеристики видового состава мелких млекопитающих внутри лесного массива использовали данные учетов в ловчие канавки. Считается, что учеты в канавки наиболее полно отражают состав мелких млекопитающих данного региона (Шефтель, 2018). Показано, что ловчие канавки ловят преимущественно нерезидентное население (Наумов, 1955; Щипанов и др., 2003) и динамика отловов в канавки отражает общую динамику нерезидентной активности различных видов (Калинин, 2012). Обычно численность в канавках приводят в расчете на цилиндро-сутки. Чтобы получить сопоставимые с другими учетами данные, мы проводили расчет численности как количество отловленных зверьков на общую длину канавок за сутки с перерасчетом на 1 км. Предполагается, что при попадании в канавку зверьки не пересекают ее, а двигаются вдоль канавки. Подобные расчеты ранее проводили для сравнения уловистости в канавки с показателями нерезидентной активности, полученными на линиях живоловок (Щипанов, 2021).
Для наиболее полного охвата фауны данного региона приводим результаты учетов в ловчие канавки за весь срок работы (2004–2020 гг.). Учеты в канавки так же как и учеты на воде проводили в августе, канавки располагались в лесном массиве в пределах 0.3–2 км от линий учета на воде. Всего использовано 4 канавки по 50 м с 5 цилиндрами, отработано 780 канавко-суток, отловлено 6804 особи мелких млекопитающих 14 видов.
При сравнении данных по численности и качественному составу мелких млекопитающих, полученных разными методами, использовали результаты учетов только за годы, когда учеты проводились параллельно. Для получения сравнимых результатов все расчеты численности проводили с учетом линейного размера облавливаемой территории, за единицу учета принято количество особей на 1 км за сутки. При учете на воде это длина всех ловчих плотиков, при учете в ловчие канавки использована общая длина канавок, а при учете на берегу длина учетной линии.
Для оценки способности плывущих зверьков ориентироваться на ближайший берег были проведены эксперименты по методике, использованной ранее при изучении реакций зверьков на плотики (Калинин, Куприянова, 2015). Зверьков в отсаднике без дна помещали на деревянный плотик со сторонами 20 см, выдерживали в течение 10 мин, после чего отсадник убирали. Наблюдатель находился в 4 м от плотика, при этом каждый раз менял место наблюдения. После выпуска зверьки самостоятельно спускались в воду и выбирали направление движения. Плотик располагался в 15 м от берега при ширине реки около 80 м. Фиксировали траекторию движения зверька и направление движения – к ближайшему берегу или от него (35 экспериментов).
РЕЗУЛЬТАТЫ
Видовой состав при учетах на воде. При учетах на воде зарегистрирован широкий спектр видов мелких млекопитающих, включающий как грызунов, так и насекомоядных. Всего за 8 лет работы было отловлено 100 экз. мелких млекопитающих 10 видов (табл. 1). Отмечено 4 вида землероек-бурозубок, 3 вида лесных полевок, 2 вида серых полевок и лесной лемминг. Наиболее массовым видом среди землероек была обыкновенная бурозубка (9% в отловах), а среди грызунов красная полевка (27%), красно-серая полевка (25%) и лесной лемминг (27%). Для сравнения приводим результаты учетов в ловчие канавки за весь срок их работы (табл. 1). Всего при учетах в ловчие канавки отмечено 14 видов. Все виды мелких млекопитающих, обнаруженные при учете на воде, так же отловлены в ловчие канавки. На воде отмечены не только массовые виды, но и достаточно редкие. У всех не зафиксированных на воде видов (крошечная бурозубка, тундряная бурозубка, обыкновенная кутора, лесная мышовка) доля улова в канавках составила менее 1%. Некоторые другие редкие виды (доля в учетах которых в канавках также менее 1%), такие как малая бурозубка и полевка экономка, все же отмечены при учетах на воде в единичных экземплярах. Таким образом, на воде, несмотря на ограниченную выборку, зафиксирован практически полный состав мелких млекопитающих данного региона.
Таблица 1.
Количество отловленных особей (n), средние показатели обилия (особей на 1 км в сутки) и доли (%) мелких млекопитающих при учетах ловчими канавками в массиве леса (лес), линиями ловушек на берегу по урезу воды (берег) и на воде ловушками на плотиках в 15–25 м от берега (вода)
| Вид | Лес | Берег | Вода | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | обилие | % | n | обилие | % | n | обилие | % | |
| Бурозубка обыкновенная (Sorex araneus L. 1758) |
1925 | 49.4 | 28.3 | 28 | 8.0 | 18.8 | 9 | 1.1 | 9.0 |
| Бурозубка средняя (Sorex caecutiens Laxmann 1788) |
1254 | 32.2 | 18.4 | 49 | 14.0 | 32.9 | 4 | 0.5 | 4.0 |
| Бурозубка малая (Sorex minutus L. 1766) |
64 | 1,6 | 0,9 | 5 | 1.4 | 3.4 | 2 | 0.3 | 2.0 |
| Бурозубка равнозубая (Sorex isodon Turuv 1924) |
171 | 4.4 | 2.5 | 7 | 2.0 | 4.7 | 2 | 0.3 | 2.0 |
| Бурозубка крошечная (Sorex minutissimus Zimmermann 1780) |
8 | 0.2 | 0.1 | 0 | 0.0 | 0.0 | 0 | 0.0 | 0.0 |
| Бурозубка тундряная (Sorex tundrensis Merriam 1900) |
18 | 0.4 | 0.3 | 0 | 0.0 | 0.0 | 0 | 0.0 | 0.0 |
| Кутора обыкновенная (Neomys fodiens Pennant 1771) |
9 | 0.2 | 0.1 | 2 | 0.6 | 1.3 | 0 | 0.0 | 0.0 |
| Полевка красная (Myodess rutilus Pallas 1779) |
1530 | 39.2 | 22.5 | 32 | 9.1 | 21.5 | 27 | 3.3 | 27.0 |
| Полевка рыжая (Myodes glareolus Schreber 1780) |
302 | 7.8 | 4.4 | 8 | 2.3 | 5.4 | 2 | 0.3 | 2.0 |
| Полевка красно-серая (Myodes rufocanus Sundevall 1846) |
352 | 9 | 5.2 | 12 | 3.4 | 8.1 | 25 | 3.1 | 25.0 |
| Полёвка тёмная (Microtus agrestis L. 1761) |
151 | 3.8 | 2.2 | 0 | 0.0 | 0.0 | 1 | 0.1 | 1.0 |
| Полевка экономка (Microtus oeconomus Pallas 1776) |
50 | 1.2 | 0.7 | 2 | 0.6 | 1.3 | 1 | 0.1 | 1.0 |
| Мышовка лесная (Sicista betulina Pallas 1779) |
47 | 1.2 | 0.7 | 0 | 0.0 | 0.0 | 0 | 0.0 | 0.0 |
| Лемминг лесной (Myopus schisticolor Lilljeborg 1844) |
873 | 22.4 | 12.8 | 4 | 1.1 | 2.7 | 27 | 3.3 | 27.0 |
| Всего | 6804 | 174.6 | 100 | 149 | 42.6 | 100 | 100 | 12.3 | 100 |
При учетах на воде отловлено значительное количество взрослых, способных к размножению зверьков. В том числе отмечены взрослый самец лесного лемминга, взрослая самка красно-серой полевки, 2 взрослые самки красной полевки (1 беременная), взрослый самец рыжей полевки, 4 взрослые перезимовавшие самки (1 беременная) и 1 самец обыкновенной бурозубки, 1 самка средней бурозубки.
Количественная оценка и динамика численности. Количество зверьков, переплывающих реку, менялось по годам значительно (рис. 2). Наибольшее количество было отмечено в 2013 г., когда их численность составила 26.7 особей на 1 км за сутки, а наименьшее количество отмечено в 2012 г. – всего 2.2 особи. Менялся и состав зверьков, переплывающих реку. Поскольку материал, собранный при учетах на воде, весьма ограничен (всего 100 экз. за 8 лет) и отдельные виды представлены единичными экземплярами, то дальнейшее сравнение проводили для двух экологических групп – землеройки бурозубки (Sorex) и лесные полевки (Myodes). Например, в 2020 г. при общей численности мелких млекопитающих 15.4 особей на 1 км за сутки доля землероек составила 36.8%, а в 2017 г. при численности 20.0 особей доля землероек всего 3.6%. В годы с очень малым общим количеством зверьков, отмеченных на воде, землеройки вообще не фиксировались. В среднем за 8 лет на воде отлавливали 11.3 зверька на 1 км в сутки (всех видов). Наиболее массовым видом среди землероек была обыкновенная бурозубка – 1.1, а среди грызунов красная полевка – 3.3 особи в сутки на 1 км (табл. 1). Необходимо отметить, что результаты учетов на воде могут быть несколько занижены. Некоторая часть зверьков, вылезая на плотики, могут не попасть в ловушку, а продолжать движение. В отдельных случаях на плотиках обнаруживался помет зверьков, но в ловушки они не попадали.
Рис. 2.
Динамика интенсивности форсирования водных преград разными видами (особей на 1 км в сутки): 1 – землеройки бурозубки, 2 – лесные полевки, 3 – лесной лемминг, 4 – прочие виды.

Сравнение количества расселяющихся особей на воде с другими показателями нерезидентной активности. Преодоление водных преград может служить хорошим показателем уровня расселения в популяциях мелких млекопитающих. Другим показателем расселения может служить количество мелких млекопитающих, попадающих на берег, на открытые пляжи вдоль уреза воды, на таких пляжах встречаются только зверьки во время расселения. Общий уровень нерезидентной активности в лесном массиве оценивался по данным учета ловчими канавками, расположенными на удалении от берега. При расчетах показателей численности использованы данные за 2013–2020 гг., когда проводили все три варианта учетов.
Поскольку показатели численности во всех случаях выражены в одних единицах, можно провести сравнение уровня нерезидентной активности внутри массива леса, на открытом берегу, куда попадают зверьки, пересекшие опушку леса и полосу травянистой растительности на склоне, и результаты учетов на воде. Среднее количество особей рассчитывали только за годы, когда все учеты работали одновременно. Если при учетах на воде общее количество мелких млекопитающих составило 16.2 особи на 1 км за сутки, то на берегу по урезу воды – 39.4 особи, а в массиве леса при учете канавками – 165.3 особи. Сходные цифры получены и при использовании всего объема материала (табл. 1). Такая закономерность прослеживается в целом для всех видов. Необходимо учитывать, что на берегу и на воде мы отлавливаем только расселяющихся особей – дальних переселенцев, в то время как канавки фиксируют все случаи нерезидентности, включая временные ознакомительные выходы со своих домашних участков, и некоторое количество оседлых особей. Во всех трех случаях использованы разные методы учета с разной разрешающей способностью, тем не менее, зная количество зверьков, попадающих на линию учета, можно оценить порядок величины их численности. По сравнению с количеством зверьков, отмечаемых на воде, на берегу отмечается в 2–4 раза больше мелких млекопитающих, а внутри массива леса – в 10–12 раз больше. Таким образом, на берег попадают только наиболее мотивированные особи, дальние переселенцы, которые способны пересечь открытые, обычно избегаемые лесными видами территории. Такие зверьки концентрируются на берегу, по урезу воды, но только часть из них попадает в воду, а значительная часть избегает воды и возвращается в лесной массив. При этом перемещения мелких млекопитающих по берегу и попадание их в воду происходили только в темное время суток.
Для сравнения динамики уровня нерезидентной активности в разные годы в лесу, на берегу и на воде проведен корреляционный анализ. Поскольку при учетах на воде количество отловленных экземпляров для каждого из видов незначительно, то анализ проведен для всего сообщества мелких млекопитающих. Динамика изменения уровня активности в разные годы совпадает во всех трех случаях. Корреляция между канавками и берегом R = 0.92, t = 3.96, p = 0.029, между канавками и водой R = 0.89, t = 4.3, p = 0.005, между берегом и водой корреляция высокая и близкая к достоверной R = 0.84, t = 2.7, p = 0.073. Соответственно, количество зверьков, попадающих на открытый берег и пересекающих водные преграды, зависит от общего уровня нерезидентной активности в популяции.
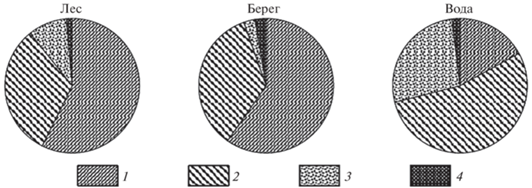
Соотношение видов на воде и на берегу. Из-за ограниченного количества данных сравнения проводили только для экологических групп – землеройки и лесные полевки, выделяя отдельно лесного лемминга. Оценивали долю этих видов в отловах в лесу, на берегу и на воде (рис. 3). Использованы данные за 5 лет, когда были применены одновременно все варианты учетов. На воде доля полевок значительно выше, чем в других учетах. Землероек-бурозубок в канавках встречено 57.4%, на берегу 59.7%, а на воде только 17.0% от всех мелких млекопитающих. При этом лесных полевок в канавках было 31.9%, на берегу 34.9%, а на воде они составили больше половины улова 54.0%. Интересно отметить, что лесной лемминг составил значительную долю улова на воде – 27.0%, в то время как на берегу и в канавках он отмечался значительно реже.
Рис. 3.
Соотношение видов при учетах ловчими канавками в массиве леса (лес), линиями ловушек на берегу по урезу воды (берег) и на воде ловушками на плотиках в 15–25 м от берега (вода): 1 – землеройки бурозубки, 2 – лесные полевки, 3 – лесной лемминг, 4 – прочие виды.
Избегание водных преград разными видами. Снижение доли землероек при учетах на воде по сравнению с берегом может возникать при разной степени избегания водных препятствий различными видами. Были проведены эксперименты по оценке реакции разных видов на ближайший берег по методике, описанной ранее (Калинин, Куприянова, 2015). Фиксировали направление движения зверька – к ближайшему берегу или от него. Всего проведено 35 экспериментов: 14 с землеройками-бурозубками и 21 с лесными полевками (табл. 2). У всех видов зверьки чаще поворачивали к берегу, но достоверные отличия от случайного распределения в биноминальном тесте получены только для землероек (p = 0.006), у лесных полевок отличия от случайного распределения не достигают принятого уровня достоверности (p = 0.09). Нет достоверных различий и между полевками и землеройками (точный критерий Фишера p = 0.26). Таким образом, можно предположить, что, попадая в воду, часть зверьков целенаправленно возвращается обратно, ориентируясь на ближайший берег. Землеройки сильнее лесных полевок избегают пересекать реку, с этим связано преобладание полевок при учете на воде, в отличие от преобладания землероек при учетах на берегу. Вывод о стремлении расселяющихся землероек избежать попадания в воду сделали также Хански и Пелтонен (Hanski, Peltonen, 1988; Peltonen, Hanski, 1991), показав, что больше землероек попадает к островам с полуостровов, где они накапливаются, передвигаясь вдоль уреза воды, чем к островкам от прямых берегов.
Таблица 2.
Выбор направления движения мелкими млекопитающими (число особей) в эксперименте при попадании в воду
| Вид | К берегу | От берега |
|---|---|---|
| Бурозубка обыкновенная | 6 | 1 |
| Бурозубка средняя | 6 | 1 |
| Всего землероек | 12 | 2 |
| Полевка красная | 11 | 6 |
| Полевка рыжая | 3 | 1 |
| Всего полевок | 14 | 7 |
Ориентация на границу леса с открытого пространства показана и для других видов, в частности белоногих хомячков (Peromyscus leucopus Rafinesque 1818), которые на открытой местности определяли направление на лес с расстояния до 30 м (Zollner, Lima, 1997), а при увеличении освещенности – с расстояния до 90 м (Zollner, Lima, 1999). Полевки Гаппера (Myodes gapperi Vigors 1830) ориентировались в сторону леса с расстояния до 20 м (Gillis, Nams, 1998). В сторону ближайшего лесного берега ориентируются и землеройки-бурозубки при выпуске в воду (Сергеев, 1973). Интенсивность реакции избегания воды имеет видовые особенности, что определяет изменение соотношения видов на берегу и на воде. У некоторых видов, таких как лесной лемминг, реакция избегания может быть очень слабой. В результате доля этого вида в отловах значительно возрастает. Если при отловах ловчими канавками доля лесного лемминга составляла 9.3%, то на воде он встречался в 27% случаев (рис. 3).
ОБСУЖДЕНИЕ
Все виды мелких млекопитающих лесной зоны могут преодолевать значительные водные преграды. Один из важных вопросов – достаточно ли количества плывущих зверьков для обеспечения эффективного обмена особями между двумя берегами. По нашим данным, средняя плотность оседлых особей всех видов в регионе исследования составляла около 12 особей/га (Калинин, 2012, 2019), т.е. в полосе леса шириной 100 м на 1 км береговой линии в среднем обитает около 120 мелких млекопитающих. Полученные нами результаты показывают, что если в течение суток в среднем на воде отлавливали 11.3 особи на 1 км, то за месяц реку могут форсировать около 350 особей различных видов на 1 км береговой линии. Таким образом, способность мелких млекопитающих преодолевать водные преграды может обеспечить существенный обмен между берегами.
Способность к плаванию может зависеть от особенностей строения волосяного покрова (Giannoni et al., 1994), но в основном эта способность зависит от размера тела (Hanski, 1986; Hanski, Kuitunen, 1986). В зависимости от особенностей видов и условий среды (температура воды) ширина успешно преодолеваемых водных пространств может существенно варьировать. По данным Сергеева (1981), у обыкновенной бурозубки при средней скорости 13.5 м/мин продолжительность плавания зависит от температуры воды. При температуре воды до 10°C продолжительность плавания в среднем составляет 7.4 мин, при температуре 10–15°C – 10.2 мин, а при 15–19°C – 14.4 мин. Температура воды влияет на плавательную способность и у других видов (Giannoni et al., 1994). По нашим оценкам, скорость плавания как обыкновенной бурозубки, так и красной полевки на прямолинейных участках составила 15–20 м/мин. Мы наблюдали, как молодая самка красной полевки, попав случайно в воду, переплыла реку шириной 70 м за 4.5 мин, т.е. ее средняя скорость без учета сноса течением была 15.5 м/мин. Примерно такие же скорости приводятся и в других работах (Skarén, 1980). Таким образом, река шириной до 200 м не является непреодолимым препятствием даже для мелких видов, таких как землеройки-бурозубки. При увеличении размера водной преграды вероятность ее успешного преодоления резко снижается. Потенциальная способность мелких млекопитающих пересекать водные преграды в зависимости от их ширины лучше всего описывается экспоненциальной кривой (Bohdal et al., 2016).
Все виды мелких млекопитающих в той или иной степени способны к преодолению водных преград, но количество зверьков, попадающих в воду, зависит от многих причин. Прежде всего это связано с уровнем численности данного вида, точнее с количеством расселяющихся особей. Чем выше уровень нерезидентной активности данного вида в текущем году, тем с большей вероятностью особей этого вида можно обнаружить на воде. Кроме того, реакция избегания воды у разных видов выражена по-разному, попадая в воду зверьки могут сразу возвращаться обратно, ориентируясь на ближайший берег. Различие в реакциях избегания приводит к тому, что видовой состав мелких млекопитающих, пересекающих водные преграды, отличается от имеющегося на берегу. При увеличении ширины преграды возникают дополнительные риски, и более крупные виды, которые обычно являются и лучшими пловцами, имеют больше преимуществ. При пересечении водных преград велик риск подвергнутся нападению хищников. Это могут быть как птицы (Skarén, 1980), так и хищные рыбы (Теплова, Теплов, 1953; Калинин, Куприянова, 2016). На р. Илыч мелкие млекопитающие могут в значительном количестве поедаться европейским хариусом. Зверьки были отмечены у 18.4% хариусов весом более 200 г, при этом большую часть составляли землеройки бурозубки – 64.3%, а лесные полевки только – 20.9% (Калинин, Куприянова, 2016). Учитывая, что в то же время при учетах на воде преобладали полевки, хищники могут поедать больше землероек и селективно воздействовать на видовой состав мелких млекопитающих, преодолевающих водные преграды.
Преодоление водных преград мелкими млекопитающими может происходить и зимой по льду, как это было показано при анализе заселенности островов (Lomolino, 1988, 1993). При этом по льду заселяются удаленные от берегов острова, на ближние (до 500 м) зверьки попадают по воде в летнее время (Hanski, 1986). Мелкие млекопитающие, в том числе и землеройки, могут передвигаться по льду на значительные расстояния, до нескольких километров (Tegelstrom, Hansson, 1987). Обычным это явление может быть ранней весной, когда на льду можно встретить ранних насекомых, а мигрирующие землеройки могут ими питаться (Hanski, 1986). Дополнительным источником питания могут быть далеко разносимые по насту семена хвойных деревьев. По наблюдениям А.Н. Формозова (1976), после высевания семян ели бурозубки (особенно малая бурозубка) могут совершать длительные путешествия по насту и, возможно, по льду в поисках корма.
Нужно отметить, что количество расселяющихся зверьков зависит от сезона. Обычно наиболее выражен летне-осенний пик расселения, когда популяции мелких млекопитающих достигают максимальной сезонной численности (Kozakiewicz, 1976; Gliwicz, 1992). Именно в этот период можно ожидать максимальное количество зверьков, пересекающих водные преграды. Перемещения в зимнее время обычно более редкие, но при этом зверьки могут перемещаться на большие расстояния.
Таким образом, даже крупные реки не являются непреодолимым барьером, и способность мелких млекопитающих преодолевать водные преграды может обеспечивать обмен особями между двумя берегами.
Список литературы
Калинин А.А., 2012. Оседлая и нерезидентная составляющая численности массовых видов мелких млекопитающих по данным учета на линиях живоловок // Зоологический журнал. Т. 91. № 6. С. 759–768.
Калинин А.А., 2019. Последствия учетов мелких млекопитающих методом безвозвратного изъятия // Экология. № 3. С. 211–216. [Kalinin A.A., 2019. The consequences of small mammal censuses by method of irreversible removal // Russian Journal of Ecology. Vol. 50. № 3. P. 262–267].
Калинин А.А., Куприянова И.Ф., 2015. Методика количественного учета мелких млекопитающих при миграциях через водные преграды // Зоологический журнал. Т. 94. № 3. С. 365–369. [Kalinin A.A., Kupriyanova I.F., 2016. A Technique for Quantitative Estimation of Small Mammals Traversing Water Obstacles // Biology Bulletin. Vol. 43. № 7. P. 743–746].
Калинин А.А., Куприянова И.Ф., 2016. Мелкие млекопитающие в питании европейского хариуса (Thymallus thymallus, Thymallidae, Salmoniformes) // Зоологический журнал. Т. 95. № 6. С. 712–719.
Наумов Н.П., 1955. Изучение подвижности и численности мелких млекопитающих с помощью ловчих канавок // Вопросы краевой, общей и экспериментальной паразитологии и медицинской зоологии. Т. 9. С. 179–202.
Сергеев В.Е., 1973. Особенности ориентации землероек на воде // Экология. № 6. С. 87–90.
Сергеев В.Е., 1981. Воздействие весенне-летних разливов на землероек в пойме р. Оби // Сукцессии животного населения в биоценозах поймы реки Оби. Новосибирск: Наука. С. 125–146.
Теплова Е.Н., Теплов В.П., 1953. Питание щуки в бассейне верхней Печоры // Вопросы ихтиологии. Вып. 1. С. 94–103.
Толкачёв О.В., 2016. Исследование миграций мышевидных грызунов в городской среде // Экология. № 4. С. 307–312.
Формозов А.Н., 1976. Звери, птицы и их взаимосвязи со средой обитания. М.: Наука. 310 с.
Шефтель Б.И., 2018. Методы учета численности мелких млекопитающих // Russian Journal of Ecosystem Ecology. Т. 3. № З. С. 1–21.
Щипанов Н.А., 1986. К экологии малой белозубки (Crocidura suaveolens) // Зоологический журнал. Т. 66. № 7. С. 1051–1060.
Щипанов Н.А., 2021. Количественная оценка величины нерезидентной составляющей в локальных популяциях обыкновенных бурозубок (Sorex araneus L.) // Зоологический журнал. Т. 100. № 8. С. 938–946.
Щипанов Н.А., Калинин А.А., Бобрецов А.В., Павлова С.В., 2019. Гибридная зона между хромосомными расами Сок и Серов у обыкновенной бурозубки Sorex araneus (Lipotyphla, Mammalia) на территории Европейской России // Генетика. Т. 55. № 4. С. 426–438. [Shchipanov N.A., Kalinin A.A., Bobretsov A.V., Pavlova S.V., 2019. Hybrid Zone between the Sok and Serov Chromosomal Races of the Common Shrew Sorex araneus (Lipotyphla, Mammalia) in European Russia // Russian Journal of Genetics. Vol. 55. № 4. P. 451–463].
Щипанов Н.А., Купцов А.В., 2004. Нерезидентность у мелких млекопитающих и ее роль в функционировании популяции // Успехи современной биологии. Вып. 124. № 1. С. 28–43.
Щипанов Н.А., Купцов А.В., Калинин А.А., Олейниченко В.Ю., 2003. Конуса и живоловки ловят разных землероек-бурозубок (Insectivora, Soricidae) // Зоологический журнал. Т. 82. № 10. С. 1258–1265.
Щипаное Н.А, Литвинов Ю.Н., Шефтелъ Б.И., 2008. Экспресс-метод оценки локального биологического разнообразия сообщества мелких млекопитающих // Сибирский экологический журнал. Т. 15. № 5. С. 783–791.
Aars J., Ims R.A., Liu H.P., Mulvey M., Smith M.H., 1998. Bank voles in linear habitats show restricted gene flow as revealed by mitochondrial DNA (mtDNA) // Molecular Ecology. V. 7. №. 10. P. 1383–1389.
Bohdal T., Navrátil J., Sedláček F., 2016. Small terrestrial mammals living along streams acting as natural landscape barriers // Ekologia (Bratislava). V. 35. № 2. P. 191–204.
Bowler D.E., Benton T.G., 2005. Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics // Biological Reviews. V. 80. P. 205–225.
Brehme C.S. Tracey J.A., McClenaghan L.R., Fisher R.N., 2013. Permeability of roads to movement of scrubland lizards and small mammals // Conservation Biology. V. 27. № 4. P. 710–720.
Brunke J., Radespiel U., Russo I., Bruford M., Goossens B., 2019. Messing about on the river: the role of geographic barriers in shaping the genetic structure of Bornean small mammals in a fragmented landscape // Conservation Genetics. V. 20. P. 691–704.
Clobert J., Galliard L., Cote J., Meylan S., Massot M., 2009. Informed dispersal, heterogeneity in animal dispersal syndromes and the dynamics of spatially structured populations // Ecology letters. V. 12. № 3. P. 197–209.
Ćosić N., Říčanová Š., Bryja J., Penezić A., Ćirović D., 2013. Do rivers and human-induced habitat fragmentation affect genetic diversity and population structure of the European ground squirrel at the edge of its Pannonian range? // Conservation Genetics. V. 14. № 2. P. 345–354.
Cote J., Bestion E., Jacob S., Travis J., Legrand D., Baguette M., 2017. Evolution of dispersal strategies and dispersal syndromes in fragmented landscapes // Ecography. V. 40. № 1. P. 56–73.
Fedyk S., Pavlova S.V., Chętnicki W., Searle J.B., 2019. Chromosomal hybrid zones // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press. P. 271–311.
Gerlach G., Musolf K., 2000. Fragmentation of landscape as a cause for genetic subdivision in bank voles // Conservation biology. V. 14. № 4. P. 1066–1074.
Giannoni S.M., Borghi C.E., Martínez-Rica J.P., 1994. Swimming ability of the Mediterranean pine vole Microtus (Terricola) duodecimcostatus // Acta Theriologica. V. 39. № 3. P. 257–265.
Gillis E.A., Nams V.O. 1998. How red-backed voles find habitat patches // Canadian Journal of Zoology. V. 76. № 5. P. 791–794.
Gliwicz J., 1992. Patterns of dispersal in non-cyclic populations of small rodents // Animal Dispersal. Springer Netherlands. P. 147–159.
Greenwood P.J., 1980. Mating systems, philopatry and dispersal in birds and mammals // Animal behaviour. V. 28. № 4. P. 1140–1162.
Hanski I., 1986. Population dynamics of shrews on small islands accord with the equilibrium model // Biological Journal of the Linnean Society. V. 28. № 1–2. P. 23–36.
Hanski I., Kuitunen J., 1986. Shrews on small islands: epigenetic variation elucidates population stability // Ecography. V. 9. № 3. P. 193–204.
Hanski I., Peltonen A., 1988. Island colonization and peninsulas // Oikos. V. 51. P. 105–106.
Kozakiewicz M., 1976. Migratory tendencies in population of bank voles and description of migrants // Acta Theriologica. Vol. 21. № 24. P. 321–338.
Kozakiewicz M., Gryczyńska–Siemiątkowska A., Panagiotopoulou H., Kozakiewicz A., Rutkowski R., Abramowicz K., Gortat T., 2009. The spatial genetic structure of bank vole (Myodes glareolus) and yellow-necked mouse (Apodemus flavicollis) populations: the effect of distance and habitat barriers // Animal Biology. V. 59. № 2. P. 169–187.
Lambin X., Le Bouille D., Oliver M.K., Sutherland C., Tedesco E., Douglas A., 2012. High connectivity despite high fragmentation: iterated dispersal in a vertebrate metapopulation // Dispersal ecology and evolution. Oxford: Oxford University Press. P. 405–412.
Lidicker W.Z., 1999. Responses of mammals to habitat edges: an overview // Landscape Ecology. V. 14. № 4. P. 333–343.
Lomolino M.V., 1988. Winter immigration abilities and insular community structure of mammals in temperate archipelagos // The biogeography of the island region of western Lake Erie. P. 185–196.
Lomolino M.V., 1993. Winter filtering, immigrant selection and species composition of insular mammals of Lake Huron // Ecography. V. 16. № 1. P. 24–30.
Matthysen E., 2005. Density-dependent dispersal in birds and mammals // Ecography. V. 28. № 3. P. 403–416.
McGregor R.L., Bender D.J., Fahrig L., 2008. Do small mammals avoid roads because of the traffic? // Journal of Applied Ecology. V. 45. № 1. P. 117–123.
Moulin N.L., Wyttenbach A., Brüunner H., Goudet J., Hausser J., 1996. Study of gene flow through a hybrid zone in the common shrew (Sorex araneus) using microsatellites // Hereditas. V. 125. № 2–3. P. 159–168.
Narain Y., Fredga K., 1996. A hybrid zone between the Hällefors and Uppsala chromosome races of Sorex araneus in central Sweden // Hereditas. V. 125. № 2–3. P. 137–145.
Peltonen A., Hanski I., 1991. Patterns of island occupancy explained by colonization and extinction rates in shrews // Ecology. V. 72. № 5. P. 1698–1708.
Rico A., Kindlmann P., Sedláček F., 2009. Can the barrier effect of highways cause genetic subdivision in small mammals? // Acta theriologica. V. 54. № 4. P. 297–310.
Savidge I.R., 1973. A stream as a barrier to homing in Peromyscus leucopus // Journal of Mammalogy. V. 54. № 4. P. 982–984.
Skarén U., 1980. The water as a barrier in spreading of shrews // Savon Luonto. V. 12. P. 44–47.
Stenseth N.C., Lidicker Jr W.Z., 1992. The study of dispersal: a conceptual guide // Animal dispersal: small mammals as a model (Ed. Stenseth N.C., Lidicker W.Z.). London: Chapman & Hall. P. 5–20.
Tegelstrom H., Hansson L., 1987. Evidence of long distance dispersal in the common shrew (Sorex araneus) // Zeitschrift für Säugetierkunde. V. 52. № 1. P. 52–54.
Whitmee S., Orme C.D.L., 2013. Predicting dispersal distance in mammals: a trait-based approach // Journal of Animal Ecology. V. 82. № 1. P. 211–221.
Wierzbicki H., Moska M., Strzała T., Macierzyńska A., 2011. Do aquatic barriers reduce male-mediated gene flow in a hybrid zone of the common shrew (Sorex araneus)? // Hereditas. V. 148. № 4-5. P. 114–117.
Zollner P.A., Lima S.L., 1997. Landscape-level perceptual abilities in white-footed mice: perceptual range and the detection of forested habitat // Oikos. V. 80. № 1. P. 51–60.
Zollner P.A., Lima S.L., 1999. Illumination and the perception of remote habitat patches by white-footed mice // Animal Behaviour. V. 58. № 3. P. 489–500.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал



