Зоологический журнал, 2022, T. 101, № 4, стр. 386-408
Масштабирование органов чувств насекомых. 2. Сенсиллы. Обсуждение. Заключение
А. А. Макарова a, *, А. В. Дьякова a, С. Ю. Чайка a, А. А. Полилов a
a Биологический факультет Московского государственного университета имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: amkrva@gmail.com
Поступила в редакцию 30.08.2020
После доработки 25.10.2021
Принята к публикации 14.11.2021
- EDN: WAEEHR
- DOI: 10.31857/S0044513422040079
Аннотация
Вторая часть обзора включает систематизацию литературных данных о масштабировании антеннальной сенсорной системы насекомых и аллометрический анализ количественных данных по 483 видам из 21 отряда. Установлено, что у насекомых число сенсилл на антенне положительно коррелирует с размером тела. При сравнении данного параметра у крупных и мельчайших насекомых разброс величин составил три порядка. Выявлена корреляция линейных размерных характеристик механорецепторных хетоидных сенсилл с размером тела, разброс значений составил один порядок. Достоверная корреляция числа типов сенсилл, а также длины и диаметра кутикулярных отделов обонятельных базиконических сенсилл с размерами тела не обнаружена. По-видимому, сложность строения элементарных сенсорных единиц органов чувств ограничивает уменьшение их размеров, вследствие чего оптимизация размещения сенсорного аппарата при миниатюризации насекомых происходит в первую очередь за счет уменьшения количества сенсорных единиц (омматидиев, сенсилл). Ультраструктура миниатюрных сложных глаз уже достаточно хорошо изучена. Работ, посвященных миниатюризации рецепторного аппарата антенн, почти нет. Анализ данных, полученных в течение нескольких десятилетий, позволяет выявить некоторые закономерности масштабирования сенсорных систем насекомых.
Исследование сенсилл представителей самых разных групп и размерных классов насекомых ведется давно, и с появлением и распространением новых возможностей и техник в микроскопии количество и качество подобных работ возрастает. В литературе имеется огромное количество информации о сенсиллах, зачастую авторы описывают такие характеристики, как количество сенсилл, их морфологию и типы, морфометрические параметры (Amornsak et al., 1998; Chiappini et al., 2001). При этом работы, посвященные изучению масштабирования сенсиллярного аппарата, крайне малочисленны. Среди работ по насекомым среднего и крупного размерного класса только одна работа содержит межвидовой аллометрический анализ морфометрических параметров (Symonds, Elgar, 2013), в то время как еще три исследования посвящены внутривидовой вариации (Tschinkel et al., 2003; Smallegange et al., 2008; van der Woude, Smid, 2016). Данные о крайней миниатюризации сенсиллярного аппарата содержатся в некоторых работах нашей группы (Polilov, 2015; Diakova et al., 2018; Diakova, Polilov, 2020, Diakova, Polilov, 2021). В итоге, несмотря на большое количество работ, посвященных сенсиллам насекомых, проблема масштабирования рецепторного аппарата сенсилл и его миниатюризации почти не изучена.
Сенсиллы
Общая характеристика сенсилл и краткий обзор основных работ
Тело насекомых покрыто большим числом кутикулярных чувствительных органов – сенсилл. Они зачастую состоят из небольшого числа рецепторных клеток, но последние могут быть весьма многочисленны и могут обладать высокой чувствительностью. Сенсиллы особенно разнообразны и хорошо изучены на антеннах. Разные типы сенсилл расположены также на ногах, придатках ротового аппарата, крыльях, половых придатках (Hallberg et al., 2003). Внутренние хордотональные сенсиллы, гомологичные поверхностным сенсиллам, воспринимают движения и положения тела и его придатков, а группы высокоспециализированных хордотональных органов функционируют в качестве органов слуха (Field, Matheson, 1998).
В результате исследования сенсорных систем насекомых получено большое количество данных, обобщение и систематизацию которых можно найти во многих обзорах и монографиях.
Обобщение ранних работ, посвященных исследованию антенн, обонятельным антеннальным сенсиллам и эволюции сенсилл, можно найти в работе Каллахана (Callahan, 1975). Монография “Руководство по физиологии органов чувств насекомых” посвящена строению и функциям органов чувств и содержит главы о механорецепции и слухе, хеморецепции, восприятии температуры и влажности, а также реакции насекомых на электрические и магнитные поля (Мазохин-Поршняков, 1983). Обзор работ, посвященный внутренним хордотональным сенсиллам и хордотональным органам, можно найти в монографии Филда и Матесона (Field, Matheson, 1998). Морфологии и функционированию сенсорных систем членистоногих посвящена монография Иванова “Органы чувств насекомых и других членистоногих” (2000). Сенсорная система чешуекрылых рассмотрена в монографии “Lepidoptera, Moths and Butterflies” (Hallberg et al., 2003). Обзор, включающий ряд современных исследований хордотональных органов, содержится в работе Як (Yack, 2004). Атлас электронно-микроскопической морфологии хеморецепторных органов насекомых описывает разнообразие хеморецепторных органов с акцентом на наиболее характерные типы сенсилл, свойственные представителям основных отрядов (Синицина, Чайка, 2006). Обзор биомеханики сенсорных систем насекомых приведен в статье Сэйна и МакГенри (Sane, McHenry, 2009). Раздел, посвященный строению и функционированию сенсилл и хордотональных органов, содержится в монографии Чайки (2010). Разнообразие антеннальных сенсилл паразитических наездников и связь количества и морфофункциональных типов сенсилл с паразитическим образом жизни рассмотрены в обзорах (van Baaren et al., 2007; Romani et al., 2010).
Антенны имеются у большинства взрослых насекомых и играют важную роль в восприятии сенсорной информации об окружающей среде (Schneider, 1964; Callahan, 1975). Антеннальная сенсорная система представляет собой высокочувствительный мультимодальный орган, не имеющий аналогов в природе. Антеннальные рецепторы выполняют такие разнообразные функции, как механочувствительность (в том числе проприоцепция), термо- и гигрорецепция, вкусовая и обонятельная рецепция, а также слух. Восприятие воздушных потоков и гравитации, осуществляется Джонстоновым и центральным органами – хордотональными органами, расположенными внутри антенны. На одной антенне может находиться до ста тысяч поверхностных сенсилл (Shields, Hildebrand, 2001), а число различных морфофункциональных типов антеннальных сенсилл может достигать семнадцати (Di Giulio et al., 2012). Рецепторы антенн поставляют информацию для осуществления таких ключевых и сложных процессов, как полет, питание, размножение, в том числе поиск полового партнера, избегание неблагоприятных условий среды, конспецифическая коммуникация, и многое другое.
Сенсиллы всех модальностей содержат биполярные рецепторные клетки, а также три вспомогательные или обкладочные клетки – тормогенную, трихогенную и текогенную (рис. 1A), выполняющие опорные, трофические и другие функции, в том числе осуществляющие секрецию кутикулы сенсиллы (Иванов, 2000). Вспомогательные клетки формируют внеклеточную полость сенсиллы, заполненную отличающейся по составу от гемолимфы жидкостью. Антеннальные сенсиллы чрезвычайно разнообразны морфологически, что зачастую затрудняет выделение морфофункциональных типов и определение гомологических связей типов сенсилл у различных групп насекомых. Как правило, для описания сенсилл используются детали внешней морфологии, такие, как общая форма и скульптура кутикулярной поверхности. Особенное значение в характеристике сенсилл несут параметры, косвенно указывающие на их функции. Так, отсутствие пор указывает на механочувствительность либо термо/гигрорецепцию, наличие апикальных пор свидетельствует о вкусовой чувствительности, наличие пор на всей поверхности кутикулярного отдела сенсиллы – об обонятельной чувствительности (Елизаров, Чайка, 1972). Наличие рельефа на кутикулярной поверхности (бороздок, выростов и прочее) и значимой разницы в размерах также, как правило, рассматривается исследователями как достаточное основание для выделения отдельного морфофункционального типа сенсилл. Наиболее показательным для определения функции сенсилл и их гомологических связей с точки зрения морфологии является исследование их иннервации, однако такие работы встречаются значительно реже, чем описание внешней морфологии.
Рис. 1.
Схема строения механорецепторной сенсиллы. A – крупные насекомые (рисунок адаптирован из Keil, 1997a); B – мельчайшие насекомые на стадии имаго (на примере Megaphragma). bl – базальная мембрана, ch – кутикулярный волосок, ep – эпителий, jm – соединительная мембрана, ls – внеклеточная полость, nu – клеточное ядро, sc – чувствительный нейрон, th – текогенная клетка, to – тормогенная клетка, tr – трихогенная клетка. C – схема сенсиллы мельчайшего насекомого (на примере Megaphragma) в едином масштабе со схемой крупных насекомых (на примере средних размеров механорецепторной сенсиллы у насекомых с длиной тела 2–3 см).

Подавляющую часть работ представляют исследования внешней морфологии сенсилл, выполненные с применением сканирующего электронного микроскопа и посвященные антеннальным сенсиллам. Наибольшее количество работ выполнено на представителях отрядов Coleoptera, Diptera, Hymenoptera, Lepidoptera и Orthoptera, основательно изучены Hemiptera и Trichoptera. Работы по остальным отрядам малочисленны. Сенсорный аппарат антенн насекомых часто используется для видовой диагностики и различения полов, особенно у миниатюрных форм. Многие исследования выполнены на экономически значимых видах и вредителях (Greenwood, Chapman, 1984; Ochieng et al., 1998).
Внутреннее строение сенсилл в большинстве случаев исследуют с применением трансмиссионной электронной микроскопии. На основании серий поперечных срезов авторы реконструируют ультраструктуру сенсилл, что позволяет с высокой точностью определять их функциональную специализацию. Нередки описания сенсилл смешанного типа, совмещающих в себе несколько модальностей, например хемо- и механорецепцию, что не позволяет с точностью установить их функцию лишь по внешнему строению сенсиллы (Chiappini et al., 2001). Детальные морфологические исследования посвящены онтогенезу антеннальных сенсилл (Kuhbandner, 1985; Blöchl, Selzer, 1988). Исследование ультраструктуры позволяет определить количество нейронов, иннервирующих каждый тип сенсилл. Благодаря этому становится возможным приблизительно оценить уровень их чувствительности и сравнить его с уровнем чувствительности у близких видов с другой жизненной стратегией (Ranieri et al., 2016). Количество нейронов, в совокупности с особенностями строения кутикулярного отдела, в некоторых случаях позволяет точнее определить специализацию сенсиллы; так, термо-/гигрорецептор с тремя чувствительными нейронами, как правило, чувствителен к холоду, сухости и влажности (Yokohari, 1999).
Новым и активно развивающимся направлением является изучение генов, вовлеченных в функционирование сенсилл. Гены одорант-связывающих белков обонятельных и вкусовых сенсилл были выявлены в геноме Drosophila melanogaster (Diptera, Drosophilidae) (Galindo, Smith, 2001). Анализ генов, вовлеченных в хеморецепцию у Tribolium castaneum (Coleoptera, Tenebrionidae), показал отсутствие полового диморфизма и наличие широкого спектра вкусовых и обонятельных рецепторов, необходимых для длительного выживания особи (вплоть до двух лет во взрослом состоянии) (Dippel et al., 2016). Исследование обонятельных рецепторов в мембране дендритов миниатюрного паразитического наездника Megaphragma amalphitanum (Hymenoptera, Trichogrammatidae) выявило сохранение консервативных хеморецепторных участков и появление новых уникальных рецепторов (Sharko et al., 2019). Происхождение и эволюция обонятельных рецепторов насекомых рассмотрены в работе Миссбах и соавторов (Missbach et al., 2014). Многие работы фокусируются на связи экологии вида и специализации рецепторов, а также на влиянии среды на чувствительность антенны к специфическим запахам (Farhadian et al., 2012; Rinker et al., 2013).
В ходе исследований иннервации антенн выявлено большое количество разнообразных афферентных путей, передающих сенсорную информацию в центральные отделы нервной системы. Изучение иннервации обонятельных сенсилл жесткокрылого T. castaneum показало, что в то время как информация, полученная от антеннальных сенсилл, обрабатывается в долях дейтоцеребрума, отростки хеморецепторных сенсилл ротового аппарата достигают других нейропилей, и их сигналы обрабатываются отдельно (Dippel et al., 2016). Помимо работ, посвященных изучению поверхностных сенсилл, много работ, посвященных иннервации Джонстонова органа, расположенного внутри второго членика антенны (Kamikouchi et al., 2006; Ai et al., 2007; Boekhoff-Falk, Eberl, 2014).
Физиологические исследования посвящены выявлению сигналов, воспринимаемых сенсиллами, и определению пределов их чувствительности (Klein et al., 1988; Dreller, Kirchner, 1995). Значительная часть работ затрагивает восприятие половых феромонов и других аттрактантов (Anderson et al., 2000), в том числе насекомыми-вредителями. Представленные в этих работах данные позволяют создать базу для биологического контроля численности насекомых-вредителей и производства феромонных ловушек (Malo et al., 2004; Park, Hardie, 2004).
Так как антеннальная сенсорная система играет главенствующую роль в важнейших аспектах жизни насекомых, исследование антеннальных сенсилл тесно связано с исследованием экологии и поведения. Сравнение морфологии антенн и антеннальных сенсилл у насекомых различных экологических групп позволяет выявить значимые характеристики сенсилл (типы, количество, морфология), способствующие выживанию и сохранению приспособленности видов. Примером подобной работы может быть исследование антеннальных сенсилл у клептопаразитических и непаразитических видов пчел (Wcislo, 1995). Детально исследована внутривидовая коммуникация, осуществляемая при помощи антеннальных сенсилл, в особенности ее роль в половом поведении (Bin et al., 1989; Piersanti et al., 2017). Во многих работах рассматривается значение антеннальных сенсилл для паразитических видов насекомых. Обширное исследование вариативности сенсорного аппарата антенн самок паразитических наездников выявило взаимосвязь между расположением сенсилл и их участием в обнаружении и оценке потенциальных хозяев (van Baaren et al., 2007). Было показано использование проприоцептивных сенсилл паразитическим наездником Trichogramma minutum (Hymenoptera, Trichogrammatidae) для оценки пригодности яйца хозяина для заражения (Schmidt, Smith, 1986).
Обзор работ, посвященных масштабированию сенсилл насекомых
Размер тела насекомых значительно влияет на размерные и количественные характеристики антенн и антеннальных сенсилл. Морфологический анализ 126 видов паразитических наездников Chalcidoidea показал наличие корреляции между размером тела и площадью антенн (Symonds, Elgar, 2013). При этом длина тела видов, паразитирующих на представителях отряда Hemiptera, оказалась в большинстве случаев меньше длины тела видов, паразитирующих на представителях других отрядов, а площадь их антенн была больше относительно размера тела. Более узкая специализация в плане выбора хозяев и паразитирование на представителях отряда Coleoptera оказались ассоциированы с крупным размером тела (Symonds, Elgar, 2013).
Исследования особей одного вида с различной длиной тела, разброс значений которой может быть значительным у некоторых видов насекомых, освещают вопрос масштабирования антенн с позиции внутривидовой вариации. Одна из таких работ посвящена обонятельной системе паразитического наездника Trichogramma evanescens (Hymenoptera, Trichogrammatidae), размеры тела которого значительно изменяются в зависимости от размера яйца хозяина, в котором он развивался. Было установлено, что число и длина обонятельных антеннальных сенсилл, а также число гломерул в антеннальных долях зависят от размера тела особи. При этом была выявлена корреляция между абсолютными и относительными размерами гломерул и длиной тела (van der Woude, Smid, 2016). Значительный разброс размеров тела наблюдается у Musca domestica (Diptera, Muscidae): имаго из популяции с высокой плотностью содержания личинок в 1.5 раза меньше имаго из популяции личинок с низкой плотностью. Было установлено, что размер антенн у M. domestica положительно коррелирует с размером тела. Также наблюдалась корреляция с количеством сенсилл; антенны крупных и мелких мух были оснащены одинаковыми типами сенсилл, однако на антеннах крупных мух их было обнаружено почти в 2 раза больше (Smallegange et al., 2008). Предметом еще одного исследования стало изучение размерных характеристик рабочих муравьев вида Solenopsis invicta (Hymenoptera, Formicidae). Было установлено, что с увеличением размеров тела антенны становятся короче относительно длины тела, при этом наибольший вклад в это относительное укорочение вносит булава (Tschinkel et al., 2003).
Экстремальная миниатюризация
Хотя органы чувств многих насекомых изучены достаточно подробно, изучение сенсорной системы миниатюрных насекомых и связанных с миниатюризацией ее особенностей началось сравнительно недавно, и работы в данной области малочисленны. За последние годы были опубликованы всего три работы, посвященные исследованию влияния экстремальной миниатюризации на антеннальные сенсиллы трех видов паразитических наездников рода Megaphragma (длина тела около 0.2 мм) (Diakova et al., 2018; Diakova, Polilov, 2021) и мельчайшего свободноживущего насекомого, жесткокрылого Scydosella musawasensis (Coleoptera, Ptiliidae) (длина тела 0.3 мм) (Diakova, Polilov, 2020). Несмотря на крайне маленький размер тела, паразитический образ жизни требует сохранения чувствительности антенн на уровне, сравнимым с таковым у крупных паразитических наездников, имеющих в сотни раз более длинные антенны. Число и расположение сенсилл были одинаковы у особей одного вида и пола, следовательно, их антеннальная сенсорная система устроена максимально эффективно и экономично. Сравнительный анализ антеннальных сенсилл у Megaphragma и у крупных паразитических наездников показал, что миниатюризация приводит к значительному уменьшению количества этих структур. Представители рода Megaphragma имеют 39–49 антеннальных сенсилл (в зависимости от вида и пола), в то время как антенны крупных паразитических наездников несут до 9000 сенсилл (Das et al., 2011). Тем не менее корреляция между размерами тела и количеством типов сенсилл не была обнаружена. Изученные виды имеют 8 типов сенсилл, в то время как у некоторых значительно более крупных видов паразитических наездников их только 4. Длина и диаметр сенсилл (сравнение размеров проводилось для хетоидных, базиконических и проприоцептивных сенсилл) также почти не зависели от изменения размера тела (Diakova et al., 2018).
При исследовании ультраструктуры антенн M. amalphitanum было обнаружено отсутствие у плакоидных сенсилл трихогенной, тормогенной и текогенных клеток (рис. 1В) (Diakova, Polilov, 2021). При этом эпителиальные клетки распластаны по всей внутренней поверхности кутикулы и охватывают большую площадь; так, в педицеллуме было обнаружено всего лишь 4 эпителиальные клетки. При этом малое количество эпителиальных клеток, обладающих к тому же небольшим объемом цитоплазмы, дополнительно увеличивает доступное пространство внутри миниатюрных антенн.
В связи с отсутствием информации относительно развития сенсилл в онтогенезе мельчайших насекомых пока неизвестны источники формирования структурных элементов сенсиллы, таких как ее рецепторная клетка, кутикулярный отдел и сочленовная мембрана. У насекомых и других членистоногих более крупных размеров процессы формирования сенсилл хорошо изучены и отражены в сводках (Иванов, 2000; Леонович, 2005). Поскольку все элементы сенсилл формируются из прегиподермальных клеток, то эти клетки после дифференцировки в разные типы обкладочных клеток и выполнения сенсиллогенной функции, вероятно, подверглись полной редукции, как и “избыточные” обкладочные клетки на стадии раннего развития сенсилл (Martini, Schmidt, 1983). В ряде работ выявлена редукция обкладочных клеток: трихогенной – в макрохете Calliphora vicina (Keil, 1978), а также тормогенной – в базиконической сенсилле Calliphora erythrocephala (Diptera, Calliphoridae) (Kuhbandner, 1984). Но не менее вероятен и путь преобразования обкладочных клеток в гиподермальные. В пользу такого мнения свидетельствуют выявленные факты внедрения обкладочных клеток после секреции кутикулярных отделов сенсиллы в гиподермальный пласт (Lee, Altner, 1985; Keil, 1997). Примером коренной смены функции клетками гиподермальной природы в органах чувств иной модальности может служить преобразование корнеагенных клеток в фасеточном глазу насекомых. Корнеагенные клетки, выполнив функцию секреции кутикулы роговицы, заполняются пигментными гранулами и приобретают статус главных пигментных клеток. Однако функционирование сенсилл, лишенных обкладочных клеток не ясно. Ведь сохранение последних у большинства насекомых обусловлено их участием в формировании внутренней сенсиллярной полости, состав рецепторно-лимфатической жидкости которой отличается от состава гемолимфы.
Аллометрический анализ основных количественных характеристик антеннальных сенсилл насекомых
Количественные характеристики сенсиллярного аппарата имеются во многих публикациях, большинство из которых посвящено антеннам. Нами проанализированы основные характеристики сенсилл антенн по данным из 169 работ, охватывающих 483 вида из 21 отряда: Odonata (Slifer, Sekhon, 1972; Rebora et al., 2009; Piersanti et al., 2010); Ephemeroptera (Gaino, Rebora, 1998; Rebora et al., 2009а); Dermaptera (Slifer, 1967; Al-Dosary, 2009); Plecoptera (Slifer, 1979; Kapoor, 1985; Rebora et al., 2016; Piersanti et al., 2017); Orthoptera (Riegert, 1960; Greenwood, Chapman, 1984; Bland, 1994; Ochieng et al., 1998; Chen et al., 2003; Li et al., 2007; Schneider, Römer, 2016; Faucheux, 2017; Kuřavová et al., 2017; Fea et al., 2019); Mantodea (Holwell et al., 2007; Faucheux, 2008; Carle et al., 2014); Notoptera (Pritchard, Scholefield, 1978; Drilling, Klass, 2010); Embioptera (Slifer, 1975); Phasmida (Monteforti et al., 2002); Blattodea (Schaller, 1978; Ramaswamy, Gupta, 1981; Yanagawa et al., 2009); Thysanoptera (Ding et al., 2010; De Facci et al., 2011; Li, Feng, 2013; Zhu et al., 2017; Wang et al., 2019; Hu et al., 2020); Hemiptera (Le Rü et al., 1995; Liang, 2001; Carbajal-de-la-Fuente, Catalá, 2002; Fu et al., 2012; Gonzaga-Segura et al., 2013; Ahmad et al., 2016; Ranieri et al., 2016; Zhang et al., 2016; Wang et al., 2018; Wang et al., 2018; Nowińska, Brożek, 2019); Psocoptera (Slifer, Sekhon, 1979; Hu et al., 2009); Phthiraptera (Cicchino, Abrahamovich, 1988; Clarke, 1990; Baker, Chandrapatya, 1992; Cruz, 1996; Arya, Singh, 2012; Ahmad et al., 2014); Hymenoptera (Bromley et al., 1980; Barlin et al., 1981; Cave, Gaylor, 1987; Butterfield, Anderson, 1994; van Baaren et al., 1996, 1999; Amornsak et al., 1998; Consoli et al., 1999; Chiappini et al., 2001; Tschinkel et al., 2003; Bleeker et al., 2004; Marques-Silva et al., 2006; da Rocha et al., 2007; Gao et al., 2007; Crook et al., 2008; Onagbola, Fadamiro, 2008; Dweck, 2009; Li et al., 2009; Shang et al., 2010; Xi et al., 2010, 2011; Das et al., 2011; Zhou et al., 2011, 2013; Galvani et al., 2012; Zhang et al., 2012; Suwannapong et al., 2012; Zhou et al., 2013; Jun et al., 2013; Wang, 2013; Barsagade et al., 2013; Fialho et al., 2014; Namikawa, Amornsak, 2016; Yang et al., 2016; Diakova et al., 2018; Polidori et al., 2020); Neuroptera (Slifer, 1979а; Juan et al., 2017; Randolf et al., 2017); Strepsiptera (Derr, Cook, 2005); Coleoptera (Moeck, 1967; Borden, 1968; Payne et al., 1973; Dyer, Seabrook, 1975; Harbach, Larsen, 1977; Kim, Yamasaki, 1996; Skilbeck, Anderson, 1996; Merivee et al., 2002; Saïd et al., 2003; Di Giulio et al., 2012; Oliva, 2012; Pérez-González, Zaballos, 2013; Ali et al., 2016; Polilov, 2016; Zauli et al., 2016; Handique et al., 2017); Trichoptera (Valuyskiy et al., 2017; Melnitsky et al., 2018); Lepidoptera (Nieukerken, Dop, 1987; Davis, 1994; Shields, Hildebrand, 2001; Castrejón-Gómez et al., 2003; Malo et al., 2004; Faucheux, 2006; Castrejón-Gómez, Carrasco, 2008; Faucheux, Gibbs, 2008; Yang et al., 2009; Frank et al., 2010; Jiang et al., 2010; Sun et al., 2011; Chang et al., 2015; Roh et al., 2016; da Silva et al., 2019; Weedon et al., 2020); Diptera (McIver, 1969, 1980; Mercer, McIver, 1973; Chu-Wang et al., 1975; Henderson, Wellington, 1982; Honda et al., 1983; Giannakakis, Fletcher, 1985; Ross, Anderson, 1987; Dickens et al., 1988; Felippe-Bauer et al., 1989; Sutcliffe et al., 1990; Blackwell et al., 1992; Ross, 1992; Giangiuliani et al., 1994; Lee et al., 1994; Parashar et al., 1994; Cribb, 1996; Rahal et al., 1996; Riesgo-Escovar et al., 1997; Kline, Axtell, 1999; Ilango, 2000; Pitts, Zwiebel, 2006; Sukontason et al., 2007; Arzuffi et al., 2008; Chen, Fadamiro, 2008; Freitas Fernandes et al., 2008; Smallegange et al., 2008; Castrejón-Gómez, Rojas, 2009; Freitas Fernandes, Linardi et al., 2009; Freitas Fernandes, Pimenta et al., 2009; Hu et al., 2010; Bisotto-de-Oliveira et al., 2011; Faucheux, Gibernau, 2011; Liu et al., 2013; Wang et al., 2014; Li et al., 2015; Zhang et al., 2015; Keyan et al., 2016; Liu et al., 2016; Hempolchom et al., 2017).
В результате анализа было установлено, что число сенсилл коррелирует с размером тела и достоверно увеличивается с ростом размера тела, как у насекомых в целом (113.2x1.38 (OLS – 317.6x0.87)), так для всех выборок по отдельности (b 1.36–3.02 × × (OLS – 0.70–1.29)) (рис. 2А, 2С), а также для исследованных представителей отрядов Orthoptera (19.50x2.63), Hemiptera (17.66x1.48), Coleoptera (358.1x1.31), Lepidoptera (55.083x1.82), Hymenoptera (420.7x1.33), Diptera (103.9x1.53) (рис. 2Е). Достоверной разницы по коэффициенту пропорциональности и аллометрическому показателю не обнаружено при сравнении самцов и самок (рис. 2А), но обнаружено при сравнении насекомых с неполным и полным превращением (a = 38.28 и 197.7 соответственно, p < 0.05) (рис. 2С), а крупные и мелкие насекомые достоверно различаются коэффициентом и показателем (a = 42.3 и 480.8, b = 1.69 и 3.02 соответственно, p < 0.05). Среди представителей отрядов Hymenoptera и Coleoptera значительно превосходят Diptera и Lepidoptera по коэффициенту пропорциональности, и все вместе значительно превосходят Hemiptera и Orthoptera (p < 0.001). По аллометрическому показателю исследованные представители Orthoptera и Lepidoptera значительно превосходят всех остальных (p < 0.05). Наименьшее число антеннальных сенсилл (17) обнаружено у Philaenus spumarius (Hemiptera, Aphrophoridae) с длиной тела 6 мм (Ranieri et al., 2016), наибольшее (100 000) – у Manduca sexta (Lepidoptera, Sphingidae) с длиной тела 45 мм (Shields, Hildebrand, 2001).
Рис. 2.
Зависимость основных характеристик антеннальных сенсилл от размера тела насекомых. A – число сенсилл, B – число типов сенсилл, С – число сенсилл для насекомых с полным и неполным превращением, D – число типов сенсилл для насекомых с полным и неполным превращением, E – число сенсилл для отдельных отрядов, F – число типов сенсилл для отдельных отрядов.

Уменьшение количества антеннальных сенсилл при уменьшении размера тела ранее было показано для паразитических наездников (Diakova et al., 2018) и мельчайших жесткокрылых (Diakova, Polilov, 2020), при этом вариативность в количестве сенсилл снижалась с уменьшением размера тела. При исследовании крупных и мелких особей T. evanescens (van der Woude, Smid, 2016) и M. domestica (Smallegange et al., 2008) также была выявлена корреляция между размерами тела и числом антеннальных сенсилл. При учете факторов, влияющих на количество сенсилл, необходимо также принимать во внимание особенности биологии исследуемых видов насекомых. В зависимости от чувствительности антенны, необходимой для поддержания приспособленности вида, изменяется количество сенсилл, что особенно заметно на примере хеморецепторных сенсилл. Так, у кровососущего клопа Rhodnius prolixus (Hemiptera, Reduviidae), вынужденного многократно искать хозяина в течение жизни, в 18 раз больше хеморецепторных сенсилл, чем у постельного клопа Cimex lectularius (Hemiptera, Cimicidae), обитающего рядом с хозяином (Чайка, 1980). Часто количество обонятельных сенсилл значительно больше у самцов, чем у самок того же вида, что связано с половым поведением и поиском полового партнера (Nieukerken, Dop, 1987; Ivanov, Melnitsky, 2011).
По числу типов сенсилл на антеннах корреляции с размерами тела не обнаружено, аллометрические показатели для насекомых в целом (10.28x–0.29 (OLS 6.09x–0.02)) и для всех выборок не демонстрируют достоверных отличий от 0 (рис. 2В, 2D, 2F). При попарном сравнении выборок наблюдаются достоверные различия по коэффициенту пропорциональности между насекомыми с неполным и полным превращением, мелкими и крупными насекомыми (a = 11.38 и 3.76, 5.83 и 12.42 соответственно, p < 0.05). Наибольшее количество типов сенсилл (17) описано у Paussus favieri (Coleoptera, Carabidae) с длиной тела 4 мм, наименьшее (2) – у двух видов Hymenoptera, одного вида Plecoptera, двух видов Ephemeroptera, одного вида Blattodea и одного вида Strepsiptera (Schaller, 1978; Kapoor, 1985; Gaino, Rebora, 1998; Derr, Cook, 2005; Fialho et al., 2014).
Отсутствие корреляции между размером тела и количеством типов антеннальных сенсилл было ранее установлено для паразитических наездников (Diakova et al., 2018). Несмотря на разницу в 45 раз в размере тела между самым мелким (Megaphragma carribea (Hymenoptera, Trichogrammatidae)) и самым крупным (Microplitis croceipes (Hymenoptera, Braconidae)) видами, вошедшими в анализ, количество типов сенсилл у них составляет 8 и 6 соответственно. При исследовании внутривидовой изменчивости M. domestica вариации в количестве типов сенсилл также не было обнаружено (Smallegange et al., 2008). По всей видимости, количество типов сенсилл зависит от потребности вида в разнородной и разнообразной информации об окружающей среде, которая в свою очередь не зависит от размера организма.
Длина и диаметр основания хетоидных сенсилл (ChS) достоверно увеличиваются с ростом размеров тела как для насекомых в целом (для длины 13.18x0.653 (OLS 24.27x0.279), для диаметра 0.96x0.537 (OLS 1.22x0.385)) (рис. 3А, 3В), так и для отдельных выборок (b для длины 0.506–0.764 (OLS 0.193–0.341), для диаметра 0.462–0.676 (OLS 0.323–0.438)). При этом для всех выборок аллометрический показатель не только достоверно больше 0, но и достоверно меньше 1 (p < 0.001), следовательно, несмотря на то, что сенсиллы становятся крупнее с ростом размеров тела, их размеры относительно размеров тела при этом уменьшаются. При попарном сравнении выборок диаметра наблюдаются достоверные различия по коэффициенту пропорциональности между насекомыми с неполным и полным превращением, мелкими и крупными насекомыми (а = 0.89 и 0.98, 1.33 и 0.67 соответственно, p < 0.05). У Diptera наблюдается противоположный характер аллометрии (231.2x–0.876 (OLS 106.7x–0.352)), достоверно отличающийся от других насекомых (p < 0.001). Наибольшей длины (300 мкм) ChS достигают у Culicoides nubeculosus (Diptera, Ceratopogonidae) с длиной тела 4 мм (Blackwell et al., 1992), наименьшая длина (6.3 мкм) описана у Megaphragma carribea длиной 0.19 мм (Diakova et al., 2018). Наибольший диаметр ChS (8 мкм) зафиксирован у Monochamus notatus и Monochamus scutellatus (Coleoptera, Cerambycidae) длиной тела 29 и 40 мм соответственно (Dyer, Seabrook, 1975), а также у Eugaster powysi (Orthoptera, Tettigoniidae) длиной тела 45 мм (Faucheux, 2017). Наименьший диаметр ChS (0.6 мкм) описан у S. musawasensis длиной тела 0.34 мм (Diakova, Polilov, 2020).
Рис. 3.
Зависимость линейных размеров сенсилл от размеров тела насекомых. A – длина механорецепторных сенсилл (ChS), B – диаметр основания механорецепторных сенсилл (ChS), C – длина обонятельных сенсилл (MB), D – диаметр основания обонятельных сенсилл (MB).
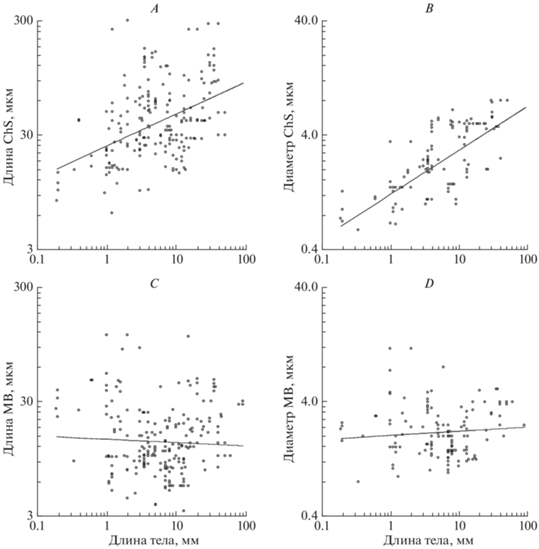
В нашем предыдущем исследовании в анализе размерных характеристик ChS паразитических наездников, сделанном на основе литературных данных, наблюдалась слабая корреляция длины ChS с длиной тела, а зависимость между диаметром ChS и длиной тела не была обнаружена (Diakova et al., 2018). Можно предположить, что объем данных, приведенных в литературе для Parasitica, был недостаточным для получения достоверных результатов регрессионного анализа, и дополнение базы данных по перепончатокрылым размерами сенсилл Aculeata позволило выявить аллометрические тренды, менее заметные на меньшей выборке.
Длина и диаметр основания базиконических мультипоровых сенсилл (MB) не демонстрируют достоверной корреляции с размерами тела (рис. 3С, 3D); их аллометрические показатели достоверно не отличаются от 0, как для насекомых в целом (для длины 33.81x–0.561 (OLS 14.09x–0.029), для диаметра 1.11x0.401 (OLS 2.03x0.036)), так и для отдельных выборок. При попарном сравнении выборок диаметра наблюдаются достоверные различия по коэффициенту пропорциональности между исследованными насекомыми с неполным и полным превращением, а также мелкими и крупными насекомыми (a = 1.19 и 3.92, 2.87 и 0.70 соответственно, p < 0.05). Наибольшей длины (113 мкм) и диаметра (11.6 мкм) MB достигают у Pteromalus cerealellae (Hymenoptera, Pteromalidae) с длиной тела 1.5 мм (Onagbola, Fadamiro, 2008), наименьшая длина (3.3 мкм) описана у самок Hypoderma lineatum (Diptera, Oestridae) длиной 13 мм (Li et al., 2015). Наименьший диаметр MB (0.8 мкм) зафиксирован у S. musawasensis (Diakova, Polilov, 2020).
Полученные результаты согласуются с ранее проведенным анализом длин и диаметров MB паразитических наездников, в результате которого не было установлено корреляции размерных характеристик MB и длины тела (Diakova et al., 2018). При этом исследование внутривидовой вариации у T. evanescens показало наличие зависимости длины обонятельных антеннальных сенсилл от размера тела особи (van der Woude, Smid, 2016), но было сделано на выборках искусственно сформированного разброса размеров тела. Таким образом, размеры MB не коррелируют с размерами тела между видами, но, возможно, могут зависеть от длины тела особей конкретного вида.
Ранее была показана выраженная корреляция размерных характериситик механорецепторных проприоцептивных сенсилл (TS2-AP, щетинки Бёма) и размеров тела у паразитических наездников (Diakova et al., 2018). Разрозненность выводов, полученных из аллометрических анализов длин и диаметров ChS, TS2-AP и MB (первые и вторые, механорецепторные, зависят от длины тела, третьи, обонятельные, – не зависят), может свидетельствовать о том, что масштабирование сенсилл напрямую зависит от их функции. Можно предположить, что механорецепторные сенсиллы, кутикулярные отделы которых контактируют с субстратом, уменьшаются или увеличиваются вместе с размером тела, в то время как размеры обонятельных сенсилл, ввиду совершенно отличного механизма рецепции, не зависят от размера тела.
Общие принципы масштабирования органов чувств
Сравнительный аллометрический анализ
В ходе обширного сравнительного анализа было установлено, что число индивидуальных функциональных единиц как в сложном глазу, так и в антеннальной сенсорной системе коррелирует с размером тела у насекомых. При этом разброс количества единиц составляет три порядка и для сенсилл, и для омматидиев, и наблюдается значительная величина аллометрического показателя. В целом для насекомых аллометрический показатель для количества сенсорных единиц сходен и равен 1.46 для числа фасеток и 1.38 для числа сенсилл. Коэффициент пропорциональности для числа фасеток у мелких и крупных насекомых (121.9 и 20.46, p < 0.001 для a, p < < 0.05 для b) достоверно ниже, чем коэффициент пропорциональности для числа сенсилл (480.8 и 42.3, p < 0.05).
Зависимость линейных размеров функциональных единиц от размера тела несколько менее выражена. Размерные характеристики омматидия обнаруживают разброс в 15 раз по длине омматидия среди всех изученных насекомых и в среднем в 5 раз по диаметру фасеток у мельчайших и крупных видов. В отдельных отрядах этот разброс существенно выше. Так, диаметр фасеток у крупных жесткокрылых (один из самых крупных – Titanus giganteus (Coleoptera, Cerambycidae) (Dvořáček et al., 2020)) в 30 раз больше, чем у мельчайших (S. musawasensis (Makarova et al., 2019)). Разница в длине ChS у мельчайших и крупных видов среди исследованных представителей составляет всего 48 раз, в диаметре – примерно 13 раз. Это видно и по величине аллометрического показателя, который для размерных характеристик заметно (иногда в разы) меньше, чем для количественных (аллометрический показатель для диаметра фасеток: 0.32; длины сенсилл ChS: 0.653; диаметра сенсилл ChS: 0.537). В то же время, длина и диаметр MB не обнаружили достоверной корреляции с размерами тела, и, если для некоторых отрядов аллометрический показатель был близок к нулю, для других он являлся отрицательным. Причиной, по которой размерные характеристики омматидиев и сенсилл не изменяются так же сильно при масштабировании, как их число, является, по-видимому, сложность их внутреннего устройства, а в случае сенсилл – еще и морфологическая ригидность конструкции. Более заметное изменение размеров омматидиев и сенсилл, вероятно, привело бы к критическому уменьшению их чувствительности. В случае механорецепторных ChS сенсилла представляет из себя кутикулярный вырост с подходящим к нему отростком чувствительного нейрона (Жантиев, 1969) и может, по всей видимости, в некоторой степени масштабироваться за счет уменьшения длины и диаметра кутикулярного выроста без изменения размеров нейрона. В то же время, в обонятельных MB отростки нейронов располагаются внутри кутикулярного выроста (Chiappini et al., 2001), и его уменьшение неминуемо повлияет либо на их количество, либо на их размеры, от которых будет зависеть чувствительность сенсиллы. Вероятно, именно этот фактор препятствует корреляции размеров MB и размеров тела. Подобная ситуация наблюдается и для омматидиев, размер линзы которых c одной стороны ограничен ее чувствительностью, с другой стороны – влиянием дифракции (Barlow, 1952; Land, 1981). Линза должна быть достаточного размера, чтобы пропустить необходимое количество света, и достаточной силы, чтобы сфокусировать его на вершине рабдома. Необходимость размещения клеточных компонентов омматидия и субклеточных элементов (ядра, митохондрии, пигментные гранулы) также ограничивает масштабирование всей конструкции.
Баланс между числом и размером рецепторов индивидуален для каждой группы насекомых. И там, где у одних миниатюризация выражается в сокращении числа рецепторов, но сохранении их большего размера, у других, напротив, число рецепторов имеет приоритет. Подобным примером могут служить два вида из семейства Trichogrammatidae: T. evanescens (длина тела 0.3–0.4 мм) имеет 128 фасеток, средний диаметр которых 6.39 мкм (Fischer et al., 2010), в то время как M. mymaripenne (длина тела 0.2 мм) имеет всего 29 омматидиев при среднем диаметре фасетки 8.1 мкм (Makarova et al., 2015). Несколько похожая картина наблюдается и при сравнении сенсилл на антеннах этих паразитоидов. Число сенсилл существенно варьирует у видов родов Megaphragma и Trichogramma и достоверно зависит от размера тела, в то время как индивидуальный размер сенсилл не показывает строгой корреляции с размером тела. Наряду с этим, для трех видов рода Megaphragma показан больший относительный диаметр сенсилл по сравнению с большинством более крупных хальцидоидов (Diakova et al., 2018).
Ранее было показано отсутствие корреляции между числом типов антеннальных сенсилл и размерами тела у наездников-яйцеедов (Diakova et al., 2018). В выполненном анализе этот вывод был подтвержден в гораздо большем масштабе для остальных насекомых. Число морфофункциональных типов говорит в первую очередь о разнообразии сенсорной информации, получаемой насекомым. Даже подтипы сенсилл, различающиеся небольшими морфологическими деталями, будут воспринимать немного разную информацию. Так, длина кутикулярного отдела механорецепторной сенсиллы влияет на то, насколько близко необходимо находиться предмету для тактильного ощущения его насекомым, а наиболее мелкие механорецепторы специализированы в качестве проприоцептивных сенсилл, ощущающих не посторонние предметы, а соседние членики антенны или конечности (Иванов, 2000). Однопоровые сенсиллы, имеющие кутикулярный кратер, будут сочетать в себе функции вкусового и тактильного рецептора, не имеющие кратера воспринимать тактильную информацию не будут (Жантиев, 1969). Таким образом, малое количество типов и подтипов сенсилл говорит о небольшом разнообразии воспринимаемой сенсорной информации, как правило, включающей в себя тактильную информацию и ощущение температуры и влажности (Kapoor, 1985; Gaino, Rebora, 1998; Derr, Cook, 2005; Fialho et al., 2014). Насекомые с большим количеством типов сенсилл, вне зависимости от размера тела, демонстрируют весь возможный спектр рецепторов: механорецепторы, контактные и дистантные хеморецепторы, термо/гигрорецепторы и проприоцепторы. В таком случае именно образ жизни насекомого определяет высокое разнообразие рецепторов, что можно увидеть, например, у таких паразитов и паразитоидов, как Trichogramma australicum (Hymenoptera, Trichogrammatidae) (размер тела 0.45 мм, количество типов антеннальных сенсилл – 14) (Amornsak et al., 1998) и Forcipomyia townsuillensis (Diptera, Ceratopogonidae) (размер тела 2.6 мм, количество типов антеннальных сенсилл – 13) (Cribb, 1996).
Можно предположить, что строение сенсилл и омматидиев даже у крупных насекомых уже в высокой степени оптимизировано и не содержит элементов, от которых можно было бы легко отказаться в пользу масштабирования. Энергетические и метаболические затраты на образование и поддержание функциональности органов чувств очень значительны (Howard et al., 1987; Niven, Laughlin, 2008). Вероятно, и у крупных насекомых в составе сенсилл и омматидиев наблюдаются только необходимые и оптимизированные по размеру элементы, так как излишние расходы энергии делают вид менее приспособленным эволюционно.
Сравнительный ультраструктурный анализ
Масштабирование омматидиев и сенсилл ограничено структурными и функциональными пределами и может различаться в органах чувств разных модальностей. Фоторецепторы насекомых признаны эволюционно отличными от сенсилл (Merritt, 2006). Омматидии не обнаруживают морфологического сходства с сенсиллой: сенсорные нейроны фоторецепторов ацилиарные и рабдомерные, а остальные клетки омматидия не гомологичны обкладочным клеткам сенсилл в отношении их морфологии или функции. Тем не менее генетические исследования развития показывают общую потребность в пронейральном гене (atonal) для фоторецепторов и хордотональных органов (Jarman et al., 1994).
Несмотря на отсутствие гомологичных структур, общие законы масштабирования одинаково влияют на сложные глаза и сенсорный аппарат антенн насекомых. Морфологические адаптации, обнаруженные у мельчайших насекомых, по большей части представляют собой структурные перестройки функциональных единиц сложных органов чувств. Однако сами клеточные реорганизации и редукции, обнаруженные в случаях экстремальной миниатюризации, будут различны для органов чувств разных модальностей и в разных группах насекомых и будут определяться происхождением органа. В отличие от омматидиев, клеточный состав которых в целом сохраняет такой же общий план строения, как у крупных насекомых, организация сенсилл демонстрирует редукции клеточного состава у экстремально миниатюрных насекомых. Отсутствие у M. amalphitanum вспомогательных клеток в составе сформировавшихся сенсилл может быть свидетельством уникальной адаптации к миниатюризации.
Количество и размер клеток, составляющих сложный орган чувств (сложные глаза, хордотональный орган), должны ограничивать миниатюризацию аналогично тому, что наблюдается в центральной нервной системе.
Сравнительный анализ масштабирования центральной и периферической нервной системы
Экстремальное уменьшение размера тела оказывает влияние почти на все аспекты биологии животных, включая строение и функции нервной системы и органов чувств. Масштабирование органов чувств неразрывно связано с изменениями в центральной нервной системе. Пределом миниатюризации для структур ЦНС явлется размер ядра и минимальный диаметр аксонов. Размер ядра ограничен размером генома, и у мельчайших насекомых уменьшается за счет увеличения степени копактизации хроматина (Polilov, 2015). Наименьший расчетный диаметр аксона не должен превышать 0.08 мкм (иначе возникнут шумовые помехи и нарушится работа ионных каналов) (Faisal et al., 2005). Однако у перепончатокрылого Encarsia formosa (Aphelinidae) длиной тела 0.6 мм имеются аксоны и меньшего диаметра – 0.045 мкм (Hustert, 2012). Значительное увеличение относительного объема центральной нервной системы у мелких форм, в сравнении с крупными (Eberhard, Wcisclo, 2011; Polilov, 2015; Polilov, Makarova, 2017 и другие), является распространенным аллометрическим паттерном, известным как правило Халлера (Rensch, 1948). Это правило требует радикальных структурных изменений и колоссальных энергетических затрат от видов с малым размером тела, необходимых для производства и поддержания непропорционального количества нервной ткани. Сенсорная обработка занимает часть общего энергопотребления нервной системы и, следовательно, ограничена как общим энергетическим бюджетом животного, так и распределением энергетических затрат в нервной системе (Niven, Laughlin, 2008). Подобно центральной нервной системе, миниатюрные органы чувств сталкиваются с двумя основными проблемами при обработке информации: шумом в ионных каналах и потреблением энергии (Niven, Farris, 2012). Меньший размер или большее число органов чувств увеличивают шум, влияя на обработку и передачу информации. Нервная ткань, включая афферентные волокна различных органов чувств, очень затратна в метаболическом плане (Laughlin et al., 1998; Niven, Laughlin, 2008). Так, около 10% от общего энергетического баланса (потребления кислорода сетчаткой) в состоянии покоя расходуется на поддержание фоторецепторов (Howard et al., 1987).
Учитывая, что степень развития зрения и количество омматидиев в сложном глазу коррелирует с размером оптических долей (Power, 1943; Rein et al., 1999; Gronenberg, Hölldobler, 1999), а размерные характеристики сложных глаз у некоторых насекомых успешно используются для оценки важности зрения (Gronenberg, Hölldobler, 1999), рост эволюционной значимости конкретной сенсорной модальности также может быть оценен через увеличение объема соответствующих нейропилярных центров нижнего и высшего порядка (Stöckl et al., 2016). Таким образом, изменение относительных объемов нейропилярных центров любой сенсорной модальности может привести к изменению работы этого анализатора, и будет во многом определять адаптацию животного к условиям микромира.
Помимо многократного увеличения относительного объема ЦНС и мозга, для микронасекомых отмечена значительная олигомеризация и концентрация ЦНС, изменение формы мозга, которое часто сопровождается асимметрией (Макарова, Полилов, 2013, 2013а, 2017, 2017а; Polilov, Makarova, 2017). Нервная система подвергается сокращению числа и размеров структурных элементов (нейронов, омматидиев в составе глаз, сенсилл на антеннах) при многократном уменьшении размера тела. А в экстремальных случаях миниатюризации наблюдаются уникальные адаптации. Так, одной из уникальных особенностей Megaphragma является строение ее центральной нервной системы, которая характеризуется лизисом 95% ядер нервных клеток (Polilov, 2012). Интересно, что наряду с почти безъядерной центральной нервной системой, все клетки рецепторных аппаратов органов чувств (сложных глаз, Джонстонова органа) сохраняют ядра. Учитывая энергопотребление сенсорных органов, нефункциональные органы не должны возникать в природе из-за снижения приспособленности ввиду потраченной энергии независимо от размера животного (Niven, Laughlin, 2008). Определить минимальную энергетическую потребность какого-либо органа практически невозможно, так как даже “простая” информация, несмотря на свою “дороговизну” с точки зрения метаболизма, может быть необходима для успешного воспроизводства и обеспечения выживания вида. Возможно, поддержание полнофункциональной сенсорной системы может иметь даже больший приоритет, чем сохранение ряда морфологических или функциональных свойств нервной системы.
Пределы уменьшения размеров органов чувств
Пределы масштабирования органов чувств определяются комплексной системой взаимозависимых параметров. Структурные и количественные параметры, такие как число и размер омматидиев в составе сложного глаза, сенсилл на антеннах насекомого, размер диоптрического аппарата, длина и ширина рабдома, будут определять функциональные пределы масштабирования и контролироваться физическими законами. Так, масштабирование звукоизлучающих структур будет регулироваться законами акустики (Sanborn, Phillips, 1995; Bennet-Clark, 1998), зрение – законами оптики (Kirschfeld, 1976; Land, 1997), обоняние – процессами диффузии и броуновского движения (Beebe et al., 2002), а чувствительность рецептора будет зависеть от его размера.
Наименьший известный диаметр фасетки составляет порядка 6 мкм и не ограничен дифракцией (Fischer et al., 2010). Малое число фасеток в составе сложного миниатюрного глаза (25–30), ниже экспериментально подтвержденного числа, необходимого для сохранения способности к навигации (50–60 по: McLeman et al., 2002). Однако, такого небольшого числа, все же достаточно для активного полета, способность к которому сохраняют почти все мельчайшие насекомые, многие из которых при этом обладают выдающимися летными способностями (Farisenkov et al., 2020). Число фасеток должно обеспечивать достаточное разрешение, а диаметр линз должен быть такого размера, чтобы пропускать достаточное количество света. Диоптрический аппарат должен быть способен сфокусировать свет на вершине рабдома, а рабдом должен быть настолько велик, чтобы поглотить достаточное количество фотонов для генерации сигнала. При этом в омматидии заданного размера должно быть достаточно места для органелл, необходимых для функционирования клеток. Все эти факторы зависят друг от друга, и ни один из них не может быть оптимизирован без влияния на другой.
Количество морфофункциональных типов сенсилл определяет набор сенсорных модальностей, воспринимаемых насекомым. При этом сенсиллы одной модальности, но разной морфологии, по всей видимости, увеличивают разнообразие сенсорной информации об окружающей среде. Если рассмотреть виды, обладающие наименьшим количеством типов антеннальных сенсилл, можно обнаружить, что их всего два, и, как правило, это механорецепторы и термо/гигрорецепторы (Kapoor, 1985; Gaino, Rebora, 1998; Derr, Cook, 2005; Fialho et al., 2014). Вероятно, наиболее необходимая информация о среде для насекомых (из модальностей, воспринимаемых сенсиллами) – тактильная, а также информация о температуре и влажности. Это предположение косвенно подтверждает тот факт, что даже у самого маленького насекомого, экстремально миниатюризованного самца Dicopomorpha echmepterygis (Hymenoptera, Mymaridae), не имеющего ни глаз, ни рта, есть по одной механорецепторной сенсилле на каждой антенне (Mockford, 1997). При этом у миниатюрных паразитических наездников Megaphragma, которые всего лишь в 1.1–1.4 раза больше, наблюдается уже 6/8 типов антеннальных сенсилл в зависимости от пола, необходимость в которых обусловлена паразитическим образом жизни (Diakova et al., 2018). Таким образом, минимальный предел количества типов сенсилл задается необходимостью насекомого в получении разнообразной сенсорной информации из окружающей среды и даже в самых экстремальных случаях требует наличия как минимум механорецепторов.
Предел уменьшения числа сенсилл косвенно связан с количеством их типов, так как модальность задает минимальное количество сенсилл каждого типа, необходимое для выполнения соответствующей функции. Так, для термо-/гигрорецепции может быть достаточно одной сенсиллы на антенну, что наблюдается, например, у миниатюрных наездников Megaphragma (Diakova et al., 2018). Сенсиллы других модальностей, как правило, представлены в большем количестве. Например, у пенницы Philaenus spumarius (Hemiptera, Aphrophoridae), обладающей наименьшим числом антеннальных сенсилл среди вошедших в анализ видов, на каждой антенне расположены три обонятельные базиконические сенсиллы, восемь целоконических сенсилл с двойной стенкой (предположительно также обонятельные) и четыре целоконические сенсиллы с одинарной стенкой (предположительно термо/гигрорецепторы) (Ranieri et al., 2016). Вероятно меньшее количество обонятельных сенсилл настолько снизит чувствительность антенны к запахам, что их наличие на антенне уже не будет иметь функционального смысла. По всей видимости, оптимизация количества сенсилл ограничена необходимостью сохранения чувствительности антенны к специфическим раздражителям, с одной стороны, и разнообразия этих раздражителей – с другой.
Пределы миниатюризации сенсилл определяются как минимум двумя факторами. Первый – это сохранение функциональности сенсилл. В случае с механорецептороными сенсиллами длина кутикулярного отдела напрямую влияет на их радиус восприятия стимулов, так как для этого необходим непосредственный контакт предметов со стенкой кутикулярного отдела сенсиллы. Таким образом, неудивительно, что самые короткие ChS наблюдаются у экстремально миниатюрных M. carribea, живущих в условиях микромира (Diakova et al., 2018). У них же обнаружена и наименьшая описанная на данный момент механорецепторная сенсилла, составляющая всего 0.48 мкм в длину и 0.32 мкм в диаметре. Эта сенсилла относится к проприоцептивным сенсиллам, которые находятся на сочленениях антенны Megaphragma и регистрируют движение сочленений относительно друг друга. В данном случае именно миниатюрные размеры члеников антенны позволяют ей сохранять функциональность даже при таких размерах.
Вторым фактором, ограничивающим миниатюризацию сенсилл, является сложность их ультраструктурной организации. Так, обонятельные сенсиллы содержат многократно ветвящиеся отростки множества чувствительных нейронов (Chiappini et al., 2001). Даже специализированные плакоидные сенсиллы на антенне миниатюрной Megaphragma имеют по 11–12 отростков на каждую сенсиллу (Diakova, Polilov, 2021).
Нейроны, содержащие специфические белковые обонятельные рецепторы, а также их проекции и гломерулы антеннальной доли составляют сложную систему с одотопической организацией (Gao et al., 2000), плохо поддающуюся оптимизации и миниатюризации. Вероятно, именно сложность внутреннего устройства ограничивает оптимизацию обонятельных MB, следствием чего является отсутствие корреляции между их размерными характеристиками и размерами тела.
Количество и размер клеток, составляющих рецепторный аппарат сложного органа чувств, должны ограничивать миниатюризацию аналогично тому, что наблюдается в центральной нервной системе. Значение имеют и метаболические затраты, и физические свойства. Одним из важных факторов, лимитирующих миниатюризацию нейронов и рецепторных клеток, по-видимому, является соотношение объемов ядра и цитоплазмы (Polilov, 2015). Изначально оценка данного параметра была основана на определении площади срезов, и соотношение составляло 90% (Полилов, 2008). Позднее эта оценка была уточнена на основании волюметрических исследований, и, согласно новым данным, соотношение объема ядра и цитоплазмы в нейронах и рецепторных клетках микронасекомых составляет от 50 (Fischer et al., 2018, 2019) до 77% (наши неопубл. д).
Предел масштабирования органов чувств любой модальности будет всегда определяться чувствительностью данного органа, которая зависит от размера и функциональности каждой структурной единицы органа (омматидия, сенсиллы). Баланс между сокращением числа и размера структурных элементов сложных органов чувств и важность той или иной модальности для биологии животного будет определять пределы масштабирования анализатора. Экстремальное уменьшение размера структурных единиц сложных органов чувств (сложные глаза, Джонстонов орган) сопровождается клеточными реорганизациями и даже редукциями, уменьшением размера клеточных компонентов и субклеточными перестройками, которые, тем не менее, не нарушают базовой конструкции, свойственной крупным насекомым.
ЗАКЛЮЧЕНИЕ
Размеры тела существенно влияют на организацию органов чувств насекомых. Анализ всех доступных данных позволил нам выделить общие принципы масштабирования органов чувств у насекомых. Число структурных единиц (сенсилл и омматидиев) сложных органов чувств сильно зависит от размеров тела и многократно изменяется вместе с изменениями размеров тела насекомых. Наряду с этим, размеры, структура и разнообразие отдельных единиц демонстрируют меньшую зависимость от размера тела или вовсе не зависят от него. По всей видимости, при уменьшении размера тела, адаптации, направленные на оптимизацию функционирования органов чувств, значительно ограничены поддержанием необходимого уровня функциональности органа.
Наибольший интерес для изучения масштабирования представляют предельные значения размеров тела. Органы чувств наиболее крупных насекомых детально не изучены. Мельчайшие насекомые изучены гораздо подробнее, и у них наблюдается ряд уникальных особенностей строения органов чувств, связанных с миниатюризацией.
Несмотря на общие принципы масштабирования, конструкция органов чувств разной модальности по-разному реагирует на экстремальное уменьшение размера тела: одни органы сохраняют клеточный состав структурных элементов (сложные глаза), свойственный крупным насекомым, у других обнаруживаются редукции целых групп клеток (например, трихогенной, тормогенной и текогенной клеток у M. amalphitanum). Обнаруженные у мельчайших насекомых уникальные морфологические адаптации (дистальное положение ядер фоторецепторных клеток, сокращение числа вторичных пигментных клеток, сокращение слоя трахеального тапетума и редукция рабдомеров у части фоторецепторов, утрата вспомогательных клеток рецепторного аппарата сенсилл и другие) демонстрируют, насколько эволюционно пластичны органы чувств насекомых. Функциональность органов чувств во многом определяется строением и размерами их структурных элементов, они же и ограничивают миниатюризацию. Для омматидиев это диаметр линзы, длина диоптрического аппарата, а также длина и диаметр рабдома. Для сенсилл – размеры чувствительных элементов рецепторов.
Разностороннее исследование организации органов чувств насекомых, в том числе и их масштабирования, – не только значительный шаг в изучении масштабирования у животных, но и интересный материал для технических решений при разработке сенсорных устройств в робототехнике. Результаты изучения сложных глаз уже позволяют делать общие заключения о принципах их масштабирования, однако часть направлений анализа данных по сенсиллам носит скорее предварительный характер и требует дальнейшего изучения. Также в литературе практически отсутствуют данные о строении органов чувств гигантов из мира насекомых. Проблема гигантизма также может стать перспективным направлением изучения масштабирования органов чувств, так как увеличение таких сложных структур тоже имеет свои пределы.
Список литературы
Елизаров Ю.А., Чайка С.Ю., 1972. Ультраструктурная организация обонятельных сенсилл антенн и пальп комаров Culex pipiens molestus (Diptera, Culicidae) // Зоологический журнал. Т. 11. Вып. 51. С. 1665–1674.
Жантиев Р.Д., 1969. Ультраструктурная организация механорецепторных сенсилл насекомых // Журнал общей биологии. Т. 30. С. 224–231.
Иванов В.П., 2000. Органы чувств насекомых и других членистоногих. М.: Наука. 279 с.
Леонович С.А., 2005. Сенсорные системы паразитических клещей. СПб.: Наука. 235 с.
Мазохин-Поршняков Г.А. (Ред.), 1983. Руководство по физиологии органов чувств насекомых. М.: Изд-во Моск. ун-та. 262 с.
Макарова А.А., Полилов А.А., 2013. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. I. Мельчайшие жесткокрылые – жуки-перокрылки (Coleoptera, Ptiliidae) // Зоологический журнал. Т. 92. С. 523–533.
Макарова А.А., Полилов А.А., 2013а. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. II. Мельчайшие перепончатокрылые (Нymenoptera, Mymaridae, Trichogrammatidae) // Зоологический журнал. Т. 92. С. 695–706.
Макарова А.А., Полилов А.А., 2017. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. III. Сеноеды (Psocoptera, Liposcelididae) // Зоологический журнал. Т. 96. С. 275–288.
Макарова А.А., Полилов А.А., 2017а. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. IV. Трипсы (Thysanoptera, Thripidae) // Зоологический журнал. Т. 96. С. 410–417.
Полилов А.А., 2008. Анатомия мельчайших жесткокрылых – жуков-перистокрылок трибы Nanosellini (Coleoptera, Ptiliidae) и пределы миниатюризации насекомых // Зоологический журнал. Т. 87. № 2. С. 181–188.
Синицина Е.Е., Чайка С.Ю., 2006. Атлас электронно-микроскопической морфологии хеморецепторных органов насекомых. М.: Типография Россельхозакадемии. 289 с.
Чайка С.Ю., 1980. Ультраструктура антеннальных сенсилл клопа Rhodnius prolixus (Hemiptera, Reduviidae) // Паразитология. Вып. 4. С. 486–491.
Чайка С.Ю., 2010. Нейроморфология насекомых. М.: Типография Россельхозакадемии. 396 с.
Ahmad A., Gupta N., Gupta D.K., Saxena A.K., 2014. Scanning electron microscopy of antennal sensilla of Goniocotes species infesting Helmeted guinea fowl, Numida meleagris (Galliformes: Numididae) // Researcher. V. 6. P. 155–167.
Ahmad A., Parveen S., Brozek, J., Dey D., 2016. Antennal sensilla of phytophagous and predatory pentatomids (Hemiptera: Pentatomidae): A comparative study of four genera // Zoologischer Anzeiger. Bd. 261. S. 48–55.
Ai H., Nishino H., Itoh T., 2007. Topographic organization of sensory afferents of Johnston’s organ in the honeybee brain // Journal of Comparative Neurology. V. 502. P. 1030–1046.
Al-Dosary M.M., 2009. Morphological characterization of the antennal sensilla of the earwig Anisolabis maritima (Dermaptera: Carcinophoridae) with reference to their probable functions // Saudi Journal of Biological Sciences. V. 16. P. 17–22.
Ali S.A.I., Diakite M.M., Ali S., Wang M.Q., 2016. Effects of the antennal sensilla distribution pattern on the behavioral responses of Tribolium castaneum (Coleoptera: Tenebrionidae) // Florida Entomologist. V. 99. P. 52–59.
Amornsak W., Cribb B., Gordh G., 1998. External morphology of antennal sensilla of Trichogramma australicum Girault (Hymenoptera: Trichogrammatidae) // International Journal of Insect Morphology and Embryology. V. 27. P. 67–82.
Anderson P., Hallberg E., Subchev M., 2000. Morphology of antennal sensilla auricillica and their detection of plant volatiles in the Herald moth, Scoliopteryx libatrix L. (Lepidoptera: Noctuidae) // Arthropod Structure & Development. V. 29. P. 33–41.
Arya S., Singh S.K., 2012. Antennal sensilla of head of poultry shaft louse, Menopon gallinae (Phthiraptera, Insecta, Menoponidae, Amblycera) // Journal of Applied and Natural Science. V. 4. P. 196–199.
Arzuffi R., Robledo N., Valdez J., 2008. Antennal sensilla of Toxotrypana curvicauda (Diptera: Tephritidae) // Florida Entomologist. V. 91. P. 669–673.
van Baaren J., Barbier R., Nénon J.P., 1996. Female antennal sensilla of Epidinocarsis lopezi and Leptomastix dactylopii (Hymenoptera: Encyrtidae), parasitoids of pseudococcid mealybugs // Canadian Journal of Zoology. V. 74. P. 710–720.
van Baaren J., Boivin G., Bourdais D., Roux O., 2007. Antennal sensilla of hymenopteran parasitic wasps: variations linked to host exploitation behavior // Modern Research and Educational Topics in Microscopy. V. 1. P. 345–352.
van Baaren J., Boivin G., Le Lannic J., Nénon J.P., 1999. Comparison of antennal sensilla of Anaphes victus and A. listronoti (Hymenoptera, Mymaridae), egg parasitoids of Curculionidae // Zoomorphology. V. 119. P. 1–8.
Baker G.T., Chandrapatya A., 1992. Sensilla on the mouthparts and antennae of the elephant louse, Haematomyzus elephantis Piaget (Phthiraptera: Haematomyzidae) // Journal of Morphology. V. 214. P. 333–340.
Barlin M.R., Vinson S.B., Piper G.L., 1981. Ultrastructure of the antennal sensilla of the cockroach-egg parasitoid, Tetrastichus hagenowii (Hymenoptera: Eulophidae) // Journal of Morphology. V. 108. P. 97–108.
Barlow H.B., 1952. The size of ommatidia in apposition eyes // Journal of Experimental Biology. V. 29. P. 667–674.
Barsagade D.D., Tembhare D.B., Kadu S.G., 2013. Microscopic structure of antennal sensilla in the carpenter ant Camponotus compressus (Fabricius) (Formicidae: Hymenoptera) // Asian Myrmecology. V. 5. P. 113–120.
Beebe D.J., Mensing G.A., Walker G.M., 2002. Physics and applications of microfluidics in biology // Annual Review of Biomedical Engineering. V. 4. P. 261–286.
Bennet-Clark H.C., 1998. Size and scale effects as constraints in insect sound communication // Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. V. 353. P. 407–419.
Bin F., Colazza S., Isidoro N., Solinas M., Vinson S.B., 1989. Antennal chemosensilla and glands, and their possible meaning in the reproductive behaviour of Trissolcus basalis (Woll.) (Hym.: Scelionidae) // Entomologica. V. 24. P. 65–79.
Bisotto-de-Oliveira R., Redaelli L.R., Santana J., 2011. Morphometry and distribution of sensilla on the antennae of Anastrepha fraterculus (Wiedemann) (Diptera: Tephritidae) // Neotropical Entomology. V. 40. P. 212–216.
Blackwell A., Mordue J.A., Mordue W., 1992. Morphology of the antennae of two species of biting midge: Culicoides impunctatus (Goetghebuer) and Culicoides nubeculosus (Meigen) (Diptera, Ceratopogonidae) // Journal of Morphology. V. 103. P. 85–103.
Bland R.G., 1994. External morphology and abundance of antennal sensilla in australian Gryllacrididae // Journal of Morphology. V. 18. P. 252–270.
Bleeker M.A. K., Smid H.M., Van Aelst A.C., Van Loon J.J.A., Vet L.E.M., 2004. Antennal sensilla of two parasitoid wasps: A comparative scanning electron microscopy study // Microscopy Research and Technique. V. 63. P. 266–273.
Blöchl R., Selzer R., 1988. Embryogenesis of the connective chordotonal organ in the pedicel of the American cockroach: Cell lineage and morphological differentiation // Cell and Tissue Research. V. 252. P. 669–678.
Boekhoff-Falk G., Eberl D.F., 2014. The Drosophila auditory system // Wiley Interdisciplinary Reviews: Developmental Biology. V. 3. P. 179–191.
Borden J.H., 1968. Antennal morphology of Ips confusus (Coleoptera: Scolytidae) // Annals of the Entomological Society of America. V. 61. P. 10–13.
Bromley A.K., Dunn J.A., Anderson M., 1980. Ultrastructure of the antennal sensilla of aphids // Cell and Tissue Research. V. 205. P. 493–511.
Butterfield A., Anderson M., 1994. Morphology and ultrastructure of antennal sensilla of the parasitoid, Trybliographa rapae (Westw.) (Hymenoptera: Cynipidae) // International Journal of Insect Morphology and Embryology. V. 23. P. 11–20.
Callahan P.S., 1975. Insect antennae with special reference to the mechanism of scent detection and the evolution of the sensilla // International Journal of Insect Morphology and Embryology. V. 4. P. 381–430.
Carbajal-de-la-Fuente A.L., Catalá S., 2002. Relationship between antennal sensilla pattern and habitat in six species of Triatominae // Memorias Do Instituto Oswaldo Cruz. V. 97. P. 1121–1125.
Carle T., Toh Y., Yamawaki Y., Watanabe H., Yokohari F., 2014. The antennal sensilla of the praying mantis Tenodera aridifolia: A new flagellar partition based on the antennal macro-, micro- and ultrastructures // Arthropod Structure & Development. V. 43. P. 103–116.
Castrejón-Gómez V.R., Carrasco J.V., 2008. Morphological characteristics of antennal sensilla in Talponia batesi (Lepidoptera: Tortricidae) // Annals of the Entomological Society of America. V. 101. P. 181–188.
Castrejón-Gómez V.R., Nieto G., Valdes J., Castrejón F., Rojas J.C., 2003. The antennal sensilla of Zamagiria dixolophella Dyar (Lepidoptera: Pyralidae) // Annals of the Entomological Society of America. V. 96. P. 672–678.
Castrejón-Gómez V.R., Rojas J.C., 2009. Antennal sensilla of Anastrepha serpentina (Diptera: Tephritidae) // Annals of the Entomological Society of America. V. 102. P. 310–316.
Cave R.D., Gaylor M.J., 1987. Antennal sensilla of male and female Telenomus reynoldsi Gordh and Coker (Hymenoptera: Scelionidae) // International Journal of Insect Morphology and Embryology. V. 16. P. 27–39.
Chang X.Q., Zhang S., Lv L., Wang M.Q., 2015. Insight into the ultrastructure of antennal sensilla of Mythimna separata (Lepidoptera: Noctuidae) // Journal of Insect Science. V. 15. P. 1–8.
Chen H.H., Zhao Y.X., Kang L., 2003. Antennal sensilla of grasshoppers (Orthoptera: Acrididae) in relation to food preferences and habits // Journal of Biosciences. V. 28. P. 743–752.
Chen L., Fadamiro H.Y., 2008. Antennal sensilla of the decapitating phorid fly, Pseudacteon tricuspis (Diptera: Phoridae) // Micron. V. 39. P. 517–525.
Chiappini E., Solinas C., Solinas M., 2001. Antennal sensilla of Anagrus atomus (L.) (Hymenoptera: Mymaridae) female and their possible behavioural significance // Entomologica. V. 35. P. 51–76.
Chu-Wang I.W., Axtell R.C., Kline D.L., 1975. Antennal and palpal sensilla of the sand fly Culicoides furens (Poey) (Diptera: Ceratopogonidae) // International Journal of Insect Morphology and Embryology. V. 4. P. 131–149.
Cicchino A.C., Abrahamovich A.H., 1988. Contribution to the knowledge of the cepahalic sensilla and the water-uptake system of adults and nymphs of Vernoniella bergi (Kellogg 1906) (Insecta; Phthiraptera: Ischnocera) // Microscopia Electronica y Biologia Celular. V. 12. P. 121–148.
Clarke A.R., 1990. External morphology of the antennae of Damalinia ovis (Phthiraptera: Trichodectidae) // Journal of Morphology. V. 203. P. 203–209.
Consoli F.L., Kitajima E.W., Parra J.R.P., 1999. Sensilla on the antenna and ovipositor of the parasitic wasps Trichogramma galloi Zucchi and T. pretiosum Riley (Hym., Trichogrammatidae) // Microscopy Research and Technique. V. 324. P. 313–324.
Cribb B.W., 1996. Antennal sensilla of the female biting midge: Forcipomyia (Lasiohelea) townsvillensis (Taylor) (Diptera: Ceratopogonidae) // International Journal of Insect Morphology and Embryology. V. 25. P. 405–425.
Crook D.J., Kerr L.M., Mastro V.C., 2008. Sensilla on the antennal flagellum of Sirex noctilio (Hymenoptera: Siricidae) // Annals of the Entomological Society of America. V. 101. P. 1094–1102.
Cruz M.D.S., 1996. Antennal sense organs of Phthiraptera (Insecta). Scanning electron microscopy of the “Pit Organs” of several species of Anoplura // Micron. V. 27. P. 11–15.
da Rocha L., Moreira G.R.P., Redaelli L.R., 2007. Morphology and distribution of antennal sensilla of Gryon gallardoi (Brèthes) (Hymenoptera: Scelionidae) females // Neotropical Entomology. V. 36. P. 721–728.
da Silva K.B., da Silva C.B., Ribeiro Júnior K.A.L., de Freitas J.M.D., de Freitas J.D. et al., 2019. Morphology and distribution of antennal sensilla of Automeris liberia (Lepidoptera: Saturniidae) // Micron. V. 123. P. 71–89.
Das P., Chen L., Sharma K.R., Fadamiro H.Y., 2011. Abundance of antennal chemosensilla in two parasitoid wasps with different degree of host specificity may explain sexual and species differences in their response to host-related volatiles // Microscopy Research and Technique. V. 74. P. 900–909.
Davis D.R., 1994. New leaf-mining moths from Chile, with remarks on the history and composition of Phyllocnistinae (Lepidoptera: Gracillariidae) // Tropical Lepidoptera. V. 5. P. 65–75.
De Facci M., Wallén R., Hallberg E., Anderbrant O., 2011. Flagellar sensilla of the eusocial gall-inducing thrips Kladothrips intermedius and its kleptoparasite, Koptothrips dyskritus (Thysanoptera: Phlaeothripinae) // Arthropod Structure & Development. V. 40. P. 495–508.
Derr D.P., Cook J.L., 2005. Morphology of the antenna of Caenocholax fenyesi pierce (Strepsiptera: Myrmecolacidae) based on scanning electron microscopy // Proceedings of the Entomological Society of Washington. V. 107. P. 762–769.
Di Giulio A., Maurizi E., Rossi Stacconi M.V., Romani R., 2012. Functional structure of antennal sensilla in the myrmecophilous beetle Paussus favieri (Coleoptera, Carabidae, Paussini) // Micron. V. 43. P. 705–719.
Diakova A.V., Makarova A.A., Polilov A.A., 2018. Between extreme simplification and ideal optimization: antennal sensilla morphology of miniaturized Megaphragma wasps (Hymenoptera: Trichogrammatidae) // PeerJ. V. 6. e6005.
Diakova A.V., Polilov A.A., 2020. Sensation of the tiniest kind: the antennal sensilla of the smallest free-living insect Scydosella musawasensis (Coleoptera: Ptiliidae) // PeerJ. V. 8. e1040.
Diakova A.V., Polilov A.A., 2021. Porous or non-porous? The challenge of studying unusual placoid sensilla of Megaphragma wasps (Hymenoptera, Trichogrammatidae) with electron microscopy // Journal of Hymenoptera Research. V. 84. P. 69–73.
Dickens J.C., Hart W.G., Light D.M., Jang E.B., 1988. Tephritid olfaction: morphology of the antennae of four tropical species of economic importance (Diptera: Tephritidae) // Annals of the Entomological Society of America. V. 81. P. 325–331.
Ding Y.H., Zhu G.P.P., Wang M.Q., Zhang, G.A., 2010. Observation of antennal sensilla of Frankliniella occidentalis with scanning electron microscopy // Chinese Bulletin of Entomology. V. 47. P. 165–171.
Dippel S., Kollmann M., Oberhofer G., Montino A., Knoll C. et al., 2016. Morphological and transcriptomic analysis of a beetle chemosensory system reveals a gnathal olfactory center // BMC Biology. V. 14. P. 65–77.
Dreller C., Kirchner W.H., 1995. The sense of hearing in honeybees // Bee World. V. 76. P. 6–17.
Drilling K., Klass K.D., 2010. Surface structures of the antenna of Mantophasmatodea (Insecta) // Zoologischer Anzeiger. Bd. 249. S. 121–137.
Dvořáček J., Sehadova H., Weyda F., Tomčala A., Hejníková M., Kodrík D., 2020. First comprehensive study of a giant among the insects, Titanus giganteus: basic facts from its biochemistry, physiology, and anatomy // Insects. V. 11. P. 1–22.
Dweck H.K.M., 2009. Antennal sensory receptors of Pteromalus puparum female (Hymenoptera: Pteromalidae), a gregarious pupal endoparasitoid of Pieris rapae // Micron. V. 40. P. 769–774.
Dyer L.J., Seabrook W.D., 1975. Sensilla on the antennal flagellum of the sawyer beetles Monochamus notatus (Drury) and Monochamus scutellatus (Say) (Coleoptera: Cerambycidae) // Journal of Morphology. V. 146. P. 513–531.
Eberhard W.G., Wcislo W.T., 2011. Grade changes in brain-body allometry: morphological and behavioural correlates of brain size in miniature spiders, insects and other invertebrates // Advances in Insect Physiology. Casas J. (Ed.). Burlington: Academic Press. P. 154–214.
Faisal A.A., White J.A., Laughlin S.B., 2005. Ion-channel noise places limits on the miniaturization of the brain’s wiring // Current Biology. V. 15. Issue 12. P. 1143–1149.
Farhadian S.F., Suárez-Fariñas M., Cho C.E., Pellegrino M., Vosshall L.B., 2012. Post-fasting olfactory, transcriptional, and feeding responses in Drosophila // Physiology and Behavior. V. 105. P. 544–553.
Farisenkov S.E., Lapina N.A., Petrov P.N., Polilov A.A., 2020. Extraordinary flight performance of the smallest beetles // PNAS. V. 117. № 40. P. 24643-24645.
Faucheux M.J., 2006. Antennal sensilla of male Lophocorona pediasia Common 1973 and their phylogenetic implications (Lepidoptera: Lophocoronidae) // Annales de La Societe Entomologique de France. V. 42. P. 113–118.
Faucheux M.J., 2008. Antennal sensilla of the male praying mantid Oxyothespis maroccana Bolivar, 1908 (Insecta: Mantodea: Mantidae): distribution and functional implications // Bulletin de l’Institut Scientifique. V. 20. P. 29–36.
Faucheux M.J., 2017. Antennal sensilla of the armoured ground cricket, Eugaster powysi Kirby, 1891 (Orthoptera, Tettigoniidae, Hetrodinae) // Bulletin de l’Institut Scientifique. V. 39. P. 1–17.
Faucheux M.J., Gibbs G.W., 2008. Antennal sensilla in the endemic New Zealand moth family Mnesarchaeidae: morphology and phylogenetic implications (Lepidoptera: Mnesarchaeoidea) // Bulletin de l’Institut Royal Des Sciences Naturelles de Belgique, Entomologie. V. 78. P. 123–133.
Faucheux M.J., Gibernau M., 2011. Antennal sensilla in five Psychodini moth flies (Diptera: Psychodidae: Psychodinae) pollinators of Arum spp. (Araceae) // Annales de La Societe Entomologique de France. V. 47. P. 89–100.
Fea M.P., Mark C.J., Holwell G.I., 2019. Sexually dimorphic antennal structures of New Zealand Cave Wētā (Orthoptera: Rhaphidophoridae) // New Zealand Journal of Zoology. V. 46. P. 124–148.
Felippe-Bauer M.L., Bauer P.G., Silva Filho F.C., 1989. Scanning electron microscopy of the antennal sensilla in female Culicoides paraensis (Diptera: Ceratopogonidae) // Memórias Do Instituto Oswaldo Cruz. V. 84. P. 463–469.
Fialho M.D.C.Q., Guss-Matiello C.P., Zanuncio J.C., Campos L.A.O., Serrão J.E., 2014. A comparative study of the antennal sensilla in corbiculate bees // Journal of Apicultural Research. V. 53. P. 392–403.
Field L.H., Matheson T., 1998. Chordotonal Organs of Insects // Advances in Insect Physiology. V. 27. Elsevier. 230 p.
Fischer S., Lu Z., Meinertzhagen I.A., 2019. Three-dimensional ultrastructural organization of the ommatidium of the minute parasitoid wasp Trichogramma evanescens // Arthropod Structure & Development. V. 48. P. 35–48.
Fischer S., Müller C.H.G., Meyer-Rochow V.B., 2010. How small can small be: The compound eye of the parasitoid wasp Trichogramma evanescens (Westwood, 1833) (Hymenoptera, Hexapoda), an insect of 0.3- to 0.4-mm total body size // Visual Neuroscience. V. 28. P. 295–308.
Fischer S., Lu Z., Meinertzhagen I.A., 2018. From two to three dimensions: the importance of the third dimension for evaluating the limits to neuronal miniaturization in insects // Journal of Comparative Neurology. V. 526. № 4. P. 653–662.
Frank D.L., Leskey T.C., Bergh J.C., 2010. Morphological characterization of antennal sensilla of the Dogwood Borer (Lepidoptera: Sesiidae) // Annals of the Entomological Society of America. V. 103. P. 993–1002.
Fernandes F.F., de Bahia-Nascimento A.C., Pinto L.C., Sousa Leal C., de Secundino N.F.C., Pimenta P.F.P., 2008. Fine structure and distribution pattern of antennal sensilla of Lutzomyia longipalpis (Diptera: Psychodidae) sand flies // Journal of Medical Entomology. V. 45. P. 982–990.
Fernandes F.F., Linardi P.M., Chiarini-Garcia H., 2002. Morphology of the antenna of Dermatobia hominis (Diptera: Cuterebridae) based on scanning electron microscopy // Journal of Medical Entomology. V. 39. P. 36–43.
Fernandes F.F., de Pimenta P.F.P., Linardi P.M., 2009. Antennal sensilla of the New World screwworm fly, Cochliomyia hominivorax (Diptera: Calliphoridae) // Journal of Medical Entomology. V. 41. P. 545–551.
Fu B.X., Bellis G.A., Hong J., Wang J.R., Wu Q. et al., 2012. Morphology, distribution, and abundance of antennal sensilla of male and female macropterous and brachypterous small brown planthopper, Laodelphax striatellus (Fallén) (Hemiptera: Delphacidae) // Microscopy Research and Technique. V. 75. P. 1492–1512.
Gaino E., Rebora M., 1998. Ultrastructure of the antennal sensilla of the mayfly Baetis rhodani (Pictet) (Ephemeroptera: Baetidae) // International Journal of Insect Morphology and Embryology. V. 27. P. 143–149.
Galindo K., Smith D.P., 2001. A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla // Genetics. V. 159. P. 1059–1072.
Galvani G.L., González A., Roig-Alsina A.H., Settembrini B.P., 2012. Distribution and morphometric studies of flagellar sensilla in Emphorini bees (Hymenoptera, Apoidea) // Micron. V. 43. P. 673–687.
Gao Q., Yuan B., Chess A., 2000. Convergent projections of Drosophila olfactory neurons to specific glomeruli in the antennal lobe // Nature Neuroscience. V. 3. P. 780–785.
Gao Y., Luo L.Z., Hammond A., 2007. Antennal morphology, structure and sensilla distribution in Microplitis pallidipes (Hymenoptera: Braconidae) // Micron. V. 38. P. 684–693.
Giangiuliani G., Lucchi A., Vinson S.B., Bin F., 1994. External anatomy of adult antennal sensilla of the fly, Trichopoda pennipes F. (Diptera: Tachinidae) // International Journal of Insect Morphology and Embryology. V. 23. P. 105–113.
Giannakakis A., Fletcher B.S., 1985. Morphology and distribution of antennal sensilla of Dacus tryoni (Froggat) (Diptera: Tephritidae) // Journal of the Australian Entomological Society. V. 31–35. P. 110–129.
Gonzaga-Segura J., Valdéz-Carrasco J., Castrejón-Gómez V.R., 2013. Sense organs on the antennal flagellum of Leptoglossus zonatus (Heteroptera: Coreidae) // Annals of the Entomological Society of America. V. 106. P. 510–517.
Greenwood M., Chapman R.F., 1984. Differences in numbers of sensilla on the antennae of solitarious and gregarious Locusta migratoria L. (Orthoptera: Acrididae) // International Journal of Insect Morphology and Embryology. V. 13. P. 295–301.
Gronenberg W., Hölldobler B., 1999. Morphologic representation of visual and antennal information in the ant brain // Journal of Comparative Neurology. V. 412. P. 229–240.
Hallberg E., Hansson B.S., Lofsted C., 2003. Sensilla and proprioceptors // Lepidoptera, Moths and Butterflies. N.P. Kristensen (Ed.). V. 2: Morphology, Physiology, and Development. Berlin: De Gruyter. P. 265–278.
Handique G., Bhattacharyya B., Baruah A.A.L.H., Boruah R., 2017. Antenna morphology and sensilla microstructure of the male and female scarab beetle, Lepidiota mansueta Burmeister (Coleoptera: Scarabaeidae) // Invertebrate Reproduction and Development. V. 61. P. 200–205.
Harbach R.E., Larsen J.R., 1977. Fine structure of antennal sensilla of the adult mealworm beetle, Tenebrio molitor L. (Coleoptera: Tenebrionidae) // International Journal of Insect Morphology and Embryology. V. 6. P. 41–60.
Hempolchom C., Yasanga T., Wijit A., Taai K., Dedkhad W. et al., 2017. Scanning electron microscopy of antennal sensilla of the eight Anopheles species of the Hyrcanus Group (Diptera: Culicidae) in Thailand // Parasitology Research. V. 116. P. 143–153.
Henderson D.E.H., Wellington W.G., 1982. Antennal sensilla of some aphidophagous Syrphidae (Diptera): fine structure and electroantennogramme study // Canadian Journal of Zoology. V. 60. P. 3172–3186.
Holwell G.I., Barry K.L., Herberstein M.E., 2007. Mate location, antennal morphology, and ecology in two praying mantids (Insecta: Mantodea) // Biological Journal of the Linnean Society. V. 91. P. 307–313.
Honda I., Ishikawa Y., Matsumoto Y., 1983. Morphological studies on the antennal sensilla of the onion fly, Hylemya antiqua Meigen (Diptera: Anthomyiidae) // Applied Entomology and Zoology. V. 18. P. 170–181.
Howard J., Blakeslee B., Laughlin S.B., 1987. The intracellular pupil mechanism and photoreceptor signal-noise ratios in the fly Lucilia cuprina // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 231. P. 415–435.
Hu F., Zhang G.-N., Jia F.-X., Dou W., Wang J.-J., 2010. Morphological characterization and distribution of antennal sensilla of six fruit flies (Diptera: Tephritidae) // Annals of the Entomological Society of America. V. 103. P. 661–670.
Hu F., Zhang G.N., Wang J.J., 2009. Antennal sensillae of five stored-product psocids pests (Psocoptera: Liposcelididae) // Micron. V. 40. P. 628–634.
Hu Q., Li W., Feng J., 2020. Morphology, distribution, ultrastructure, and possible function of the external sensilla on antennae and mouthparts of Echinothrips americanus Morgan (Thysanoptera: Thripidae) // Journal of Asia-Pacific Entomology. V. 23. P. 599–605.
Hustert R., 2012. Giant and dwarf axons in aminiature insect, Encarsia formosa (Hymenoptera, Calcididae) // Arthropod Structure & Development. V. 41. Issue 6. P. 535–543.
Ilango K., 2000. Morphological characteristics of the antennal flagellum and its sensilla chaetica with character displacement in the sandfly Phlebotomus argentipes Annandale and Brunetti sensu lato (Diptera: Psychodidae) // Journal of Biosciences. V. 25. P. 163–172.
Ivanov V.D., Melnitsky S.I., 2011. Structure and morphological types of the antennal olfactory sensilla in Phryganeidae and Limnephilidae (Insecta: Trichoptera) // Zoosymposia. V. 5. P. 210–234.
Jarman A.P., Grell E.H., Ackerman L., Jan L.Y., Jan Y.N., 1994. Atonal is the proneural gene for Drosophila photoreceptors // Nature. V. 369. P. 398–400.
Jiang N., Li Q., Zhou J.H., Xiao Y.B., 2010. Observation of antennal sensilla of Stomphastis thraustica with scanning electron microscope // Chinese Bulletin of Entomology. V. 47. P. 355–359.
Juan W., Hong Y.C., Meng Q.W., Chen X.L., Li S.Z., 2017. Scanning electron microscopy (SEM) observations of antennal sensilla of Chrysopa pallens Rambur (Neuroptera: Chrysopidae) // Plant Diseases & Pests. V. 8. P. 1–19.
Jun L., Qiang G., Shi C.H., Lu J., Guang W.L., 2013. Types, morphologies and distributions of antennal sensilla of Quadrastichus erythrinae (Hymenptera: Eulophidae) // Florida Entomologist. V. 96. P. 1288–1297.
Kamikouchi A., Shimada T., Ito K., 2006. Comprehensive classification of the auditory sensory projections in the brain of the fruit fly Drosophila melanogaster // The Journal of Comparative Neurology. V. 499. P. 317–356.
Kapoor N.N., 1985. External morphology and distribution of the antennal sensilla of the stonefly, Paragnetina media (Walker) (Plecoptera: Perlidae) // International Journal of Insect Morphology and Embryology. V. 14. P. 273–280.
Keil T.A., 1978. Die Makrochaeten auf dem Thorax von Calliphora vicina Robineau-Disvoidy (Calliphoridae, Diptera) // Zoomorphologie. Bd 90. S. 151-180.
Keil T.A., 1997. Comparative morphogenesis of sensilla: A review // International Journal of Insect Morphology and Embryology. V. 26. P. 151-160.
Keil T.A., 1997a. Functional Morphology of Insect Mechanoreceptors // Microscopy Research and Technique. V. 39. P. 506–531.
Keyan Z.S., Wang Y., Li D., Liu Y., Li X.J., Cheng W.N., 2016. Morphology, ultrastructure and possible functions of antennal sensilla of Sitodiplosis mosellana Géhin (Diptera: Cecidomyiidae) // Journal of Insect Science. V. 16. P. 71–87.
Kim J.L., Yamasaki T., 1996. Sensilla of Carabus (Isiocarabus) fiduciarius saishutoicus Csiki (Coleoptera: Carabidae) // International Journal of Insect Morphology and Embryology. V. 25. P. 153–172.
Kirschfeld K., 1976. The Resolution of Lens and Compound Eyes // Neural Principles in Vision. Zettler F., Weiler R. (Eds). Berlin–Heidelberg: Springer. P. 354–370.
Klein U., Bock C., Kafka W.A., Moore T.E., 1988. Antennal sensilla of Magicicada cassini (Fisher) (Homoptera: Cicadidae): Fine structure and electrophysiological evidence for olfaction // International Journal of Insect Morphology and Embryology. V. 17. P. 153–167.
Kline D.L., Axtell R.C., 1999. Sensilla of the antennae and maxillary palps of Culicoides hollensis and C. melleus (Diptera: Ceratopogonidae) // Journal of Medical Entomology. V. 36. P. 493–502.
Kuhbandner B., 1984. Ultrastructure and ontogeny of the hair sensilla on the funicle of Calliphora erythrocephala (Insecta, Diptera) I. The basiconical sensilla // Zoomorphology. V. 104. P. 373–385.
Kuhbandner B., 1985. Ultrastructure and ontogeny of the double-walled sensilla on the funicle of Calliphora erythrocephala Meigen (Diptera: Calliphoridae) // International Journal of Insect Morphology and Embryology. V. 14. P. 227–242.
Kuřavová K., Wahab R.A., Kočárek P., 2017. External morphology of the antennae and sense organs of the groundhopper Discotettix belzebuth (Orthoptera, Tetrigidae) // Zoologischer Anzeiger. Bd. 266. S. 120–128.
Land M.F., 1981. Optics and vision in invertebrates // In Handbook of Sensory Physiology. Autrum H. (Ed.). Vol. 7/6C. Berlin, Germany: Springer Verlag. P. 471–592.
Land M.F., 1997. Visual Acuity in Insects // Annual Review of Entomology. V. 42. P. 147–177.
Laughlin S.B., de Ruyter van Steveninck R.R., Anderson J.C., 1998. The metabolic cost of neural information // Nature Reviews Neurosciences. V. 1. P. 36–41.
Lee J.K., Altner H., 1985. Sensory cell degeneration in the ontogeny of the chemosensitive sensilla in the labial palp-pit organs of the butterfly, Pieris rapae L. (Insecta, Lepidoptera) // Cell and Tissue Research. V. 242. P. 279–288.
Lee W., Chang J., Hwang Y., Lin T., 1994. Morphology of the antennal sensilla of the oriental fruit fly, Dacus dorsalis Hendel (Diptera: Tephritidae) // Zoological Studies. V. 33. P. 65–71.
Li N., Ren B.Z., Liu M., 2007. The study on antennal sensilla of eight Acrididae species (Orthoptera: Acridoidea) in Northeast China // Zootaxa. V. 1544. P. 59–68.
Li W., Feng J., 2013. Ultrastructure of antennal sensilla in three species of Frankliniella Karny (Thysanoptera: Thripidae) // Acta Entomologica Sinica. V. 56. P. 1088–1097.
Li X.Y., Liu X.H., Ge Y.Q., Zhang D., 2015. Scanning electron microscopy of antennal sensory organs of the cattle grub, Hypoderma lineatum (Diptera: Oestridae) // Parasitology Research. V. 114. P. 3865–3871.
Li Z., Yang P., Peng Y., Yang D., 2009. Ultrastructure of antennal sensilla of female Ceratosolen solmsi marchali (Hymenoptera: Chalcidoidea: Agaonidae: Agaoninae) // The Canadian Entomologist. V. 141. P. 463–477.
Liang A.P., 2001. Morphology of antennal sensilla in Achilixius sandakanensis Muir (Hemiptera: Fulgoromorpha: Achilixiidae) with comments on the phylogenetic position of the Achilixiidae // Raffles Bulletin of Zoology. V. 49. P. 221–225.
Liu X.H., Liu J.J., Li X.Y., Zhang D., 2016. Antennal sensory organs of Scathophaga stercoraria (Linnaeus, 1758) (Diptera: Scathophagidae): ultramorphology and phylogenetic implications // Zootaxa. V. 4067. P. 361–372.
Liu X.H., Zhang M., Shi J., Li K., Zhang D., 2013. Ultrastructure of antennal sensilla of a parasitoid fly, Pales pavida Meigen (Diptera: Tachinidae) // Micron. V. 55. P. 36–42.
Makarova A.A., Meyer-Rochow V.B., Polilov A.A., 2019. Morphology and scaling of compound eyes in the smallest beetles (Coleoptera: Ptiliidae) // Arthropod Structure & Development. V. 48. P. 83–97.
Makarova A.A., Polilov A.A., Fischer S., 2015. Comparative morphological analysis of compound eye miniaturization in minute hymenoptera // Arthropod Structure & Development. V. 44. P. 21–32.
Malo E.A., Castrejón-Gómez V.R., Cruz-López L., Rojas J.C., 2004. Antennal sensilla and electrophysiological response of male and female Spodoptera frugiperda (Lepidoptera: Noctuidae) to conspecific sex pheromone and plant odors // Annals of the Entomological Society of America. V. 97. P. 1273–1284.
Martini R., Schmidt K., 1983. Cell degeneration during early development of hymenopteran olfactory sensilla // Tissue and Cell. V. 15. P. 823-827.
Marques-Silva S., Matiello-Guss C.P., Delabie J.H.C., Mariano C.S.F., Zanuncio J.C., Serrão J.E., 2006. Sensilla and secretory glands in the antennae of a primitive ant: Dinoponera lucida (Formicidae: Ponerinae) // Microscopy Research and Technique. V. 69. P. 885–890.
McIver S.B., 1969. Antennal sense organs of female Culex tarsalis (Diptera: Culicidae) // Annals of the Entomological Society of America. V. 62. P. 1455–1461.
McIver S.B., 1980. Sensory aspects of mate-finding behavior in male mosquitoes (Diptera: Culicidae) // Journal of Medical Entomology. V. 17. P. 54–57.
McLeman M.A., Pratt S.C., Franks N.R., 2002. Navigation using visual landmarks by the ant Leptothorax albipennis // Insectes Sociaux. V. 49. P. 203–208.
Melnitsky S.I., Ivanov V.D., Valuyskiy M.Y., Zueva L.V., Zhukovskaya M.I., 2018. Comparison of sensory structures on the antenna of different species of Philopotamidae (Insecta: Trichoptera) // Arthropod Structure & Development. V. 47. P. 45–55.
Mercer K.L., McIver S.B., 1973. Studies on the antennal sensilla of selected blackflies (Diptera: Simuliidae) // Canadian Journal of Zoology. V. 51. P. 729–734.
Merivee E., Ploomi A., Rahi M., Bresciani J., Ravn H.P. et al., 2002. Antennal sensilla of the ground beetle Bembidion properans Steph. (Coleoptera, Carabidae) // Micron. V. 33. P. 429–440.
Merritt D.J., 2006. The organule concept of insect sense organs: sensory transduction and organule evolution // Advances in Insect Physiology. Simpson S.J. (Ed.). Oxford, U.K.: Academic Press. V. 33. P. 192–241.
Missbach C., Dweck H.K.M., Vogel H., Vilcinskas A., Stensmyr M.C. et al., 2014. Evolution of insect olfactory receptors // ELife. V. 20. P. 1–22.
Mockford E.L., 1997. A new species of Dicopomorpha (Hymenoptera: Mymaridae) with diminutive, apterous males // Annals of the Entomological Society of America. V. 90. P. 115–120.
Moeck A., 1967. Electron microscopic studies of antennal sensilla in the ambrosia beetle Trypodendron lineatum (Olivier) (Scolytidae) // Canadian Journal of Zoology. V. 46. P. 30–45.
Monteforti G., Angeli S., Petacchi R., Minnocci A., 2002. Ultrastructural characterization of antennal sensilla and immunocytochemical localization of a chemosensory protein in Carausius morosus Brünner (Phasmida: Phasmatidae) // Arthropod Structure & Development. V. 30. P. 195–205.
Namikawa S.K., Amornsak W., 2016. Antennal sensilla morphology of Theocolax elegans (Westwood) (Hymenoptera: Pteromalidae), a larval parasitoid of the maize weevil, Sitophilus zeamais (Motschulsky) (Coleoptera: Curculionidae) // Agriculture and Natural Resources. V. 50. P. 374–379.
Nieukerken E.J.V., Dop H., 1987. Antennal sensory structures in Nepticulidae (Lepidoptera) and their phylogenetic implications // Journal of Zoological Systematics and Evolutionary Research. V. 25. P. 104–126.
Niven J.E., Farris S.M., 2012. Miniaturization of nervous systems and neurons // Current Biology. V. 22. P. R323–R329.
Niven J.E., Laughlin S.B., 2008. Energy limitation as a selective pressure on the evolution of sensory systems // Journal of Experimental Biology. V. 211. P. 1792–1804.
Nowińska A., Brożek J., 2019. Antennal sensory structures in water bugs of Nepoidea (Insecta: Hemiptera: Nepomorpha), their morphology and function // Zoomorphology. V. 138. P. 307–319.
Ochieng S.A., Hallberg E., Hansson B.S., 1998. Fine structure and distribution of antennal sensilla of the desert locust, Schistocerca gregaria (Orthoptera: Acrididae) // Cell and Tissue Research. V. 291. P. 525–536.
Oliva A., 2012. The antennal sensilla of Oxelytrum erythrurum (Blanchard) and Oxelytrum apicale (Brullé) (Coleoptera: Silphidae) // Neotropical Entomology. V. 41. P. 395–403.
Onagbola E.O., Fadamiro H.Y., 2008. Scanning electron microscopy studies of antennal sensilla of Pteromalus cerealellae (Hymenoptera: Pteromalidae) // Micron. V. 39. P. 526–535.
Parashar B.D., Chauhan R.S., Prakash S., 1994. Mechanotactile and olfactory antennal sensilla in four species of female tabanids (Diptera) // Bolletino di Zoologia. V. 61. P. 121–128.
Park K.C., Hardie J., 2004. Electrophysiological characterisation of olfactory sensilla in the black bean aphid, Aphis fabae // Journal of Insect Physiology. V. 50. P. 647–655.
Payne T.L., Moeck H.A., Willson C.D., Coulson R.N., Humphreys W.J., 1973. Bark beetle olfaction-II. Antennal morphology of sixteen species of Scolytidae (Coleoptera) // International Journal of Insect Morphology and Embryology. V. 2. P. 177–192.
Pérez-González S., Zaballos J.P., 2013. Antennal morphology of the endogean carabid genus Typhlocharis (Coleoptera: Carabidae: Anillini): Description of sensilla and taxonomic implications // Journal of Morphology. V. 274. P. 809–823.
Piersanti S.R.M., Rebora M., Gaino E., 2010. A scanning electron microscope study of the antennal sensilla in adult Zygoptera // Odonatologica. V. 39. P. 235–241.
Piersanti S.R.M., López-Rodríguez M.J., Tierno de Figueroa J.M., 2017. A comparison between the adult antennal sensilla of the cavernicolous stonefly Protonemura gevi and other epigean Protonemura species (Plecoptera: Nemouridae) in a biological context // Annales de La Societe Entomologique de France. V. 53. P. 47–54.
Pitts R.J., Zwiebel L.J., 2006. Antennal sensilla of two female anopheline sibling species with differing host ranges // Malaria Journal. V. 5. P. 1–12.
Polidori C., Jorge A., Ornosa C., 2020. Antennal morphology and sensillar equipment vary with pollen diet specialization in Andrena bees // Arthropod Structure & Development. V. 57. P. 112–130.
Polilov A.A., 2012. The smallest insects evolve anucleate neurons // Arthropod Structure & Development. V. 41. P. 29–34.
Polilov A.A., 2015. Small Is Beautiful: Features of the Smallest Insects and Limits to Miniaturization // Annual Review of Entomology. V. 60. P. 103–121.
Polilov A.A., 2016. At the Size Limit – Effects of Miniaturization in Insects. Cham: Springer. 325 p.
Polilov A.A., Makarova A.A., 2017. The scaling and allometry of organ size associated with miniaturization in insects: A case study for Coleoptera and Hymenoptera // Scientific Reports. V. 7. P. 1–7.
Power M.E., 1943. The effect of reduction in numbers of ommatidia upon the brain of Drosophila melanogaster // Journal of Experimental Zoology. V. 94. P. 33–71.
Pritchard G., Scholefield P., 1978. Observations on the food, feeding behaviour, and associated sense organs of Grylloblatta campodeiformis (Grylloblattodea) // The Canadian Entomologist. V. 110. P. 205–212.
Rahal Y., Barry P., Hawlitzky N., Renou M., 1996. Antennal olfactory sensilla of the parasitoid fly, Pseudoperichaeta nigrolineata Walker (Diptera: Tachinidae) // International Journal of Insect Morphology and Embryology. V. 25. P. 145–152.
Ramaswamy S.B., Gupta A.P., 1981. Sensilla of the antennae and the labial and maxillary palps of Blattella germanica (L.) (Dictyoptera: Blattellidae): Their classification and distribution // Journal of Morphology. V. 168. P. 269–279.
Randolf S., Zimmermann D., Aspöck U., 2017. Head anatomy of adult Coniopteryx pygmaea: Effects of miniaturization and the systematic position of Coniopterygidae (Insecta: Neuroptera) // Arthropod Structure & Development. V. 46. P. 304–322.
Ranieri E., Ruschioni S., Riolo P., Isidoro N., Romani R., 2016. Fine structure of antennal sensilla of the spittlebug Philaenus spumarius L. (Insecta: Hemiptera: Aphrophoridae). I. Chemoreceptors and thermo-/hygroreceptors // Arthropod Structure & Development. V. 45. P. 432–439.
Rebora M., Figueroa J.M.T., de Piersanti S., 2016. Antennal sensilla of the stonefly Dinocras cephalotes (Plecoptera: Perlidae) // Arthropod Structure & Development. V. 45. P. 552–561.
Rebora M., Piersanti S., Gaino E., 2009. A comparative investigation of the antennal sensilla in adult Anisoptera // Odonatologica. V. 38. P. 329–340.
Rebora M., Piersanti S., Gaino E., 2009a. The antennal sensilla of adult mayflies: Rhithrogena semicolorata as a case study // Micron. V. 40. P. 571–576.
Rein K., Zöckler M., Heisenberg M., 1999. A quantitative three-dimensional model of the Drosophila optic lobes // Current Biology. V. 9. Issue 2. P. 93–96.
Rensch B., 1948. Histological changes correlated with evolutionary changes of body size // Evolution. V. 2. P. 218–230.
Riegert P.W., 1960. The humidity reactions of Melanoplus bivittatus (Say) (Orthoptera, Acrididae): antennal sensilla and hygro-reception // The Canadian Entomologist. V. 92. P. 561–570.
Riesgo-Escovar J.R., Piekos W.B., Carlson J.R., 1997. The Drosophila antenna: ultrastructural and physiological studies in wild-type and lozenge mutants // Journal of Comparative Physiology. V. 180. P. 151–160.
Rinker D.C., Pitts R.J., Zhou X., Suh E., Rokas A., Zwiebel L.J., 2013. Blood meal-induced changes to antennal transcriptome profiles reveal shifts in odor sensitivities in Anopheles gambiae // Proceedings of the National Academy of Sciences of the United States of America. V. 110. P. 8260–8265.
Roh H.S., Park K.C., Oh H.W., Park C.G., 2016. Morphology and distribution of antennal sensilla of two tortricid moths, Cydia pomonella and C. succedana (Lepidoptera) // Microscopy Research and Technique. V. 79. P. 1069–1081.
Romani R., Isidoro N., Bin F., 2010. Antennal Structures Used in Communication by Egg Parasitoids // Egg Parasitoids in Agroecosystems with Emphasis on Trichogramma. Consoli F.L., Parra J.R.P., Zucchi R.A. (Eds). Berlin: Springer. P. 57–96.
Ross K.T.A., Anderson M., 1987. Morphology of the antennal sensilla of the cabbage root fly, Delia radicum L. (Diptera: Anthomyiidae) // International Journal of Insect Morphology and Embryology. V. 16. P. 331–342.
Ross K.T.A., 1992. Comparative study of the antennal sensilla of five species of root maggots: Delia radicum L., D. floralis F., D. antiqua Mg., D. platura Mg. (Diptera: Anthomyiidae) and Psila rosae F. (Diptera: Psilidae) // International Journal of Insect Morphology and Embryology. V. 21. P. 175–197.
Saïd I., Tauban D., Renou M., Mori K., Rochat D., 2003. Structure and function of the antennal sensilla of the palm weevil Rhynchophorus palmarum (Coleoptera, Curculionidae) // Journal of Insect Physiology. V. 49. P. 857–872.
Sanborn A.F., Phillips P.K., 1995. Scaling of sound pressure level and body size in cicadas (Homoptera: Cicadidae; Tibicinidae) // Annals of the Entomological Society of America. V. 88. P. 479–484.
Sane S.P., McHenry M.J., 2009. The biomechanics of sensory organs // Integrative and Comparative Biology. V. 49. P. 8–23.
Schaller D., 1978. Antennal sensory system of Periplaneta americana L. // Cell and Tissue Research. V. 191. P. 121–139.
Schmidt J.M., Smith J.J.B., 1986. Correlations between body angles and substrate curvature in the parasitoid wasp Trichogramma minutum: a possible mechanism of host radius measurement // Journal of Experimental Biology. V. 125. P. 271–285.
Schneider D., 1964. Insect Antennae // Annual Review of Entomology. V. 9. P. 103–122.
Schneider E.S., Römer H., 2016. Sensory structures on the antennal flagella of two katydid species of the genus Mecopoda (Orthoptera, Tettigonidae) // Micron. V. 90. P. 43–58.
Shang L., Wang Y., Wang P., Wang S., Ren B., 2010. Application of rough set analysis in species and caste discrimination of bumblebees (Hymenoptera: Apidae: Bombus) based on antennal sensilla // Annals of the Entomological Society of America. V. 103. P. 654–660.
Sharko F.S., Nedoluzhko A.V., Lê B.M., Tsygankova S.V., Boulygina E.S. et al., 2019. A partial genome assembly of the miniature parasitoid wasp, Megaphragma amalphitanum // PLOS ONE. V. 14. P. 1–18.
Shields V.D.C., Hildebrand J.G., 2001. Recent advances in insect olfaction, specifically regarding the morphology and sensory physiology of antennal sensilla of the female sphinx moth Manduca sexta // Microscopy Research and Technique. V. 55. P. 307–329.
Skilbeck C.A., Anderson M., 1996. The ultrastructure, morphology and distribution of sensilla on the antennae of the adult parasitoids Aleochara bilineata Gyll. and Aleochara bipustulata L. (Coleoptera: Staphylinidae) // International Journal of Insect Morphology and Embryology. V. 25. P. 261–280.
Slifer E.H., 1967. Sense organs on the antennal flagella of earwigs (Dermaptera) with special reference to those of Forficula auricularia // Journal of Morphology. V. 122. P. 63–79.
Slifer E.H., 1975. Sense organs on the antennal flagellum of two species of Embioptera (Insecta) // International Journal of Insect Morphology and Embryology. V. 4. P. 467–475.
Slifer E.H., 1979. Sense organs on the antennal flagellum of a stonefly (Plecoptera, Insecta) // Journal of Morphology. V. 160. P. 50–65.
Slifer E.H., 1979a. Sense organs on the antennal flagella of four species of Chrysopa (Neuroptera: Chrysopidae) // Journal of Morphology. V. 160. P. 14–25.
Slifer E.H., Sekhon S.S., 1972. Sense organs on the antennal flagella of damselflies and dragonflies (Odonata) // International Journal of Insect Morphology and Embryology. V. 1. P. 289–300.
Slifer E.H., Sekhon S.S., 1979. Sense organs on the antennal flagellum of Psocids (Insecta, Psocoptera) // Journal of Morphology. V. 160. P. 78–89.
Smallegange R.C., Kelling F.J., Den Otter C.J., 2008. Types and numbers of sensilla on antennae and maxillary palps of small and large houseflies, Musca domestica (Diptera, Muscidae) // Microscopy Research and Technique. V. 71. P. 880–886.
Stöckl A., Heinze S., Charalabidis A., El Jundi B., Warrant E., Kelber A., 2016. Differential investment in visual and olfactory brain areas reflects behavioural choices in hawk moths // Scientific Reports. V. 6. P. 1–10.
Sukontason K.L., Methanitikorn R., Chaiwong T., Kurahashi H., Vogtsberger R.C., Sukontason K.L., 2007. Sensilla of the antenna and palp of Hydrotaea chalcogaster (Diptera: Muscidae) // Micron. V. 38. P. 218–223.
Sun X., Wang M.Q., Zhang G., 2011. Ultrastructural observations on antennal sensilla of Cnaphalocrocis medinalis (Lepidoptera: Pyralidae) // Microscopy Research and Technique. V. 74. P. 113–121.
Sutcliffe J.F., Kokko E.G., Shipp J.L., 1990. Transmission electron microscopic study of antennal sensilla of the female black fly, Simulium arcticum (IIL-3; 11s-10.11) (Diptera: Simuliidae) // Canadian Journal of Zoology. V. 68. P. 1443–1455.
Suwannapong G., Noiphrom J., Benbow M., 2012. Ultramorphology of antennal sensilla in thai single open nest honeybees (Hymenoptera: Apidae) // The Journal of Tropical Asian Entomology. V. 30. P. 31–42.
Symonds M.R.E., Elgar M.A., 2013. The evolution of body size, antennal size and host use in parasitoid wasps (Hymenoptera: Chalcidoidea): a phylogenetic comparative analysis // PLoS One. V. 8. e78297.
Tschinkel W.R., Mikheyev A.S., Storz S.R., 2003. Allometry of workers of the fire ant, Solenopsis invicta // Journal of Insect Science. V. 3. P. 1–11.
Valuyskiy M.Y., Melnitsky S.I., Ivanov V.D., 2017. Structure of antennal sensilla in the caddisfly genus Rhyacophila pictet (Trichoptera, Rhyacophilidae) // Entomological Review. V. 97. P. 703–722.
van der Woude E., Smid H.M., 2016. How to escape from Haller’s rule: Olfactory system complexity in small and large Trichogramma evanescens parasitic wasps // Journal of Comparative Neurology. V. 524. P. 1876–1891.
Wang Q.K., Liu X.H., Lu P.F., Zhang D., 2014. Ultrastructure of antennal sensilla in Hydrotaea armipes (Fallén) (Diptera: Muscidae): New evidence for taxonomy of the genus Hydrotaea // Zootaxa. V. 3790. P. 577–586.
Wang R.R., Liu J.J., Li X.Y., Liang A.P., Bourgoin T., 2018. Relating antennal sensilla diversity and possible species behaviour in the planthopper pest Lycorma delicatula (Hemiptera: Fulgoromorpha: Fulgoridae) // PLoS One. V. 13. Issue 3. e0194995.
Wang X., Xie Y., Zhang Y., Liu W., Xiong Q., 2018a. Antennal Sensilla of Didesmococcus koreanus Borchsenius (Hemiptera: Coccoidea: Coccidae) in different instars // Zoologischer Anzeiger. Bd. 274. S. 103–114.
Wang X.S., Shaukat A., Han Y., Yang B., Tang L.D., Wu J.H., 2019. Morphology and distribution of the antennal sensilla of two species, Megalurothrips usitatus and Thrips palmi (Thysanoptera: Thripidae) // Insects. V. 10. P. 35–46.
Wang Z., 2013. Morphology and ultrastructure of antennal sensilla of Macrocentrus cingulum Brischke (Hymenoptera: Braconidae) and their probable functions // Micron. V. 35. P. 56–70.
Wcislo W.T., 1995. Sensilla numbers and antennal morphology of parasitic and non-parasitic bees (Hymenoptera: Apoidea) // International Journal of Insect Morphology and Embryology. V. 24. P. 63–81.
Weedon S., Porch N., Symonds M.R.E., 2020. Evolution of male antennal size in moths (Lepidoptera): a comparative test of potential trade-offs and correlated growth in Australian species // Austral Entomology. V. 59. P. 156–166.
Xi Y.Q., Yin X.M., Li H.J., Zhu C.D., Zhang Y.Z., 2010. Scanning electron microscopy studies of antennal sensilla of Lysiphlebus fabarum (Marshall) (Hymenoptera: Braconidae) // Acta Entomologica Sinica. V. 53. P. 936–942.
Xi Y.Q., Yin X.M., Zhu C.D., Guerrieri E., Zhang Y.Z., 2011. Scanning electron microscopy studies of antennal sensilla of Ooencyrtus phongi (Hymenoptera: Encyrtidae) // Microscopy Research and Technique. V. 74. P. 936–945.
Yack J.E., 2004. The structure and function of auditory chordotonal organs in insects // Microscopy Research and Technique. V. 63. P. 315–337.
Yanagawa A., Shimizu S., Noma K., Nishikawa M., Kazumasa O., Yokohari F., 2009. Classification and distribution of antennal sensilla of the termite Coptotermes formosanus (Isoptera: Rhinotermitidae) // Sociobiology. V. 54. P. 327–349.
Yang H., Yan S.C., Liu D., 2009. Ultrastructural observations on antennal sensilla of Coleophora obducta (Meyrick) (Lepidoptera: Coleophoridae) // Micron. V. 40. P. 231–238.
Yang S.Y., Zhong Y.Z., Zhang J.P., Wang X.P., Zhang F., 2016. A Comparative Scanning Electron Microscopy Study on Antennal Sensilla of Trissolcus japonicus and Trissolcus plautiae, Egg Parasitoids of Stink Bugs (Pentatomidae) // Annals of the Entomological Society of America. V. 109. P. 112–120.
Yokohari F., 1999. Atlas of Arthropod Sensory Receptors: Dynamic Morphology in Relation to Function. Eguchi E., Tominaga Y. (Eds). Berlin: Springer. P. 191–210.
Zauli A., Maurizi E., Carpaneto G.M., Chiari S., Svensson G.P., Giulio A.D., 2016. Antennal fine morphology of the threatened beetle Osmoderma eremita (Coleoptera: Scarabaeidae), revealed by scanning electron microscopy // Microscopy Research and Technique. V. 79. P. 178–191.
Zhang C., Pan L., Lu Y., Dietrich C., Dai W., 2016. Reinvestigation of the antennal morphology of the white-backed planthopper Sogatella furcifera (Horváth) (Hemiptera: Delphacidae) // Zoologischer Anzeiger. Bd. 262. S. 20–28.
Zhang D., Liu X.H., Li X.Y., Cao J., Chu H.J., Li K., 2015. Ultrastructural investigation of antennae in three cutaneous myiasis flies: Melophagus ovinus, Hippobosca equina, and Hippobosca longipennis (Diptera: Hippoboscidae) // Parasitology Research. V. 114. P. 1887–1896.
Zhang S., Zhang Z., Kong X., Wang H., Zhou G., Yu J., 2012. External morphology of Trichogramma dendrolimi Matsumura (Hymenoptera: Trichogrammatidae) organ and ultrastructure of the sensilla // Microscopy Research and Technique. V. 75. P. 1513–1521.
Zhou H., Wu W.J., Niu L.M., Fu Y.G., 2013. Antennal sensilla of female Encarsia guadeloupae Viggiani (Hymenoptera: Aphelinidae), a nymphal parasitoid of the spiraling whitefly Aleurodicus dispersus (Hemiptera: Aleyrodidae) // Micron. V. 44. P. 365–372.
Zhou H., Wu W.J., Zhang F.P., Fu Y.G., 2013a. Scanning Electron Microscopy Studies of the Antennal Sensilla of Metaphycus parasaissetiae Zhang & Huang (Hymenoptera: Encyrtidae) // Neotropical Entomology. V. 42. P. 278–287.
Zhou H., Wu W.J., Zhnag Z.F., Zhnag Y., 2011. Antennal sensilla of Apanteles cypris Nixon (Hymenoptera: Braconidae), a larval endoparasitoid of Cnaphalocrocis medinalis Guenée (Lepidoptera: Pyralidae) // Microscopy Research and Technique. V. 74. P. 1199–1208.
Zhu W., Zhou S., Wang S., Han D., Chen J., Fu Y., 2017. Ultrastructure and distribution of antennal sensilla of the chilli thrips Scirtothrips dorsalis Hood (Thysanoptera: Thripidae) // Microscopy Research and Technique. V. 80. P. 1283–1296.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


