Зоологический журнал, 2022, T. 101, № 5, стр. 568-580
Особенности агонистического и маркировочного поведения у самцов лабораторных мышей (Mus musculus) разных инбредных линий при формировании социальной иерархии
М. А. Клещев a, *, А. В. Осадчук a, Л. В. Осадчук a
a Федеральное государственное бюджетное научное учреждение Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения РАН
630090 Новосибирск, Россия
* E-mail: max82cll@bionet.nsc.ru
Поступила в редакцию 28.01.2021
После доработки 03.03.2021
Принята к публикации 09.04.2021
- EDN: JOVYDA
- DOI: 10.31857/S0044513422030060
Аннотация
Известно, что способность животного к социальному доминированию в сообществе зависит от комплекса поведенческих и физиологических особенностей, которые могут предопределяться генотипом. Однако значение каждой из этих особенностей доминантного ранга остается неясным, особенно при изменении средовых условий формирования иерархии. Важнейшими факторами, определяющими паттерны поведения самцов при формировании социальной иерархии, являются степень освоения участка обитания и наличие полового партнера. При использовании парадигмы “резидент–интрудер” изучены особенности обонятельных контактов, агонистического и маркировочного поведения при парном ссаживании самцов лабораторных мышей двух инбредных линий в экспериментальной модели формирования социальной иерархии. В работе использовали половозрелых (возраст 90 дней) самцов мышей инбредных линий РТ и CBA/Lac и самок инбредной линии DD/He без предварительного сексуального опыта. К самцу-резиденту, которого предварительно помещали с самкой линии DD/He в экспериментальную клетку на двое суток для освоения территории, подсаживали самца-интрудера другой линии. После этого в течение первых 30 мин после формирования группы наблюдали за агонистическим поведением самцов. Кроме того, оценивали маркировочную активность самцов до формирования социальной группы и в период установления доминантно-субординантных отношений. Предварительное освоение самцом территории увеличивало агрессивность и вероятность доминирования у животных обоих генотипов. Однако вне зависимости от степени освоенности территории самцы линии РТ демонстрировали больше наступательных атак и чаще становились доминантами, чем самцы линии CBA/Lac. Генетические различия по маркировочной активности самцов не были ассоциированы с таковыми по социальному доминированию. Результаты исследования свидетельствуют о том, что у самцов инбредных линий мышей генетически детерминированная способность к социальному доминированию связана в первую очередь с генетическими различиями по агонистическому поведению, а не с уровнем маркировочного поведения, вне зависимости от степени освоения территории.
Социальное доминирование, или социальная иерархия, – это система взаимоотношений между особями в социальной группе, когда доминирующие особи, одерживая победу в социальном конфликте, получают преимущество в доступе к лимитирующим ресурсам среды по сравнению с подчиненными (Панов, 2010). В качестве лимитирующих ресурсов могут выступать пища, удобные участки обитания, половой партнер и некоторые другие ресурсы. Организация сообщества на основе социальной иерархии наблюдается у синантропных домовых мышей при определенных условиях существования, например при повышении плотности популяции (Котенкова, Мунтяну, 2007) или в искусственных группировках (Соколов и др., 1990). Социальная иерархия описана и у других видов животных (Wilson, 2000; Sapolsky, 2005; Neumann et al., 2011), хотя следует отметить, что социальная структура сообществ млекопитающих очень разнообразна, зависит от ряда экологических факторов (Громов, 2017) и социальное доминирование не является универсальным феноменом.
Социальный ранг особи связан с рядом поведенческих и физиологических параметров. Доминантные животные, по сравнению с подчиненными, более агрессивны, часто имеют более низкий уровень кортикостероидов (Creel, 2001), повышенный уровень тестостерона, больший вес (Sneddon et al., 2011), более высокое качество сперматозоидов (Koyama, Kamimura, 1999). Доминанты, как правило, лучше размножаются, чем низкоранговые особи (Ellis, 1995).
Установление доминантно-субординантных отношений в сообществе животных может модифицировать поведение особей и влиять на состояние их здоровья (Sapolsky, 2005; Bartolomucci, 2007). Важность феномена социального доминирования для установления этологической структуры популяции, а также влияние социального ранга на здоровье индивида делают актуальным изучение генетических и средовых факторов, предопределяющих его социальное положение в сообществе, однако генетическим аспектам этой проблемы уделяется мало внимания. Имеются лишь единичные публикации, посвященные генетике социального доминирования. В экспериментах, проведенных исследовательским коллективом А.В. Осадчука (Осадчук, 1990), самцы мышей определенных инбредных линий чаще становились доминантами, чем мыши других линий. В дальнейшем был проведен детальный анализ поведения при установлении и поддержании социальной иерархии у лабораторных мышей с использованием этологической модели социального доминирования в “минимальном социуме” (Брагин и др., 2006; Клещев и др., 2013). Данная экспериментальная модель состояла из двух самцов разных инбредных линий, проживающих в одной и той же экспериментальной клетке от 5 до 30 дней. Установлено, что число элементов агонистического поведения максимально в первые 20 мин после ссаживания животных, когда происходит формирование иерархии, а затем этот показатель (число элементов) снижается. На протяжении всего времени существования группы сохраняется асимметрия по агонистическому поведению, когда доминанты проявляют агрессивное поведение, а субординанты – субмиссивное поведение (Брагин и др., 2006; Осадчук и др., 2009; Клещев и др., 2013). Данная экспериментальная модель полностью воспроизводит временной паттерн поведения при формировании и поддержании социальной иерархии, описанный ранее у домовых мышей (Соколов и др., 1990), а также физиологические и репродуктивные последствия социального доминирования (Осадчук и др., 2010; Гуторова и др., 2012; Клещев, Осадчук, 2014). Было показано, что в большинстве пар социальный ранг устанавливается в течение первых 20 мин после формирования группы и в дальнейшем не изменяется длительное время (Брагин и др., 2006; Koolhaas et al., 2013). Таким образом, период формирования иерархии имеет важнейшее значение для установления иерархической структуры группы.
В экспериментах с использованием описанной выше модели социальной иерархии было показано, что самцы инбредных линий BALB/cLac и РТ оказались более агрессивными при установлении доминантно-субординантных отношений и значительно чаще становились доминантами по сравнению с самцами инбредной линии CBA/Lac (Осадчук и др., 2009). Сходная закономерность была установлена для самцов мышей инбредных линий РТ и CBA/Lac в пубертатном возрасте (Клещев и др., 2013). Таким образом, у мышей генетические особенности паттерна агрессивного поведения при формировании социальной иерархии в значительной мере обусловливают генетические различия в способности к социальному доминированию. Данный результат представляется вполне логичным, поскольку известно, что у домовых мышей социальная иерархия устанавливается в результате агрессивных столкновений между самцами (Кроукфорт, 1970; Соколов и др., 1990). Генетические различия по агрессивному поведению самцов домовых мышей хорошо документированы (Maxon, Canastar, 2003). Однако способность к социальному доминированию может предопределяться и другими особенностями поведения и нервной системы, в частности маркировочной активностью (Drickamer, 2001) и типом высшей нервной деятельности (Соколов и др., 1990).
Кроме того, способность к социальному доминированию и поведение при формировании социальной группы могут в значительной степени зависеть от средовых условий формирования иерархии (Williamson et al., 2017). Согласно результатам более ранних исследований предварительное освоение территории усиливает агрессивность самцов-резидентов. В частности, у диких домовых и лабораторных мышей самец-резидент интенсивно атакует самца-интрудера (Золотарев, 1978; Koolhaas et al., 2013). В этой ситуации присутствие самки усиливает агрессивность самцов (Hayashi, Tomihara, 2000). Для интрудеров обычно характерны относительно низкий уровень агрессии, повышенная частота проявления субмиссивного поведения и высокий уровень стресса (Martinez et al., 1998). Таким образом, предварительное знакомство с территорией может способствовать достижению высокого социального ранга (Шилов, 1991). Конкуренция за обладание участком обитания может существенно модифицировать наследственно обусловленные свойства нервной системы и поведения, влияющие на способность к социальному доминированию, такие как устойчивость к социальному стрессу (Шилов, 1991), маркировочное поведение (Hurst, Beynon, 2004), агрессивность (Koolhaas et al., 2013).
У многих видов животных, в том числе и у домовых мышей, хемокоммуникационные механизмы играют ведущую роль в поддержании пространственно-этологической структуры популяции. Известно, что домовые мыши интенсивно маркируют свою территорию мочевыми метками, которые представляют собой маленькие капельки и полоски мочи, оставляемые на субстрате. Запаховые метки предоставляют разнообразные сведения о животном, оставившем метку: вид, пол, индивидуальную идентичность, состояние здоровья, обеспеченность ресурсами и местонахождение на территории (Hurst, Beynon, 2004; Arakava et al., 2008). Маркировка участка обитания мочой является важным паттерном поведения, которое необходимо для демонстрации социального статуса самца (Hurst, 1990, 1993). Самцы-резиденты интенсивно маркируют свою территорию мочевыми метками и тем самым могут оказывать ольфакторное влияние на интрудера. Самец, доминирующий на определенной территории и успешно защищающий свой участок обитания от вторжения других животных, оставляет значительно больше запаховых меток, в большем числе мест, чем интрудеры или подчиненные животные, и эти метки более свежие. Кроме того, моча домовых мышей содержит химические сигналы, которые также несут информацию о социальном статусе и конкурентоспособности владельца территории и могут модифицировать поведение других животных (Hurst, Beynon, 2004). Таким образом, высокий уровень маркировочной активности самца может существенно повысить его шансы стать доминантом, в особенности при защите уже освоенной территории.
Однако данные о генетических различиях по способности к доминированию в экспериментальной модели социальной иерархии были получены на “нейтральной арене”, когда животных помещали в незнакомую экспериментальную клетку. Остается неясным, в какой степени генетические различия по способности к социальному доминированию могут быть модифицированы территориальным статусом самца (резидент или интрудер). Эта информация необходима для адекватной интерпретации данных о генетической регуляции способности к социальному доминированию, поскольку в природных условиях формирование социальных групп и перестройка их структуры происходят не на “нейтральной арене”, а на территориях, уже освоенных другими животными.
Цель настоящей работы состояла в том, чтобы изучить особенности агонистического и маркировочного поведения у самцов мышей разных генотипов во время формирования социальной иерархии при различном территориальном статусе самца, в частности в положении резидента (при защите своей территории) и в положении интрудера (при конкуренции за территорию, занятую другим самцом). Для этого проводили наблюдения за агрессивным и субмиссивным поведением резидентов и интрудеров инбредных линий PT и CBA/Lac при формировании социальной иерархии и оценивали маркировочную активность самцов этих линий. Дополнительно подсчитывали число назо-назальных и назо-аногенитальных контактов, поскольку обонятельные контакты являются важным средством хемокоммуникации у грызунов (Громов, 2008; Arakava et al., 2011).
МАТЕРИАЛ И МЕТОДЫ
Животные и экспериментальные процедуры
В работе использовали половозрелых (возраст 90 дней) самцов мышей инбредных линий РТ и CBA/Lac и самок инбредной линии DD/He без предварительного сексуального опыта. Все животные были выращены в стандартных условиях вивария Института цитологии и генетики СО РАН. Репродуктивные группы для разведения животных формировали из одного самца и 2–3 самок. День родов считали первым днем жизни потомства. В возрасте 2-3 дней размер помета выравнивали таким образом, чтобы в нем оставалось 3–7 детенышей. В возрасте 1 мес молодых особей отсаживали от родителей и формировали однополые группы. Каждую такую группу, которая состояла из 4–6 самцов, содержали в стандартной пластиковой клетке до начала эксперимента. В помещениях, где содержали животных и проводили эксперимент, поддерживались стандартная температура (+22°С) и неинвертированный световой режим (ночь/день 12/12 ч). Воду и пищу предоставляли животным без ограничения.
Перед рассадкой в экспериментальные группы всех самцов содержали в изоляции в течение 4 сут для снятия эффектов групповых взаимодействий. После периода одиночного содержания самца линии РТ или CBA/Lac (резидента) помещали с самкой линии DD/He в чистую металлическую экспериментальную клетку размером 45 × 15 × 10 см. Клетка была разделена непрозрачными пластиковыми перегородками на три отсека – два боковых и один центральный. Каждая перегородка имела отверстие внизу, которое служило лазом. В экспериментальной клетке самец-резидент и самка находились двое суток, в течение которых они осваивали экспериментальную клетку. После этого к ним подсаживали самца-интрудера другой инбредной линии (PT или CBA/Lac), которого до подсаживания содержали в аналогичной экспериментальной клетке без самки и других самцов. Партнеров подбирали таким образом, чтобы различия в массе тела у них были минимальны. В 54 парах резидентами были самцы инбредной линии РТ, а интрудерами – самцы CBA/Lac. В 57 парах резидентами были самцы линии CBA/Lac, а интрудерами – самцы линии РТ.
Все экспериментальные процедуры выполнены с соблюдением правил, изложенных в директивах европейского сообщества (86/669/ЕЕС) и Хельсинской декларации по защите позвоночных животных, используемых для лабораторных целей.
Социальное доминирование, агонистическое поведение и обонятельные контакты
Сразу же после помещения интрудера в клетку самца-резидента начинали наблюдения за поведением обоих самцов, которые продолжались в течение последующих 30 мин. Все поведенческие тесты записывали на видеокамеру и в дальнейшем подсчитывали суммарное число элементов агонистического поведения и обонятельных контактов у каждого самца за 30 мин теста во время формирования социальной иерархии. У мышей социальная иерархия устанавливается между самцами в ходе агонистических столкновений и социальный статус животного проявляется в специфических элементах агрессивного и субмиссивного поведения (Grant, Mackintosh, 1963; Benton, 1980; Соколов и др., 1990; Брагин и др., 2006). К агрессивному поведению мы относили наступательные атаки, оборонительные атаки (атака самца в ответ на нападение оппонента) и сигналы угрозы (быстрая вибрация хвостом – tail rattling). Поскольку число оборонительных атак самца зависит от числа наступательных атак партнера, то для оборонительных атак рассчитана доля ответных атак самца от наступательных атак партнера (%). К субмиссивному поведению относили бегство от оппонента (“убегания”) и специфические вертикальные позы подчинения. Так же подсчитывали число назо-назальных (обнюхивание носовой области партнера) и назо-аногенитальных (обнюхивание области гениталий и ануса партнера) контактов. Социальный ранг каждому самцу присваивали на основании асимметрии в проявлении агрессивного и субмиссивного поведения. После проведения наблюдений самцы находились в той же экспериментальной клетке в течение 5 дней. Сохранение социального ранга каждого животного контролировали по асимметрии в проявлении агрессивного и субмиссивного поведения, наблюдая за животными 3 раза в день по 20 мин на протяжении всего времени существования группы. В статье приведены данные по поведению самцов мышей в первые 30 мин после формирования группы (период формирования социальной иерархии).
Маркировочное поведение
В данном эксперименте маркировочную активность самцов оценивали дважды.
Первый тест (выявление базальной маркировочной активности) проводили за сутки до подсаживания интрудера к резиденту. До первого маркировочного теста резидентов в течение суток содержали с самкой линии DD/He, а будущих интрудеров содержали поодиночке. Второй тест проводили на четвертый день после подсаживания интрудера к резиденту для выявления маркировочной активности самцов мышей в условиях сложившихся иерархических отношений.
Все маркировочные тесты проходили в тех же экспериментальных клетках, где проживали самцы. Для этого из каждой экспериментальной клетки удаляли самку и подстилку и ставили вместо двух перегородок одну сплошную перегородку по центру клетки, которая делила ее на два отсека. В каждой экспериментальной клетке в первом маркировочном тесте (до формирования социальной группы) самца оставляли в одном из двух отсеков клетки, при пустующем втором отсеке. Во втором маркировочном тесте экспериментальную клетку разделяли непрозрачной пластиковой перегородкой на два отсека и каждого самца помещали в свой отсек. На пол клетки помещали хроматографическую бумагу толщиной 1 мм (Whatman Paper Ltd) размером 22.5 × 15.0 см. Каждый маркировочный тест длился 1 ч. После проведения маркировочного теста возвращали самку и подстилку в клетку, перегородки с лазами устанавливали на место. Маркировочную активность каждого самца оценивали по числу мочевых меток, оставленных на хроматографической бумаге, которые подсчитывали при ультрафиолетовом освещении (Desjardins et al., 1973).
Статистическая обработка результатов
Статистическую обработку данных проводили с помощью пакета компьютерных программ Statistica (версия 6.0). Уровень (частоту) социального доминирования выражали в виде доли (%) доминантных самцов данной инбредной линии. Анализ сопряженности уровня доминирования в зависимости от территориального статуса у самцов двух инбредных линий проведен на основе точного критерия Фишера. Достоверность различий в краевых (маргинальных) частотах доминирования в зависимости от генотипа линий и территориального статуса оценивали методом χ2. Проверку данных на нормальность распределения проводили по критерию Колмогорова-Смирнова. Поскольку для всех показателей распределение данных достоверно отличалось от нормального распределения, для сравнения групп использовали непараметрический критерий Манна–Уиттни. Данные представлены как средняя арифметическая и ее ошибка (Mean ± SEM).
РЕЗУЛЬТАТЫ
Уровень социального доминирования
Социальный ранг у самцов во всех исследованных парах устанавливался в течение 30 мин после их формирования и не менялся на протяжении всего времени существования групп (5 дней).
Анализ таблицы сопряженности (2 × 2) частоты доминирования в зависимости от территориального статуса у самцов двух инбредных линий при формировании социальной иерархии (табл. 1), проведенный на основе точного критерия Фишера, выявил высокодостоверные (p < 0.0003) связи между генотипом самца и его территориальным статусом. Особенно ярко это проявилось у самцов линии CBA/Lac, которые, будучи в положении интрудера, оказались практически полностью неспособными стать доминантами (всего 1 случай из 54). Вместе с тем анализ краевых (маргинальных) частот доминирования выявил существенные генотипические различия ($\chi _{{(1)}}^{2}$ = 25.31, p < 0.0001): самцы линии PT почти в 3 раза чаще становились доминантами по сравнению с самцами линии CBA/Lac. Также четко была выражена ожидаемая зависимость от территориальных условий ($\chi _{{(1)}}^{2}$ = 23.43, p < 0.0001). В среднем резиденты более чем в 2.5 раза чаще занимали доминантный ранг, чем интрудеры. Таким образом, самцы линии PT, в отличие от самцов линии CBA/Lac, проявляли свою высокую способность занимать доминантный ранг в социальной иерархии вне зависимости от своего территориального статуса.
Таблица 1.
Сопряженность частоты доминантов и территориального статуса у самцов двух инбредных линий при формировании социальной иерархии
| Частота доминантов (доля от общего числа самцов, %) | Территориальные условия содержания | Всего доминантов |
|
|---|---|---|---|
| резидент | интрудер | ||
| В инбредной линии PT | n = 53 47.75 |
n = 29 26.13 |
n = 82 73.87 |
| В инбредной линии CBA/Lac | n = 28 25.23 |
n = 1 0.90 |
n = 29 26.13 |
| Всего доминантов | n = 81 72.97 |
n = 30 27.03 |
n = 111 100 |
Агонистическое поведение
Данные по подчиненным самцам-резидентам линии РТ и доминирующим самцам-интрудерам линии CBA/Lac не приведены в статье, поскольку в этих группах представлено только по одному самцу.
У самцов-резидентов инбредной линии РТ число наступательных атак было достоверно выше (p < 0.01), чем у резидентов линии CBA/Lac (рис. 1). На чужой территории число наступательных атак у субординантов РТ было также выше, чем у субординантов CBA/Lac (p < 0.01).
Рис. 1.
Число наступательных атак у самцов инбредных линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01), b – достоверность влияния территориального статуса (p < 0.01). Здесь и далее (рис. 2–7) число животных в группе варьировало от 27 до 52.

Число наступательных атак у доминантов РТ на чужой территории было достоверно ниже, чем на своей территории (p < 0.01). У субординантов линии CBA/Lac территориальные условия не влияли на число наступательных атак. Число наступательных атак у субординантов РТ и CBA/Lac было достоверно меньше, чем у доминантов (p < 0.01).
На освоенной территории доминанты линии РТ достоверно чаще (p < 0.01) оборонялись в ответ на нападение партнера, чем доминанты линии CBA/Lac (рис. 2). На чужой территории число ответных атак у субординантов линии РТ было выше, чем у субординантов линии CBA/Lac (p < 0.05). Территориальные условия не влияли на количество ответных атак у доминантов РТ. У интрудеров линии CBA/Lac, которые становились субординантами, число ответных атак было ниже, чем у субординантов линии CBA/Lac, находившихся на своей территории (p < 0.05). Доминанты всех генотипов в любых территориальных условиях чаще оборонялись в ответ на нападение партнера, чем субординанты (p < 0.01).
Рис. 2.
Доля оборонительных атак (от наступательных атак партнера) у самцов инбредных линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01), c – достоверность влияния территориального статуса (p < 0.05).

На освоенной территории число вибраций хвостом у доминантов линии РТ было достоверно выше (p < 0.01), чем у доминантов линии CBA/Lac (рис. 3). На чужой территории число вибраций хвостом у субординантов CBA/Lac было достоверно ниже (p < 0.01), чем у субординантов линии РТ. На чужой территории число вибраций хвостом у доминантов РТ было достоверно меньше, чем на освоенной территории (p < 0.01). На чужой территории не было отмечено влияния социального статуса на число вибраций хвостом у самцов РТ. Число вибраций хвостом у субординантов CBA/Lac было достоверно ниже (p < 0.01), чем у доминантов этой линии.
Рис. 3.
Число вибраций хвостом у самцов линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01), b – достоверность влияния территориального статуса (p < 0.01).

Элементы субмиссивного поведения были характерны только для подчиненных особей и крайне редко отмечались у доминантов (табл. 2).
Таблица 2.
Число элементов субмиссивного поведения у самцов линий РТ и CBA/Lac с различным социальным и территориальным статусом в период формирования социальной иерархии
| Показатель | Доминанты | Субординанты | ||||||
|---|---|---|---|---|---|---|---|---|
| резиденты | интрудеры | резиденты | интрудеры | |||||
| PT | CBA/Lac | PT | CBA/Lac | PT | CBA/Lac | PT | CBA/Lac | |
| Вертикальные позы подчинения | 0.00 | 0.43 ± 0.20 | 0.00 | – | – | 7.64 ± 1.27b | 14.00 ± 2.70a | 23.90 ± 1.98 |
| Убегания | 0.00 | 0.14 ± 0.08 | 0.14 ± 0.08 | – | – | 3.25 ± 0.90b | 10.46 ± 2.03 | 12.32 ± 1.56 |
Число вертикальных защитных поз у субординантов-интрудеров линии CBA/Lac было достоверно выше, чем таковое у субординантов-интрудеров линии РТ (p < 0.01) и у субординантов-резидентов линии CBA/Lac (p < 0.01). Число “убеганий” у субординантов-интрудеров линии CBA/Lac не отличалось от такового у субординантов-интрудеров РТ. Число “убеганий” у субординантов-интрудеров линии CBA/Lac было достоверно выше, чем у субординантов-резидентов той же линии (p < 0.01).
Обонятельные контакты
Hа предварительно освоенной территории (рис. 4) доминанты линии CBA/Lac достоверно чаще (p < 0.01) обнюхивали носовую область партнера, чем доминанты линии РТ в аналогичных территориальных условиях. Число назо-назальных контактов у субординантов линии CBA/Lac было достоверно ниже на чужой территории, чем на предварительно освоенной территории (p < 0.01). У доминантов линии РТ территориальные условия не влияли на число назо-назальных контактов. Число назо-назальных контактов у доминантов линии CBA/Lac, находившихся на своей территории, было достоверно выше (p < 0.01), чем у субординантов.
Рис. 4.
Число назо-назальных контактов у самцов инбредных линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01), b – достоверность влияния территориальных условий (p < 0.01).

Доминанты линии CBA/Lac, находившиеся на своей территории, обнюхивали область гениталий и ануса партнера значительно чаще (p < 0.01), чем доминанты-резиденты линии РТ (рис. 5). Число ано-генитальных контактов у субординантов линии РТ, находившихся на чужой территории, не отличалось от такового у субординантов -интрудеров линии CBA/Lac. Число ано-генитальных контактов у доминантов-интрудеров линии РТ было достоверно выше, чем у доминантов-резидентов этой линии (p < 0.01). У субординантов-резидентов линии CBA/Lac число ано-генитальных контаков было выше (p < 0.01) по сравнению с субординантами-интрудерами той же линии.
Рис. 5.
Число назо-аногенитальных контактов у самцов инбредных линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01), b – достоверность влияния территориальных условий (p < 0.01).

Маркировочное поведение
До образования социальной группы (первый маркировочный тест, рис. 6) число мочевых меток у самцов линии CBA/Lac, которых содержали в изоляции до маркировочного теста, были достоверно (p < 0.01) выше, чем у самцов линии РТ, которых также содержали поодиночке. При содержании самцов-резидентов с самкой линии DD/He в течение суток, самцы линии CBA/Lac достоверно чаще маркировали территорию по сравнению с самцами линии РТ (p < 0.01).
Рис. 6.
Число мочевых меток перед образованием социальной группы у самцов инбредных линий РТ и CBA/Lac при одиночном содержании и содержании с самкой: a – достоверность межлинейных различий (p < 0.01).
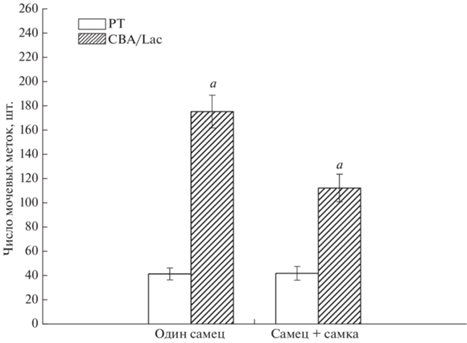
Маркировочная активность у резидентов линии CBA/Lac до образования социальной группы была связана с их последующим социальным рангом. У будущих доминантов линии CBA/Lac число мочевых меток составило 189.29 ± 23.45 и было достоверно выше (p < 0.05), чем у резидентов той же линии, которые становились в дальнейшем субординантами – 124.36 ± 16.7 соответственно. У будущих доминантов линии РТ число мочевых меток составило 100.68 ± 17.84 и не отличалось от такового у будущих субординантов (89.46 ± 17.84).
Содержание с самкой достоверно уменьшало маркировочную активность у животных линии CBA/Lac (p < 0.01), но не оказывало влияния на этот показатель у самцов линии РТ (рис. 6).
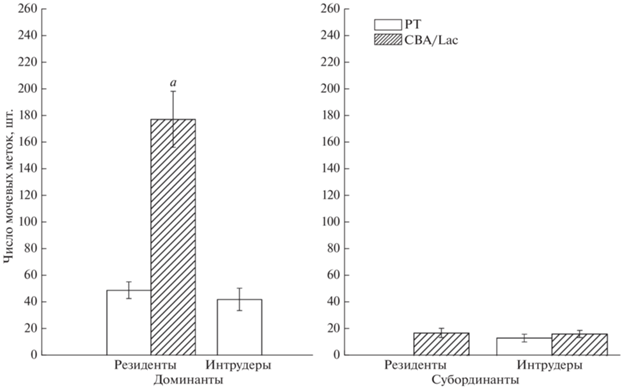
В период стабильных иерархических отношений между самцами (второй маркировочный тест, 4-й день после формирования социальной группы) число мочевых меток у субординантов всех генотипов было значительно ниже (p < 0.01), чем у доминантов (рис. 7). У доминантов-резидентов линии CBA/Lac маркировочная активность была выше (p < 0.01), чем у доминантов линии РТ, как резидентов, так и интрудеров. Во втором тесте межлинейные различия по маркировочной активности между субординантами линий РТ и CBA/Lac не отмечались. В период стабильных иерархических отношений территориальный статус самца не оказал влияния на маркировочную активность ни у доминантов линии РТ, ни у субординантов линии CBA/Lac.
Рис. 7.
Число мочевых меток на четвертый день существования социальной группы у самцов инбредных линий РТ и CBA/Lac с различным социальным (доминант или субординант) и территориальным (резидент или интрудер) статусом при формировании социальной иерархии: a – достоверность межлинейных различий (p < 0.01).
ОБСУЖДЕНИЕ
Проведенное исследование выявило существенное влияние генотипа и территориального статуса животного (резидент или интрудер) на уровень социального доминирования и паттерны агонистического поведения у самцов лабораторных мышей. Предварительное освоение территории увеличивало вероятность социального доминирования, а также повышало число наступательных и ответных атак у самцов мышей линий РТ и CBA/Lac. Эти данные соответствуют имеющимся представлениям о том, что предварительное освоение территории и наличие полового партнера увеличивают шансы особи достичь доминирующего положения (Золотарев, 1978; Шилов, 1991). Несмотря на то, что у интрудеров вероятность социального доминирования и экспрессия агрессивного поведения были снижены по сравнению с таковыми у резидентов, межлинейные различия по этим показателям сохранялись независимо от территориального статуса самца. Самцы линии РТ, как резиденты, так и интрудеры, проявляли бо́льшую склонность к доминированию по сравнению с самцами линии CBA/Lac. Таким образом, установлено, что у самцов лабораторных мышей выбор стратегии лидерства или подчинения, как при защите своей территории, так и при освоении нового участка обитания, определяется в первую очередь генетическими особенностями животного. Ранние исследования, посвященные генетике социального доминирования (Осадчук и др., 2009), были проведены на “нейтральной арене”, когда животных помещали в незнакомую экспериментальную клетку и они взаимодействовали между собой без предварительного освоения территории. Результаты настоящего исследования дополняют эти данные, показывая, что генетические различия по способности к социальному доминированию сохраняются вне зависимости от степени освоения территории.
В нашем исследовании самцы инбредной линии РТ, как резиденты, так и интрудеры, показывали более высокий по сравнению с самцами CBA/Lac уровень наступательных атак и вибраций хвостом. При нападении партнера как на своей, так и на чужой территории самцы линии РТ более активно оборонялись, чем самцы линии CBA/Lac. Поскольку у домовых мышей социальная иерархия устанавливается в результате агонистических взаимодействий между самцами (Кроукфорт, 1970; Соколов и др., 1990), то можно предположить, что генетические различия в выраженности агрессивного поведения, которые проявляются как на своей, так и на чужой территории, в значительной мере обусловливают генетические различия по уровню социального доминирования.
Считается, что уровень маркировочной активности особи может являться хорошим предиктором социального ранга (Drickamer, 2001), в особенности для резидента, поскольку самцы мышей активно маркируют свою территорию мочевыми метками, оказывая ольфакторное влияние на интрудера. Результаты нашего исследования отчасти подтверждают это мнение, поскольку базальная маркировочная активность резидентов линии CBA/Laс, которые в дальнейшем становились доминантами, была выше, чем у будущих субординантов этой линии. Однако проведенные нами эксперименты показали, что базальная маркировочная активность самцов линии CBA/Lac была выше, чем у самцов линии РТ. В период поддержания доминантно-субординантных отношений доминанты линии CBA/Lac также значительно чаще маркировали территорию, чем доминанты линии РТ. Самцы линии CBA/Lac значительно чаще обнюхивали партнера, чем самцы линии РТ, как при формировании, так и при поддержании социальных отношений. Таким образом, самцы линии CBA/Lac характеризуются более высоким уровнем маркировочной активности и повышенной склонностью к обонятельным контактам, но сниженной способностью к доминированию по сравнению с самцами линии РТ. Полученные результаты позволяют предположить, что существенный вклад в генетические различия по способности к социальному доминированию у домовых мышей вносит генетически детерминированный уровень агрессивности, а не маркировочной активности. Результаты нашего исследования демонстрируют роль генетически детерминированного уровня агрессивности для достижения доминирующего положения вне зависимости от степени освоения участка обитания. Однако вопрос о том, какие поведенческие особенности и связанные с ними свойства нервной и эндокринной систем животного могут иметь ведущее значение для установления и поддержания доминантно-субординантных отношений, остается открытым. Известно, что начальный период формирования доминантно-субординантных отношений сопровождается социальным стрессом, который наиболее выражен у интрудеров (Шилов, 1991; Martinez et al., 1998). Даже в этой ситуации самцы-интрудеры инбредной линии РТ демонстрировали активную стратегию поведения, проявляя агрессию по отношению к хозяину территории. Животные с разными стратегиями поведения (пассивной или активной) в тесте “резидент – интрудер” различаются также по двигательной активности, реактивности симпатической нервной системы, реактивности гипоталамо-гипофизарно-надпочечниковой оси и другим взаимосвязанным поведенческим и физиологическим параметрам (Koolhaas et al., 2013). Генетически детерминированная устойчивость животного к социальному стрессу, сопровождающему формирование доминантно-субординантных отношений, может обусловливать выбор животным стратегии лидерства или подчинения (Шилов, 1991; Осадчук и др., 2009).
Согласно современным данным, проявление агрессивного поведения и устойчивость к стрессу есть результат совместного функционирования различных структур мозга и характеристик нейротрансмиттерных систем (Takahashi, Miczek, 2014; Bartholow, 2018). Работа этой сложной системы находится под контролем гормонов, в частности тестостерона (Nelson, Trainor, 2007). Тестостерон стимулирует агрессивное (Trainor et al., 2009; Carré, Olmstead, 2015) и маркировочное поведение (Arakawa et al., 2008), когнитивные процессы (Ciocca et al., 2016), а также оказывает анскиолитическое действие (Aikey et al., 2002; Celec et al., 2015). Данные поведенческие эффекты тестостерона способствуют достижению доминирующего положения. При этом считается, что ведущее значение для достижения и удержания высокого социального ранга имеет не базальный уровень тестостерона, а быстрое транзиторное увеличение его концентрации в крови в период социальной нестабильности, в частности при формировании социальной группы или изменении ее состава (Wingfield, 1990; Oyegbile, Marler, 2005; Mehta et al., 2008). Ранее в наших исследованиях у самцов линии РТ была показана более высокая по сравнению с самцами линии CBA/Lac реактивность семенников к действию хорионического гонадотропина как in vitro (Осадчук, Свечников, 1995), так и in vivo (Зарубина, Осадчук, 2011). Хорионический гонадотропин является функциональным аналогом лютеинизирующего гормона и эффективно стимулирует секрецию тестостерона, что позволяет выявлять потенциальные возможности семенников. Полученные данные указывают на более высокий стероидогенный потенциал семенников у самцов линии РТ по сравнению с самцами линии CBA/Lac, который, вероятно, реализуется в период формирования социальной иерархии и способствует доминированию. Предполагается, что фенотипическая изменчивость по стероидогенному потенциалу семенников может быть обусловлена количеством и/или активностью рецепторов к лютеинизирующему гормону (Зарубина, Осадчук, 2011) или активностью ферментов стероидогенеза (Осадчук, Свечников, 1998). Согласно результатам данного исследования генетические особенности, обусловливающие высокий стероидогенный потенциал клеток Лейдига, могут вносить существенный вклад в способность самца доминировать как на освоенной, так и на чужой территории. При этом данные о взаимосвязи уровня тестостерона и социального статуса у мышей остаются противоречивыми. В частности, введение экзогенного тестостерона самцам лабораторных мышей не позволило установить взаимосвязи между уровнем этого гормона и доминантным рангом (Bronson, 1996; Martinez-Sanchis et al., 1998). У мышей аутбредной линии CD-1 в условиях стабильной социальной иерархии уровень тестостерона был снижен у подчиненных животных по сравнению с доминантами, но только в группах, характеризующихся высокой агрессивностью доминирующего самца (Williamson et al., 2017). Учитывая высокую изменчивость поведения и социальной структуры группировок, характерную для домовых мышей (Краснов, Хохлова, 1994), можно предполагать, что взаимосвязь между секрецией тестостерона и социальным статусом у самцов этого вида является достаточно сложной и зависит от состава и продолжительности существования социальной группы, генотипа животных и средовых условий формирования иерархии.
ЗАКЛЮЧЕНИЕ
Таким образом, у самцов лабораторных мышей установлено влияние генотипа и территориальных условий формирования социальной иерархии на уровень доминирования и паттерны агонистического поведения. Предварительное освоение территории увеличивало агрессивность и вероятность доминирования у самцов обоих генотипов. Однако межлинейные различия по агрессивному поведению и уровню доминирования сохранялись как на своей территории, так и на территории, освоенной другим самцом. Независимо от территориальных условий формирования иерархии ведущее значение в проявлении наследственно обусловленной повышенной способности к социальному доминированию у самцов линии РТ играет генетически детерминированный уровень агрессивности животного, а не уровень маркировочной активности. Предполагается, что высокий стероидогенный потенциал семенников может вносить существенный вклад в генетически детерминированную способность к социальному доминированию.
Список литературы
Брагин А.В., Осадчук Л.В., Осадчук А.В., 2006. Экспериментальная модель формирования и поддержания социальной иерархии у лабораторных мышей // Журнал высшей нервной деятельности. Т. 56. № 3. С. 412–419.
Гуторова Н.В., Клещев М.А., Осадчук Л.В., 2012. Роль длительных социальных взаимодействий в контроле сперматогенной функции у самцов мышей инбредных линий PT и CBA/Lac // Российский физиологический журнал им. И.М. Сеченова. Т. 98. № 7. С. 854–861.
Громов В.С., 2008. Пространственно-этологическая структура популяций грызунов. М.: Товарищество научных изданий КМК. 581 с.
Громов В.С., 2017. Эволюция социальности у млекопитающих. М.: Товарищество научных изданий КМК. 364 с.
Зарубина (Дубовенко) Е.А., Осадчук Л.В., 2011. Феногенетический анализ реактивности семенников к действию хорионического гонадотропина у мышей инбредных линий // Генетика. Т. 47. № 2. С. 249–254.
Золотарев С.А., 1978. Изменение агрессивного поведения у самцов дикой домовой мыши под влиянием разной степени знакомства с территорией // Биологические науки. № 9. С. 59–64.
Клещев М.А., Гуторова Н.В., Осадчук Л.В., 2013. Генетические особенности возрастной динамики агонистического поведения у самцов лабораторных мышей в условиях социальной иерархии // Экологическая генетика. Т. 10. № 4. С. 64–72.
Клещев М.А., Осадчук Л.В., 2014. Социальное доминирование и репродуктивный успех у самцов лабораторных мышей (Mus musculus) // Журнал эволюционной биохимии и физиологии. Т. 50. № 3. С. 201–206.
Краснов Б.Р., Хохлова И.С., 1994. Пространственно-этологическая структура группировок // Домовая мышь. Происхождение, распространение, систематика, поведение. Под ред. Котенковой Е.В., Булатовой Н.Ш. М.: Наука. С. 188–214.
Кроукфорт П., 1970. Артур, Билл и другие (все о мышах). М.: Мир. 158 с.
Котенкова Е.В., Мунтяну А.И., 2007. Феномен синантропии: адаптации и становление синантропного образа жизни в процессе эволюции надвидового комплекса Mus musculus // Успехи современной биологии. Т. 127. № 5. С. 514–528.
Осадчук А.В., 1990. Микроэволюционные основы функционирования адренокортикальной и половой систем // Онтогенетические и генетико-эволюционные аспекты нейроэндокринной регуляции стресса. Под ред. Науменко Е.В. Новосибирск: Наука. С. 160–169.
Осадчук А.В., Свечников К.В., 1995. Генетический контроль стероидогенеза в клетках Лейдига лабораторных мышей // Доклады РАН. Т. 343. № 2. С. 281–283.
Осадчук А.В., Свечников К.В., 1998. Генетический контроль активностей микросомальных ферментов стероидогенеза в клетках Лейдига инбредных линий мышей // Генетика. Т. 34. № 9. С. 1277–1285.
Осадчук Л.В., Брагин А.В., Осадчук А.В., 2009. Межлинейные различия в социальном доминировании и временных паттернах агонистического поведения у самцов лабораторных мышей // Журнал высшей нервной деятельности. Т. 59. № 3. С. 322–330.
Осадчук Л.В., Саломачева И.Н., Осадчук А.В., 2010. Зависимые от генотипа изменения репродуктивной функции при формировании социальной иерархии у самцов лабораторных мышей // Журнал высшей нервной деятельности. Т. 60. № 3. С. 339–351.
Панов Е.Н., 2010. Поведение животных и этологическая структура популяций. М.: Книжный дом Либроком. 424 с.
Соколов В.Е., Котенкова Е.В., Лялюхина С.И., 1990. Биология домовой и курганчиковой мышей. М.: Наука. 207 с.
Шилов И.А., 1991. Механизмы формирования и поддержания пространственно-этологической структуры популяции. Структура популяций у млекопитающих. М.: Наука. 240 с.
Aikey J.L., Nyby J.G., Anmuth D.M., James P.J., 2002. Testosterone rapidly reduces anxiety in male house mice (Mus musculus) // Hormones and Behavior. V. 42. № 4. P. 448–460.
Arakawa H., Blanchard D.C., Arakawa K. et al., 2008. Scent marking behavior as an odorant communication in mice // Neuroscince Biobehavoural Reviews. V. 32. № 7. P. 1236–1248.
Arakawa H., Cruz S., Deeak T., 2011. From models to mechanisms: odorant communication as a key determinant social behavior in rodents during illness-associated states // Neuroscience and Biobehavioral Reviews. V. 35. P. 1916–1928.
Bartolomucci A., 2007. Social stress, immune functions and disease in rodents // Frontiers Neuroendocrinology. V. 28. № 1. P. 28–49.
Bartholow B.D., 2018. The aggressive brain: insights from neuroscience // Current Opinion in Psychology. V. 19. P. 60–64.
Benton D., Dalrymple-Alford C., Brain P., 1980. Comparisons of measures of dominance in the laboratory mouse // Animal behaviour. V. 28. P. 1274–1279.
Bronson F.H., 1996. Effects of prolonged exposure to anabolic steroids on the behavior of male and female mice // Pharmacology Biochemistry and Behavior. V. 53. P. 329–334.
Carré J.M., Olmstead N.A., 2015. Social neuroendocrinology of human aggression: examining the role of competition-induced testosterone dynamics // Neuroscience. V. 286. P. 171–186.
Celec P., Ostatníková D., Hodosy J., 2015. On the effects of testosterone on brain behavioral functions // Frontiers in Neuroscience. V. 9. Article 12. P. 1–17. https://doi.org/10.3389/fnins.2015.00012
Ciocca G., Limoncin E., Carosa E. et al., 2016. Is testosterone a food for the brain? // Sexual Medicine Reviews. V. 4. № 1. P. 15–25.
Creel S., 2001. Social dominance and stress hormones // Trends in Ecology & Evolution. V. 16. P. 491–497.
Desjardins C., Maruniak J.A., Bronson F.H., 1973. Social rank house mice: differentiation revealed by ultraviolet of urinary marking patterns // Nature. V. 20. P. 939–941.
Drickamer L.C., 2001. Urine marking and social dominance in male house mice (Mus musculus domesticus) // Behavioural Processes. V. 53. P. 113–120.
Ellis L., 1995. Dominance and reproductive success among nonhuman animals: a cross-species comparison // Ethology & Sociobiology. V. 164. № 4. P. 257–333.
Grant E.C., Mackintosh J.H., 1963. A comparison of the social postures of some common laboratory rodents behavior // Behaviour. V. 21. № 3-4. P. 246–259.
Hayashi S., Tomihara K., 2000. The influence of female on male territorial dominance and female preference in dwelling place in laboratory mice // Journal Ethology. V. 18. № 1. P. 47–51.
Hurst J.L., 1990. Urine marking in populations of wild house mice Mus domesticus Rutty: communication between males // Animal Behaviour. V. 40. P. 209–222.
Hurst J.L., 1993. The priming effect of urine substrate marks on interactions between male house mice Mus musculus domesticus // Animal Behaviour. V. 45. P. 55–83.
Hurst J.L., Beynon R.J., 2004. Scent wars: the chemobiology of competitive signalling in mice // BioEssays. V. 26. № 12. P.1288–1298.
Koolhaas J.M., Coppens C.M., Boer S.F., Buwalda B., Meerlo P. et al., 2013. The resident-intruder paradigm: a standardized test for aggression, violence and social stress // Journal of Visualized Experiments. V. 77. P. 2–7.
Koyama S., Kamimura S., 1999. Lowered sperm motility in subordinate social status of mice // Physiology and Behaviour. V. 65. P. 665–669.
Martinez M., Calvo-Torrent A., Pico-Alfonso M., 1998. Social defeat and subordination as models of social stress in laboratory rodents: a review // Aggressive Behavior. V. 24. P. 241–256.
Martinez-Sanchis S., Salvador A., Moya-Albiol L., Gonzalez-Bono E., Simon V.M., 1998. Effects of chronic treatment with testosterone propionate on aggression and hormonal levels in intact male mice // Psychoneuroendocrinology. V. 23. P. 275–293.
Maxson S.C., Canastar A., 2003. Conceptual and methodological issues in the genetics of mouse agonistic behavior // Hormones and Behavior. V. 44. № 3. P. 258–262.
Mehta P.H., Jones A.C., Josephs R.A., 2008. The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat // Journal of Personality and Social Psychology. V. 94. P. 1078–1093.
Nelson R.J., Trainor B.C., 2007. Neural mechanisms of aggression // Nature Reviews Neuroscience. V. 8. P. 536–546.
Neumann C., Duboscq G., Dubuc C., 2011. Assessing dominance hierarchies: validation and advantages of progressive evaluation with Elo-rating // Animal Behaviour. V. 82. № 4. P. 911–921.
Oyegbile T.O., Marler C.A., 2005. Winning fights elevates testosterone levels in California mice and enhances future ability to win fights // Hormones and Behavior. V. 48. P. 259–267.
Sapolsky R.M., 2005. The influence of social hierarchy on primate health // Science. V. 308. № 5722. P. 648–652.
Sneddon L.U., Schmidt R., Fang Y., Cossins A.R., 2011. Molecular correlates of social dominance: a novel role for ependymin in aggression // PlosOne. V. 6. P. 1–9.
Takahashi A., Miczek K.A., 2014. Neurogenetics of aggressive behavior: studies in rodents // Current Topics in Behavioral Neurosciences. V. 17. P. 3–44.
Trainor B.C., Sisk C.L., Nelson R.J., 2009. Hormones and the development and expression of aggressive behavior. Hormones, Brain and Behavior, 2nd edition. V. 1. San Diego: Academic Press. P. 167–203.
Williamson C.M., Lee W., Romeo R.D., Curley J.P., 2017. Social context-dependent relationships between mouse dominance rank and plasma hormone levels // Physiology and Behavior. V. 171. P. 110–119.
Wilson E.O., 2000. Sociobiology: The New Synthesis. Cambridge: Harvard University Press. 537 p.
Wingfield J.C., Hegner R.E., Dufty A.M., Ball G.F., 1990. The “Challenge Hypothesis”: theoretical implications for patterns of testosterone secretion, mating systems, and breeding strategies // The American Naturalist. V. 136. № 6. P. 829–846.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


