Зоологический журнал, 2022, T. 101, № 7, стр. 723-735
Материалы по фауне и экологии коловраток Урала. Семейство Synchaetidae (Rotifera, Eurotatoria, Ploima). Род Polyarthra
А. Г. Рогозин *
Южно-Уральский Федеральный научный центр Минералогии и геоэкологии
Уральского отделения РАН
456317 Челябинская обл., Миасс, Россия
* E-mail: rogozin57@gmail.com
Поступила в редакцию 29.06.2021
После доработки 03.10.2021
Принята к публикации 08.10.2021
- EDN: BKPVPG
- DOI: 10.31857/S0044513422070091
Аннотация
Обобщен материал по распространению на Урале коловраток (Rotifera) из рода Polyarthra Ehrenberg 1834 семейства Synchaetidae на основе исследований автора и анализа литературных источников. Обнаружены 8 валидных видов: P. dolichoptera Idelson 1925, P. euryptera Wierzejski 1891, P. longiremis Carlin 1943, P. luminosa Kutikova 1962, P. major Burckhardt 1900, P. minor Voigt 1904, P. remata Skorikov 1896, P. vulgaris Carlin 1943. Девятый из найденных видов, P. dissimulans Nipkow 1952, возможно, является species inquirenda (Nogrady, Segers, 2002). Указаны места находок, приведены данные по морфологии, биологии, количественному развитию и индикаторным свойствам видов в водоемах Урала. Наиболее широко распространены и многочисленны в водоемах Урала P. dolichoptera и P. vulgaris. Вероятно, низкая температура воды ограничивает географическое распространение рода Polyarthra, представленного преимущественно теплолюбивыми видами, в северные широты.
Настоящая работа – дальнейшее обобщение материала по коловраткам отряда Ploima на Урале. Она завершает рассмотрение крупного семейства планктонных коловраток Synchaetidae Hudson et Gosse 1886. Характеристика видов, аутэкологические сведения приведены в том же формате и с теми же особенностями, что и в предыдущих работах (Рогозин, 2018–2020). Количественные данные, характеризующие популяции коловраток, были получены стандартным методом фракционного лова автоматическим батометром Паталаса объемом 5 л. Как правило облавливали всю толщу воды от поверхности до дна через каждые 5 м, в случае мелководных участков глубиной 3–5 м отбирали придонную и поверхностную пробы, при глубине менее 3 м – пробу из середины водной толщи. Каждую пробу концентрировали путем процеживания через сито из мельничного газа до объема 60 мл, дальнейшая работа по определению численности проведена стандартными методами камеральной обработки проб. Перед вычислением среднего арифметического выполнялась предварительная проверка выборок на нормальное распределение. При указании средней численности везде приводятся доверительные 95% интервалы и число наблюдений (N).
Род Polyarthra Ehrenberg 1834. В роде 10 валидных видов (Nogrady, Segers, 2002), из которых на Урале обнаружены 8. Спорным девятым для фауны Урала является Polyarthra dissimulans Nipkow 1952, которого некоторые авторы относят к species inquirenda (Nogrady, Segers, 2002). Polyarthra – типичные обитатели планктона.
Polyarthra dissimulans Nipkow 1952 (рис. 1а)
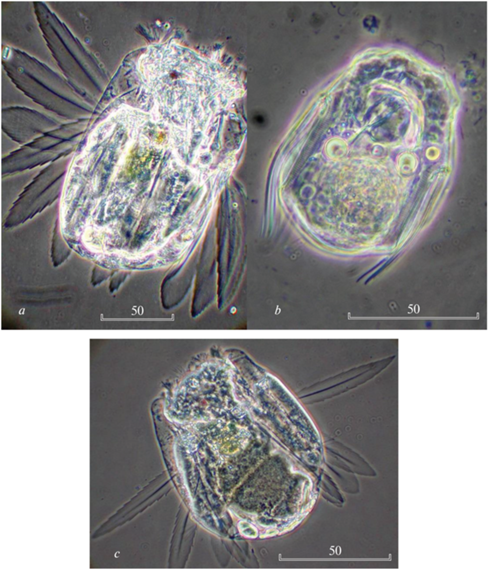
Рис. 1.
Коловратки рода Polyarthra из южноуральских водоемов: a – P. dissimulans Nipkow 1952 из оз. Малый Теренкуль, b – P. dolichoptera Idelson 1925 из оз. Тургояк, c – P. longiremis Carlin 1943 из оз. Малый Теренкуль, d – P. luminosa Kutikova 1962 из оз. Большой Ишкуль. Фазовый контраст. Размеры указаны в микрометрах.

Впервые этот редкий вид был обнаружен нами в р. Куштумге, притоке Миасса (бассейн Тобола). Следующие находки сделаны в озерах Бараус, Малое Миассово (Рогозин, 2004), Ильменское, Малый Теренкуль, Тургояк (восточные предгорья Южного Урала, неопубликованные данные автора). Размеры (мкм) по нашим данным: длина тела 140–165, длина плавников 142–158, ширина плавников 8–9.
Обитатель пелагиали озер, что подтверждается и литературными данными (Virro, Haberman, 2005). Термофильный вид (1.7) с признаками эвритермности (SEI = 2.8). В целом предпочитает температуру воды от 13 до 18°С. В уральских водоемах встречается с начала мая, после схода льда, до середины июня, таким образом, по сезонному спектру может быть отнесен к весенне-летним видам. Набережный (1984) считает P. dissimulans теплолюбивым из-за обитания в летнее время в водоеме-охладителе Молдавской ГРЭС. Вирро (Virro, 1995), не обнаруживший P. dissimulans в холодном Чудском озере, также отнес его к тепловодным, ссылаясь на публикации ряда авторов (Кутикова, 1970; Bērziņš, Pejler, 1989), однако в первой работе вид указан как “вероятно теплолюбивый”, а во второй – не упоминается. Во всяком случае, наши данные выводам о возможной термофильности вида не противоречат.
Коловратка встречается при содержании растворенного кислорода от 5.2 до 17.2 мгО/дм3, что демонстрирует широкий диапазон устойчивости к этому фактору. Предпочитает нейтральные или щелочные воды (рН от 7.0 до 9.2). Эвтрофный стенобионтный вид (индивидуальный индекс 1.8, SEI = 4.2). По нашим данным, выраженный бетамезосапроб (1.9) с высоким индикаторным весом (4.7). Сладечек (Sladeček, 1983) характеризует вид в водоемах Европы как олигосапроба (1.2) с индикаторным весом 4. Подобные различия в свойствах видов в разных географических областях мы обнаруживали неоднократно и отмечали в предыдущих работах.
Численность P. dissimulans невелика и колеблется в пределах от 200 до 1500 экз./м3. Наибольшая численность – 1580 экз./м3 – обнаружена в мезотрофном оз. Бараус в мае.
Редкость находок P. dissimulans на Урале может быть связана и с некоторой сложностью выявления этого вида, схожего с более распространенным и многочисленным P. dolichoptera Idelson, при разборе массовых гидробиологических проб.
На территории России известен из водоемов Северо-Запада, а также из водоемов Восточной Сибири. Распространен в Палеарктике.
Валидность P. dissimulans подвергается сомнению рядом авторов, которые относят его к species inquirenda (Nogrady, Segers, 2002).
Polyarthra dolichoptera Idelson 1925 (рис. 1b)
Примерно до середины 20 века этот вид значился в работах уральских гидробиологов под ныне не валидными наименованиями P. trigla или P. platyptera, ввиду чего идентифицировать его истинную встречаемость и распространение на Урале не представляется возможным. Формально нет указаний на находки P. dolichoptera на Среднем Урале и в Приуралье, где основные исследования коловраток были проведены в первой половине прошлого века. Кроме того, существует предположение о том, что P. dolichoptera – комплекс криптических видов, этот вопрос требует дальнейших исследований (Obertegger et al., 2014). На Южном Урале вид широко распространен в многочисленных озерах восточных предгорий Уральского хребта: Аргаяш (Макарцева, 1978), Бараус, Большое и Малое Миассово, Ильменское, Большой Таткуль (Рогозин, 2004), Тургояк (Рогозин, 1998), Табанкуль (Рогозин, 2006), Малый Теренкуль (Рогозин, 2009а), Увильды (Рогозин, 2009), Аракуль, Большой Еланчик, Еловое, Иткуль, Большой Ишкуль, Кысыкуль, в лесостепных и степных озерах Зауралья, в том числе высокоминерализованных: Подборное, Селезян, Сладкое, Сугояк, Южиган (неопубликованные данные автора), а также в Аргазинском водохранилище на р. Миасс (бассейн Тобола) (Рогозин, 2013). Вид обнаружен и на западном склоне Южного Урала в р. Сим (бассейн Белой) (неопубликованные данные автора). На западном склоне Полярного Урала найден в многочисленных водоемах р. Кара (Богданова, 2003), на восточном склоне – в озерах Ингилор и Сядатото и других водоемах бассейна Нижней Оби (Богданов и др., 2004, 2005).
Размеры (мкм) по нашим данным: длина тела 100–180, ширина тела 85–107, длина плавников 165–198, длина брюшных плавничков 57–70.
Эупланктонный пелагический вид, обитающий преимущественно в пресных озерных водах, хотя встречается и в солоноватых и соленых, включая прибрежные зоны морей (Кутикова, 1970; Jersabek, Bolortsetseg, 2010).
Криофильный вид с признаками эвритермности, поскольку обитает и в теплых водах (индивидуальный термоиндекс 0.7, SEI = 2.3). Встречается круглогодично, однако предпочитает весну и начало лета (май–июнь), холодноводный период с массовым развитием микроводорослей. Сходные результаты были получены и по Чудскому озеру, с той разницей, что в пелагиали пик численности P. dolichoptera наблюдался в июле. При этом и зимой это один из доминирующих видов планктона (Virro, 1995). В озерах Англии и Чехии характеризуется как весенне-раннелетний (Devetter, 1998; Elliott, 2006). Есть указания на массовое размножение P. dolichoptera осенью (Герасимов, Шабанова, 2018) и даже летом в мелководных хорошо прогретых водоемах (Bērziņš, Pejler, 1989). Как холодноводный, причем стенотермный вид, P. dolichoptera охарактеризован рядом исследователей (May, 1983; Jersabek, Bolortsetseg, 2010). С утверждением о стенотермности этой коловратки вряд ли можно согласится исходя из приведенных выше результатов. По-видимому, температурный оптимум вида в уральских водоемах лежит в пределах 10–12°С, в целом же составляет от 5 до 15°С (Koste, 1978).
Polyarthra dolichoptera может быть охарактеризован как оксифильный вид, предпочитающий содержание кислорода в воде не ниже 4 мг/дм3 и насыщение не менее 40%, что согласуется с данными других наблюдений (Jersabek, Bolortsetseg, 2010). Вместе с тем он устойчив к низким концентрациям O2 (Stenson, 1983).
Несмотря на приспособленность к широкому диапазону рН (Jersabek, Bolortsetseg, 2010), оптимумом для P. dolichoptera являются нейтральные воды с рН 7.0 (Bērziņš, Pejler, 1987).
Известные эвригалинные свойства P. dolichoptera проявляются и в водоемах Урала – вид обнаружен как в ультрапресных (Тургояк, Увильды и др.), так и в солоноватых и соленых озерах (Подборное, Южиган и др.).
Согласно нашим данным, вид приурочен к эвтрофным озерам, реже встречается в мезотрофных и очень редко в олиготрофных, может быть отнесен к эвтрофам с умеренной стенобионтностью (индивидуальный индекс 1.7, SEI = 3.2). Аналогичный результат получен для озер Турции, где вид отнесен к индикаторам эвтрофии (Bozkurt, Tepe, 2011).
По отношению к органическому загрязнению воды проявляет себя на Урале как бетамезосапроб с индивидуальным сапробным индексом 1.9 и индикаторным весом 2.8. Сходные показатели получены для Западной Сибири – сапробный индекс 1.6, индикаторный вес 3 (Ермолаева, Двуреченская, 2013). В Европе отнесен к олиго-бетамезосапробам с индексом 1.5 и индикаторным весом 3 (Sladeček, 1983).
Polyarthra dolichoptera облигатно питается микроводорослями, преимущественно крипто- и хризомонадами, а также центрическими диатомеями (Pourriot, 1977). Именно эти водоросли составляют основу планктона зимой и весной, когда развитие P. dolichoptera максимально. Наибольшая зарегистрированная численность вида в уральских озерах – 544 тыс. экз./м3 (в середине июня в слабоминерализованном лесостепном оз. Сугояк). Средняя численность по всему массиву наших проб составила 30.6 ± 15.4 тыс. экз./м3 (N = 204). Встречаемость – 18.5%. Подобные величины получены, например, в Чудском озере, где численность коловратки обычно составляла от 8 до 20 тыс. экз./м3 (Virro, 1995).
В литературе нередко упоминается о влиянии беспозвоночных хищников на численность P. dolichoptera. По одним данным, хищная коловратка Asplanchna priodonta Gosse избегает потребления P. dolichoptera (Gilbert, Williamson, 1978), по другим (Guiset, 1977) – для аспланхн (в том числе A. girodi Guerne), а также, особенно, Ploesoma hudsoni Imhof, P. dolichoptera является обычной добычей. Согласно нашим материалам, численность P. dolichoptera не имеет статистической связи с численностью A. priodonta (корреляция Спирмена r = 0.13 и статистически незначима – p = 0.40). А вот другая хищная аспланхна – A. girodi – в высокой степени коррелирует по численности с обсуждаемым видом (r = 0.71, p = 0.002). Вполне вероятно, что это означает синхронное колебание плотности популяций жертвы и хищника и позволяет предположить, что A. girodi оказывает воздействие на развитие полиартры в уральских озерах. C P. hudsoni есть среднего уровня корреляция (0.46), значимая на уровне p < 0.1 (p = 0.09). Последнее позволяет предположить, что P. hudsoni также может оказывать определенное влияние на численность P. dolichoptera.
Есть данные, что P. dolichoptera избирательно потребляется копеподой Mesocyclops leuckarti (Claus) благодаря способности настигать жертву, несмотря на резкие “скачки” с помощью плавников (Walz, 1993). В нашем случае это не подтверждается – корреляция численности этих видов составляет всего 0.24, и она статистически незначима (р = 0.39).
Мы рассмотрели статистическую связь численности P. dolichoptera с другими распространенными в уральских озерах видами рода Polyarthra – P. luminosa Kutikova и P. vulgaris Carlin по всему массиву проб с помощью корреляционного анализа (корреляция Спирмена). C P. luminosa r = = 0.69 (p = 0.006) с P. vulgaris r = 0.61 (p = 0.04). Таким образом, количественная динамика видов очень сходна и сходство статистически значимо. С одной стороны, это может говорить об общности аутэкологии видов, с другой – об отсутствии конкуренции между ними за пищевые ресурсы.
Polyarthra dolichoptera распространен на всей территории России, встречается преимущественно западнее Урала. Известен во всех зоогеографических областях, кроме Неотропической и Антарктической.
Polyarthra euryptera Wierzejski 1891
Обнаружен только в Приуралье и на Южном Урале. Первая находка сделана в Каме и оз. Ласьвинском (Опарина, 1923), в дальнейшем вид неоднократно встречен в Каме и водоемах ее бассейна (Граевский, Поганкин, 1937; Таусон, 1946, 1947), в конце 1930-х годов в озерах восточных предгорий Ильменского хребта Аргаяш, Ильменское, Большой Ишкуль, Малое Миассово, Чебаркуль (неопубликованные данные А.О. Таусон). P. euryptera отмечен как часто встречающийся и сравнительно обильный вид (по глазомерной оценке численности “немного” и “порядочно”). В дальнейшем найден в озерах этого же района Большой Теренкуль (Макарцева, 1978) и Большое Миассово (Рогозин, 1995). Следует отметить, что за все время исследований мы встретили эту коловратку только однажды в оз. Большое Миассово (единичные экземпляры). В дальнейшем она ни разу не встречалась, хотя озера, упомянутые в рукописи Таусон, были обследованы неоднократно. Морфометрические и количественные данные по развитию этой коловратки у автора отсутствуют. Опарина (1923) приводит длину тела 220–270, длину плавников 81–119 мкм, ширину плавников 40–60 мкм; отношение ширины плавников к длине 0.5.
Эупланктонный обитатель пресных прудов и озер (Кутикова, 1970), иногда встречается в потамопланктоне (Jersabek, Bolortsetseg, 2010).
Летний теплолюбивый вид, характеризуется как стенотермный (Bērziņš, Pejler, 1989; Jersabek, Bolortsetseg, 2010). Показано, что температурный фактор один из главнейших, определяющих развитие популяции P. euryptera (Bégin, Vincent, 2017). Известно также, что вид предпочитает нейтральные или слабокислые воды (Bērziņš, Pejler, 1987).
Polyarthra euryptera – типичный обитатель эвтрофных водоемов и считается видом-индикатором эвтрофии (Теоретические вопросы …, 1993). При этом Сладечек (Sladeček, 1983) относит вид к олигосапробам (индивидуальный сапробный индекс 1.2).
Питаясь исключительно водорослями различных размерных категорий, в том числе крупными диатомовыми, P. euryptera способна потреблять избирательно наиболее крупные клетки (Pourriot, 1977). Вид устойчив к конкуренции за пищевые ресурсы с дафниями (Gilbert, 1989). Нередко достигает высокой численности и доминирует в зоопланктонных сообществах (например, в японском оз. Икеда (Baloch et al., 1998) или в хорошо прогреваемых летом термокарстовых озерах Канады (Bégin, Vincent, 2017).
Обитает на всей территории России. Встречается в Голарктике и Ориентальной области.
Polyarthra longiremis Carlin 1943 (рис. 1с)
Редкий вид, встреченный из всех регионов Урала пока только на Южном. Первая находка сделана автором (Рогозин, 1998) в конце 1990-х гг. в оз. Тургояк (восточные предгорья Ильменского хребта). В дальнейшем обнаружен в близлежащих озерах Большое Миассово (Рогозин, 2000) и Аргаяш (Рогозин, 2004). По нашим данным, размеры, мкм: длина тела 157–190, ширина тела 95–100, длина плавников 140–168, ширина 9–12.
По биологии сходен с предыдущим видом, обитает в планктоне пресных вод (иногда в потамопланктоне, Jersabek, Bolortsetseg, 2010). Упоминается как индикатор мелководности (Koste, 1978), в частности в Чудском озере встречался только в литорали (Virro, Haberman, 1993). Нередко обитает в полигумозных водоемах (Nogrady, Segers, 2002).
По нашим данным, стенотермобионт (индивидуальный термоиндекс 2.7, SEI = 3.3). Это совпадает с результатами других исследователей (Virro, Haberman, 1993; Jersabek, Bolortsetseg, 2010). В южноуральских озерах максимум развития P. longiremis приходится на конец мая–июнь, встречается вплоть до октября. В других озерах умеренного климата достигает наибольшей численности в конце лета–начале осени, при максимальном прогреве воды (Virro, 1995).
Устойчив к кислым водам, встречается и в слабощелочных (до рН 8.7, Nogrady, Segers, 2002). Характеристика вида по отношению к трофии озер противоречива, его относят как к типичным олиготрофам (Schöll, 2002), так и эвтрофам (Кутикова, 1970; Jersabek, Bolortsetseg, 2010). Наши результаты подтверждают последнее – вид является стенобионтным (SEI = 4.2) эвтрофом (индивидуальный индекс 1.9). Это согласуется с его свойствами бетамезосапроба (индивидуальный сапробный индекс 1.4, индикаторный вес 3.9). Как вид, устойчивый к органическому загрязнению, упомянут и другими авторами (Крылов, 2014). Данным Сладечека (Sladeček, 1983) это противоречит, он относит вид к олигосапробам (1.0) с высшим индикаторным весом (5).
Наибольшая зарегистрированная численность вида в уральских озерах 37.8 тыс. экз./м3 (в середине июня в заросшем заливе оз. Большое Миассово в предгорьях Ильменского хребта на Южном Урале). Встречаемость 2.5%. Polyarthra longiremis относительно редок с невысоким обилием, иногда отмечаются вспышки численности. Согласно литературным данным, может входить в число доминантов зоопланктонного сообщества (Virro, 1995; Paturej, Gutkowska, 2015).
На территории России широко распространен западнее Урала, от субарктических регионов до южной аридной зоны, известны отдельные находки в Западной Сибири. Обнаружен во всех зоогеографических областях Земли, кроме Пацифики и Антарктики.
Polyarthra luminosa Kutikova 1962 (рис. 1d)
Гидробиологи, работавшие на Урале, либо не различали этот вид, причисляя его к сборным trigla или platyptera, либо относили к P. vulgaris. По крайней мере, до 1998 г. на Урале он формально не был известен. Наши исследования показали, что P. luminosa довольно широко распространен в озерах восточных предгорий Южного Урала. Первая находка – в оз. Тургояк (Рогозин, 1998). Впоследствии встречен в оз. Увильды (Рогозин, 2009), Аргазинском водохранилище на р. Миасс (Рогозин, 2013), а также в озерах Еловое, Иткуль, Большой Ишкуль, Кысыкуль, Большое Миассово (неопубликованные данные автора). Размеры (мкм) по нашим данным: длина тела 150–178, длина плавников 112–125, ширина плавников 10–24; длина брюшных плавников 42–45, ширина – 4–6.
Эупланктонный обитатель пресных озер, прудов и рек, обитает как в открытой воде, так и в фитали среди погруженных и плавающих макрофитов (Jersabek, Bolortsetseg, 2010). Встречается в течение всего периода открытой воды, с мая по ноябрь, чаще всего осенью, что согласуется с результатами Вирро (Virro, 1995) по Чудскому озеру и другими материалами (Virro et al., 2009). По нашим данным это термофильный вид (2.0) с выраженной температурной толерантностью (SEI = 1.6). Характеристика его как летнего стенотермного (Nogrady, Segers, 2002; Jersabek, Bolortsetseg, 2010) представляется слишком радикальной.
Polyarthra luminosa обитает в озерах с хорошим кислородным режимом и обычно встречается при концентрации растворенного О2 не ниже 6 мг/дм3. Это согласуется с данными других авторов (Jersabek, Bolortsetseg, 2010). Предпочитает низкую минерализацию воды (Bielańska-Grajner, Gładysz, 2010); на Урале приурочен к ультрапресным и пресным озерам с минерализацией на более 400 мг/дм3.
По нашим материалам – олигомезотроф со склонностью к обитанию в олиготрофных водах, индивидуальный индекс 0.6 с промежуточной стено-/эвритрофностью (SEI = 2.6). Андроникова (1996), обобщив имеющиеся опубликованные данные, характеризует P. luminosa как типичный вид олиготрофных водоемов. Такая характеристика согласуется с сапробными свойствами вида – по нашим данным, это олигосапроб (1.2) со средним индикаторным весом (2.8). В сводке Сладечека (Sladeček, 1983) по биоиндикаторам эта коловратка не упоминается.
Наиболее высокая зарегистрированная численность вида в уральских озерах – 122.4 тыс. экз./м3 (во второй половине августа в заросшем заливе Халитовская курья Аргазинского водохранилища на р. Миасс). Средняя численность по всему массиву наших проб 15.1 ± 4.9 тыс. экз./м3 (N = 205). Встречаемость 18.6%. Это одна из наиболее многочисленных и широко распространенных на Южном Урале коловраток рода Polyarthra. Она и в литературе нередко упоминается как доминирующий вид летнего и осеннего планктона (Haberman, 2000; Деревенская и др., 2012; Аюушсурэн и др., 2013). Наблюдение за вертикальным распределением P. luminosa в южноуральском оз. Большое Миассово показало, что он концентрируется преимущественно в верхних горизонтах толщи воды (0–10 м). Как упоминалось выше, численность P. luminosa положительно и статистически значимо коррелирует с численностью других распространенных видов рода – P. dolichoptera и P. vulgaris. Корреляция Спирмена численности P. luminosa с численностью кладоцер в целом, а также с наиболее распространенными на Южном Урале Bosmina longispina Leydig 1860 и Daphnia cucullata Sars 1862 (по всему массиву проб, где они встречались совместно) практически равна нулю и при этом не значима (r = 0.08–0.12, p > 0.05). Это позволяет предполагать отсутствие конкуренции за пищевые ресурсы между ними. Если рассматривать возможное влияние беспозвоночных хищников, то так же не обнаружено корреляции численности P. luminosa, хищных коловраток рода Asplanchna и наиболее распространенных в исследованных озерах хищных циклопов M. leuckarti. Это позволяет предполагать отсутствие заметного пресса хищников на популяции P. luminosa.
Встречается на всей территории России, большинство находок известно западнее Урала. Распространен в Голарктической, Неотропической и Ориентальной зоогеографических областях.
Polyarthra major Burckhardt 1900 (рис. 2а)
Рис. 2.
Коловратки рода Polyarthra из южноуральских водоемов: a – P. major Burckhardt 1900 из оз. Большой Кисегач, b – P. minor Voigt 1904 из оз. Демидовское, c – P. P. vulgaris Carlin 1943 из оз. Табанкуль. Фазовый контраст. Размеры указаны в микрометрах.
Вид распространен от Южного до Полярного Урала, но находки его сравнительно редки, первая состоялась лишь в середине 1990-х годов в южноуральском предгорном оз. Большой Таткуль (Рогозин, 1995). Впоследствии обнаружен и в других озерах восточных предгорий: Большой Еланчик, Большой Ишкуль, Большой Кисегач, Большое Миассово (неопубликованные данные автора). Найден также в западных предгорьях Южного Урала (пруд на р. Сим), в лесостепном Зауралье (Аргазинское водохранилище на р. Миасс (неопубликованные данные автора) и в оз. Синеглазово в Челябинске (Речкалов, Марушкина, 2005)). На Полярном Урале встречен в водоемах восточного макросклона и бассейна Нижней Оби (Богданов и др., 2004, 2005).
Размеры (мкм) по нашим данным: длина тела 150–180, длина плавников 125–168, ширина плавников 25–32.
Пресноводный озерный эупланктонный вид, изредка обитающий в потамопланктоне, попадается преимущественно летом и осенью (Virro, 1995; Jersabek, Bolortsetseg, 2010), но иногда и весной (Мухортова, Романова, 2008). В уральских озерах встречается практически круглогодично, кроме мая и июня. Наиболее часто – в сентябре, декабре и феврале. Это определяется тем, что вид относится к криобионтам (индивидуальный термоиндекс 0.6, SEI = 3.3) и заметного обилия достигает обычно в холодных водах, часто подо льдом. Если же не брать во внимание количественные характеристики распределения по температурному градиенту, то P. major вполне может сойти за эвритермный вид, к каковым его нередко и относят (Virro, 1995; Nogrady, Segers, 2002).
Вид избегает минерализованных вод (Jersabek, Bolortsetseg, 2010), 300–400 мг/дм3, видимо, являются для него пределом (Bielańska-Grajner, Cudak, 2014). На Урале встречен только в ультрапресных и пресных водах с минерализацией менее 300 мг/дм3. Упоминание P. major как обитателя Каспийского моря (Османов и др., 2018) является, возможно, ошибочным определением.
По нашим данным, мезоэвтрофный вид (индивидуальный трофический индекс 1.5, SEI = 3.6). Согласно сведениям других исследователей, характерен для водоемов с низкой трофией (Ruttner-Kolisko, 1972), для мезотрофных вод (Barrabin, 2000).
Наибольшая зарегистрированная нами численность P. major 27.1 тыс. экз./м3 (подо льдом в феврале, оз. Большой Кисегач), средняя – 9.5 ± ± 4.1 тыс. экз./м3 (N = 22). Встречаемость по нашим данным 3.7%. Средняя численность порядка 7–8 тыс. экз./м3 наблюдалась в волжских водохранилищах (Лазарева и др., 2018). Согласно литературным данным, численность P. major может регулироваться хищной коловраткой Asplanchna girodi (Barrabin, 2000), в наших условиях они совместно никогда не встречались.
Вид известен на всей территории России, больше всего находок на северо-западе европейской части и в Поволжье. Обитает во всех зоогеографических областях, кроме Пацифики и Антарктики.
Polyarthra minor Voigt 1904 (рис. 2b)
Нечасто встречается на Урале, впервые обнаружен в Приуралье в среднем течении Камы и озерах ее бассейна Диком, Источном, Ласьвинском, Осиновом (Опарина, 1923; Таусон, 1946), в оз. Большой Кумикуш (Таусон, 1934). Несколько находок были сделаны на Южном Урале студентом МГУ Н.В. Бондаренко (рукописные материалы 1938 г.) в озерах предгорий Ильменского хребта Ильменское, Большой Кисегач, Малое Миассово. Мы встречали этот вид в олигодистрофном оз. Демидовское (Рогозин, 2004) и в ныне несуществующем искусственном оз. Няшевский Прудок в предгорьях Ильменского хребта, в Аргазинском водохранилище на р. Миасс (неопубликованные данные автора).
Размеры (мкм) по нашим данным: длина тела 72–75, длина плавников 70–72, ширина плавников от 4 до 10. Опарина (1923) приводит длину тела 85, плавников 90 мкм, ширину плавников 4 мкм.
Обитатель литорали озер, прудов, болот, встречается среди водной растительности, сфагнума, зеленых нитчатых водорослей, а также в открытой воде (Кутикова, 1970; Jersabek, Bolortsetseg, 2010).
Материала для определения индивидуального термоиндекса вида у нас недостаточно, всего две находки были сделаны в середине лета и начале осени. Разные исследователи (Nogrady, Segers, 2002; Wærvågen, Andersen, 2017) определяют его как летний вид, причем в составе предоминантов сообщества. С весны до осени P. minor доминировал в разных водоемах дельты Дуная (Florescu et al., 2016). По-видимому, теплолюбивый. Вероятно, оксифильный (Ермолаева и др., 2019). Сладечек (Sladeček, 1983) относит вид к ксеноолигосапробам (индивидуальный сапробный индекс 0.6 с индикаторным весом 3).
В наших находках численность вида составила 1.6 тыс. и 80 экз./м3. Опарина (1923) указывает, что он встречался “в небольшом количестве”. Других сведений о количественном развитии вида на Урале нет.
Обитает, по-видимому, на всей территории России, известны находки от западных границ до Восточной Сибири. Встречается во всех зоогеографических областях, кроме Афротропической и Антарктической.
Polyarthra remata Skorikov 1896
Известен на Урале почти исключительно на территории Южного Урала, хотя впервые найден в р. Кама в окрестностях Перми (Опарина, 1923). Большинство находок сделано в озерах восточных предгорий: Тургояк (Рогозин, 1995), Большое Миассово (Рогозин, 2000), Малый Теренкуль (Рогозин, 2009), Бараус, Большой Ишкуль, Савелькуль (неопубликованные данные автора), Ильменское (неопубликованные данные Н.В. Бондаренко), в западных предгорьях в Миньярском и Симском прудах на р. Сим (Рогозин, 2007), в степной р. Большая Караганка на юге Челябинской обл. (неопубликованные данные автора). Обнаружен и в предлесостепном Зауралье в Аргазинском водохранилище на р. Миасс (неопубликованные данные автора).
Размеры (мкм) по нашим данным: длина тела 89–115, ширина тела 65–85, длина плавников 80–95, ширина плавников 8–10. Опарина (1923) приводит длину тела 150, ширину тела 100 мкм, длину плавников 136 мкм.
Эупланктонный обитатель открытой воды пресных и солоноватых озер, прудов и рек (Кутикова, 1970; Jersabek, Bolortsetseg, 2010), причем имеются сведения об избегании им заросших участков акватории (Pejler, 1962). На Урале он встречался только в ультрапресных и пресных водоемах – озерах, прудах и небольших реках.
Вид проявляет свойства термофила (индивидуальный термоиндекс 1.6), однако относительно эвритермный (SEI = 2.5) и иногда попадается даже в холодных (с температурой ниже 8°С) водах. Как эвритермный, он характеризуется и в других работах (Bērziņš, Pejler, 1989; Nogrady, Segers, 2002). Численность положительно коррелирует с температурой воды (Tellioğlu, Akman, 2007). Встречается вид, в основном, с мая по август, иногда попадается в пробах до октября. По данным Вирро (Virro, 1995), в Чудском озере наиболее обилен в августе–сентябре. Встречается и зимой (Nogrady, Segers, 2002).
Помимо температуры воды, численность P. remata также положительно коррелирует с содержанием кислорода (Bégin, Vincent, 2017). Мы, в частности, никогда не встречали эту коловратку при концентрации O2 ниже 6 мг/дм3. Отмечено также положительное влияние общего азота и хлорофилла а на обилие вида (Kuczyńska-Kippen et al., 2017), что согласуется с утверждением о нем, как индикаторе эвтрофных условий (Attayde, Bozelli, 1998). Он упоминается и как эвритрофный (Nogrady, Segers, 2002). Тем не менее, по нашим материалам, P. remata характеризуется как стенобионтный мезотроф (индивидуальный индекс 1.1, SEI = 3.4). В эвтрофных водах он обитает, однако обилие и встречаемость его гораздо ниже, чем в мезотрофных. К сожалению, во многих работах индикаторные свойства вида по отношению к трофности вод определяются “на глазок”, без рассмотрения распределения встречаемости и обилия по градиенту трофического статуса.
В водоемах Урала P. remata является олигобетамезосапробом (индивидуальный сапробный индекс 1.6, индикаторный вес 3.6. Это соответствует данным сводки Сладечека (Sladeček, 1983), согласно которой индикаторные показатели вида 1.5 и 3 соответственно.
Максимальная зарегистрированная численность вида в водоемах Южного Урала – 55.2 тыс. экз./м3 (оз. Большое Миассово в предгорьях Ильменского хребта), что является относительно высоким показателем для обитающих на Урале видов рода Polyarthra. Средняя численность по всем пробам 6.5 ± 4.9 тыс. экз./м3 (N = 43). Встречаемость 3.9%. Сравнительно высокая численность отмечена и в других исследованиях, и вид может доминировать в зоопланктонных сообществах (Tellioğlu, Akman, 2007).
Как и другие Polyarthra, этот вид является альгофагом и в летнее время нередко подвергается конкурентному исключению со стороны ветвистоусых ракообразных (Horpilla et al., 2019). Популяция вида также может регулироваться хищными веслоногими ракообразными (Diéguez, Gilbert, 2002) и личинками Chaoborus (Bégin, Vincent, 2017).
Находки вида известны на всей территории России, большинство – западнее Урала (скорее всего, в связи с общей лучшей изученностью гидрофауны). Встречается во всех зоогеографических областях, кроме Афротропической и Антарктической.
Polyarthra vulgaris Carlin 1943 (рис. 2c)
Наряду с P. dolichoptera, это самый известный на Урале вид рода Polyarthra. Для него так же остается неясным вопрос истинной картины распространения, поскольку он мог значиться во многих работах первой половины 20 века под именами сборных видов P. platyptera и P. trigla. В уральской гидробиологической литературе под именем P. vulgaris вид упоминается только для водоемов Южного Урала: оз. Тургояк (Уломский, 1964), Большие Касли, Киреты, Силач, Сунгуль (Козлова, 1979), Большое Миассово (Рогозин, 2000), Табанкуль (Рогозин, 2006), Увильды (Рогозин, 2009), Малый Теренкуль (Рогозин, 2009а), многочисленные озера Кисегач–Миассовской группы (Бараус, Большой Кисегач, Малое Миассово, Еловое и др., неопубликованные данные автора). В лесостепной зоне обнаружен в оз. Кундравинское (Козлова, 1966), Смолино, Сугояк, Аргазинском и Шершневском водохранилищах на р. Миасс (неопубликованные данные автора). В степной зоне найден в оз. Большое Чебачье (неопубликованные данные автора) и в прудах Чесменского рыбхоза (Любимова, 1971).
Размеры (мкм) по данным автора: длина тела 180–198, длина основных плавников 125–162, ширина основных плавников 19–23, длина брюшных плавников 52–55.
Эупланктонный обитатель преимущественно пресных озер и прудов, иногда попадается и в потамопланктоне, среди макрофитов (Jersabek, Bolortsetseg, 2010). Наши находки полностью это подтверждают.
Эвритермный вид (SEI = 1.3) с предпочтением холодных вод (индивидуальный термоиндекс 0.8). Как эвритермный, P. vulgaris характеризуется многими исследователями (Ruttner-Kolisko, 1972; Bērziņš, Pejler, 1989 и др.), также отмечена его приуроченность к холодным водам (Virro, 1995; Shah et al., 2015). Ввиду таких свойств в уральских водоемах P. vulgaris встречается круглогодично. Нам вид попадался с мая по ноябрь, пики численности наблюдались в любой месяц этого периода. По данным Козловой (1966), в Кундравинском оз. максимум обилия наблюдался в конце зимы, а летом вид не встречался вовсе, в оз. Тургояк пик развития приходился на осень (Уломский, 1964). Характеристика вида как летне-осеннего (Elliott, 2006) противоречит выводам исследований на Урале.
Polyarthra vulgaris эврибионтен по отношению к содержанию кислорода (Jersabek, Bolortsetseg, 2010), это может быть одним из ключевых факторов в разделении экологических ниш со сходным по спектру питания оксифильным видом P. dolichoptera (Stenson, 1983), с которым P. vulgaris даже значимо коррелирует по численности (см. выше). Существует мнение, что P. vulgaris оксифильный вид, т.к. редко встречается в гиполимнионе стратифицированных озер (Barrabin, 2000). Наши данные этому не соответствуют – и в гиполимнионе разных озер, и в вышележащих слоях воды он встречался одинаково часто с примерно равным обилием, несмотря на существенную разницу в содержании кислорода (от 1.7 до 12.8 мг/дм3).
Эвригалинный вид (Bielańska-Grajner, Cudak, 2014; Османов и др., 2018). Несмотря на это, в солоноватых и соленых озерах Южного Урала он нам ни разу не встречался. Обитает в достаточно широком диапазоне кислотности, от 4.9 до 8.7 (Nogrady, Segers, 2002).
Наши материалы показывают, что P. vulgaris является преимущественно мезотрофом (индивидуальный индекс 1.1), однако обитает также в олиготрофных и эвтрофных водах и занимает промежуточное положение между стено- и эвритрофными видами (SEI = 2.3). Установлено положительное влияние электропроводности, содержания ионов аммония, нитратов, фосфатов (Plangklang et al., 2019), общего азота и хлорофилла а (Kuczyńska-Kippen et al., 2017) на численность популяций P. vulgaris. Последнее связано с тем, что вид альгофаг и питается микроводорослями, преимущественно крипто- и хризомонадами, а также центрическими диатомеями (Pourriot, 1977). Летом он проигрывает пищевую конкуренцию (как и другие коловратки) кладоцерам, в частности Diaphanosoma brachiurum (Shah et al., 2015). Благодаря скачкообразному движению в толще воды, часто успешно избегает нападений беспозвоночных хищников (копеподы, хаоборусы, хищные коловратки) (Gilbert, 1985), влияние которых на популяции полиатртры обычно несущественно.
Формально P. vulgaris можно отнести к бетамезосапробам (2.0), однако низкий индикаторный вес (1.5) показывает достаточно безразличное отношение вида к содержанию растворенных органических веществ. Он попадался во всех зонах сапробности, вплоть до ксеносапробной. Сладечек (Sladeček, 1983) также относит эту коловратку к бетамезосапробам (2.1, индикаторный вес 2).
Максимальная зарегистрированная нами численность вида 420 тыс. экз./м3 (заросший залив оз. Большое Миассово в предгорьях Ильменского хребта на Южном Урале), средняя численность 10.8 ± 2.3 тыс. экз./м3 (N = 186). Уломский (1964) приводит среднюю численность в оз. Тургояк 11.3 тыс. экз./м3. Встречаемость по нашим данным 15.6%. Популяции P. vulgaris вообще нередко достигают высокой плотности (например, среднегодовая плотность в турецком оз. Кебан Дам составляла более 25 тыс. экз./м3, Tellioğlu, Akman, 2007) и вид может быть доминирующим в зоопланктонных сообществах в течение всего года (Plangklang et al., 2019).
Чрезвычайно широко распространенная коловратка, известная на всей территории России. Встречается везде, кроме Антарктики.
Род Polyarthra представлен в водоемах Урала достаточно полно, не обнаружены лишь тропические виды P. indica Segers et Babu 1999 и P. leleki Koste et Tobias 1989, известные из Индии и Восточной Африки соответственно. Потенциально наиболее широко распространенные в России и многочисленные виды P. dolichoptera и P. vulgaris до середины 20 века фигурировали в уральской гидробиологической литературе под именами platyptera и trigla, признанными ныне species inquirenda, поэтому истинная картина их распространения еще не выяснена. Очевидно, что температурный фактор играет важную роль в распространении Polyarthra. Большинство видов рода теплолюбивы или эвритермны с некоторым предпочтением теплых вод, поэтому встречаются только на Южном Урале и (некоторые) в Приуралье. До Полярного Урала доходят лишь эвритермный (с предпочтением холодных вод) P. dolichoptera и криобионт P. major.
Список литературы
Андроникова И.Н., 1996. Структурно-функциональная организация зоопланктона озерных экосистем разных тропических типов. СПб.: Наука. 189 с.
Аюушсурэн Ч., Шевелева Н.Г., Аров И.В., 2013. Таксономический состав зоопланктона и морфология редких видов в озерах бассейна Улаагчны Хар (Западная Монголия) // Известия Иркутского гос. ун-та. Сер. Биология, экология. Т. 6. № 2. С. 117–127.
Богданова Е.Н., 2003. К изучению зоопланктона Полярного Урала (зоопланктон бассейна р. Кара) // Научный вестник. Биологические ресурсы Полярного Урала. Вып. 3. Ч. 2. Салехард. С. 23–29.
Богданов В.Д., Богданова Е.Н., Госькова О.А., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2004. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: УрО РАН. 168 с.
Богданов В.Д., Богданова Е.Н., Гаврилов А.Л., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2005. Экологическое состояние притоков Нижней Оби (реки Харбей, Лонготъеган, Щучья). Екатеринбург: Изд-во Уральского ун-та. 236 с.
Герасимов Ю.Л., Шабанова А.В., 2018. Ракообразные и коловратки пруда у ТЦ “Пирамида” (г. Самара) после мелиорации пруда // Вестник Воронежского гос. университета. № 1. С. 64–72.
Граевский Э.Я., Поганкин М.В., 1937. Материалы по гидрофауне реки Камы и ее поймы в районе г. Соликамск – р. Чусовая // Известия Биологического научно-исследовательского ин-та при Пермском гос. ун-те. Т. 11. Вып. 3–4. С. 79–132.
Деревенская О.Ю., Палагушкина О.В., Мингазова Н.М., 2012. Трофические взаимоотношения фито- и зоопланктона в карстовых озерах // Популяционная экология. № 3. С. 84–89.
Ермолаева Н.И., Двуреченская С.Я., 2013. Региональные индексы индикаторной значимости зоопланктонных организмов в водоемах юга Западной Сибири // Экология. № 6. С. 476–480.
Ермолаева Н.И., Зарубина Е.Ю., Баженова О.П., Двуреченская С.Я., Михайлов В.В., 2019. Влияние абиотических и трофических факторов на суточную горизонтальную миграцию зоопланктона в литоральной зоне Новосибирского водохранилища // Биология внутренних вод. № 4. Вып. 1. С. 50–59.
Козлова И.В., 1966. Планктон озера Кундравинского // Труды Уральского отделения СибНИИРХ. Т. 7. С. 77–83.
Козлова И.В., 1979. Зоопланктон Каслинской группы озер и его продукция // Сборник научных трудов НИИ озерного и речного рыбного хозяйства. № 10. С. 118–124.
Крылов А.В., 2014. Межгодовые изменения летнего зоопланктона пойменных озер р. Хопер // Поволжский экологический журнал. № 2. С. 216–226.
Кутикова Л.А., 1970. Коловратки фауны СССР. Л.: Наука. 744 с.
Лазарева В.И., Сабитова Р.З., Соколова Е.А., 2018. Особенности структуры и распределения позднелетнего (август) зоопланктона в водохранилищах Волги // Труды ИБВВ РАН. Вып. 82 (85). С. 28–51.
Любимова Т.С., 1971. Зоопланктон выростных прудов Чесменского рыбхоза Челябинской области // Труды Уральского отделения СибНИИРХ. Т. 8. С. 253–258.
Макарцева Е.С., 1978. Видовой состав и продуктивность зоопланктона / Эколого-продукционные особенности озер различных ландшафтов Южного Урала. Л.: Наука. С. 150–188.
Мухортова О.В., Романова Е.П. 2008. Весенний комплекс зоопланктона прудов Ботанического сада г. Самары // Известия Самарского научного центра РАН. Т. 10. № 2. С. 514–521.
Набережный А.И., 1984. Коловратки водоемов Молдавии. Кишинев: Штиинца. 328 с.
Опарина Н.Я., 1923. К фауне коловраток окрестностей г. Перми // Труды Биологического научно-исследовательского ин-та при Пермском государственном ун-те. Т. 1. Вып. 9–10. С. 165–175.
Османов М.М., Рабазанов Н.И., Бархалов Р.М., Амаева Ф.Ш., Алигаджиев М.М., Абдурахманова А.А., 2018. Динамика распределения зоопланктона в акватории острова Тюлений Каспийского моря // Юг России: экология, развитие. Т. 13. № 4. С. 57–67.
Речкалов В.В., Марушкина Е.В., 2005. Исследование видового состава и динамики зоопланктона озера Синеглазово // Вестник Челябинского гос. университета. Т. 12. № 1. С. 15–22.
Рогозин А.Г., 1995. Коловратки Челябинской области. Миасс: ИГЗ УрО РАН. 128 с.
Рогозин А.Г., 1998. Экология зоопланктона // Экология озера Тургояк. Миасс: ИГЗ УрО РАН. С. 84–113.
Рогозин А.Г., 2000. Зоопланктон // Экология озера Большое Миассово. Миасс: ИГЗ УрО РАН. С. 128–165.
Рогозин А.Г., 2004. Новые виды коловраток (Rotifera) в фауне водоемов восточной части Южного Урала и Южного Зауралья // Известия Челябинского научного центра. Вып. 3. С. 132–135.
Рогозин А.Г., 2006. Зоопланктон гипертрофного водоема на примере озера Табанкуль (Южный Урал): биологическое разнообразие и биология некоторых видов коловраток // Известия Челябинского научного центра. Вып. 3. С. 78–82.
Рогозин А.Г., 2007. О зоопланктоне водоемов западных предгорий Южного Урала (Миньярский пруд на реке Сим) // Известия Челябинского научного центра. Вып. 3. С. 75–79.
Рогозин А.Г., 2009. Зоопланктон озера Увильды // Известия Челябинского научного центра. Вып. 1. С. 62–67.
Рогозин А.Г., 2009а. Зоопланктон озера Малый Теренкуль // Известия Челябинского научного центра. Вып. 3. С. 28–33.
Рогозин А.Г., 2013. Зоопланктон Аргазинского водохранилища (Южный Урал) и его многолетние изменения // Биология внутренних вод. № 2. С. 25–33.
Рогозин А.Г., 2018. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Рода Anuraeopsis, Brachionus, Notholca // Зоологический журнал. Т. 97. № 7. С. 773–783.
Рогозин А.Г., 2019. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Род Keratella // Зоологический журнал. Т. 98. № 7. С. 732–748.
Рогозин А.Г., 2020. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Рода Kellicottia, Plationus, Platyias // Зоологический журнал. Т. 99. № 3. С. 243–252.
Таусон А.Г., 1934. Гидробиологический очерк озер верхней Камы // Труды Пермского биологического ин-та. Т. 6. Вып. 1–2. С. 103–118.
Таусон А.О., 1946. Зоопланктон р. Камы на участке с. Галево – р. Белая // Известия Естественно-научного ин-та при Молотовском гос. ун-те. Т. 12. Вып. 5. С. 155–167.
Таусон А.О., 1947. Планктон верхней Камы // Ученые записки Молотовского гос. ун-та. Т. 4. Вып. 2. С. 3–16.
Теоретические вопросы классификации озер, 1993. Под ред. Смирнова Н.П. СПб.: Наука. 185 с.
Уломский С.Н., 1964. Планктон озера Тургояк // Труды Уральского отделения ГосНИОРХ. Т. 6. С. 83–90.
Attayde J.L., Bozelli R.L., 1998. Assessing the indicator properties of zooplankton assemblages to disturbance gradients by canonical correspondence analysis // Canadian Journal of Fisheries and Aquatic Sciences. V. 55. № 8. P. 1789–1797.
Baloch W.A., Maeda H., Saisho T., 1998. Seasonal abundance and vertical distribution of zooplankton in Lake Ikeda, Southern Japan // Microbes and Environments. V. 13. № 1. P. 1–8.
Barrabin J.M., 2000. The rotifers of Spanish reservoirs: Ecological, systematical and zoogeographical remarks // Limnetica. V. 19. P. 91–167.
Bégin P.N., Vincent W.F., 2017. Permafrost thaw lakes and ponds as habitats for abundant rotifer populations // Arctic Science. V. 3. P. 354–377.
Bērziņš B., Pejler B., 1987. Rotifer occurrence in relation to pH // Hydrobiologia. V. 147. P. 107–116.
Bērziņš B., Pejler B., 1989. Rotifer occurrence in relation to temperature // Hydrobiologia. V. 175. P. 223–231.
Bielańska-Grajner I., Cudak A., 2014. Effects of salinity on species diversity of rotifers in anthropogenic water bodies // Polish Journal of Environmental Studies. V. 23. № 1. P. 27–34.
Bielańska-Grajner I., Gładysz A., 2010. Planktonic rotifers in mining lakes in the Silesian Upland: Relationship to environmental parameters // Limnologica. V. 40. Issue 1. P. 67–72.
Bozkurt A., Tepe Y., 2011. Zooplankton composition and water quality of Lake Gölbaşı (Hatay-Turkey) // Fresenius Environmental Bulletin. V. 20. P. 166–174.
Devetter M., 1998. Influence of environmental factors on the rotifer assemblage in an artificial lake // Hydrobiologia. V. 387. P. 171–178.
Diéguez M.C., Gilbert J.J., 2002. Suppression of the rotifer Polyarthra remata by the omnivorous copepod Tropocyclops extensus: predation or competition // Journal of Plankton Research. V. 24, Issue 4. P. 359–369.
Elliott J.I., 2006. Seasonal changes in abundance and distribution of planktonic rotifers in Grasniere (English Lake District) // Freshwater Biology. V. 7. № 2. P. 147–166.
Florescu L., Parpală L., Catană R., Moldoveanu M., 2016. Comparative assessment of micro- and mesozooplankton in different types of ecosystems in the Danube delta (Romania) // Romanian Journal of Biology–Zoology. V. 61. № 1–2. P. 61–73.
Gilbert J.J., 1985. Escape response of the rotifer Polyarthra: A high-speed cinematographic analysis // Oekologia. V. 66. P. 322–331.
Gilbert J.J., 1989. The effect of Daphnia interference on a natural rotifer and ciliate community: Short-term bottle experiments // Limnology and Oceanography. V. 34. № 3. P. 606−617.
Gilbert J.J., Williamson C.E., 1978. Predator-prey behavior and its effect on rotifer survival in associations of Mesocyclops edax, Asplanchna girodi, Polyarthra vulgaris, and Keratella cochlearis // Oekologia. V. 37. P. 13–22.
Guiset A., 1977. Stomach content in Asplanchna and Ploeosoma // Archiv für Hydrobiologie–Beiheft Ergebnisse der Limnologie. V. 8. P. 126–129.
Haberman J., 2000. Dominant zooplankton species in lake Peipsi // Proceedings of Estonian Academy of Sciences. Biology, Ecology. V. 49. P. 34−51.
Horpilla J., Härkönen L., Hellén N., Estlander S., Pekcan-Hekim Z., Ojala A., 2019. Rotifer communities under variable predation-turbulence combinations // Hydrobiologia. V. 828. P. 339–351.
Jersabek C.D., Bolortsetseg E., 2010. Mongolian rotifers (Rotifera, Monogononta) – a checklist with annotations on global distribution and autecology // Proceedings of the Academy of Natural Sciences of Philadelphia. V. 159. P. 119–168.
Koste W., 1978. Rotatoria. Die Radertiere Mitteleuropas, 2nd ed. V. 1. Berlin and Stuttgart: Gebruder Borntraeger. 673 p.
Kuczyńska-Kippen N., Klimaszyk P., Piotrowicz R., 2017. Zooplankton communities in three adjacent soft water lobelia lakes of slightly differentiated morphology and trophic state // Limnological Revue. V. 17. № 4. P. 207–214.
May L., 1983. Rotifer occurrence in relation to water temperature in Leven, Scotland // Hydrobiologia V. 104. P. 311–315.
Nogrady T., Segers H., 2002. Rotifera: Asplanchnidae, Gastropodidae, Lindiidae, Microcodidae, Synchaetidae, Trochosphaeridae. Leiden: Backhuis Publishers. 264 p.
Obertegger U., Flaim G., Fontaneto D., 2014. Cryptic diversity within the rotifer Polyarthra dolichoptera along an altitudinal gradient // Freshwater Biology. V. 59. Issue 11. P. 2413–2427.
Paturej E., Gutkowska A., 2015. The effect of salinity levels on the structure of zooplankton communities // Archives of Biological Sciences, Belgrade. V. 67. № 2. P. 483–492.
Pejler B., 1962. The zooplankton of Ösbysjön, Djursholm: II. Further ecological aspects // Oikos. V. 13. Issue 2. P. 216–231.
Plangklang N., Boonyanusith C., Athibai S., 2019. Species richness and abundance of monogonont rotifers in relation to environmental factors in the UNESCO Sakaerat Biosphere Reserve, Thailand // Journal of Threatened Taxa. V. 11. Issue 9. P. 14 087–14 100.
Pourriot R., 1977. Food and feeding habits of rotifera // Archiv für Hydrobiologie–Beiheft Ergebnisse der Limnologie. V. 8. P. 243–260.
Ruttner-Kolisko A., 1972. Rotatoria // Binnengewässer. V. 26. Issue 1. P. 99–234.
Schöll K., 2002. Seasonal changes in the Rotifera assemblages of a shallow lake in the Fertő-Hanság National Park, Hungary // Opuscula Zoologica, Budapest. V. 34. P. 85–94.
Shah J.A., Kumar Pandit A., Shah G.M., 2015. A research on rotifers of aquatic ecosystems of Kashmir Himalaya for documentation and authentication // The Proceedings of the National Academy of Sciences, India, Section B. Biological Sciences. V. 85. № 1. P. 13–19.
Sladeček V., 1983. Rotifers as indicators of water quality // Hydrobiologia. V. 100. P. 169–201.
Stenson J.A.E., 1983. Changes in the relative abundance of Polyarthra vulgaris and P. dolichoptera, following the elimination of fish // Hydrobiologia. V. 104. P. 269–273.
Tellioğlu A., Akman F., 2007. Seasonal variations in the species diversity of planktonic rotifers in the Pertek region of Keban Dam Lake, Turkey // Journal of Freshwater Ecology. V. 22. № 4. P. 609–615.
Virro T., 1995. The genus Polyarthra in Lake Peipsi // Hydrobiologia. V. 313/314. P. 351–357.
Virro T., Haberman J., 1993. The rotifers of Lake Peipus // Hydrobiologia. V. 255. P. 389–396.
Virro T., Haberman J., 2005. Annotated list of rotifers of Lake Võrtsjärv // Proceedings of the Estonian Academy of Sciences. Biology, Ecology. V. 54. № 1. P. 53–66.
Virro T., Haberman J., Haldna M., Blank K., 2009. Diversity and structure of the winter rotifer assemblage in a shallow eutrophic northern temperate Lake Võrtsjärv // Aquatic Ecology. V. 43. P. 755–764.
Wærvågen S.B., Andersen T., 2017. Seasonal quantitative dynamics and ecology of pelagic rotifers in an acidified boreal lake // Journal of Limnology. V. 77. № 1. https://doi.org/10.4081/jlimnol.2017.1685
Walz N., 1993. Life history strategies of rotifers / Plankton Regulation Dynamics: Experiments and Models in Rotifer Continuous Cultures. Ecological Studies. V. 98. Berlin, Heidelberg: Springer-Verlag. 308 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


