Зоологический журнал, 2022, T. 101, № 9, стр. 1015-1031
Пространственная структура гнездовых поселений длиннохвостого (Stercorarius longicaudus) и среднего (Stercorarius pomarinus) поморников (Charadriiformes, Stercorariidae) в тундрах Таймыра
С. П. Харитонов *
Институт проблем экологии и эволюции имени А.Н. Северцова РАН
117312 Москва, Россия
* E-mail: serpkh@gmail.com
Поступила в редакцию 09.11.2021
После доработки 19.01.2022
Принята к публикации 20.01.2022
- EDN: MIRPDE
- DOI: 10.31857/S0044513422090069
Аннотация
Материал по гнездованию и территориальному поведению двух видов поморников, характерных для тундр северо-западного Таймыра, собран в 1996−2020 гг., с перерывами, в окрестностях бухты Медуза (73°21′ с.ш., 80°32′ в.д.), северо-запад п-ова Таймыр. Пространственное распределение гнезд или центров гнездовых территорий обоих видов поморников за более чем 20-летний период оказалось групповым (конгрегационным). Это означает, что поморники, особенно длиннохвостые, в пространственной структуре своих популяций имеют значительное количество постоянных мест гнездования – территориальных ячеек. Многократно используемые ячейки у средних поморников имеют более выраженные биотопические особенности, нежели у длиннохвостых. Для последних биотоп гнездования, видимо, не имеет решающего значения. Причина тяготения птиц к одним и тем же участкам тундры, на вид ничем не отличающихся от других мест, не ясна. Попытка привлечь теорию “сигнального поля” для объяснения этого явления успехом не увенчалась. При условном разбиении пространства на территориальные ячейки и выборе определенных мест для отправления жизненных функций птицы ориентируются на еще неизвестные нам существенные факторы среды, нежели чисто экологические факторы и следы предыдущей активности животных. Для длиннохвостых поморников отмечена тенденция чаще гнездиться в таких территориальных ячейках, где присутствие человека более заметно. Для средних поморников подобное не отмечалось, они, как сильные птицы, хорошо противостоят песцу и в дополнительном факторе защиты, каковым может быть присутствие человека, видимо, не нуждаются.
Три вида поморников – средний (Stercorarius pomarinus), длиннохвостый (S. longicaudus) и короткохвостый (S. parasiticus) – типичные тундровые виды, имеющие циркумполярное распространение (Чернов, 1980). В прибрежных арктических тундрах северо-западного Таймыра гнездятся первые два вида, короткохвостый поморник здесь появляется как редкий залетный вид (Харитонов, 2015; Головнюк и др., 2018). Средний поморник, будучи миофагом, гнездится массово в годы высокой численности леммингов (Литвин, Овсяников, 1990; Сыроечковский, 2013; Kharitonov et al., 2017). Сам факт гнездования средних поморников, а также плотность гнездования этих птиц – хорошие индикаторы высокой численности леммингов (Харитонов и др., 2008). У длиннохвостого поморника более широкий спектр питания: он в значительной степени энтомофаг, а также нередко в его рационе присутствует и растительная пища (Чернов, 1980). Тем не менее в сезоны с обилием леммингов эти грызуны также становятся кормовым объектом этого поморника (Seyer et al., 2020; собственные наблюдения, рис. 1). В отличие от средних, длиннохвостые поморники гнездятся почти каждый год, однако в годы высокой численности леммингов численность гнездящихся поморников увеличивается. Оба вида хорошо защищают свое гнездо от песца, хотя в годы малой численности леммингов, когда пресс хищничества песцов на гнездящихся птиц тундры резко увеличивается, длиннохвостые поморники не всегда способны противостоять песцу, и разорение их гнезд в такие годы возрастает (Khomenko et al., 1999; наши наблюдения). Кроме того, длиннохвостые поморники, так же как и гусеобразные птицы (Kharitonov et al., 2017), скорее всего, способны оценивать численность песцов и леммингов в конкретный сезон, и временами вовсе не приступают к гнездованию.
В период наших исследований длиннохвостые поморники размножались почти каждый год, за редким исключением (в 2000 г. не отмечено ни одного гнезда). Для гнездования они выбирают средние и нижние части тундровых склонов, травянистые долины, плоскобугристые болота (Головнюк и др., 2018). Средние поморники откровенно тяготеют к низинным и сырым местам, хотя биотопы гнездования обоих видов значительно перекрываются.
По мере того, как материал по длиннохвостым поморникам стал накапливаться, даже “на глаз” стала заметна следующая закономерность: гнезда этих птиц в разные годы обнаруживались примерно в одних и тех же местах, даже если при этом были пропуски сезонов гнездования. На вид эти места ничем не отличались от многих других в округе, тем не менее поморники почему-то гнездились именно здесь, игнорируя остальные возможности. Гнезда обоих видов поморников – это лунки без выстилки, после гнездового сезона конкретное место гнездования абсолютно незаметно. Следов прошедшего гнездования в тундре не остается. Поэтому не получается приписать стремление поморников к одним и тем же местам ориентацией на следы прошлого гнездования, как это рассматривается в теории сигнального поля (Наумов, 1977). Как и в случае с длиннохвостым поморником, хотелось бы проверить повторяемость конкретных мест гнездования и у среднего поморника.
Поскольку в нашем распоряжении имеется многолетний материал по одной и той же местности, то есть возможность изучить повторяемость использования одних и тех же гнездовых мест у двух видов поморников. Кроме особенностей пространственной структуры поселений поморников в каждый конкретный год, в данном сообщении рассмотрены динамика этой структуры в череде сезонов и возможные связи (или отсутствие таковых) с экологическими условиями конкретных гнездовых мест. В литературе этот вопрос до настоящего времени практически не рассматривался.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в 2000−2007, 2012, 2014-2020 гг. в рамках многолетнего мониторинга арктических тундр в окрестностях бухты Медуза (73°21′ с.ш., 80°32′ в.д.) Диксонского р-на Таймырского Долгано-ненецкого муниципального района (Харитонов, 2015). Кроме того, использованы опубликованные данные исследований в этом районе в сезоны 1996–1999 и 2015–2017 гг. (Tulp et al., 1997; Khomenko et al., 1999; Willems et al., 2002; Головнюк и др., 2018), а также сведения о местоположении гнезд, найденных участниками совместных экспедиций в данный район Таймыра в 2000–2007 и 2016 гг. Использованы и опубликованные сведения по дополнительному исследованию 2002 г., проводившемуся в нижнем течении р. Убойная (73°37′ с.ш., 82°10′ в.д.), северо-западный Таймыр (Klaassen, Cottaar, 2002). Наблюдения проводили с начала июня до конца июля каждого сезона.
Координаты найденных гнезд определяли при помощи GPS−навигаторов: Garmin-12 и Garmin-72. Точность измерения в данном районе достигала 1.85 м по широте и 1.08 м по долготе (Харитонов и др., 2011). В некоторых случаях, если гнездо не удавалось найти или оно на территории поморника отсутствовало, по поведению птиц мы довольно точно могли определить центр территории, который затем использовали в вычислениях как возможную точку гнездования. Плотность гнездования поморников вычисляли, используя расстояния между ближайшими соседями; подробно способ изложен в публикации Харитонова (2007).
Численность леммингов оценивали в баллах от 1 до 5, при этом применяли еще и промежуточные, половинные баллы (методика описана в публикации Харитонова с соавторами (2008)). Численность леммингов считалась высокой в годы, когда балл был не менее 3. В основном именно в эти сезоны гнездились белые совы. Особый случай гнездования сов при малой численности леммингов в 2016 г., видимо, вызван экспериментально выставленными нами макетами белых сов (Харитонов, 2019). С оценкой влияния песцов на птиц тундры дело обстоит сложнее. В годы высокой численности леммингов численность песцов обычно высока, однако песцы могут как сильно, так и слабо влиять на птичье население. В последнем случае – когда большинство песцов в исследуемом районе переключается на добычу леммингов, что происходит, если бродячие песцы малочисленны или отсутствуют вовсе, а есть исключительно размножающиеся пары песцов. Переключение на добычу преимущественно или исключительно леммингов происходит по довольно простой причине: охотящемуся самцу необходимо все время носить добычу в нору самке и щенкам, при этом леммингов во рту он может принести целую “гроздь”, тогда как более одного яйца песец нести не может. Практически полное игнорирование птичьих гнезд у песцов происходит при относительно невысокой численности леммингов, когда добывать их нелегко, и самец на поиски грызунов тратит практически все свое охотничье время. Интересно, что птицы эту ситуацию способны распознать в самом начале сезона, и даже такие беззащитные перед песцом виды как черные (Branta bernicla) и краснозобые (B. ruficollus) казарки гнездятся просто в тундре без опаски и без защиты хищников-покровителей. Поэтому для оценки численности и воздействия песцов на птиц тундры мы предлагаем не один (численность) показатель, а два показателя: первый – балл численности песца по 5-балльной системе, аналогичной таковой для характеристики численности леммингов (1 – “очень мало” до 5 – “очень много”); второй – оценка влияния песцов на гнездящихся птиц любых видов: “слабое” и “сильное”. Оценить влияние песцов труднее, чем численность, этот показатель в какой-то мере интуитивен и основан на уровне разорения гнезд всех видов. Для данного района тундры нами всегда оценивалась успешность размножения большинства видов тундровых птиц, что отражено в доступных наших отчетах на сайте “Птицы Арктики” (www.arcticbirds.ru).
Поиск человеком гнезд длиннохвостых поморников трудностей не представляет: эти птицы довольно скоро садятся на гнезда, если отойти от него на 50–100 м. Напротив, найти гнездо среднего поморника очень трудно. Эти птицы сходят с гнезда задолго до того, когда человек подойдет к нему. Птицы обычно сразу же начинают отвлекающие демонстрации и демонстрации “ложных гнезд”, надолго присаживаясь в разных местах тундры. Поиск реальных гнезд очень затратен по времени, и, в отличие от гнезд длиннохвостых поморников, обычно не удается найти все гнезда в исследуемом районе.
Все гнезда или центры гнездовых территорий поморников обоих видов в дальнейшем наносили на оцифрованные карты района исследований в программе MapInfo. Математические характеристики пространственного распределения (плотность гнездования и тип распределения гнезд и центров территорий) получены при помощи компьютерной программы “Карта колонии” (“Colonmap”) (Харитонов, 1999). Методика подробно описана нами ранее (Харитонов, 2007).
При статистической обработке для сравнения средних вместо общепринятых критериев Стьюдента и Маннa–Уитни мы использовали критерий Бейли (Плохинский, 1978). Большое достоинство этого критерия в том, что он годится для любых типов распределений, а не только для нормального распределения, и обладает большей статистической мощностью, чем критерий Маннa–Уитни, поскольку последний является непараметрическим (ранговым), а критерий Бейли – параметрический. Критерий Бейли обладает той же статистической мощностью, что и критерий Стьюдента, но не содержит требования обязательного нормального распределения данных.
Для выяснения, насколько часто птицы используют одни и те же гнездовые участки повторно, необходима уверенность, что выбранный район тундры достаточно полно обследовался каждый год работы. Понятно, что не вся область мониторинга, которая обычно составляла 130 км2, а в отдельные годы доходила до 340 км2 (Харитонов, 2015), могла быть одинаково тщательно обследована. Наиболее полно обследованной мы рассматриваем область около 26 км2 в ближайших окрестностях базы экспедиции – Станции им. Виллема Баренца. По положению эти наиболее полно обследованные области для длиннохвостых и средних поморников несколько различались, но по площади были примерно одинаковы. В данном сообщении использованы данные только по району, который можно было считать надежно и полностью обследованным. Здесь удалось найти практически все гнезда длиннохвостых поморников. Для средних поморников такой уверенности нет, однако тоже найдено довольно много гнезд, что все же позволило нам представить характер повторного использования гнездовых участков и у этого поморника. Для основных построений использованы данные по 81 гнезду и четырем территориям с хорошо видимым центром активности у длиннохвостых поморников и 107 гнездам и двум территориям средних поморников.
РЕЗУЛЬТАТЫ
Фенология гнездования. Первое яйцо появляется у длиннохвостых поморников во второй половине июня. Время начала гнездования по сезонам колеблется незначительно (рис. 2), пределы: 16 июня в 2016 г. и 27 июня в 2002 и 2014 гг. В более ранние и теплые сезоны откладка яиц может начаться на 1–2 дня раньше, чем в среднем, в поздние и холодные сезоны – немного позже. Однако следует отметить условность понятия “ранний” и “поздний”. Сезон может быть очень ранним по началу наступления теплых дней, и для каких-то птиц он и окажется ранним. Однако потом холод может вернуться, и для других видов он может оказаться поздним. Пример – сезон 2020 г., когда снег начал таять в середине мая, но холода вернулись, и длиннохвостые поморники загнездились в поздние сроки, как в холодный годы. Средние поморники, если гнездились, то начинали откладку яиц 18–25 июня. Чаще они начинали гнездиться раньше длиннохвостых поморников, хотя в отдельные сезоны (2016) это могло быть наоборот (рис. 2).
Рис. 2.
Изменение колебания средних минимальных (квадраты, светло-фиолетовая линия) и средних максимальных (ромбы, синяя линия) температур в течение периода работ (2000–2020 гг. с пропусками сезонов); сроки откладки первого яйца в сезоне для длиннохвостых (зеленые треугольники, зеленая линия) и средних (бурые треугольники, бурые линии) поморников; сроки начала течения воды на р. Медуза – основной реки в районе работ (фиолетовые круги, фиолетовая линия). Для 1996 г. данные взяты из Tulp et al., 1997. Ось ординат вмещает в себя три шкалы: для минимальных и максимальных температур –°С. Для сроков размножения обоих видов поморников – это число дней от первого июня до откладки первого яйца. Для даты начала течения воды р. Медуза после зимы – это число дней от первого мая до начала движения воды по реке. Линии тренда для р. Медуза и дат гнездования поморников – штриховые, обозначены тем же цветом, что и основные линии соответствующих графиков. Приведены корреляционные отношения, в случае со сроками течения р. Медузы тренд достоверен (приведена достоверность), поэтому приведено и уравнение линии тренда. Для максимальных и минимальных температур линии тренда черные сплошные. Для минимальных температур тренд близок к достоверному (достоверность приведена).
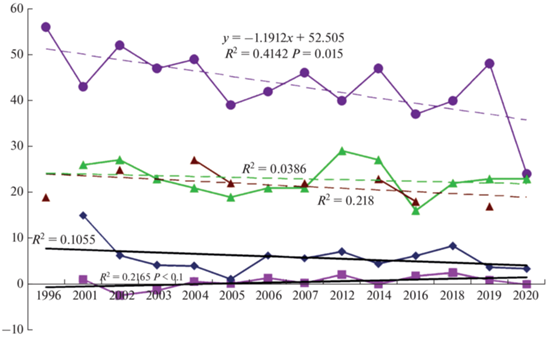
Результаты анализа динамики сроков гнездования обоих видов поморников в зависимости от современной ситуации с изменением климата представлены на рис. 2, где для удобства восприятия на одной оси ординат помещены три шкалы и визуально “разнесены” сравниваемые величины. Большинство тенденций недостоверны, однако, поскольку тенденций несколько и они часто однотипные, решено их рассмотреть подробнее. Единственная довольно четкая достоверная тенденция обнаружена в сроках начала движения воды в р. Медуза (рис. 2). Даже если убрать из рассмотрения необычно ранний 2020 г., то все равно корреляция между сроками начала движения р. Медуза и календарным годом остается весьма близкой к достоверной (r = –0.53, N = 13, P = = 0.06). По ходу сезонов сильнее менялась средняя минимальная температура первой половины июня, нежели средняя максимальная. При этом средняя минимальная повышалась, хотя здесь зависимость от сезона достоверна на низшем уровне достоверности (рис. 2), а средняя максимальная демонстрировала, наоборот, слабую и недостоверную тенденцию – к уменьшению температурных значений (рис. 2). Для обоих видов поморников заметна тенденция к более ранним срокам гнездования год от года в течение периода исследований. У длиннохвостых поморников эта тенденция выражена слабее, у средних сильнее. Тем не менее обе тенденции недостоверны, возможно, из-за относительно небольшого количества материала.
Распределение гнезд длиннохвостых поморников в пределах сезона и между сезонами. Во время сезонов с небольшой численностью леммингов длиннохвостые поморники при даже небольшой численности – от 7 гнезд на площадь нашего участка рассмотрения – довольно быстро насыщают тундру. (Равномерное распределение означает экологическое насыщение территории данным видом (Харитонов, 2007)). Однако в сезоны с высокой численностью леммингов в той же области может гнездиться ощутимо больше поморников этого вида, и тогда даже при 12 гнездящихся парах насыщение территории не наступает. При этом длиннохвостые поморники могут гнездиться на значительно меньшем расстоянии друг от друга, чем в сезоны с малой численностью леммингов (табл. 1). Хотя, судя по тому что коэффициент Кларка Эванса R (Clark, Evans, 1954) всегда больше единицы (табл. 1), гнездящиеся пары длиннохвостых поморников обычно антагонистичны друг другу, и в пределах каждого отдельного сезона они гнездовые ассоциации между собой не образуют. Эта закономерность наблюдается, даже если рассматривать не гнезда и территории, а просто точки встреч длиннохвостых поморников в тундре. Такое исследование было выполнено в 2001 г., когда отмечено на карте 53 точки встреч длиннохвостых поморников в тундре, распределение которых было случайным (коэффициент Кларка-Эванса близок к единице): R = 0.98, P = 0.73.
Таблица 1.
Характеристики пространственного распределения гнезд длиннохвостых поморников в области исследования в разные сезоны
| Сезон | Число гнезд | Среднее расстояние до ближайшего соседа, м | Минимальное расстояние до ближайшего соседа, м | Тип распределения, коэффициент Кларка-Эванса (R) и достоверность | Балл численности леммингов |
|---|---|---|---|---|---|
| 1996 | 3 | 1520 ± 278 | 1242 | – | 5 |
| 1997 | 4 | 1611 ± 390 | 943 | – | 2 |
| 1998 | 2 | 2630 | 2630 | – | 1 |
| 1999 | 5 | 925 ± 248 | 444 | – | 4 |
| 2001 | 6 | 2206 ± 333 | 1286 | – | 1 |
| 2002 | 7 | 1372 ± 163 | 796 | Равномерное R = 1.5, P = 0.04 |
3 |
| 2004 | 9 | 1531 ± 154 | 993 | Равномерное R = 1.43, P = 0.04 |
3.5 |
| 2005 | 12 | 1112 ± 200 | 319 | Случайное R = 1.17, P = 0.28 |
5 |
| 2006 | 3 | 1646 ± 483 | 1163 | – | 1 |
| 2014 | 4 | 1472 ± 520 | 635 | – | 5 |
| 2016 | 13 | 1311 ± 134 | 768 | Равномерное R = 1.54, P = 0.003 |
2.5 |
| 2018 | 5 | 1188 ± 242 | 690 | – | 2 |
| 2019 | 3 гнезда + + 3 территории | 1657 ± 241 | 1194 | Случайное R = 1.35, P = 0.16 |
3 |
| 2020 | 2 | 1248 | 1248 | – | 1 |
Если нанести на карту все рассматриваемые нами 85 точек гнездования (гнезд или центров территорий) длиннохвостых поморников во все сезоны наблюдений в пределах рассматриваемой области около 26 км2, то распределение точек гнездования окажется достоверно групповым (R = = 0.78, P = 0.0002). Это означает, что длиннохвостые поморники демонстрируют тенденцию из года в год гнездиться примерно в одних и тех же местах. Эта особенность сохраняется даже при более строгом тестировании: групповое распределение сохраняется в группе близко расположенных точек, даже если в качестве площади мы берем минимальный описанный многоугольник (Convex Hull), который на рис. 3 изображен зеленым цветом (N = 57, R = 0.79, P = 0.003). Используя различные ключевые расстояния, можно выделить группы точек гнездования. Логично использовать в качестве такого ключевого расстояния среднее расстояние до ближайшего соседа для всей выборки гнезд за рассматриваемый период лет. Для длиннохвостого поморника в исследуемой области оно было равно 195.56 м. Если между соседними точками гнездования расстояние не превышает эту величину, то данные точки гнездования рассматриваются как принадлежащие к одной группе. В нашем случае получилось 48 групп, от 1 до 12 (выделено эллипсом на рис. 3) точек в каждой, в среднем, 1.81 точек в группе. Среднее минимальное расстояние между центрами таких групп составило 380.5 ± 19.8 м. Именно с этого ключевого расстояния и начинает проявляться достоверно равномерное распределение между центрами таких групп (рис. 4). При увеличении ключевого расстояния для выделения групп число групп становится меньше, но равномерное распределение между центрами любых групп остается (рис. 4).
Рис. 3.
Карта-схема размещения точек гнездования и территориальных ячеек длиннохвостых поморников. Фиолетовые точки – точки гнездования; бирюзовые звездочки – центры территориальных ячеек; красные кружки с номерами – центры ячеек, где зафиксировано неоднократное гнездование; синие кружки – центры зон гнездования; область, обведенная зеленой линией, и область, обведенная коричневой линией, – это минимальные описанные многоугольники (Convex Hulls) определенных групп точек гнездования; эллипс обводит самую большую группу точек гнездования; заштрихованная область – мониторинговая площадка в 4 км2; область, обведенная фиолетовой линией, – мониторинговая площадка в 8 км2; домик – Станция им. Виллема Баренца.

Рис. 4.
Величина R (Коэффициент Кларка-Эванса) в зависимости от среднего размера группы точек гнездования (сплошная черная линия графика) у длиннохвостых поморников. Ось абсцисс – средний размер группы точек гнездования, ось ординат – величина коэффициента R. Область, ограниченная сверху и снизу черной штриховой линией, – это область значений R, при которых распределение точек гнездования не отличается от случайного при пороге достоверности P = 0.1. Область, ограниченная сверху и снизу серой сплошной линией, – это область значений R, при которых распределение точек гнездования не отличается от случайного при пороге достоверности P = 0.05.

Вернемся к первоначальным группам со средним размером 1.81 гнезда в группе. Особенностью этих групп является то, что в один момент времени в течение сезона в такой группе могло находиться только одно гнездо. Некоторое исключение, очевидно подтверждающее правило, составила группа из 12 гнезд. В 2016 и 2017 гг. здесь наблюдалось по два гнезда длиннохвостого поморника, но не одновременно. В обоих случаях первое гнездо было разорено, через некоторое время появлялось другое. Хотя птицы были не меченые, подобный ход событий позволяет предполагать повторное гнездование той же пары в случае разорения первого гнезда. В 2016 г. расстояние между такими гнездами составило 25 м, в 2017 г. – 189 м, т.е. меньше выбранного нами ключевого расстояния для выделения групп.
Если же постепенно увеличивать ключевое расстояние для выделения групп, то равномерное распределение таких групп остается (рис. 4). “Равномерность” достигает пика в R = 1.98 при ключевом расстоянии в 601.38 м, средний размер группы при этом равен 7 (от 1 до 34 точек гнездования в группе). Таким образом, соседние малые группы явно условно объединяются в “зоны гнездования” длиннохвостых поморников. В нашем районе видно 12 таких зон (рис. 3). Если в одной и той же малой группе не может быть двух гнезд одновременно в тот же сезон, то в одной зоне гнездования может быть несколько гнезд в один и тот же год.
Распределение гнезд средних поморников в пределах сезона и между сезонами. В годы, когда средние поморники гнездятся или образуют охраняемые территории, они обычно делают это со значительно более высокой плотностью, чем длиннохвостые поморники (табл. 1 и 2). При массовом гнездовании средних поморников их территории или гнезда практически всегда демонстрируют равномерное распределение (табл. 2). Однако негнездящиеся особи средних поморников, в отличие от таких же особей длиннохвостых, чаще образуют группы, которые перемещаются по тундре. Наблюдения 2001 г., когда была отмечена 71 встреча средних поморников, распределение этих точек встреч было групповым (коэффициент Кларка-Эванса достоверно меньше единицы): R = 0.85, P = 0.015. Следовательно, эти птицы, в отличие от длиннохвостых поморников, склонны к стайности, подобное отмечено и М.С. Стишовым (устное сообщение) на о-ве Врангеля.
Таблица 2.
Характеристики пространственного распределения гнезд и территорий средних поморников в области исследования в разные сезоны
| Сезон | Число гнезд | Среднее расстояние до ближайшего соседа, м | Минимальное расстояние до ближайшего соседа, м | Тип распределения, коэффициент Кларка-Эванса (R) и достоверность | Балл численности леммингов |
|---|---|---|---|---|---|
| 1996 | 4 | 1221 ± 305 | 818 | – | 5 |
| 1997 | 2 | 1235 | 1235 | – | 2 |
| 1999 | 12 гнезд и 44 территории | 304 ± 12 | 121 | Равномерное R = 1.29, P < 0.001 |
4 |
| 2002 | 45 территорий | 304 ± 8 | 226 | Равномерное R = 1.54, P < 0.002 |
3 |
| 2002 р. Убойная |
18 | 450 ± 29 | 239 | Равномерное R = 1.38, P = 0.007 |
3 |
| 2004 | 17 | 660 ± 65 | 406 | Равномерное R = 1.27, P = 0.047 |
3.5 |
| 2005 | 36 | 468 ± 22 | 184 | Равномерное R = 1.36, P < 0.001 |
5 |
| 2007 | 19 территорий | 445 ± 44 | 250 | Равномерное R = 1.37, P = 0.006 |
3.5 |
| 2014 | 34 территории | 358 ± 20 | 234 | Равномерное R = 1.38, P < 0.001 |
5 |
| 2016 | 25 | 620 ± 55 | 280 | Равномерное R = 1.24, P = 0.033 |
2.5 |
| 2019 | 4 гнезда и 2 территории | 1318 ± 100 | 1080 | Случайное R = 1.46, P = 0.08 (По P < 0.1-равномерное) |
3 |
Для большей точности анализа распределения точек гнездования были исключены данные по 1996–1999 гг., так как в эти годы не всегда показано, где именно располагаются территории, а где – гнезда. Неожиданно, анализ пространственного распределения многолетнего поселения средних поморников тоже показал достоверно групповое распределение (R = 0.86, N = 109, P = 0.005), хотя показатель распределения здесь ближе к случайному, чем у длиннохвостого поморника (рис. 5). Это означает, что средние поморники тоже имеют тенденцию из года в год гнездиться примерно в одних и тех же местах, хотя эта тенденция у них выражена значительно слабее, чем у длиннохвостых поморников.
Рис. 5.
Карта-схема размещения точек гнездования и территориальных ячеек длиннохвостых поморников. Фиолетовые точки – точки гнездования; бирюзовые звездочки – центры территориальных ячеек; красные кружки – центры ячеек, где зафиксировано неоднократное гнездование; домик – Станция им. Виллема Баренца.

Для выделения групп точек гнездования у среднего поморника среднее минимальное расстояние между точками (179.74 м) оказалось слишком велико: средний поморник гнездится плотнее длиннохвостого, и если рассматривать такие группы, то они могут включать два гнезда разных пар в один сезон, что искажает результаты анализа. Дело в том, что повторных кладок в один и тот же сезон у среднего поморника мы не отмечали ни разу. Если следовать той же логике, что и для длиннохвостых поморников, т.е. взять такое расстояние, при котором распределение выделенных групп точек гнездования становится достоверно равномерным (рис. 6), то это расстояние составит 103.17 м. Средний размер группы при таком расстоянии равен 1.3 гнездовые точки (1–4 точки в группе); таких групп можно выделить 84, среднее минимальное расстояние между центрами этих групп равно 279.2 ± 15.0 м. В этом случае уже нет попадания двух гнезд в одну группу в один сезон.
Рис. 6.
Величина R (Коэффициент Кларка-Эванса) в зависимости от среднего размера группы точек гнездования (сплошная черная линия графика) у средних поморников. Обозначения те же, что и на рис. 4.
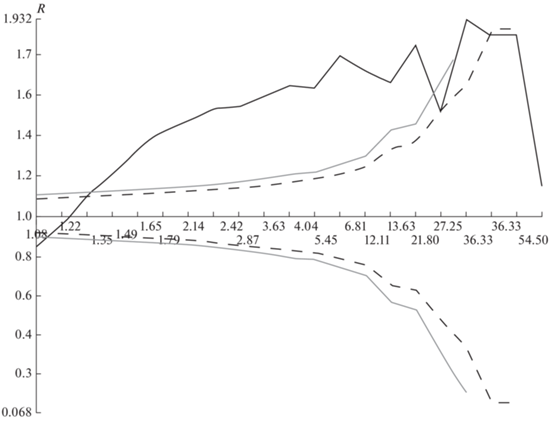
У среднего поморника не отмечается агрегации групп гнезд в зоны гнездования, как это имеет место у длиннохвостого (рис. 5). Такие зоны не обнаруживаются и математически, так как при средних размерах группы 1.3 гнездовые точки и, например, 2.57 точек, большинство групп состоит из одиночных гнезд, а при среднем размере группы в 25 гнезд (это когда распределение групп все еще достоверно равномерное, при большем размере оно случайное – см. рис. 6) мы имеем всего 4 группы, где самая большая включает в себя почти все точки гнездования – 91 из 109 рассматриваемых.
ОБСУЖДЕНИЕ
Фенология гнездования. Собранные за более чем 20-летний период данные показали незначительное влияние современных климатических изменений на сроки гнездования обоих видов поморников. При этом у длиннохвостого поморника тенденция столь слаба, что о ней пока еще рано серьезно говорить. На среднего поморника климатические изменения, видимо, влияют сильнее. Возможно, что не только более теплая погода первой половины июня может подтолкнуть поморников гнездиться раньше, как это хорошо видно при переходе от 2014 к 2016 гг. (рис. 2), но и очень высокая численность леммингов в начале сезона тоже может стимулировать поморников, причем обоих видов, гнездиться раньше. Это касается переходов от 2012 к 2014 гг.: 2014 г. был значительно холоднее 2012, но численность лемминга была высокой. А в 2005 г. наблюдался т.н. суперпик численности леммингов (Харитонов и др., 2008), который бывает один раз в 11 лет, и в 2005 г. несмотря на ощутимо более холодный июнь, оба вида поморников загнездились раньше, чем в 2004 (рис. 2).
Постоянные места многолетнего гнездования – т.н. “территориальные ячейки”. Конгрегационное (групповое) распределение точек гнездования суммарно за все годы работ свидетельствует о том, что поморники, особенно длиннохвостый, в пространственной структуре своих популяций имеют значительное количество постоянных мест гнездования. Биотопы этих мест явно разные: и довольно сухая тундра, склоны холмов, и болотистая тундра. Эта особенность отмечена нами ранее у ряда других птиц тундры: у белых сов, зимняков и сапсанов (Харитонов, 2019; Харитонов и др., 2005), для хищных птиц подобное явление вообще характерно (Галушин, 1982). В пространственной структуре популяций обоих видов поморников есть постоянные территориальные ячейки (а у длиннохвостых поморников, видимо, и пространственная структура популяции состоит практически из таких ячеек), где в каждый конкретный год либо могут быть, либо могут не быть гнезда данных видов. Территориальная ячейка – это занимаемый на протяжении ряда лет участок местности, на котором в какие-то сезоны (не обязательно каждый год подряд) пара птиц образует гнездовую территорию. При этом гнездо в такой ячейке может находиться как в одном месте, так и в разных; в какие-то годы птицы могут занимать территорию, но не гнездиться. Постоянство территориальных ячеек состоит в том, что на протяжении ряда лет птицы занимают территорию на одном и том же месте. Поселение птиц может быть рассмотрено как совокупность таких ячеек, или модулей. Ячейки существуют много лет и не меняют своего положения резко. Прилетающие птицы лишь “заполняют” некие территориальные модули. Численность и плотность гнездящихся или территориальных пар может меняться от сезона к сезону, но общее число вместилищ территорий в данной местности год от года постоянно.
Хотя из 48 ячеек длиннохвостых поморников неоднократное гнездование обнаружено лишь в 13, в действительности таких многократно используемых ячеек значительно больше, так как нередко отмечалось, что пары длиннохвостых поморников прилетают именно на место прошлогоднего гнездования и держатся там длительное время, иногда весь сезон, не приступая к гнездованию. То есть все равно птицы тяготеют к определенным районам тундры. К сожалению, мы обратили внимание на это явление (появляются в начале сезона на прошлогодней территории и затем ее оставляют) довольно поздно, поэтому не можем здесь дать достаточно полную оценку этого явления. Во всяком случае и 2019 г. в пределах рассматриваемого района пары длиннохвостых поморников долго держались в трех из пяти конкретных мест тундры, где в 2018 г. были гнезда, а в 2020 г. – в четырех из пяти мест, где в 2019 г. были гнезда или территории без гнезд. При этом во все эти три года подряд гнезда или территории без гнезд отмечали в трех точках из тех же пяти.
При гнездовании в одной и той же территориальной ячейке длиннохвостые поморники практически никогда не гнездятся именно в той же самой точке, что и в прошлый раз (не важно, в прошлом году или ранее). Из 96 повторных гнездований в разных ячейках один раз нами зафиксировано нулевое расстояние и один раз – расстояние 2 м, все остальные расстояния между гнездами, отмеченные в разные сезоны, были гораздо больше. Возможно, это тоже было гнездование в одном и том же месте, хотя уровень точности GPS навигаторов не позволяет сделать четкое заключение. Среднее расстояние переселений у длиннохвостых поморников за весь период исследований составило 217.7 ± 15.2 м, N = 96. Логично – чем больше гнездований в одной и той же ячейке, тем больше имеющийся там разброс расстояний между местами последовательных гнездований, коэффициент корреляции Пирсона r = 0.71, N = 13, P = 0.007, непараметрический коэффициент корреляции Спирмена даже выше r = = 0.77 при том же уровне достоверности.
Однако гораздо важнее узнать, как меняется расстояние в зависимости от числа лет, прошедших после предыдущего гнездования в той же ячейке. Логично ожидать, что чем больше лет прошло, тем дальше от первоначального места птицы должны гнездиться. Оказалось, вовсе не так: расстояние от точки предыдущего гнездования до точки текущего гнездования никак не связано с числом лет, прошедших между этими событиями: коэффициент корреляции (Пирсона) исчезающе мал: r = 0.06, N = 96, P = 0.59. При рассмотрении конкретных ячеек эта закономерность проявляется в том же виде. В ячейках номер 1 и 2, где отмечено больше всего гнездований (рис. 3), коэффициенты корреляции составляют 0.049 и ‒0.011 соответственно, и весьма далеки от достоверности.
Хотя у средних поморников повторное гнездование отмечено всего в 19 из 84 рассматриваемых ячеек, на самом деле это явление сильно недооценено, причем даже сильнее, чем у длиннохвостого поморника. Случаев гнездования в одних и тех же ячейках у средних поморников куда больше, чем удалось зафиксировать, потому что гнезда этого вида, в отличие от гнезд длиннохвостого поморника, найти довольно трудно, и это специальная работа, на которую чаще всего не хватает времени.
Обнаружилось, что если средние поморники гнездятся в ячейке, где когда-то ранее было гнездо, то, вне зависимости от числа лет между этими событиями, гнездятся значительно ближе к месту предыдущего гнездования, чем это отмечено у длиннохвостых поморников. Среднее расстояние от прежнего до текущего места гнездования в ячейке равно 66.4 ± 5.8 м, N = 33, максимально – 132 м.
Если поморники обоих видов повторно гнездятся в одних и тех же территориальных ячейках, пусть и не обязательно ежегодно, то возникает вопрос: не те ли это самые птицы, что гнездились в прошлый раз? Для выяснения этой ситуации в 2017 г. В. Головнюком четыре гнездящиеся птицы из разных пар были помечены цветными кольцами. На следующий год, в 2018 г., ни одна из них не была обнаружена ни в тех же местах, ни в каких-либо других. Однако в 2018 г. отмечено повторное гнездование каких-то пар в двух ячейках из четырех, где в прошлом году происходило мечение. Поскольку в двух ячейках точно в тех же местах поморники загнездились, но это были уже другие птицы без колец, то это говорит о привлекательности именно территориальных ячеек (буквально точек на пространстве тундры), неважно для каких птиц.
Литературные сведения на эту темы скудны и выводы сомнительны. В книге Винокурова и Кищинского (1976) сказано, что “на Таймыре” (ни место, ни сезон не указаны, ссылки на другую статью нет) помеченные крылометками длиннохвостые поморники наблюдались “десятки раз, некоторые встречены и через 2 года”. Где помечены, там ли встречены, в какой год – не ясно.
На о-ве Врангеля отмечен случай гнездования несколько лет подряд одного и того же окольцованного длиннохвостого поморника около балка с учеными (К.Е. Литвин, устное сообщение). Однако здесь не совсем чистый эксперимент – поморник явно имел пристрастие по каким-то причинам гнездиться около балка с людьми. Подобное явление известно, когда более слабые особи льнут к местам активности человека, как, например, нами отмечено в колонии белых гусей (Харитонов, 1988) или в колонии тихоокеанских черных казарок (Branta bernicla nigricans) в 1993 г. в дельте Юкона, Аляска, где потерявшая самца самка казарки не могла отвоевать место для гнездования среди других казарок и загнездилась возле наблюдательной вышки, куда другие казарки боялись подходить (наши наблюдения).
Наблюдения показывают, что постоянными в тундре являются именно определенные места, куда в разные годы прилетают в основном разные птицы, тем не менее они выбирают одни и те же места гнездования, хотя вокруг простирается такая же однотипная тундра.
Что касается средних поморников, долгоживущих птиц, то теоретически можно допустить гнездование одних и тех же птиц повторно в тех же местах. Однако и это сомнительно. Во-первых, число ячеек с повторными гнездованиями представляется все же бо́льшим, чем количество птиц, которые могли жить 20 и более лет, таких птиц бывают обычно единицы. Во-вторых, у средних поморников довольно много особей-меланистов, и не одному наблюдателю ни разу не бросилось в глаза, чтобы меланисты гнездились в одних и тех же местах в разные годы.
Экологические особенности мест гнездования поморников. Ячейки многократного гнездования обоих видов поморников расположены как на плакорах, на тундровых склонах по берегам ручьев, так и на болотистых местах (рис. 7), нередко на сфагновых кочках. При этом средние поморники гнездятся чаще в болотцах, а длиннохвостые – гораздо чаще на склонах долин ручьев. Если же гнездо среднего поморника расположено на плакоре, то скорее всего это будет локальная депрессия местности. При этом в одной и той же территориальной ячейке могут быть элементы разных биотопов: в один сезон пара может гнездиться на относительно сухом склоне, в другой сезон – совсем рядом, но поместив гнездо на сфагновую кочку. Особенно это характерно для длиннохвостых поморников. Подобное явление лишний раз показывает, что птицам важнее находиться в определенном районе тундры (неизвестно, каким образом выбранного), нежели придерживаться определенного биотопа. Внутри одной ячейки длиннохвостых поморников может быть весь набор имеющихся в окрестности биотопов.
Рис. 7.
Карта-схема района работ с обозначением территориальных ячеек, где зафиксировано неоднократное гнездование у длиннохвостого (красные кружки) и среднего (бирюзовые кружки) поморников. Домик – Станция им. Виллема Баренца.
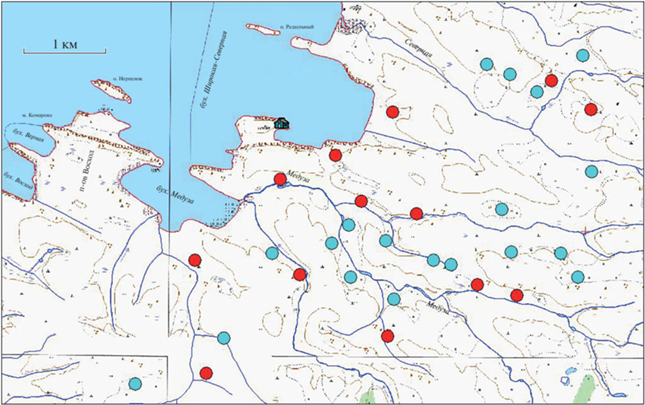
У длиннохвостых поморников наблюдается сильный разброс точек гнездования в территориальных ячейках, причем разброс такой, что перекрывает расстояния между ячейками. Дополнительный анализ распределения точек гнездования в минимальном описанном многоугольнике (Convex Hull) зоны гнездования длиннохвостых поморников, где расположены наиболее плотные группы точек (номера ячеек 1, 2, 4, 20, рис. 3, обведено коричневым), дает уже не групповое, а случайное распределение точек гнездования (R = = 0.89, N = 29, P = 0.28), т.е. птицы могли гнездиться здесь в любой точке одинакового биотопа тундры. Данный факт лишний раз свидетельствует о том, что в действительности для длиннохвостых поморников пригодно любое место в тундре.
У среднего поморника малое расстояние между последовательными гнездованиями в одной ячейке отмечено именно в сырых биотопах, на болотных кочках, которые невелики по размерам. Видимо, здесь можно говорить о “более экологических” ячейках у среднего поморника, нежели у длиннохвостого. Учитывая, что у средних поморников ячейки с многократным гнездованием расположены в понижениях плакоров или в нижних частях долин ручьев и в болотцах, тогда как однократные места могут быть и на плакорах, средние поморники предпочитают не склоны, как длиннохвостые, а плоские места плакоров. Данные о гнездовании средних поморников в наиболее характерных для этого вида местах позволяют предположить, что основа выбора ячеек – экологическая. То есть именно специфические условия привлекают среднего поморника, в отличие от длиннохвостого поморника, для которого при прочих равных условиях биотоп не важен.
На настоящее время приходится признать, что длиннохвостые поморники ориентируются на неизвестные нам раздражители, например элементы макроландшафта (на каменных грядах гнездиться не будут, а будут гнездиться в равнинной, или низменной, тундре, без камней), при этом элементы микроландшафта, очевидно, не имеют значения. В ячеистости пространственной структуры популяций видится влияние фактора, который человек не улавливает. В этом плане мы попробовали привлечь теорию “сигнального поля” Н.П. Наумова. Основное положение теории гласит, что “сигнальное поле представляет собой пространство событий, запечатленных в следах жизнедеятельности многих поколений животных, ранее занимавших данную территорию, с имеющимися на ней ресурсами. Эти следы жизнедеятельности (норы, тропы, скопления помета и т.п.), ставшие атрибутом ландшафта, были названы "стабильными элементами сигнального поля”, а весь их комплекс – “матрицей стабильных элементов”. Матрица стабильных элементов образует зрительно-запаховый образ пространства” (Наумов, 1977). Как видно из определения, эта теория опирается на хорошо видимые ориентиры, понятные даже человеку.
В случае с рассматриваемыми здесь обоими видами поморников говорить об оставшихся следах жизнедеятельности не приходится: конкретные точки гнездования поморников на следующий сезон неотличимы от других мест в тундре. Получается, что мы имеем дело с виртуальной расчерченностью пространства, которая в неполной мере, а то и просто слабо зависит от свойств ландшафта и прежних следов жизнедеятельности вида. При этом речь идет именно о виртуальной расчерченности, поскольку границы гнездовых территорий никак не выражены в природе, а существуют только в восприятии птиц конкретного вида. Таким образом, теория “сигнального поля” не в состоянии удовлетворительно объяснить это явление. Видимо, сигнальное поле, на которое ориентируются животные во время отправления необходимых жизненных функций, устроено сложнее, чем представляется ныне. Оно может и не включать в себя привнесенные организмами особенности ландшафта. Возможно, нам пока приходится предполагать существование некого неизвестного нам канала передачи информации в природе (С.И. Малышев, по: Гороховская, 2015).
Расчерченность пространства без постоянных ориентиров известна и для других групп птиц, в частности воробьиных (Федчук, 2009), для которых из-за малой продолжительности жизни особей говорить о преемственности одних и тех же мест вообще не приходится. В этом плане интересен также факт расчерченности пространства у медоносных пчел, у которых имеется постоянный участок для спаривания диаметром 20 м. Хотя преемственности нет и здесь: трутни не переживают зиму, а самки не появляются здесь дважды (Мак-Фарленд, 1988).
Совместное пространственное распределение двух видов поморников. Оба вида поморников можно рассмотреть и как экологически близкие виды, поэтому можно проанализировать пространственное распределение территориальных ячеек обоих видов. Совместное распределение ячеек обоих видов также получилось групповым (R = = 0.83, P = 0.0001, N = 172, рис. 8), что вполне понятно, так как оба упомянутых вида имеют тенденцию из года в год гнездиться примерно в одних и тех же местах. Среднее минимальное расстояние между ячейками в этом случае получается 149.5 ± ± 7.1 м, т.е. меньше, чем в случае обоих одновидовых распределений. Таким образом, конкретные районы гнездования видов, хотя эти виды и имеют разные экологические предпочтения, перекрываются. Два самых маленьких расстояния между ячейками разных видов равны 25 и 50 м. Это означает, что в данных случаях разные виды поморников (понятно, что в разные годы) используют одну и ту же гнездовую ячейку. В одном случае эта ячейка расположена на склоне ручья (предпочитаемый биотоп длиннохвостого поморника), а в другом случае – в болотистой низине (предпочитаемый биотоп среднего поморника).
Рис. 8.
Карта-схема района работ с обозначением территориальных гнезд длиннохвостого (фиолетовые кружки) и среднего (зеленые кружки) поморников. Домик – Станция им. Виллема Баренца.
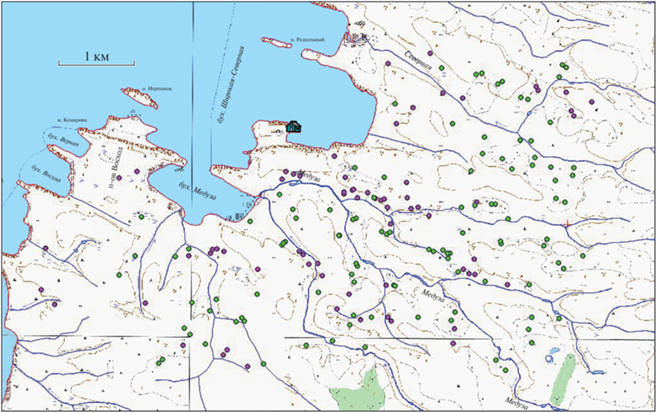
Вычисленное нами среднее минимальное расстояние – это расстояние между ячейками, которые могут быть заняты в разные годы, не обязательно одновременно. Если рассматривать этот показатель в пределах одного сезона, реальное минимальное расстояние между гнездами разных видов оказывается значительно больше. В сезоны, когда массово гнездились средние поморники, эти расстояние составляли: 2002 г. 472 м, 2004 г. 232.5 м, 2005 г. 253 м, 2007 г. 549 м, 2016 г. 391.5 м, 2019 г. 305.6 м.
Возможное влияние наблюдателей на распределение гнезд длиннохвостого поморника. Длиннохвостые поморники при принятии решения гнездиться или не гнездиться руководствуются рационально-вероятностной стратегией, подобной той, которую мы обнаружили и у гусей тундры (Харитонов, 2019a). Согласно этой стратегии в годы с ожидаемо высокой угрозой от песцов, не только больше гнезд бывает разорено, но и изначально гнездится значительно меньше особей, чем в годы с ожидаемо малой угрозой. Территории без гнезд значительно чаще отмечаются в малолемминговые и “песцово-опасные” годы.
Фактор наличия человека в области гнездования конкретных пар, по всей видимости, тоже является элементом среды и влияет на принятие решения о гнездовании. Неожиданно фактор антропогенного беспокойства может иметь не отрицательное, а положительное значение. Дело в том, что передвигающиеся по тундре люди беспокоят всех ее обитателей, в том числе и песцов. Поэтому как птицы, если они не имеют гнезда в конкретном районе тундры, так и песцы, если они не имеют норы в конкретном месте, в норме стараются избегать близких встреч с человеком. Недаром у птиц и млекопитающих существует межвидовое распознавание сигналов тревоги. Известно также, что птицы могут использовать зоны, чаще посещаемые человеком, как возможно более безопасные для гнездования (например, Харитонов, 1988; Сыроечковский, 2013).
В нашем случае это проявляется следующим образом: наибольшее число гнездований длиннохвостых поморников отмечено там, где наиболее высока активность исследователей, т.е. именно в районах мониторинговых площадок 4 и 8 км2 (рис. 3), хотя соседние районы работ обследуются не хуже, и здесь удавалось найти практически все гнезда длиннохвостых поморников. Даже если на мониторинговых площадках непосредственно наблюдения не проводятся, то все равно при выходе на маршруты в тундру исследователи волей-неволей проходят эти площадки, создавая здесь фактор своего присутствия.
Две ячейки поморников на площадке в 4 км2 (ячейки номер 1 и 2) – самые “размытые” и часто сливаются, в то время как другие – менее “размытые”. В этих ячейках явно гнездятся чаще, чем в других и они из-за этого более размыты. Ячейки неравного размера: у Станции они могут быть маленькими, а дальше от Станции – большими. Повторные кладки наблюдали в 2016 и 2017 г. в одной из близких к Станции ячеек – ячейке номер 2. Еще одно возможное влияние присутствия человека на приятие решения о гнездовании – это ситуация в сезоне 2020 г. В этом году длиннохвостые поморники из всех окрестностей загнездились только на одной из мониторинговых площадок, на той, что имела площадь 8 км2, причем не в той части этой площадки, где было больше всего леммингов (численность леммингов в разных частях площадки определена по присутствию и размерам кладки гнездящихся здесь зимняков), а там, где исследователь (в данном случае я) действительно больше перемещался. Получается, что поморники в свою оценку места будущего гнездования добавили фактор: “вот тут ходит человек, которого песцы боятся”. В данном случае обе пары длиннохвостых поморников в 2020 г. просчитались – оба гнезда все равно были разорены, но это уже другой вопрос, не относящийся к теме статьи.
Хотя поморники гнездятся там, где наблюдается активность людей, все же они ориентируются на виртуальную (т.е. существующую только в представлениях птиц и не имеющую реально выраженных биотопических границ в природе) расчерченность местности – территориальные ячейки, которые от частого гнездования ячейки получаются размытыми. Больший разброс гнезд (“размытость”) в ячейках, где чаще ходят люди, подтверждается математически. Средняя дистанция переселения по годам в ячейках на краях нашей области работ (ячейки номер 5, 21, 39, 18, 13, 41 – рис. 3) составила 156.9 ± 23.9 м, N = 22; тогда как в ячейках, где чаще присутствовали люди (ячейки с номерами 1, 2, 4, 11, 20, 37, 48 – рис. 3), 238.1 ± 18.0 м, N = 73. разница достоверна по критерию Бейли: t = 2.71, число степеней свободы по Бейли = 47.16, P = 0.009.
Большой разброс точек гнездования в ячейках, где чаще присутствовали люди, может иметь, на наш взгляд, и еще одну причину. Возможно, здесь проявляется двоякое влияние фактора беспокойства: места активности людей привлекали поморников, однако некоторые пары могли страдать от беспокойства и могли совершать дополнительные перемещения внутри ячеек при поиске места для устройства гнезда.
У средних поморников, в отличие от длиннохвостых, не замечено специального увеличения концентрации точек гнездования в районах, где больше ходят люди (рис. 3 и 5). Видимо, средние поморники более индифферентны к присутствию людей, чем длиннохвостые.
ЗАКЛЮЧЕНИЕ
В пространственной структуре популяций обоих видов поморников есть постоянные территориальные ячейки (а у длиннохвостых поморников районы гнездования, видимо, и состоят из них), где в каждый конкретный год гнезда могут быть либо могут отсутствовать. Существование этих территориальных ячеек лишь частично объясняется экологическими факторами и не объясняется теорией сигнального поля. При условном разбиении пространства на территориальные ячейки и выборе определенных мест для отправления жизненных функций птицы ориентируются на еще неизвестные нам существенные факторы среды, нежели чисто экологические факторы и следы предыдущей активности животных.
В результате предпринятого анализа можно заключить: 1) на тундровых склонах, оттаявших к моменту гнездования, длиннохвостым поморникам для размещения гнезда годится любое место, экологические особенности конкретного места гнездования большого значения не имеют; 2) длиннохвостые поморники при выборе места гнездования предпочитают такие территориальные ячейки, где сильнее проявляется фактор присутствия человека; 3) большой разброс положения точек гнездования в ячейках, посещаемых людьми, может означать, что длиннохвостые поморники, хотя и стремятся к людям, все же испытывают и фактор беспокойства со стороны людей, т.к. в местах, где люди ходят реже, разброс точек гнездования в ячейках значительно меньше; 4) средние поморники – сильные птицы, хорошо противостоят песцу и в дополнительном факторе защиты, каковым может быть присутствие человека, видимо, не нуждаются.
Список литературы
Винокуров А.А., Кищинский А.А., 1976. Методы мечения птиц // Кольцевание в изучении миграций птиц фауны СССР. М.: Наука. С. 182–208.
Галушин В.М., 1982. Роль хищных птиц в экосистемах. Итоги науки и техники. Зоология позвоночных. М.: ВИНИТИ. Вып. 11. С. 158–238.
Головнюк В.В., Соловьев М.Ю., Поповкина А.Б., 2018. Характер пребывания и численность птиц в окрестностях арктической станции биологических исследований “Виллем Баренц” по наблюдениям 2015–2017 гг. // Научные труды Федерального государственного бюджетного учреждения “Объединенная Дирекция заповедников Таймыра”. Вып. 2. Норильск: АПЕКС. С. 79–105.
Гороховская Е.А., 2015. Теоретический подход С.И. Малышева к эволюции поведения // Зоологический журнал. Т. 94. № 10. С. 1151–1162.
Литвин К.Е., Овсяников Н.Г., 1990. Зависимость размножения и численности белых сов и песцов от численности леммингов на острове Врангеля // Зоологический журнал. Т. 69. № 4. С. 52−64.
Мак-Фарленд Д., 1988. Поведение животных. М.: Мир. 520 с.
Наумов Н.П., 1977. Биологические (сигнальные) поля и их значение в жизни млекопитающих // Успехи современной териологии. М.: Наука. С. 93–110.
Плохинский Н.А., 1978. Математические методы в биологии. М.: Издательство Московского университета. 265 с.
Сыроечковский Е.В., 2013. Пути адаптации гусеобразных трибы Anserini к обитанию в Арктике. М.: Товарищество научных изданий КМК. 307 с.
Федчук Д.В., 2009. Пространственная структура локальных популяций луговых воробьиных Европейского Севера России и механизмы ее формирования. Автореф. дис. … канд. биол. наук. М.: МПГУ. 24 с.
Харитонов С.П., 1988. Этологическая структура локальной группировки в колонии белых гусей (Anser caerulescens) // Зоологический журнал. Т. 67. № 10. С. 1530–1537.
Харитонов С.П., 1999. Компьютерная программа “Карта колонии”, исполняемый файл – colonmap.exe
Харитонов С.П., 2007. Изучение пространственного распределения гнезд в колонии. Методы и теоретические аспекты исследований морских птиц. Материалы V Всерос. школы по морской биологии (25–27 октября 2006 г., г. Ростов-на-Дону). Ростов-на-Дону: Издательство ЮНЦ РАН. С. 83–104.
Харитонов С.П., 2015. Птицы и млекопитающие окрестностей бухты Медуза, Диксонский район, северо-западный Таймыр // Научные труды Федерального государственного бюджетного учреждения “Объединенная Дирекция заповедников Таймыра”. Вып. 1. Норильск: АПЕКС. С. 173–200.
Харитонов С.П., 2019. Биология гнездования и структура популяций зимняка Buteo lagopus, сапсана Falco peregrinus и белой совы Nyctea scandiaca в арктических тундрах // Русский орнитологический журнал. Т. 28. № 1847. С. 5277–5279.
Харитонов С.П., 2019a. “Рациональное” и “иррациональное” в поведении птиц: сочетание рационально-вероятностной и релизерной моделей поведения при принятии решения о выборе места гнездования // Вестник Тверского Государственного Университета. Биология и экология. № 1 (53). С. 233–250.
Харитонов С.П., Бубличенко А.Г., Коркина С.А., 2005. Экология гнездования белых сов на северо-западном Таймыре: сопоставление с фазами динамики численности леммингов и пространственное распределение. Совы Северной Евразии (Волков С.В., Морозов В.В., Шариков А.В., ред.). Москва. С. 23–31.
Харитонов С.П., Волков А.Е., Виллемс Ф., Клейф Х. ван, Клаассен Р.Х.Г. и др., 2008. Колонии черных казарок возле белых сов: расстояния между гнездами в зависимости от численности леммингов и песцов // Известия РАН. Серия Биологическая. № 3. С. 313–323.
Харитонов С.П., Иваненко Н.Ю., Чухарева И.П., Анисимов Ю.А., 2011. Использование GPS-навигатора для картирования колоний птиц: методическая проверка. Поволжский экологический журнал. № 1. С. 59–69.
Чернов Ю.И., 1980. Жизнь тундры. М.: Мысль. 239 с.
Clark P.J., Evans F.C., 1954. Distance to the nearest neighbour as a measure of spatial relationships in populations // Ecology. V. 35. № 4. P. 445–453.
Kharitonov S.P., Klaassen R.H.G., Nowak D.J., Nowak A.I., Osipov D.V., Natalskaya O.V., 2017. Brent Geese (Branta bernicla) associations with Pomarine Skuas (Stercorarius pomarinus) on the mainland tundra // Biology Bulletin. V. 44. № 8. P. 852–859.
Khomenko S., Rosenfeld S., Dyluk S., 1999. Birds of Medusa Bay, NW Taimyr, in 1997 // Results of a Russian-Ukranian expedition. WIWO-report-66. Zeist.: WIWO. P. 1–48.
Klaassen R.H.G., Cottaar F., 2002. The relationship between breeding goose and wader species, lemming density and predator abundance at the Uboynaya River, Taimyr Peninsula, Russia. Preliminary expedition report. Wageningen: Institute Alterra, Green World Research. P. 1–9.
Seyer Y., Gauthier G., Frauteux D., Therrien J.-F., 2020. Resource partitioning among avian predators in the Arctic tundra // Journal of Animal Ecology. V. 29. P. 2934–2945.
Tulp I., Bruinzeel L., Jukema J., Stepanova O., 1997. Breeding waders at Medusa Bay, Western Taimyr, in 1996. WIWO-report 57. Zeist: WIWO. 92 p.
Willems F., Turnhout C. van, Kleef H. van, Felix R., 2002. Breeding Birds of Medusa Bay, Taimyr, Russia // Methods for biological monitoring in the Arctic, with results of 1998 and 1999. WIWO-report 77. Zeist: WIWO. 177 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал



