Зоологический журнал, 2023, T. 102, № 2, стр. 123-140
Статолиты брюхоногих моллюсков и их использование в качестве регистрирующих структур
О. А. Хорошутина *
Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
105187 Москва, Окружной проезд, 19, Россия
* E-mail: olga.khoroshutina@gmail.com
Поступила в редакцию 14.06.2022
После доработки 19.10.2022
Принята к публикации 28.10.2022
- EDN: HTLMDZ
- DOI: 10.31857/S0044513423020083
Аннотация
В обзоре рассмотрено формирование статолитов брюхоногих моллюсков в онтогенезе, включая ранние стадии, проанализированы процесс роста статолитов брюхоногих моллюсков разных видов, их строение и морфометрические характеристики, особенности внутренней структуры, химический и минералогический состав. Обсуждаются разные типы формирующихся концентрических отметок (периодические отметки роста, отметки выклева/оседания, отметки, маркирующие другие онтогенетические события) на статолитах и причины их формирования. Рассмотрены преимущества использования статолитов как регистрирующих структур. Также приведены данные по верификации годовой периодичности образования отметок на статолитах.
Один из основных органов чувств, присущий как беспозвоночным (статоцист), так и позвоночным (лабиринт), – это орган равновесия, с помощью которого животные воспринимают гравитационное поле Земли. Гравирецепция необходима животным как для определения положения тела в пространстве, так и для активной ориентации, локомоции, регуляции движений глаз (установлены как непосредственные синаптические контакты между рецепторными клетками статоцистов и глаз, так и морфофункциональное взаимодействие рецепторных клеток, которое обеспечивается глазодвигательным центром (Винников, 1995)). Строение этого органа обладает высоким конвергентным сходством у разных типов животных, что объясняется, в том числе, постоянством действия гравитации на протяжении всего периода эволюционной истории (Асеев и др., 2013). При этом, как правило, чем сложнее поведение животного, тем более сложными и специализированными являются сенсорные структуры, которыми оно обладает. Базовая схема строения органа равновесия включает в себя две основные составляющие: сенсорные элементы, или рецепторные клетки, и инерциальную массу (одно или несколько образований различной формы, которые при изменении положения в пространстве раздражают рецепторные клетки). Сам статоцист у разных групп беспозвоночных может иметь вид ямки или пузырька, выстилающий его сенсорный эпителий обычно представляет собой первично-чувствующие клетки (однако у некоторых групп, например гребневиков и головоногих, встречаются вторично-чувствующие клетки); инерциальная масса находится в заполненной жидкостью полости статоциста (Budelmann, 1988). Особенности строения статоциста беспозвоночных могут варьировать, при этом следует принимать во внимание, что беспозвоночные, в отличие от позвоночных, не являются эволюционно однородной монофилетической группой (Markl, 1974). Так, например, у сцифомедуз статоцисты расположены в краевых тельцах, или ропалиях, которые находятся по краю зонтика и представляют собой трансформированные щупальца (Yamashita, 1957); у некоторых семейств полихет статоцисты метамерны и встречаются в нескольких передних сегментах тела (Ariciidae – 6 пар, Orbiniidae – до 20 пар (Markl, 1974)). Для моллюсков также характерно наличие органов равновесия, судя по всему, обладающих общностью происхождения (за исключением панцирных моллюсков (Polyplacophora) (Markl, 1974). При это у активно перемещающихся головоногих статоцисты обладают наиболее сложным строением среди беспозвоночных (Williamson, 1995).
Инерциальная масса в органах равновесия – статоцистах – у беспозвоночных может представлять собой один сравнительно крупный статолит или несколько более мелких статоконий. Статолиты (или статоконии) описаны у разных групп беспозвоночных: полихет (Beesley et al., 2000), бескишечных турбеллярий (Иванов и др., 1972), голотурий (Ehlers, 1997), гидроидов (Санамян, Санамян, 2012), сцифомедуз (Yamashita, 1957; Spangenberg, Beck, 1968), кубомедуз (Ueno et al., 1995; Mooney, Kingsford, 2017), ракообразных (Espeel, 1985) и других. В статоцистах моллюсков также обнаруживаются единичные статолиты или множественные статоконии: у брюхоногих (Винников и др., 1971; Chase, 2002), головоногих (Clarke, Maul, 1962; Clarke, 1978) и двустворчатых моллюсков (Morton, 1985; Galante-Oliveira et al., 2019).
Статолиты растут на протяжении всего онтогенеза, причем скорость роста статолитов неравномерна и коррелирует со скоростью обмена веществ животного, отражая ее периодические изменения. В связи с этим статолиты имеют морфологически неоднородную слоистую структуру, причем ростовые слои сохраняются на протяжении всей жизни животного. Таким образом, статолиты относятся к так называемым регистрирующим структурам (Мина, Клевезаль, 1970; Клевезаль, Смирина, 2016), которые отражают изменения окружающей среды, фиксируют онтогенетические события, приводящие к изменению скорости роста, и используются в том числе для определения возраста животного. Среди моллюсков методика определения возраста по статолитам хорошо отработана и широко применяется у головоногих (Jackson, 1994; Arkhipkin, 2005; Arkhipkin et al., 2018).
Возможность определения индивидуального возраста животного крайне важна для изучения структуры популяции и ее динамики. В то же время, проблема определения индивидуального возраста брюхоногих моллюсков все еще не решена для некоторых групп, а универсальный способ, который был бы достаточно прост в применении, не разработан.
Многообразию методов определения индивидуального возраста гастропод посвящен обзор Холлимана с соавторами (Hollyman et al., 2018a). Так, для оценки размерно-возрастной структуры популяции довольно часто используют косвенные методы, например выделение модальных классов в гистограммах частотного распределения высот раковин моллюсков (Kideys, 1996). Однако этот метод дает приблизительную оценку и не позволяет говорить об индивидуальном возрасте животных. Среди прямых методов, с помощью которых можно оценить возраст отдельных моллюсков, наиболее просто для определения возраста использовать внешние регистрирующие структуры – линии нарастания на раковине: внешние (например, Fissurella crassa (Bretos, 1980), Monodonta lineata (Williamson, Kendall, 1981; Lewis et al., 1982), Peringia ulvae (Горбушин, 2003), Littorina obtusata (Козминский, 2006)) и внутренние (например, морское блюдечко (Patella vulgata) (Ambrose et al., 2016), морская туфелька (Crepidula fornicata) (Guy et al., 2013) и разные виды морских ушек (Prince et al., 1988; Shepherd et al., 1995, 2000; Naylor, 2010), а также нерестовые отметки (Rapana venosa (Косьян, Антипушина, 2011)). Для ряда видов подтверждено ежегодное образование отметок на крышечке (оперкулуме): Buccinum undatum (Santarelli, Gros, 1985), Buccinum osagawai (Голиков, 1980; Овсянников, Островский, 2008), Busycon carica (Power, 2009).
Однако внешние регистрирующие структуры со временем могут повреждаться под воздействием внешней среды и становиться плохо читаемыми, что затрудняет оценку индивидуального возраста моллюска. Кроме того, для ряда видов (например, Nucella heyseana (Селин, 2003); Gibbula cineraria (Schöne et al., 2007)) показано, что отметки на раковине или оперкулуме не являются годовыми, поэтому методика не может стать универсальной. Такие методы, как анализ содержания стабильных изотопов 16О/18О (Epstein et al., 1951) или анализ изменения концентраций некоторых микроэлементов (Mg, Ba, Sr (Lloyd et al., 2008; Manríquez et al., 2012)), хотя и достаточно надежны, но весьма трудоемки. В связи с этим цель настоящего обзора – обобщение данных по строению и химическому составу статолитов (внутренней регистрирующей структуры брюхоногих моллюсков), развитию их в онтогенезе, а также обсуждение метода определения индивидуального возраста брюхоногих моллюсков по отметкам на статолитах, результатов его верификации в работах ряда авторов, преимуществ и недостатков данного метода.
СТАТОЛИТЫ БРЮХОНОГИХ МОЛЛЮСКОВ
Орган равновесия – статоцист
Статоцисты гастропод обычно имеют форму, близкую к сферической, и расположены вблизи педальных ганглиев подглоточного ганглионарного комплекса в мускулатуре ноги (рис. 1 (Hollyman et al., 2017a, fig. 1)). Они окружены соединительной тканью и связаны эластичными тяжами как между собой, так и с мускулатурой ноги (Горгиладзе и др., 2013). Полость статоциста заполнена статолимфой, а внутренняя стенка содержит первично-чувствующие волосковые клетки (механорецепторы), расположенные асимметрично (рис. 2 (Budelmann, 1988, fig. 30.6 )). Несмотря на анатомическую близость к педальным ганглиям, статоцисты иннервируются церебральными ганглиями, которые, в свою очередь, связаны коннективами с педальными ганглиями (Голиков, 1980).
Рис. 1.
Самка B. undatum (схема), извлеченная из раковины (А), половина рассеченного тела моллюска B. undatum под проходящим светом с использованием стереомикроскопа (B) и статолит перед извлечением (С): s – сифон, m –мантия, p – хоботок, op – оперкулум, f – нога, t – щупальца, cg – церебральный ганглий, st – статолит, sc – статоцист, n – нерв. Стрелкой показано, что dg (пищеварительная железа) и g (гонады) находятся за границами схемы. Прерывистая линия: разрез в сагиттальной плоскости. Пунктир: зона, показанная ниже (С). (Hollyman et al., 2017a, fig. 1).

Рис. 2.
Статоцист с неполяризованными волосковыми клетками (поперечное сечение): статоцист легочных и заднежаберных брюхоногих моллюсков с тринадцатью крупными волосковыми клетками (A), правый (нижний) статоцист двустворчатого моллюска рода Pecten с многочисленными небольшими волосковыми клетками (B), статоцист лопатоногого моллюска морской зуб Dentalium vulgare с крупными (темными) и маленькими (светлыми) неполяризованными волосковыми клетками (C), статоцист переднежаберного брюхоногого моллюска рода Pterotrachea с рецепторными клетками, расположенными в макуле, в нижней части статоциста (D); s – статолит; ss – статоконии; сс – реснитчатые клетки. (Budelmann, 1988, fig. 30.6 ).
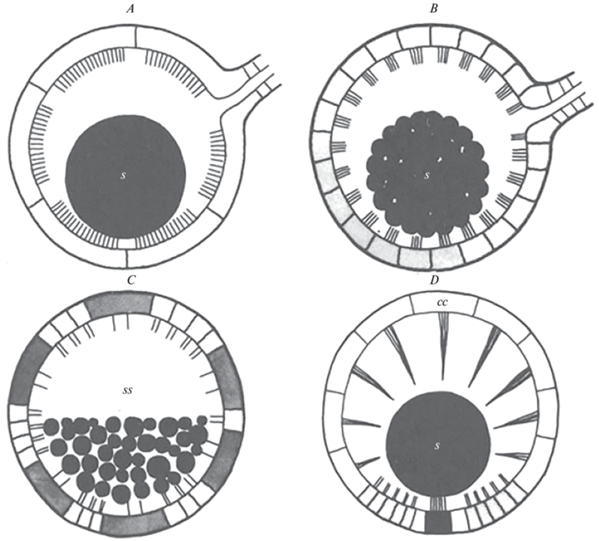
У некоторых видов гастропод в статоцисте содержится не один статолит, а множество более мелких статоконий (Винников и др., 1971). Статокония, как правило, мельче статолита. Количество статоконий в статоцисте непостоянно, они могут срастаться между собой (Горгиладзе, 2020), что делает их малопригодными для использования в качестве регистрирующих структур. Так, статоконии в статоцистах наземной легочной улитки Helix lucorum обычно овальные с плоской поверхностью, имеют сферическое ядро диаметром около 1.5 мкм, однако наблюдаются также статоконии, различающиеся по форме или имеющие несколько ядер (Горгиладзе и др., 2010). Считается, что множественные статоконии встречаются у более примитивных брюхоногих моллюсков, например в выделявшемся ранее отряде археогастропод, тогда как наличие единичного статолита в статоцисте – эволюционно более прогрессивный признак (Fretter, Graham, 1994; Richardson et al., 2005). Это, возможно, является частным случаем олигомеризации – постепенного уменьшения числа гомологичных органов в процессе эволюции и специализации (Догель, 1954). У двустворчатых моллюсков наблюдается схожая картина: существуют группы и с единичным статолитом, и с множественными статокониями, однако, по-видимому, это не имеет большого филогенетического значения (Morton, 1985; Morton, Machado, 2021).
Морфометрические характеристики статолитов
Морфометрические характеристики статолитов брюхоногих моллюсков характеризуются видовой, возрастной и индивидуальной изменчивостью. Галанте-Оливейра с соавторами (Galante-Oliveira et al., 2013), проведя исследование 12 видов брюхоногих моллюсков побережья Португалии, сообщают о вариабельности диаметров статолитов. Средние значения основных параметров для некоторых видов представлены в табл. 1.
Таблица 1.
Средние значения основных измерений статолитов и высоты раковины некоторых видов брюхоногих моллюсков
| Вид | Диаметр выклевного кольца/кольца оседания, мкм | Диаметр статолита, мкм | Высота раковины, мм | N | Источник |
|---|---|---|---|---|---|
| Peringia ulvae (Littorinimorpha, Hydrobiidae) | – | 41.2 ± 2.6 | 7.44 ± 0.61 | 6 | Galante-Oliveira et al., 2013 |
| Aporrhais pespelecani (Littorinimorpha, Aporrhaidae) | – | 187.7 ± 28.8 | 33.63 ± 2.92 | 6 | Galante-Oliveira et al., 2013 |
| Ranella olearium (Littorinimorpha, Ranellidae) | – | 327.4 ± 25.7 | 136.50 ± 16.28 | 6 | Galante-Oliveira et al., 2013 |
| Charonia lampas (Littorinimorpha, Charoniidae) | – | 344.0 ± 39.9 | 168.67 ± 39.46 | 6 | Galante-Oliveira et al., 2013 |
| Nassarius reticulatus (Neogastropoda, Nassariidae) | 36.38 ± 1.98 | 157.28 ± 9.97 | 29.39 ± 1.67 | 22 | Barroso et al., 2011 |
| Buccinum morchianum (Neogastropoda, Buccinidae) | 82.13 ± 16.49 | 323.13 ± 30.19 | 87.96 ± 15.04 | 8 | Хорошутина, Лищенко, 2018; Хорошутина, Лищенко, неопубликованные данные |
| Buccinum polare (Neogastropoda, Buccinidae) | 77.36 ± 7.72 | 294.09 ± 16.45 | 60.04 ± 6.14 | 11 | Хорошутина, Лищенко, 2018; Хорошутина, Лищенко, неопубликованные данные |
| Rapana venosa (Neogastropoda, Muricidae) | 33.67 ± 2.89 | 234.18 ± 32.08 | 59.08 ± 13.08 | 59 | Хорошутина, Лищенко, 2022 |
Разница в морфометрических характеристиках между левым и правым статолитом брюхоногих моллюсков в основном не отмечается (например, Richardson et al., 2005; Galante-Oliveira et al., 2013; Hollyman et al., 2017a; Хорошутина, Лищенко, 2018). В то же время Горгиладзе с соавторами (2013) отмечают у Pomatias rivularis разницу в морфометрических показателях между левым и правым статолитом (левый статолит крупнее, форма одного из статолитов может заметно отклоняться от правильной сферической). Авторы также говорят о наличии заметной индивидуальной изменчивости, например, в проявлении асимметрии одного из пары статолитов. При этом асимметрия инерциальной массы отмечается и у других групп беспозвоночных и позвоночных, например, у гребневиков (Винников и др., 1971) и рыб (для меченосцев Xiphophorus helleri и цихлид Oreochromis mossambicus) показана связь асимметрии отолитов и проявлений болезни движения (петлеобразные плавательные движения, положение вниз головой, верчение) (Hilbig et al., 2003).
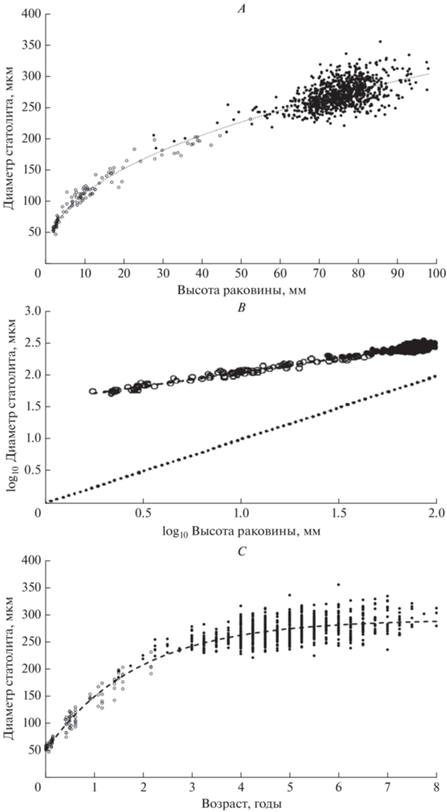
Размер статолита положительно коррелирует с линейными размерами раковины; с ростом моллюска диаметр статолита увеличивается. Однако эта зависимость не прямая, рост статолитов характеризуется заметной отрицательной аллометрией. Это приводит к тому, что у мелких моллюсков статолиты имеют относительно более крупные размеры, с возрастом скорость роста статолита снижается быстрее, чем скорость роста раковины; и относительные размеры статолитов уменьшаются. Холлиман с соавторами (Hollyman et al., 2017a) исследовали взаимосвязь диаметра статолита и высоты раковины Buccinum undatum: она довольно точно описывается степенной функцией (y = 41.38 × x0.4354, R 2 = 0.96). При этом точки, соответствующие диаметрам статолитов и длинам раковины моллюсков до 60 мм, лежат практически на линии функции, что позволяет точно предсказывать высоту раковины, имея диаметр статолита (и наоборот). В то же время, у моллюсков, высота раковины которых выше 60 мм, появляется большой разброс в диаметрах статолитов (рис. 3A (Hollyman et al., 2017a, fig. 3), возможно, это связано как со значительным снижением скорости роста раковины с возрастом в целом, так и с индивидуальными различиями в скорости роста. Дополнительно эту зависимость иллюстрирует график, построенный по логарифмически преобразованным данным (рис. 3B (Hollyman et al., 2017a, fig. 3)). Также авторы установили, что зависимость между диаметром статолита и возрастом описывается кривой Берталанфи (R 2 = = 0.90) (рис. 3C (Hollyman et al., 2017a, fig. 3)).
Рис. 3.
Взаимосвязь между высотой раковины и диаметром статолита B. undatum, описываемая степенной функцией (y = 41.38 × x0.4354, R 2 = 0.96) (A); диаграмма рассеяния, показывающая взаимосвязь между логарифмически преобразованными данными (log10) (B), пунктирная линия – изометрическая зависимость; взаимосвязь между возрастом моллюска и диаметром статолита B. undatum, описываемая кривой Берталанфи (R 2 = 0.90) (C). N = 931 для всех точек. ⚫ – собранные моллюски, ⚪ – выращенные в лабораторных условиях (Hollyman et al., 2017a, fig. 3, с изменениями).
Микроструктура статолитов
Статолиты брюхоногих моллюсков имеют, как правило, гладкую поверхность. Внутренняя структура на шлифах статолитов представлена расположенным в центре ядром, окруженным концентрическими отметками разной прозрачности и ширины. Ядро, как правило, имеет наиболее темный оттенок, его окружают хорошо заметные широкие светлые и узкие темные зоны (зоны остановки роста – отметки последующих лет). Также на образцах заметна радиальная исчерченность. Подобную структуру описывает ряд авторов (Горгиладзе и др., 2013; Richardson et al., 2005; Galante-Oliveira et al., 2013; Hollyman et al., 2017a); в нашей работе по Buccinum morchianum, B. polare и некоторым видам других родов семейства Buccinidae (Хорошутина, Лищенко, 2018), а также при исследовании статолитов Rapana venosa нами было обнаружено схожее строение статолитов (рис. 4). Основа такой структуры – органический матрикс, строение которого можно наблюдать при помещении статолита в кислую среду: после растворения CaCO3 в растворе серной, соляной, азотной кислоты (время экспозиции зависит от концентрации раствора и размера статолита) остается тонкая прозрачная структура с характерным кольцевидным и радиальным рисунком, присущая самому статолиту (Горгиладзе и др., 2013).
Рис. 4.
Статолит Rapana venosa с отшлифованной поверхностью. Хорошо заметны ядро и годовые концентрические отметки.

Кольцевидный рисунок статолита формируется путем постоянного образования ростовых слоев. На шлифах статолитов брюхоногих моллюсков может быть заметно несколько типов концентрических отметок. Основные из них – годовые, их образование связано с сезонным снижением скорости обмена веществ (Hollyman et al., 2018). Однако могут образовываться также отметки других типов, соответствующие более коротким периодам. Например, Белл (Bell, 1984) отмечает формирование суточных приростов личиночных статолитов Littorina scabra. В то же время для других видов о наличии суточных отметок не сообщается (Richardson et al., 2005; Galante-Oliveira et al., 2013; Hollyman et al., 2017a). Образуются также отметки, маркирующие определенные онтогенетические события, например “кольцо выклева” (для видов с прямым развитием) или “кольцо поселения” (для видов со стадией планктонной личинки). Это первая четкая отметка, окружающая темное ядро, следом за ней идет отметка первого года. (Galante-Oliveira et al., 2013; Fisher, Rudders, 2017). Для N. reticulatus показано также образование так называемых “отметок возмущения”, или стрессовых отметок, появляющихся вследствие остановки роста из-за антропогенных или естественных стрессовых воздействий (например, штормов, нереста, воздействия орудий лова, хищничества (Richardson, 2001; Galante-Oliveira et al., 2015)). В некоторых локациях такие кольца появляются чаще, чем в других, что может быть связано с сильно изменяющимися параметрами окружающей среды (Barroso et al., 2005). Количество таких отметок у N. reticulatus достоверно выше в лагуне Риа-де-Авейру, чем в относительно более стабильном прилегающем морском районе. Эти данные были подтверждены методами микроэлементного анализа, при этом визуально годовые отметки и “отметки возмущения” могут быть неотличимы друг от друга (Galante-Oliveira et al., 2015).
Химический и минералогический состав статолитов
Основное химическое соединение, из которого состоят статолиты, – это карбонат кальция (CaCO3). Статолиты брюхоногих моллюсков, как и раковины, могут включать в себя несколько полиморфных модификаций CaCO3: обычно это и кальцит, и арагонит (Galante-Oliveira et al., 2014), но показано, что статолиты, например, B. undatum состоят только из арагонита (Hollyman et al., 2017a). Аналогичные данные получили Горгиладзе с соавторами (2013), которые провели рентгенофазовый анализ кристаллической структуры статолитов Pomatias rivularis.
Элементный анализ образцов статолитов P. rivularis, проведенный Горгиладзе с соавторами (2013) с использованием системы микроанализа “ISIS” (Oxford, Великобритания), показал, что основные элементы, составляющие вещество статолита, – это Ca, C, O, N. Также статолиты содержат Sr и Mg – элементы, замещающие в карбонатах Са, в состав более сложных соединений входят атомы Fe, Al, Na, K, P, S, Si.
Концентрации микроэлементов, включенных в структуру карбоната кальция (Sr, Mg, Na и другие), зависят от ряда факторов (например, типа кристаллической решетки, солености, температуры морской воды, физиологических факторов (Hollyman et al., 2017)). В процессе формирования карбонатных структур моллюсков, в том числе статолитов, ионы Ca2+ могут замещаться ионами других двухвалентных металлов со схожими ионными радиусами (Dietzel et al., 2004). Чаще всего это Mg2+ и Sr2+, но могут также образовываться и более сложные структуры с включением Na+, Al3+, Fe3+ и одновалентных галогенид-ионов. Несмотря на то, что ионный радиус Na+ (0.95) близок к ионному радиусу Ca2+ (0.99), разница их зарядов требует включения в структуру кристаллической решетки либо трехвалентных катионов Al3+, Fe3+ (замещение двух ионов Ca2+ парой Na+–Me3+) (Billings, Ragland, 1968), либо замещения пары Ca2+–${\text{CO}}_{3}^{{2 - }}$ парой Na+–галогенид анион (F−, Cl−, Br− или I−) (Yoshimura et al., 2017).
При этом концентрации микроэлементов, замещающих Ca2+, зависят от вида полиморфной модификации CaCO3. Для кальцита с ромбоэдрической кристаллической решеткой характерно включение иона Mg2+ (атом этого иона обладает меньшим радиусом) в более высоких концентрациях, чем для арагонита. Напротив, орторомбическая структура кристаллической решетки арагонита чаще включает обладающий бо́льшим атомным радиусом ион Sr2+, замещающий Ca2+ (Hollyman et al., 2017). Поэтому для интерпретации результатов микроэлементного анализа крайне важно знать минералогический состав статолитов изучаемого вида: профили Mg2+ и Sr2+ для кальцит-арагонитовых статолитов и чисто арагонитовых статолитов будут различаться.
Важным фактором, влияющим на фиксацию некоторых микроэлементов в биогенных карбонатах, являются условия внешней среды. В работе Холлимана показано, что концентрации Mg2+ и Sr2+ как в кальците, так и в арагоните статолитов зависят от температуры окружающей морской воды во время минерализации, что позволяет реконструировать сезонные циклы температуры (Hollyman et al., 2017).
Циклы Na+ в карбонатах статолитов брюхоногих моллюсков оказались отрицательно скоррелированы с циклами Mg2+ и соответствовали годовым отметкам статолитов. Возможно, фиксация натрия также контролируется каким-либо фактором с годовым циклом, например температурой или скоростью роста моллюска (Hollyman et al., 2017). Однозначных данных по факторам, влияющим на включение Na+ в карбонаты статолитов и другие биогенные карбонаты, не найдено. Так, например, в статолитах кальмара Gonatus fabricii обнаружены суточные циклы Na/Ca, вероятно, соответствующие суточным циклам роста, связанным с кормлением (Zumholz et al., 2007). В то же время, Йошимура с соавторами в работе по биогенным карбонатам осадочных пород, образованных кораллами, двустворчатыми моллюсками, фораминиферами (Yoshimura et al., 2017), отмечает, что и факторы окружающей среды (например, температура, соленость), и биологические факторы, такие как микроструктура скелета и скорость кальцификации, оказывают незначительное влияние на концентрацию внутрискелетного натрия. Однако более ранние данные по биогенным карбонатам донных осадков вблизи коралловых рифов показывают, что на концентрацию Na+ в биогенных карбонатах может оказывать влияние соленость морской воды (Billings, Ragland, 1968).
РАЗВИТИЕ СТАТОЛИТОВ БРЮХОНОГИХ МОЛЛЮСКОВ В ОНТОГЕНЕЗЕ
Статоцисты у моллюсков возникают в виде эктодермальных инвагинаций, полость которых обычно закрывается, хотя в некоторых случаях остается канал, сообщающийся с внешней средой (Markl, 1974). Закладка статолитов в статоцистах происходит во время развития личинки в яйцевой капсуле (Bell, 1982, 1983, 1984; Lloyd et al., 2008; Manríquez et al., 2012; Zacherl et al., 2003, 2003a). Ядро статолита у моллюсков, в том числе брюхоногих, образуется на ранних стадиях онтогенеза, как правило, эндогенным путем. Однако, например, для педивелигеров двустворчатого моллюска Ostrea edulis Винников (Винников, 1995) отмечает наличие отверстий в статоцистах, ведущих в келликеров канал, через которые может происходить занос внешних частиц. Кристаллизация статолитов у брюхоногих моллюсков, так же, как и у животных других систематических групп, осуществляется под воздействием фермента карбоангидразы (Винников, 1995).
Наличие статолитов фиксируется у ювенильных моллюсков как с прямым, так и с непрямым типом развития (со стадией плавающей личинки). В ряде работ статолиты обнаружены у только что вышедших из яйцевой капсулы велигеров (напр., Richardson et al., 2005; Barroso et al., 2005; Chatzinikolaou, Richardson, 2007). О наличии статолитов (видимых через практически прозрачную раковину велигера) у личинок переднежаберных и заднежаберных моллюсков также сообщает Белл (Bell, 1982, 1983, 1984). У ювенильных моллюсков, развивающихся без стадии плавающей личинки, например, у B. undatum (Hollyman et al., 2017a) и Busycotypus canaliculatus (Fisher, Rudders, 2017), статолиты обнаруживаются перед выходом моллюска из яйцевой капсулы.
Рост статолитов в процессе онтогенеза моллюска происходит путем постоянного образования ростовых слоев, что на уровне микроструктуры выражается в формировании характерного кольцевидного рисунка. Ежедневные “кольца роста” были отмечены для статолитов личинок Littorina scabra (Bell, 1982); основные видимые отметки на шлифе статолита обычно образовываются во время сезонной остановки роста моллюска (Hollyman et al., 2018а).
Также встречаются концентрические отметки, отмечающие важные онтогенетические события: “кольца выклева” или “кольца поселения”. Первая ярко выраженная концентрическая отметка, окружающая ядро статолита, в зависимости от типа развития моллюска (прямое или непрямое) может интерпретироваться по-разному. Считается, что у видов с пелагическими планктонными личинками она маркирует оседание личинки на субстрат. У N. reticularis, который имеет непрямое развитие, первая отметка, вероятно, является “кольцом поселения”, или “кольцом метаморфоза” и формируется непосредственно перед оседанием моллюска (Barroso et al., 2005; Chatzinikolaou, Richardson, 2007). Схожие кольца обнаружены у моллюска Polinices pulchellus (Richardson et al., 2005а), а также других видов со стадией пелагической планктонной личинки в онтогенезе (Galante-Oliveira et al., 2013).
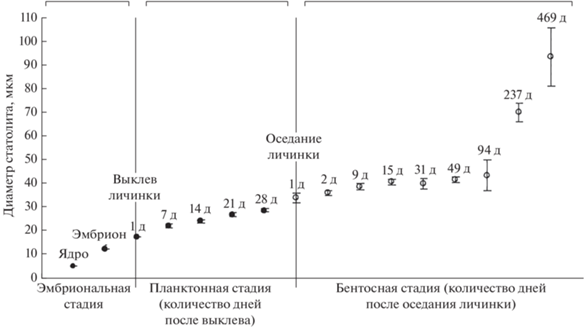
Chatzinikolaou и Richardson (2007) достаточно подробно описали рост статолитов в онтогенезе N. reticulatus (рис. 5, Chatzinikolaou, Richardson, 2007), выращенных в лабораторных условиях. У личинок пара статолитов и их положение в ткани ноги были видны непосредственно через тонкую личиночную раковину, что позволило провести их прямое измерение. Рисунок концентрических отметок на шлифах статолитов у личинок и молоди известного возраста использовался для определения того, на каком этапе жизни моллюска образовалось ядро, “кольцо поселения” и первые периодические отметки. У эмбрионов, личинок и молодых особей разного возраста диаметр ядра статолита (n) составлял ровно 5 мкм, что свидетельствует о формировании ядра в период раннего эмбрионального развития. Авторами также показано, что первая концентрическая отметка (средний диаметр 33.19 ± 0.13 мкм) у N. reticulatus связана с поселением пелагической личинки, а следующая за ней– маркирует первый год жизни (средний диаметр 82.7 ± 0.6 мкм).
Рис. 5.
Зависимость среднего диаметра статолита Nassarius reticulatus (доверительный интервал ± 95%) от возраста личинки в течение эмбриональной и планктонной стадии (⚫), а также ювенильной бентосной стадии (⚪). Над символами обозначено количество дней после выклева и оседания. (Chatzinikolaou, Richardson, 2007, fig. 3).
У видов, не имеющих личиночной стадии, первая четкая концентрическая отметка, видимо, маркирует выход моллюска из яйцевой капсулы (“кольцо выклева”). Для Buccinum undatum показано, что время образования первой четкой отметки связано с процессом выклева моллюска (Hollyman., 2017; Hollyman et al., 2017a). Для Busycotypus canaliculatus (также с прямым развитием) тоже было описано предполагаемое появление первой концентрической отметки вскоре после выклева (Fisher, Rudders, 2017). Авторы показали, что в момент выклева концентрическая отметка на статолите ещё не сформировалась. С учетом того, что средний диаметр первой отметки в среднем больше размера статолита при выклеве (72.4 и 69.6 мкм соответственно), авторы предполагают, что первая концентрическая отметка соответствует стадии адаптации к донному образу жизни в течение 7–14 дней после выклева.
Таким образом, важно отметить, что и “кольца выклева”, и “кольца поселения”, маркируют, по-видимому, одно и то же событие в онтогенезе у моллюсков с прямым и непрямым типом развития: переход на стадию ювенильного моллюска и адаптацию к донному образу жизни (Hollyman et al., 2017a).
ИСПОЛЬЗОВАНИЕ СТАТОЛИТОВ БРЮХОНОГИХ МОЛЛЮСКОВ В КАЧЕСТВЕ РЕГИСТРИРУЮЩИХ СТРУКТУР
Преимуществом статолитов как регистрирующих структур является их внутреннее расположение: они защищены от внешних воздействий, которые затрудняют определение возраста по внешним регистрирующим структурам (раковинам, оперкулумам моллюсков). Показано, например, что для ряда видов читаемость статолитов выше, чем у оперкулумов (Fisher, 2015; Hollyman, 2018). При этом на микроструктуру статолитов и их химический состав опосредованно влияют не только химический состав окружающей морской воды, но и физические и биологические факторы: соленость, температура, онтогенетические события (Hollyman et al., 2018а).
Использование статолитов для определения индивидуального возраста моллюска. Верификация метода
Статолиты беспозвоночных и отолиты позвоночных (например, рыб) применяются для определения индивидуального возраста животных. Так, например, статолиты головоногих моллюсков (кальмаров, каракатиц, сепиолид (Jackson, 1994; Arkhipkin, 2005)) широко используются для определения возраста (Arkhipkin et al., 2018). Для этих статолитов и для отолитов рыб (Nishimura, Yamada, 1984; Panella, 1971; Stevenson, Campana, 1992; Campana, 2005) показана как годовая, так и суточная периодичность образования колец нарастания (Hurley et al., 1979; Lipinski, 1980; Rosenberg et al., 1980).
На надежность оценок возраста по периодическим отметкам на шлифах статолитов влияют в основном два основных фактора:
– возраст образования первой отметки,
– периодичность образования колец (Galante-Oliveira et al., 2015).
С учетом того, что образование первой отметки для моллюсков с непрямым типом развития связывают с оседанием личинки (Barroso et al., 2005; Chatzinikolaou, Richardson, 2007; Galante-Oliveira et al., 2013; Richardson et al., 2005), возраст образования первой отметки для них может варьировать и зависит, в том числе, от продолжительности личиночной стадии. Для моллюсков с прямым развитием возраст образования первой отметки связан с выклевом и также варьирует в некоторых пределах: для B. undatum образование отметки непосредственно связано с выклевом (Hollyman, 2017; Hollyman et al., 2017a), для Busycotypus canaliculatus авторы говорят о возможном интервале в 7–14 дней (Fisher, Rudders, 2017). Тем не менее возможная погрешность определения возраста образования первой отметки (несколько суток) априори меньше периода, с которым образуются последующие отметки, из чего следует, что этой ошибкой можно пренебречь.
Годовая периодичность образования колец статолитов брюхоногих моллюсков показана у ряда видов: B. undatum (Hollyman et al., 2017a), N. reticulatus (Barroso et al., 2005), Polinices pulchellus (Richardson et al., 2005), Neptunea antiqua (Richardson et al., 2005а), Busycotypus canaliculatus (Fisher, Rudders, 2017) (табл. 2). Верификация метода определения возраста по годовым концентрическим отметкам на статолитах была произведена несколькими способами: с помощью исследования статолитов лабораторно выращенных моллюсков, анализа содержания стабильных изотопов кислорода в карбонатах раковины и микроэлементного анализа статолитов и карбонатов раковины (в том числе изменяющихся отношений Sr/Ca, Mg/Ca и других), анализа размерного состава (Hollyman et al., 2018а). При этом годовая периодичность образования отметок на статолитах подтверждена для ограниченного набора видов моллюсков, что требует осторожности при применении этого метода к другим видам.
Таблица 2.
Верификация метода определения возраста моллюсков по периодическим концентрическим отметкам на статолитах
| Вид | Метод | Источник | Примечание |
|---|---|---|---|
| Buccinum undatum | Лабораторное выращивание | Hollyman et al., 2017a | Выращивание до двухлетнего возраста (N = 240, прямое развитие, первая отметка – выклев) |
| Buccinum undatum | Анализ 16О/18О в карбонатах раковины | Hollyman et al., 2017a | N = 2, прямое развитие, возраст моллюсков 3 и 4 года |
| Buccinum undatum | Микроэлементный анализ карбонатов статолита (масс-спектрометрия вторичных ионов (SIMS), концентрации 27Al, 44Ca, 23Na, 88Sr и 24Mg) | Hollyman et al., 2017 | N = 30, прямое развитие, возраст – до четырех лет |
| Nassarius reticulatus | Лабораторное выращивание | Chatzinikolaou, Richardson, 2007 | Выращивание до одного года (N = 320, непрямое развитие, первая отметка – оседание личинки) |
| Nassarius reticulatus | Микроэлементный анализ карбонатов статолита (масс-спектрометрия с индуктивно связанной плазмой LA-ICP-MS, отношение Sr/Ca, а также Mg/Ca и Ba/Ca) | Galante-Oliveira et al., 2015 | N = 20, возраст до девяти лет, непрямое развитие |
| Nassarius reticulatus | Анализ размерного состава | Barroso et al., 2005 | N = 31, возраст до четырех лет, непрямое развитие |
| Neptunea antiqua | Микроэлементный анализ карбонатов раковины (индукционно-плазменный атомно-эмиссионный спектрометр (ICPAES), отношение Mg/Ca) | Richardson et al., 2005а | N = 4, прямое развитие, возраст моллюсков до 17 лет |
| Polinices pulchellus | Анализ размерного состава | Richardson et al., 2005 | N = 79, возраст 1–2 года, непрямое развитие |
| Busycotypus canaliculatus | Анализ размерного состава | Fisher, Rudders, 2017 | N = 213, возраст 4–8 лет, прямое развитие |
Лабораторное выращивание. Моллюсков B. undatum выращивали до двухлетнего возраста, кладки и моллюсков содержали в аквариумах с проточной водой из пролива Менай (Великобритания, пролив отделяет о-в Англси от Уэльса), температура и соленость воды соответствовали естественным, цикл свет : темнота – 10 ч : 14 ч, кормление 3 раза в неделю скумбрией Scomber scombrus (Hollyman et al., 2017a). На шлифах статолитов отчетливо видны как периодические отметки, соответствующие возрасту 1 и 2 года, так и “кольцо выклева”, окружающее область роста в яйцевой капсуле с более монотонным рисунком. Присутствуют также дополнительные кольца возмущения, значительно отличающиеся по выраженности и четкости от годовых колец.
Подробно исследовано формирование первых отметок у личинок и молоди N. reticulatus, выращенных в лабораторных условиях. Образование первой заметной концентрической отметки было связано с оседанием планктонных личинок, вторая отметка соответствовала первому году жизни (Chatzinikolaou, Richardson, 2007).
Анализ 16О/18О в карбонатах раковины. Метод определения возраста по соотношению уровня стабильных изотопов 16О/18О в карбонатах раковины применяется, в том числе, для определения индивидуального возраста брюхоногих моллюсков и для верификации других методов (Косьян, Антипушина, 2011; Roussel et al., 2011; Santarelli, Gros, 1985; Schöne et al., 2007). Верификация количества годовых отметок на шлифах статолитов B. undatum с помощью анализа содержания стабильных изотопов кислорода в карбонатах раковины произведена Холлиманом с соавторами (Hollyman et al., 2017a). Моллюски (самец и самка) были выловлены у берегов Великобритании (высота раковины > 5 см). Образцы, взятые на всем протяжении плеча оборота раковины с шагом 1 мм, использовались для восстановления профиля 18О и вычисления годовых темпов роста за весь период жизни животного на его основе. Полученные изменения в темпах роста с течением времени и максимальный возраст каждого образца карбоната раковины сравнивали с количеством и расположением колец роста в статолитах. Авторы показали согласованность между положением концентрических отметок статолитов и максимальными значениями содержания 18О (у самки – 3 пика 18О и 3 годовые отметки на статолите, у самца – 4 пика и 4 отметки). С учетом того, что повышение содержания более тяжелого изотопа 18О сопряжено с понижением температуры воды, появление кольцевых отметок в структуре статолитов обоснованно связывается с зимней остановкой роста. Таким образом, возраст моллюсков был оценен как 3 года для самки и 4 года для самца.
Микроэлементный анализ. Анализ содержания различных элементов в веществе статолита или в карбонатах раковины обычно проводится методом масс-спектрометрии, что позволяет определить концентрацию различных элементов, их соотношение и изотопный состав. Для верификации годовой периодичности формирования концентрических отметок в статолитах обычно используют циклы Sr, Mg, Ba. Галанте-Оливейра с соавторами (Galante-Oliveira et al., 2015) показали годовую периодичность образования отметок в статолитах N. reticulatus с использованием масс-спектрометрии с индуктивно связанной плазмой LA-ICP-MS. Используемый ими метод основан на определении циклов стронция (отношение Sr/Ca) в карбонате статолита и сопоставлении их с сезонно меняющимися параметрами окружающей среды (в данном случае с годовым циклом температур). Дополнительно контролировались концентрации Mg и Ba относительно Ca. Этот метод также позволил различить образующиеся дополнительные “кольца возмущения”, затрудняющие определение возраста, и истинные годовые кольца. Отметки, которые совпадают с пиками 88Sr/48Ca, образуются ежегодно в холодное время года; для “колец возмущения” изменений в концентрации 88Sr не отмечено. Авторы указывают, что визуальные различия между истинными годовыми отметками и “кольцами возмущения” не обнаружены. Но пики 88Sr/48Ca совпадают с 95.2% видимых концентрических отметок проанализированных статолитов, поэтому метод определения индивидуального возраста путем подсчета концентрических отметок можно считать валидным.
Холлиман с соавторами (Hollyman et al., 2017) с использованием масс-спектрометрии вторичных ионов (SIMS) проанализировали концентрации пяти элементов: 27Al, 44Ca, 23Na, 88Sr и 24Mg в статолитах B. undatum. Использовались как статолиты моллюсков, выловленных у берегов Великобритании, так и статолиты лабораторно выращенных моллюсков (параметры температуры и солености в лабораторном эксперименте соответствовали параметрам естественной среды). Отношения Mg/Са имели самые четкие циклы с минимумами, соответствующими темным годовым кольцам роста (наблюдался зимний минимум, коррелирующий с циклом температуры морской воды). Хотя общие отношения Mg/Ca были в 10–15 раз ниже, чем отношения Na/Ca и Sr/Ca, эта сезонная закономерность последовательно наблюдалась во всех отобранных образцах, в том числе в лабораторно выращенных. Профиль Na/Ca также коррелировал с годовым циклом температур, в то время как профиль Sr/Ca совпадал с ними только частично, а в некоторых случаях наблюдалась отрицательная корреляция. При этом отношение Sr/Ca во всех статолитах взрослых животных показало увеличение по направлению к внешнему краю статолита: по мере роста отношение Sr/Ca увеличивалось. Возможно, это связано с изменениями метаболической активности и снижением скорости роста с возрастом.
Циклы Mg/Ca в карбонатах раковины, минимумы которых совпадали с периодическими отметками статолитов, были получены также для Neptunea antiqua, что подтвердило их ежегодное образование. Максимальный возраст моллюска в исследовании составил 17 лет, при этом авторы отмечают сложности с подсчетом отметок на периферической зоне статолита и необходимость дополнительной обработки для точного определения возраста животного (Richardson et al., 2005а).
Анализ размерного состава раковин моллюсков. Один из методов анализа размерно-возрастного состава популяции и исследования группового роста беспозвоночных заключается в определении возраста поколений путем анализа распределения размерных частот и выделения в размерном ряду модальных классов (length frequency distribution analysis (LFDA)). При этом считается, что в каждом отдельно взятом возрастном классе размеры животных распределены нормально; отклонения от нормальности, в частности, связанные с изменением скорости роста под влиянием факторов окружающей среды, не учитываются. С возрастом, в связи с постепенным замедлением роста, связь “размер–возраст” также становится менее однозначной. Тем не менее метод позволяет получить достаточно точную оценку возрастного состава популяции (Васильев, 2016).
Метод анализа распределения размерных частот и выделения модальных классов (length frequency distribution analysis (LFDA)) применяется для брюхоногих моллюсков, например, в работах с Buccinum undatum (Kideys, 1996). В некоторых работах верификация годовой периодичности образования концентрических отметок в статолитах брюхоногих моллюсков проводилась с помощью анализа размерных частот высот раковин. Так, Баррозо с соавторами (Barroso et al., 2005) выявили зависимость между количеством отметок в статолитах N. reticulatus и размерным классом, к которому относится моллюск. В работе по Polinices pulchellus (Richardson et al., 2005) также проводился анализ размерного состава: сравнивались высоты раковин, оцененные по диаметрам видимых отметок на шлифах статолитов, и полученные в результате анализа частотного распределения. Результаты подтвердили годовую периодичность возникновения концентрических отметок статолитов. Для Busycotypus canaliculatus (Fisher, Rudders, 2017) результаты определения возраста путем подсчета количества кольцевых концентрических отметок статолитов коррелируют с результатами когортного анализа (Bhattacharya, 1967) с использованием наблюдаемых распределений частот высоты раковины моллюсков.
Использование статолитов для анализа абиотических факторов
Статолит, как регистрирующая структура, имеет определенный потенциал не только для определения индивидуального возраста животного, но и для изучения тех меняющихся условий окружающей среды, в которой жил моллюск. На химический состав статолитов, помимо других абиотических факторов, непосредственное влияние оказывает состав морской воды. С учетом того, что географические регионы могут различаться по составу морской воды, данные о концентрации химических элементов, содержащихся в статолитах, можно использовать для определения района происхождения. Так, например, были проанализированы концентрации микроэлементов в статолитах личинок Concholepas concholepas методом лазерной масс-спектрометрии из трех регионов Чили (Manríquez et al., 2012). Между регионами была обнаружена статистически достоверная разница в концентрациях микроэлементов личиночных статолитов. Также была проведена успешная реклассификация личинок в соответствующие географические регионы.
В то же время, потенциал статолитов как структур, фиксирующих температуру окружающей морской воды, ограничен. В разделе, посвященном химическому составу статолитов, упоминалось, что концентрации ионов Mg2+ (а также Sr2+) в биогенных карбонатах статолитов обусловлены температурой морской воды в период образования приростов. Холлиман с соавторами (Hollyman et al., 2017) показали, что эта зависимость позволяет реконструировать сезонные циклы температуры воды по минимальным и максимальным пикам Mg/Ca в карбонатах статолитов B. undatum. Тем не менее значительная индивидуальная изменчивость концентраций ионов Mg2+, обусловленная, по-видимому, физиологическим контролем включения Mg2+, а также уменьшение амплитуды циклов концентрации ионов Mg2+ по мере увеличения возраста моллюска не позволяют точно восстановить значения температур на определенных этапах онтогенеза.
Статолиты, одна из регистрирующих структур брюхоногих моллюсков, это небольшие шарообразные образования, которые состоят из кальцита и/или арагонита (полиморфных модификаций карбоната кальция) и располагаются в статоцистах – органах гравирецепции. Статолиты имеют внутреннюю структуру, сформированную периодическим нарастанием концентрических слоев, что позволяет использовать их как для определения возраста животных, так и для реконструкции определенных изменений в биотических и абиотических факторах окружающей среды (температура, химический состав воды, стрессовые воздействия). Характерная микроструктура статолитов, образованная чередующимися темными и светлыми зонами, которые окружают темное ядро, обусловлена изменениями в скорости роста моллюска. Статолиты начинают формироваться- на ранних этапах онтогенеза (во время развития в яйцевой капсуле) и имеют четко сформированное ядро к моменту выклева, а первая концентрическая отметка образуется во время перехода моллюска к бентосному образу жизни (выклев моллюска из яйцевой капсулы для видов с прямым типом развития и оседание личинки на субстрат для видов с непрямым типом). Последующие отметки, как правило, являются годовыми и связаны с сезонным замедлением скорости роста моллюска. Тем не менее могут встречаться также “кольца возмущения” – стрессовые отметки или отметки, связанные с другими онтогенетическими событиями (такими, как нерест, выклев).
Годовая периодичность образования концентрических отметок на шлифах статолитов верифицирована в большом количестве работ методами лабораторного выращивания, изотопного анализа карбонатов раковины, микроэлементного анализа карбонатов статолита и раковины, а также путем анализа размерного состава для нескольких видов моллюсков с прямым (Buccinum undatum (Hollyman et al., 2017a), Busycotypus canaliculatus (Fisher, Rudders, 2017), Neptunea antiqua (Richardson et al., 2005а)) и непрямым (Nassarius reticulatus (Barroso et al., 2005), Polinices pulchellus (Richardson et al., 2005)) типами развития (табл. 2). Анализировались моллюски разных возрастов: для метода лабораторного выращивания подтверждено образование годовых концентрических отметок в возрасте 1–2 года, другими методами исследовались моллюски более старших возрастов (до 17 лет для долгоживущего вида Neptunea antiqua (Richardson et al., 2005а)). С помощью микроэлементного анализа статолитов N. reticulatus удалось различить истинно годовые кольца и “кольца возмущения” (стрессовых отметок), при этом доля “колец возмущения” составила менее 5% (Galante-Oliveira et al., 2015). Хотя разрешающая способность метода может снижаться падать в старших возрастах из-за значительного снижения скорости роста моллюсков, а точность оценки возраста может уменьшаться из-за наличия “колец возмущения”, по совокупности данных метод признается валидным для описанных видов. В то же время, необходимы дальнейшие исследования, направленные на применение метода определения индивидуального возраста по концентрическим отметкам на статолитах других видов брюхоногих моллюсков.
Преимуществом статолитов как регистрирующих структур является их защищенность от воздействий окружающей среды, которые часто затрудняют определение возраста по внешним регистрирующим структурам, таким как раковина и оперкулум. Поэтому для анализа может использоваться большинство образцов, и в результате выборка остается репрезентативной. К недостаткам метода можно отнести достаточно сложный подготовительный этап, что затрудняет использование определения возраста по статолитам в качестве полевой методики. Однако метод с успехом может использоваться в лабораторных исследованиях, для верификации полевых методов определения возраста и при составлении размерно-возрастных ключей для популяции.
Список литературы
Асеев Н.А., Малышев А.Ю., Коршунова Т.А., Браваренко Н.И., Лемак М.С., Рощин М.В., Захаров И.С., Балабан П.М., 2013. Адаптация физиологической реакции органа равновесия к условиям микрогравитации: эксперименты на спутниках “Фотон” // Сенсорные системы. Т. 27. № 4. С. 327–337. EDN: PVCBTE
Васильев А.Г., 2016. Совершенствование методов оценки состояния запасов и перспектив промысла трубачей Buccinum osagawai. Дис. … канд. биол. наук. М.: ВНИРО. 118 с.
Винников Я.А., 1995. Гравитационные механизмы взаимодействия сенсорных систем у беспозвоночных в эволюционном аспекте // Авиакосмическая и экологическая медицина. Т. 29. № 1. С. 4–18. EDN: ZCHODN
Винников Я.А., Газенко О.Г., Титова Л.К., Бронштейн А.А., Цирулис Т.П., Певзнер Р.А., Говардовский В.И., Грибакин Ф.Г., Иванов В.П., Аронова М.З., Чехонадский Н.А., 1971. Рецептор гравитации. Эволюция структурной, цитохимической и функциональной организации. Под ред. В.Н. Черниговского. Л.: Наука. Т. XII. 523 с.
Голиков А.Н., 1980. Моллюски Buccinidae Мирового океана: Фауна СССР. Новая серия. Л.: Наука. Т. 5. Вып. 2. 508 с.
Горбушин А.М., 2003. Строение и механизм образования линий зимней остановки роста на раковине Hydrobya ulvae (Gastropoda, Protobranchia) Белого моря // Зоологический журнал. Т. 72. Вып. 11. С. 29–34.
Горгиладзе Г.И., Букия Р.Д., Давиташвили М.Т., 2010. Морфологические особенности статоконий в статоцистах наземной легочной улитки Helix lucorum // Бюллетень экспериментальной биологии и медицины. Т. 149. Вып. 2. С. 236–240. https://doi.org/10.1007/s10517-010-0924-1
Горгиладзе Г.И., Носовский А.М., Букия Р.Д., 2013. Статолит Pomatias rivulare // Сенсорные системы. Т. 27. Вып. 3. С. 216–223. EDN: RCFKJL
Горгиладзе Г.И., 2020. Пластичность инерциальной массы в органе равновесия в изменяющемся гравитационном поле // Сенсорные системы. Т. 34. Вып. 4. С. 267–282. https://doi.org/10.31857/S0235009220040022
Догель В.А., 1954. Олигомеризация гомологичных органов как один из главных путей эволюции животных. Л.: Издательство Ленинградского университета. 368 с.
Иванов В.П., Мамкаев Ю.В., Певзнер Р.А., 1972. Электронно-микроскопическое исcледование статоциста бескишечной турбеллярии Convoluta convoluta // Журнал эволюционной биохимии и физиологии. Т. 8 (2). С. 189–194.
Клевезаль Г.А., Смирина Э., 2016. Регистрирующие структуры наземных позвоночных. Краткая история и современное состояние исследований // Зоологический журнал. Т. 95. С. 872–896. https://doi.org/10.7868/S0044513416080079
Козминский Е.В., 2006. Определение возраста у Littorina obtusata (Gastropoda, Prosobranchia) // Зоологический журнал. Т. 85. С. 146–157. EDN: MPVQYL
Косьян А.Р., Антипушина Ж.А., 2011. Определение индивидуального возраста Rapana venosa (Valenciennes, 1846) по динамике 18O в карбонатах раковины // Океанология. Т. 51. Вып. 6. С. 1082–1082.
Мина М.В., Клевезаль Г.А., 1970. Принципы исследования регистрирующих структур // Успехи современной биологии. Т. 70. Вып. 3. С. 341–352. EDN: ONFUFR
Овсянников В.П., Островский В.И., 2008. Закономерности роста брюхоногого моллюска Buccinum osagawai в северной части Охотского моря // Известия ТИНРО. Т. 154. С. 37–45.
Санамян К.Э., Санамян Н.П., 2012. Новые находки мейобентосных гидроидов (Cnidaria: Hydrozoa) в дальневосточных морях России // Сохранение биоразнообразия Камчатки и прилегающих морей. Материалы ХIII междунар. науч. конф., посвящ. 75-летию со дня рождения известного отечественного специалиста в области лесоведения, ботаники и экологии, д.б.н. С.А. Дыренкова. Петропавловск-Камчатский: Камчатпресс. С. 102–109.
Селин Н.И., 2003. Рост и продолжительность жизни брюхоногого моллюска Nucella heyseana (Gastropoda) из залива Петра Великого Японского моря // Биология моря. Т. 29. Вып. 2. С. 115–119. EDN: OUIPMP
Хорошутина О.А., Лищенко Ф.В., 2018. Микроструктура статолитов трубачей (Buccinidae, Rafinesque, 1815) Дальневосточных морей России // Перспективы рыболовства и аквакультуры в современном мире. Материалы III научной школы молодых учёных и специалистов по рыбному хозяйству и экологии, посвященной 140-летию со дня рождения К.М. Дерюгина, Звенигород, 15–21 апреля 2018 года. Под ред. А.М. Орлова, И.И. Гордеева, А.А. Сергеева. Звенигород: Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии. С. 144.
Хорошутина О.А., Лищенко Ф.В. 2022. Определение индивидуального возраста Rapana venosa (Valenciennes, 1846) с использованием статолитов // Современные проблемы и перспективы развития рыбохозяйственного комплекса: материалы X международной научно-практической конференции молодых ученых и специалистов. Под ред. И.И. Гордеева, А.С. Сафронова, А.А. Смирнова, К.К. Киввы, О.В. Воробьевой, Л.О. Архипова, О.А. Мазниковой, Е.В. Лаврухиной, А.А. Сумкиной. М.: Издательство ВНИРО. С. 211–216.
Ambrose W.G., Locke W.L., Bigelow G.F., Renaud P.E., 2016. Deposition of annual growth lines in the apex of the common limpet (Patella vulgata) from Shetland Islands, UK and Norway: evidence from field marking and shell mineral content of annual line deposition // Environmental Archaeology. V. 21. P. 79–87. https://doi.org/10.1179/1749631414Y.0000000058
Arkhipkin A.I., 2005. Statoliths as black boxes (life recorders) in squid // Marine and Freshwater Research. V. 56. P. 573–583. https://doi.org/10.1071/MF04158
Arkhipkin A., Bizikov V., Doubleday Z., Laptikhovsky V., Lishchenko F., Perales-Raya C., Hollyman P., 2018. Techniques for Estimating the Age and Growth of Molluscs Cephalopoda // Journal of Shellfish Research. V. 37. P. 783–792. https://doi.org/10.2983/035.037.0409
Barroso C.M., Nunes M., Richardson C.A., Moreira M.H., 2005. The gastropod statolith: a tool for determining the age of Nassarius reticulatus // Journal of the Marine Biological Association of the United Kingdom. V. 146. P. 1139–1144. https://doi.org/10.1007/s00227-004-1516-2
Barroso C.M., Rato M., Veríssimo A., Sousa A., Santos J. A., Coelho S., Gaspar M.B., Maiad F., Galante-Oliveira S., 2011. Combined use of Nassarius reticulatus imposex and statolith age determination for tracking temporal evolution of TBT pollution in the NW Portuguese continental shelf // Journal of Environmental Monitoring. V. 13 (11). P. 3018–3025. https://doi.org/10.1039/C1EM10508F
Bhattacharya C.G., 1967. A simple method of resolution of a distribution into Gaussian components // Biometrics. V. 23. P. 115–135.
Beesley P.L., Ross G.J.B., Glasby C.J. (eds), 2000. Polychaetes and allies: the southern synthesis. Fauna of Australia. Vol. 4A: Polychaeta, Myzostomida, Pognophora, Echiura, Sipuncula. CSIRO publishing, Melbourne.
Bell J.L., 1982. Daily increments in the statoliths of gastropod larvae: their use in age determination // American Zoologist. V. 22. P. 861.
Bell J.L., 1983. Deposition of increments in the statoliths of gastropod larvae; effects of environmental conditions // American Zoologist. V. 23. P. 989.
Bell J.L., 1984. Statoliths as age indicators in gastropod larvae: application to measurement of field growth rates // Pacific Science. V. 38. P. 357.
Billings G.K., Ragland P.C., 1968. Geochemistry and mineralogy of the recent reef and lagoonal sediments south of Belize (British Honduras) // Chemical Geology. V. 3. P. 135–153. https://doi.org/10.1016/0009-2541(68)90006-5
Bretos M., 1980. Age determination in the keyhole limpet Fissurella crassa Lamarck (Archaeogastropoda: Fissurellidae), based on shell growth rings // The Biological Bulletin. V. 159. P. 606–612. https://doi.org/10.2307/1540826
Budelmann B.U., 1988. Morphological diversity of equilibrium receptor systems in aquatic invertebrates // Sensory biology of aquatic animals. Springer, New York. P. 757–782. https://doi.org/10.1007/978-1-4612-3714-3_30
Campana S.E., 2005. Otolith science entering the 21st century // Marine and freshwater research. V. 56 (5). P. 485–495. https://doi.org/10.1071/MF04147
Chase R., 2002. Behavior and its neural control in gastropod molluscs. New York: Oxford University Press. 281 p.
Chatzinikolaou E., Richardson C., 2007. Evaluating growth and age of netted whelk Nassarius reticulatus (Gastropoda: Nassariidae) using statolith growth rings // Marine Ecology Progress Series. V. 342. P. 163–176. https://doi.org/10.3354/meps342163
Clarke M.R., 1978. The cephalopod statolith – An introduction to its form // Journal of the Marine Biological Association of the United Kingdom. V. 58. P. 701–712. https://doi.org/10.1017/S0025315400041345
Clarke M.R., Maul G.E., 1962. A description of the ‘scaled’ squid Lepidoteuthis grimaldi Joubin 1895 // Proceedings of the Zoological Society of London. V. 139. P. 97–118. https://doi.org/10.1111/j.1469-7998.1962.tb01824.x
Dietzel M., Gussone N., Eisenhauer A., 2004. Co-precipitation of Sr2+ and Ba2+ with aragonite by membrane diffusion of CO2 between 10 and 50°C // Chemical Geology. V. 203. P. 139–151. https://doi.org/10.1016/j.chemgeo.2003.09.008
Ehlers U., 1997. Ultrastructure of the statocysts in the apodous sea cucumber Leptosynapta inhaerens (Holothuroidea, Echinodermata) // Acta Zoologica. V. 78. P. 61−68. https://doi.org/10.1111/j.1463-6395.1997.tb01127.x
Epstein S., Buchsbaum R., Lowenstam H., Urey H.C., 1951. Carbonate Water Isotopic Temperature Scale // GSA Bulletin. V. 62 (4). P. 417–426.
Espeel M., 1985. Fine structure of the statocyst sensilla of the mysid shrimp Neomysis integer (Leach, 1814) (Crustacea, Mysidacea) // Journal of Morphology. V. 186. P. 149−165. https://doi.org/10.1002/jmor.1051860203
Fisher R.A., 2015. Age, growth, size at sexual maturity and reproductive biology of channeled whelk, Busycotypus canaliculatus, in the U.S. Mid-Atlantic. VIMS Marine Resource Report № 2015-15, VSG-15-09. 28 p.
Fisher R.A., Rudders D.B., 2017. Population and reproductive biology of the channeled whelk, Busycotypus canaliculatus, in the US Mid-Atlantic // Journal of Shellfish Research. V. 36. P. 427–444. https://doi.org/10.2983/035.036.0215
Fretter V., Graham A., 1994. British Prosobranch Molluscs: their functional anatomy and ecology. Revised and updated edition. London, printed for the Ray Society.
Galante-Oliveira S., Marçal R., Ribas F., Machado J., Barroso C., 2013. Studies on the morphology and growth of statoliths in Caenogastropoda // Journal of Molluscan Studies. V. 79. P. 340−345. https://doi.org/10.1093/mollus/eyt028
Galante-Oliveira S., Marçal R., Guimarães F., Soares J., Lopes J.C., Machado J., Barroso C., 2014. Crystallinity and microchemistry of Nassarius reticulatus (Caenogastropoda) statoliths: towards their structure stability and homogeneity // Journal of Structural Biology. V. 186. P. 292−301. https://doi.org/10.1016/j.jsb.2014.03.023
Galante-Oliveira S., Marçal R., Espadilha F., Sá M., Abell R., Machado J., Barroso C., 2015. Detection of periodic Sr Ca−1cycles along gastropod statoliths allows the accurate estimation of age // Marine Biology. V. 162. P. 1473–1483. https://doi.org/10.1007/s00227-015-2684-y
Galante-Oliveira S., Pereira A., Baptista T., Guimarães F., Soares J., Lopes J. C., Machado J., Barroso C., 2019. Morphology and Ontogeny of Statoliths in the Grooved Carpet Shell, Ruditapes decussatus // Microscopy and Microanalysis. V. 25 (1). P. 244–249. https://doi.org/10.1017/S143192761801245X
Guy C., Reid N., Roberts D., 2013. Ageing of slipper limpet (Crepidula fornicata) shells from Belfast Lough // Irish Naturalist’s Journal. V. 32. P. 45–48.
Hilbig R., Anken R. H., Rahmann H., 2003. On the origin of susceptibility to kinetotic swimming behaviour in fish: A parabolic aircraft flight study // Journal of Vestibular Research. V. 12 (4). P. 185–189.
Hollyman P.R., 2017. Age, growth and reproductive assessment of the whelk, Buccinum undatum, in coastal shelf seas. PhD thesis, Bangor University. 404 p.
Hollyman P.R., Chenery S.R.N., EIMF, Ignatyev K., Laptikhovsky V.V., Richardson C.A., 2017. Micro-scale geochemical and crystallographic analysis of Buccinum undatum statoliths supports an annual periodicity of growth ring deposition // Chemical Geology. V. 526. P. 153–164. https://doi.org/10.1016/j.chemgeo.2017.09.034
Hollyman P., Leng M., Chenery S., Laptikhovsky V., Richardson C., 2017a. Statoliths of the whelk Buccinum undatum: a novel age determination tool // Marine Ecology Progress Series. V. 598. P. 261–272. https://doi.org/10.3354/meps12119
Hollyman P., Chenery S., Leng M., Laptikhovsky V., Colvin C., Richardson C., 2018. Age and growth rate estimations of the commercially fished gastropod Buccinum undatum // ICES Journal of Marine Science. V. 75 (6). P. 2129–2144. https://doi.org/10.1093/icesjms/fsy100
Hollyman P., Laptikhovsky V., Richardson C., 2018a. Techniques for Estimating the Age and Growth of Molluscs: Gastropoda // Journal of Shellfish Research. V. 37. P. 773–782. https://doi.org/10.2983/035.037.0408
Hurley G.V., Beck P., Drew J., Radtke R.L., 1979. Preliminary report on validating age readings from statoliths of the short-finned squid (Illex illecebrosus) // International commition for the Northwest Atlantic Fisheries Res. Doc. № 79/II/26, Ser. № 5352. Dartmouth, Nova Scotia: International Commission for the Northwest Atlantic Fisheries. 6 p.
Jackson G.D., 1994. Application and future potential of statolith increment analysis in squid and sepioids // Canadian Journal of Fisheries and Aquatic Sciences. V. 51. P. 2612–2625. https://doi.org/10.1139/f94-261
Kideys A.E., 1996. Determination of age and growth of Buccinum undatum L. (Gastropoda, Prosobranchia) off Douglas, Isle of Man // Helgoläander Meeresuntersuchungen. V. 50 (3). P. 353–368. https://doi.org/10.1007/BF02367109
Lewis J.R., Bowman R.S., Kendall M.A., Williamson P., 1982. Some geographical components in population dynamics: possibilities and realities in some littoral species // Netherlands Journal of Sea Research. V. 16. P. 18–28.
Lipinski M.R., 1980. A preliminary study on age of squids from their statoliths. NAFOSCR Doc. № 80/II/22. Dartmouth, Nova Scotia: Northwest Atlantic Fisheries Organization. 17 p.
Lloyd D.C., Zacherl D.C., Walker S., Paradis G., Sheehy M., Warner R.R., 2008. Egg source, temperature and culture seawater affect elemental signatures in Kelletia kelletii larval statoliths // Marine Ecology Progress Series. V. 353. P. 115–130. https://doi.org/10.3354/meps07172
Manríquez P., Galaz S., Opitz T., Hamilton S., Paradis G., Warner R., Castilla J., Labra F., Lagos N., 2012. Geographic variation in trace-element signatures in the statoliths of near-hatch larvae and recruits of Concholepas concholepas (loco) // Marine Ecology Progress Series. V. 448. P. 105–118. https://doi.org/10.3354/meps09514
Markl H., 1974. The perception of gravity and of angular acceleration in invertebrates // Vestibular System Part 1: Basic Mechanisms. Springer, Berlin, Heidelberg. P. 17–74. https://doi.org/10.1007/978-3-642-65942-3_2
Mooney C.J., Kingsford M.J., 2017. Discriminating populations of medusae (Chironex fleckeri, Cubozoa) using statolith microchemistry // Marine and Freshwater Research. V. 68. P. 1144–1152. https://doi.org/10.1071/mf16104
Morton B., 1985. Statocyst structure in the Anomalodesmata (Bivalvia) // Journal of Zoology. V. 206. P. 23−34.
Morton B., Machado F.M., 2021. The origins, relationships, evolution and conservation of the weirdest marine bivalves: The watering pot shells. A review // Advances in Marine Biology. V. 88. P. 137–220.
Naylor J.R., 2010. A brief assessment of the potential of shell growth checks as a method to age paua. Final Research Report for Ministry of Fisheries Project SEA2010-01. Ministry for Primary Industries, Wellington, New Zealand. 8 p.
Nishimura A., Yamada J., 1984. Age and growth of larval and juvenile walleye pollock Theragra chalcogramma (Pallas), as determined by otolith daily growth increments // Journal of Experimental Marine Biology and Ecology. V. 82 (2). P. 191–205. https://doi.org/10.1016/0022-0981(84)90104-7
Panella G., 1971. Fish otoliths: daily growth layers and periodical patterns // Science. V. 173. P. 1124–1127. https://doi.org/10.1126/science.173.4002.1124
Prince J.D., Sellers T.L., Ford W.B., Talbot S.R., 1988. A method for ageing the abalone, Haliotis rubra (Mollusca: Gastropoda) // Australian Marine and Freshwater Research. V. 39 (2). P. 167–175. https://doi.org/10.1071/MF9880167
Richardson C.A., 2001. Molluscs as archives of environmental change // Oceanography and Marine Biology. V. 39. P. 103–164.
Richardson C.A., Kingsley-Smith P.R., Seed R., Chatzinikolau E., 2005. Age and growth of the naticid gastropod Polinices pulchellus (Gastropoda: Naticidae) based on length frequency analysis and statolith growth rings // Marine Biology. V. 148. P. 319–326. https://doi.org/10.1007/s00227-005-0072-8
Richardson C.A., Saurel C., Barroso C.M., Thain J., 2005a. Evaluation of the age of the red whelk Neptunea antiqua using statoliths, opercula and element ratios in the shell // Journal of Experimental Marine Biology and Ecology. V. 325. P. 55–64. https://doi.org/10.1016/J.JEMBE.2005.04.024
Rosenberg A.A., Wiborg K.F., Beck I.M., 1980. Growth of Todarodes sagittatus (Lamarck) (Cephalopoda: Ommastrephidae) from the northwest Atlantic, based on counts of statolith growth rings // Sarsia. V. 66. P. 53–57. https://doi.org/10.1080/00364827.1981.10414520
Roussel S., Huchette S., Clavier J., Chauvaud L., 2011. Growth of the European abalone (Haliotis tuberculata L.) in situ: seasonality and ageing using stable oxygen isotopes // Journal of Sea Research. V. 65. P. 213–218. https://doi.org/10.1016/j.seares.2010.10.001
Power A., Sellers C., Walker R., 2009. Growth and sexual maturity of the knobbed whelk, Busycon carica (Gmelin, 1791) from a commercially harvested population in coastal Georgia. Occasional papers of the University of Georgia Marine Extension Service. V. 4. 24 p.
Santarelli L., Gros P., 1985. Dejtermination de l’ â ge et de la croissance de Buccinum undatum L. (Gastropoda, Prosobranchia) a l’aide des isotopes stables de la coquille et de l’ornementation operculaire // Ocean Acta. V. 8 (2). P. 221–229.
Schöne B.R., Rodland D.L., Wehrmann A., Heidel B., Oschmann W., Zhang Z., Fiebig J., Beck L., 2007. Combined sclerochronologic and oxygen isotope analysis of gastropod shells (Gibbula cineraria, North Sea): life-history traits and utility as a high-resolution environmental archive for kelp forests // Marine Biology. V. 150. P. 1237–1252. https://doi.org/10.1007/s00227-006-0435-9
Shepherd S.A., Al-Wahaibi D., Al-Azri A.R., 1995. Shell growth checks and growth of Omani abalone Haliotis mariae // Marine and Freshwater Research. V. 46. P. 575–582. https://doi.org/10.1071/MF9950575
Shepherd S.A., Woodby D., Rumble J.M., Avalos-Borja M., 2000. Microstructure, chronology and growth of the pinto abalone, Haliotis kamtschatkana, in Alaska // Journal of Shellfish Research. V. 19. P. 219–228.
Spangenberg D., Beck C.W., 1968. Calcium sulfate dehydrate statoliths in Aurelia // Transactions of the American Microscopical Society. V. 87 (3). P. 329–335. https://doi.org/10.2307/3224817
Stevenson D.K., Campana S.E. (ed.), 1992. Otolith microstructure examination and analysis // Canadian Special Publication of Fisheries and Aquatic Sciences. V. 117. P. 1–126.
Ueno S., Imai C., Mitsutani A., 1995. Fine growth rings found in statolith of a cubomedusa Carybdea rastoni // Journal of Plankton Research. V. 17 (6). P. 1381–1384. https://doi.org/10.1016/j.jcz.2006.03.001
Williamson R., 1995. A sensory basis for orientation in cephalopods // Journal of the Marine Biological Association of the United Kingdom. V. 75 (1). P. 83–92. https://doi.org/10.1017/S0025315400015216
Williamson R., Kendall M.A., 1981. Population age structure and growth of the trochid Monodonta lineata determined from shell rings // Journal of the Marine Biological Association of the United Kingdom. V. 61. P. 1011–1026. https://doi.org/10.1017/S0025315400023122
Yamashita T., 1957. Über den Statolithen in den Sinneskörpern der Meduse Aurelia aurita // Zoo Biology. V. 109. P. 111–115.
Yoshimura T., Tamenori Y., Suzuki A., Kawahata H., Iwasaki N., Hasegawa H., Nguyen L.T., Kuroyanagi A., Yamazaki T., Kuroda J., Ohkouchi N., 2017. Altervalent substitution of sodium for calcium in biogenic calcite and aragonite // Geochimica et Cosmochimica Acta. V. 202. P. 21–38. https://doi.org/10.1016/j.gca.2016.12.003
Zacherl D.C., Manríquez P.H., Paradis G., Day R.W., Castilla J.C., Warner R.R., Lea D.W., Gaines S.D., 2003. Trace elemental fingerprinting of gastropod statoliths to study larval dispersal trajectories // Marine Ecology Progress Series. V. 248. P. 297–303. https://doi.org/10.3354/meps248297
Zacherl D.C., Paradis G., Lea D.W., 2003a. Barium and strontium uptake into larval protoconchs and statoliths of the marine neogastropod Kelletia kelletii // Geochimica et Cosmochimica Acta. V. 67. P. 4091–4099. https://doi.org/10.1016/s0016-7037(03)00384-3
Zumholz K., Klügel A., Hansteen T., Piatkowski U., 2007. Statolith microchemistry traces the environmental history of the boreoatlantic armhook squid Gonatus fabricii // Marine Ecology Progress Series. V. 333. P. 195–204. https://doi.org/10.3354/meps333195
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


