Зоологический журнал, 2023, T. 102, № 2, стр. 141-152
Двустворчатый моллюск Mya arenaria Linnaeus 1758 (Myidae) на мелководных участках губ Зеленецкая и Ярнышная Баренцева моря: особенности аллометрического роста
О. В. Смолькова a, *, Н. И. Мещеряков a, **
a Мурманский морской биологический институт РАН
183010 Мурманск, Россия
* E-mail: sm.olj@mail.ru
** E-mail: meshcheriakov104@mail.ru
Поступила в редакцию 04.07.2022
После доработки 20.08.2022
Принята к публикации 23.08.2022
- EDN: ETZUVE
- DOI: 10.31857/S0044513423010099
Аннотация
Представлены результаты исследований биологии двустворчатого моллюска M. arenaria на литорали губ Зеленецкая и Ярнышная Баренцева моря. Дана характеристика особенностям относительного роста различных частей тела. В губе Зеленецкая средняя плотность поселения моллюсков 40.0 ± 0.13 экз./м2, биомасса 279.7 ± 0.86 г/м2, в губе Ярнышная 62.6 ± 0.29 экз./м2 и 141.9 ± 0.60 г/м2 соответственно. Впервые проведен подробный гранулометрический анализ грунта исследованных участков, определено содержание органического вещества. Установлено, что исследованные районы различаются по составу донных отложений. Среднее содержание органического вещества на литорали губы Зеленецкая 0.8%, губы Ярнышная 2.2%. Показано, что формообразование раковины определяется адаптациями к условиям жизни и отражает различную размерно-возрастную структуру поселений M. arenaria. У моллюсков старших возрастных групп относительный рост происходит по принципу слабой отрицательной аллометрии, у молодых особей раковина нарастает изометрически.
Mya arenaria (L. 1758) – это крупные двустворчатые моллюски, зарывающиеся в грунт. Моллюски широко распространены в северном полушарии (Conde et al., 2010). Встречаются как на атлантическом и тихоокеанском побережьях Северной Америки, так и в морях Арктического региона (Баренцево, Белое море) и Восточной Атлантики (Балтийское, Черное и Средиземное моря) (Максимович, 1979; Carlton, 1992; Strasser, 1999; Wheaton, 2008). М. аrепаriа обитают на литорали и ведут малоподвижный образ жизни, способны выдерживать изменение факторов среды в широких диапазонах. Благоприятная температура для их жизнедеятельности составляет от 2 до 28°C (Baker, Mann, 1990). Абсолютно приемлемым для данного вида является изменение солености от 1 до 30‰ (Хлебович, Станкявичюс, 1979). Кроме того, моллюск обладает значительной устойчивостью к высокому содержанию сероводорода и дефициту кислорода (Thamdrup, 1935; Baker, Mann, 1990). Однако, вопреки высокой толерантности M. arenaria к изменению солености, температуры и химического состава среды, распространение моллюска на литорали тесно связано с составом грунта (Свешников, 1963). Моллюски играют важную роль в прибрежных водах в качестве фильтраторов, связывают взвешенное органическое вещество водной толщи, способствуют накоплению отложений на дне и, таким образом, используют первичную продукцию и улучшают качество воды (Pedersen, 1992; Riisgard, Seerup, 2003; Forster, Zettler, 2004).
Изучению особенностей биологии и экологии M. arenaria посвящено немало работ (Максимович, 1978; Schaffer, Zettler, 2007; Cardoso et al., 2009; Gerasimova et al., 2016). В России исследования данного вида проводились в основном в Белом и Балтийском морях, также имеются некоторые работы по изучению мии из Азово-Черноморского бассейна (Бешевли, Колягин, 1967; Савчук, 1970; Золотницкий, Сытник, 2020). Много работ связано с эволюционной историей и таксономией моллюсков рода Mya (MacNeil, 1965; Bernard, 1979; Petersen, 1999; Bouchet, Gofas, 2013; ITIS, 2017). В дальневосточных морях ведется комплексная таксономическая работа по изучению экологии, морфологии и особенностей распространения M. japonica, близкородственного для M. arenaria вида (Zhang et al., 2018). Информация о биологии и особенностях распространения моллюсков M. arenaria в Баренцевом море очень фрагментарна. С начала прошлого века данный вид неоднократно отмечается в составе баренцевоморской литоральной фауны (Дерюгин, 1915; Гурьянова и др., 1929; Любина и др., 2009; Фролов, 2009), тем не менее количественные представления о современном состоянии сообществ баренцевоморской M. arenaria, об особенностях роста и продукционном потенциале вида не сформированы. Однако исследование особенностей биологии долгоживущих эврибионтных видов представляет большой научный интерес как для понимания адаптивных особенностей организмов в онтогенезе, так и для оценки влияния на эти организмы различных экологических факторов (колебания солености и температуры, сильные штормы, выбросы загрязняющих веществ). В литературе встречаются исследования, указывающие на значимость методов анализа роста раковин для реконструкции экологических событий с целью мониторинга окружающей среды (Kennish, Olsson, 1975). Кроме того, модели роста показывают, насколько приливные, суточные и сезонные циклы влияют на протекание основных физиологических процессов в организме (питание, дыхание, скорость метаболизма и репродуктивный цикл).
Цель нашего исследования – изучение поселений двустворчатых моллюсков M. arenaria на мелководных участках губы Зеленецкая и губы Ярнышная Баренцева моря, расчет и анализ морфометрических характеристик роста различных частей тела мии, подробное описание гранулометрического состава донных отложений в месте наибольшего скопления моллюсков на литорали.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены на литорали губы Ярнышная и губы Зеленецкая (Дальний пляж) Баренцева моря в июле 2021 г. (рис. 1).
Количественный учет M. arenaria производили на литорали во время отлива рамкой площадью 0.1 м2. Пробы отбирали с глубины 30 см и промывали через сито с размером ячеи 0.5 мм. Собранных моллюсков помещали в ведра с морской водой и транспортировали в лабораторию для проведения биологического анализа. В каждом районе отбирали по 10 проб. Соленость и температуру воды измеряли одновременно с отбором проб с помощью портативных рефрактометра и термометра.
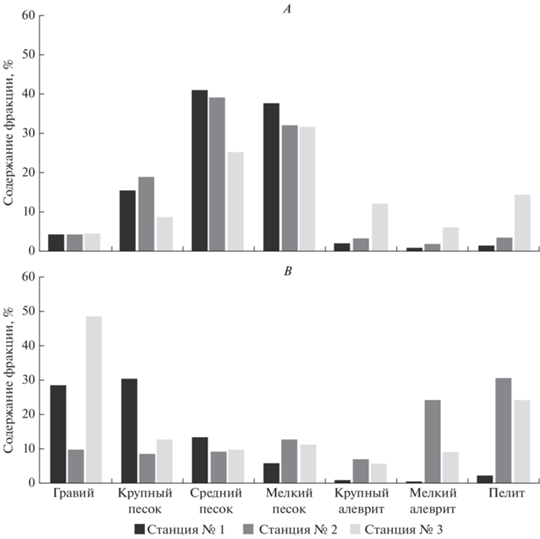
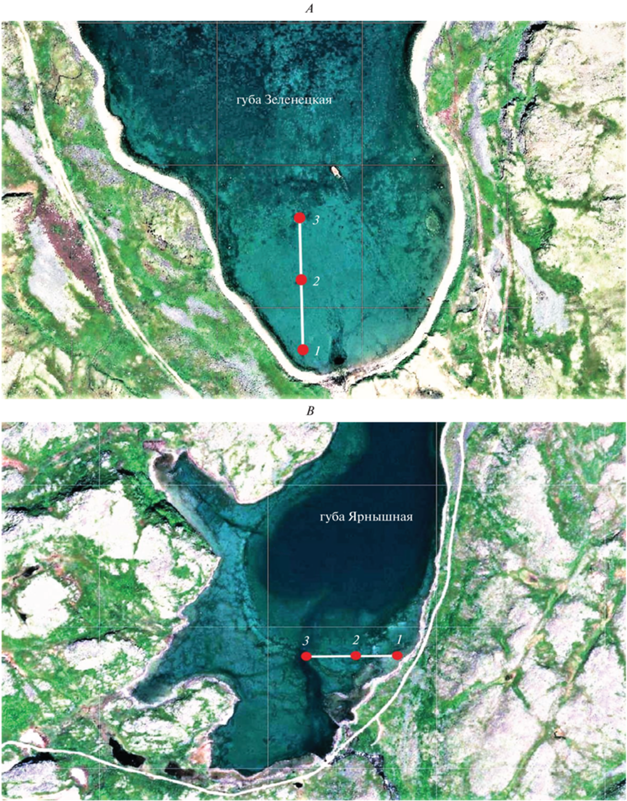
Для определения гранулометрического состава грунта выполнено 2 разреза в приливно-отливной зоне исследованных участков (рис. 2А, 2B). Каждый разрез включает в себя 3 станции отбора проб, ориентированные по направлению от берега к урезу воды в отлив. Грунт отбирали с помощью колонок с внутренним диаметром 7 см. Мощность вскрытой осадочной толщи на каждой точке составила 20 см. В каждой колонке выделили 3 горизонта 0–5, 5–10 и 10–20 см. Пробы обрабатывали при использовании гранулометрического анализа по методике, разработанной “ВНИИОкеангеология” (Андреева, Лапина, 1998), типы донных отложений выделяли согласно интерпретации Клёновой (1948). Также определили долю потери массы осадка при прокаливании (ППП), в качестве косвенного показателя содержания органики в донных отложениях. Всего было собрано, обработано и проанализировано 18 проб донных отложений.
Рис. 2.
Схемы расположения трансект для количественного учета M. arenaria и станции отбора проб для гранулометрического анализа донных отложений: А – губа Зеленецкая (Дальний пляж), B – губа Ярнышная; 1–3 – номера станций отбора проб грунта.
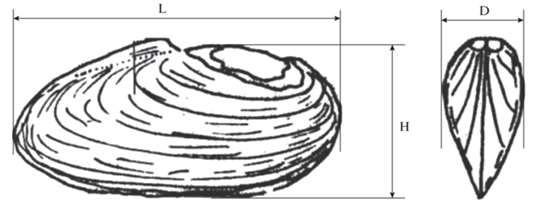
При биологическом анализе у каждого моллюска измеряли длину (L, мм), высоту (H, мм) и выпуклость раковины (D, мм) (рис. 3). Эти параметры использовали для вычисления коэффициентов удлинения (H/L) и выпуклости (D/L, D/H) раковины мии в процессе роста моллюсков. Одновременно с этим определяли общую (живую) массу моллюска (W, г), массу раковины (Wr, г), мягких тканей (Wm, г) и сифона (Ws, г). Взвешивание производили на электронных весах с точностью до 0.01 г. после просушивания компонентов на фильтровальной бумаге. Возраст определяли по внешней морфологии раковины, подсчитывая годичные кольца, которые образуются при зимней остановке роста и которые представляют собой утолщенные линии нарастания (Скарлато, 1990; Haskin, 1954). Всего за период исследований собрано и обработано 103 экз. M. arenaria (40 в губе Зеленецкая, 63 в губе Ярнышная).
Рис. 3.
Схема измерения (мм) раковины двустворчатых моллюсков (Наумов, 2006): L – длина, H – высота, D – выпуклость.
Связь между различными частями тела мии исследовали на основании онтогенетических изменений раковин моллюсков, описываемых уравнением простой аллометрии (Алимов, 1981):
где X и Y – исследуемые параметры моллюсков; a, b – коэффициенты. Анализ выборки проведен из совокупности, включающей особей разного размера и возраста.Данные проанализированы с помощью регрессионного анализа.
Характер распределения количественных и размерных показателей оценивали по критерию Колмогорова–Смирнова. Достоверность различий между средними определяли, используя индекс Уилкоксона–Манна–Уитни. Различия считали недостоверными при р ≥ 0.05. Математические расчеты проводили с помощью программного пакета STATISTICA 10.0 и электронных таблиц MS Excel-2010.
РЕЗУЛЬТАТЫ
Условия обитания Mya arenaria. Осмотр прибрежной части губы Зеленецкая показал, что моллюски обитают преимущественно в восточной части губы на илисто-песчаной литорали (Дальний пляж), в бухте Оскара они встречаются единично, не образуя плотного поселения. Литораль Дальнего пляжа пологая, в кутовой части имеет протяженность более 200 м. Соленость у уреза воды в отлив и в литоральных лужах в июле 2021 составляла 32–34‰. Температура воды поднималась до 15°С, поверхностный слой грунта (5 см) прогревался до 21°С.
Поселение моллюсков Дальнего пляжа сосредоточено в среднем и нижнем горизонтах литорали, вблизи ручья. По данным наших исследований, донные отложения губы Зеленецкая в нижней части литорали (станция № 3) представлены песком, который на глубине залегания 10 см замещается песчанистым илом с примесью разнозернистого песка и гравия (рис. 4А). В центральной части литорали (станция № 2) донные отложения также представлены песком, который на глубине залегания 10 см замещается более тонким материалом – илистым песком. В верхней части литорали (станция № 1) по всей вскрытой толще распространен песок. Содержание органики увеличивается с 0.4% в верхней части литорали до 0.8–2.8% к урезу воды.
Плотность поселения моллюсков Дальнего пляжа варьирует от 1 до 64 экз./м2. Средняя плотность поселения составляет 40.0 ± 0.13 экз./м2, биомасса – 279.7 ± 0.86 г/м2. Наибольшей плотности (более 60 экз./м2) поселение достигает на участках нижней части литорали, представленных разнозернистым песком, с примесью крупного алеврита (12%), пелита (до 14%) и максимальным содержанием органического вещества (до 2.8%). В верхней части литорали, где донные отложения сложены исключительно песчанистыми фракциями (93%), а содержание органического вещества не превышает 0.4%, плотность поселения минимальна и не превышает (3–7 экз./м2).
В губе Ярнышная M. arenaria встречается в южной кутовой части. Литораль имеет протяженность до 400 м в кутовой части, пологая. Соленость в северной части 33‰, к югу она снижается до 19‰. Температура воды в литоральных лужах и на поверхности грунта (5 см) летом достигала 20°С, около уреза воды в отлив – 17°С.
В нижней части литорали (станция № 3) осадки представлены разнозернистым песком с примесью гравия более 25% (рис. 4Б). С увеличением глубины залегания доля гравия увеличивается, на глубине 5–10 см до 40%, после 10 см до 70%. Для центральной части (станция № 2) литорали характерно распространение илистого песка, которой с увеличением глубины залегания замещается илом. При этом отмечается примесь гравийного материала (7–9%) по всей вскрытой осадочной толще. В верхней части литорали (станция № 1) верхний слой осадков сложен разнозернистым песком и гравием, на глубине залегания 5–10 см отмечена фация плохо сортированных осадков, сложенных в равной степени гравием, разнозернистым песком и алевритопелитовым материалом. На глубине 10–20 см осадки представлены илом, с примесью разнозернистого песка и гравия. Содержание органического вещества на литорали также разнообразно. В нижней части литорали (около ручья) доля органических веществ составляет от 0.3 до 1%, при этом максимальное значение этого показателя отмечено в слое 5–10 см. В центральной части литорали отмечено наибольшее содержание органического вещества в донных отложениях (4.5%). При этом на поверхности содержание органики составляет 1%, а с глубиной увеличивается до 6.3%. В верхней части литорали количество органического вещества увеличивается с 0.5 на поверхности до 2.9% в слое 10–20 см.
Поселение M. arenaria расположено в южной части губы, где донные отложения представлены разнозернистым или илистым песком с примесью гравийного материала. Моллюски занимают преимущественно средний горизонт литорали. Плотность поселения варьирует от 5 до 74 экз./м2. Средняя плотность поселения моллюсков составляет 62.6 ± 0.29 экз./м2 при биомассе 141.9 ± 0.60 г/м2. Наибольшей плотности (75 экз./м2) поселение достигает на участках илистого песка, который с глубиной залегания замещается илом с примесью гравийного материала (7–9%), наименьшая плотность (3 экз./м2) отмечена на участках, где донные отложения сложены разнозернистым песком с примесью гравия более 25%.
Для исследованных районов отмечена сильная обратная корреляционная связь между содержанием в грунте мелких алевритовых и пелитовых фракций и плотностью поселения моллюсков (r = –0.9995). Также отрицательной корреляционной зависимостью (r = –0.9979) плотность поселения связана с содержанием органического вещества в поверхностном слое грунта.
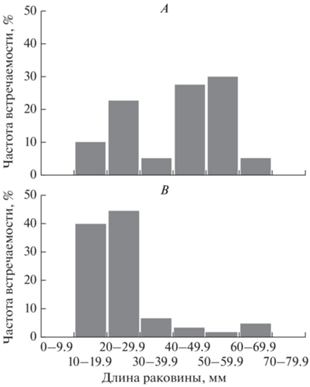
Биология Mya arenaria. Размерно-возрастной состав поселений. Размеры моллюсков в исследованных районах варьировали от 16.9 до 63.7 мм в губе Зеленецкая, от 10.2 до 66.9 мм в губе Ярнышная. В губе Зеленецкая наиболее часто встречаются моллюски, размер которых составляет от 50.0 до 59.9 мм (30%) и 40.0–49.9 (27.5%) Длина самого крупного экземпляра из числа найденных из указанного района была 63.1 мм, его возраст составлял 9 лет (рис. 5B). Размерное распределение мий на литорали губы Ярнышная представлено некрупными моллюсками с длиной раковины 10.0–19.9 мм (39.7%) и 20.0–29.9 мм (44.4%) (рис. 5А). Доля крупных особей размером более 60 мм была незначительна (4.6%). Длина самого крупного моллюска составляла 66.9 мм, масса тела – 24.62 г, возраст – 13 лет. В табл. 1 представлены морфометрические измерения моллюсков, обитающих в губах Зеленецкая и Ярнышная.
Таблица 1.
Морфометрические показатели моллюсков M. arenaria, обитающих в губах Зеленецкая и Ярнышная
| Показатель | Районы исследований | |||
|---|---|---|---|---|
| Губа Ярнышная | Губа Зеленецкая | |||
| Среднее | Стандартная ошибка | Среднее | Стандартная ошибка | |
| Длина раковины, мм | 25.2 | 1.5 | 41.2 | 2.3 |
| Высота раковины, мм | 15.0 | 0.9 | 24.4 | 1.3 |
| Выпуклость раковины, мм | 9.2 | 0.6 | 15.3 | 0.9 |
| Общая масса, г | 2.3 | 0.6 | 7.0 | 0.9 |
| Масса раковины, г | 1.6 | 0.4 | 3.2 | 0.4 |
| Масса мягких тканей, г | 1.4 | 0.3 | 3.8 | 0.4 |
| Масса сифона, г | 1.5 | 0.1 | 1.7 | 0.2 |
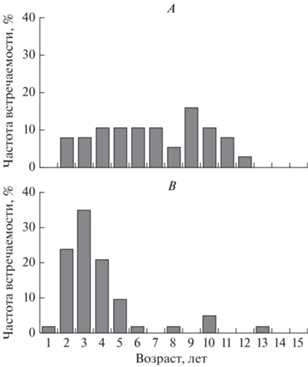
Возрастной состав поселений M. arenaria в 2021 году в губах значительно различался. На литорали губы Зеленецкая (рис. 6B) возрастной ряд у моллюсков был достаточно равномерным и был представлен моллюсками в возрасте от 2 до 12 лет, наибольшей частотой встречаемости отмечена возрастная группа 9+ (15.8%). Моллюски в возрасте 4–7 и 10 лет составили по 10.5% в выборке. Единично встречен моллюск 12 лет.
В губе Ярнышная (рис. 6А) возраст мий был от 1 до 13 лет. Доминировали здесь моллюски младших возрастных групп в возрасте 2–4 года (79.4%) с длиной раковины от 10.2 до 29.6 мм. Доля особей в возрасте 5 и 10 лет составляла 9.5 и 4.8% соответственно. Единично в выборке нами были отмечены особи в возрасте 6, 8, 13 лет (1.6%). Существенная доля молоди свидетельствует о том, что 2017–2019 годы были благоприятные для пополнения поселения.
Аллометрический рост. Изучение относительных изменений длины (L) и высоты (H) раковин мии показало, что связь параметров для моллюсков губы Зеленецкая имеет вид H = 0.715 ± ± 0.004L0.9499±0.031, n = 40, R2 = 0.991 (рис. 7А), в губе Ярнышная H = 0.595 ± 0.002L1.0007±0.026, n = 63, R2 = 0.993 (рис. 7B). Среднее значение отношения высоты к длине мии (индекс H/L) в губе Зеленецкая и губе Ярнышная 0.597, т.е. высота составляет в среднем 59.7% от длины моллюска, со стандартным отклонением SD = 0.026 и варьированием минимальных и максимальных значений в пределах 0.53–0.64.
Рис. 7.
Зависимость высоты (H, 1) и толщины (D, 2) от длины (L) раковины M. arenaria в губах Зеленецкая (А) и Ярнышная (B).
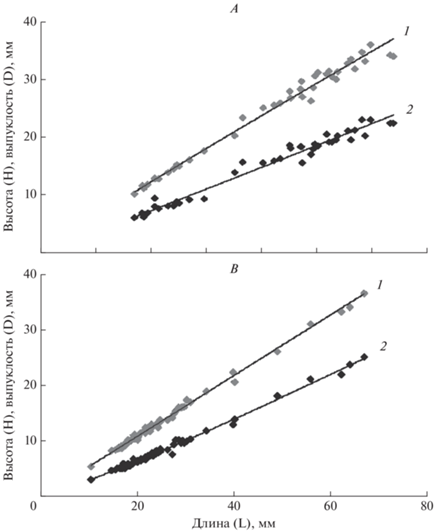
Уравнение зависимости выпуклости раковины (D) от длины раковины (L) у M. arenaria губы Зеленецкая имеет вид D = 0.343 ± 0.004L1.0208±0.037, n = 40, R2 = 0.972 (рис. 7А), в губе Ярнышная D = = 0.245 ± 0.003L11202±0.024, n = 63, R2 = 0.988 (рис. 7B).
Величина отношения толщины к длине мии (D/L) составила 0.371 (37.1%) при SD = 0.023 в губе Зеленецкая, и несколько меньшее значение 0.359 (35.9%) в губе Ярнышная.
Расчеты, проведенные для моллюсков из губы Ярнышная, показали, что взаимосвязь длины и высоты раковины характеризуется изометрией (коэффициент регрессии b несколько превышает или равен 1), а изменения толщины (выпуклости) раковины относительно ее длины имеют выраженную положительную аллометрию (b составляет более 1.1).
Соотношение размерно-весовых характеристик моллюсков описывается аллометрическими уравнениями:
W = 1.0 ± 0.34 × 10–4L2.9 ± 0.07, R2 = 0.96 – для губы Ярнышная;
W = 0.6 ± 0.41 × 10–4L3.1 ± 0.2, R2 = 0.99 – для губы Зеленецкая.
В губе Ярнышная увеличение массы тела моллюсков происходит медленнее роста раковины в длину и зависимость параметров характеризуется отрицательной аллометрией (b < 3). В губе Зеленецкая b = 3.1, т.е. рост протекает с сохранением геометрического подобия, без изменения формы раковины (изометрический рост).
Изучение аллометрических отношений между весовыми параметрами моллюсков и анализ относительного роста массы мягких тканей (Wm), массы сифона (Ws) и раковины (Wr) от общей массы целого моллюска (W) представляет особый интерес для решения ряда практических задач и оценки возможности использования M. arenaria в марикультуре. Статистический анализ показал, что связь между параметрами описывается линейной функцией с коэффициентами детерминации R2 = 0.95–0.99. Доля средней массы раковины (Wr/W) мии в губе Зеленецкая составила 45%, с колебаниями от 37 до 59% (табл. 2). Средняя масса мягких тканей составляет 55% относительно общей массы (табл. 2) при изменчивости от 41 до 63%. Масса сифона составляет 19% от общей массы тела. Соотношение Wr/W в губе Ярнышная составляет 47%, масса мягких тканей 53%, масса сифона – 8% от общей массы моллюсков. Значения коэффициентов корреляции представлены в табл. 2. Значения варьируются слабо и находятся в диапазоне 0.95–0.99. Самые низкие значения r для соотношения Ws/W, %.
Таблица 2.
Данные регрессионного анализа и коэффициент корреляции, рассчитанные для весовых параметров моллюсков
| Показатель, % | М ± SD | min–max | a | b | r |
|---|---|---|---|---|---|
| Губа Зеленецкая | |||||
| Wr/W | 45.3 ± 0.05 | 37.1–58.7 | 0.05 ± 0.007 | 0.45 ± 0.123 | 0.988 |
| Wm/W | 54.7 ± 0.05 | 41.3–62.9 | –0.05 ± 0.007 | 0.55 ± 0.324 | 0.981 |
| Ws/W | 18.7 ± 0.07 | 3.6–37.9 | –0.05 ± 0.008 | 0.21 ± 0.076 | 0.955 |
| Губа Ярнышная | |||||
| Wr/W | 47.2 ± 0.05 | 32.5–58.4 | –0.57 ± 0.005 | 0.11 ± 0.009 | 0.997 |
| Wm/W | 52.9 ± 0.05 | 41.6–67.5 | 0.09 ± 0.005 | 0.45 ± 0.360 | 0.998 |
| Ws/W | 7.7 ± 0.05 | 4.1–23.2 | –0.05 ± 0.006 | 0.14 ± 0.113 | 0.975 |
ОБСУЖДЕНИЕ
Согласно результатам нашего исследования мелководные участки губ Ярнышная и Зеленецкая Баренцева моря представляют собой типичные, характерные для поселений M. arenaria биотопы. Это кутовые участки различных губ с илисто-песчаной литоралью, где моллюски образуют довольно плотные поселения.
Гранулометрический состав грунта на литорали губы Ярнышная разнообразный и изменяется от разнозернистого песка с примесью гравия в нижней и верхней частях литорали до илистого песка в центральной части. Донные отложения губы Зеленецкая в нижней части литорали представлены песком, который на глубине залегания 10 см замещается песчанистым илом с примесью разнозернистого песка и гравия. Среднее содержание органического вещества составляет 0.8% в губе Зеленецкая, 2.2% – в губе Ярнышная.
Средняя плотность поселения моллюсков в губе Зеленецкая составляет 40.0 ± 0.13 экз./м2, биомасса – 279.7 ± 0.86 г/м2. Наибольшую плотность поселения (75 экз./м2) моллюски формируют на участках, представленных илистым песком с незначительной (до 9%) примесью гравийного материала, наименьшую (3 экз./м2) – на участках, сложенных разнозернистым песком с примесью гравия более 25%. В губе Ярнышная средняя плотность поселения 62.6 ± 0.29 экз./м2 при биомассе 141.9 ± 0.60 г/м2. Наибольшая (60 экз./м2) – на участках разнозернистого песка с примесью (до 14%) алевритовых и пелитовых фракций, наименьшая – в местах, где донные отложения более чем на 90% состоят из песчанистых фракций.
Тесная связь между составом грунта и количественными показателями поселений M. arenaria была показана в работах В.А. Свешникова на Белом море в 1963 г., где отмечается, что наличие в грунте грубообломочного материала неблагоприятно сказывается на жизни моллюсков, затрудняет закапывание и приводит к сдавливанию раковин моллюсков. По результатам проведенного подробного анализа донных отложений на мелководных участках губ Ярнышная и Зеленецкая, выявлено, что присутствие гравийного материала в пределах 7–9% является допустимым для жизни и успешного закапывания M. arenaria. Грунт, представленный илистым или разнозернистым песком с содержанием алевритовых и пелитовых фракций не менее 20%, вполне пригоден для построения неоплывающих норок.
Количественные характеристики M. arenaria в исследованных районах достаточно высокие и сопоставимы с показателями обилия моллюсков в других географических районах, а иногда и гораздо выше этих показателей. Схожие показатели обилия отмечаются в Белом море на литорали губы Северная (46.7 экз./м2) Кандалакшского залива (Щербакова, 2006), губы Колежемская (66.7 экз./м2) Онежского залива (Smolkova, 2021). В Керченском проливе Черного моря плотность поселений моллюсков M. arenaria составляет 23 экз./м2 (Иванов, Синегуб, 2008), на литорали губы Долгая Кандалакшского залива – 25.4 экз./м2 (Щербакова, 2006), что практически в 2 раза ниже показателей обилия данного вида на литорали исследованных районов Восточного Мурмана.
Характер аллометрического роста моллюсков из разных поселений различается. Рассчитанные величины параметров уравнения аллометрического роста показали, что у M. arenaria губы Зеленецкая формообразование раковины происходит по принципу слабой отрицательной аллометрии (b ≤ 1), близкой к изометрии. Отрицательная аллометрия указывает на то, что нарастание высоты и толщины (выпуклости) раковины относительно ее длины у моллюсков, собранных в губе Зеленецкая, происходит медленнее, поэтому раковина имеет уплощенную форму. Полученные данные согласуются с результатами исследований, проведенных для моллюсков M. arenaria северо-западной части Черного моря (Савчук, 1976) и южной части Азовского моря (Золотницкий, Сытник, 2020), губы Хлебная Кольского залива (Смолькова, Мещеряков, 2022).
Для поселений M. arenaria губы Ярнышная характерны более высокие показатели роста (коэффициенты a и b) по сравнению с показателями для губы Зеленецкая. Скорее всего это связано с размерно-возрастными особенностями поселений. В губе Зеленецкая основную долю в поселении составляют взрослые мии, относительный рост которых идет по принципу отрицательной аллометрии, и особи имеют уплощенную раковину. В губе Ярнышная поселение состоит преимущественно из моллюсков младших возрастных групп (2–4 года), и относительное изменение размеров характеризуется выраженной положительной аллометрией. Вектор роста раковины в толщину (выпуклость) преобладает. Молодые моллюски, населяющие поверхностный слой грунта, в большей степени подвержены воздействию динамичной внешней среды (приливно-отливные течения, волновые нагоны), чем взрослые особи, которые занимают более глубокие горизонты грунта. Выпуклая раковина позволяет молодым моллюскам легче удерживаться в поверхностных слоях илисто-песчаных донных отложений.
Анализ соотношения размерно-весовых характеристик показал, что коэффициенты a, отражающие силу взаимодействия исследуемых параметров друг относительно друга, имеют в исследованных районах существенные различия. Прирост массы у моллюсков в губе Ярнышная происходит быстрее, чем у моллюсков из губы Зеленецкая (табл. 2). Более высокий прирост биомассы у моллюсков из губы Ярнышная в 2021 г., скорее всего, связан с трофическим фактором и содержанием органического вещества в грунте.
Для M. arenaria, которые являются инфаунными малоподвижными животными и всю свою жизнь проводят в грунте, важным фактором, определяющим прирост биомассы, является трофический. Моллюски заселяют кутовые участки различных губ с вытекающими на литораль ручьями, которые выносят достаточное количество органического вещества, что в свою очередь обеспечивает успешное протекание важных физиологических процессов у моллюсков (питание, дыхание, размножение). Содержание органического вещества донных отложений в местах наибольшего скопления моллюсков на литорали губы Ярнышная варьирует от 1.6 до 4.5%, в губе Зеленецкая этот показатель не превышает 1.4%.
Связь длины с массой тела может существенно варьировать в зависимости от различных факторов среды (Feder, Paul, 1974; Miac et al., 1997). В работах по изучению аллометрического роста мии в Белом (Максимович, 1978), Балтийском (Schaffer, Zettler, 2007) и Азовском (Золотницкий, Сытник, 2020) морях получены немного иные коэффициенты a и b (табл. 3), что объясняется различными условиями окружающей среды в разных географических районах.
Таблица 3.
Параметры уравнений зависимости общей массы от длины раковины моллюсков M. arenaria губ Зеленецкая и Ярнышная и других районов исследования
| Район исследования | a | b | Ссылка |
|---|---|---|---|
| Баренцево море (губа Зеленецкая) | 0.6 × 10–4 | 3.10 | Смолькова, 2021 |
| Баренцево море (губа Ярнышная) | 1.0 × 10–4 | 2.90 | Смолькова, 2021 |
| Баренцево море (губа Хлебная) | 3.5 × 10–4 | 2.08 | Смолькова, 2022 |
| Белое море (губа Чупа) | 2.0 × 10–4 | 2.86 | Максимович, 1978 |
| Балтийское море (устье р. Варнов) | 1.8 × 10–4 | 2.75 | Schaffer, Zettler, 2007 |
| Азовское море (бухта Булганак) | 1.6 × 10–4 | 2.90 | Золотницкий, Сытник, 2020 |
Помимо прочего, M. arenaria обладают высокой пластичностью и способны выдерживать критические значения различных факторов среды (соленость, температура, содержание кислорода и сероводорода), что дает возможность моллюскам адаптироваться и формировать поселения с высокой плотностью в районах, неблагоприятных для других, менее устойчивых к изменениям среды видов-конкурентов.
ЗАКЛЮЧЕНИЕ
Представленные исследования позволили получить информацию о современном состоянии поселений двустворчатого моллюска M. arenaria на литорали губ Зеленецкая и Ярнышная Баренцева моря и охарактеризовать некоторые особенности относительного роста различных частей тела. Впервые проведен подробный гранулометрический анализ донных отложений исследованных участков, определено содержание органического вещества.
Формообразование раковины отражает различную размерно-возрастную структуру поселений M. arenaria. У моллюсков старших возрастных групп относительный рост происходит по принципу слабой отрицательной аллометрии, у молодых особей раковина нарастает изометрически. Прирост общей массы у моллюсков в губе Ярнышная выше, чем в губе Зеленецкая. Основными показателями, определяющими наиболее благоприятные условия жизни, являются содержание в грунте органического вещества в пределах от 1.6 до 4.5%, состав донных отложений, характеризующийся преобладанием илистого песком с примесью гравийного материала не более 7–9%, и высокая устойчивость моллюсков к изменению условий среды.
Полученные данные о биологии двустворчатого моллюска M. arenaria на мелководных участках губ Ярнышная и Зеленецкая Баренцева моря в дальнейшем послужат базой для мониторинга возможных изменений, вызванных антропогенным воздействием или климатическими флуктуациями. Кроме того, с помощью этих данных можно решать практические задачи, связанные с использования M. arenaria в марикультуре.
Список литературы
Алимов А.Ф., 1981. Функциональная экология пресноводных двустворчатых моллюсков // Труды Зоол. ин-та АН СССР. Л.: Наука, Ленинградское отделение. Т. 96. С. 137–154.
Андреева И.А., Лапина Н.Н., 1998. Методика гранулометрического анализа донных осадков Мирового океана и геологическая интерпретация результатов лабораторного изучения вещественного состава осадков. Изд. СПб.: ВНИИОкеангеология. 45 с.
Бешевли Л.Е., Колягин В.А., 1967. О находке моллюска Муа arenaria (Bivalvia) в северо-западной части Черного моря // Вестник зоологии. № 3. С. 82–84.
Гурьянова Е.Ф., Закс И.Г, Ушаков П.В., 1929. Литораль Кольского залива. Ч. II // Труды Ленингр. общества естествоиспытателей. Т. 59. Вып. 2. С. 17–107.
Дерюгин К.М., 1915. Фауна Кольского залива и условия ее существования // Зап. Имп. Академии наук. СПб. Т. 34. № 1. 929 с.
Золотницкий А.П., Сытник Н.А., 2020. Характеристика аллометрического роста песчаной ракушки мии (Mya arenaria Linnaeus, 1758) Южной части Азовского моря // Водные биоресурсы и среда обитания. Т. 3. № 3. С. 56–66. http://journal.azniirkh.ru, www.azniirkh.ru ISSN 2618-8147 print, ISSN 2619-1024
Иванов Д.А., Синегуб И.А., 2008. Трансформация биоценозов Керченского пролива после вселения хищного моллюска Rapana thomasiana и двустворчатых Mya arenaria и Сunearca cornea // Современные проблемы экологии Азово-Черноморского региона. Материалы III Международной конференции. Керчь. С. 45–51.
Клёнова М.В., 1948. Геология моря. М.: Учпедгиз. 182 с.
Любина О.С., Ахметчина О.Ю., Фролова Е.А., Фролов А.А., Дикаева Д.Р., Гарбуль Е.А., 2009. Зообентос литорали и сублиторали. Количественное распределение, пространственно-временная изменчивость // Кольский залив: освоение и рациональное природопользование. Отв. ред. Матишов Г.Г. М.: Наука. С. 161–182.
Максимович Н.В., 1978. Особенности экологии и биоэнергетические свойства популяций Mya arenaria L. (Bivalvia) в губе Чупа // Вестник Ленинградского государственного университета. Серия 3: Биология. № 21. С. 28–36.
Максимович Н.В., 1979. Некоторые особенности экологии массовых видов двустворчатых моллюсков губы Чупа // Моллюски. Основные результаты их изучения. Авторефераты докладов. Сборник 6. Л.: Наука. С. 86–88.
Наумов А.Д., 2006. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа. Исследования фауны морей. Т. 59 (67). Изд. СПб. С. 23–24.
Савчук М.Я., 1970. Распространение и некоторые особенности биологии двустворчатого моллюска Mya arenaria L. в прибрежном мелководье северо-западной части Черного моря и в лиманах // Океанология. Т. 10. Вып. 3. С. 521–528.
Савчук М.Я., 1976. Акклиматизация двустворчатого моллюска Mya arenaria в Черном море // Биология моря. № 6. С. 40–46
Свешников В.А., 1963. Биоценотипические связи и условия существования некоторых кормовых беспозвоночных инфауны литорали Кандалакшского залива Белого моря // Труды Кандалакшского государственного заповедника. Вып. IV. Труды ББС МГУ. Т. II. С. 114–134.
Скарлато О.А., 1990. Методы изучения двустворчатых моллюсков // Труды Зоологического института АН СССР. Т. 219. 208 с.
Смолькова О.В., 2021. Продукционные характеристики поселений двустворчатого моллюска Mya arenaria Linne, 1758 Баренцева моря // Труды Кольского научного центра. Т. 3 (12). Серия Океанология. Вып. 9. С. 141–150. https://doi.org/10.37614/2307-5252.2021.11
Смолькова О.В., Мещеряков Н.И., 2022. Биология двустворчатых моллюсков Mya arenaria (Linnaeus, 1758) Кольского залива Баренцева моря // Труды Кольского научного центра РАН. Т. 4 (13). Сер. Океанология. Вып. 10. С. 86–99. https://doi.org/10.37614/2307-5252.2022.4.10.009
Фролов А.А., 2009. Двустворчатые моллюски верхней сублиторали среднего и южного колена залива // Кольский залив: освоение и рациональное природопользование. М.: Наука. С. 182–202.
Хлебович В.В., Станкявичюс А.Б., 1979. Пределы ступенчатой адаптации Macoma balthica, Mytilus edulis и Mya arenaria из восточной части Балтийского моря // Моллюски. Основные результаты их изучения. Авторефераты докладов. Сборник 6. Л.: Наука. С. 42–43.
Щербакова И.Б., 2006. Двустворчатый моллюск Mya arenaria в экосистемах литорали Белого моря. Автореф. дис. … канд. биол. наук. Изд-во ПетрГУ. 29 с.
Baker P., Mann R.L., 1990. Habitat requirements for the softshell clam, Mya arenaria in the Chesapeake Bay // Special Scientific Report № 125. Williamsburg: Virginia Institute of Marine Science Publ., College of William and Mary Publ. 35 p. https://doi.org/10.25773/v5-jc3f-tk19
Bernard F.R., 1979. Identification of the living Mya (Bivalvia: Myoida) // Japanese Journal of Malacology. V. 38. P. 185–204.
Bouchet P., Gofas S., 2013. Mya Linnaeus, 1758. In: MolluscaBase (2017). World Register of Marine Species. Available at: http://marinespecies.org/aphia.php?p=taxdetails&id=138211
Cardoso J.F.M.F., Witte J.I.J., van der Veer H.W., 2009. Differential reproductive strategies of two bivalves in the Dutch Wadden Sea // Estuarine, Coastal and Shelf Science. V. 84. № 1. P. 37–44. https://doi.org/10.1016/j.ecss.2009.05.026
Carlton G.T., 1992. Introduced marine and estuarine mollusks of the North America: an-end-off-the-20-th-century perspective // J. Shell-life Res. V. 11. P. 489–505.
Conde A., Novais J., Domınguez J., 2010. Southern limit of distribution of the soft-shell clam Mya arenaria on the Atlantic East Coast // Biol. Inv. V. 12. P. 424–432.
Feder H.M., Paul A.J., 1974. Age, growth and size-weight relationships of the soft-shelled clam, M. arenaria, in Prince William Sound, Alaska // Proceedings of the National Shellfisheries Association. V. 64. P. 45–52.
Forster S., Zettler M.L., 2004. The capacity of the filter-feeding bivalve Mya arenaria L. water transport in sandy beds // Mar. Biol. 144. P. 1183–1189. https://doi.org/10.1007/s00227-003-1278-2
Gerasimova A.V., Martynov F.M., Filippova N.A., Maximovich N.V., 2016. Growth of Mya arenaria L. at the northern edge of the range: heterogeneity of soft-shell clam growth characteristics in the White Sea // Helgoland Marine Research. V. 70. 14 p. https://doi.org/10.1186/s10152-016-0457-8
Haskin H.H., 1954. Age determination in mollusks // Transactions of the New Yom Academy of Science. V. 16. P. 300–304.
ITIS, 2017. Mya Linnaeus, 1758. Integrated Taxonomic Information System. Available at: https://www.itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&search_value=81691#null
Kennish M.J., Olsson R.K., 1975. Effects of thermal discharges on the microstructural growth of Mercenaria mercenaria // Environmental Geology. V. 1. № 1. P. 41–64. https:// doi. org/ 10. 1007/ BF024 26940
MacNeil F.S., 1965. Evolution and distribution of the genus Mya, and Tertiary migrations of Mollusca // Professional Paper US, Department of the Interior, Geological Survey. V. 483. P. 1–51.
Miac J., Groth M., Wolowicz M., 1997. Seasonal changes in the Mya arenaria (L.) population from Inner Puck Bay // Oceanologia. V. 39. № 2. P. 177–195.
Pedersen T.F., 1992. Temporal variations in heat dissipation and oxygen uptake of the soft shell clam Mya arenaria L. (Bivalvia) // Ophelia. V. 36. № 3. P. 203–216.
Petersen G.H., 1999. Five recent Mya species, including three new species and their fossil connections // Polar Biology. V. 22. P. 322–328.
Riisgard H.U., Seerup D.F., 2003. Filtration rates in the soft clam Mya arenaria: effects of temperature and body size // Sarsia. V. 88. P. 415–428.
Schaffer F., Zettler M.L., 2007. The clam sipho as indicator for growth indices in the soft-shell clam Mya arenaria // Helgoland Marine Research. V. 61. № 1. P. 9–16. https://doi.org/10.1007/s10152-006-0049-0
Smolkova O.V., 2021. Linear growth and yield of bivalve mollusks Mya arenaria Linnaeus, 1758 in the conditions of the littoral of the Barents and White seas // IOP Conf. Series: Earth and Environmental Science: AFE-2021 (Fundamental and Applied Scientific Research in the Development of Agriculture in the Far East (AFE-2021, 20–21 June 2021, Ussurijsk, Russian Federation). 2021. V. 937. Article № 022078. P. 1–10. https://doi.org/10.1088/1755-1315/937/2/022078
Strasser M., 1999. Mya arenaria – an ancient invader of the North Sea coast // Helgolander Meeresuntersuchungen. V. 52. № 3–4. P. 309–324. doi: 10.1007/BF02908905
Thamdrup H.M., 1935. Beiträge zur Ökology der Wattenfauna // Meddelelser Fra komm. Danmarks Fickeri-og Havundersgelser, Ser, Fiskeri. V. 10. P. 62–65.
Wheaton F.W., Schaffer G.U., Ingling A.L., Douglass L.W., 2008. Physical properties of soft shell clams, Mya arenaria, Aquacultural Engineering. V. 38. Iss 3. P. 181–188. https://doi.org/10.1016/j.aquaeng.2008.03.002
Zhang J.L., Yurchenko O.V., Lutaenko K.A., Kalachev A.V., Nekhaev I.O., Aguilar R., Zhan Z.F., Ogburn M.B., 2018. A tale of two soft-shell clams: an integrative taxonomic analysis confirms Mya japonica as a valid species distinct from Mya arenaria (Bivalvia: Myidae) // Zoological Journal of the Linnean Society. V. 184 (3). P. 605–622. https://doi.org/10.1093/zoolinnean/zlx107
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал