Зоологический журнал, 2023, T. 102, № 4, стр. 408-430
Основные направления эволюции млекопитающих
А. К. Агаджанян *
Палеонтологический институт имени А.А. Борисяка РАН
117647 Москва, Россия
* E-mail: aagadj@paleo.ru
Поступила в редакцию 21.10.2022
После доработки 10.02.2023
Принята к публикации 15.02.2023
- EDN: UYATMR
- DOI: 10.31857/S0044513423040037
Аннотация
Изложены современные взгляды на происхождение и раннюю эволюцию млекопитающих. Использованы материалы, накопленные автором, по морфологии современных и ископаемых однопроходных, сумчатых и плацентарных. Суммируются данные по мезозойским млекопитающим, в т.ч. полученные за последние годы. Предложена модель механизма морфогенетических преобразований в ходе эволюционного развития Mammalia. Дан обзор основных направлений эволюции млекопитающих от позднего триаса до кайнозоя.
Вопросы происхождения, ранней эволюции и основных направлений развития класса Mammalia обсуждаются достаточно давно. Им посвящен ряд фундаментальных исследований (Simpson, 1928, 1929; Mesozoic mammals…, 1979; Kielan-Jaworowska et al., 2004; Ромер, Парсонс, 1992). Однако за последние 10–15 лет появились новые материалы, которые значительно расширяют существующие представления о географии и направлениях эволюции этой важнейшей группы позвоночных (Лопатин, 2013, 2018; Kemp, 2005, 2006; Averianov et al., 2013). Возникает необходимость более глубокого анализа накопленных к настоящему времени данных.
В основу работы положены материалы автора по анатомии современных утконоса, ехидны и целого ряда сумчатых Австралии, палеонтологические коллекции млекопитающих Музеев Естественной Истории Сиднея, Лондона, Мюнхена, Парижа, Токио, Пекина. Благодаря любезности и поддержке коллег были доступны палеонтологические и зоологические коллекции Института экологии растений и животных РАН в Екатеринбурге, Зоологического института РАН в Санкт-Петербурге, Института археологии и этнографии РАН в Новосибирске, каф. Палеонтологии Томского государственного университета. И, разумеется, автор постоянно имел доступ к обширнейшим коллекциям Палеонтологического института им. А.А. Борисяка РАН в Москве.
Происхождение млекопитающих
Возникновение Mammalia связано с выходом позвоночных на сушу, с дальнейшей эволюцией наземных тетрапод, с вычленением ствола синапсид, с длительным и сложным процессом маммализации. Бóльшая часть этих преобразований приходится на конец палеозоя и начало мезозоя. Однако и после обособления ствола млекопитающих происходило неуклонное совершенствование всех основных систем и органов представителей класса Mammalia. Это обеспечило им ведущее положение в сообществах Земли на протяжении кайнозоя.
Выход позвоночных на сушу произошел в верхнем девоне около 360 млн лет назад. Ему предшествовал выход на сушу растений и беспозвоночных, что создавало наличие биоресурсов для плотоядных амфибий. Освоение новой среды обитания потребовало коренного преобразования основных систем жизнеобеспечения, в т.ч., локомоторного аппарата. Водные позвоночные палеозоя, как и современные, в качестве основного движителя использовали хвост, а конечности служили, прежде всего, рулями глубины. Их плоскость располагалась горизонтально, что обеспечивало оптимальное выполнение данной функции. Такая позиция конечностей у водных позвоночных отрабатывалась в течение 100 млн лет и прочно зафиксировалась в их анатомии. Однако на суше передвигаться на таких, направленных в стороны (латерально), конечностях было невозможно. Выползая на сушу, первые наземные позвоночные (амфибии) лежали брюхом на грунте, а конечности, как плавники, торчали в стороны. На стадии рептилий они приподняли над субстратом тело, но при этом оно было расположено между конечностями, что крайне неэффективно с точки зрения расхода мышечной энергии. В дальнейшем позвоночные, осваивая сушу, должны были преодолеть наследие длительного существования в водной среде и перевести конечности в вертикальное (парасагиттальное) положение. Для этого требовались очень крупные преобразования всей опорно-двигательной системы. Одновременно происходили изменения в строении черепа, покровов и других частей тела. Эти преобразования протекали по-разному в разных филогенетических линиях, важнейшие из которых – диапсиды и синапсиды.
Разделение наземных позвоночных на диапсид и синапсид
Обе группы наземных позвоночных – диапсиды и синапсиды – обособились в позднем палеозое от близких форм котилозавров. Их предшественники, амфибии, имели примитивные мешкообразные легкие, а их ребра не обладали подвижностью, что обусловливало малую эффективность системы нагнетания воздуха и, следовательно, газового обмена. Помимо легких и кожного покрова у лабиринтодонтов дополнительным органом дыхания была ротовая полость, что тормозило эволюцию челюстного аппарата и всего черепа. Появление на стадии рептилий более совершенных ячеистых легких и подвижных ребер сняло с ротовой полости эту функцию, что, в свою очередь, открыло пути преобразования черепа. Его поперечный профиль становится сводчатым, а в крыше черепа появились окна, благодаря которым жевательные мышцы m. temporalis больше не были ограничены размерами ротовой полости и могли беспрепятственно развиваться, прикрепляясь верхними концами к наружной поверхности черепа. У диапсид появились два таких окна и, следовательно, две скуловые дуги (апсиды), у синапсид – одно окно и одна скуловая дуга (апсида) с каждой стороны черепа. В этом состоит одно из важных, но не единственных, различий в строении черепа двух названных групп.
К диапсидам относятся текодонты, крокодилы, динозавры, ящерицы, змеи и птицы. Они имеют кинетический череп, т.е. подвижные сочленения между отдельными его частями. Одно из главных направлений эволюции диапсид – формирование ажурной и подвижной структуры черепа. Их нижняя челюсть состоит из нескольких костей, унаследованных от лабиринтодонтов. Раскрывая рот, ящерицы и змеи не только отводят вниз (опускают) нижнюю челюсть, но могут приподнимать и опускать переднюю часть верхней челюсти. Высокой подвижностью обладают нижнечелюстной сустав и симфиз между двумя половинами нижней челюсти. Причем нижнечелюстной сустав может изменять свое положение относительно базикраниальной части черепа, смещаясь латерально. Это позволяет диапсидам заглатывать очень крупную добычу. Змеи, как известно, могут заглатывать объекты, размер которых значительно превышают диаметр их тела.
У диапсид происходит постоянная смена зубов. Вместо выпавших или обломанных зубов вырастают другие. Такая лабильная смена зубов исключает окклюзию. Поэтому у диапсид не выработался зубной аппарат разрезающего или перетирающего типа.
У диапсид фактически не было мозговой коробки. Полость, в которой расположен головной мозг, была открыта спереди. Сам мозг и у древних, и у современных диапсид (кроме птиц) очень примитивен.
В стволе диапсид по-своему происходила эволюция локомоторного аппарата. Многие из них перешли к бипедии, что сопровождалось редукцией передних конечностей, или вовсе к утрате конечностей, как, например, произошло в эволюции змей.
Диапсиды, по-видимому, никогда не обладали гомойотермией – физиологически обусловленной стабильной температурой тела (за исключением птиц). Лишь у крупных диапсид, из-за их большой массы, инерционно сохранялась более или менее постоянная температура тела. У всех диапсид эритроциты имеют ядра.
К синапсидам относятся пеликозавры, терапсиды и млекопитающие. Большое значение для понимания происхождения класса Mammalia имеют фундаментальные исследования Татаринова (1974, 1976). Череп синапсид не обладал кинетизмом. Наоборот, со временем он становился все более монолитным. Консолидация элементов черепа дала возможность уже в триасе сформировать черепную коробку, что открывало в дальнейшем возможность развития крупного головного мозга. Число костей нижней челюсти у синапсид неуклонно уменьшалось. В итоге из шести костей осталась только одна – зубная, os dentale. Количество зубов и их положение в челюсти стабилизировались, и стала возможной окклюзия. Это, в свою очередь, позволило осуществлять первичную обработку пищи в ротовой полости.
В эволюции локомоторного аппарата синапсиды вначале уступали диапсидам. Ни в перми, ни в триасе они не освоили передвижение на двух конечностях, а перевести свои конечности в вертикальное положение они смогли лишь на стадии млекопитающих.
Древнейшие Synapsida, представители отряда Pelycosauria, известны из позднего карбона (320–298.9 млн лет). Специализированные пеликозавры существовали на протяжении почти всего пермского периода (298.9–252.17 млн лет). Они имели сравнительно небольшие размеры: от ящерицы до крупного варана. Большинство пеликозавров было плотоядными. Лишь для Caseidae допускается растительноядение. Вероятно, пеликозавры могли регулировать в некоторых пределах температуру тела. Остистые отростки их позвонков поднимались на значительную высоту. Между ними была натянута кожная перепонка “парус”, которая могла обеспечивать прогрев кровеносных сосудов. Возможно, это была первая попытка регулировать температуру тела.
В пермском периоде синапсиды первыми в истории Земли создали богатую и разнообразную фауну наземных позвоночных. Только два региона сохранили окаменевшие остатки ее представителей в значительном количестве: Южная Африка и Русская платформа (бассейн верхней Волги, Северной Двины и Башкирия). В середине пермского периода от пеликозавров обособился отряд Therapsida. В поздней перми (258–252.2 млн лет) представители этого ствола дали очень широкую адаптивную радиацию. Среди них были как мелкие, так и крупные животные, достигавшие размеров тапира и даже носорога, а хищники – размеров тигра. Они занимали экологические ниши всеядов (Dinocephalia), хищников (Gorgonopsia) и специализированных растительноядов (Anomodontia). Однако к концу перми значительная их часть вымерла, лишь Kannemeyeridae, крупные растительнояды, дожили до среднего триаса. Кроме того, представители Therocephalia и Cynodontia успешно пережили позднюю пермь, a Cynodontia дали и заметное увеличение разнообразия в середине триаса. В целом, это были плотоядные животные мелких и средних размеров. Среди них были как специализированные хищники (Procynosuchidae, Cynognatidae и др.), так и неспециализированные растительнояды (Bienotheriidae, Tritylodontidae и др.). Их отличали сравнительно низкий уровень пищевой специализации и несовершенство локомоторного аппарата. Однако общий уровень эволюционной продвинутости у них был достаточно высок. Это выражалось в образовании костного нëба, очень большом размере височных окон (и, соответственно, височной мускулатуры), формировании окклюзии зубного аппарата, усложнении самих зубов, увеличении размеров зубной кости и неуклонной редукции постдентальных костей нижней челюсти. Позвоночный столб и скелет конечностей также обладали рядом продвинутых черт. Именно от плотоядных, неспециализированных мелких триасовых териодонтов, возможно Cynognatidae, обособились древнейшие млекопитающие. Однако ни одна из известных на сегодня групп териодонтов не может рассматриваться непосредственным предком млекопитающих. Это связано с тем, что териодонты представлены в палеонтологической летописи специализированными формами, а первые млекопитающие позднего триаса очень примитивны по своей морфологии. Татаринов (1976) вслед за Т. Гексли допускал обособление млекопитающих непосредственно от позвоночных амфибиального уровня организации.
К началу юры диапсиды вытеснили синапсид, в основном благодаря освоению двуногой локомоции. В наземных сообществах хищные динозавры полностью заменили хищных синапсид. Некоторые растительноядные синапсиды пережили свое время и сосуществовали с динозаврами, но в целом биота синапсид была почти нацело стерта сообществом диапсид, господство которых продолжалось с начала юры до конца мела (185–65 млн лет). В конце мелового периода началось вымирание представителей динозавровой фауны. Однако многие диапсиды (крокодилы, ящерицы, змеи) успешно освоили биоты кайнозоя и существуют и теперь, а птицы делят с млекопитающими господствующее положение среди животных суши.
В кайнозое начался новый расцвет синапсид (млекопитающих), но уже на принципиально другом уровне организации. Этому расцвету предшествовал длительный и сложный процесс морфологических и физиологических преобразований. Он растянулся приблизительно на 130 млн лет от позднего триаса до конца мела. Процесс приобретения признаков млекопитающих (маммализация) протекал параллельно в нескольких эволюционных линиях поздних териодонтов, что породило разнообразие мезозойских млекопитающих, большинство из которых вымерло к началу кайнозоя. Можно выделить общие тенденции и направления морфогенеза, характерные для всех представителей класса Mammalia.
Процесс маммализации охватывал глубокие преобразования морфологии и физиологии поздних териодонтов. Главные из них приведены ниже.
Перестройка общей организации строения тела
– Одними из важных преобразований на пути маммализации были: удлинение шейного отдела и увеличение подвижности образующих его позвонков; усложнение строения двух первых позвонков: атланта и эпистрофея; появление двух затылочных мыщелков. Это привело к значительному увеличению подвижности головы относительно туловища, что сделало более эффективной работу челюстного аппарата при захвате добычи. Главным следствием этой подвижности явилось увеличение количества и улучшение качества информации, которую получают анализаторы: зрительный, слуховой, обонятельный, тактильный. В свою очередь, увеличение объема поступающей информации – необходимое условие развития центральной нервной системы.
– Подвижность переднего отдела позвоночника обеспечивалась и редукцией шейных ребер, которые присутствуют у всех рептилий и еще сохраняются у терапсид, но отсутствуют уже у первых млекопитающих. При этом редуцируется бóльшая часть тела каждого шейного ребра, а проксимальные их концы сохраняются, прирастая двумя своими головками к телу позвонка. Эти изменения приводят к образованию гемального канала, через который проходит позвоночная артерия, снабжающая кровью головной отдел. Формирование канала обеспечивает бесперебойное снабжение головы кровью, которое не зависит от изгибов шеи.
Редукция ребер произошла и в поясничном отделе. Это снимало запреты на увеличение в случае необходимости размеров брюшной полости, что открывало путь к освоению совершенного растительноядения, а впоследствии и к живорождению.
– В процессе маммализации происходит увеличение крестцового отдела позвоночника, усиливается связь между крестцовыми позвонками и костями таза, что повышает эффективность работы задних конечностей.
– У млекопитающих нарастает дорсостабильность грудного и поясничного отделов позвоночника, особенно в эволюционных стволах копытных. В противоположность рептилиям резко снижается латеральная подвижность грудных и поясничных позвонков.
– Изменяется роль хвостового отдела позвоночника. У рыб и амфибий хвост выполнял, прежде всего, роль движителя, у некоторых групп рептилий, например ихтиозавров, – роль балансира, органа защиты или движителя. У млекопитающих хвост становится органом терморегуляции. Показано, например, что хвост русской выхухоли выполняет функции “теплового окна”, которое может менять температуру более чем на 30°C в зависимости от условий охлаждения или перегрева животного (Еськова и др., 2022). Вторично у некоторых млекопитающих хвост может выполнять функции движителя, парашюта, балансира, органа опоры, захвата, коммуникации и др.
– Важным этапом маммализации является изменение положения конечностей от латерального к парасагиттальному. Только при вертикальной постановке конечностей возможна оптимизация их работы при передвижении на суше. Однако это требует перестройки всей структуры скелета. В передней и задней конечностях постепенно формируется шейка плечевой и бедренной костей, что позволяет расположить эти кости под углом к плоскости сустава. Меняют положение стопы передней и задней конечностей, они разворачиваются вперед. Изменяют положение локтевой и коленный суставы. При этом коленный сустав смещается медиально и вперед, что сохраняет положение большой и малой берцовых костей по отношению к костям стопы. Большая берцовая кость располагается медиальнее, малая берцовая кость латеральнее костей стопы и коленного сустава. Более сложные преобразования происходят в локтевом суставе, который смещается медиально и назад. При этом дистальный конец локтевой кости, связанный со стопой, занимает латеральную позицию по отношению к костям стопы, а проксимальный конец занимает медиальную позицию по отношению к локтевому суставу. В свою очередь, нижний конец радиуса оказывается медиальнее по отношению к костям передней стопы, а верхний конец – латеральнее по отношению к локтевому суставу плечевой кости. Происходит перекрещивание костей предплечья. Это был трудный и длительный процесс морфогенеза, который затянулся до конца мелового периода. Однако столь сложное преобразование открывало в будущем возможность пронации и супинации предплечья, что резко увеличивало функциональные возможности передних конечностей. В итоге именно это существенно повысило эффективность охотничьих адаптаций хищников и заложило основы орудийной деятельности гоминид.
Латеральная постановка конечностей еще сохранялась у большинства млекопитающих мезозоя. Она описана для триконодонтида Jeholodens из нижнего мела Китая, симметродонта Zhangheotherium из отложений первой половины нижнего мела Китая, для мультитуберкулят мела Монголии (Hu et al., 1997; Qiang et al., 1999; Kielan-Jaworowska, Gambaryan, 1994).
Перестройка черепа и челюстного аппарата
– Одна из модернизаций черепа была выражена в увеличении височного окна, что сделало возможным увеличение височной мускулатуры. Если у пеликозавров ранней перми височное окно было меньше размеров глазницы, то у триасовых терапсид оно значительно превышает размер глазницы. В позднем триасе этот процесс завершается полным слиянием глазницы и височного окна. И такое строение височной области сохраняется у всех мезозойских млекопитающих. Лишь в кайнозое, по мере развития m. masseter (жевательной мышцы), вторично возникает заглазничная перемычка для укрепления скуловой дуги, т.к. именно к ней крепится этот мускул. У приматов за счет разрастания заглазничной перегородки полость глазницы частично, а у гоминид полностью, изолирована от жевательной мускулатуры, что очень важно для независимой работы глазных мышц.
– Другая крупная перестройка черепа – формирование костного нëба. Уже на стадии поздних териодонтов происходит разрастание верхнечелюстных и нëбных костей. Постепенно медиальные края этих костей соединяются друг с другом и образуют костное нëбо. Благодаря этому разъединяются ротовая полость и дыхательный тракт, что снимает запреты на одновременное дыхание и питание животного. Возникает возможность жевания, т.е. лучшей обработки пищевого комка. Это, в свою очередь, обусловливает более эффективное усвоение питательных веществ и, следовательно, повышение уровня обмена, необходимого для поддержания постоянной температуры тела. Кроме того, выполнение любых функций челюстным аппаратом не блокирует процесс дыхания.
– Модернизация затрагивает и нижнюю челюсть, которая претерпевает существенные преобразования (Simpson, 1928, 1929, 1938; Kermack, Mussett, 1958; Novacek, 1986; Parrington, 1979; Allin, Hopson, 1992). Начинаются они с разрастания зубной кости, которая неуклонно увеличивается в размерах от пермских пеликозавров к позднетриасовым териодонтам. Если у пеликозавров зубная кость (os dentale) занимала лишь переднюю часть нижней челюсти, то у поздних териодонтов она занимает все пространство от симфиза до нижнечелюстного сустава и составляет основную массу челюсти. Увеличение размеров зубной кости сопровождается редукцией остальных (постдентальных) костей. Они уменьшаются в размерах, и большинство из них постепенно исчезает. Дольше других сохраняются сочленованная (os articulare) и угловая (os angulare) кости. Первая из них, os articulare, у териодонтов образует нижнечелюстной сустав, упираясь в квадратную кость черепа (os quadratum). Вторая, os angulare, – имеет форму дуги и поддерживает барабанную перепонку. В позднем триасе зубная кость, разрастаясь назад, упирается в чешуйчатую кость черепа (os squamosum). При этом у первых млекопитающих возникает двойное сочленение нижней челюсти с черепом: articulare–quadratum (рептилийное) и dentale–squamosum (маммальное), которое сохранялось на протяжении нескольких миллионов лет. В дальнейшем, в течение юры усиливается контакт dentale–squamosum, а сустав articulare–quadratum теряет свое значение. Его кости уменьшаются, смещаются в процессе эволюции от нижней челюсти к основанию черепа и выполняют функцию звукопередаточного механизма от барабанной перепонки, которая натянута на кольце угловой кости, к стремечку. Последнее упирается в овальное окно каменистой кости (os petrosum) и передает звуковые колебания в полость, где расположены вестибулярный аппарат и улитка, т.е. собственно слуховой сенсор. Таким образом, в процессе маммализации угловая кость рептилий преобразуется в тимпанальную (os. tympanicum) кость млекопитающих и несет барабанную перепонку, сочленованная кость териодонтов и первых млекопитающих становится молоточком (malleus), ручка которого примыкает к барабанной перепонке, а проксимальная часть причленяется к quadratum, сама квадратная кость становится наковальней (incus). Так формируется звукопередаточный механизм в полости среднего уха современных млекопитающих. Третий элемент этого механизма – стремечко (stapes) – первичен и унаследован еще от рептилий и даже амфибий. На стадии рыб он выполнял роль подвески (hyomandibulare), которая обеспечивала причленение нижней челюсти к черепу.
Трехчленная структура этой системы сделала возможной передачу внешнего механического воздействия на барабанную перепонку, далее – на каменистую кость и улитку не только перпендикулярно плоскости перепонки, но и под углом к ней, точнее в трех разных плоскостях. Это позволило в дальнейшем осуществлять смещение вестибулярного аппарата и сенсорной части слухового анализатора, улитки (cochlea), в самых различных направлениях относительно барабанной перепонки, т.е. наружного уха. Трехчленность звукопроводящего механизма снимает запреты на любые модификации базикраниальной части черепа и пространственные перемещения каменистой кости в процессе эволюции. В полной мере эти возможности были реализованы в стволе Theria и, особенно, Eutheria. У них каменистая кость и, следовательно, вестибулярный аппарат с улиткой смещаются медиально и вверх по отношению к чешуйчатой кости. Точнее, petrosum мало меняет свое пространственное положение по отношению к basioccipitale, но при этом squamosum постоянно расширяется в связи с неуклонным расширением мозговой полости и смещается латерально. Вентральный край этой кости опускается вниз. В итоге чешуйчатая кость закрывает petrosum и последняя оказывается на внутренней стороне squamosum, под ее защитой. Os petrosum практически изолирована от воздействия внешней среды, в т.ч. и мускулатуры. У большинства современных млекопитающих petrosum погружена в костную структуру черепной коробки и не принимает участия в формировании внешних стенок полости среднего уха. Эту функцию выполняет, как правило, os tympanicum, реже alisphenoideum, а иногда особая кость os bullae или entotympanicum (Weber, 1927). Названные кости не только образуют костную перегородку между глоткой и полостью среднего уха, но и формируют резонаторную камеру: bulla tympani. В формировании резонаторных полостей может принимать участие и squamosum, например, у неполнозубых (Edentata). Лишь у приматов, особенно у Lemuridae, латеральный край каменистой кости образует тонкую выгнутую пластинку, которая принимает участие в формирование слуховой капсулы. Правда, у разных приматов соотношение каменистой и барабанной кости при этом различно (Weber, 1927; Szalay, Delson, 1979). У высших приматов слуховая капсула и слуховой проход формируются полностью за счет os tympanicum.
Наличие сочленений в звукопроводящей системе malleus–incus–stapes открывало возможности эволюционных преобразований базальной части черепа. Подтверждает это положение ряд фактов. У большинства представителей Metatheria и древнейших Eutheria отдельные косточки в системе malleus–incus–stapes сохраняют подвижное сочленение между собой. Однако у представителей специализированных групп, формирование которых закончилось к эоцену, malleus и incus теряют подвижное сочленение друг с другом и фактически образуют единый, консолидированный рычаг сложной формы. К этому времени сложились основные адаптивные и морфологические типы млекопитающих (отряды), сформировалась принципиальная конструкция их черепов и они приобрели современный облик. Каменистая кость (petrosum) заняла положение на внутренней поверхности squamosum, и в каждой эволюционной линии млекопитающих звукопередаточный механизм среднего уха достиг своей конструктивной и функциональной оптимизации. После этого отпала необходимость в подвижном сочленении malleus–incus, происходит его оссификация, например, у грызунов в ходе онтогенеза (Weber, 1927).
От нижней челюсти к базальной части черепа смещается и угловая кость (angulare), которая несет барабанную перепонку и в качестве os timpanicum формирует наружную стенку полости среднего уха.
Трехчленность звукопроводящего механизма имеет и другой адаптивный смысл. При внезапных и очень больших нагрузках на барабанную перепонку ударной волны она выполняет роль демпфера, ослабляя отрицательные воздействия (перегрузки) на сенсорную часть слухового аппарата.
Параллельно с этими процессами происходила и модернизация черепа в целом. Но в подклассах Prototheria, Eotheria и Theria она протекала по-разному (Kermack, Kielan-Jaworowska, 1971; Crompton, Ai-Lin Sun, 1985; Lillegraven, Krust, 1991; Hopson, Rougier, 1993; Wible, Hopson, 1993; Агаджанян, 2003, 2003а; Lopatin, Averianov, 2009). У Prototheria и Eotheria основную роль в формировании боковой стенки мозговой капсулы играла каменистая кость (os petrosum), а у Theria – чешуйчатая (os squamosum). У прототериевых млекопитающих мозговая капсула формируется спереди в значительной мере за счет алисфеноида, а сбоку – за счет os petrosum. Чешуйчатая кость черепа, в виде небольшой изогнутой пластинки, прикрывала мозговую коробку лишь сзади и сбоку. Такой тип строения черепа имеют представители отрядов: Triconodonta (Kermack, et al., 1981), Docodonta (Lillegraven, Krust, 1991), Monotremata (Bemmelen, 1901; Archer et al., 1992), Multituberculata (Kielan-Jaworowska, 1971; Clemens, Kielan-Jaworowska, 1979; Miao, 1988) и Gondwanatheria (Krause et al., 1997, 2014, 2020). У представителей этих отрядов форма черепа примерно одинаковая. Их череп широкий в затылочной части и плавно суживается к роструму. Суставные площадки для причленения нижней челюсти расположены на уровне затылочного отверстия. У Metatheria и Eutheria краниальная часть черепа неуклонно разрастается назад и затылочное отверстие for. magnum все дальше смещается назад от линии fossa glenoidea.
Скуловая кость (os jugale) у Prototheria постепенно утрачивалась в процессе эволюции. У позднеюрского докодонта Haldonodon она еще присутствует (Lillegraven, Krust, 1991), однако тенденция сближения концов скуловых отростков os maxillare и os squamosum уже хорошо выражена. Ее практически нет у современных Monotremata. Хотя, на самом деле, у Ornithorinchus скуловая кость сохраняется в виде маленького рудимента в составе заглазничного выступа скуловой дуги. К ней крепится передний край хрящевой трубки наружного слухового прохода, который открывается у утконосов в глазницу. У ехидны слуховой проход открывается в задней части черепа, и у нее скуловая кость отсутствует. У Multituberculata скуловая дуга формировалась за счет скуловых отростков верхнечелюстной и чешуйчатой костей. Однако сама os jugale иногда сохранялась в виде небольшой пластинки на внутренней поверхности скулового отростка os maxillare. Она отмечена у позднеюрских Paulchoffatiidae, позднемелового Nemegtbaatar, палеоценового Ptilodus, у эоценового Ectypodus (Hopson et al., 1989).
Morganucodon, позднетриасовый представитель Triconodonta, имел тонкую и вытянутую os jugale, которая принимала участие в формировании скуловой дуги. Однако промежуток скуловой дуги, образованный os jugale, был небольшой. Еще более короткую скуловую кость имел позднеюрский-раннемеловой Jeholodens (Ji et al., 1999).
У териевых млекопитающих в ходе филогенеза os squamosum значительно увеличивалась в размерах, прикрывая каменистую кость. Боковая стенка мозговой капсулы формируется за счет os squamosum. Алисфеноид небольшой и прикрывает только передненижнюю часть мозговой полости. Скуловая кость (os jugale) присутствует у териевых млекопитающих (за исключением некоторых насекомоядных), играя важную роль в формировании скуловой дуги. У большинства эволюционно продвинутых групп она увеличивается в размерах, принимает участие в защите глазницы и является местом прикрепления жевательной мускулатуры. Развитие скуловой дуги в значительной мере определяет степень развития и функциональные возможности жевательного мускула.
Другое существенное преобразование черепа – закрытие отверстия третьего (теменного) глаза. Как известно, этот непарный светочувствительный орган присутствует у некоторых бесчелюстных, рыб, земноводных и рептилий. Он служит для восприятия интенсивности света и для ориентирования в пространстве. На черепе ему соответствует хорошо выраженное теменное отверстие, прикрытое кожей. Непарный глаз может находиться в самом этом отверстии (у большинства рептилий), над черепом (у бесхвостых земноводных и некоторых рыб) или под ним (у миног и некоторых рептилий). У высших позвоночных теменное отверстие сдвигается назад. У терапсид оно находилось уже в задней части свода черепной коробки. Такое перемещение отверстия и в дальнейшем его замыкание объясняется тем, что промежуточный мозг в ходе эволюции отодвигался назад из-за увеличения размеров полушарий головного мозга. Увеличиваясь в размерах, эти полушария закрывают сверху промежуточный мозг, теряется светочувствительная функция пинеального органа, и он трансформируется у млекопитающих в железу внутренней секреции – эпифиз.
В целом, в процессе эволюционных преобразований количество костей в черепе териевых млекопитающих уменьшается, эти кости все более консолидируются, нарастают объем и конструктивная целостность черепной коробки.
Существенные изменения в процессе маммализации претерпевает зубная система. Зубы амфибий и большинства рептилий, изнашиваясь, беспорядочно заменяются на протяжении всей жизни животного. Количество их варьирует в довольно широких пределах, а по своей морфологии они мало отличаются друг от друга. У представителей этих групп отсутствует окклюзия – постоянное и точное смыкание верхних и нижних зубов. Исключение составляют лишь утконосые динозавры, гадрозавры, представители диапсид, у которых развивалась целая батарея зубов в верхней и нижней челюстях, обеспечивая перетирание жесткой растительной пищи. У териодонтов, особенно позднетриасовых, количество зубов стабилизируется. Возникает гетеродонтия. Щечные зубы усложняются. У всех зубов ясно выражены: коронка, шейка и корень. Коронки верхних щечных зубов расширяются и противостоят нижним зубам. Появляется окклюзия, и, как следствие, образуются фасетки стирания. Из териодонтов наиболее сложно устроенные зубы имели Tritylodontidae, растительноядные цинодонты, жившие в позднем триасе и юре. Это были специализированные животные с массивной челюстью, которые не могли быть непосредственными предками млекопитающих. Обособление млекопитающих, вероятно, происходило от мелких неспециализированных плотоядных териодонтов, таких как Cynognathidae, Dviniidae, Traversodontidae, Chiniquodontidae.
Преобразования важнейших морфо-физиологических параметров синапсид в процессе маммализации. Некоторые преобразования морфо-физиологических параметров возникли еще на стадии териодонтов, а другие окончательно сложились на поздних стадиях эволюции млекопитающих.
– Волосяной покров был одним из признаков, формирование которого произошло очень рано. Его наличие реконструируется уже для терапсид поздней перми, например для Lycaenops, Thrinaxodon, Proburnetia и др. Первоначально, по-видимому, волосы возникли в виде тонких и длинных кератиновых образований: вибрисс. Их назначение, как и у современных млекопитающих, – создавать зону тактильного контроля вокруг головы. Благодаря вибриссам, животное получает информацию о предметах, расположенных на близком расстоянии от головы (и не только) или находящихся в зоне непосредственного с вибриссами контакта. Но уже в триасе циногнаты обладали сплошным волосяным покровом, который является необходимым условием и маркером гомойотермии.
– Важной особенностью эволюции млекопитающих являются изменения эритроцитов крови. Во-первых, они существенно уменьшились в размерах, что значительно увеличило общую суммарную площадь их поверхности на единицу объема. Во-вторых, они утратили ядра, в противоположность эритроцитам всех других позвоночных. Зная время расхождения основных стволов млекопитающих, можно предполагать, что исчезновение ядер в эритроцитах произошло еще в триасе. Этот ароморфоз означал значительное повышение функциональных возможностей крови. Форма двояковогнутых линз увеличивает площадь каждого эритроцита и, таким образом, скорость поглощения кислорода. Отсутствие ядра позволяет менять параметры клетки, у клеток появляется возможность сжиматься и принимать форму эллипса при прохождении через очень узкие капилляры, что обеспечивает высокую плотность системы капилляров и, как следствие, максимально эффективный газообмен.
– Гомойотермия, важнейший признак синапсидного ствола, начала формироваться на очень ранних этапах эволюции. Одним из признаков теплокровности является развитие нижних обонятельных раковин – максиллотурбиналий (Татаринов, 1976). Они достаточно хорошо выражены уже у позднепермских скалопозавров, например, из местонахождения Котельнич (Татаринов, 1999). Существуют и другие доказательства становления гомойотермии на стадии терапсид. На костях верхней и нижней челюстей в их передней части отчетливо прослеживается сеть желобков, в которых были расположены кровеносные сосуды и нервы. У прогрессивных тероцефалов верхнегубные сосуды и нервы образовывали сеть, аналогичную сети вибриссовых сосудов и нервов млекопитающих (Татаринов, 1976). Следовательно, у этих форм в зачаточном виде существовал волосяной покров, необходимый при становлении гомойотермии.
Гомойотермия – значительное араморфное преобразование – делает возможными резкое увеличение скорости метаболизма, интенсификацию мышечной активности и значительное повышение активности нервной системы. Вряд ли можно назвать случайностью то, что у иктидозухоидей максиллотурбиналии, функция которых состоит в подогреве вдыхаемого воздуха, заметно крупнее, чем у обычных пермских териодонтов (Татаринов, 1999).
Высокая и постоянная температура тела обусловливает высокую и постоянную скорость биохимических реакций, что поддерживает высокий уровень обмена веществ. Кроме того, гомойотермия делает возможным существование в кишечнике специализированной бактериальной флоры, которая обеспечивает расщепление молекул клетчатки. Это открывает путь к эффективному растительноядению в мелком размерном классе.
Только при гомойотермии возможна дистанционная хеморецепция, т.е. обоняние. Это связано с тем, что чувствительность хеморецепторов зависит о скорости химических реакций и эффективна лишь при высокой и постоянной температуре.
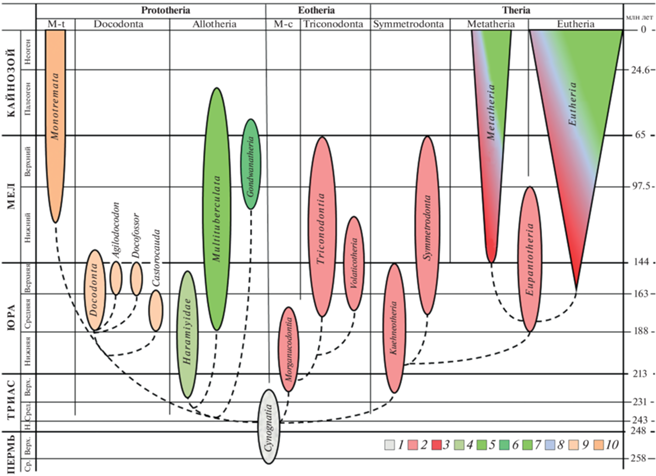
Процессы морфогенеза, разумеется, не закончились после становления маммальных признаков в стволе синапсид. Перечисленные выше особенности были характерны уже для всех млекопитающих конца юры и начала мелового периода. В дальнейшем продолжалось совершенствование общей организации, отдельных систем и органов млекопитающих. Правда, в разных эволюционных линиях оно протекало по-разному. Это обусловливало возникновение нескольких направлений ранней эволюции млекопитающих (McKenna, 1969; Crompton, Jenkins, 1979; Rowe, 1988; Novacek, 1990; Kielan-Jaworowska, 1992; Аверьянов, Лопатин, 2011, 2014; Averianov et al., 2013, 2013a; Lopatin, Averianov, 2017). Начиная уже с триаса, в рамках класса Mammalia выделяется несколько крупных стволов: подклассы Eotheria, Prototheria и Theria, их состав и временное распространение показано в табл. 1.
Таблица 1.
Таксономическая структура класса Млекопитающих
| Таксоны | Время |
|---|---|
| CLASSIS MAMMALIA | T3-R |
| subclassis Eotheria Kermack et Mussett 1958 | T3-J2 |
| ordo Morganucodonta (Kermack, Musset et Rigney 1973) | T3-K1 |
| ordo Triconodonta Osborn 1888 | J2-K2 |
| subclassis Prototheria Gill 1872 | T3-R |
| infraclassis Docodontiformes (Kinman 1994) comb. et rank n. | T3-K1 |
| ordo Docodonta Kretzoi 1946 | J2-K1 |
| infraclassis Monotremata (C.L. Bonaparte 1837) rank n. | K1-R |
| ordo Platypoda (Gill 1872) McKenna 1993 | K1-R |
| ordo Tachyglossa (Gill 1872) McKenna 1993 | N1-R |
| infraclassis Allotheria (Marsch 1880) Hopson 1970 | T3-P3 |
| ordo Haramiyida McKenna et Bell 1998 | T3-J1 |
| ordo Multituberculata Cope 1884 | J2-P3 |
| order Gondwanatheria Mones 1987 | K2-Kz |
| subclassis Theria Parker et Haswell 1897 | T3-R |
| infraclassis Pantotheria (Marsh 1880) Simpson 1929 | T3-K2 |
| ordo Kuehneotheria McKenna 1975 | T3-J3 |
| ordo Symmetrodonta (Simpson 1925) | J1-K2 |
| ordo Eupantotheria Kermack et Mussett 1958 | J1-K2 |
| infraclassis Metatheria Huxley 1880 | [J2]K1-K2-R |
| infraclassis Eutheria Huxley 1880 | J2-R |
Расцвет Eotheria и Prototheria приходится на мезозой, Theria – на кайнозой. Морфологические преобразования в этих группах протекали по-разному, что определяло их судьбы на разных этапах эволюционной истории.
Эволюция млекопитающих в мезозое
Для представителей подклассов Eotheria и Prototheria с момента появления их в геологической летописи характерно сложное и специализированное строение зубного аппарата. При этом каждый отряд имел уникальный тип строения зубной системы. Ниже приведена их краткая характеристика.
Подкласс Eotheria Kermack et Mussett 1958
– Отряд Triconodonta. На ранних стадиях эволюции верхние и нижние зубы были сходны по своей морфологии. Количество резцов 3–4. Клык один, хорошо развит. Премоляров 3–5, чаще 4. Моляров 3–5, чаще 4. Щечные зубы имели три крупных бугра, сжатых латерально и вытянутых вдоль продольной оси челюсти. Параллельно им на лингвальной стороне нижних зубов и буккальной стороне верхних присутствуют небольшие дополнительные бугорки по основанию коронки. Бугры островершинные. Таковыми они сохранялись на протяжении всей жизни животного, благодаря стиранию боковых склонов, о чем свидетельствуют фасетки, вытянутые от вершины к основанию коронки. Представители Triconodonta известны в Северной Америке, Южной Америке Евразии, Африке и в Сибири. Они существовали от позднего триаса до конца мела, т.е. более 150 млн лет. На протяжении этого длительного периода во всех регионах представители этого отряда имели примерно одинаковое строение щечных зубов. Правда, к концу нижнего мела наблюдается тенденция преобразования зубной системы. У Gobiconodon из Монголии, например, верхние щечные зубы, в противоположность нижним, имели коронку, расширенную на буккальной стороне. Щечные зубы нижней челюсти, напротив, претерпевали сжатие в трансверзальном направлении, т.е. приобретали разрезающую функцию.
Подкласс Prototheria Gill 1872
– Отряд Docodonta включает несколько семейств. Они существовали на протяжении средней и верхней юры. Описано около 7 родов из Шотландии, Англии, Португалии, Монголии и Северной Америки. Наиболее распространенные из них Docodontidae Marsh 1887. Представители семейства имели небольшие резцы с уплощенной лопатообразной коронкой, в количестве 3–5, один крупный клык. Верхние премоляры одновершинные; несли по одному дополнительному бугорку спереди и сзади от главного бугра. При этом задний бугорок едва выражен, и оба они смещены от продольной оси зуба. Верхние и нижние премоляры имеют сходное строение. Их количество варьирует от 3 до 4. Количество моляров у разных представителей – от 5 до 8. Верхние моляры имеют в плане форму трапеции с закругленными углами, в средней части которой выражено сужение, т.е. длина наружного и внутреннего краев коронки больше, чем длина коронки посередине. Наружная и внутренняя части зуба несут по одному крупному бугру, которые соединены между собой узким поперечным гребнем. При этом лингвальный бугор меньше, чем буккальный.
Значительное своеобразие характерно для нижних моляров. Их коронка вытянута вдоль челюсти и в плане имеет овальную форму. Она несет один крупный бугор на буккальной стороне и два бугра чуть меньших размеров на лингвальной стороне зуба. Все три бугра островершинные и несут небольшие фасетки стирания. Каждый из внутренних бугров соединен с наружным узким гребнем. Задний из этих гребней развит сильнее переднего. Впереди и сзади от этих бугров коронка имеет углубления-долинки, напоминающие талонидные бассейны. При жевании у Docodonta преобладали передне-задние движения, а не поперечные, как у Theria (Butler, 1986). С некоторыми вариациями такое строение имеют представители родов Haldanodon, Docodon, Borealestes, Peraiocynodon (Butler, 1997).
Уклоняющееся строение имеют моляры Simpsonodontidae (Kermack et al., 1987; Averianov et al., 2010; Butler, 1997; Martin, Averianov, 2010). Их верхние моляры не имеют продольного сужения (“перехвата”) в средней части или оно выражено очень слабо. Сами бугорки зубов отличаются массивностью и несколько иным взаиморасположением. Нижние щечные зубы имеют строение, аналогичное строению зубов Docodon, но в задней части коронки имеют несколько небольших складок (“морщин”). Однако расположение бугорков и расположение фасетки стирания остаются сходными у всех представителей Docodonta (Kermack et al., 1987; Lopatin, Averianov, 2005).
За время своего существования докодонты освоили разные экологические ниши, что породило разнообразие адаптивных специализаций. Помимо наземных, известны формы амфибиальные – Castorocauda, лазающие – Agilodocodon и роющие – Docofossor (Ji et al., 2006; Meng et al., 2015; Luo et al., 2015).
Никаких аналогий, а тем более гомологий, моляры Docodonta с тритуберкулярными зубами Eutheria не имеют. Docodonta, безусловно, формировались конвергентно с другими млекопитающими. Хотя были сделаны попытки сближать юрских докодонтов с “симметродонтом” Woutersia из позднего триаса Франции (Sigogneau-Russell, Hahn, 1995; Butler, 1997).
– Отряд Monotremata: его современные представители Ornithorinchus, Tachyglossus и Zaglossus, как известно, лишены зубов во взрослом состоянии. Однако современные утконосы на ранних стадиях постнатального развития имеют щечные зубы и рудименты резцов. Коронки щечных зубов Ornithorinchus по соотношению размеров бугров и гребней отдаленно напоминают зубы Docodonta.
Из отложений позднего олигоцена – раннего миоцена Риверслей Австралии известен Obdurodon, череп которого почти идентичен черепу современного утконоса (Archer et al., 1992). Этот утконос, в отличие от современного, обладал постоянно функционирующими зубами. Вместе с черепом были найдены и отдельные разрозненные зубы. Верхние и нижние премоляры Obdurodon были одновершинные, довольно простого строения, прокалывающего типа. Коронка верхних моляров была образована четырьмя поперечными гребнями, которые попарно были плотно прижаты друг к другу и соединялись на лингвальной стороне зуба, образуя на жевательной поверхности две U-образные структуры. Еще более удивительное строение имели нижние моляры. Их коронки несли 5 бугров: 2 на буккальной стороне и 3 на лигвальной. Два передних бугра, наружный и внутренний, соединены поперечным гребнем. Два задних внутренних бугра соединены поперечными гребнями с одним задним наружным бугром, т.е. задние гребни формируют U-образную структуру (Archer et al., 1992; Pian et al., 2013). Таким образом, нижние моляры Obdurodon не имеют аналогов ни тригонида, ни талонида. По типу образования гребней, которые расположены в задней части зуба (а не в передней, как у Theria), нижние моляры Obdurodon аналогичны молярам Docodonta.
Еще более выразительны щечные зубы Steropodon galmani, представителя Monotremata, найденного в отложениях второй половины раннего мела Австралии (Archer, et al., 1985). Он был описан по фрагменту правой ветви довольно массивной нижней челюсти с тремя молярами М1–3. Образец был найден в отложениях формации Griman Creek, Австралии, возраст которой – конец раннего мела (Альб). Состав фауны: двоякодышащие рыбы (Ceratodus wollastoni, Neoceratodus forsteri), черепахи, плезиозавры, крокодилы, тероподы (Rapator ornitholestoides), орнитоподы (Fulgurotherium australe), зауроподные динозавры.
Судя по сохранившейся альвеоле, последний премоляр у Steropodon был хорошо развит. Совершенно необычно для меловых млекопитающих, и млекопитающих вообще, было строение коронки зубов (Агаджанян, 2003а). Самый маленький из зубов – последний. Два предшествующих зуба – более крупные. Коронки двух первых зубов в проекции имеют форму прямоугольников с округлыми углами. Коронка последнего зуба в проекции напоминает трапецию (рис. 1). Уже этот признак – столь расширенные в основании коронки щечные зубы – не известны для раннемеловых Theria. Два задних зуба (М2 и М3), несмотря на различия в размерах, имеют сходное строение коронки. Они несут по два бугра на буккальной стороне зуба и по три – на лингвальной. Передний буккальный бугор соединен с двумя передними лингвальными буграми островершинными гребнями так, что гребни образуют U-образную структуру. Задний буккальный и задний лингвальный бугры соединены двумя плотно сжатыми гребнями, которые образуют структуру сжатого овала. Передний моляр (М1) имеет по два бугра на буккальной стороне и по два – на лингвальной, которые также соединены поперечными гребнями. В отличие от М2 и М3, на этом зубе гребни не парные. Лишь от заднего буккального бугра, помимо высокого заднего гребня, к лингвальной стороне коронки направлен небольшой передний гребень, который при этом достигает только середины зуба. На всех зубах хорошо развиты передний и задний цингулюмы. Подобных структур нет у меловых Theria. Когда в эволюции Theria появляется талонид и начинает увеличиваться задняя часть коронки, то возникший гипоконид бывает, прежде всего, связан с тригонидом, а конкретно, с метаконидом. Лишь впоследствии формируется энтоконид и еще позже образуется связывающий их гребень. У Steropodon передняя часть зуба, “тригонид”, не связан с его задней частью, “талонидом”. Никакого сходства между зубами Steropodon и представителями Theria уловить не удается. Если еще учесть меловой возраст австралийского животного и сравнить его, например, с меловыми Aegialodon Северного полушария, то станет очевидной огромная морфологическая и эволюционная дистанция между Monotremata и Theria.
Рис. 1.
Фрагмент нижней челюсти Steropodon galmani Archer, Flannery, Rithcie et Molnar 1985: 1 – вид с буккальной (внешней) стороны, 2 – вид с лингвальной (внутренней) стороны, 3 – вид сверху.
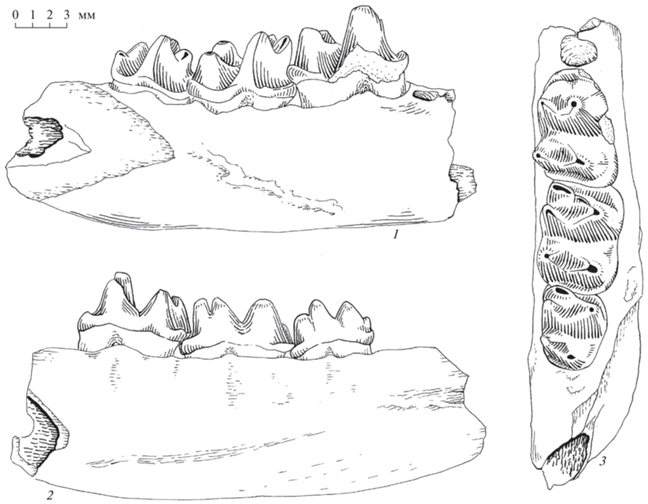
Сравнение щечных зубов Steropodon и Obdurodon, напротив, показывает их очень большое сходство. Средний нижний зуб Steropodon (М2) практически идентичен голотипу Obdurodon insignis. Зубы Obdurodon по общему плану строения не отличаются от зубов Steropodon, но выглядят более специализированными. Не вызывает сомнений то, что сходство и преемственность зубной системы Steropodon–Obdurodon–Ornithorinchus отражают принадлежность названных групп к единой эволюционной линии.
Известны и другие материалы по меловым млекопитающим Австралии. Они получены из отложений формации Вонтагги на юге штата Виктория в местонахождении Флэт Рок (Rich et al., 1999). По наличию спор Pilosisporites notensis и данным циркониевого метода, это местонахождение датируется низами апта: 121–112.5 млн лет. Ausktribosphenos nyktops, описанный по нижней челюсти, отнесен авторами к трибосфеническим млекопитающим, т.е. Eutheria. Однако Арчер (Musser, Archer, 1998) склонен относить его к перамуридам либо к однопроходным. Последнее кажется наиболее вероятным. Моляры Ausktribosphenos имеют укороченную заднюю часть коронки и этим они несколько отличаются от зубов Steropodon, что, по-видимому, и создало сходство с трибосфеническими молярами. Однако взаиморасположение бугров, их наклон и строение гребней, соединяющих эти бугры, более всего напоминают зубы Steropodon и некоторых представителей Docodonta. Кроме того, зубы этих млекопитающих существенно отличаются от моляров плацентарных млекопитающих раннего мела, которые хорошо известны. Напомним, что у позднеюрских симметродонтов верхние и нижние моляры были примерно одинакового строения и не имели талонида, а тем более гипокона. Это подтверждается обширными материалами из Северной Америки и Европы (Simpson, 1928, 1929; Kemp, 2005, 2006). Лишь у некоторых представителей, например Peramus tenuirostris, на нижних зубах появляется маленький низкий бугорок в задней части коронки, который соединяется небольшим гребнем с метаконом. У представителей Theria из раннего мела Азии, таких как Kielantherium, Arguitherium и др., талонид на нижних зубах выражен довольно хорошо, но лишь в виде единственного бугорка, который по размерам значительно уступает тригонидной части зуба. И только у позднемеловых Theria талонидная часть зуба достигает размеров тригонида, например у Deltatheridium, Kennalestes, Zalambdalestes и др. из Монголии, Paleomolops из Техаса, Daulestes из Узбекистана (McKenna, Kielan-Jaworowska, 2000) и даже превышает его по длине. При этом тригонид, как правило, остается шире талонида. Только у кайнозойских насекомоядных талонид превышает по своей ширине тригонид. Если принять трибосфеническую природу зубов Ausktribosphenos, то тогда надо допустить, что австралийские “Placentalia” достигли эволюционного уровня плацентарных Северного Полушария примерно на 100 млн лет раньше. Это утверждение не соответствует фактам, накопленным за последние десятилетия, и его нельзя принять всерьез.
Кроме своеобразного строения зубов, есть и другие доводы против отнесения австралийских меловых млекопитающих к плацентарным. Ausktribosphenos имеет своеобразное строение нижней челюсти. Она тонкая и лишена углового отростка, а ее нижний край изогнут кверху в проксимальной части. Ни один представитель ископаемых и современных Theria, начиная с триасового Kuehneotherium, не имел и не имеет такое строение нижней челюсти. Подобное строение характерно только для Obdurodon и современного Ornithorinchus.
В отложениях формации Вонтагги, названной выше, найден еще один очень интересный образец (Rich et al., 2001, 2016). Это нижняя челюсть, которая имеет небольшой, но хорошо выраженный угловой отросток. По строению суставного отростка, слегка отогнутого внутрь, вытянутого назад и вверх, эта челюсть напоминает челюсть Ornithorinchus. Это указывает на то, что в прошлом морфологическое и адаптивное разнообразие Monotremata было достаточно велико. Ведь в Южном Полушарии они были широко распространены. Из палеоцена Южной Америки, например, описан Monotrematum sudamericanum – форма, близкая по строению зубов к Obdurodon (Pascual et al., 1992, 2002). Не приходиться сомневаться в том, что ареал Monotremata охватывал все южные континенты и на этом обширном пространстве существовали различные таксономические и экологические формы.
Наконец, к Monotrematа был отнесен фрагмент нижней челюсти представителя нового семейства Kollikodontidae, найденный в раннемеловых отложениях (средний альб) формации Гриман Крик Австралии (Flannery et al., 1995). Однако, как показали наши наблюдения, образец Kollikodon не имеет никаких признаков, указывающих на его отношение к Monotrematа. Более всего по своей морфологии он напоминает Phalangiridae.
– Отряд Haramiidae – своеобразная группа, положение которой в системе было довольно долго “болезненно непонятным” (Simpson, 1928, с. 53). Сам Г.Г. Симпсон относил представителей Haramiidae к отряду Multituberculata. Позднее они рассматривались как семейство insertae sedis в рамках Multituberculata. Однако в сводке Пивто, например, они помещены среди терапсид (Piveteau, 1961). В первом издании сводки Мюллера Haramiidae не упоминаются среди млекопитающих, а во втором издании они отнесены к Multituberculata уже в ранге подотряда (Müller, 1970, 1989). Накопление новых материалов (Jenkins et al., 1997) показало, что эта триасовая группа, несомненно, принадлежит млекопитающим, правда, очень своеобразным. Они имели полный набор зубов: резцов 4, клык 1, премоляров 4, моляров 3. Верхние и нижние резцы довольно крупные и направлены вперед. Между третьим и четвертым резцами была небольшая диастема. Клык – крупнее премоляров. Моляры значительно крупнее премоляров. Первые и вторые моляры верхней и нижней челюсти крупнее третьих моляров. Все, и верхние и нижние, моляры несут продольную долинку в центральной части коронки зуба, которая разделяет два ряда бугорков. На верхних зубах буккальные бугорки крупнее лингвальных, на нижних зубах крупнее лингвальные бугорки. При смыкании зубов внутренний ряд бугорков верхних моляров оказывался в продольной долинке (“бассейне”) нижних моляров. По морфологии щечных зубов Haramiyidae более всего напоминают представителей Multituberculata, с которыми они, вероятно, связаны общим предком. Однако их морфология в целом предполагает достаточную удаленность друг от друга двух названных групп. Очень своеобразно строение резцов Haramiyavia. Они небольшие, особенно верхние, и были расположены в челюсти с некоторым интервалом. По-видимому, резцы Haramiyidae в процессе эволюции испытывали некоторую редукцию. Первоначально Haramiyidae были известны только из позднего триаса и ранней юры, хотя и высказывались предположения о возможном присутствии их в средней юре. Из отложений средней юры Англии была описана серия зубов (30 экз.) вновь выделенного семейства Eleutherodontidae (Kermack et al., 1998). Анализ морфологии и механизма жевания убедительно показал, что зубная система Eleutherodon аналогична таковой представителей Haramiyidae. Единственное отличие – несколько большее количество бугорков, которые обрамляют центральную долинку каждого зуба. Щечные зубы Eleutherodon имели сильно развитые корни, что предполагает большие статические нагрузки на коронки зубов при сжатии челюстей. Вместе с тем коронки зубов не имеют явных следов стирания, т.е. нет свидетельства повышенных абразивных нагрузок. Все это предполагает потребление жесткой, но высококалорийной пищи: семян растений и, возможно, беспозвоночных. Большинство харамиид были небольшого размера. Например, Arboroharamiya allinhopsoni из Китая имел череп длиной 30.8 мм. Он имел кожную складку, покрытую мехом, между передними и задними лапами и был способен к планирующему полету (Han et al., 2017). Возраст отложений, в которых была сделана находка, 164–159 млн лет, т.е. начало поздней юры. Можно уверенно предполагать, что зверьки вели древесный образ жизни. Из средней–поздней юры Китая известен и более крупный представитель этого рода: A. jenkinsi, размеры которого на 30–40% превышали размеры A. allinhopsoni (Zheng et al., 2013). Анализ морфологии костей конечностей также указывает на его древесный образ жизни.
– Отряд Multituberculata отличается наибольшим своеобразием зубной системы среди всех мезозойских и раннекайнозойских млекопитающих. Представители группы имели хорошо выраженные черты растительноядной адаптации с момента появления в геологической летописи. Multituberculata существовали более 100 млн лет от юры до середины кайнозоя. На протяжении этого времени их зубная система неуклонно совершенствовалась, сохраняя одновременно первоначальный план строения. Ее отличительные черты – гипертрофированное развитие резцов, особенно передней пары, редукция клыков, образование диастемы, уменьшение в процессе эволюции количества щечных зубов при усложнении структуры каждого из них, формирование в нижней челюсти высококоронкового премоляра режущего типа. Наружные и внутренние бугры щечных зубов не соединялись поперечными гребнями, они туповершинные и обособлены друг от друга. Премоляры Р4 верхние и, особенно, нижние Multituberculata напоминают Р4 некоторых примитивных кенгуру и фалангерид. Виды, существовавшие в палеоцене, обладали крупными резцами, которые, подобно резцам грызунов, были уплощены и лишь спереди покрыты эмалью. Нижние резцы очень рано в эволюции приобрели аризодонтию. Верхние резцы, хотя и сохраняли корни, но сильно редуцированные.
Представители древних семейств Plagiaulacidae и Paulchoffatidae, жившие в юре и раннем мелу, имели почти полный набор зубов: I 3/3; C 1-2/0; P 5-4/4-3; M 2/2. У форм позднего мела и раннего кайнозоя количество зубов заметно уменьшается. Taeniolabididae, например, имели: I 2/1; C 0/0; P 4/2; M 2/2. Уменьшение числа зубов сопровождалось их усложнением, особенно P4, M1, M1–2. Причем у древних Multituberculata строение щечных зубов было подобно таковому у Haramiyidae, т.е. коронка каждого зуба несла два ряда бугорков (по 3–4 в каждом ряду), вытянутых вдоль зуба с глубокой продольной долинкой между ними. У поздних Multituberculata происходят изменения в строении этих зубов. Они несут три ряда бугорков, количество которых в каждом ряду могло достигать 10, и, соответственно, исчезала продольная долинка.
– Отряд Gondwanatheria включает 3 вымерших семейства и 2 вымерших рода incertae sedis. Представители отряда известны из отложений верхнего мела и палеоцена (83.6–55.5 млн лет) на территории континентов, которые в юре входили в состав Гондваны – единого массива суши Южного полушария (Krause et al., 1997). Первоначально они были описаны из Южной Америки. Позднее их остатки были обнаружены в Антарктиде, Южной Африке, на Мадагаскаре и в Индии. На Мадагаскаре две их находки представлены черепами и почти полным скелетом, что позволило уточнить положение группы в системе млекопитающих. Боковая стенка черепной коробки мадагаскарских Adalatherium и Vintana формировалась за счет алисфеноида в передней части и каменистой кости сзади, которые примыкали друг к другу в нижней части черепа. Пространство между ними в верхней части прикрывала чешуйчатая кость (squamosum). Подобное строение черепа имели представители Prototheria. Гондванатерии, вероятно, близки многобугорчатым, являются родственной им, но самостоятельной, группой.
По строению зубной системы гондванатерии разделяются на две клады. В одну из них входят таксоны, представители которых имели низкокоронковые щечные зубы с хорошо выраженными корнями: Ferugliotherium и Trapalcotherium из позднего мела Аргентины (Krause et al., 1992; Rougier et al., 2009; Gurovich, Beck, 2009) и Adalatherium из отложений позднего мела Мадагаскара (Krause et al., 2020). При этом Ferugliotherium и Trapalcotherium имеют сходное строение зубов и по этому признаку отдаленно напоминают хомякообразных. А брахиодонтные моляры Adalatherium имеют своеобразное, уникальное, ни с чем не сравнимое строение и очень отдаленно напоминают щечные зубы Sciuridae. Открытие Adalatherium важно еще и тем, что это единственный гондванатерий, представленный в летописи полным скелетом, который ясно демонстрирует наличие кости epipubis, как и у всех мезозойских млекопитающих.
Другую кладу гондванатериев образуют таксоны, представители которых имели высококоронковые щечные зубы. К ним относятся Gondwanatherium из верхнего мела Аргентины, Sudamerica из раннего палеоцена Аргентины и Антарктиды (Koenigswald et al., 1999), Galulatherium из отложений апт-сеномана Танзании (O’Connor et al., 2019), Lavanify (Krause et al., 1997), Vintana из позднего мела Мадагаскара и Bharattherium из позднего мела Индии (Prasad et al., 2007; Verma et al., 2012). Череп Vintana в целом по своему строению очень похож на череп Adalatherium. Однако щечные зубы Vintana мезодонтные, имеют глубокие входящие складки и островки эмали на жевательной поверхности (Krause et al., 2014), которые заполнены наружным цементом. В стволе териевых млекопитающих подобное строение моляров возникает только в конце кайнозоя, во второй половине миоцена. Это свидетельствует о том, что формирование щечных зубов, в значительной степени адаптированных к питанию растительной пищей, происходило у гондванатериев приблизительно на 60 млн лет раньше, чем у сумчатых и плацентарных млекопитающих. Череп Vintana характеризуется ярко выраженными признаками инадаптивного развития. Его скуловые кости (os jugale) имеют крупные выросты, направленные вниз, со следами крепления жевательной (массетерной) мускулатуры на внешней поверхности. Такое строение скуловых дуг имеют некоторые позднекайнозойские дипродонтные сумчатые Австралии и некоторые неполнозубые Южной Америки.
На основании результатов детального анализа можно предположить родство этой группы с Multituberculata (Gurovich, 2005).
Приведенные выше краткие характеристики мезозойских млекопитающих, за исключением некоторых деталей, не претерпели принципиальных морфологических изменений в течение более чем 160 млн лет существования подклассов Prototheria и Eotheria. Совершенно иначе складывалась эволюция в стволе Theria.
Подкласс Theria Parker et Haswell 1897
Начальная стадия эволюции Theria характеризуется очень простым строением зубной системы. Основу коронки щечных зубов составлял крупный центральный островершинный конус, который дополняли два небольших конуса спереди и сзади от него. При этом верхние и нижние зубы имели практически одинаковое строение на ранних стадиях эволюции. Такой облик имеют зубы Kuehneotherium, древнейшего симметродонта из позднего триаса – ранней юры Шотландии (Kermack et al., 1968). Причем у Kuehneotherium передний и задний бугорки уже несколько смещены от продольной оси коронки: на верхних зубах – наружу, а на нижних зубах – внутрь. В последующей истории отряда Simmetrodonta на протяжении первого этапа эволюции от позднего триаса до середины мела происходил сдвиг первого и третьего бугорков латерально на верхних зубах и медиально на нижних.
Этот процесс предопределяет формирование “прототрибосфенических” зубов у поздних симметродонтов, а в дальнейшем трибосфенических зубов Metetheria и Eutheria. В поздней юре в некоторых линиях начинается обособление площадки будущего талонида на нижних щечных зубах. К позднему мелу талонид достигает по размерам тригонидной части коронки, энтоконид и метаконид соединяются гребнем, формируется бассейн талонида. Коронка нижних щечных зубов вытягивается вдоль оси челюсти. Преобразование верхних щечных зубов протекало иначе. Четвертый, дополнительный, бугор гипокон закладывался в эволюции значительно позднее, только в кайнозое. Однако уже в начале позднего мела коронка верхних щечных зубов расширялась латерально при смещении пара- и метаконов буккально к внешней стороне челюсти. Возникла структурная асимметрия в строении верхних и нижних щечных зубов. Кроме того, в линиях Theria наблюдается неуклонное сокращение количества зубов при дальнейшем усложнении, морфологической и функциональной специализации каждого из них. Параллельно происходят описанные выше изменения в строении всего черепа, особенно базикраниальной его части. Преобразуется посткраниальный скелет, медленно, но неуклонно формируется парасагиттальная постановка конечностей. Одновременно происходит усиление крестца за счет консолидации отдельных позвонков. В линии Eutheria редуцируются, а к началу кайнозоя полностью исчезают эпипубические кости, что знаменует появление специализированной плацентарности.
В целом, в базальной эволюции Mammalia ясно выделяется несколько независимых линий развития:
– Линия Triconodonta характеризуется сходством строения верхних и нижних зубов на ранних этапах эволюции, наличием трех крупных бугров по центральной оси моляров, сжатых латерально.
– Линия Docodonta характеризуется различием в строении верхних и нижних зубов, наличием двух конусов на верхних щечных зубах, расположенных по латеральному и медиальному краям коронки, и наличием поперечного гребня на этих зубах. Средняя часть коронки верхних зубов сжата в передне-заднем направлении.
– Линия Monotremata характеризуется сходством строения верхних и нижних зубов с Docodonta, ископаемые формы утконосов отличаются наличием поперечных гребней, которые образуют две U-образные структуры.
– Линия Haramiidae–Multituberculatа характеризуется сходством морфологии верхних и нижних зубов, наличием на ранних стадиях эволюции продольной долинки по центральной оси зуба, которая обрамляется латерально и медиально рядом небольших туповершинных бугорков.
– Линия Gondwanatheria – некоторые представители имели мезодонтные и даже гипсодонтные щечные зубы, аризодонтные резцы, у некоторых появился наружный цемент. Причем такие признаки приобретены еще в мезозое.
– Линия Theria характеризуется сходством строения верхних и нижних зубов на ранней стадии эволюции, при этом каждый щечный зуб состоит из одного крупного конуса и двух небольших конусов, переднего и заднего, смещенных от продольной оси зуба. Последующие пути и формы преобразования верхних и нижних зубов различны. Верхние зубы расширяются латерально, нижние – вдоль оси челюсти.
Представители пяти первых эволюционных направлений сохраняли в течение всего мезозоя удивительную стабильность строения зубной системы и структуры щечных зубов. Лишь в линиях Haramiidae и Multituberculatа в процессе эволюции наблюдается формирование третьего продольного ряда бугорков.
В линии Theria, начиная со второй половины мела, скорости эволюционных преобразований коронки щечных зубов и резцов неуклонно возрастали. Сначала между протоконом, параконом и метаконом верхних зубов появились промежуточные бугорки: параконуль и метаконуль. В линии Metatheria происходило увеличение коронки за счет стилярной полки (расширения наружного края верхних зубов), в линии Eutheria – за счет увеличения размеров параконуля и метаконуля. В раннем кайнозое в обеих линиях Theria происходит образование гипокона, дополнительного бугорка на верхних молярах. Коронки щечных зубов становятся квадритуберкулярными. В дальнейшем на этой основе формируется все разнообразие зубов современных млекопитающих.
Таким образом, представители одних линий сохраняют стабильность своей морфологии на протяжении многих миллионов лет, представители других – претерпевают значительные морфологические изменения. Возникает вопрос о причинах столь разных судеб различных эволюционных линий Mammalia. По-видимому, таких причин несколько.
Одна из этих причин – природа морфологических преобразований. Постоянство структур фенотипа обеспечивается стабилизирующим отбором и регуляторными механизмами самого организма (Шмальгаузен, 1968). Любое преобразование признака в процессе эволюции возможно только при дестабилизации его адаптивной нормы и увеличении масштабов изменчивости (Шишкин, 1987, 1988, 1988a; Раутиан, 1988, 2006), (рис. 2). Это может происходить лишь при ослаблении стабилизирующего отбора и деструкции регуляторных механизмов. Однако дестабилизация признака, а тем более нескольких признаков одновременно, угрожает существованию таксона. Чем глубже уровень дестабилизации признака и выше уровень его вариабельности, тем больше угроза существованию таксона, но тем более крупное морфологическое преобразование может быть реализовано (рис. 3). Возникает эффект “игольного ушка” – увеличение внутрипопуляционной изменчивости приводит к снижению доли индивидов, максимально адаптированных к данным условиям внешней и внутренней среды. Чем значительнее внутрипопуляционная изменчивость, тем меньше в популяции хорошо адаптированных индивидов. Если дестабилизации подвергается несколько признаков одновременно, угроза существования популяции еще больше возрастает. Именно поэтому в процессе эволюции невозможно одновременное преобразование большого числа признаков, ибо нарушение запрета неизбежно приводит к нарушению преемственности и к элиминации таксона. Поэтому так редко фиксируются крупные морфологические преобразования и, соответственно, появление таксонов высокого ранга. Таким образом, стабильность морфологии скелета, черепа, зубной системы Triconodonta, Docodonta, Monotremata, Multituberculatа и Gondwanatheria объясняется сложностью строения представителей этих отрядов и высоким уровнем специализации с момента их появления в геологической летописи. Представители Theria, напротив, имели наименее специализированную и простую структуру зубов, всей зубной системы и посткраниального скелета. Это определяло их статус “изгоев” в наземной биоте мезозоя. Но при этом они имели меньше рисков и больше шансов на морфогенетические преобразования.
Рис. 2.
Соотношение старой и новой адаптивной нормы признака в процессе дестабилизации и морфогенеза: А – исходное распределение частот значений признака до начала морфогенетического преобразования, В – новое распределение частот значений признака после морфогенетического преобразования. Чем больше дистанция между старой и новой нормой признака, тем меньшее количество особей в популяции адаптировано к условиям среды, тем меньше “игольное ушко”, тем выше риск вымирания популяции и элиминации таксона в ходе исторического развития.
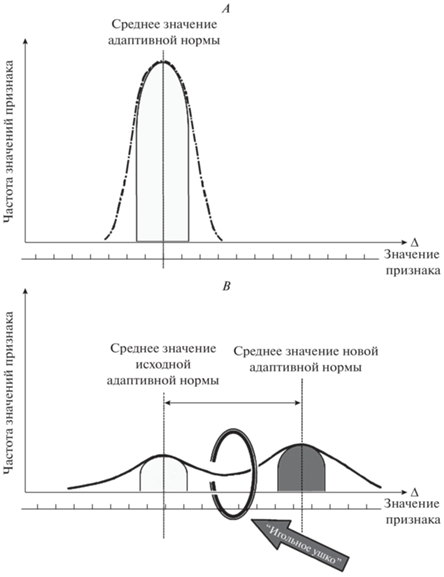
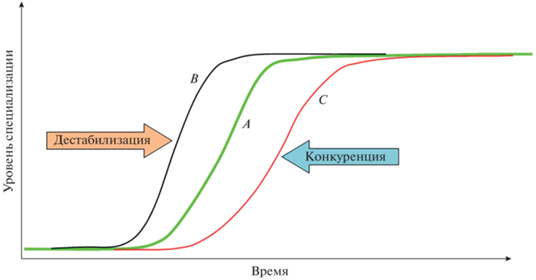
Рис. 3.
Важнейшие факторы (Сцилла и Харибда), определяющие прохождение через “игольное ушко” араморфного преобразования признаков: А – сбалансированный вариант морфогенеза; В – быстрый вариант морфогенеза с кардинальными преобразованиями, резким снижением адаптивных возможностей и высокой вероятностью вымирания; C – замедленный вариант морфогенеза с минимальными преобразованиями, плавным и небольшим снижением адаптивных возможностей и риском быть вытесненным конкурентами.
Существует и дополнительное объяснение. В мезозое структура экологических ниш наземных позвоночных была достаточно плотной. В триасе это было обусловлено адаптивным разнообразием териодонтов, большинство из которых по уровню пищевой специализации значительно превосходили первых млекопитающих. В юре и в мелу господствующее положение в наземных сообществах занимали диапсиды (“динозавры”). Дестабилизация фенотипа первых млекопитающих и связанное с этим нарушение адаптивной нормы могли привести к исчезновению их популяций. Лишь у Theria, имевших подчиненное значение в мезозойской биоте, уровень специализации черепа, зубной системы и посткраниального скелета был невысок, ограничения на ее преобразования были менее жесткими. Структура динозавровых сообществ обусловливала функционирование стабилизирующего отбора, в том числе, и в популяциях млекопитающих. И только после крушения биоты динозавров началась их бурная радиация.
Морфологические преобразования коронки зубов тесно связаны со структурой всего зубного аппарата. Чем сложнее строение и выше специализация отдельных зубов, тем меньше количество таких зубов в зубной системе. Это правило не знает исключений. Ему может быть дано объяснение. Как показывают наблюдения над врожденной тератологией и аберрантными формами зубов современных и ископаемых млекопитающих, на левой и правой сторонах челюсти морфология каждого зуба проявляется независимо друг от друга и может существенно различаться. Это предполагает, что онтогенез каждого зуба определяется сложным набором генов. Поскольку зубы любого млекопитающего образуют единый функциональный ансамбль, реализации геномных программ для каждого зуба должна быть в онтогенезе жестко скоррелирована между собой. Чем полнее зубная система, тем сложнее достигнуть такой корреляции развития. Чем меньше количество зубов, тем могут быть проще и, следовательно, надежнее как геномные, так и регуляторные механизмы их формирования в онтогенезе. По-видимому, именно с этим связано морфологическое разнообразие зубов кайнозойских Theria. Сокращение количественных показателей зубной системы открыло для Theria пути модификации и усложнения каждого зуба (Агаджанян, 2003а). На основании наблюдений можно предположить, что уменьшение количества геномных и регуляторных программ, реализующих одновременно развитие зубной системы в онтогенезе, облегчает их взаимную координацию. Вероятно, это правило может быть распространено на развитие всех систем организма.
Вымирание отрядов Prototheria и Eotheria было предопределено, т.к. они не имели возможности изменить свой статус в сообществе. Переход в крупный размерный класс им был закрыт хищными динозаврами, а в мелком размерном классе их стали в конце мела теснить обладатели трибосфенических щечных зубов, представители Metatheria и Eutheria. При этом некоторые из них, например дидельфид Didelphodon vorax из позднего мела Северной Америки и Канады, достигал размеров небольшой собаки и веса до 6 кг (Fox, Naylor, 2006; Wilson et al., 2016). Судя по строению зубной системы, он занимал экологическую нишу не только хищника, но и падальщика. Кроме того, Eutheria приобрели еще одно важное преимущество – более совершенный тип размножения: плацентарность, формирование которой началось в самом конце позднего мела. Основные направления эволюции млекопитающих в мезозое показаны на рис. 4.
Рис. 4.
Направления адаптивной радиации млекопитающих мезозоя: 1 – различные адаптивные типы поздних териодонтов Cynognatia; 2 – неспециализированное плотоядение, преимущественно беспозвоночными; 3 – специализированное плотоядение, в т.ч. позвоночными; 4 – неспециализированное растительноядение, преимущественно семеноядение, и питание беспозвоночными; 5 – специализированное растительноядение, преимущественно семеноядение, питание генеративными частями растений, луковицами, клубнями, корневищами; 6 – высокоспециализированное растительноядение, включая питание вегетативными частями растений; 7– высокоспециализированное растительноядение, включая питание компонентами травяного покрова; 8 – смешанный тип питания, включающий питание растительными и животными объектами; 9 – преимущественное питание мелкими беспозвоночными; 10 – питание крупными водными беспозвоночными и личинками термитов.
Как известно, современные Monotremata размножаются путем откладывания яиц. При этом строение их генеративной системы имеет большие отличия от таковой других млекопитающих. У Monotremata нет пузырьков vesicula seminalis, коагулянтной железы и дискретной простатической железы, которые характерны для большинства млекопитающих. У Monotremata отсутствуют увеличенная простата и комплекс бульбоуретральных желез, описанных для большинства млекопитающих. Очень своеобразно строение сперматозоидов. У Ornithorynchus и Tachiglossus головка сперматозоида сильно вытянута и имеет периферическое расположение хроматина в ядре, аналогично сперматозоидам птиц.
Развитие яйцевых фолликул Monotremata имеет сходство с таковым у зауропсидных рептилий. Строение покровов яиц Monotremata также типично для яиц зауропсид. Их мукоидная оболочка и скорлупа образуются при овуляции яиц во время их прохождения через фаллопиевы трубы или в матке. Полностью сформировавшаяся скорлупа яиц утконоса и ехидны имеет очень сходную структуру. Ультраструктура поверхности внутриматочных яиц утконоса построена из свободно расположенных нерегулярных гранул, что контрастирует с фиброзной структурой птичьих яиц.
Уникальный репродукционный цикл у самок однопроходных является следствием интеграции маточной желточной секреторной фазы, т.е. они имеют зауропсидный тип репродукции. На формирование основного источника питания эмбриона идут продукты секреции слизистой оболочки матки (во время желточной фазы развития эмбриона), а не яичника.
Физиология размножения Monotremata и архаизм их генеративной системы сохраняют до сегодняшнего дня облик генеративной системы наземных позвоночных триаса, а, вероятно, и более древних этапов эволюции позвоночных. Судя по всему, яйцеоткладывание было характерным типом размножения всех предшественников Monotremata, т.е. Docodonta и Multituberculata. Анализу размножения Multituberculata посвящено специальное исследование (Kielan-Jaworowska, 1979). На основании формы и размеров тазовых костей Kryptobaatar dashzevegi был сделан вывод о том, что Multituberculata, возможно, обладали живорождением, правда, размер появлявшихся на свет детенышей был очень маленький, подобно размерам детенышей современных Marsupialia. Во всех случаях можно утверждать, что ни один из представителей Prototheria не обладал плацентарностью современного тип. Более того, судя по всему, плацентарность, как набор морфологических и физиологических признаков длительного вынашивания эмбрионов, возникла сравнительно недавно даже в стволе Theria.
Маркером появления плацентарности является исчезновение эпипубических (сумчатых) костей. Развитие крупного эмбриона невозможно при наличии эпипубических костей, т.к. они ограничивают размеры брюшной полости. Эти кости имели все териодонты, все известные Prototheria и Eotheria, юрские и меловые Theria и даже позднемеловые Eutheria (Jäger et al., 2020; Kielan-Jaworowska, 1979; Hu et al., 1997; Novacek et al., 1997; Szalay, Trofimov, 1996). Это означает, что плацентарность, как комплекс признаков длительного вынашивания эмбриона, окончательно сформировалась в стволе Eutheria только к началу кайнозоя. Группы, в которых возникла плацентарность, получили существенные преимущества, особенно на стадии пренатального развития. Принципиальное увеличение сроков эмбриогенеза привело к увеличению роли регуляторных механизмов в онтогенетических и филогенетических преобразованиях, сделало эти процессы более пластичными, увеличило скорость эволюционной реакции таксонов на требования внешней среды. Усиление связи организма эмбриона и организма матери оказалось особенно важным для развития и эволюционных преобразований нервной системы и, прежде всего, головного мозга. Именно по уровню развития центральной нервной системы Eutheria принципиально отличаются от Prototheria, Eotheria, Metatheria. Именно центральная нервная система получает гипертрофированное развитие в эмбриогенезе плацентарных. Это объясняется двумя причинами: физиологической и функциональной.
Эмбрион плацентарных, в т.ч. их головной мозг, лучше обеспечивается кислородом и питательными веществами, чем детеныш Metatheria, висящий на соске в сумке матери. Кроме того, новорожденный детеныш сумчатого должен обладать мощной лицевой и челюстной мускулатурой для реализации функции сосания, что накладывает ограничения на постнатальные преобразования черепа.
У плацентарных на эмбриональной стадии головной мозг, центральная нервная система, пребывают в функциональной паузе. Развитие “органа” (головного мозг) жестко не связано с существованием эмбриона. Отсутствие прямой связи между развитием эмбриона и структурой центральной нервной системы снимает запреты на ее преобразование. Невозможно существование системы, в которой головной мозг преобразовывался бы сам и одновременно отвечал бы за нормальное функционирование развивающегося организма. Продолжительная беременность удлинила сроки онтогенетического развития центральной нервной системы и, следовательно, повысила возможности ее преобразования и усложнения. Таким образом, плацентарность явилась для позвоночных спусковым механизмом эволюции головного мозга.
Это хорошо видно при сравнении головного мозга различных представителей класса Mammalia. Морфология мозга довольно хорошо изучена по слепкам и отливкам полости черепной коробки триконодонтид, докодонтов, мультитуберкулят и эупантотериев (Simpson, 1928; Lillegraven, Krust, 1991; Kielan-Jaworowska, 1983, 1986; Krause, Kielan-Jaworowska, 1993). Установлено, что они имели сходное строение головного мозга, для которого было характерно слабое развитие полушарий переднего мозга. Большие полушария головного мозга имели продолговатую форму, по своим размерам лишь незначительно превышали обонятельные доли и были лишены складок. У всех мезозойских млекопитающих, включая Eupantotheria (непосредственных предков Metatheria и Eutheria), большие полушария не перекрывали мозжечка. При этом размеры самого мозжечка едва превышали диаметр спинного мозга. У современных ехидны и утконоса, в противоположность мезозойским млекопитающим, передние полушария значительно превышают по своим размерам обонятельные доли и частично прикрывают переднюю часть мозжечка. Кроме того, у ехидны лобные доли несут по две складки, которые разделяют соматосенсорную и моторную, зрительную и аудиторную области кортекса (Rowe, Bohringer, 1992). Все это резко контрастирует с морфологией центральной нервной системы современных млекопитающих, полушария головного мозга которых значительно превышают по размерам обонятельные доли и полностью покрывают мозжечок. Исключение составляют, например, тенреки, у которых мозжечок не полностью прикрыт полушариями головного мозга.
Внутри группы Metatheria и Eutheria также существуют значительные различия в величине и пропорциях головного мозга. Хорошо известны сопоставления мозговой полости черепов сумчатого волка (Thylacinus) и волка (Canis), сумчатого дьявола (Sarcophilus) и росомахи (Gulo) (Weber, 1927). Имея сходные размеры и схожую экологию, названные представители сумчатых имеют значительно меньший объем черепной коробки, чем их аналоги плацентарных.
Увеличение размеров головного мозга ярко выражено и в эволюции плацентарных. Сопоставление представителей лошадеобразных (эоценового Hyracotherium, олигоценового Mesohippus, раннемиоценового Anchitherium, позднемиоценового Merychippus, плиоценового Pliohippus и плейстоценовой Equus) показывает неуклонное увеличение размеров головного мозга, увеличение количества и усложнение складок коры (Edinger, 1948). Выразительную картину дает сравнение небольшого головного мозга эоценового Dinoceras и крупного мозга современной Equus (Weber, 1927). Тенденция увеличения головного мозга ярко выражена в эволюции приматов (Szalay, Delson, 1979).
Важно подчеркнуть, что начало принципиальных преобразований головного мозга приходится на палеоцен и совпадает по времени с исчезновением сумчатых костей у Eutheria, т.е. с появлением совершенной плацентарности.
Список литературы
Аверьянов А.О., Лопатин А.В., 2011. Филогения Триконодонтов и Симметродонтов и происхождение современных млекопитающих // Доклады Академии наук. Т. 436. № 2. С. 276–279.
Аверьянов А.О., Лопатин А.В., 2014. О филогенетическом положении Однопроходных млекопитающих (Mammalia, Monotremata) // Палеонтологический журнал. № 4. С. 83–104.
Агаджанян А.К., 2003. Вопросы ранней радиации млекопитающих // Палеонтологический журнал. № 1. С. 78–91.
Агаджанян А.К., 2003а. Адаптивная радиация млекопитающих: основные этапы // Палеонтологический журнал. № 2. С. 73–81.
Еськова К.А., Рутовская М.В., Ивлев Ю.Ф., 2022. Тепловые окна у русской выхухоли. Млекопитающие в меняющемся мире: актуальные проблемы териологии. (XI Съезд Териологического общества при РАН). Материалы конференции с международным участием, 14–18 марта 2022 г., г. Москва, ИПЭЭ РАН. М.: Товарищество научных изданий КМК. С. 109.
Ковалевский В.О., 1875. Остеология двух ископаемых видов из группы копытных. Entelodon и Gelocus aymardi // Известия Императорского общества любителей естествознания, антропологии и этнографии. Т. XVI. Вып. 1. С. 2–61.
Ковалевский В.О., 1948. Об Anchitherium aurelianense Cuv. и о палеонтологической истории лошадей. 1873. В.О. Ковалевский. Палеонтология лошадей. Изд. АН СССР. С. 1–147.
Ковалевский В.О., 1948а. Остеология Anchitherium aurelianense Cuv. как формы, выясняющей генеалогию типа лошадей. 1873. В.О. Ковалевский. Палеонтология лошадей. Изд. АН СССР. С. 153–252.
Каландадзе Н.Н., Раутиан А.С., 1993. Юрский экологический кризис сообщества наземных тетрапод и эвристическая модель сопряженной эволюции сообщества и биоты // Проблемы доантропогенной эволюции биосферы. М.: Наука. С. 60–95.
Лопатин А.В., 2013, Новые находки раннемеловых млекопитающих в Монголии // Доклады Академии Наук. Т. 449. № 4. С. 491–493.
Лопатин А.В., Аверьянов А.О., Мащенко Е.Н., Лещинский С.В., 2009. Раннемеловые млекопитающие Западной Сибири. 2. Tegotheriidae // Палеонтологический журнал. № 4. С. 92–100.
Лопатин А.В., 2018. Современные данные о происхождении и ранней радиации млекопитающих // Зоологический журнал. Т. 97. № 8. С. 1013–1020.
Раутиан А.С., 1988. Палеонтология как источник сведений о закономерностях и факторах эволюции // Современная палеонтология. Т. 2. М.: Недра. С. 76– 118.
Раутиан А.С., 2006. Букет законов эволюции. Эволюция биосферы и биоразнообразия. Ред. С.В. Рожнов. М.: Товарищество научных изданий КМК. С. 20–18.
Ромер А.Ш., Парсонс Т., 1992. Анатомия позвоночных. Т. 1. М.: Мир. 355 с.
Татаринов Л.П., 1974. Териодонты СССР // Труды Палеонтологического института АН СССР. Т. 143. М.: Наука. 251 с.
Татаринов Л.П., 1976. Морфологическая эволюция териодонтов и общие вопросы филогенетики. М.: Наука. 258 с.
Татаринов Л.П., 1999. Носовая полость, максиллярная сенсорная система и некоторые особенности головного мозга иктидозухоидей (Reptilia, Theriodontia) // Палеонтологический журнал. № 1. С. 101–113.
Шишкин М.А., 1987. Индивидуальное развитие и эволюционная теория // Эволюция и биоценотические кризисы. М.: Наука. С. 76–124.
Шишкин М.А., 1988. Эволюция как эпигенетический процесс // Современная палеонтология. Т. 2. С. 142– 169.
Шишкин М.А., 1988а. Закономерности эволюции онтогенеза. Современная палеонтология. Том 2. С. 169– 209.
Шмальгаузен И.И., 1968. Факторы эволюции. Теория стабилизирующего отбора. М.: Наука. 451 с.
Allin E.F., Hopson J.A., 1992. Evolution of the auditory system in Synapsida (“mammalian-like reptiles” and primitive mammals) as seen in the fossil record // The evolution biology of hearing. New York– Berlin etc.: Springer-Verlag. P. 587–614.
Archer M., Flannery T.F., Ritchie A., Molnar R.E., 1985. First Mesozoic mammal from Australia – an Early Cretaceous monotreme // Nature. V. 318. P. 363–366.
Archer M., Jenkins F., Hand S.J., et al., 1992. Description of the skull and non-vestigial dentition of a Miocene platypus (Obdurodon diksoni n.sp.) from Riversleigh, Australia, and the problem of monotreme origins // Platypus and Echidnas. N.S. Wales: Publ. Royal Zool. Soc. P. 15–27.
Averianov A.O., Lopatin A.V., Krasnolutskii S.A., Ivantsov S.V., 2010. New Docodontans from the Middle Jurassic of Siberia and reanalysis of Docodonta interrelationships // Proceed. of the Zoological Institute RAS. V. 314. № 2. P. 121–148.
Averianov A., Martin T., Lopatin A., Krasnolutskii S.A., 2013. Stem therian mammal Amphibetulimus from the Middle Jurassic of Siberia. Paläontologische Zeitschrift. Scientific Contributions to Palaeontology. S. 1–10. ISSN 0031-0220.
Averianov A.O., Martin Th., Lopatin A.V. b., 2013a. A new phylogeny for basal Trechnotheria and Cladotheria and affinities of South American endemic Late Cretaceous mammals. Naturwissenschaften. Bd. 100. S. 311–326. https://doi.org/10.1007/s00114-013-1028-3
Bemmelen J.F. van, 1901. Der Schädelbau der Monotremen // Semons Zool. Forschungsreisen in Australien usw. Jena. Dritter Band: Monotremen und Marsupialier. II. Lieferung IV. 94 S.
Butler P.M., 1986. Docodont molars as tribosphenic analogues (Mammalia, Jurassic) // Mem. Museum. Nat. Histoir, Paris, Ser. C. V. 53. P. 329–340.
Butler P.M. 1997. An alternative hypothesis on the origin of Docodont molar teeth // Journal of Vertebrate Paleontology. V. 17 (2). P. 435–439.
Clemens W.A., Kielan-Jaworowska Z., 1979. Multituberculata // Mesozoic mammals: the first two-thirds of mammalian history. Ed. J.A. Lillegraven, Z. KielanJaworowska, W.A. Clemens. Berkely: Univ. California Press. P. 99–149.
Crompton A.W., Ai-Lin Sun., 1985. Cranial structure and relationships of the Liassic mammal Sinoconodon // Zool. J. Linn. Soc. V. 85. P. 99–119.
Crompton A.W., Jenkins F.A., 1979. Origin of mammals// Mesozoic mammals: the first two-thirds of mammalian history. Ed. J.A. Lillegraven, Z. Kielan- Jaworowska, W.A. Clemens. Berkely: Univ. California Press. P. 59–73.
Edinger T., 1948. Evolution of horse brain. Mem. Geol. Soc. Amer., mem. 25. P. 1–177.
Flannery T.F., Archer M., Rich T.H., Jones R., 1995. A new family of monotremes from the Cretaceous of Australia. Nature. V. 377. № 6548. P. 418–420.
Fox R.C., Naylor B.G., 2006. Stagodontid marsupials from the Late Cretaceous of Canada and their systematic and functional implications // Acta Palaeontologica Polonica. V. 51. № 1. P. 13–36.
Gurovich Y., 2005. Bio-Evolutionary aspects of Mesozoic Mammals: Description, phylogenetic relationships and evolution of the Gondwanatheria, (Late Cretaceous and Paleocene of Gondwana). Tesis presentada para obtener el título de Doctor de la Universidad de Buenos Aires en el area de Ciencias Biológicas. Buenos Aires. P. 1–546.
Gurovich Y., Beck, R., 2009. The phylogenetic affinities of the enigmatic mammalian clade Gondwanatheria // Journal of Mammalian Evolution. V. 16. № 1. P. 25–49.
Han G., Mao F., Bi S., Wang Y., Meng J., 2017. A Jurassic gliding euharamiyidan mammal with an ear of five auditory bones // Nature. V. 451–466.
Hopson J.A., Kielan-Jaworowska Z., Allin E.F., 1989. The cryptic jugal of multituberculates // Journal of Vertebrate Paleontology. V. 9. № 2. P. 201–209.
Hopson J.A., Rougier G.W., 1993. Braincase structure in the oldest known skull of therian mammal: inplications for mammalian systematics and cranial evolution // Amer. J. Sci. V. 293. P. 268–299.
Hu Y., Wang Y., Luo Z., Li C., 1997. A new symmetrodont mammal from China and its implications for mammalian evolution // Nature. V. 390. № 13. P. 137–142.
Jäger K.R.K., Luo Z.-X., Martin T., 2020. Postcranial skeleton of Henkelotherium guimarotae (Cladotheria, Mammalia) and locomotor adaptation // Journal of Mammalian Evolution. V. 27. P. 349–372.
Jenkins F.A., Gatesy S.M., Shubin N.H., Amaral W.W., 1997. Haramiyids and Triassic mammalian evolution // Nature. V. 385. № 20. P. 715–718.
Ji Q., Zhe-Xi Luo, Ji Shu’an., 1999. A Chinese triconodont mammal and mosaic evolution of the mammalian skeleton // Nature. № 398. P. 326–330.
Ji Q., Luo, Z. X., Yuan C.-X., Tabrum A.R., 2006. A swimming mammaliaform from the Middle Jurassic and ecomorphological diversification of early mammals // Science, V. 311. P. 1123–1126.
Kemp T.S., 2005. The Origin and Evolution of Mammals. Oxford University Press. 331 p.
Kemp T.S., 2006. The origin and early radiation of the therapsid mammal-like reptiles: a palaeobiological hypothesis // Journal Compilation European Society for Evolutionary Biolog. P. 1231–1247.
Kermack K.A., Mussett F., 1958. The jaw articulation of the Docodonta and the classification of Mesozoic mammals // Proc. Royal Soc. Ser. B. V. 148. P. 204–215.
Kermack D.M., Kermack K.A., Mussett F., 1968. The Welsh pantothere Kuehneotherium praecursoris // Zool. J. Linn. Soc. V. 47. № 312. P. 407–423.
Kermack K.A., Kermack D.M., Lees P.M., Mills J.R.E., 1998. New multituberculate-like teeth from the Middle Jurassic of England // Acta Palaeontologica Polonica. V. 43. № 4. P. 581–606.
Kermack K.A., Kielan-Jaworowska Z., 1971. Therian and nontherian mammals // Zool. J. Linn. Soc. V. 50. Suppl. 1. P. 103–115.
Kermack K.A., Lee A.J., Lees P.M., Mussett F., 1987. A new docodont from the Forest Marble. Zoological // Journal of the Linnean Society. V. 89. P. 1–39.
Kermack K.A., Mussett F., Rigney H.W., 1981. The skull of Morganucodon // Zool. J. Linn. Soc. London. V. 71. P. 1–158.
Kielan-Jaworowska Z., 1979. Pelvis structure and nature of reproduction in Multituberculata // Nature. V. 277. № 5695. P. 402–403.
Kielan-Jaworowska Z., 1983. Multituberculate endocranial casts // Palaeovertebrata. V. 13. № 1–2. P. 1–12.
Kielan-Jaworowska Z., 1986. Brain evolution in Mesozoic mammals // Contributions to Geology, University of Wyoming. Special paper 3. P. 21–34.
Kielan-Jaworowska Z., 1992. Interrelationships of Mesozoic mammals // Histor. Biol. V. 6. P. 185–202.
Kielan-Jaworowska Z., Cifelli R., Luo Zhe-Xi., 2004. Mammals from the age of dinosaurs: origins, evolution, and structure. New York: Columbia University Press. 630 p.
Kielan-Jaworowska Z., Gambaryan P.P., 1994. Postcranial anatomy and habits of Asian multituberculate mammals // Fossils & strata. № 36. 92 p.
Koenigswald W. v., Goin F., Pascual R., 1999. Hypsodonty and enamel microstructurein the Paleocene gondwanatherian mammal Sudamerica ameghinoi // Acta Palaeontologica Polonica. V. 44 (3). P. 263–300.
Krause D.W., Kielan-Jaworowska Z., Bonaparte J.F., 1992. Ferugliotherium Bonaparte, the first known multituberculate from South Africa // J. Vert. Paleont. V. 12. P. 351–376.
Krause D.W., Kielan-Jaworowska Z., 1993. The endocranial cast and encephalization quotient of Ptilodus (Multituberculata, Mammalia) // Palaeovertebrata. V. 22. № 2–3. P. 99–112.
Krause D.W., Prasad G.V.R., von Koenigswald W., Sahni A., Grinek F.E., 1997. Cosmopolitanism among Gondwanan Late Cretaceous mammals // Nature. V. 390. P. 504–507.
Krause D.W., Hoffmann S., Wible J.R., Kirk E.C., Schultz J.A., von Koenigswald W., Groenke J.R., Rossie J.B., O’Connor P.M., Seiffert E.R., Dumont E.R., Holloway W.L., Rogers R.R., Rahantarisoa L.J., Kemp A.D., Andriamialison H., 2014. First cranial remains of a gondwanatherian mammal reveal remarkable mosaicism // Nature. V. 515. P. 513–527.
Krause D.W., Hoffmann S., Hu Y., Wible J.R., Rougier G.W, Kirk E.Ch., Groenke J.R., Rogers R.R., Rossie J.B., Schultz J.A., Evans A.R., Koenigswald von W., Rahantarisoa L.J., 2020. Skeleton of a Cretaceous mammal from Madagascar reflects long-term insularity // Nature. V. 581. P. 421–439.
Lillegraven J.A., Krust G., 1991. Cranio-mandibular anatomy of Haldanodon expectatus (Docodonta; Mammalia) from the Late Jurassic of Portugal and its implications to the evolution of mammalian characters // Contrib. Geol. Univ. Wyoming. V. 28. № 2. P. 39–138.
Lopatin A.V., Averianov A.O., 2005. A new Docodont (Docodonta, Mammalia) from the Middle Jurassic of Siberia // Doklady Biological Sciences. V. 405. P. 434–436.
Lopatin A.V., Averianov A.O., 2009. Mammals that coexisted with dinosaurs finds on Russian territory // Vestnik Rossiiskoi Akademii Nauk. V. 79. № 6. P. 523–529.
Lopatin A.V., Averianov A.O., 2017. The stem placental mammal Prokennalestes from the Early Cretaceous of Mongolia // Paleontological Journal. V. 51. № 12. P. 1293–1374.
Luo Z.X., Meng Q.J., Ji Q., Liu D., Zhang Y.G., Neander A.I., 2015. Evolutionary development in basal mammaliaforms as revealed by a docodontan // Science. V. 347 (6223). P. 760–764.
Martin T., Averianov A.O., 2010. Mammals from the Middle Jurassic Balabansai Formation of the Fergana Depression, Kyrgyzstan // Journal of Vertebrate Paleontology. V. 30. P. 855–871.
McKenna M.C., 1969. The origin and early differentiation of therian mammals // Ann. New York Acad. Sci. V. 167. P. 217–240.
McKenna M.C., Kielan-Jaworowska Z., 2000. Earliest eutherian mammal skull, from the Late Cretaceous (Coniacian) of Uzbekistan // Acta Paleontol. Pol. V. 45. № 1. P. 1–54.
Meng Q.J, Ji Q., Zhang Y.G., Liu D., Grossnickle D.M., Luo Z.X., 2015. An arboreal docodont from the Jurassic and mammaliaform ecological diversification // Science. V. 347. P. 764–768.
Mesozoic mammals: the first two-thirds of mammalian history, 1979. Ed. J.A. Lillegraven, Z. Kielan-Jaworowska, W.A. Clemens. Berkeley: Univ. California Press. 311 p.
Miao D., 1988. Skull morphology of Lambdopsalis bulla (Mammalia, Multituberculata) and its implications to mammalian evolution. Spec. pap., Univ. Wyoming. Contr. Geol. № 4. P. 1–104.
Müller A.H., 1970. Lehrbuch der Paläozoologie. Band III. Vertebraten, Mammalia. Jena: VEB Gustav Fischer Verlag. 855 S.
Müller A.H., 1989. Lehrbuch der Paläozoologie. Band III. Vertebraten, Mammalia. Jena: VEB Gustav Fischer Verlag. 865 S.
Musser A.M., Archer M., 1998. New information about the skull and dentary of the Miocene platypus Obdurodon dicksoni, and a discussion of ornithorhynchid relationships // Philos. Trans. Royal Soc. of London. Ser. B. V. 353. P. 1063–1078.
Novacek M.J., 1986. Origin and transformation of the mammalian stapes // Contrib. Geol. Univ. Wyoming. Spec. Pap. 3. P. 35–53.
Novacek M.J., 1990. Morphology, paleontology, and the higher clades of mammals // Current mammalogy. V. 2. Ed. H.H. Genoways. N.Y.: Plenum Publ. Corp. P. 507–543.
Novacek M.J., Rougler G.W., Wible J.R., McKenna M.C., Dashzeveg D., Horovitz I., 1997. Epipubic bones in eutherian mammals from the Late Cretaceous of Mongolia // Natura. V. 389. № 2. P. 483–485.
O’Connor P.M., Krause D.W., Stevens N.J., Groenke J.R., MacPhee R.D.E., Kalthoff D.C., Roberts E.M., 2019. A new mammal from the Turonian–Campanian (Upper Cretaceous) Galula Formation, southwestern Tanzania // Acta Palaeontologica Polonica. V. 64. № 1. P. 65–84.
Parrington F.R., 1979. The evolution of the mammalian middle and outer ears: a personal review // Biol. Rev. V. 54. P. 369–387.
Pascual R., Archer M., Jaureguizar E.O., Prado J.L., Godthelp H., Hand S.J., 1992. First discovery of monotremes in South America // Nature. V. 356. P. 704–705.
Pascual R., Goin F.J., Balarino L., Udrizar Sauthier D.E., 2002. New data on the Paleocene monotreme Monotrematum sudamericanum, and the convergent evolution of triangulate molars // Acta Palaeontologica Polonica. V. 47. № 3. P. 487–492.
Pian R., Archer M., Hand S.J., 2013. A new, giant platypus, Obdurodon tharalkooschild, sp. nov. (Monotremata, Ornithorhynchidae), from the Riversleigh World Heritage Area, Australia // Journal of Vertebrate Paleontology. V. 33. № 6. P. 1255–1259.
Piveteau J., 1961. Traite de Paleontologie. Tome VI. L’origine des Mammiferes et les aspects fondamentaus de leur evotulion. Paris. 1135 p.
Prasad G.V.R., Verma O., Sahni A., Krause D.W., Khosla A., Parmar V., 2007. A new Late Cretaceous Gondwanatherian mammal from Central India // Proc. Indian Natn. Sci. Acad. V. 73. № 1. P. 17–24.
Qiang J., Zhexi L., Shu-an J., 1999. A Chinese triconodont mammal and mosaic evolution of the mammalian skeleton // Nature. V. 398. P. 326–330.
Rich T.H., Hopson J.A., Gill P.G., Trusler P., Rogers-Davidson S., Morton S., Cifelli R.L., Pickering D., Kool L., Siu K., Burgmann F.A., Senden T., Evans A.R., Wagstaff B.E., Seegets-Villiers D., Corfe I.J., Flannery T.F., Walker K., Musser A.M., Archer M., Pian R., Vickers-Rich P., 2016. The mandible and dentition of the Early Cretaceous monotreme Teinolophos trusleri // Australasian Journal of Palaeontology. Alcheringa 40, ISSN 0311-5518.
Rich T.H., Vickers-Rich P., Constantine A., Flannery T.F., Kool L., Van Klaveren N., 1999. Early Cretaceous mammals from Flat Rocks, Victoria, Australia // Records of the Queen Victoria Museum and Art Gallery. № 106. P. 1–34.
Rich T.H., Vickers-Rich P., Trusler P., Flannery T.F., Cifelli R., Constantine A., Kool L., van Klaveren N., 2001. Monotreme Nature of the Australian Early Cretaceous mammal Teinolophos // Acta Palaeontologica Polonica. V. 46. № 1. P. 113–118.
Rougier G.W., Chornogubsky L., Casadio S., Arango N.P., Giallombardo A., 2009. Mammals from the Allen Formation, Late Cretaceous, Argentina // Cretaceous Research. V. 30. P. 223–238.
Rowe M.J., Bohringer R.C., 1992. Functional organization of the cerebral cortex in Monotremes. Platypus and echidnas. Ed. Augee M.L. // Royal Zool. Soc. New South Wales. Mosman. P. 177–193.
Rowe T., 1988. Definition, diagnosis, and origin of Mammalia // J. Vertebr. Paleontol. V. 8. № 3. P. 241–264.
Sigogneau-Russell D., Hahn, R., 1995. Reassessment of the late Triassic symmetrodont mammal Woutersia // Acta Palaeontologica Polonica. V. 40. 3. P. 245–260.
Simpson G.G., 1928. A catalogue of the Mesozoic Mammalia in the Geological Department of the British Museum. London, Willam Clowes & Sons, Limited. 208 p.
Simpson G.G., 1929. American Mesozoic Mammalia. London, New Haven – Yale University Press. 171 p.
Simpson G.G., 1938. Osteography of the ear region in Monotremes // Amer. Museum Novitas. № 978. P. 1–15.
Szalay F.S., Delson E., 1979. Evolutionary history of the primates. London: Academic press, INC. 580 p.
Szalay F.S., Trofimov B.A., 1996. The Mongolian Late Cretaceous Asiatherium, and the early phylogeny and paleobiogeography of Metatheria // Journal of Vertebrate Paleontology. V. 16. № 3. P. 474–509.
Verma O., Prasad G.V.R., Khosla A., Parmar V., 2012. Late Cretaceous Gondwanatherian mammals of India: distribution, interrelationships and biogeographic implications // Journal of the Palaeontological Society of India. V. 57. № 2. P. 95–104.
Weber M., 1927. Die Säugetiere. Einfürung in die Anatomie und Systematik der recenten und fossilien Mammalia. Jena: Verlag von Gustav Fischer. B. I. 444 S.
Wible J.R., Hopson J.A., 1993. Basicranial evidence for early mammal phylogeny // Mammal phylogeny. N. Y.: Springer-Verlag. P. 45–62.
Wilson G.P., Ekdale E.G., Hoganson J.W., Calede J.J., Linden A.V., 2016. A large carnivorous mammal from the Late Cretaceous and the North American origin of marsupials // Nature Communications. 7:13734. https://doi.org/10.1038/ncomms13734www.nature.com/ naturecommunications
Zheng X., Bi S., Wang X., Meng J., 2013. A new arboreal haramiyid shows the diversity of crown mammals in the Jurassic period // Nature. V. 500. P. 199–202.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


