Биоорганическая химия, 2020, T. 46, № 4, стр. 396-403
Цитоскелетный белок зиксин модулирует экспрессию генов-мишеней Shh cигнального каскада в клетках нервной пластинки эмбрионов шпорцевой лягушки Xenopus laevis
Н. Ю. Мартынова 1, Е. А. Паршина 1, Ф. М. Ерошкин 1, А. Г. Зарайский 1
1 Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 ГСП Москва, В:437, ул. Миклухо-Маклая, 16/10, Россия
Поступила в редакцию 19.12.2019
После доработки 20.12.2019
Принята к публикации 24.12.2019
Аннотация
Ранее, в результате исследования роли цитоскелетного белка зиксина в процессах дифференцировки клеток в зачатке центральной нервной системы (ЦНС) шпорцевой лягушки Xenopus laevis, мы обнаружили его взаимодействие с тремя компонентами сигнального каскада секретируемого фактора Sonic hedgehog (Shh): трансмембранным рецептором Shh – Patched2 (Ptc2), а так же транскрипционными регуляторами Gli1 и Zic1. В настоящей работе мы изучили влияние нокдауна зиксина на экспрессию некоторых ключевых белков Shh-каскада. Методом ОТ-к ПЦР было показано, что подавление трансляции зиксина усиливает ингибирующее действие Shh на экспрессию таких генов-мишеней этого каскада, как Pax6, Irx3 и Dbx2, а также влияет на количество транскриптов ряда генов, кодирующих белки, непосредственно обеспечивающих функционирование Shh-каскада: Shh, Gli1, Ptc2 и Zic1. В результате предложена гипотеза о том, что зиксин участвует в регуляции пространственной разметки клеток нервной пластинки за счет ингибирующего влияния на Shh-каскад.
ВВЕДЕНИЕ
Зиксин – лим-доменный белок (LIM-domain protein), локализованный преимущественно во внутриклеточной части клеточных контактов, где он регулирует динамику актинового цитоскелета, – был впервые идентифицирован в 1991 г [1]. В последнее время зиксин привлекает все большее внимание в связи с его способностью к перемещению в ядро при механических воздействиях и регулировать там генную экспрессию [2]. В связи с этим можно предположить, что зиксин может оказывать модулирующее влияние на функционирование различных сигнальных каскадов, связывающих внешние воздействия на клетку с генной экспрессией. Такое предположение базируется на следующих данных, полученных как в нашей лаборатории, так и в мировой литературе:
— зиксин, благодаря своей локализации в подмембранном пространстве, способен взаимодействовать с трансмембранными рецепторами различных лигандов и влиять на передачу от них сигналов внутрь клетки. Примером, подтверждающим возможность подобного взаимодействия, является связывание зиксина с гомодимерным трансмембранным гликопротеином эндоглином – рецептором III типа для TGF-β (transforming growth factor β) [3], а так же данные, полученные в нашей лаборатории о взаимодействии зиксина с трансмембранным рецептором фактора Hh – Patched2 (Ptc2) [4];
— как было показано ранее на культуре клеток [5] и в наших недавних работах на клетках нервной пластинки зародышей Xenopus для транскрипционных регуляторов Shh-каскада Gli1 и Zic1, зиксин оказывает влияние на генную экспрессию, связывая транскрипционные факторы и изменяя их внутриклеточную локализацию благодаря своей сигнальной последовательности экспорта из ядра (NES – от nuclear export signal] [6, 7];
— предполагается, что зиксин, перемещаясь в ядро, может влиять на транскрипционную активность генов за счет взаимодействия с регуляторными участками ДНК и/или с определенными транскрипционными факторами и их белковыми партнерами, что так же подтверждено как мировыми исследованиями [8] так и данными, полученными нами для транскрипционного репрессора Xanf1 [9, 10].
В настоящей работе мы изучили на эмбрионах шпорцевой лягушки Xenopus laevis влияние трансляционного нокдауна зиксина, вызванного с помощью инъекций морфолиновых олигонуклеотидов, на экспрессию ряда генов, кодирующих белки, участвующие в функционировании Shh-каскада. В результате было показано, что подавление трансляции мРНК зиксина вызывает ингибирование экспрессии самого Shh, одного из трех основных эффекторов этого каскада, транскрипционного фактора Gli2, а также транскрипционного фактора Zic5, участвующего в формировании нервного гребня [11]. В то же время, наблюдалось усиление транскрипции трансмембранного рецептора Smo и транскрипционного фактора Zic1, образующего тройной комплекса с зиксином и фактором Gli1 и способствующего перемещению этого комплекса в ядро [7]. Кроме этого, показано, что при снижении уровня зиксина происходит усиление ингибирования генов-мишеней Shh-каскада, которые подавляются в ответ на высокие концентрации Shh.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Подавление трансляции эндогенного зиксина морфолиновыми олигонуклеотидами
Для микроинъекций в зародыши использовалось 2 типа морфолиновых олигонуклеотидов, первые блокировали трансляцию его эндогенной мРНК за счет связывания с ее 5' областью в районе инициации трансляции (МО Zyxin), другие связывались с последовательностью мРНК на границе 3 экзона и 3 интрона (5588–5613 н.п.) и нарушали ее сплайсинг (Splice MO). Поскольку ранее применение морфолиновых олигонуклеотидов, блокирующих трансляцию мРНК эндогенного зиксина приводило к ранней гибели зародышей в результате нарушения межклеточной адгезии и дезагрегации клеток [6, 10] в ходе гаструляции, были подобраны концентрации морфолиновых олигонуклеотидов в диапазоне, которые вызывали повреждения в формирующейся нервной трубки (рис. 1а) и достоверно детектируемое уменьшение уровня зиксина (рис. 1б).
Рис. 1.
Влияние подавления зиксина на Shh каскад. (а–а'' подавление трансляции зиксина вызывает дефекты при формировании нервной пластинки и затрудняет смыкание нервной трубки в ходе нейруляции, а – схема эксперимента, а'– дефекты нервной пластинки при подавлении зиксина морфолиновыми олигонуклеотидами в концентрации 0.3 мМ, а'' –детекция места попадания инъецированного материала за счет добавления флуоресцин-лизин декстрана (FLD). б–б'' оценка степени подавления трансляции зиксина при помощи морфолиновых олигонуклеотидов, б – схема эксперимента, б' – вестерн блоттинг с анти-зиксиновыми антителами из лизатов инъецированных зародышей на 14 стадии развития, в качестве контроля использовали анти-тубулиновые моноклональные антитела, б'' – проверка статистической достоверности подавления зиксина при помощи Zyxin MO и Splice MO. в – схема канонического Shh-каскада с обозначением трех основных этапов – рецепторного, трансмиссии и активация транскрипции с указанием основных участников и мишеней. г –изменение уровня экспрессии генов-участников и мишеней Shh-каскада, показанное методом ОТ-к ПЦР, г – изменение генов-участников каскада при подавлении зиксина, г' – изменение генов-мишеней каскада 1 и 2 классов при подавлении зиксина).
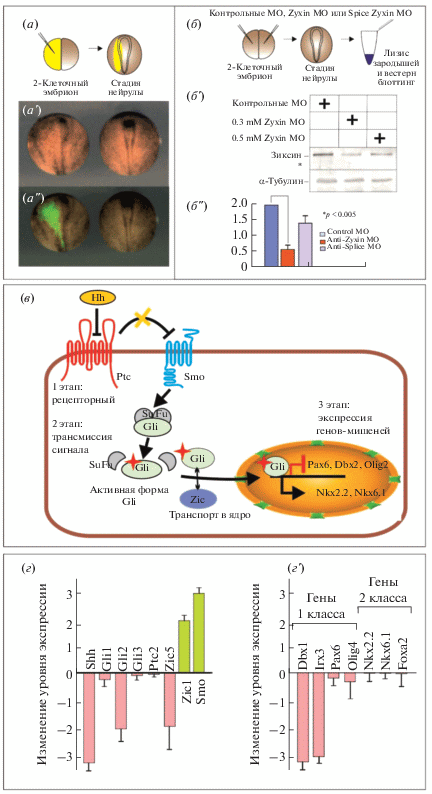
Степень подавления зиксина детектировали при помощи вестерн-блоттинга лизатов зародышей на стадии нейрулы с анти-зиксин поликлональными антителами кролика, полученными ранее [10] (рис. 1б'). Как показало дальнейшее сравнение интенсивности полосы эндогенного зиксина на блоте экстрактов из контрольных и опытных эмбрионов, умеренное подавление трансляции зиксина в эмбрионах (в 3.8 раза) происходило в случае инъекций морфолино блокирующего трансляцию в концентрации 0.15–0.3 мМ (4 нанолитра на бластомер). В то же время, морфолино, блокирующие сплайсинг вызывало аналогичное подавление при более высоких концентрациях (0.5–0.8 mМ). (рис. 1б'').
2. Анализ изменений в экспрессии генов-участников и генов-мишеней Shh-каскада в клетках нервной пластинки в ответ на подавление зиксина
Для понимания нашего выбора исследуемых генов приведем краткое описание Shh сигнального каскада. Канонический Shh-каскад запускается секреторным белком Sonic hedgehog (Shh), который синтезируются в виде про-белка мол. весом около 45 кДа, но в процессе секреции проходит стадию автокаталитического расщепления на два фрагмента – N (около 19 кДа) и С (около 25 кДа). Именно N-фрагмент отвечает за все известные на сегодняшний день сигнальные функции hedgehog [12–14]. Канонический сигнальный каскад состоит из трех основных этапов – рецепторного – прием сигнала; этап трансмиссии внутри клетки и активация мишеней каскада транскрипционными факторами в ядре. На первом этапе участниками этого каскада являются два трансмембранных белка: рецепторы Patched (Ptc) и Smoothened (Smo) [15, 16]. В отсутствие молекул Shh во внеклеточном пространстве, Ptc связывает Smo, блокируя внутриклеточную активацию каскада. При появлении же Shh, происходит его связывание с Ptc, что приводит к высвобождению Smo и к активации каскада. На втором этапе трансмиссии сигнала Smo, свободный от взаимодействия с Ptc, вызывает инактивацию внутриклеточного ингибитора каскада – белка Suppressor of Fused (SuF)], что в свою очередь приводит к перемещению в ядро активных форм белков семейства Gli (Gli1, Gli2 и Gli3), которые непосредственно регулируют экспрессию геномных мишеней Shh-каскада [17, 18]. Кроме этого, в передаче сигнала участвуют факторы Zic, которые физически взаимодействует с Gli, облегчая их транспорт в ядро [19, 20]. Регуляция экспрессии, как и репертуар геномных мишеней зависит от “чувствительности” генов транскрипционных факторов Gli к уровню активации каскада [20].
Данный сигнальный каскад играет ключевую роль в разметке дифференцировки клеток в раннем зачатке ЦНС. На стадии нейрулы Shh – экспрессируется вдоль продольной средней линии нервной пластинки и кодируемый им белок-морфоген Shh диффундирует в стороны от этой линии, образуя поперечные градиенты в правой и левой половине пластинки. Профиль градиента морфогена Shh определяет, какие дифференцировки будут на том или ином расстоянии от средней линии [21]. Например, гены Nkx2.2 и Nkx6.1 экспрессируются вблизи средней линии нервной пластинки – в зоне высоких концентраций Shh. В тоже время, ген Pax6 экспрессируется, начиная с некоторого расстояния от средней линии, т.е. там, где концентрация Shh снижается до определенного значения. В зависимости от того, ингибируется или активируется данный гомеобоксный ген высокой концентрацией Shh, мишени этого сигнального каскада подразделяются на два класса. Гены класса I (Pax6, Irx3, Dbx) – ингибируются Shh , а гены класса II (Nkx2.2 и Nkx6.1) – активируются им [22].
Таким образом, гены, которые были отобраны для исследования делились на гены-участники Shh-каскада: основной морфоген – секретируемый фактор Shh, на рецепторном этапе – трансмембранные белки-рецепторы patched 2 и Smo, на этапе трансмиссии основные эффекторы каскада, гены Gli1,2,3 и факторы Zic1 и Zic5, и на этапе воздействия на геномные мишени мы тестировали гены двух классов: гены 1 класса, ингибируемые высокими концентрациями Shh (Pax6, Dbx, Irx3) и гены 2 класса, активируемые им (Nkx2, Nkx6, Foxa2). Для анализа подавления экспрессии зиксина инъекции морфолиновых олигонуклеотидов проводили в оба дорсальных бластомера на стадии 8 клеток. Таким образом были получены следующие типы эмбрионов:
1 – контроль (инъекции контрольных МО),
2 – эмбрионы с пониженной концентрацией зиксина за счет инъекций Zyxin МО в концентрации 0.3 мМ,
3 – эмбрионы с пониженной концентрацией зиксина за счет инъекций ZyxinSplice MO в концентрации 0.6 мМ.
Полученные эмбрионы инкубировали до стадии начала формирования нервной пластинки (нейрула) и затем анализировали экспрессию выбранных генов методом ОТ-кПЦР. В результате было установлено, что при подавлении трансляции зиксина достоверно уменьшается количество транскриптов следующих основных участников Shh-каскада: самого фактора Shh, его рецептора Patched (Ptc2) одного из основных транскрипционных эффекторов Shh семейства Gli-транскрипционного фактора Gli2, а также одного из Zic-факторов: Zic5. В то же время, возрастает экспрессия фактора Zic1, способного к взаимодействию с Gli1 и перемещению его в ядро, а так же трансмембранного рецептора Smoothened (Smo), который запускает каскад при высвобождении от Ptc2 (рис. 1в, 1г).
Кроме того были исследованы изменения в экспрессии генов-мишеней Shh-каскада 1 и 2 классов. В результате было выяснено что гены 2 класса, активирующиеся в ответ на Shh-сигнал (Nkx2.2 и Nkx6.1), практически не меняют свою экспрессию в ответ на подавление зиксина. В то же время, гены 1 класса, подавляющиеся при высокой концентрации Shh (Pax6, Dbx, Irx3), реагируют еще более сильным подавлением. То есть влияние зиксина на гены-мишени 1 класса Shh-каскада является отрицательным, поскольку его подавление усиливает ингибирующий эффект Shh на эти гены.
Полученные результаты дополняют полученные нами ранее данные о влиянии зиксина на регуляцию экспрессии генов, вовлеченных в процесс ранней разметки зачатка центральной нервной системы. Ранее при помощи метода гибридизации in situ мы показали сильное уменьшение активности генов-мишеней 1 класса, в норме экспрессирующихся в латеральной области нервной трубки (Pax6, Dbx1, Olig4). Так же мы наблюдали слабо детектируемые этим методом изменения в зоне экспрессии генов-мишеней 2 класса экспрессирующихся в вентральной области нервной трубки (Foxa2, Gli1, Ptc2) [6].
Мы использовали метод ОТ-кПЦР для исследования и получили результаты, которые подтвердили и дополнили данные предыдущих работ. Было подтверждено ингибирующее влияние подавления зиксина на гены-мишени 1 класса-Dbx1, Pax6, Olig4, Irx3, которые экспрессируются в презумптивно дорсальной области нервной пластинки, то есть в зоне низких концентраций Shh (рис. 2). Важно, что метод ОТ-кПЦР дает возможность количественно и статистически достоверно оценить степень этого подавления.
Рис. 2.
Схема формирования нервной трубки в ходе нейруляции и позиции областей экспрессии генов-мишеней Shh каскада 1 и 2 класса (в рисунке использованы материалы с сайта https://slide-share.ru/slide/2325962.jpeg).
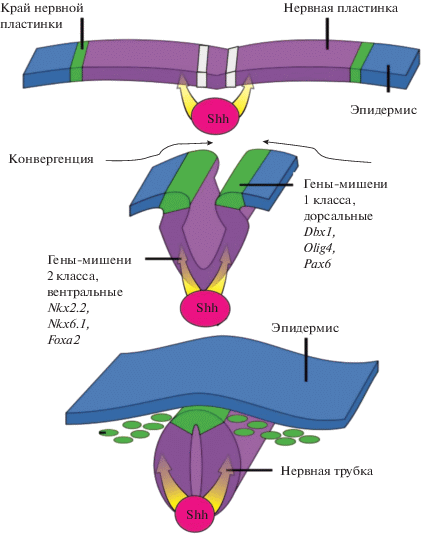
Получено подтверждение данных о слабом влиянии зиксина на гены 2 класса (Foxa2, Nkx2.2, Nkx6.1), экспрессирующихся в презумтивно вентральнй зоне нервной пластинки, т.е. вблизи ее центральной линии, в зоне высоких концентраций фактора Shh.
Получены новые данные о влиянии зиксина на гены-участники Shh сигнального каскада, в частности, усиление экспрессии мембранного белка Smo и фактора Zic1 и уменьшение количества транскриптов секретируемого фактора Shh и факторов Gli2 и Zic5 в ответ на подавление зиксина.
В настоящее время остается открытым вопрос о физиологической роли взаимодействия зиксина с цитоплазматическим С-концевым доменом трансмембранного рецептора PTC2. Поскольку это взаимодействие эволюционно консервативно и актуально для человека, как мы показали в работе [4] полученные данные о непосредственном взаимодействии этих белков имеют не только научный, так и практический интерес, поскольку существует множество данных о роли мутаций С-концевых доменов Ptc рецепторов в процессах формирования нервной системы и канцерогенезе, при этом механизмы функционирования этих рецепторов изучены пока недостаточно, что открывает возможность для дальнейших исследований в этой области.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
1. Микроинъекции морфолиновых олигонуклеотидов
Зародышей Xenopus получали в результате оплодотворения in vitro и растворяли оболочки в 2% цистеине при рН 7.8. Инъекции выполняли в бластомеры на 2-клеточной стадии в 0.1× MMR, в один или оба, в зависимости от целей эксперимента, в 4% фиколле и через 2 часа инъецированные яйца переносили в 0.1× MMR для дальнейшей инкубации. Морфолиновые олигонуклеотиды (МО) смешивали с флуоресцеин-лизин-декстраном (FLD, Invitrogen, 40 кДа, 5 мкг/мкл) и микроинъецировали 5–6 нанолитров раствора МО в различных концентрациях. На стадии нейрулы (стадия 14) эксплантаты нейроэктодермы вырезали из эмбрионов, инъецированных Zyxin MO и контрольных MO, и немедленно лизировали в реагенте TrizolH (Ambion) для выделения РНК. 3 × 10 эксплантатов нейроэктодермы получали для каждого эксперимента, всего было проведено три независимых эксперимента.
МО были приобретены у Gene Tools (Филомат, Орегон, США). Последовательности морфолиновых олигонуклеотидов, использованных в работе приведены в табл. 1.
Таблица 1.
Последовательности морфолиновых олигонуклеотидов, использованных в работе
| Название | Позиция и последовательность морфолиновых олигонуклеотидов |
|---|---|
| MO Zyxin | Позиция +32...+57 мРНК, кодирующая зиксин для обеих псевдоаллелей зиксина у Xenopuslaevis: TGAAATGTTGATGGTGAAGGAGGAC |
| MO Splice | Позиция +953...+972 незрелой мРНК, кодирующая зиксин для обеих псевдоаллелей зиксина у Xenopus laevis: ctcccactactcacaactcaCCTGATG (intron) (exon) |
| MO контрольные | Вариант MO Zyxin c точечными мутациями TTAACTGTTTAATGTTGAATGAGAAC в качестве негативного контроля |
Электрофорез
Образцы анализировали с помощью SDS-PAGE в 10% гелях по методу Laemmli и подвергали электроблоттингу на PVDF-мембрану (Millipore Corp. Inc.). В качестве первичных антител использовали анти-зиксиновые моноспецифичные поликлональные антитела кролика, полученные ранее [10] и моноклональные антитела к α-тубулину (Sigma). Вторичными антителами были: козий анти-кроличий F (ab') фрагмент антитела, конъюгированный с щелочной фосфатазой (Sigma) и анти-мышиный F (ab') фрагмент антитела, конъюгированный с щелочной фосфатазой (Sigma). Стабилизированный субстрат Western Blue (Promega) использовали для обнаружения антител, конъюгированных с щелочной фосфатазой.
ОТ-кПЦР
Тотальную РНК из вырезанных на 14 стадии нервных пластинок выделяли с использованием реагента ExtractRNA (Evrogen) в соответствии с протоколом производителя. РНК осаждали по стандартной методике на основе EtOH и очищали с использованием наборов CleanRNA Standard (Evrogen) и растворяли в 20 мкл воды без РНКазы. Для синтеза первой цепи 250 нг суммарной РНК, выделенной из каждого образца, подвергали обратной транскрипции в 20 мкл конечного объема обратной транскриптазой M-MLV в присутствии 10 пмоль олиго-dT праймера в соответствии с рекомендациями производителя (Evrogen) (+ОТ образец). В качестве отрицательного контроля в реакцию не добавляли обратную транскриптазу M-MLV (образец –ОТ). Для реакции кПЦР использовали приготовленную реакционную смесь, фирменное название qPCRmix-HS SYBR в соответствии с инструкциями производителя (Evrogen). Общий объем 25 мкл смеси содержал: 5 мкл 5× qPCRmix-HS SYBR реакционной смеси, 0.2 мкМ праймеров, 10 нг кДНК-матрицы. Использовалась стандартная программа 40 циклов с горячим стартом; температура отжига составляла 59°С, относительное удлинение – 72°С и плавление 95°С – все длилось 25 секунд. Проверку длины фрагментов ДНК и отсутствие неспецифичных продуктов в результате после проведения PCR проводили один раз после первой реакции с использованием данной пары праймеров с использованием электрофореза в агарозном геле. В результате проверки неспецифичных продуктов выявлено не было, фрагменты ДНК соответствовали предполагаемой длине продукта (табл. 2).
Таблица 2.
Последовательности олигонуклеотидов (праймеров), использованных для анализа экспрессии исследуемых факторов (с их индентификационными номерами в системе PubMed-NCBI) методом кПЦР с указанием длины амплифицированного фрагмента
| № | Название гена | Идентификационный номер белка в NCBI | Последовательность праймера | Длина амплификата, н.п. (нуклеотидных пар) |
|---|---|---|---|---|
| 1 | Elongation factor 1 alpha, EF-α |
NP_001080911 | Прямой: GTTCATTTACCGCACAGGTTATCA Обратный: ACACAGGGGCATATCCAGCA |
70 |
| 2 | Ornithine decarboxylase 1 (ODC) |
NP_001080167.1 | Прямой: GCCAGTTCTAACAAAGAAACCCA Обратный: TCTACGATACGATCCAGCCCA |
93 |
| 3 | NK2 homeobox 1 (Nkx2) |
NP_001079093 | Прямой: GCTCTGATTATGGCTCGGCT Обратный: CCTCCCACTTCCCTTTTTG |
181 |
| 4 | Homeobox B (Foxa2) |
NP_001165629.1 | Прямой: ATGGACAGTCCAACATCAACAGA Обратный: AAACAGAGCCCAGGTGACAAGT |
91 |
| 5 | Sonic hedgehog (Shh) |
Q92000 | Прямой: AGCAACATCCAACCAGGAGA Обратный: CCACTTTCACCGCCTTCA |
73 |
| 6 | Dbx1 | NP_001079210.1 | Прямой: CGAAACTCCAAGGAACGGGA Обратный: CCCCGAGGATTTCTTGCTCA |
114 |
| 7 | Gli2 | AF109923_1 | Прямой: CAACATTGGCGGAGGAAAGC Обратный: TTTGTGGGTATCAAACACTCTCT |
239 |
| 8 | Gli3 | NP_001081440.1 | Прямой: GGTTGGATTCACAGGGGACT Обратный: CATCATCCCGGTCAGTCACG |
191 |
| 9 | Ptc2 | NP_001129638.1 | Прямой: GACCCCCGGCTATATGAACG TATTGCCTGGAACATCCTGGT |
142 |
| 10 | Zic1 | NP_001083799.1 | Прямой: CCTGCAGGCTTGGTAAGAGA Обратный: GCCCGATGAGACATGCAGAT |
151 |
| 11 | Zic5 | NP_001079126.1 | Прямой: CAAACTCTCACGTGGACTGGA Обратный: GAGAGCAGAGAACACTGGCG |
249 |
| 12 | Smo | NP_001128704.1 | Прямой: TGCCCGAATGAAGTACAGAAC Обратный: AAGGTGGCCAGAGTAAAGAAGG |
224 |
| 13 | Irx3 | NP_001084204.1 | Прямой: GTGGTTGGTCAAAGGCAACTT Обратный: GGTTTATGGGCTACGGGCAT |
158 |
| 14 | Nkx6.1 | NP_001093386.1 | Прямой: CAAGTCAAGCAGCGCCATAC Обратный: TGAGGCTTTAGCTGTGTCCC |
129 |
| 15 | Gli1 | AAC24946 | Прямой: CATGAGCCGGAAACAGTGTA Обратный: TGACTTGCATTGTACTGGCCAT |
169 |
| 16 | Olig4 | NP_001039180.1 | Прямой: GCCAGCATCAGACTATGCCA Обратный: CGTGGTGGTTGTGGCAGATA |
2. Статистические методики, использованные для анализа достоверности полученных данных
Для проверки статистической достоверности данные ОТ-кПЦР, полученные от трех независимых экспериментов, были импортированы в Microsoft Excel и проанализированы с использованием метода ΔΔCt. Для нормировки уровня экспрессии генов в качестве внутреннего контроля использовали уровень экспрессии гена фактора элонгации EF-1α и орнитин-декарбоксилазы (ODC), уровни экспрессии которых в данных экспериментальных условиях считались неизменными.
Для статистического анализа изменений в экспрессии зиксина на проявленных специфическими антителами PVDF мембранах измеряли площади полосы с молекулярной массой 100 кДа, соттветствующей зиксину или 58 кДа, соответствующей α-тубулину при помощи программного обеспечения ImageJ (NIH, США). Получали численные значения, которые анализировали в программах: Microsoft Excel 2013 (Microsoft corporation, США): сначала получали численное выражение отношения значений, соответствующих полосе зиксина к значениям, соответствующим референсной полосе (α-тубулин). Далее использовали данные, полученные в более, чем 5-кратном повторении экспреримента для статистического анализа с использованием t-критерия Стьюдента в программе Excel.
Критический уровень значимости (p) для всех статистических критериев принимали равным 0.05.
Список литературы
Crawford A.W., Beckerle M.C. // J. Biol. Chem. 1991. V. 266. P. 5847–5853.
Yoshigi M., Hoffman L.M., Jensen C.C., Yost H.J., Beckerle M.C. // J. Cell. Biol. 2005. V. 171. P. 209–215.
Conley B.A., Koleva R., Smith J.D., Kacer D., Zhang D., Bernabéu C., Vary C.P. // J. Biol. Chem. 2004. V. 279. P. 27 440–27 449.
Мартынова Н.Ю., Ермолина Л.В., Ерошкин Ф.М., Зарайский А.Г. // Биоорг. хим. 2015. Т. 41. С. 744–748. [Martynova N.U., Ermolina L.V., Eroshkin F.M., Zarayskiy A.G. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 1–5.]
Nix D.A., Beckerle M.C. // J. Cell. Biol. 1997. V. 138. P. 1139–1147.
Martynova N.Y., Ermolina L.V., Ermakova G.V., Eroshkin F.M., Gyoeva F.K., Baturina N.S., Zaraisky A.G. // Dev. Biol. 2013. V. 380. P. 37–48.
Martynova N.Y., Parshina E.A., Ermolina L.V., Zaraisky A.G. // Biochem. Biophys. Res. Commun. 2018. V. 504. P. 251–256.
Sadler I., Crawford A.W., Michelsen J.W., Beckerle M.C. // J. Cell. Biol. 1992. V. 119. P. 1573–1588.
Мартынова Н.Ю., Ермолина Л.В., Ерошкин Ф.М., Гиоева Ф.К., Зарайский А.Г. // Биоорг. хим. 2008. Т. 38. С. 573–576. [ Martynova N.Y., Ermolina L.V., Eroshkin F.M., Gioeva F.K., Zaraisky A.G. // Russ. J. Bioorg. Chem. 2008. V. 34. P. 513–516.]
Martynova N.Y., Eroshkin F.M., Ermolina L.V., Ermakova G.V., Korotaeva A.L., Smurova K.M., Zaraisky A.G. // Dev. Dyn. 2008. V. 237. P. 736–749.
Nakata K., Koyabu Y., Aruga J., Mikoshiba K. // Mech. Dev. 2000. V. 99. P. 83–91.
Lee J.J., Ekker S.C., von Kessler D.P., Porter J.A., Sun B.I., Beachy P.A. // Science. 1994. V. 266. P. 1528–1537.
Lai C.J., Ekker S.C., Beachy P.A., Moon R.T. // Development. 1995. V. 121. P. 2349–2360.
Porter J.A., von Kessler D.P., Ekker S.C., Young K.E., Lee J.J., Moses K. Beachy P.A. // Nature. 1995. V. 374. P. 363–366.
Chen Y., Struhl G. // Cell. 1996. V. 87. P. 553–563.
Alcedo J., Ayzenzon M., Von Ohlen T., Noll M., Hooper J.E. // Cell. 1996. V. 86. P. 221–232.
Skoda A.M., Simovic D., Karin V., Kardum V., Vranic S., Serman L. // Bosn. J. Basic. Med. Sci. 2018. V. 18. P. 8–20.
Pietrobono S., Gagliardi S., Stecca B. // Front. Genet. 2019. V. 10. P. 556.
Koyabu Y., Nakata K., Mizugishi K., Aruga J., Mikoshiba K. // J. Biol. Chem. 2001. V. 276. P. 6889–6892.
Mizugishi K., Aruga J., Nakata K., Mikoshiba K. // J. Biol. Chem. 2001. V. 276. P. 2180–2188.
Ingham P.W. // Genes Dev. 2001. V. 15. P. 3059–3087.
Briscoe J., Pierani A., Jessell T.M., Ericson J. // Cell. 2000. V. 101. P. 435–445.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


