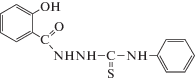Биоорганическая химия, 2020, T. 46, № 4, стр. 404-409
Антирадикальная и антимикробная активность тиосемикарбазидных и 1,2,4-триазольных производных гидроксибензойной кислоты
Ж. Б. Сатпаева 1, 2, З. Т. Шульгау 3, С. Б. Ахметова 4, О. А. Нуркенов 2, С. Д. Фазылов 1, 2, М. Ж. Буркеев 1
1 Карагандинский государственный университет им. Е.А. Букетова
100028 Караганда, ул. Университетская, 28, Казахстан
2 Институт органического синтеза и углехимии РК
100008 Караганда, ул. Алиханова, 1, Казахстан
3 РГП на ПХВ “Национальный центр биотехнологии” КН МОН РК
010000 Нур-Султан, Коргалжынское шоссе, 13/5, Казахстан
4 Карагандинская государственная медакадемия
100000 Караганда, ул Гоголя, 40, Казахстан
Поступила в редакцию 10.02.2020
После доработки 20.02.2020
Принята к публикации 22.02.2020
Аннотация
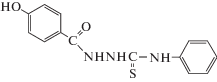
В статье приведены результаты оценки антимикробной и антиоксидантной активности синтезированных биологически активных веществ в сравнении со стандартным антиоксидантом – аскорбиновой кислотой. Антиоксидантную активность изучали по способности взаимодействовать с радикалом – 2,2-дифенил-1-пикрилгидразилом (ДФПГ, ${\text{DPP}}{{{\text{H}}}^{\centerdot }}$). Установлено, что в условиях данной тест-системы выраженную антирадикальную активность проявили образцы 2-(2-гидроксибензоил)-N-фенилгидразинкарботиоамид (1) IC50(DPPH) = 15.5 µМ, для 2-(4-гидроксибензоил)-N-фенилгидразинкарботиоамид (2) IC50(DPPH) оказалось равной 31.7 µМ. Результаты оценки антимикробной активности в отношении грамположительных и грамотрицательных тест-штаммов показали слабую антибактериальную активность.
ВВЕДЕНИЕ
Производные cалициловой кислоты (салицилаты) вошли в клиническую практику с конца XIX века и повсеместно применяются до настоящего времени. Такие производные cалициловой кислоты как ацетилсалициловая кислота (аспирин), салицилат натрия, салициланилид, салициламид (САМ), метилсалицилат используются в медицине в качестве анальгетиков (болеутоляющее), антипиретиков (жаропонижающее) и антиагрегантов (антитромботическое), антиоксидантов, антипролиферативных и цитотоксических агентов [1–3], они также показали противоопухолевую активность [4–6]. По последним данным производные салициловой кислоты можно рассматривать как биорегуляторы, которые синтезируются самим организмом и выполняют защитные функции. И это позволяет переосмыслить роль салициловой кислоты в патофизиологии человека и животных.
В соседних положениях бензойного кольца у молекулы салициловой кислоты находится группа ОН, как у фенола, и группа СООН – как у бензойной кислоты, которые имеют большие возможности для химической трансформации ее молекулы. Салициловая кислота является природным фенольным гормоном, которая играет важную роль в защите растений от разного рода грибов и патогенных микроорганизмов. Из анализа литературных данных [7, 8] по различным производным салициловой кислоты можно отметить следующую особенность взаимосвязи “структура–биологическая активность” в молекулах ее производных:
а) Все замещения по кислотным группам (участки I и II) обеспечивали сохранение жаропонижающих, анальгезирующих, противовоспалительных свойств и появлению новых видов активности (R' = OCH3, OC3H7-i, NH2, NHCH2CH2, COOR) и др. [9–11].
б) Замещения по фенильному кольцу молекулы салициловой кислоты (участок III) – появлению противотуберкулезных, фунгицидных, противогрибковых, антидепрессантных и др. свойств. При этом во многих препаратах также сохраняется обезболивающее, жаропонижающее свойства исходного субстрата [12–14].
В Новосибирском институте органической химии (НИОХ) им. Н.Н. Ворожцова СО РАН на базе структур осалмида и парацетамола направленным синтезом была получена группа замещенных амидов салициловой кислоты, имеющих в орто-положении экранирующие трет-бутильные заместители и изучены их антиоксидантные свойства [15]. Антиоксидантные свойства изученных веществ авторы объясняют протеканием двух механизмов: взаимодействием с пероксильными радикалами и разрушением гипероксидов с образованием молекулярных продуктов.
Целенаправленный поиск эффективных новых терапевтических агентов на основе салициловой кислоты, отличающихся повышенной биологической активностью в сочетании с низкой токсичностью и менее выраженным побочным действием, по прежнему является актуальной задачей. Перспективным направлением создания новых биоактивных производных салициловой кислоты является синтез “гибридных молекул”, сочетающих в своей структуре несколько функциональных групп, независимо или синергически действующих на процесс окисления субстратов в липидной или водной фазе.
Целью настоящей работы является исследование антимикробной и антирадикальной активности тиосемикарбазидных и триазоловых производных орто- и пара-гидроксибензойных кислот (1–4) на модели 2,2-дифенил-1-пикрилгидразила (ДФПГ), расширение арсенала антиоксидантных средств синтетического происхождения на основе салициловой кислоты, его аналога.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Объекты исследования приведены в табл. 1.
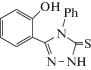
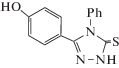
Ранее нами были синтезированы производные салициловой кислоты и его аналога (1–4), имеющего в пара-положении гидроксильную группу [16, 17], которые содержат в своей структуре тиоамидную группу, остаток фенильного кольца, а также 1,2,4-триазольные группы. Оценка антирадикальных свойств соединений (1–4) с целью выявления среди них активных антиоксидантов была проведена впервые.
Из табл. 2 мы видим, что из представленных соединений (1–4) только 2-(2-гидроксибензоил)-N-фенилгидразинкарботиоамид (1) и 2-(4-гидроксибензоил)-N-фенилгидразинкарботиоамид (2) снижают оптическую плотность исходного раствора ДФПГ-радикала более чем на 50%, а значит являются перспективными для дальнейших исследований.
Таблица 2.
Значения оптической плотности раствора 100 µМ ДФПГ-радикала после 10-минутной инкубации с испытуемым веществом в финальной концентрации 50 µМ
| № | Названия соединения | Оптическая плотность, отн. ед. |
|---|---|---|
| 1 | 2-(2-Гидроксибензоил)-N-фенилгидразинкарботиоамид (1) | 0.049 |
| 2 | 2-(4-Гидроксибензоил)-N-фенилгидразинкарботиоамид (2) | 0.297 |
| 3 | 3-(2-Гидроксифенил)-4-фенил-1H-1,2,4-триазол-5(4H)-тион (3) | 0.82 |
| 4 | 3-(4-Гидроксифенил)-4-фенил-1H-1,2,4-триазол-5(4H)-тион(4) | 0.882 |
| Контроль (раствор ДФПГ без испытуемого образца) | 1.038 |
Во второй серии эксперимента изучали способность соединений 1 и 2 взаимодействовать с ДФПГ-радикалом в различных концентрациях (от 2.5 до 50 µМ) (табл. 3).
Таблица 3.
Значения оптической плотности раствора 100 µМ ДФПГ-радикала после 10-минутной инкубации с веществами 1 и 2 в финальных концентрациях в реакционной смеси 50, 25, 20, 15, 10, 5 и 2.5 µМ
| № | Финальная концентрация веществ 1 и 2 в реакционной смеси, µМ |
Оптическая плотность, отн. ед. для 1 | Оптическая плотность, отн. ед. для 2 |
|---|---|---|---|
| 1 | 50 | 0.048 | 0.315 |
| 2 | 25 | 0.294 | 0.575 |
| 3 | 20 | 0.413 | 0.644 |
| 4 | 15 | 0.562 | 0.708 |
| 5 | 10 | 0.698 | 0.758 |
| 6 | 5 | 0.848 | 0.817 |
| 7 | 2.5 | 0.929 | 0.858 |
| Контроль (раствор ДФПГ без испытуемого образца) | 1.038 | 1.038 |
Зависимость оптической плотности раствора ДФПГ-радикала от концентрации соединений 1 и 2 представлена на рис. 1.
Рис. 1.
Зависимость оптической плотности раствора ДФПГ-радикала от концентрации 2-(2-гидроксибензоил)-N-фенил-гидразинкарботиоамид (1) и 2-(4-гидроксибензоил)-N-фенил-гидразинкарботиоамид (2).
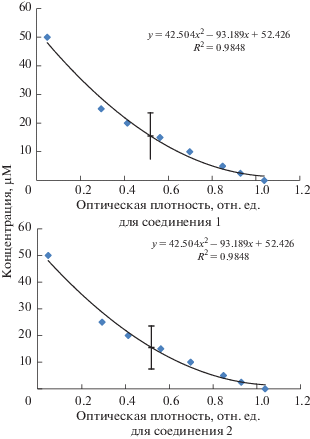
С помощью построенных калибровочных кривых (рис. 1) определили концентрации 2-(2-гидроксибензоил)-N-фенилгидразинкарботиоамида (1) и 2-(4-гидроксибензоил)-N-фенилгидразинкарботиоамида (2), способные на 50% снижать оптическую плотность 100 µМ раствора ДФПГ-радикала. Для соединения (1) IC50(DPPH) равна 15.5 µМ, а для соединения (2) IC50(DPPH) оказалось равной 31.7 µМ.
В качестве стандартного вещества с антиоксидантным действием использовали аскорбиновую кислоту, для которой мы изучили способность в различных концентрациях (от 2.5 до 50 µМ) взаимодействовать с ДФПГ-радикалом (табл. 4). В обзоре Е. Niki [18, 19] аскорбиновая кислота отнесена к водорастворимым антирадикальным соединениям и показана ее возможность взаимодействия со свободными радикалами жирнокислотных компонентов липидов.
Таблица 4.
Значения оптической плотности раствора 100 µМ ДФПГ-радикала после 10-минутной инкубации с аскорбиновой кислотой в финальных концентрациях в реакционной смеси 50, 25, 20, 15, 10, 5 и 2.5 µМ
| № | Финальная концентрация аскорбиновой кислоты в реакционной смеси, µМ | Оптическая плотность, отн. ед. |
|---|---|---|
| 1 | 50 | 0.029 |
| 2 | 25 | 0.418 |
| 3 | 20 | 0.51 |
| 4 | 15 | 0.635 |
| 5 | 10 | 0.694 |
| 6 | 5 | 0.791 |
| 7 | 2.5 | 0.865 |
| Контроль (раствор ДФПГ без испытуемого образца) | 1.028 |
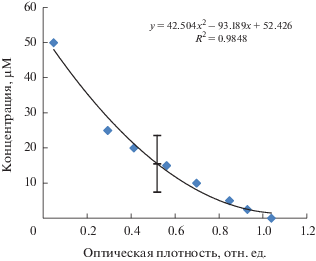
С помощью построенной калибровочной кривой (рис. 2) определили концентрацию аскорбиновой кислоты, способную на 50% снижать оптическую плотность 100 µМ раствора ДФПГ-радикала. Для аскорбиновой кислоты IC50(DPPH) оказалась равной 19.9 µМ.
Рис. 2.
Зависимость оптической плотности раствора ДФПГ-радикала от концентрации аскорбиновой кислоты.
Оценка антирадикального действия образцов (1–4) в отношении ДФПГ-радикала показала, что в условиях данной тест-системы, наиболее выраженную антирадикальную активность проявили образцы 1 и 2, для которых была определена концентрация, способная на 50% снижать оптическую плотность 100 µМ раствора ДФПГ-радикала. Для 2-(2-гидроксибензоил)-N-фенилгидразинкарботиоамид (1) IC50(DPPH) оказалась равной 15.5 µМ, для 2-(4-гидроксибензоил)-N-фенилгидразинкарботиоамид (2) IC50(DPPH) оказалось равной 31.7 µМ.
По полученным нами данным IC50(DPPH) (µМ) для референтного образца, в данном случае для аскорбиновой кислоты – 19.9 µМ. Активность образца 2-(2-гидроксибензоил)-N-фенилгидразинкарботиоамид (1) IC50(DPPH) = 15.5 µМ, не уступает референтному образцу аскорбиновой кислоте.
По литературным данным [20] IC50(DPPH) (µМ) для известных антиоксидантов, таких как, глутатион – 49, гидрохинон – 27, тролокс – 28, α-токоферол – 28, кверцетин – 8. Таким образом, антирадикальная активность образцов 1 и 2 сопоставима с активностью известных антиоксидантов.
Продолжая исследования по обнаружению среди синтезированных производных веществ с выраженной биологической активностью, были проведены первичные скрининговые испытания соединений (1–4) на антимикробную активность в отношении грамположительных (Staphylococcus aureus, Bacillus subtilis), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli) и к дрожжевому грибку Candida ablicans штаммов методом диффузии в агар. Препарат сравнения – гентамицин для бактерий и нистатин для дрожжевого грибка C. ablicans.
Антимикробную активность соединений (1–4) оценивали по диаметру зон задержки роста тест-штаммов (мм). Диаметр зон задержки роста меньше 10 мм и сплошной рост в чашке оценивали как отсутствие антибактериальной активности, 10–15 мм – слабая активность, 15–20 мм – умеренно выраженная активность, свыше 20 мм – выраженная. Каждый образец испытывался в трех параллельных опытах [21].
Результаты исследования антимикробной активности образцов приведены в табл. 5.
Таблица 5.
Антимикробная активность образцов (1–4)
| Соединение | Staphylococcus aureus | Bacillus subtilis | Escherichia coli | Pseudomonas aeruginosa | Candida ablicans |
|---|---|---|---|---|---|
| 1 | 18 ± 1 | 16 ± 1 | 14 ± 1 | 12 ± 1 | 13 ± 1 |
| 2 | 12 ± 1 | 11 ± 1 | 10 ± 1 | – | 12 ± 1 |
| 3 | 13 ± 1 | 13 ± 1 | 12 ± 1 | – | 11 ± 1 |
| 4 | 12 ± 1 | 14 ± 1 | 12 ± 1 | – | 11 ± 1 |
| Гентамицин | 26 ± 1 | 24 ± 1 | 23 ± 1 | 24 ± 1 | – |
| Нистатин | – | – | – | – | 22 ± 1 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе был использован ДФПГ фирмы “Sigma Aldrich”. Для оценки антирадикальной активности исследуемых образцов (1–4) в тесте с ДФПГ-радикалом использовали метанольный раствор ДФПГ (100 µМ). Для отбора веществ с выраженной антирадикальной активностью смешивали 2 мл 100 µМ метанольного раствора ДФПГ с 20 мкл исследуемого объекта, растворенного в метаноле в концентрации 5 µМ. Таким образом, финальная концентрация испытуемого вещества в реакционной смеси составила 50 µМ. Через 10 минут после добавления раствора испытуемого соединения к раствору ДФПГ-радикала измеряли снижение оптической плотности при 515 нм. Для веществ, способных снижать оптическую плотность более чем на 50%, проводили тест на взаимодействие с ДФПГ-радикалом в финальных концентрациях исследуемых веществ 50, 25, 20, 15, 10, 5 и 2.5 µМ. После чего определяли концентрацию испытуемого вещества, способную на 50% снижать оптическую плотность – IC50(DPPH).
Изучение антимикробной активности вышеуказанных образцов проводилось по отношению к штаммам грамположительных бактерий Staphylococus aureus, Bacillus subtilis, к грамотрицательным штаммам Escherichia coli, Pseudomonaus aeruginosa и к дрожжевому грибку Candida albicans методом диффузии в агар (лунок). Препараты сравнения – гентамицин для бактерий и нистатин для дрожжевого грибка C. albicans.
Культуры выращивали на жидкой среде рН 7.3 ± ± 0.2 при температуре от 30 до 35°С в течение 18–20 часов. Культуры разводили 1 : 1000 в стерильном 0.9% растворе натрия хлорида изотоническом, вносили по 1 мл в чашки с соответствующими элективными, питательными средами для изучаемых тест-штаммов и засевали по методу “сплошного газона”. После подсушивания на поверхности агара формировали лунки размером 6.0 мм, в которые вносили раствор исследуемого образца, гентамицина, нистатина. В контроле использовали этиловый спирт в эквиобъемных количествах. Посевы инкубировали при 37°С, учет растущих культур проводили через 24 часа.
ВЫВОДЫ
1. На основании результатов исследования антирадикальных свойств синтезированных веществ установлено, что антирадикальная активность образцов 1 и 2 сопоставима с активностью известных антиоксидантов. Они обладает выраженным антирадикальным действием.
2. В результате проведенного биоскрининга на антимикробную активность установлено, что все исследованные вещества проявляют слабую антибактериальную активность в отношении грамположительных и грамотрицательных тест-штаммов.
Список литературы
Rainsford, K.D. Aspirine and Related Drugs. London, UK: CRC Press, 2004.
Sahoo J. Paidesetty S.K. // Egyp. J. Bas. Appl. Sci. 2015. V. 2. P. 268–280. https://doi.org/10.1016/j.ejbas.2015.07.006
Djurendić E., Dojčinović Vujašković S., Sakač M. et al. // Arkivoc. 2011. V. 2. P. 83–102. https://doi.org/10.3998/ark.5550190.0012.207
Thun M.J., Jacobs E.J., Patrono C. // Nat. Rev. Clin. Oncol. 2012. V. 9. P. 259–267.
Pathirana R., West P., Hedderley D., Eason J. // Protoplasma. 2017. V. 254. P. 1–13.
Spitz G.A., Furtado C.M., Sola-Penna M., Zancan P. // Biochem. Pharmacol. 2009. V. 77. P. 46–53.
Ioana M.C., Iena C.U., Alfa Xenia Lupea et al. // Rev. Chim. 2008. V. 59. № 2. P. 247–250.
Martin Krátký, Jarmila Vinšová // Molecules. 2012. V. 17. P. 9426–9442. https://doi.org/10.3390/molecules17089426
Alicja Wodnicka, Elżbieta Huzar, Maria Krawczyk, Halina Kwiecień // Polish J. of Chem. Tech. V. 19. 1. P. 143–148. https://doi.org/10.1515/pjct-2017-0019
Runde Xiong, Dong Xu, Xiangpin Deng et al. // Royal Soc. of Chem. Medchemcomm. 2019. https://doi.org/10.10.39/c8md00484f
Evgenija Djurendić, Sanja Dojčinović Vujašković, Marija Sakač et al. // Arkivoc. 2011. V. 2. P. 83–102. https://doi.org/10/3998/.ark.5550190.0012.207
Fadeyi O.O., Obafemi C.A., Adewunmi C.O., Iwalewa E.O. // African J. of Biotech. 2004. V. 3. P. 426–431. https://doi.org/10.1.1.892.8817
Herman Gerhon, Raulo Parmegiani // Pfister Chemical Works, Ridgefield, New Jersey, 1962.
Andressa Brito Lira, Camila de Albuquerque Montenegro, Kardilandia Mendes de Oliveira et al. // Hindawi. Oxidative Medicine and Cellular Longevity. 2018. Р. 14. ID 6179427. https://doi.org/10.1155/2018/6179427
Перевозкина М.Г. // Инновации в науке: сб. ст. по матер. XXXVII междунар. науч.-практ. конф. № 9(34). Новосибирск: СибАК, 2014.
Nurkenov O.A., Fazylov S.D., Satpaeva Zh.B. et al. // Russ. J. of Gen. Chem. 2014. V. 84. P. 1857–1859. https://doi.org/10.1134/S1070363214090369
Nurkenov O.A., Fazylov S.D., Satpaeva Zh.B. et al. // Russ. J. of Gen. Chem. 2015. V. 85. P. 57–60. https://doi.org/10.1134/S1070363215010107
Niki E. // J. Chem. and Phys. Lipids. 1987. V. 44. P. 227–253.
Niki E., Takahashi M., Komiko E. // Chem. Letters. 1986. P. 1573–1576.
Plattner S. et al. // Anal. Bioanal. Chem. 2014. V. 406. P. 213–224.
Навашин С.М., Фомина И.П. Рациональная антибиотикотерапия // Справочник, М.: Медицина, 1982. 496 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия