Биоорганическая химия, 2021, T. 47, № 6, стр. 785-794
Влияние кортизола и тетрагидрокортизола на вторичную структуру аполипопротеина А-I по данным инфракрасной Фурье-спектроскопии
А. Н. Дударев 1, А. Ю. Городецкая 1, Т. А. Ткаченко 1, И. Ф. Усынин 1, *
1 Научно-исследовательский институт биохимии, Федеральный исследовательский центр фундаментальной
и трансляционной медицины
630117 Новосибирск, ул. Тимакова, 2, Россия
* E-mail: ivan.usynin@niibch.ru
Поступила в редакцию 20.11.2020
После доработки 05.12.2020
Принята к публикации 10.12.2020
Аннотация
Изучены особенности взаимодействия стероидного гормона кортизола и его метаболита тетрагидрокортизола (ТГК) с двумя сывороточными белками человека – аполипопротеином А-I (апоА-I) и альбумином (ЧСА). С помощью метода тушения флуоресценции триптофана установлено, что константа связывания гормонов с белками возрастает в ряду комплексов: апоА-I−ТГК < ЧСА−ТГК < < апоА-I−кортизол < ЧСА−кортизол. Полученные результаты подтверждают существующие представления о важной роли альбумина и апоА-I в транспорте активных форм стероидных гормонов. Однако использование инфракрасной Фурье-спектроскопии выявило наиболее выраженные и разнонаправленные изменения во вторичной структуре белков под влиянием неактивной формы гормона – ТГК. При инкубации апоА-I в присутствии ТГК наблюдалось дозозависимое снижение содержания α-спиралей и увеличение содержания β-поворотов. В ЧСА под влиянием ТГК, напротив, количество α-спиралей возрастало, а β-поворотов – снижалось. Подобные изменения обнаружены в структуре апоА-I под влиянием кортизола. Вторичная структура ЧСА в присутствии кортизола не изменялась. Предполагается, что конформационные изменения апоА-I под влиянием стероидных гормонов могут приводить к изменению акцепторных и регуляторных свойств данного белка.
ВВЕДЕНИЕ
Липопротеины высокой плотности (ЛПВП), помимо участия в липидном обмене, оказывают регуляторное влияние на функции клеток различных органов и тканей организма. Так, митогенное действие ЛПВП продемонстрировано на культуре эндотелиальных [1], гладкомышечных [2] и опухолевых клеток [3]. В культуре гладкомышечных клеток ЛПВП усиливают клеточный рост, индуцированный эпидермальным фактором роста, фактором роста тромбоцитов и фактором роста фибробластов [4].
Регуляторные эффекты ЛПВП связывают с наличием на поверхности липопротеиновой частицы белкового компонента – аполипопротеина А-I (апоА-I) [5]. АпоА-I – высококонсервативный белок, состоящий из амфипатических α-спиралей [6]. Резкое увеличение уровня экспрессии плацентарного лактогена под влиянием апоА-I показано на клетках трофобластов человека [7]. В макрофагах апоА-I стимулирует синтез и секрецию простагландина Е2 [8], а в первичной культуре клеток костного мозга активирует пролиферацию прогениторных клеток гранулоцитарного и моноцитарного ростка [9]. Взаимодействие апоА-I с АТФ-зависимым кассетным транспортером (ABCA1) на плазматической мембране фибробластов приводит к активации внутриклеточных сигнальных путей, включая Cdc42 [10].
Ранее нами было обнаружено, что апоА-I, выделенный из плазмы крови человека, стимулирует биосинтез белка в культуре гепатоцитов. Его стимулирующий эффект изменялся при взаимодействии со стероидными гормонами. Прединкубация апоА-I с кортизолом снижала стимулирующий эффект апоА-I, в то время как восстановленная форма кортизола – тетрагидрокортизол (ТГК) – усиливала эффект апоА-I [11]. Механизм обнаруженного явления остается неясным. Предполагается, что апоА-I выполняет роль переносчика гормонов в ядро клетки, где восстановленная форма гормона усиливает экспрессию генов с последующей активацией биосинтеза белка [12]. Однако не исключено, что взаимодействие апоА-I со стероидными гормонами, отличающимися по своей структуре, может сопровождаться конформационными перестройками, приводящими к изменению регуляторных свойств данного белка.
Цель данной работы – с помощью ИК-Фурье-спектроскопии изучить особенности изменения вторичной структуры апоА-I и сывороточного альбумина человека (ЧСА) под влиянием кортизола и его метаболита ТГК.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ собственной флуоресценции белков широко используется для изучения механизмов связывания различных лигандов с белками [13–16]. Из трех флуоресцирующих аминокислот (триптофан, тирозин, фенилаланин) наиболее выраженной флуоресценцией в ультрафиолетовой области спектра обладает триптофан, который обусловливает ~90% всей белковой флуоресценции. Флуоресцентные свойства триптофана крайне чувствительны к изменению его микроокружения. Поэтому комплексообразование с низкомолекулярными лигандами и макромолекулами сопровождается значительными изменениями спектра флуоресценции белков [13, 14].
С использованием метода тушения (снижения) флуоресценции триптофана [13] нами было исследовано взаимодействие стероидного гормона кортизола и его восстановленной формы ТГК с апоА-I. Для сравнения в аналогичных условиях анализировали взаимодействие стероидных гормонов с ЧСА. Как известно, аминокислотная цепь апоА-I (28 кДа) состоит из 234 остатков, включая четыре триптофановых остатка [17]. ЧСА (66.4 кДа) представляет собой глобулярный белок, состоящий из 585 а.о., включая один остаток триптофана (Trp214) [18]. В работе использовали коммерческий препарат ЧСА (Sigma, США). Для выделения нативного апоА-I применяли метод делипидирования свежевыделенных ЛПВП с помощью смеси бутанола и диизопропилового эфира [19]. Данный способ, в отличие от широко распространенного метода делипидирования плазменных липопротеинов с помощью смеси этанола и диэтилового эфира, позволяет избежать денатурации белка и, следовательно, сохранить в большей степени их исходную (нативную) структуру. Как видно из рис. 1, используемый нами метод позволяет получить гомогенный препарат апоА-I, очищенный от остальных белков, содержащихся в исходной фракции ЛПВП.
Рис. 1.
Электрофоретический анализ в 10%-ном ПААГ очищенного апоA-I и суммарной фракции ЛПВП, выделенных из плазмы крови человека с помощью изоплотностного ультрацентрифугирования в растворе KBr. Дорожки: 1 – апоА-I; 2 – ЛПВП; 3 – маркер масс белков (10–250 кДа).

Анализ спектральных свойств показал, что исходные спектры флуоресценции апоА-I и ЧСА имеют максимумы при 336 и 333 нм соответственно (рис. 2). При регистрации спектров в присутствии возрастающих концентраций гормонов максимум спектра флуоресценции апоА-I не изменялся, в то время как спектр флуоресценции ЧСА сдвигался в коротковолновую область (рис. 2). Наблюдаемое снижение интенсивности флуоресценции белков в ответ на увеличение концентрации гормонов свидетельствует о формировании комплексов гормон–белок, что сопровождается конформационными изменениями белка [20]. В нашем случае наибольшее снижение флуоресценции триптофана обнаружено у обоих белков под влиянием кортизола.
Рис. 2.
Влияние ТГК (а, в) и кортизола (б, г) на собственную триптофановую флуоресценцию апоА-I (0.1 мг/мл) и ЧСА (0.1 мг/мл).

Расчет констант связывания (Кb) гормонов проводили с помощью уравнения Штерна–Фольмера: F0/F = 1 – Kb [Q]. Для определения Kb измеряли интенсивность флуоресценции белка в отсутствие (F0) и в присутствии (F) различных концентраций [Q] кортизола или ТГК, но при постоянной концентрации белка [13]. Прямолинейная зависимость в координатах Штерна–Фольмера указывает на существование в растворе одного типа флуорофоров, одинаково доступных для тушителя (рис. 3). На основании кривых тушения флуоресценции триптофана были рассчитаны константы связывания кортизола с апоА-I и ЧСА, которые составили (1.0 ± 0.1) × × 103 М–1 и (2.0 ± 0.4) × 104 М–1 соответственно. В отличие от кортизола, его восстановленная форма вызывала менее выраженные изменения в спектрах обоих белков. Константа связывания ТГК с апоА-I составила (3.1 ± 0.4) × 102 М–1, а с ЧСА – (8.2 ± 0.9) × 102 М–1.
Рис. 3.
Графики Штерна–Фольмера для концентрационного тушения триптофановой флуоресценции апоА-I (а, б) и ЧСА (в, г) добавлением различных концентраций кортизола (б, г) и ТГК (а, в). По оси ординат – отношение максимальной флуоресценции белка в отсутствие лиганда [F0] к интенсивности флуоресценции белка после добавления лиганда [F]. По оси абсцисс – концентрация лигандов [Q]. R – коэффициент корреляции Пирсона.

Различия, обнаруженные между влиянием гормонов на спектральные характеристики белков, можно объяснить разной способностью гормонов проникать во внутренние области белков. Незначительное снижение флуоресценции апоА-I под влиянием ТГК, вероятно, связано с тушением остатков триптофана преимущественно на поверхности данного белка и отражает неспособность данной формы гормона проникать во внутренние области белка. В целом полученные результаты свидетельствуют о том, что константа связывания гормонов с белками возрастает в ряду комплексов: апоА-I−ТГК < ЧСА−ТГК < < апоА-I−кортизол < ЧСА−кортизол. Полученные результаты подтверждают существующие в литературе представления о важной роли альбумина [16] в транспорте активной формы стероидного гормона кортизола.
Как известно, взаимодействие лиганда с белком может сопровождаться конформационными изменениями последнего. Например, изменение вторичной структуры ЧСА в сторону снижения доли α-спиралей зарегистрировано при его взаимодействии с тестостероном [21], дексаметазоном [19], прогестероном [22], тритерпеноидами [23] и противоопухолевым препаратом цисплатином [24]. Противоположные изменения в сторону увеличения доли α-спиралей и β-слоев зарегистрировано при взаимодействии ЧСА с транс-ресвератролом [25]. Учитывая тот факт, что апоА-I выполняет не только транспортные [5], но и важные регуляторные функции [9, 10], нами было исследовано влияние кортизола и ТГК на вторичную структуру апоА-I.
Анализ соотношения элементов вторичной структуры белка проводили с помощью метода ИК-Фурье-спектроскопии в области спектра амид I (1600–1700 см–1). Данная область спектра – наиболее информативна и чувствительна к изменениям конформации полипептида за счет вклада валентных колебаний связей C=O [26, 27]. При анализе полосы амид I с помощью метода нарушенного полного внутреннего отражения (НПВО) использовали следующие интервалы положения пиков второй производной: α-спирали – от 1660 до 1649 см–1, β-слои – от 1695 до 1680 см–1 и 1637–1614 см–1, β-повороты – от 1679 до 1675 см–1 и от 1674 до 1664 см–1, неупорядоченные структуры – от 1648 до 1638 см–1 [25, 28].
Одно из ограничений данного метода – сильное поглощение воды в области спектра амид I. Использование тяжелой воды (D2О) вместо Н2О позволяет предотвратить вклад растворителя в спектр белка, однако не решает проблему полностью, поскольку D2O может оказывать влияние на нативную структуру белка [29]. В последние годы получил широкое распространение метод НПВО, позволяющий снизить до минимума влияние растворителя на измерение спектра белков [30]. Кроме того, современные приборы за счет высокой чувствительности позволяют вычитать вклад растворителя в спектр белка. Проведенное нами сравнение спектров раствора ЧСА, приготовленного на D2O и H2O, не выявило значительных различий между этими образцами по соотношению элементов вторичной структуры ЧСА (табл. 1). Учитывая данный факт, все дальнейшие исследования были проведены с водными растворами белков, содержащими фосфатный буфер (рН 7.4).
Таблица 1.
Содержание элементов вторичной структуры ЧСА (7.5 мг/мл) в растворе дейтерия (D2О) и воды (Н2О) по данным ИК-Фурье-спектроскопии
| Растворитель | Соотношение элементов вторичной структуры ЧСА, % | |||
|---|---|---|---|---|
| α-спирали | β-слои | β-повороты | неупорядоченные структуры | |
| D2О | 52 ± 3 | 16 ± 3 | 15 ± 2 | 17 ± 3 |
| Н2О | 48 ± 2 | 20 ± 3 | 12 ± 2 | 20 ± 3 |
Согласно данным рентгеноструктурного анализа, вторичная структура ЧСА содержит α-спирали (68.8%), β-слои (7.3%), β-повороты (2.1%) и неупорядоченные структуры (21.8%) [31]. Однако данные о соотношении элементов вторичной структуры белков, полученные с помощью ИК-спектроскопии, могут существенно отличаться от этих значений. Так, количество α-спиралей в структуре альбумина, по данным разных авторов, колеблется от 47 до 70% [32]. Эти противоречия, вероятно, связаны с особенностями используемых в разных лабораториях методов регистрации и анализа ИК-спектров. Кроме того, результаты анализа вторичной структуры в значительной степени зависят от исходной конформации используемых белков, концентрации и способа их подготовки для анализа.
Проведенный нами анализ водного раствора ЧСА (Sigma, США) с помощью ИК-Фурье-спектроскопии выявил следующее соотношение элементов вторичной структуры: α-спирали – 47 ± 2%, β-слои – 21 ± 1%, β-повороты – 10 ± 2%, неупорядоченные структуры – 22 ± 2% (табл. 2). Подобная доля α-спиральных участков и неупорядоченных структур обнаружена в структуре апоА-I. Однако у апоА-I, по сравнению с ЧСА, содержание β-слоев было в 1.5 раза меньше, а β-поворотов – в 2.1 раза больше (табл. 2).
Таблица 2.
Влияние кортизола на содержание элементов вторичной структуры ЧСА и апоА-I по данным ИК‑Фурье-спектроскопии
| Элементы вторичной структуры белка | Содержание элементов вторичной структуры белка, % | |||||||
|---|---|---|---|---|---|---|---|---|
| ЧСА | апоА-I | |||||||
| Концентрация кортизола, М | Концентрация кортизола, М | |||||||
| 0 (контроль) | 5 × 10–8 | 5 × 10–7 | 5 × 10–6 | 0 (контроль) | 5 × 10–8 | 5 × 10–7 | 5 × 10–6 | |
| α-Спирали | 47 ± 2 | 49 ± 3 | 49 ± 2 | 50 ± 4 | 45 ± 2 | 50 ± 4 | 49 ± 2 | 53 ± 3* |
| β-Слои | 21 ± 1 | 22 ± 2 | 20 ± 2 | 18 ± 3 | 14 ± 3 | 17 ± 2 | 14 ± 2 | 13 ± 3 |
| β-Повороты | 10 ± 2 | 11 ± 2 | 8 ± 4 | 13 ± 2 | 21 ± 3 | 21 ± 2 | 19 ± 3 | 15 ± 2* |
| Неупорядоченные структуры | 22 ± 2 | 18 ± 3 | 23 ± 2 | 19 ± 2 | 20 ± 3 | 12 ± 4 | 18 ± 1 | 19 ± 3 |
Для изучения влияния гормонов на структуру белков использовали аликвоты белков, приготовленные на фосфатном буфере (рН 7.4). Раствор белка (7.5 мг/мл) инкубировали в течение 30 мин при комнатной температуре в присутствии стероидных гормонов в конечной концентрации 5 × × 10–8, 5 × 10–7 и 5 × 10–6 М. Контрольные пробы инкубировали параллельно в присутствии соответствующей концентрации растворителя. Для количественного определения соотношения элементов вторичной структуры белка на алмазный кристалл ИК-спектрометра наносили 20 мкл полученной смеси и проводили запись ИК-спектра.
При инкубации апоА-I в присутствии 5 × 10–6 М кортизола наблюдалось увеличение доли α-спиралей на 8% (р < 0.05) и снижение доли β-поворотов на 6% (р < 0.05) (табл. 2). ТГК, в отличие от кортизола, вызывал в структуре апоА-I увеличение доли β-поворотов на 7% (р < 0.05) за счет уменьшения доли α-спиральных участков на 9% (р < 0.05) (табл. 3). При этом доля β-слоев и неупорядоченных структур в апоА-I практически не изменялась под влиянием как кортизола, так и ТГК. При инкубации ЧСА в присутствии 5 × 10–6 М ТГК (табл. 3) наблюдалось увеличение доли α-спиралей на 10% (р < 0.05) и снижение доли β-поворотов на 5%. Однако не обнаружено статистически значимых изменений в структуре ЧСА при его инкубации в присутствии всех исследуемых концентраций кортизола, а также в структуре апоА-I в присутствии 5 × 10–8 и 5 × 10–7 М кортизола (табл. 2). Полученные результаты свидетельствуют о разнонаправленных изменениях в структуре апоА-I под влиянием кортизола и его восстановленной формы – ТГК. Возрастание доли α-спиральных участков характерно для комплексов апоА-I–кортизол и ЧСА–ТГК, в то время как снижение доли этих структур − только для комплекса апоА-I–ТГК. Учитывая существующие представления о механизмах образования вторичной структуры белка [33], можно предположить, что наблюдаемое увеличение доли β-структур в апоА-I под действием ТГК приводит к функциональной стабилизации белка.
Таблица 3.
Влияние ТГК на содержание элементов вторичной структуры ЧСА и апоА-I по данным ИК-Фурье-спектроскопии
| Элементы вторичной структуры белка | Содержание элементов вторичной структуры белка, % | |||||||
|---|---|---|---|---|---|---|---|---|
| ЧСА | апоА-I | |||||||
| Концентрация ТГК, М | Концентрация ТГК, М | |||||||
| 0 (контроль) | 5 × 10–8 | 5 × 10–7 | 5 × 10–6 | 0 (контроль) | 5 × 10–8 | 5 × 10–7 | 5 × 10–6 | |
| α-Спирали | 48 ± 2 | 52 ± 3 | 51 ± 3 | 58 ± 3* | 46 ± 2 | 40 ± 3 | 38 ± 3 | 37 ± 3* |
| β-Слои | 20 ± 2 | 18 ± 4 | 21 ± 2 | 17 ± 3 | 16 ± 3 | 22 ± 3 | 24 ± 3 | 21 ± 2 |
| β-Повороты | 12 ± 2 | 13 ± 3 | 11 ± 3 | 7 ± 3* | 20 ± 3 | 23 ± 2 | 24 ± 3 | 27 ± 2* |
| Неупорядоченные структуры | 20 ± 3 | 17 ± 3 | 17 ± 2 | 18 ± 2 | 18 ± 2 | 15 ± 4 | 14 ± 2 | 15 ± 3 |
Механизм взаимодействия исследованных нами гормонов с апоА-I остается неизученным. Предполагается, что связывание стероидных гормонов с белками происходит с участием водородных связей между атомами белка и полярными группами гормона, а также с помощью гидрофобных и гидрофильных связей [21].
Как видно из представленных на рис. 4 данных, наиболее выраженное влияние на область амид I обоих белков оказывает ТГК. При этом его влияние на структуру ЧСА имеет характер компактизации (увеличение доли α-спиралей), в то время как на ароА-I − характер декомпактизации (увеличение доли β-поворотов). Как известно, β-повороты участвуют в формировании механизмов молекулярного распознавания, белок-белковых и белок-нуклеиновых взаимодействий [34]. Исследования, выполненные на моделях пептидов с точечными аминокислотными заменами, показали, что в процессе фолдинга и рефолдинга β-повороты активно содействуют правильному сворачиванию белка за счет сближения фланкирующих регионов аминокислотных участков белковой глобулы [35]. При удалении центрального β-поворота белки теряют способность взаимодействовать с лигандом [36]. На долю β-поворотов в поверхностном слое глобулярного белка может приходиться до 30% [37]. АпоА-I относится к белкам со средним уровнем глобулярности [38]. По данным ИК-Фурье-спектроскопии, в составе апопротеинов липопротеинов высокой плотности содержится ~32% β-поворотов [28]. АпоА-I, в отличие от альбумина, обладает большей липофильностью и относительно высокой конформационной лабильностью [38].
Рис. 4.
Разложение полосы амид I по гауссовым компонентам для апоА-I (а), ЧСА (г), а также их комплексов с 5 × 10–6 М ТГК (б, д) и 5 × 10–6 М кортизолом (в, е). НС – неупорядоченные структуры.
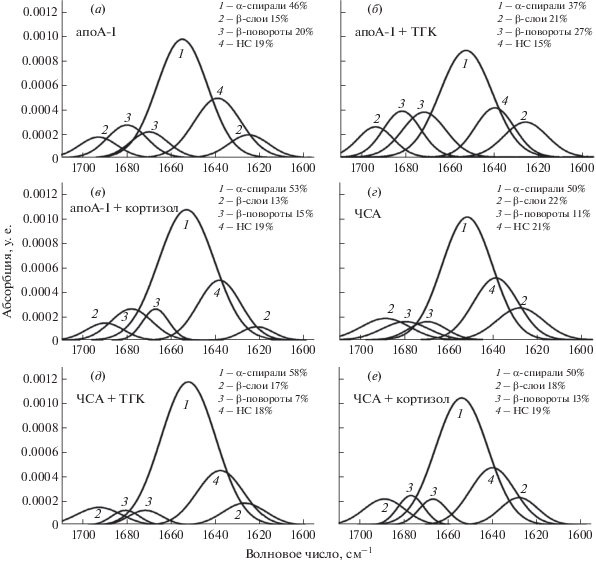
Полученные результаты свидетельствуют о том, что апоА-I не вносит существенный вклад в транспорт ТГК, но при его взаимодействии с этим метаболитом внутриклеточно или в биологических жидкостях может происходить изменение конформации апоА-I. Ранее нами было обнаружено, что взаимодействие ТГК с апоА-I усиливает стимулирующий эффект апоА-I на биосинтез белка в культуре гепатоцитов [11]. Можно предположить, что появление гидроксильной группы в кольце А в процессе биотрансформации кортизола в ТГК оказывает значительное влияние на взаимодействие ТГК с аминокислотными остатками, что, в свою очередь, приводит к изменению вторичной структуры и регуляторных свойств апоА-I. Следует заметить, что биотрансформация кортизола в ТГК, а также поглощение и ресекреция апоА-I в окружающую микросреду наиболее активно протекают в одной и той же клетке – макрофаге. Кроме того, макрофаги способны сами синтезировать [39] и, вероятно, секретируют данный белок, обладающий важными регуляторными свойствами [11].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использовали ЧСА (код А4327; Sigma, США), диизопропиловый эфир (Sigma, США), кортизол (Serva, Германия), ТГК (Research Plus Inc., США), ДМСО (Panreac, Испания). Остальные реактивы имели категорию о.с.ч. или х.ч.
Выделение апоА-I. Липопротеины выделяли из плазмы крови человека методом изоплотностного ультрацентрифугирования в растворе KBr в присутствии 3 мМ ЭДТА-Na2 на центрифуге Optima L-90K (Beckman Coulter, США) с использование углового ротора 70.1 Ti при 105 000 g [40]. Полученную фракцию ЛПВП диализовали против фосфатно-солевого буфера (PBS) при 4°С в течение 24 ч. Для получения нативного апоА-I проводили делипидирование ЛПВП в неденатурирующих условиях смесью бутанола и диизопропилового эфира [17]. Очистку апоА-I осуществляли методом высаливания сульфатом аммония с последующим растворением белка в 6 М мочевине и его ренатурацией с помощью диализа против PBS (рН 7.4) в течение 24 ч [41]. Чистоту выделенного апоА-I проверяли с помощью электрофореза в ПААГ, используя набор белковых маркеров, содержащих высокоочищенные рекомбинантные белки с молекулярной массой 10–250 кДа (СибЭнзим, Россия). Концентрацию белка определяли по методу Лоури, используя в качестве стандарта бычий сывороточный альбумин.
Флуоресцентный анализ. Константы связывания гормонов с апоА-I и ЧСА определяли методом тушения флуоресценции триптофана [13]. Для этой цели измеряли интенсивность флуоресценции раствора белка в отсутствие и в присутствии возрастающих концентраций гормонов, выступающих в качестве тушителей флуоресценции. Титрование проводили в термостатируемой (37°С) кварцевой кювете, содержащей 100 мкг белка в 1 мл PBS (рН 7.4). После добавления каждой аликвоты гормона к раствору белка содержимое кюветы интенсивно перемешивали и проводили измерение в течение 3 мин. Флуоресценцию триптофановых остатков белка регистрировали на спектрофлуориметре RF-5301 (Shimadzu, Япония) при длине волны возбуждения 280 нм и испускания (эмиссии) в диапазоне 300–500 нм. Стоковые растворы гормонов готовили в смеси спирта и ДМСО (в соотношении 1 : 1). Максимальная концентрация растворителя в растворах, содержащих белок и гормон, при проведении флуоресцентного анализа не превышала 5%. Вклад растворителя без гормона в интенсивность флуоресценции составлял не более 1.5% и не изменялся в исследуемом диапазоне волн 300–500 нм.
Инфракрасная спектроскопия. Влияние гормонов на вторичную структуру апоА-I и ЧСА исследовали методом нарушенного полного внутреннего отражения (НПВО) [42] с использованием приставки Smart Orbit на ИК-Фурье-спектрометре Nicolet 6700 (Thermo Scientific, США). Для этого аликвоты белка (7.5 мг/мл) в PBS (рН 7.4) инкубировали в течение 30 мин при комнатной температуре в отсутствие или в присутствии стероидных гормонов в конечной концентрации 5 × 10–8, 5 × 10–7 и 5 × 10–6 М. Для количественного определения соотношения элементов вторичной структуры белка на алмазный кристалл приставки Smart Orbit наносили 20 мкл смеси. Спектры регистрировали по 7 раз в диапазоне частот 4000–900 см–1, 250 сканирований с разрешением 4 см–1. Оптические пути прибора постоянно продували сухим воздухом для удаления паров воды. После вычитания из спектра белка спектра буфера, содержащего соответствующую концентрацию гормона или растворителя, проводили разложение области спектра амид I в диапазоне длин волн 1700–1600 см–1, используя методы Фурье-деконволюции и второй производной [28]. Обработку спектров проводили с помощью программы OMNIC, поставляемой с прибором. Разложение спектров на индивидуальные полосы по Гауссу выполняли с использованием программного обеспечения Origin 9.0 [43]. Исследования проведены на оборудовании ЦКП “Спектрометрические измерения” НИИ биохимии, ФИЦ фундаментальной и трансляционной медицины (Новосибирск, Россия).
Статистический анализ. Результаты представлены как среднее значение ± стандартное отклонение трех независимых экспериментов, выполненных в трех параллелях. Различия между выборками оценивали с помощью непараметрического U-критерия Манна–Уитни и считали статистически значимыми при р < 0.05.
ЗАКЛЮЧЕНИЕ
В настоящее время получено много фактов, свидетельствующих об участии апоА-I не только в транспорте холестерина, но и в регуляции внутриклеточных сигнальных путей, с которыми связаны его антиатерогенные, противовоспалительные и антиоксидантные свойства [10]. Ранее нами было показало, что регуляторные эффекты апоА-I зависят от конформационного состояния белка. В данной работе было исследовано влияние биологически активного гормона кортизола и его неактивного метаболита ТГК на вторичную структуру апоА-I. Для сравнения в аналогичных условиях было исследовано взаимодействие стероидных гормонов с ЧСА. С помощью метода тушения флуоресценции триптофана установлено, что наиболее высокую константу связывания имеют комплексы ЧСА−кортизол и апоА-I−кортизол. Полученные результаты подтверждают существующие представления о важной роли альбумина и апоА-I в транспорте активных форм стероидных гормонов. Однако использование ИК-Фурье-спектроскопии выявило наиболее выраженные и разнонаправленные изменения во вторичной структуре белков под влиянием неактивной формы кортизола – ТГК. При инкубации апоА-I в присутствии ТГК наблюдалось дозозависимое снижение содержания α-спиралей и увеличение содержания β-поворотов. В ЧСА под влиянием ТГК, напротив, количество α-спиралей возрастало, а β-поворотов – снижалось. Подобные изменения обнаружены в структуре апоА-I под влиянием кортизола. Механизмы взаимодействия исследованных нами гормонов с апоА-I остаются неизученными. Однако можно предположить, что конформационные изменения апоА-I, возникающие в процессе образования комплексов апоА-I со стероидными гормонами и их метаболитами, могут приводить к изменению акцепторных и регуляторных свойств данного белка.
Список литературы
Gospodarowicz D., Massoglia S., Cheng J., Fujii D.K. // J. Cell. Physiol. 1986. V. 127. P. 121–136. https://doi.org/10.1002/jcp.1041270116
Nofer J.R., Junker R., Pulawski E., Fobker M., Levkau B., Von Eckardstein A., Seedorf U., Assmann G., Walter M. // J. Thromb. Haemost. 2001. V. 85. P. 730–735. https://doi.org/10.1055/s-0037-1615660
Favre G., Tazi K.A., Le Gaillard F., Bennis F., Hachem H., Soula G. // J. Lipid Res. 1993. V. 34. P. 1093–1106. https://doi.org/10.1016/S0022-2275(20)37696-3
Libby P., Miao P., Ordovas J.M., Schaffer E.J. // J. Cell. Physiol. 1985. V. 124. P. 1–8. https://doi.org/10.1002/jcp.1041240102
Gordon S.M., Hofmann S., Askew D.S., Davidson W.S. // Trends Endocrin. Met. 2011. V. 22. P. 9–15. https://doi.org/10.1016/j.tem.2010.10.001
Collet X., Marcel Y.L., Tremblay N., Lazure C., Milne R.W., Perret B., Weech P.K. // J. Lipid Res. 1997, V. 38. P. 634–644. https://doi.org/10.1016/S0022-2275(20)37231-X
Handwerger S., Myers S., Richards R., Richardson B., Turzai L., Moeykins C., Meyer T., Anantharamahiah G.M. // Endocrinology. 1995. V. 136. P. 5555–5560. https://doi.org/10.1210/en.136.12.5555
Zhou X., Von Eckardstein A. // J. Huazhong. Univ. Sci. Technolog. Med. Sci. 2002. V. 22. P. 270–272. https://doi.org/10.1007/BF02896760
Усынин И.Ф., Дударев А.Н., Городецкая А.Ю., Мирошниченко С.М., Ткаченко Т.А., Ткаченко В.И. // Бюл. эксперим. биол. и мед. 2017. Т. 164. № 9. С. 285–288.
Nofer J.R. // Handb. Exp. Pharmacol. 2015. V. 224. P. 229–256. https://doi.org/10.1007/978-3-319-09665-0_6
Усынин И.Ф., Панин Л.Е. // Биохимия. 2008. Т. 73. С. 453–468.
Панин Л.Е., Тузиков Ф.В., Тузикова Н.А, Усынин И.Ф., Гимаутдинова О.И. // Биоорг. химия. 2001. Т. 27. С. 114–119. [Panin L.E., Tuzikov F.V., Tuzikova N.A., Usynin I.F., Gimautdinova O.I. // Russ. J. Bioorg. Chem. 2001. V. 27. P. 95–100.] https://doi.org/10.1023/A:1011381019423
Lakowicz J.R. // Principles of Fluorescence Spectroscopy, 3rd ed. Springer, Boston, MA, 2006. https://doi.org/10.1007/978-0-387-46312-4
Кудряшова Е.В., Гладилин А.К., Левашов А.В. // Усп. биол. химии. 2002. Т. 42. С. 257–294.
Stroupe S.D., Cheng Su-Li, Westphal U. // Arch. Biochem. Biophys. 1975. V. 168. P. 473–482.
Поляков Л.М., Суменкова Д.В., Князев Р.А., Панин Л.Е. // Биомед. химия. 2011. Т. 57. С. 308–313. https://doi.org/10.18097/pbmc20115703308
Gursky O., Atkinson D. // Proc. Natl. Acad. Sci. USA. 1996. V. 93. P. 2991–2995. https://doi.org/10.1073/pnas.93.7.2991
Белинская Д.А., Гончаров Н.В. // Биоорг. химия. 2020. Т. 46. С. 247–260. [Belinskaia D.A., Goncharov N.V. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 287–298.] https://doi.org/10.31857/S0132342320030045
Cham B.E., Knowles B.R. // J. Lipid. Res. 1976. V. 17. P. 176–181. https://doi.org/10.1016/S0022-2275(20)37003-6
Naik P.N., Chimatadar S.A., Nandibewoor S.T. // J. Photochem. Photobiol. B. 2010. V. 100. P. 147–159. https://doi.org/10.1016/j.jphotobiol.2010.05.014
Chanphai P., Vesper A.R., Bariyanga J., Bérubé G., Tajmir-Riahi H.A. // J. Photochem. Photobiol. B. 2016. V. 161. P. 184–191. https://doi.org/10.1016/j.jphotobiol.2016.05.015
Abu Teir M.M., Ghithan J.H., Darwish S.M., Abu-Hadidal M.M. // J. Appl. Biol. Sci. 2011. V. 5. P. 35–47.
Abboud R., Charcosset C., Greige-Gerges H. // Chem. Phys. Lipids. 2017. V. 207. P. 260–270. https://doi.org/10.1016/j.chemphyslip.2017.05.011
Neault J.F., Tajmir-Riahi H.A. // Biochim. Biophys. Acta. 1998. V. 1384. P. 153–159. https://doi.org/10.1016/s0167-4838(98)00011-9
Liu X., Shang Y., Ren X., Li H. // J. Chem. 2013. V. 2013. P. 1–7. https://doi.org/10.1155/2013/494706
Yang H., Yang S., Kong J., Dong A., Yu S. // Nat. Protoc. 2015. V. 10. P. 382–396. https://doi.org/10.1038/nprot.2015.024
Abrosimova K.V., Shulenina O.V., Paston S.V. // J. Phys. Conf. Ser. 2016. V. 769. P. 1–6. https://doi.org/10.1088/1742-6596/769/1/012016
Krilov D., Balarin M., Kosovic M., Gamulin O., Brnjas-Kraljevic J. // Spectrochim. Acta A. 2009. V. 73. P. 701–706. https://doi.org/10.1016/j.saa.2009.03.015
Cioni P., Strambini G.B. // Biophys. J. 2002. V. 82. P. 3246–3253. https://doi.org/10.1016/S0006-3495(02)75666-X
Поляничко А.М., Романов Н.М., Старкова Т.Ю., Костылева Е.И., Чихиржина Е.В. // Цитология. 2014. Т. 56. № 4. С. 316–322.
Sugio S., Kashima A., Mochizuki S., Noda M., Kobayashi K. // Protein Eng. Des. Sel. 1999. V. 12. P. 439–444. https://doi.org/10.1093/protein/12.6.439
Усольцев Д.А., Ситникова В.Е., Носенко Т.Н., Олехнович Р.О., Успенская М.В. // Научно-технический вестник информационных технологий, механики и оптики. 2019. Т. 19. С. 586–593. https://doi.org/10.17586/2226-1494-2019-19-4-586-593
Бычкова В.Е., Семисотнов Г.В., Балобанов В.А., Финкельштейн А.В. // Усп. биол. химии. 2018. Т. 58. С. 67–100.
Zhou H.X., Hoess R.H., DeGrado W.F. // Nat. Struct. Biol. 1996. V. 3. P. 446–451. https://doi.org/10.1038/nsb0596-446
Predki P.F., Agrawal V., Brunger A.T., Regan L. // Nat. Struct. Biol. 1996. P. 54–58. https://doi.org/10.1038/nsb0196-54
Marcelino A.M.C., Gierasch L.M. // Biopolymers. 2008. V. 89. P. 380–391. https://doi.org/10.1002/bip.20960
Kong J., Shaoning Y.U. // Acta Biochim. Biophys. Sin. 2007. V. 39. P. 549–559. https://doi.org/10.1111/j.1745-7270.2007.00320.x
Мишарин А.Ю. // Биоорг. химия. 1998. Т. 24. С. 563–585. [Misharin A.Yu. // Russ. J. Bioorg. Chem. 1998. V. 24. P. 497–517.]
Mogilenko D.A., Orlov S.V., Trulioff A.S., Ivanov A.V., Nagumanov V.K., Kudriavtsev I.V., Shavva V.S., Tanyanskiy D.A., Perevozchikov A.P. // FASEB J. 2012. V. 26. P. 2019–2030. https://doi.org/10.1096/fj.11-193946
Mills G.L., Lane P.A., Weech P.K. // Laboratory Techniques in Biochemistry and Molecular Biology. A Guidebook to Lipoprotein Technique. Amsterdam: Elsevier, 1984. P. 18–116.
Jiang L., Hea L., Fountoulakis M. // J. Chromatogr. A. 2004. V. 1023. P. 317–320. https://doi.org/10.1016/j.chroma.2003.10.029
Oberg K.A., Fink A.L. // Anal. Biochem. 1998. V. 256. P. 92–106. https://doi.org/10.1006/abio.1997.2486
Чихиржина T.В., Белая И.А., Баранова Ю.Г., Поляничко А.М. // Вестник СПбГУ. Физика и химия. 2017. Т. 4. С. 42–53. https://doi.org/10.21638/11701/spbu04.2017.106
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


