Биоорганическая химия, 2022, T. 48, № 2, стр. 162-193
Маннозные рецепторы альвеолярных макрофагов как мишень для адресной доставки лекарственных средств в легкие
И. Д. Злотников 1, Е. В. Кудряшова 1, *
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 11Б, Россия
* E-mail: helenakoudriachova@yandex.ru
Поступила в редакцию 28.12.2020
После доработки 12.01.2021
Принята к публикации 26.01.2021
- EDN: RSOBOO
- DOI: 10.31857/S0132342322010158
Аннотация
Обзор посвящен изучению структуры, свойств и функций маннозных рецепторов альвеолярных макрофагов – перспективных мишеней для создания систем адресной доставки лекарственных средств, предназначенных для лечения заболевания дыхательных путей. В первом разделе обсуждается поиск оптимальной стратегии изучения лиганд-рецепторных взаимодействий и определения специфичности лигандов к маннозным рецепторам макрофагов с целью увеличения эффективности и органной биодоступности лекарственных препаратов. Рассмотрены модельные белки, которые используются для симуляции взаимодействий белок–лиганд в системах in vitro. Так, применение конканавалина А в качестве модельного маннозоспецифичного лектина дает возможность определять параметры связывания с лигандами различной структуры, проводить широкий скрининг массива лигандов, исследовать вклад стерических факторов при связывании лигандов, что затруднительно в случае сложной мишени – маннозного рецептора альвеолярных макрофагов (CD206), для которого в связи с его малой доступностью технически сложно создать адекватную скрининговую методику in vitro. Во втором разделе обзора представлены методы определения параметров связывания углеводсодержащих лигандов с рецепторами и модельными лектинами: ИК-спектроскопия, флуоресцентные методы, аффинная хроматография, конфокальная микроскопия, проточная цитометрия, рентгеноструктурный анализ, калориметрия. Проанализирован большой массив количественных параметров комплексообразования олигосахаридных лигандов с конканавалином А. Подбор оптимальной структуры лиганда варьированием плотности и количества маннозосодержащих лигандов, а также длины спейсера рассматривается как основа для создания систем адресной доставки. В третьем разделе обзора обсуждается практическое применение рассматриваемых подходов при создании и испытании систем адресной доставки биоактивных веществ в системах in vivo.
ВВЕДЕНИЕ .......................................................163
АЛЬВЕОЛЯРНЫЕ МАКРОФАГИ И ИХ РЕЦЕПТОРЫ ...........................................163
Альвеолярные макрофаги.....................................163
Маннозные рецепторы.........................................165
Модельные лектины для выявления наиболее специфичных лигандов. Конканавалин А..............167
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ СВЯЗЫВАНИЯ УГЛЕВОДНЫХ ЛИГАНДОВ С МАННОЗНЫМИ РЕЦЕПТОРАМИ И МОДЕЛЬНЫМИ ЛЕКТИНАМИ...........................172
ИК-Фурье-спектроскопия в режиме нарушенного полного внутреннего отражения (FTIR-ATR).........172
Флуоресцентная спектроскопия.........................174
Анизотропия (поляризация) флуоресценции.........174
Калориметрия изотермического титрования.....175
Лектиновая аффинная хроматография...............177
Конфокальная микроскопия.................................177
Проточная цитометрия......................................178
Рентгеноструктурный анализ (РСА) комплексов лектинов с маннозными лигандами. Нейтронная кристаллография................................................180
Комбинации различных методов для определения параметров связывания лиганд–рецептор..........182
СОЗДАНИЕ МАННОЗИЛИРОВАННЫХ НОСИТЕЛЕЙ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ФУНКЦИЕЙ АДРЕСНОЙ ДОСТАВКИ........................................................183
Липосомы. Липидные частицы............................183
Полисахариды, хитозан и маннан.......................184
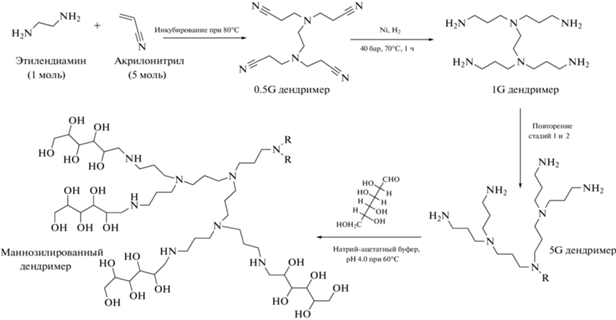
Дендримеры..........................................................185
Циклодекстрины.................................................187
ЗАКЛЮЧЕНИЕ.................................................190
СПИСОК ЛИТЕРАТУРЫ.................................190
ВВЕДЕНИЕ
Рост числа инфекционных заболеваний, вызываемых патогенными бактериями, представляет серьезную угрозу обществу, выступая основной причиной смертности в развивающихся странах и серьезной проблемой для развитых стран. Высокоэффективные антибактериальные препараты различных классов часто характеризуются низкой способностью проходить через клеточные мембраны, их концентрация внутри клетки не достигает того уровня, который создается в крови, что вынуждает прибегать на практике к длительному лечению внутриклеточных инфекций высокими дозами препарата. Это приводит к появлению нежелательных побочных реакций и низкой комплаентности к терапии у пациентов, что в свою очередь повышает риск развития антибиотикоустойчивости микроорганизмов. Возникновение и развитие резистентных и мультирезистентных штаммов возбудителей инфекций, устойчивых одновременно к нескольким типам антибиотиков приводит к появлению заболеваний, с трудом поддающихся лечению существующими лекарственными препаратами. Наиболее остро данная проблема проявляется в случае хронических инфекций или при таких тяжелых заболеваниях, как туберкулез, пневмония, листериозная инфекция, которая может вызывать менингит, пневмонию, сепсис. В случае туберкулеза стандартный курс с одновременным использованием 4–5 препаратов занимает 6–12 месяцев. Из-за необходимости приема большого количества препаратов и связанных с ними токсических эффектов противотуберкулезная терапия имеет серьезные ограничения. Многие применяющиеся в настоящее время антибактериальные препараты имеют ограничения по стабильности и биодоступности, обладают выраженными побочными эффектами и неоптимальными фармакокинетическими свойствами, вызывая поражение печени и других органов. Это обусловливает необходимость разработки новых эффективных антибактериальных препаратов, а также носителей лекарственных средств с функцией адресной доставки. Перспективной мишенью могут быть маннозные рецепторы макрофагов. Макрофаги занимают центральную роль в иммунном ответе при целом ряде заболеваний, включая онкологические, аутоиммунные, инфекционные, фибротические, и ряд других. На поверхности активированных макрофагов экспрессируется большое количество маннозных рецепторов (CD206), опосредующих эндоцитоз по клатрин-зависимому механизму. Одна из основных функций маннозных рецепторов – распознавание паттернов – концевых остатков маннозы, N-ацетилглюкозамина и фукозы присутствует на гликановых цепях белков поверхности некоторых патогенных микроорганизмов, таких как C. albicans, Mycobacterium tuberculosis, Pneumocystis carinii, Listeria monocytogenes, Leishmania donovani и др. Помимо этого, маннозные рецепторы участвуют в процессе презентации антигенов, резолюции воспалительной реакции, клиренсе некоторых гормонов. Соответственно, таргетное воздействие на макрофаги могло бы открыть новые возможности для воздействия на биохимические процессы, драйвером или непосредственным участником которых они выступают. Таким образом, потенциальные области применения систем таргетного нацеливания на макрофаги могут включать в себя доставку антивирусных или антибактериальных препаратов в очаги латентной инфекции для более эффективной терапии таких инфекционных заболеваний как, например, туберкулез, ВИЧ, Эбола.
АЛЬВЕОЛЯРНЫЕ МАКРОФАГИ И ИХ РЕЦЕПТОРЫ
Альвеолярные макрофаги
Альвеолярные макрофаги (АМ) – “первые стражи” дыхательного дерева, которые занимают центральное место в борьбе с заболеваниями легких, защищают от повреждений легочную ткань посредством распознавания и уничтожения патогенов. В ответ на инвазию микроорганизмов они выделяют различные секреторные продукты, которые, в свою очередь, вызывают фагоцитоз и/или направленный на фаголизосомы пиноцитоз [1]. Фагоцитоз блокируется при заражении микобактериями туберкулеза, и клетки на этой стадии начинают служить убежищем для размещения и роста бактерий, что сильно ограничивает эффективность антибиотикотерапии. Так, большая часть существующих противотуберкулезных препаратов малоэффективны против дормантной инфекции (туберкулез). Поэтому адресная доставка в АМ представляет значительный интерес в качестве перспективного подхода для повышения эффективности лекарственной терапии заболеваний дыхательных путей [2].
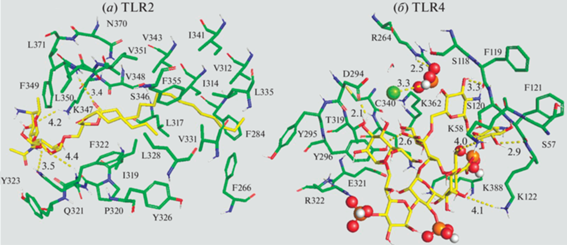
Ключевую роль во взаимодействии макрофагов с бактериями играют Toll-подобные рецепторы (TLR) [3], представляющие собой трансмембранные гликопротеины. Распознавание бактерий МФ осуществляется в том числе с помощью рецепторов TLR2 (CD282) и TLR4 (CD284), лигандами которых на поверхности Mycobacterium tuberculosis служат, например, арабиноманнан и галактоманнан, а также компоненты клеточной стенки бактерий, например, липотейхоевые кислоты. На рис. 1 приведены фрагменты TLR2 в комплексе с липотейхоевой кислотой Streptococcus pneumoniae и TLR4 с липополисахаридом E. coli. В первом случае реализуются гидрофобные взаимодействия остатков жирной кислоты с остатками Val, Leu, Pro, Phe и Tyr. Связывание углевода в TLR4 происходит в значительной степени осно́вными и ароматическими остатками. Рецепторы активируют сигнальные пути МФ, тем самым индуцируя секрецию противовоспалительных цитокинов, хемокинов и антимикробных молекул, уничтожающих бактерии или вызывающих образование гранулем [4–6].
Рис. 1.
Toll-подобные рецепторы: (а) – TLR2 в комплексе с липотейхоевой кислотой; (б) – TLR4 в комплексе с олигосахаридом. Зеленый цвет – рецептор, желтый – лиганд, оранжевый и три красные сферы – фосфатная группа (PDB: 3a7b, 3fxi).
Не менее важный класс рецепторов, обусловливающих распознавание макрофагами (МФ) и дендритными клетками (ДК) патогенов, – это лектиновые рецепторы, активность которых зависит от присутствия и концентрации ионов Ca2+ [7, 8]. Они экспрессируются во многих жизненно важных органах человека, таких как печень, селезенка, легкие, костный и головной мозг, а также в дендритных клетках, находящихся в крови или лимфе [9]. Маннозные рецепторы АМ и ДК распознают гликопротеины микроорганизмов (например, Candida albicans, Pneumocystis carinii и Leishmania donovani [9, 10]) и грибов с концевыми остатками маннозы. Напротив, у человека гликозиды на нередуцирующих концах “защищены” сиаловыми кислотами. Рассмотрим наиболее значимые С-лектиновые рецепторы (табл. 1) миелоидных клеток и макрофагов. Среди них особый интерес для данной работы представляет маннозный рецептор CD206 [9, 11, 12].
Таблица 1.
Характеристика лектиновых рецепторов миелоидных клеток и макрофагов
| Рецептор | Структурные особенности | Специфичность к лигандам | Клеточная локализация |
|---|---|---|---|
| Маннозный рецептор (CD206) | Тип I, 8 CTLD | Манноза, глюкоза, N-Ac-глюкозамин | Незрелые миелоидные дендритные клетки, моноциты, макрофаги |
| CD205 | Тип I, 10 CTLD | Не определена | Незрелые миелоидные дендритные клетки, плазмоцитоидные дендритные клетки, клетки Лангерганса |
| CD209 | Тип II, 1 CTLD | Манноза, фукоза | Незрелые миелоидные дендритные клетки, зрелые миелоидные дендритные клетки, моноциты, макрофаги, Т-клетки |
| Лангерин (CD207) | Тип II, CTLD | Манноза | Клетки Лангерганса |
| Дектин-1 | Тип II, 1 СТLD, ITAM | Р-глюкан | Незрелые миелоидные дендритные клетки, плазмоцитоидные дендритные клетки, моноциты, макрофаги, нейтрофилы, Т-клетки |
| Дектин-2 | Тип II, 1 CTLD | Манноза | Дендритные клетки, клетки Лангерганса |
Маннозные рецепторы
CD206 (рис. 2а) представляет собой трансмембранный белок (175 кДа), который распознает гликозилированные лизосомальные ферменты и углеводные фрагменты с концевыми остатками Man, Fuc и GlcNac [9, 11, 13]. N-конец CD206 состоит из одного цистеин-богатого участка (CysRD), затем следуют домен фибронектина II (FNII, рис. 2б) и восемь лектиноподобных доменов С-типа (CTLDs [14]). C-конец МР содержит трансмембранный домен и короткий C-концевой цитоплазматический домен (45 а.о.) [11].
Рис. 2.
(а) – Структура внеклеточной части маннозного рецептора CD206. Домены CTLD4–8 ответственны за связывание с Man-остатками; (б) – домен связывания фибронектина F2 (FN-1F2) с желатином. Красным цветом показаны β-слои (1–4), желтым – дисульфидные связи. Боковые радикалы Phe19 и Trp40 окрашены зеленым, а Leu17, Tyr21, Phe26, Tyr47, Tyr53 и Phe55 – синим [11].
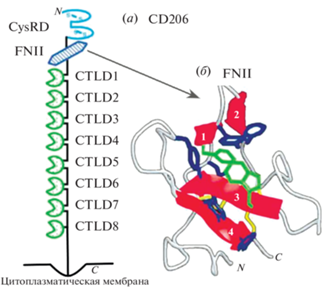
Фибронектин – это большой внеклеточный матриксный гликопротеин, состоящий из нескольких доменов, включая два модуля типа II (FN-1 и FN-2), которые могут связывать коллаген (желатин). Домены FNII (рис. 2б) обнаружены в различных белках, включая матриксные металлопротеиназы 2 и все члены семейства рецепторов маннозы, в том числе CD206 [11]. Через этот домен рецептор маннозы связывает клеточные поверхности и различные соединения, включая коллаген [15], фибрин, гепарин, ДНК, а также большинство анионных лигандов за счет наличия положительного заряда. На рис. 2б указаны аминокислоты, играющие важную роль в связывании рецептор–коллаген (желатин в данном случае моделирует свойства коллагена). Молекулярный механизм связывания коллагена этим доменом состоит в том, что ароматические аминокислотные остатки домена в гидрофобном кармане взаимодействуют с аминокислотными остатками коллагена, разрушая его тройную спираль, а остатки Arg34 и Asp36 стабилизируют это взаимодействие. Кроме того, тесная близость N- и C-концов позволяет сформировать более компактную глобулярную структуру между соседними доменами, что будет способствовать связыванию лиганда. Остатки Phe19, Trp40, Leu17, Tyr21, Phe26, Tyr47 и Tyr53 образуют гидрофобный карман [11, 15]. Таким образом, показано, что за счет объединения нескольких доменов рецептора увеличивается энергия и специфичность связывания.
Домен CysRD (рис. 2а) состоит из 147 а.о., содержит шесть остатков цистеина и связывает гликопротеины, содержащие концевой 4-сульфо-N-ацетил-глюкозамин, например, лютропин и тиреотропный гормон. Показано, что CysRD за счет 4-сульфо-N-ацетилглюкозамина также образует прочные водородные связи с цистеиновыми группами маннозных рецепторов [11, 16, 17].
С-лектиноподобный участок в CD206 состоит из восьми доменов распознавания углеводов (CTLDs) (рис. 2а) [11, 13, 18]. Эти домены во внеклеточной области маннозного рецептора имеют только 30% гомологии между собой. В своей структуре CTLDs содержат по две α-спирали и два антипараллельных β-листа. Каждый из них включает аминокислотные остатки, необходимые для связывания Ca2+ и лигандов. Из восьми CTLDs только 4–8-й участки критически необходимы для связывания и эндоцитоза лигандов с концевыми остатками Man, GlcNAc и Fuc. Отметим, что только CTLD4 (кристаллическая структура описана в работе Feinberg et al. [13, 18]) обладает доказанной углевод-связывающей активностью в изоляции от других доменов (т.е. этот участок сам по себе способен распознавать углеводные остатки, хотя и недостаточно эффективно). По литературным данным, у остальных CTLDs такая способность практически не наблюдается [19, 20]. При изучении лиганд-рецепторных взаимодействий нужно учитывать, что все восемь доменов необходимы для совместного связывания лигандов с высоким сродством и для эндоцитоза, т.к. достигается эффект многовалентного связывания (корпоративности).
Хотя важную роль играют все восемь участков, четвертый изучен более детально. Основное взаимодействие между CTLD4 и углеводным лигандом происходит через прямое взаимодействие с Ca2+ в углевод-связывающем сайте, аналогично маннан-связывающему лектину A (MBL-A, PDB: 1MSB) [20, 21]. MBL-A мыши имеет олигомерную структуру, построенную из двух субъединиц по 13 кДа каждая [22]. Человеческий MBL представляет собой гексамер тримеров (400–700 кДа), как и CD206 содержит CysRD, CTLDs [23]. Этот лектин, как и МР, играет важную роль во врожденном иммунитете, а также показывает сходные с МР механизмы распознавания лигандов. Сравнение углевод-связывающих доменов CTLD4 и MBL приведено на рис. 3 [18].
Рис. 3.
Сравнение связывания маннозы в присутствии ионов Ca2+ в основном участке CTLD4 маннозного рецептора CD206 (серые связи) и MBL-A (красные связи). Номера остатков указаны для МР, в скобках приведены эквиваленты MBL-A [18].
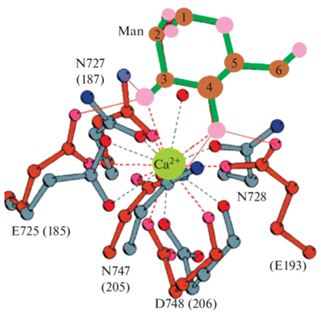
Поскольку MBL человека детально изучен [23], а именно его пути активации, роль в иммунной системе, то целесообразно провести параллели с маннозным рецептором (CD206). Для обоих рецепторов характерен механизм распознавания углеводов за счет кооперации нескольких CTLDs. Оба рецептора – лектиновые и имеют сходные структурные мотивы. Сравним функции этих рецепторов. MBL участвует в распознавании и связывании углеводов на поверхности клеточной стенки микроорганизмов, что приводит к активации лектинового пути системы комплемента. Кроме того, MBL связывает апоптотические тельца и усиливает их поглощение фагоцитами. МР распознает, поглощает и нейтрализует патогенные микроорганизмы. Кроме того, МР задействован в выработке противовоспалительных цитокинов, что служит основой функционирования врожденной и адаптивной иммунных систем.
Для МР характерен pH- и Ca2+-зависимый механизм взаимодействия рецептора с лигандом. При снижении pH с 7.8 до 4.5 сродство к рецептору уменьшалось в 45 раз, а при дальнейшем снижении и вовсе терялось. Эффективность распознавания МР лигандов также зависит от Ca2+: взаимодействие начинает происходить при концентрации катиона >10–4 М (концентрация лектина ≈10–6 M), затем резко возрастает и при содержании >10–3 М (что соответствует физиологической концентрации ионов Ca2+) выходит на плато, достигая максимального значения сродства [20].
Взаимодействие MBL с лигандом происходит по лектиновому пути (тип каскадной реакции в системе комплемента, где каждая последующая реакция протекает в силу химической функциональности, сформированной на предыдущей стадии, а также при возможности образования нескольких сайтов связывания каждое последующее связывание прочнее предыдущего – эффект кооперативности) [24]. Лектиновый путь активации комплемента не требует участия антител и запускается при связывании микробных полисахаридов лектинами, циркулирующими в плазме крови, такими как MBL. Кроме того, для MBL характерны аналогичные МР Ca2+ и pH-зависимые механизмы связывания лигандов.
По сравнению с другими маннозосвязывающими CTLDs, четвертый домен уникален тем, что в дополнение к связыванию углеводов через сайт Ca2+ происходит взаимодействие углеводов с ароматическим кольцом Tyr729, что увеличивает силу связывания (по результатам ЯМР-исследований) [11, 13, 18]. Связывание с высоким сродством – результат кластеризации нескольких CTLDs (сайты 1–8 на рис. 2а) [19]. Такая кластеризация позволяет связывать многовалентные разветвленные лиганды, такие как высокоманнозные N-связанные олигосахариды (согласно общей формуле (Man)0–14(GlcNAc)2). Наиболее часто значение индекса Man находится в диапазоне 3–9. Для CTLDs предполагается кооперативное связывание за счет конформационных изменений рецептора при связывании с углеводами. Данный аспект обсуждается только на уровне гипотез и общих выводов, поэтому открываются перспективы по определению механизмов, обеспечивающих эффективность связывания, например, с помощью компьютерного моделирования.
МР CD206 играет важную роль в иммунном ответе. В подтверждение этого приведем результаты исследования, представленного в работе Suzuki et al. [25]. Концентрация CD206 была измерена в сыворотках крови пациентов: у больных туберкулезом или добровольцев с подозрением на туберкулез концентрация CD206 составляет >2000 нг/мл (в среднем 3000–5000 нг/мл), причем у здоровых людей этот показатель не превышает 1000 нг/мл. Следовательно, скопления МФ обнаруживаются в инфицированных участках, на основе чего сделан вывод, что уровень CD206 в сыворотке крови повышается при туберкулезе и может быть потенциальным биомаркером для прогнозирования заболеваний легких [25].
В заключение данного раздела суммируем функции маннозных рецепторов (МР). Врожденная иммунная система функционирует, чтобы защитить хозяина в первые часы после проникновения инфекции, и это в первую очередь обусловлено активностью фагоцитирующих клеток, таких как макрофаги. Фагоциты экспрессируют на своей клеточной поверхности МР, которые могут распознавать широкий спектр патогенов, включая Candida albicans, Pneumocystis carinii, Leishmania donovani, Mycobacterium tuberculosis и Klebsiella pneumoniae. МР обладают высоким потенциалом при использовании в качестве мишени для усиления активации МФ и распознавания антигенов [9, 26]. Наличие данного вида рецепторов именно на АМ позволяет предположить возможность создания систем активного нацеливания для лечения инфекционных заболеваний легких, пневмонии и туберкулеза.
Модельные лектины для выявления наиболее специфичных лигандов. Конканавалин А
Взаимодействие МР альвеолярных макрофагов с гликозилированными соединениями можно исследовать на модельных лектинах, один из них – детально изученный конканавалин А (ConA) [27–32]. ConA – растительный митоген, он широко используется в биологии и биохимии для характеристики гликопротеинов и других углеводсодержащих веществ на поверхности различных клеток. ConA (рис. 4) специфически связывается с определенными структурами, содержащимися в различных сахарах, гликопротеинах, гликолипидах, главным образом с нередуцирующими концевыми α-D-маннозильными и α-D-гликозильными группами [27–32]. ConA взаимодействует с разнообразными лигандами, содержащими углеводы с большим количеством Man-остатков, маркерами групп крови, инсулиновыми рецепторами, иммуноглобулинами и карциноэмбриональным антигеном, с липопротеинами низкой плотности. ConA используется для очистки гликозилированных макромолекул в лектиновой аффинной хроматографии, а также для изучения иммунной регуляции различными иммунными клетками.
Рис. 4.
Структурная организация ConA: (а) – тетрамер; (б) – увеличенное изображение одной субъединицы; (в) – комплекс ConA с маннозой. Рецептор показан голубым цветом, манноза – белым. Зеленый шар – Ca2+, фиолетовый – Mn2+. Приведены однобуквенные наименования остатков, расстояния указаны в Å.
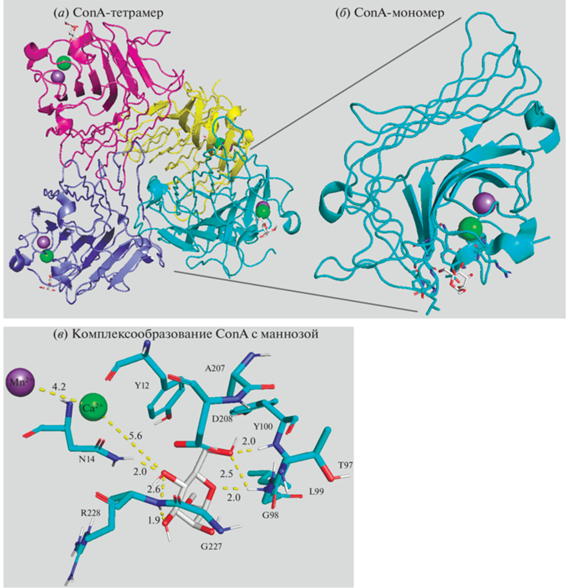
Как и большинство лектинов, ConA – гомотетрамер: каждая субъединица (26.5 кДа, 235 а.о., сильно гликирован) связывает катионы металлов (обычно Mn2+ и Ca2+) и требует их присутствия для реализации углевод-связывающей способности [31, 32]. При рН ≤ 5.8 он диссоциирует на димеры, однако практически нет различий в параметрах связывания димерного и тетрамерного ConA, т.е. связывающая способность этого лектина не утрачивается при повышении кислотности, а даже несколько усиливается при подкислении среды до pH 5, хотя для MBL характерно небольшое снижение.
ConA взаимодействует с Man-остатками олигосахаридов, подобных поверхностным углеводам бактерий. Рассмотрим механизм связывания лигандов с ConA. Основные взаимодействия обусловлены водородными связями с тремя остатками: Asp208, которому предшествует цис-пептидная связь (обусловливает оптимальную конфигурацию цепей), Asn14, который непосредственно взаимодействует с ионами кальция и Arg228. Полная структура ConА в комплексе с маннозой была установлена методом рентгеновской дифракции [33] (рис. 4а). Сходный с МР и MBL (рис. 3) механизм связывания позволяет использовать ConA в качестве модельного лектина для определения параметров взаимодействия белок–лиганд. Также важны ван-дер-ваальсовы взаимодействия между ароматическими остатками Tyr12, Phe, Leu или Cys. Конформационные изменения в месте связывания ConA таковы: первое из них затрагивает боковую цепь Arg228, второе конформационное изменение касается небольшого перемещения ~0.5 Å участка Thr97–Glu102 [28]. Конфигурация остатков аминокислот ConА, отвечающих за связывание, специфична преимущественно к структуре маннозы, к другим моносахаридным остаткам сродство более слабое, т.к. возникают структурные несоответствия гидроксильных групп углеводов центрам связывания (табл. 2).
Таблица 2.
Значения констант диссоциации (Kd) комплексов ConA с маннозосодержащими лигандами, рассчитанные при соотношении рецептор–лиганд 1 : 1
| № | Лиганд | Kd комплекса с ConA, мкМ | Условия, метод | Ссылка | |
|---|---|---|---|---|---|
| 1 | Man 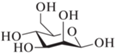 |
350 ± 30 | FTIR – изменения в ИК-спектрах, pH 7.4, 298 K |
[34] | |
| 2 | ChitMan5 | 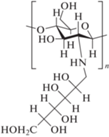 |
55 ± 3 | ||
| 3 | ChitMan90 | 16 ± 2 | |||
| 4 | GalMan (200 кДа) 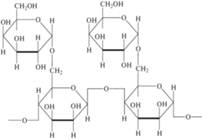 |
520 ± 40 | |||
| 5 | diMan (диманнозид) | 84 ± 8 | Обратное титрование при pH 5.5, 298.3 К | [45] | |
| 6 | triMan (триманнозид) | 9.1 ± 0.4 | |||
| 7 | MeMan | 156 ± 12 | |||
| 8 | MeUmb-Man | 23.0 ± 0.3 (29.2 ± 0.4 при pH 5.5) | Тушение флуоресценци при pH 7.2, 298.3 К | [44] | |
| 9 | MeUmb-diMan | 7.2 ± 0.3 | |||
| 10 | MeUmb-triMan | 12.2 ± 0.4 | |||
| 11 | Me-α-Glc | 510 | Калориметрия изотермического титрования при pH 7.2, 298 К | [47] | |
| 12 | Me-α-GlcNAc | 930 | |||
| 13 | Мальтоза | 760 | |||
| 14 | Мальтотриоза | 750 | |||
| 15 | MeMan | 122 | |||
| 16 | Me-α2-D-Glc | 365 | |||
| 17 | α(1,2)-Маннобиоза 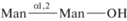 |
2.4 | |||
| 18 | Me-α(1,2)-Диманнозид 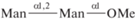 |
7.1 | |||
| 19 | α(1,2)-Триманноза 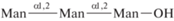 |
2.6 | |||
| 20 | α(1,3)-Маннобиоза 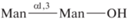 |
71 | |||
| 21 | Me-α(1,3)-Диманнозид 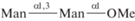 |
30 | |||
| 22 | α(1,6)-Маннобиоза 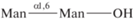 |
75 | |||
| 23 | Me-α(1,6)-диманнозид 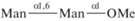 |
123 | Калориметрия изотермического титрования при pH 7.2, 298 К | [47] | |
| 24 | β(1,2)-GlcNAc-Man 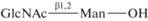 |
150 | |||
| 25 | 3,6-Ди-O-(маннопира-
нозил)-α-манно-пираноза 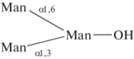 |
3.0 | |||
| 26 | Me-3,6-ди-O-(маннопиранозил)-α-маннопиранозид | 2.0 | |||
| 27 | 3,6-Ди-O-(β(1,2)-GlcNAc-маннопиранозил)-
α-маннопираноза 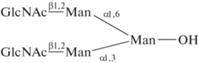 |
0.71 | |||
| 28 | 6-(3,6-Диманнопиранозил)-3-(α-маннопиранозил)-α-маннопираноза 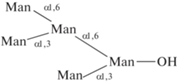 |
1.5 | |||
| 29 | Man7-гликопептид | 3.3 (Kd определяли для смеси Man7 и Man8) | |||
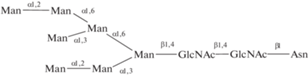 |
|||||
| 30 | Man8-гликопептид | ||||
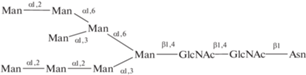 |
|||||
| 31 | Man9-гликопептид | 0.91 | |||
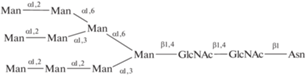 |
|||||
| 32 |  |
0.24 | Калориметрия изотермического титрования при pH 7.2, 298 К | [48] | |
| 33 |  |
0.074 | |||
| 34 | D-Глюкоза | 4070 | Метод ингибирования Ландштейнера* | [27] | |
| 35 | D-Манноза | 890 | |||
| 36 | D-Фруктоза | 1790 | |||
| 37 | Галактоза | >22 500 (низкое сродство) | |||
| 38 | Аллоза | ||||
| 39 | Метил-α-D-глюкопиранозид | 510 | |||
| 40 | Метил-β-D-глюкопиранозид | >12 700 | |||
| 41 | Метил-α-D-маннопиранозид | 122 | |||
| 42 | Метил-N-Ac-α-глюкозамин | 1015 | |||
| 43 | Метил-α-D-фруктопиранозид | >30 000 | |||
| 44 | Метил-β-D-фруктопиранозид | 173 | |||
| 45 | Метил-α-D-фруктофуранозид | 3200 | |||
| 46 | Метил-β-D-фруктофуранозид | 1160 | |||
| 47 | Метил-α-L-сорбопиранозид | 630 | |||
| 48 | Мальтоза | 880 | |||
| 49 | Изомальтоза | 450 | |||
| 50 | Целлобиоза | >22 500 (низкое сродство) | |||
| 51 | Ламинарибиоза | ||||
| 52 | Генциобиоза | ||||
| 53 | Сукроза | 4710 | |||
| 54 | Софороза | 1420 | |||
| 55 | 2-O-β-D-Галактопиранозил-D-глюкоза | ||||
| 56 | Метил-α-софорозид | 245 | |||
На рис. 4б представлена схема связывания маннозы с ConA. Примечательно, что ConA не распознает углеводы до тех пор, пока не будут заняты два участка, связывающие ионы металла (Ca2+, Mn2+) [31, 32]. Са2+ образует координационные связи с карбонильным кислородом остатков Asn, боковые цепи связаны водородными связями с углеводным лигандом. Таким образом, “координационное поле” Ca2+ фиксирует боковые цепи для оптимального взаимодействия с углеводом. Катионы также стабилизируют сайты лектина, фиксируя положения структурных элементов второй оболочки, т.е. тех элементов, которые взаимодействуют с другими группами белков. Mn2+ не координирует остатки, которые непосредственно взаимодействуют с белком, а фиксирует положение Ca2+. Считается, что для образования углевод-связывающего участка необходимо конформационное изменение белка, которое происходит только в процессе его связывания с ионами металлов [31, 32]. Экспериментальное подтверждение этой гипотезы было получено путем анализа ИК-спектров поглощения ConA с различными маннозными лигандами (α‑манноза, галактоманнан) [34]. ConA специфически связывает остатки α-D-маннозила и α-D-глюкозила в концевом положении разветвленных структур из β-гликанов, например, манноглюкан или глюкоманнан. ConA имеет четыре сайта связывания, соответствующие четырем идентичным субъединицам.
Liener et al. [27] изучали влияние структурной организации лиганда на стабильность комплексов и определяли сродство моно- и олигосахаридов к ConA. В табл. 2 приведены значения констант диссоциации (Kd) комплексов углеводных лигандов № 34–56 с ConA, которые рассчитывали относительно MeMan как эталона. Выявлено, что дисахариды (например, мальтоза и изомальтоза) связываются немного лучше, чем манноза. Метильные производные углеводов зачастую эффективнее. Улучшение или ухудшение связывания зависит от пространственной ориентации гидроксильной группы (α или β), различие может достигать 1–2 порядков. ConA более предпочтительно связывается с α-D-маннопиранозидами, чем с соответствующими β-аномерами [27]. Однако наблюдается обратная закономерность в случае фруктозы. Наиболее специфичный лиганд из моносахаридов, представленных в монографии Liener et al. [21], – метил-α-маннопиранозид, который более чем в 7 раз эффективнее связывается с ConA, чем манноза. Это подтверждается результатами, рассматриваемыми в обзорной статье Titov et al. [35], по определению эффективности связывания с ConA свободных аномеров и гликокластеров – конъюгатов с циклодекстрином на их основе. При использовании метода ELLA (анализ лектина, основанный на конкурентном связывании лигандов с лектином, меченным ферментом) показано, что конъюгаты β-циклодекстрина и маннозных остатков без спейсера не ингибировали связывание лектина с маннаном (из Saccharomyces cerevisiae), не конкурировали за сайты связывания с ConA, т.к. их сродство было значительно меньше, чем у маннана. С другой стороны, конъюгаты со спейсером (2-меркаптоацетамид, тиомочевина или этан-1,2-дитиол), наличие которого необходимо для преодоления стерических затруднений, показали прочное связывание, оказались в 16–17 раз эффективнее метил-α-D-маннопиранозида при связывании с ConA. Показано, что каждый остаток маннозы в конъюгате со спейсером в ~2.4 раза активнее одновалентного метил-маннозида. Главную роль в увеличении силы связывания играют пространственная организация маннозных лигандов и их структура. Перспективный способ улучшения эффективности связывания – использование спейсера оптимальной длины за счет баланса плотности маннозных лигандов и отсутствия стерических затруднений.
Таким образом, ConA – доступный и релевантный модельный объект для исследования взаимодействий маннозных рецепторов АМ с различными лигандами, поскольку выступает доступным природным соединением и позволяет определять параметры связывания без проведения сложных экспериментов с самими МР in vitro и ex vivo.
Для исследований взаимодействия лиганд–рецептор важно применять современные методы анализа, которые охарактеризованы в следующем разделе. Стоит отметить, что с развитием современных технологий появилась возможность получать достоверные данные о межмолекулярных взаимодействиях, непосредственно определяющих механизм связывания, структуре лигандов и белков, экспрессии рецепторов на поверхности АМ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ СВЯЗЫВАНИЯ УГЛЕВОДНЫХ ЛИГАНДОВ С МАННОЗНЫМИ РЕЦЕПТОРАМИ И МОДЕЛЬНЫМИ ЛЕКТИНАМИ
Для анализа свойств синтезированных носителей с функцией адресного нацеливания на маннозные рецепторы макрофагов необходимы быстрые и хорошо воспроизводимые методы определения параметров связывания лигандов с рецепторами. Далее рассмотрены различные методы анализа данных взаимодействий и их сравнительные характеристики.
ИК-Фурье-спектроскопия в режиме нарушенного полного внутреннего отражения (FTIR-ATR)
ИК-спектроскопия – перспективный метод исследования взаимодействий белок–лиганд, который позволяет определять особенности структуры, активных центров и пространственной ориентации молекул, фиксировать конформационные изменения белков, измерять Kd комплексов с лигандами [34]. Преимущества ИК-Фурье-спектроскопии в режиме нарушенного полного внутреннего отражения (НПВО или FTIR-ATR): высокая чувствительность, использование небольших количеств анализируемого вещества. Метод не требует оптической прозрачности образца, поэтому возможно регистрировать спектр белка в суспензии, агрегированном состоянии, в составе фрагментов мембран.
Особое распространение данный метод получил при анализе вторичной структуры белка. В ИК-спектре белка (рис. 5) особое значение имеют полосы Амид I (вклад валентных колебаний связи C=O составляет 80%, связи C–N ~15%) и Амид II (основной вклад деформационных колебаний связей N–H ~80% и минорный вклад валентных колебаний связи C–N ~15%), соответствующие колебаниям пептидной связи [31]. Область спектра Амид I (1600–1700 см–1) представляет для этой цели наибольший интерес, т.к. именно она наиболее чувствительна к изменениям во вторичной структуре белка.
Рис. 5.
ИК-спектр ConA и его изменения при связывании с маннозой в различных соотношениях. Число после М показывает соотношение концентраций Мan и ConA (М : мМ) [34].
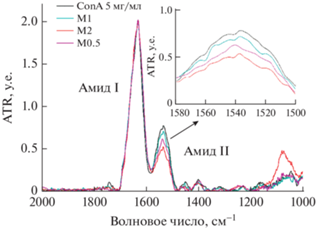
В исследованиях Naismith et al. [36] и Gerlits et al. [37] с помощью РСА и нейтронной кристаллографии были установлены изменения, которые происходят во вторичной структуре лектина при связывании с маннозными лигандами (подробнее – в подразделе “Рентгеноструктурный анализ”). Рассмотрим, как эти конформационные изменения отражаются на ИК-спектре лектина (рис. 5). Образование водородных связей при формировании вторичной структуры белка приводит к изменению энергии колебаний пептидных связей. Полосы, отвечающие валентным колебаниям N–H и C=O, смещаются в низкочастотную область спектра (область более низких энергий), поскольку наличие водородной связи облегчает смещение атома азота амидной группы и атома кислорода карбонильной группы в направлении акцептора или донора протона соответственно, что вызывает изменения в состоянии α-спиралей. Область поглощения Амид II смещается в высокочастотную область, т.к. водородная связь препятствует деформации связи N–H. Кроме того, наблюдается снижение интенсивности полосы Амид II за счет формирования водородных связей и ван-дер-ваальсовых взаимодействий. Как следствие, происходит экранирование участков пептидных цепей в сайте связывания, взаимодействия лиганд–белок, опосредованные водой, а также повышение стабильности комплекса по сравнению с рецептором. Заметно резкое увеличение интенсивности поглощения в области, близкой к Амиду III, что в основном представляет собой результат синфазной комбинации изгибания в плоскости связи N–H и деформационного колебания растяжения связи C–N, т.к. эти связи крайне чувствительны к вторичной структуре. Это позволяет сделать вывод об изменении микроокружения пептидной цепи, β-листов, что подтверждаются результатами РСА [36, 37].
В работе Sukumaran [38] проанализирована вторичная структура ConA с помощью ИК-спектроскопии. Среди основных аналитически значимых пиков использовали характеристические полосы белковых структур Амид I и Амид II. На основе спектров определена вторичная структура ConA: лектин содержит 42% β-листов и 4% α‑спиралей. Различия в составе вторичной структуры между рентгеновскими данными и данными FTIR малы и обусловлены физико-химическим состоянием образцов белка (кристаллическое состояние по сравнению с раствором, температура, рН). Поэтому данный метод перспективен при определении структуры биополимеров и комплексов лектин–лиганд. С помощью ИК-спектроскопии можно показать, что при взаимодействии белок–лиганд важную роль играют катионы Ca2+ и Mn2+, что было упомянуто выше. Так, Le-Deygen et al. [34] обнаружили, что комплексообразование с маннозосодержащими лигандами приводит к единообразным изменениям в спектре изучаемого белка (рис. 5) – уменьшению интенсивности в нормализованных по Амиду I спектрах полосы поглощения Амид II. На основе полученных результатов авторы сделали вывод, что при определенной концентрации Ca2+ и Mn2+ достигается такая конформация ConA, при которой связывание с маннозосодержащим лигандом будет наиболее эффективным.
Кроме выявления изменений во вторичной структуре белка, метод ИК-спектроскопии позволяет количественно определять сродство различных углеводов к лектинам. Так, с применением данного метода Le-Deygen et al. [34] выявили наиболее специфичные лиганды к МР альвеолярных макрофагов (связывание с АМ моделировали с помощью маннозоспецифичного лектина ConA). Для этой цели проводили анализ конформационных изменений ConA и определяли константы связывания маннозосодержащих носителей лекарств с лектином на основе ИК-спектров ConA и его комплексов с лигандами. Среди лигандов к лектину исследовали Man (маннозу), ChitMan5 или 90 (хитозан, модифицированный маннозой, 5 или 90 кДа) и GalMan (галактоманнан) (табл. 2 – лиганды № 1–4). Линеаризация изотерм сорбции комплексов ConA с маннозосодержащими лигандами позволила рассчитать значение Kd данных комплексов.
Природный лиганд для ConA – разветвленный триманнозид (маннозная тройка), для которого значение Kd комплекса составляет 0.26 × 10–5 М. Из анализируемых в работе Le-Deygen et al. [27] веществ наиболее прочный комплекс с ConA образует хитозан (90 кДа), модифицированный маннозой со степенью маннозилирования 20% (ChitMan90). Длинноцепочечный (90 кДа) хитозан в 3.5 и 22 раза эффективнее связывается с лектином по сравнению с ChitMan5 и маннозой соответственно за счет многоточечных взаимодействий с несколькими субъединицами в молекуле ConA, а короткоцепочечный хитозан (5 кДа) таким свойством не обладает, хотя для него также характерно многовалентное взаимодействие с рецептором. По данным анализа кристаллической структуры (PDB: 5CNA), среднее расстояние между сайтами связывания углеводов в ConA составляет 68 Å. Расстояние между концевыми остатками короткоцепочечного хитозана (5 кДа) не превышает по оценкам 10–15 Å, в то время как для длинноцепочечного полимера оно составляет 170–185 Å. Следовательно, длинноцепочечные полимеры, в отличие от короткоцепочечных, способны “обволакивать” белок и связываться сразу с двумя-тремя сайтами, за счет чего резко увеличивается эффективность распознавания лиганда лектином.
Галактоманнан не показывает высокого сродства к ConA, связывается слабее, чем манноза. Маннозные остатки в галактоманнане в основном находятся в главной цепи (что снижает их доступность), а содержание концевых Man-остатков мало, поэтому связывание галактоманнана с ConA низкоэффективно. Галактозные остатки неспецифичны к рецептору; сродство галактозы в 25–30 раз меньше, чем у маннозы [27]. В ChitMan, который показывает высокоэффективносе связывание с ConA, маннозные остатки находятся по бокам от основной цепи и способны участвовать во взаимодействии с лектином.
Таким образом, на основе результатов, полученных методом ИК-спектроскопии, выявлены детали механизма лектин-лигандного взаимодействия, а также определены наиболее специфичные лиганды к МР.
Флуоресцентная спектроскопия
Флуоресцентная спектроскопия – один из наиболее распространенных методов для изучения физико-химических свойств биологических систем и, в частности, структуры белков [39–45]. Этот метод позволяет выявлять изменения в микроокружении собственных флуорофоров белка или введенной флуоресцентной метки. Собственная флуоресценция большинства белков обусловлена, в первую очередь, остатками Trp. Для селективного возбуждения остатков Trp используется диапазон длин волн 295–300 нм, при этих длинах волн поглощение Tyr и Phe минимально. Флуоресцентные свойства Trp крайне чувствительны к изменению его микроокружения и, главным образом, полярности. В соответствии с этим комплексообразование с низкомолекулярными лигандами и макромолекулами, денатурация, агрегация и другие процессы существенным образом влияют на спектры флуоресценции белков. Помимо сдвига максимума флуоресценции, в результате агрегации белков или при связывании с лигандами может наблюдаться тушение флуоресценции [39–45].
Рассмотрим применение метода флуоресцентной спектроскопии для определения эффективности связывания лигандов с рецепторами. Landshcoot et al. [44] изучали взаимосвязь тушения флуоресценции при связывании лигандов с ConA. MeUmb-гликозиды – перспективные лиганды для равновесных и кинетических исследований углевод-белковых взаимодействий. Их высокий коэффициент поглощения и высокая интенсивность флуоресценции (максимальное излучение при 373 нм) позволяют проводить очень чувствительное детектирование. При связывании с белком эти лиганды демонстрируют выраженные различия спектров поглощения (в диапазоне 300–350 нм), а также изменения свойств флуоресценции лиганда: во многих случаях наблюдается выраженное тушение флуоресценции. Важно, что изменения ярко выражены и специфически зависят от структуры углеводов. Например, наблюдается значительное тушение флуоресценции 4-метилумбеллиферил-α-D-маннопиранозида (MeUmb-Man) при связывании с ConA. В табл. 2 представлены Kd комплексов, определенные на основе изменения интенсивности флуоресценции [44]. Наибольшая специфичность связывания с ConA среди лигандов № 5–10 характерна для триманнозида (triMan). Однако среди представленных метилированных производных умбеллиферона наиболее аффинен MeUmb-diMan. Вероятно, в этом случае играет роль пространственный фактор: три маннозных остатка связываются эффективно, но дополнительный остаток умбеллиферона создает стерические затруднения, поэтому сродство понижается.
В более позднем исследовании Landshcoot et al. [45] определяли Kd MeMan, диманнозида (diMan) и триманнозида с ConA в интервале температур 285–313 К методом замещающего титрования с использованием MeUmb-Man в качестве углевод-специфичного и флуоресцентного индикатора. При 298.3 К значения Kd (табл. 2) постепенно снижаются от MeMan, diMan к triMan. Данные константы, рассчитанные двумя методами (изменение флуоресценции и замещающее титрование), различаются в пределах погрешности, что позволяет говорить о точности подхода на основе флуоресцентной спектроскопии. Также можно сделать вывод о том, что наиболее эффективный лиганд для ConA – маннотриоза и ее производные: наблюдается отличие в сродстве к рецептору на 1–2 порядка по сравнению с другими лигандами. Кроме того, маннотриоза не сильно усложняет систему доставки лекарства, в отличие от сложных олигомерных лигандов.
Анизотропия (поляризация) флуоресценции
Анизотропии флуоресценции – точный метод изучения взаимодействий белков с углеводными лигандами. Суть метода состоит в том, что при возбуждении флуоресцирующего образца поляризованным светом его испускание тоже поляризовано. Флуоресцентная анизотропия – характеристика степени поляризации образца, выражается как разница параллельной и перпендикулярной составляющих флуоресценции в пересчете на общую интенсивность флуоресценции (1) или через интенсивности флуоресценции при различных положениях поляризатора с учетом G-фактора (2):
(1)
$r = {\text{ }}{{({{I}_{\parallel }}--{{I}_{ \bot }})} \mathord{\left/ {\vphantom {{({{I}_{\parallel }}--{{I}_{ \bot }})} {({{I}_{\parallel }} + {\text{ }}2{{I}_{ \bot }})}}} \right. \kern-0em} {({{I}_{\parallel }} + {\text{ }}2{{I}_{ \bot }})}};$(2)
$\begin{gathered} \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,r = {\text{ }}{{({{I}_{{{\text{VV}}}}}--G{{I}_{{{\text{VH}}}}})} \mathord{\left/ {\vphantom {{({{I}_{{{\text{VV}}}}}--G{{I}_{{{\text{VH}}}}})} {({{I}_{{{\text{VV}}}}} + {\text{ }}2G{{I}_{{{\text{VH}}}}})}}} \right. \kern-0em} {({{I}_{{{\text{VV}}}}} + {\text{ }}2G{{I}_{{{\text{VH}}}}})}},{\text{ }} \hfill \\ {\text{где}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,G = {{{{I}_{{{\text{HV}}}}}} \mathord{\left/ {\vphantom {{{{I}_{{{\text{HV}}}}}} {{{I}_{{{\text{HH}}}}}}}} \right. \kern-0em} {{{I}_{{{\text{HH}}}}}}}. \hfill \\ \end{gathered} $Существует несколько причин деполяризации (уменьшения анизотропии), среди которых основная причина – вращательная диффузия флуорофоров. Величину флуоресцентной анизотропии определяет скорость вращательной диффузии флуорофора во время жизни его возбужденного состояния, что, в свою очередь, определяется вязкостью, температурой раствора и объемом вращающегося фрагмента макромолекулы.
Любые внешние условия, влияющие на размер, форму и гибкость молекулы флуорофора (рН, температура, вязкость, денатурация под действием различных агентов и др.), могут оказывать влияние на деполяризацию флуоресценции. По этой причине метод поляризации флуоресценции часто применяется в биохимических исследованиях. Измерение анизотропии флуоресценции используется для количественной оценки реакций ассоциации белков с лигандами [39], для изучения комплексообразования с макромолекулами: связывание белков с липидными мембранами; антигена с антителом, ассоциации белков и др. [39–43]. При комплексообразовании существенно меняется размер, пространственная структура, подвижность сегментов макромолекулы, что приводит к изменению наблюдаемой анизотропии.
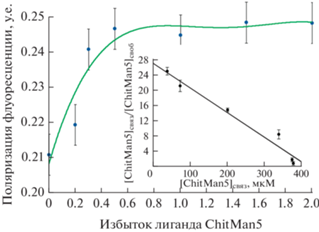
Метод поляризации флуоресценции был применен для определения параметров связывания ChitMan5 с ConA (рис. 6) [34]. К раствору ConA, ковалентно связанного с флуоресцентной меткой FITC, добавляли определенные избытки лиганда ChitMan5 и определяли значение поляризации флуоресценции. Из соответствующей изотермы адсорбции рассчитывали значение Kd = 5.5 × 10–5 М, что согласуется с данными, полученными другими методами.
Рис. 6.
Зависимость поляризации флуоресценции FITC-меченного ConA (0.25 мг/мл) от количества добавленного лиганда ChitMan5 (концентрация ConA – 0.25 мг/мл). На вставке показана линеаризация изотермы сорбции в координатах Скэтчарда [34].
Применение метода поляризации флуоресценции позволило Yuasa et al. [46] выявить зависимость сродства лигандов к лектину от их длины цепи. Определены Kd комплексов олигоманнопептидов (содержащих 1–6 остатков β-аминопропионовой кислоты и один триманнозид на одну молекулу пептида) с ConA. При увеличении длины пептидной цепи эффективность связывания увеличивалась: при n = 1 значение Kd комплекса составило 31 × 10–6 М, при n = 3 достигнут минимум 9 × 10–6 М, т.е. образуется наиболее прочный комплекс. При дальнейшем увеличении длины пептидной молекулы наблюдается обратный эффект – снижение устойчивости комплекса за счет стерического фактора (12 × 10–6 М при n = 6). Кроме того, стоит отметить повышенную устойчивость (на порядок) этих комплексов по сравнению с MeMan (табл. 2). Как и в случае хитозан-маннозы (ChitMan90), это обусловлено многоточечными взаимодействиями с рецептором. Поэтому носители, обладающие таким свойством, перспективны в специфичном нацеливании на АМ.
Калориметрия изотермического титрования
Калориметрия изотермического титрования (КИТ) – метод, используемый для определения термодинамических параметров взаимодействий в растворе. Он чаще всего применяется для изучения связывания малых молекул (например, лигандов или лекарственных соединений) с более крупными макромолекулами (белками, ДНК). Во время эксперимента лиганд порционно добавляется в ячейку образца, вызывая либо поглощение, либо выделение тепла. Проводят измерения энергии, необходимой для поддержания равных температур образца и эталонной ячейки. По полученным данным рассчитывают изменение энтальпии и энергии Гиббса, вычисляют Kd.
Mandal et al. [47] исследовали взаимодействие ConA с различными маннозосодержащими лигандами методом КИТ. Наибольший интерес представляет зависимость сродства лиганда к лектину в зависимости от его строения (функциональные группы или изомерия). В табл. 2 приведены значения Kd для комплексов ConA с лигандами № 11–31. На основании рассчитанных энергий взаимодействий лиганд–рецептор можно выявить следующие закономерности.
1) В ряду маннобиоз (1,6- 1,3- и 1,2-) связь остатков маннозы через атомы кислорода у С1 и С2 эффективнее, чем у С1 и С3, С1 и С6. В первом случае (1,2-) достигается эффект вилки или антенны, когда в связывании участвуют два конца лиганда, возникает связывание большим количеством атомов, оптимальная конфигурация, поэтому сродство гораздо выше. В случае 1,3- и 1,6-маннобиоз маннозные остатки удалены друг от друга, эффективного взаимодействия не происходит. 1,2-Изомер связывается в 3 раза эффективнее.
2) В ряду диманнозидов, т.е. метилированных маннобиоз, прослеживается аналогичная тенденция. Однако присутствие метильной группы (в положении α-1) увеличивает эффективность в связывании 1,2-изомера по сравнению с 1,6-изомером в 17 раз за счет образования дополнительных водородных связей и отсутствия стерических затруднений.
3) В ряду триманнозидов и маннотриоз существенных различий в сродстве нет, т.к. лиганд содержит три маннозных остатка, эффективно связывающихся в 1,6-, 1,3- и 1,2-изомерах. Дальнейшее добавление маннозных остатков может не приводить к улучшению связывания, т.к. возникают стерические затруднения. Однако добавление N-ацетилглюкозаминовых концевых остатков к 3,6-ди-O-(маннопиранозил)-α-маннопиранозе повышает эффективность в 4.2 раза. Лиганд № 27 (табл. 2) оказался самым специфичным к ConA среди представленных лигандов.
4) Прослеживается тенденция к увеличению сродства к ConA при переходе от моно- к ди- и триманнозидам за счет увеличения количества атомов, образующих связи, без возникновения пространственных затруднений.
5) В ряду гликопептидов наличие симметричных (одинаковых) концов лиганда в виде би- или триантенн повышает эффективность связывания: Kd у Man9 отличается от Man7 и Man8 в 3.6 раза. Различные несимметричные группировки, как правило, снижают силу взаимодействия с рецептором за счет уменьшения числа водородных связей из-за возникающих стерических затруднений.
6) Метилирование OH-групп у С6-атомов углеводов сильно увеличивает сродство к лектину, эффективность в случае маннозы возрастает в 2.9 раза, диманнозы – в 3.4 раза, триманнозы – в 1.5 раза.
7) Итак, использование триантенного лиганда, симметричных N-ацетилглюкозаминовых концов позволило на несколько порядков улучшить специфичность взаимодействия лиганда с рецептором. Так, Kd комплексов с ConA составила 122 мкМ для MeMan и 0.71 для 3,6-ди-O-(β(1,2)-GlcNAc-маннопиранозил)-α-маннопиранозы (№ 15 и 27 в табл. 2 соответственно), эффективность связывания возросла в 172 раза, т.е. на 2 порядка.
Идею созданию мультивалентного лиганда использовали Dam et al. [48]. Синтезированы три- и тетравалентные производные триманнозида (№ 32 и 33 в табл. 2). Данные соединения образуют очень прочные комплексы с ConA (Kd порядка 10–7–10–8 М).
Из анализа экспериментальных данных, приведенных в табл. 2, следует, что сродство лигандов к рецептору возрастает с увеличением содержания доступных остатков Man. Триманнозиды гораздо лучше распознаются ConA, чем моно- и дисахариды. Кроме того, дополнительное улучшение эффективности связывания достигается за счет введения концевых ацетилглюкозаминовых остатков (GlcNAc).
Описанные выше тенденции объясняются различиями в процессах N-гликозилирования, строении клеточных стенок бактерий и эукариот (олигосахаридных антигенов и экспонированных углеводных остатков). МР макрофагов и ДК предназначены для распознавания прокариотических организмов или грибов, тем самым, МР опосредуют уничтожение патогенов и поддерживают врожденный и приобретенный иммунитет. Рецептор CD206 связывает “открытые” остатки D-маннозы, N-ацетилглюкозамина и фукозы на гликанах поверхности патогенных микроорганизмов, например, микобактерий, клеточная стенка которых состоит из перекрестно связанных пептидогликанов (муреина), липоарабиноманнана, слоя сложных полисахаридов (арабиногалактанов), поверхностных миколовых кислот, а также слоя внешних гликолипидов, обусловливающего высокую устойчивость бактерий. Отметим, что у клеток дрожжей, растений и насекомых также имеется большое количество доступных Man-остатков в составе липид-связанных олигосахаридов, у растений они лишь частично “закрыты” фукозой и галактозой. Однако у животных (кроме млекопитающих) появляется “защита” из галактозы и N-гликолилнейраминовой кислоты, а у млекопитающих – дополнительно из Neu5Ac [49].
Таким образом, для эффективного связывания с маннозными рецепторами наиболее перспективны мультивалентные олигосахариды из остатков Man и GlcNAc (например, № 25–33 в табл. 2). Выявленные закономерности позволяют синтезировать высокоспецифичный лиганд к ConA, а следовательно, и к МР для разработки оптимального носителя лекарств.
Лектиновая аффинная хроматография
Лектиновая хроматография – это форма аффинной хроматографии, в которой лектины используются для разделения углеводсодержащих компонентов в образце. В качестве неподвижной фазы выступает лектин, иммобилизованный на нерастворимой матрице (например, на основе агарозы). Разделение смеси (в подвижной фазе) происходит за счет селективного связывания углеводсодержащих лигандов [50, 51]. Распространенные носители, которые используются в лектиновой аффинной хроматографии, – это ConA-сефароза и иммобилизованный на сефарозе агглютинин зародышей пшеницы, который связывает N-ацетилглюкозамин. Наиболее распространенное применение – отделение гликопротеинов от негликозилированных белков [52, 53]. Биоспецифичность определяется конформационным соответствием лигандов и участков связывания рецептора [54].
С применением данного метода Le-Deygen et al. [34] исследовали устойчивость комплекса ConA–ChitMan5 с использованием носителя ConA-сефарозы. На колонку с ConA-сефарозой наносили ChitMan5, после чего проводили градиентное элюирование маннозой (0.1–1.0 мМ). Установлено, что большая часть комплекса разрушается при 7.5-кратном избытке маннозы, а значит, Kd комплекса ConA с ChitMan5 в ~7.5 раз ниже, чем комплекса с маннозой. Это согласуется с рассчитанными значениями Kd комплексов – отличие в ~7 раз (табл. 2). Таким образом, с помощью аффинной хроматографии можно определять параметры связывания лигандов с белком относительно некоторого эталона, а также доказать, что лиганд специфически взаимодействует с ConA именно в центре связывания маннозы.
Метод лектиновой хроматографии используется для препаративного выделения лектинов из клеток. В работе Argayosa et al. [55] сообщается о выделении маннозосвязывающего лектина (MBL) из сыворотки африканского сома. Для очистки белка использовали аффинную колонку маннан-агарозы. Выделение этого лектина позволило изучить взаимодействия с патогенами, экспрессирующими маннозные лиганды. Компоненты клеточной стенки патогенных дрожжей C. albicans, содержащие β-1,2-связанные олигоманнозиды и фосфоманнан клеточной стенки S. cerevisiae, – потенциальные целевые лиганды маннозосвязывающего лектина. Также бактериальные клетки, содержащие липополисахариды, богатые концевыми остатками маннозы, ManNAcUA-GlcNAc и Glc-ManNAcUA-GlcNAc, эффективно распознавались MBL.
В работе Pawley [56] аффинная хроматография применена для выделения и идентификации белков из риса. Экстракты риса фракционировали методом колоночной аффинной хроматографии с использованием маннозы в качестве лиганда. Связанные фракции элюировали и подвергали электрофорезу и ВЭЖХ. Получено 136 различных маннозосвязывающих белков из риса. Сравнительный анализ демонстрирует очень небольшое перекрытие идентифицированных белков между соответствующими тканями. Почти 15% белков ранее не были известны, что указывает на потенциал этого хроматографического метода для выделения лектинов, в том числе маннозосвязывающих, и для изучения их свойств.
Конфокальная микроскопия
Конфокальная или лазерная сканирующая микроскопия (CLSM) широко используется для визуализации биологических объектов в субмикронной шкале, включая АМ, которые взаимодействуют с лекарственными молекулами в составе наночастиц [57, 58]. “Захват” двумерных изображений на разной глубине в образце позволяет реконструировать трехмерные структуры внутри объекта.
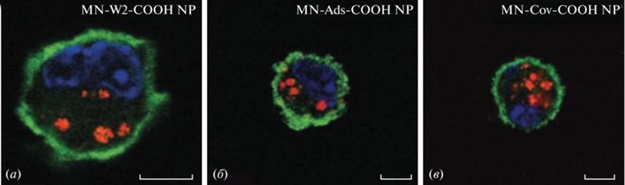
Ghotbi et al. [59] изучали связывание и эффективность поглощения маннан-декорированных наночастиц из лактид-гликолидного сополимера дендритными клетками (ДК). Суспензии ДК окрашивали FITC-меченым CD11c (интегрин, индуцирующий клеточную активацию и синтез активных форм кислорода для борьбы с патогенами). Ядра окрашивали диамидино-2-фенилиндолом. При помощи флуоресцентного окрашивания частей клеток показано, что дендритные клетки, как и макрофаги, экспрессируют маннозные рецепторы и CD11c. Кроме того, с помощью CLSM изучали взаимодействие маннан-декорированных наночастиц различных видов (рассматривались носители, содержащие адсорбированный или химически связанный маннан с дендритными клетками) (рис. 7). Единичные клеточные изображения фиксированных клеток подтвердили эффективное внутриклеточное поглощение модифицированных маннаном частиц, а не просто слабое связывание поверхностью дендритных клеток, как это наблюдалось в случае неманнозилированных наночастиц. Об этом свидетельствует наличие точечных красных пятен в цитоплазме. Все виды модифицированных частицы проникли в ДК, однако наиболее эффективным оказались частицы с ковалентно связанным маннаном (рис. 7в).
Рис. 7.
Визуализация поглощения частиц дендритными клетками с помощью конфокальной микроскопии: MN-W2-COOH NPs (а); MN-Ads-COOH NPs (б); MN-Cov-COOH NPs (в) (MN – маннан, W2 – эмульсификация, Ads – адсорбированные, Cov – химическое связывание, NP – наночастица). Красные точки внутри клеток показывают локализацию TMRD-нагруженных наночастиц в цитоплазме. Масштабный отрезок – 5 мкм [59].
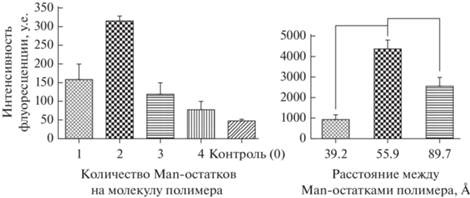
В исследовании Chen et al. [60] с помощью CLSM с применением флуоресцентных меток (FITC и 4',6-диамидино-2-фенилиндол) определяли поглощение различных видов наночастиц (варьировали длину спейсера, расстояния между маннозными остатками, молекулярную массу полимера) МР-экспрессирующими клетками макрофагов мыши J774E. На основе полученных данных определили оптимальные параметры носителя, при которых поглощение целевыми клетками наиболее эффективно. На рис. 8 показано влияние на клеточное поглощение модифицированных носителей в зависимости от количества маннозных остатков на одну нанокапсулу и расстояния между ними. Оптимальным вариантом оказались частицы, в которых два остатка маннозы находятся на расстоянии 56 Å, что близко к расстоянию между сайтами связывания в ConА.
Рис. 8.
Интенсивность флуоресценции (у.е.) как показатель клеточного поглощения носителей лекарств в зависимости от количества маннозных остатков на один полимер (а) и расстояния между ними (б) [60].
Таким образом, конфокальная микроскопия с использованием флуоресцентных меток позволяет проводить исследования по изучению взаимосвязи различных параметров носителя лекарства (размер, молекулярная масса, степень модификации, расстояние между маннозными остатками) на его поглощение целевыми клетками (МФ, ДК).
Проточная цитометрия
Проточная цитометрия (ПЦ) – высокоинформативный метод исследования клеток в дисперсных средах в режиме поштучного анализа элементов по сигналам светорассеяния и флуоресценции. Для точного измерения оптических свойств клетки равномерно пропускаются через центр сфокусированных лазерных лучей в проточном цитометре [61, 62]. Данные, генерируемые ПЦ, могут быть отображены в виде гистограммы, двумерных или трехмерных точечных диаграмм. Области на этих участках могут быть последовательно разделены на основе интенсивности флуоресценции, при этом выделяют несколько областей, характеризующих экспрессию определенных антигенов. Анализ диаграммы флуоресценции проводится следующим образом: по осям откладывается значение флуоресценции по двум флуорофорам соответственно, которое пропорционально количеству клеток с анализируемыми антигенами или поверхностными лигандами, на основе чего определяют экспрессию молекул на исследуемом образце [63].
В работе Ying et al. [64] методом ПЦ определяли поверхностную экспрессию антигенов и маннозных рецепторов (CD11b, F4/80, CD11c, CD206, CD69, CD80 и CD86), ответственных за распознавание маннозных лигандов, на МФ, а также изучали изменения фенотипа макрофагов при их активации. Рассматривали два варианта активации МФ: классический (М1 – иммуноактивирующий) и альтернативный (М2 – обратный эффект). Как обсуждалось выше, активация МФ происходит под действием сигнальных веществ, вырабатывающихся под воздействием негативных факторов, например, вирусов или бактерий. М1 зависит от Toll-подобных рецепторов (TLR) и активации ядерного фактора, приводящего к продукции цитокинов TNF-α и IL-1β, что обусловливает повышенную выработку активных форм кислорода, таких как NO [65, 66]. Таким образом, МФ M1 – иммуноактивирующие клетки, уничтожают вирусы и бактерии. Напротив, активация макрофагов М2 (под воздействием цитокинов IL-4, IL-10 или IL-13) приводит к повышению экспрессии МР CD206 и аргиназы. МФ M2 производят полиамины (чтобы вызвать пролиферацию), либо пролин для выработки коллагена. Эти МФ связаны с заживлением ран и восстановлением тканей. Противовоспалительные МФ активируются в направлении М1 во время ранней фазы заражения Mycobacterium tuberculosis. Затем МФ преимущественно активируются в фенотип M2, чтобы сохранить тканевый гомеостаз легких и избежать цитокинового шторма.
Адресное нацеливание на АМ можно использовать в нескольких случаях. Во-первых, при тяжелом протекании болезни микобактерии, попадая внутрь МФ, оказываются защищенными и блокируют иммуноактивирующую функцию АМ. В таком случае необходима доставка антибактериальных агентов (например, рифампицина) для уничтожения патогенов, т.к. иммунная система не справляется. Во-вторых, существуют определенные границы нормального количества МФ, активированных по пути 1 или 2. Как избыток, так и недостаток АМ определенного фенотипа приводит к нарушению функционирования иммунной системы. С помощью лекарственных препаратов возможно стабилизировать уровень активации M1 и M2 (например, введением γ-интерферонов, интерлейкинов, метилурацила, липополисахаридов, имитирующих антигены бактерий; или наоборот, использованием ингибиторов функций T-лимфоцитов, блокаторов рецепторов IL-33, нейтрализацией интерферонов).
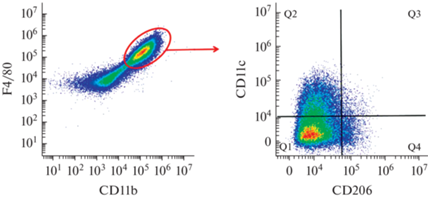
Ying et al. [64] исследовали активацию МФ по механизмам М1 и М2. Макрофаги L-929 получали из костного мозга мышей, которые широко используются как модель in vitro. М1 стимулировали липополисахаридами, М2 индуцировали IL-4 и IL-13. С применением метода ПЦ показано, что активация макрофагов по обоим путям приводит к увеличению их размеров, а также к повышению уровня экспрессии антигенов и белков на поверхности клеток (CD206, CD69, CD80 и CD86) (рис. 9). В случае М2 уровень экспрессии CD206 и вышеуказанных антигенов увеличивается в 3–5 раз, а М1 – еще более эффективно, в 10–50 раз. Это подтверждает иммуноактивирующую функцию МФ M1. Таким образом, с помощью ПЦ были установлены изменения, происходящие с МФ при их активации, определены биомаркеры каждого фенотипа макрофагов.
Рис. 9.
Анализ макрофагов методом проточной цитометрии. По осям – количество флуоресцирующих клеток. Все исследуемые МФ экспрессируют интегрин CD11b и антиген F4/80. МФ M1 обнаруживаются по фенотипу CD11b+F4/80+CD11c+CD206– (что соответствует области Q2), тогда как МФ М2 – это клетки CD11b+F4/80+CD11c–CD206+ (область Q4) [64].
Кроме того, метод ПЦ позволяет определять фенотип МФ и ДК [67]. Рецепторы МФ исследовали с помощью неогликоконъюгатов, у которых углевод связан с полиакриламидом, меченным флуоресцеином. Синтезированные лиганды связываются с МФ, выделенными из крови здоровых доноров. По изменению интенсивности флуоресценции с помощью ПЦ определяли экспрессию антигенов CD11c, CD14, CD36 и CD40 на МФ. При этом характерные для дендритных клеток антигены CD83, CD86 и CD15 на поверхности макрофагов не были обнаружены. Эти данные позволяют точно определять МФ и статус их активации in vivo (поскольку предполагается существование других путей активации МФ, что может быть обнаружено по их фенотипу), кроме того, открываются возможности по нацеливанию на эти антигены МФ для регулирования их активации.
Другой пример применения ПЦ для исследования фагоцитоза – изучение роли макрофагальных лектинов (в частности, сиалозид-связывающих лектинов – сиглеков) в элиминации апоптотических тел как одной из важных функций макрофагов [67]. Изучение механизма фагоцитоза, в частности рецепторов, ответственных за первичное распознавание, позволяет целенаправленно стимулировать фагоцитоз на ранних стадиях онкогенеза. Лектины участвуют в фагоцитозе через связывание с комплементарными углеводами клеток-мишеней. Нейтрофилы – первые клетки, проникающие в опухоль и впоследствии привлекающие туда вторичные эффекторные клетки (макрофаги, цитотоксические Т-лимфоциты), продукты секреции которых могут активировать нейтрофилы и их противоопухолевую активность. МФ и незрелые ДК также могут поглощать опухолевые клетки. Таким образом, стимуляция проникновения нейтрофилов в опухолевые ткани может быть перспективным способом лечения онкологических заболеваний.
Сиалозид-связывающие лектины (сиглеки), такие как siglec1, 5, 10, 11, 15, экспрессируются на МФ, поэтому могут использоваться как мишень при иммунотерапии [68–70]. Сиглеки экспонируются на иммунных клетках и клетках крови, они распознают цепи гликопротеинов и гликолипидов клеточной мембраны, участвуют в распознавании патогенов. Rapoport et al. [67] на основе ПЦ анализа взаимодействия макрофагов из крови здорового донора и пациентки с раком молочной железы выяснили, что клетки содержат siglec, экспрессия которого увеличивается при болезни и который взаимодействует с Neu5Ас-α(2–3)Gal- и Neu5Ac-α(2–6)Gal-содержащими гликанами. Однако siglec1 и siglec5 демонстрируют самое высокое сродство к Neu5Ac-αOBn. По изменению экспрессии лектинов сделан вывод об их ключевой роли в распознавании МФ и ДК и последующей элиминации апоптотических тел.
Рентгеноструктурный анализ (РСА) комплексов лектинов с маннозными лигандами. Нейтронная кристаллография
Кристаллографические методы – эффективные методы исследования структур комплексов белок–лиганд. Naismith et al. [36] изучали взаимодействие ConA с 3,6-ди-O-(маннопиранозил)-α-маннопиранозой (далее триманнозид) с помощью РСА монокристалла комплекса лектина с лигандом с разрешением 2.3 Å. Это позволило выявить участки, ответственные за связывание: 1,6-концевая манноза (O3, 4, 5 и O6 – наиболее задействован) связывается с Tyr12, Asn14, Gly98, Leu99, Tyr100, Ala207, Asp208, Gly227 и Arg228; редуцирующий углевод (O2, 4) связывается с Tyr12, Asp16, Leu99 и Arg228; 1,3-концевая манноза (O3, 4) взаимодействует с Tyr12, Pro12, Asn14, Thr15 и Asp16 (рис. 10а). Кроме того, установлены расстояния между взаимодействующими атомами – 2.5–3.5 Å (в среднем 3 Å). Оказалось, что в лигандах, состоящих из нескольких маннозных остатков, при связывании с лектином эффективно задействованы атомы O6. Значит, сродство диманнозида со связью 1,6 понижается, т.к. O6 не может взаимодействовать с ConA, что подтверждается значениями констант (табл. 2).
Рис. 10.
(а) – Взаимодействие ConA и 3,6-ди-O-(маннопиранозил)-α-маннопиранозы (триманнозид). Зеленый цвет – рецептор, желтый – лиганд. Зеленый шар – Ca2+, фиолетовый – Mn2+. Приведены однобуквенные наименования остатков, расстояния указаны в Å. PDB: 1ONA; (б) – взаимодействие ConA с диманнозой (по данным рентгеноструктурного анализа). Желтый цвет – рецептор, голубой – лиганд. Расстояния указаны в Å [37].
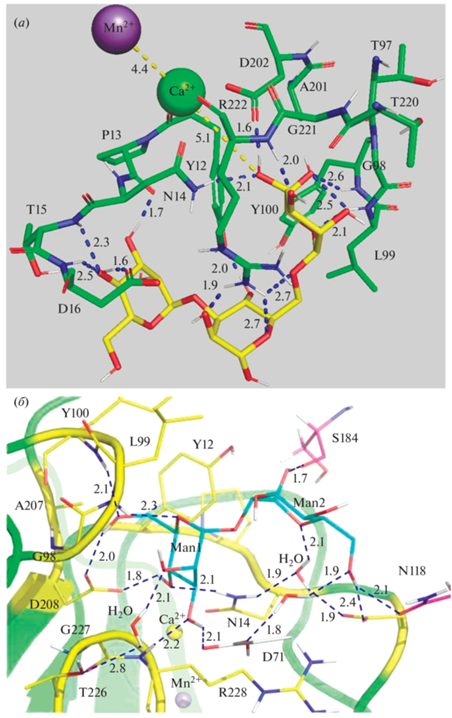
С помощью нейтронной кристаллографии Gerlits [37] более детально определен механизм взаимодействия ConA с маннобиозой (рис. 10б). Тетрамерный лектин связывает маннобиозу на участке поверхности белка (12–16, 98–100, 207, 208 и 226–228 а.о.), что хорошо согласуется с данными рассмотренной выше статьи Naismith et al. [36]. Нередуцирующий (концевой) остаток маннозы (Man1) образует шесть прямых водородных связей и одно опосредованное водой взаимодействие с ConA, тогда как восстанавливающий остаток маннозы (Man2) образует одну прямую водородную связь и один опосредованный водой контакт. Дисахарид обладает преимуществом по сравнению с моносахаридами за счет дополнительных взаимодействий: Man1 O3 образует водородную связь с карбоксильной группой Asp71, а Man2 O1 – прочную водородную связь с основной цепью карбонила Ser184. Связывание маннобиозы существенно не изменяет углевод-связывающий сайт ConA, однако значительный эффект наблюдается для атомов основной цепи Asp16 и Leu99, каждый из которых смещается на ~1 Å в сторону дисахарида с образованием водородных связей и гидрофобных взаимодействий с лигандом. Для других остатков изменяются только положения боковых цепей. Например, в комплексе ConA–маннобиоза Tyr100 и Arg228 смещаются со своих соответствующих позиций в структуре ConA, чтобы предотвратить стерические затруднения. Таким образом, сайт связывания в ConA уже предварительно сформирован до того, как дисахарид связывается, связывание лиганда индуцирует небольшие изменения в положениях боковых цепей проксимальных аминокислотных остатков.
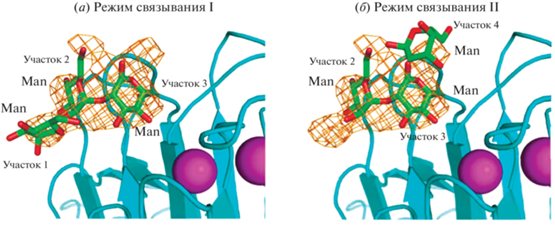
В ряде случаев существуют два варианта связывания лигандов в лектинах, что было показано на основе данных РСА [71], с помощью которого изучали структуры маннозоспецифичных лектинов ERGIC-53 и VIP36 – лектинов типа L, содержащих домены распознавания углеводов (CRD), сходные с ConA. Углевод-связывающий сайт ERGIC-53 также требует присутствия Ca2+. Лиганды (Man-α(1,2)-Man) идентифицировали по изменению электронной плотности в четырех участках CRD. Участок 3 взаимодействует с Asp121 (O1 и O2), Asn156 (N2), Gly251 (N), Gly252 (N) и Leu253 (N) за счет водородных связей в комплексе. Phe154 проявлял гидрофобное взаимодействие с атомами С4, С5 и С6 этого остатка маннозы. В участке 2 остаток маннозы образует водородную связь между группой 4-OH и Ser88. Обнаружены два альтернативных способа аккомодации Man-α(1,2)-Man в углевод-связывающем сайте CRD ERGIC-53: первый – через сайты 1, 2 и 3 (режим I), второй включает сайты 2, 3 и 4 (режим II) (рис. 11). Такие же варианты реализуются и для ConA. В режиме I группа 3-OH Man (D1) располагалась снаружи относительно углевод-связывающего кармана, что позволяло формировать связь Glc-α(1–3)-Man без стерических затруднений. Однако этот режим связывания не характерен для CRD VIP36, поскольку редуцирующий остаток маннозы Man(4) интенсивно взаимодействовал с Tyr164 в участке 4, делая режим II исключительно преобладающим. В режиме II остаток Man(D1) на участке 2 ERGIC-53 расположен в направлении петли, включающей Gly251, Gly252 и Leu253, из-за отсутствия громоздкой боковой цепи аспартата. Это структурное расположение позволяет ERGIC-53-CRD распознавать углеводы без стерических затруднений. Два пути связывания характерны и для ConA, но преимущественно реализуется второй [72].
В работе Moothoo et al. [72] рассмотрены способы распознавания маннозных остатков ConA. В субъединице А восстанавливающий концевой углевод распознается моносахаридным участком через комбинацию водородных связей, полярных контактов и ван-дер-ваальсовых взаимодействий – аналогично взаимодействию, наблюдаемому для метил-α-D-маннопиранозида. Наблюдается смещение положения маннозного кольца на 0.3 Å от места связывания. Невосстанавливающий остаток занимает новое место, и принимается основная конформация. Напротив, в субъединице D невосстанавливающий концевой остаток маннозы находится в моносахаридном сайте, взаимодействует с Gly98, Ser168 и Thr226; восстанавливающий остаток принимает другую конформацию относительно гликозидной связи, чтобы метильная группа могла получить доступ к гидрофобному карману. В третьей субъединице наблюдается электронная плотность для обоих путей связывания – характерны оба варианты. Режим связывания, наблюдаемый в субъединице А, недоступен в субъединице D из-за небольших структурных различий сайтов. Хотя все четыре субъединицы в ConA идентичны по составляющим аминокислотам, существуют небольшие отличия в их структурной организации (относительное расположение цепей), что обусловливает обсуждаемые выше явления.
Таким образом, кристаллографические методы позволяют изучать механизмы взаимодействия белок–лиганд на атомно-молекулярном уровне, выявлять общие для лектинов мотивы в распознавании углеводов, а кроме того, получать данные структурной организации комплексов для компьютерного моделирования.
Комбинации различных методов для определения параметров связывания лиганд–рецептор
Для полного и детального анализа взаимодействий белок–лиганд применяют несколько методов, что позволяет увеличивать достоверность получаемых данных, определять параметры связывания. Рассмотрим исследование, в котором использовали конфокальную микроскопию и проточную цитометрию для анализа поглощения носителя лекарства и спектральную флуоресценцию для подтверждения адресной доставки. В работе Freichels et al. [73] исследовано связывание маннозных лигандов (маннозы, ди- и триманнозидов), иммобилизованных на накокапсулах (NCs) из ковалентно сшитого гидроксиэтикрахмала и полиуретана с модельным рецептором ConA и ДК с помощью флуоресцентных методов, проточной цитометрии, количественного ЯМР, конфокальной микроскопии. Способность функционализированных маннозой NCs взаимодействовать с FITC-меченым агглютинином Galanthus nivalis исследовали в зависимости от типа маннозного лиганда, плотности маннозных остатков на единицу поверхности и наличия ПЭГ-линкера. Взаимодействие этих маннозилированных NCs с флуоресцентным лектином показывает стерическую доступность маннозы при связывании с модельным рецептором ConA. Лучшее связывание наблюдалось с diMan и triMan, которые расположены на поверхности NCs благодаря высокому связывающему сродству лектина к этим углеводам по сравнению с маннозой (табл. 2). Введение ПЭГ-линкера между NCs и углеводом приводит к усилению взаимодействия с рецептором, что в основном связано с лучшей доступностью Man. Количественные параметры носителей определены с помощью 13C-ЯМР: оптимальная поверхностная плотность лигандов составила 0.13 ед./нм2, что эквивалентно 26 000 маннозных лигандов на одну нанокапсулу.
Целевая функция маннозилированных NCs была показана на ДК. Поглощение NCs дендритными клетками усиливается на ~3 порядка за счет связывания рецепторов клеток с маннозой на поверхности этих капсул, что было продемонстрировано с помощью ПЦ с использованием в качестве метки FITC, связанного с NCs. С помощью конфокальной лазерной сканирующей микроскопии продемонстрировано, что немодифицированные NCs в основном неспецифически адсорбированы на клетках, тогда как маннозилированные triMan NCs поглощаются клетками-мишенями в гораздо большей степени. Однако различия в эффективности связывания среди маннозилированных носителей невелики (<2 раз), поэтому все исследованные в работе нанокапсулы можно считать эффективными.
Итак, из результатов вышеприведенных экспериментов следует, что механизмы взаимодействия ConA, МФ и ДК с маннозными лигандами сходны. Наблюдаются одинаковые тенденции: увеличение количества маннозных остатков в лиганде обусловливает улучшение эффективности связывания лиганда рецептором, наличие спейсеров в носителе необходимо. Таким образом, эксперименты in vitro на модельных белках необходимы для определения наиболее аффинных лигандов с учeтом оптимальных степени маннозилирования, молекулярной массу молекулы, наличия и природы спейсера. После чего отобранные конъюгаты исследуют на предмет биобезопасности, биодеградируемости и специфичного взаимодействия с целевыми рецепторами клеток (МФ).
СОЗДАНИЕ МАННОЗИЛИРОВАННЫХ НОСИТЕЛЕЙ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ФУНКЦИЕЙ АДРЕСНОЙ ДОСТАВКИ
Гликозилированные полимерные носители (конъюгаты природных полимеров, например, хитозан, декстрины, липосомы, ПЭГ с углеводными фрагментами, такими как манноза, галактоза и др.) успешно используются для доставки различных терапевтических агентов, включая противовирусные препараты (азидотимидин, ставудин), противоопухолевые препараты (метотрексат, доксорубицин), противотуберкулезные препараты (рифампицин), антигены (поверхностный антиген вируса гепатита В) и т.д. [74]. Перспективный подход – разработка носителей противотуберкулезных лекарств (ATD), нацеленных на маннозные рецепторы альвеолярных макрофагов. Высокая эффективность доставки ATD к макрофагам с использованием носителей, содержащих Man-остатки, была продемонстрирована в экспериментах in vitro. Методы синтеза комплексов и конъюгатов различных носителей (полимеров, липосом, липидные частицы) с маннозой хорошо разработаны; можно получить частицы заданного состава, размера и степени модификации. Обнаружены благоприятные эффекты in vivo для ATD-нагруженных маннозилированных носителей (липосомы, твердые липидные частицы, хитозан), в частности, увеличение общей и максимальной концентрации ATD в легких, снижение концентрации ATD в плазме крови (смягчение токсического действия лекарственных веществ), отсутствие гепатотоксичности. Рассмотрим примеры разработанных систем адресной доставки лекарств и их эффективность.
Липосомы. Липидные частицы
Использование маннозилированных липосом для доставки ATD целесообразно и эффективно для повышения общей и максимальной концентрации ATD в легких. В работе Garg et al. [75] галактозилирование липосом позволило увеличить степень поглощения лекарства азидотимидина (противовирусный препарат, нуклеозидный ингибитор обратной транскриптазы вируса иммунодефицита человека) альвеолярными макрофагами в 8.5 раз по сравнению с немодифицированными носителями.
Сходные результаты получены в исследовании Chono et al. [76], которые изучали связь степени маннозилирования липосом и их поглощения АМ. Для модификации использовали 4-аминофенил-α-D-маннопиранозид и получали липосомы с различной степенью маннозилирования (размер частиц 1 мкм). В экспериментах in vitro поглощение липосом АМ увеличивалось с увеличением степени маннозилирования в диапазоне 2.4–9.1 мол. % Man, после чего не менялось. В экспериментах in vivo маннозилированные липосомы (9.1% Man) более эффективно доставлялись в АМ после легочной аэрозолизации крысам в сравнении с немодифицированными липосомами (24 и 13% соответственно). Поглощение клетками NR8383 маннозилированных липосом происходит путем эндоцитоза, опосредованного маннозными рецепторами, что было продемонстрировано в эксперименте по конкурентному связыванию в присутствии маннозы [76]. Таким образом, показано, что модификация липосом маннозой эффективна для адресного нацеливания на МР макрофагов.
Перспективный метод модификации липосом предложен Kawakami et al. [77] и Wijagkanalan et al. [78], которые изучали интратрахеальное введение мышам Man-липосом (маннозилированных липосом) с различным соотношением маннозилированных производных холестерина (Man-C4-Chol). Химическая структура и физико-химические характеристики Man-C4-Chol удовлетворяют условиям трансфекции в МФ, заряжены положительно и эффективно распознаются маннозными рецепторами. Показано, что Man-C4-Chol проявляет высокую трансфекционную активность. Поглощение клетками Man-липосом с 7.5- и 5%-ным содержанием Man-C4-Chol было в ~3 раза выше, чем у липосом с 2.5%-ным и нулевым содержанием Man-C4-Chol соответственно. Кроме того, поглощение Man-липосом значительно ингибировалось избытком маннозы, что свидетельствует о маннозном рецептор-опосредованном эндоцитозе, как и в работе Wijagkanalan et al. [78]. В системах in vivo после интратрахеального введения высокоманнозилированных (7.5%) липосом крысам наблюдалась высокая эффективность интернализации и селективное нацеливание на АМ.
Помимо липосом в качестве липидных носителей лекарств применяются твердые липидные наночастицы (SLN). За счет большего размера (200–500 нм) можно увеличить их поглощение клетками. Однако твердые липидные наночастицы применяются в основном для нерастворимых в воде лекарств, а липосомы более универсальны. Nimje et al. [79] оценивали перспективность использования наночастиц SLN для селективной доставки противотуберкулезного препарата рифабутина в альвеолярные ткани. Были синтезированы и маннозилированы нагруженные рифабутином (R) твердые липидные наночастицы SLN (M-SLN-R). Поглощение частиц макрофагами SLN определяли с помощью флуоресценции частиц [79]. Маннозилирование твердых липидных частиц позволило увеличить поглощение клетками в 5.8 раза. Подобная картина наблюдалась и в исследованиях in vivo. Время циркуляции рифабутина в крови крыс при использовании маннозилированных липосом увеличилось с 48 до 78 ч и с 48 ч до 96 ч для SLN-R (немодифицированные частицы) и M-SLN-R соответственно. Наблюдалось преимущественное поглощение M‑SLN-R альвеолярными макрофагами, что способствовало избирательному проникновению в легкие и помогает предотвратить попадание в другие органы. С помощью сканирующей электронной микроскопии наблюдали увеличение среднего размера частиц с 251 до 389 нм при маннозилировании липидных наночастиц, что также – фактор эффективности. Более крупные частицы (в данном случае маннозилированные M-SLN-R), в отличие от мелких, преимущественно поглощаются макрофагами.
Таким образом, конъюгированные с маннозными лигандами липосомы могут быть использованы для эффективной и целенаправленной доставки лекарств и в конечном счете могут снизить их побочные эффекты.
Полисахариды, хитозан и маннан
Полисахариды (такие как маннан, хитозан и др.) – перспективные носители лекарственных средств, их отличительные свойства: доступность, биосовместимость, мукоадгезивность и отсутствие отрицательного влияния на метаболизм. Маннан — растительный полисахарид, линейный полимер, образованный из остатков маннозы, соединенных β(1–4)-связями. Существует также маннан из клеточной стенки дрожжей, который состоит из главной цепи с α(1–6)-связями и боковых ветвей, в которых манноза соединена α(1–2)- и α(1–3)-связями.
Хитозан – аминополисахарид, макромолекулы которого состоят из деацетилированных (на 70–90%) звеньев N-ацетил-D-глюкозамина, соединенных β-(1–4) гликозидными связями. Применение хитозана в качестве носителя ATD связано с его способностью снижать токсичность антибактериальных средств и усиливать поглощение ATD-нагруженных частиц макрофагами [80]. Маннозилирование хитозана проводят путем реакции аминогрупп хитозана с маннозой или ее производными. В молекуле хитозана присутствуют три типа функциональных групп, доступных для модификации: первичные аминогруппы, первичные и вторичные гидроксильные группы. Самый простой путь получения маннозилированного хитозана – это прямая реакция хитозана с α-D-маннозой. Увеличения степени связывания хитозана с лектином можно добиться гликозилированием хитозана по реакции Майяра (химическая реакция между аминокислотами и редуцирующими сахарами) либо с использованием конденсирующего реагента (например, методом активированных эфиров) [81, 82].
Рассмотрим результаты исследования Asthana et al. [83] по разработке маннозилированных наноконструкций хитозана (22 кДа, степень деацетилирования 72.5%) для доставки олигодезоксирибонуклеотидов (ODN) в МФ. Маннозилированный водорастворимый хитозан показал хорошую способность к связыванию с рецепторами (использовали МФ мыши RAW 264.7) и оптимальные физико-химические свойства: размер частиц и ζ-потенциал (табл. 3). Эффективность трансфекции зависит от соотношения ChitMan/ ODN. Наблюдается значительное повышение эффективности трансфекции при увеличении соотношения ChitMan и ODN от 1 : 1 до 3 : 1. Оптимальное соотношение ChitMan к ODN составляет 3 : 1. В этих условиях ChitMan-ODN показал в ~3 раза более высокую эффективность трансфекции, чем свободный ODN. Свободная манноза конкурирует за сайты связывания с рецепторами, в результате чего эффективность трансфекции ChitMan-ODN снижается при увеличении концентрации маннозы, а поглощение наночастиц ингибируется на ~50% при концентрации маннозы 20 мМ. Таким образом, вновь подтвержден механизм проникновения маннозилированной макромолекулы в макрофаги через систему доставки, опосредованную маннозными рецепторами.
Таблица 3.
Физико-химические свойства наночастиц маннозилированного хитозана с олигодезоксирибонуклеотидами, определенные с помощью фотонной корреляционной спектроскопии [83]
| Соотношение ChitMan к ODN | Размер частиц, нм | ζ-Потенциал, мВ | Количество ODN, поглощенных 1 млн клеток, нг |
|---|---|---|---|
| 1 : 1 | 267.12 ± 11.0 | −6.2 ± 0.02 | 30 |
| 3 : 1 | 192.48 ± 4.8 | +8.9 ± 0.82 | 74 |
| 5 : 1 | 187.16 ± 5.6 | +12.6 ± 0.64 | 65 |
| 7 : 1 | 178.24 ± 7.4 | +14.2 ± 0.46 | 60 |
Увеличение эффективности трансфекции лекарства при конъюгации противоопухолевых препаратов с маннаном (полисахарид, выделенный из дрожжей Saccharomyces cerevisiae) продемонстрировано в работе Budzynska et al. [84]. Конъюгат маннан–метотрексат показал улучшенную противоопухолевую активность и в экспериментах in vivo по сравнению со свободным лекарством на модели лейкоза мыши Р388 в брюшной полости.
Итак, маннозилированные полисахариды (хитозан и маннан) эффективно поглощаются МФ, при этом выступают биобезопасными и биодеградируемыми носителями лекарственных средств.
Дендримеры
Кроме вышеназванных полимеров, перспективные носители для доставки лекарств (например, противоопухолевых препаратов) – дендримеры – повторяющиеся разветвленные молекулы. По числу точек ветвления различают дендримеры нескольких поколений. Дендримеры 3-го поколения характеризуются высокой плотностью молекулярной структуры и имеют форму, близкую к сферической. Их растворы обладают гораздо меньшей вязкостью, чем растворы других веществ с такой же молекулярной массой. Физические характеристики дендримеров, включая их монодисперсность, растворимость в воде, способность к инкапсуляции и большое количество функционализируемых периферических групп, обусловливают применение этих макромолекул в качестве адресных средств доставки лекарств. Дендримеры универсальны вследствие широкого спектра химических модификаций, которые могут быть проведены для повышения биосовместимости и других характеристик.
Проводилось исследование по изучению биораспределения и клеточного поглощения синтезированных систем доставки (дендримеров) на линиях клеток кролика и мыши [85]. Дендримеры 4-го поколения на основе полиамидоамина (аналог – рис. 12) модифицировали маннозой для нацеливания на маннозные рецепторы. Эффективность клеточного поглощения оценивали на линии клеток мыши RAW 264.7 методом флуоресцентной микроскопии. Показано увеличение поглощения в 2.5 раза по сравнению с немодифицированными лигандами. Результаты in vitro демонстрируют, что конъюгация маннозы с дендримерами в значительной степени активирует механизм интернализации макромолекул в процессе эндоцитоза, опосредованном МР. По результатам исследования поглощения флуоресцентно меченых дендримеров в модели кролика с внутриутробным воспалением было показано, что конъюгация с маннозой изменяла распределение дендримеров по всему телу кролика с увеличением количества дендримеров, доставляемых к поврежденной глии в головном мозге. Потенциально данная система может быть использована для адресной доставки лекарств к макрофагам в печень, легкие, мозг, селезенку, ДК Лангерганса кожи и др. [85].
Улучшение терапевтического эффекта лекарства за счет маннозилирования (PPI)-дендримеров (аналог – рис. 12) было также достигнуто Dutta et al. [86], которые исследовали доставку эфавиренза (препарат для борьбы с ВИЧ) к моноцитам и макрофагам человека. Гемолитическая активность и цитотоксичность немодифицированного носителя были высокими, а токсичность конъюгированного дендримера с маннозными лигандами – незначительной. Исходный дендример высвобождает препарат in vitro в течение 24 ч, а модифицированные носители увеличивают время действия до 144 ч. Значительное улучшение клеточного поглощения эфавиренза клетками моноцитов и макрофагов наблюдалось в случае маннозомодифицированного дендримера: в 12 раз выше, чем у свободного препарата. Аналогичные PPI-дендримеры (рис. 12) разрабатывали и изучали Kumar et al. [87], используя маннозилированные дендримеры для селективной доставки противотуберкулезного препарата рифампицина к АМ. Модифицирование носителя позволило увеличить высвобождение препарата из полостей дендримера и поглощение АМ: концентрация рифампицина достигла 14.3 нг/мл (по сравнению с 1.0 нг/мл в случае использования свободного лекарства).
Таким образом, маннозилирование дендримерных носителей позволяет увеличить поглощение носителей лекарственных средств и терапевтический потенциал, а также изменить биораспределение макромолекул в организме для высокоселективной доставки.
Применение полиэтиленгликоля (ПЭГ) и других синтетических полимерных носителей
ПЭГ – распространенный модифицирующий агент, который используется также для синтеза различных сополимеров, изменения поверхностных свойств и времени циркуляции частиц. Поверхностный заряд может влиять на взаимодействие частиц с биологическими системами. Широкий спектр сополимеров ПЭГ-хитозан (степень модификации хитозана ПЭГ составляет 10–30%) с анионными липосомами применен для адресной доставки доксорубицина в клетки в экспериментах in vitro [88, 89]. Для стабилизации липосом (защиты от окисления, формирования дефектов в мембране и агрегации) использовали сополимер ПЭГ-хитозан: образование комплекса приводит к нейтрализации заряда на липосомах, размер частиц увеличивается. Согласно МТТ-тестам для оценки метаболической активности клеток и данным конфокальной микроскопии для клеточных линий аденокарциномы человека A459 и Caco-2, липосомы, покрытые ПЭГ-хитозаном, столь же эффективны, как и исходные липосомы, но гораздо более стабильны и менее токсичны.
Путем модификации маннозой молекул ПЭГ можно добиться лучшего распознавания лигандов маннозными рецепторами [90, 91]. В работе Raviv et al. [92] описаны структуры и синтез маннозилированных полиионных комплексов, состоящих из катионных полиэтилениминовых (ПЭИ 25 кДа) и ПЭГ-сегментов (3.5 кДа), несущих Man и triMan в качестве лигандов для нацеливания на МР ДК. Получены положительно заряженные блок-сополимеры (Man-ПЭГ-β-ПЭИ и Man3-ПЭГ-β-ПЭИ). Структура носителей такова: к ПЭИ-полимеру через спейсер присоединен ПЭГ-фрагмент с концевым маннозным (или триманнозным) остатком. Man3-ПЭГ-β-ПЭИ показали по сравнению с полимерами Man-ПЭГ-β-ПЭИ в 3–4 раза более высокую эффективность трансфекции в дендритные клеточные линии (клетки моноцитарного лейкоза человека THP-1 и мыши DC2.4) и низкую цитотоксичность. Маннозилированные полимеры продемонстрировали в 2–3 раза более высокую эффективность доставки генов в клетки CD11c+ по сравнению с комплексами ПЭИ–ДНК.
Более высокие показатели клеточного поглощения достигнуты в исследовании Gou et al. [93] при использовании сополимерных частиц на основе ПЭГ и ε-полилактида (57.5 кДа). Маннан-модифицированные частицы повышали концентрацию иммуноглобулинов (IgG, IgG1 и IgG2a) в сыворотке крови мышей (C57BL/6) в 5–7 раз по сравнению с немодифицированными частицами. Это обусловлено адресным нацеливанием на ДК и активацией гуморального иммунитета.
Носители на основе ПЭГ были использованы в работе D’Addio et al. [94], в которой представлен процесс синтеза сополимера полистрирола (1.5 кДа) и ПЭГ (5 кДа) с концевыми –OCH3, ‒OH или Man-остатками. С помощью конфокальной флуоресцентной микроскопии было показано, что полимеры с концевыми метоксигруппами не ассоциируются с макрофагами мыши J774A и J774E независимо от размера частиц. Специфическое нацеливание на МР исследовано с использованием носителей, имеющих 0–75% маннозид-концевых цепей ПЭГ. Максимальная ассоциация наноносителей достигается с 9%-ными цепями с маннозидным концом, что увеличивает поглощение более чем в 3 раза по сравнению с неманнозилированными полимерами.
Как показывает анализ этой и вышеприведенных статей, лучшие результаты достигаются в случае использования длинноцепочечных полимеров, т.к. реализуется эффект мультивалентного связывания; аналогичная ситуация наблюдалась для хитозана (см. выше подраздел “ИК-Фурье-спектроскопия в режиме НПВО”). Наиболее аффинный полимер должен иметь молекулярную массу >20–30 кДа.
Обратная зависимость поглощения и длины цепи полимера получена Chen et al. [60], которые синтезировали ПЭГ-содержащие наночастицы (структура полимера: ПЭГ – маннозный остаток – спейсер – маннозный остаток – флуоресцентная метка FITC) (рис. 13а) для оценки влияния количества единиц маннозы (Man), размера носителя (ПЭГ) и длины спейсера между соседними единицами маннозы на поглощение частиц в МР-экспрессирующих макрофагах мыши J774E.
С помощью флуоресцентной и конфокальной микроскопии выяснено, что среди наночастиц с 0, 1, 2 или 4 единицами маннозы поглощение (Man)2-NC было самым высоким. Показано, что необходим компромисс между “кластеризацией” маннозных остатков и возникающими стерическими затруднениями, поэтому существует оптимум (также, как и в предыдущей работе, где максимальный эффект был достигнут при 9%). Исследуемые ПЭГ-содержащие частицы показали обратную зависимость между молекулярной массой ПЭГ (5, 12, 20, 30 и 40 кДа) и поглощением клетками. ПЭГ с молекулярной массой 12 кДа был выбран для исследования расстояния между маннозными остатками. Были синтезированы три комплекса (Man)2-ПЭГ NC с различными расстояниями между маннозными остатками: 39, 56 и 89 Å. Поглощение наночастиц с расстоянием 56 Å между маннозами было в 4 и 2 раза выше, чем NC с расстояниями 39 и 89 Å соответственно. Эти результаты коррелируют с данными работы Titov et al. [35], которые показали, что наличие спейсера в циклодекстрин-маннозных конъюгатах увеличивало их сродство к ConA в несколько раз. Кроме того, как было показано выше, расстояние между сайтами связывания в ConA составляет 68 Å (примерно такое же, как и в CD206) – наиболее близко к 56 Å (второй тип (Man)2-ПЭГ NC). Таким образом, предположение о том, что соответствие расстояний между маннозными остатками в полимере расстояниям между сайтами в рецепторе увеличивает эффективность распознавания лигандов, что подтверждено экспериментально.
Итак, для наночастиц и других носителей лекарств существует определенный оптимум поверхностной маннозной модификации, а также возможность синтеза молекул с необходимыми параметрами, которые контролируются введением полимеров различной молекулярной массы и в разных соотношениях.
Циклодекстрины
Циклодекстрины (CD) – широко используемые носители лекарств, представляющие собой циклические олигомеры глюкозы, получаемые ферментативным путем. Их различают по количеству остатков глюкозы, содержащихся в одной молекуле CD. Так, простейший представитель – α-циклодекстрин – содержит 6 глюкопиранозных звеньев, β-циклодекстрин – 7, а γ-циклодекстрин – 8. Форма молекул CD – тор, напоминающий полый усеченный конус. Данная форма стабилизирована водородными связями между OH-группами, а также α-D-1,4-гликозидными связями. Гидроксильные группы в CD находятся на внешней поверхности молекулы, поэтому внутренняя полость гидрофобная и способна образовывать в водных растворах комплексы включения с другими молекулами органической и неорганической природы. В качестве “гостевых” молекул в соединениях включения выступают биологически активные вещества и лекарственные средства, которые требуется защитить от окисления, гидролиза, ферментативной деструкции, избыточной гигроскопичности и т.д. По этой причине CD нашли широкое применение в фармацевтической промышленности. Наиболее важное свойство – это повышение растворимости препаратов в воде за счет гидрофильной наружной оболочки и усиление проникновения лекарств через биологические мембраны.
В литературе описан широкий круг конъюгатов на основе циклодекстринов. Рассмотрим наиболее перспективные из них. Gómez-García et al. [95] синтезировали гетерогликокластеры, центрированные на циклодекстрине. Изучали различные варианты модификации CD углеводами (Man, Glc и Lac). Наиболее аффинным к ConA оказался CD с тремя остатками маннозы: сродство к лектину увеличилось в 7 раз по сравнению с MeMan.
Интересное и перспективное соединение на основе хитозана, модифицированного циклодекстрином (CD-Chit), исследовали Yuan et al. [96] в качестве нового носителя для малорастворимых в воде лекарственных препаратов. Полимер получен из хитозана (110 кДа) и моно-6-дезокси-6-(п-толуолсульфонил)-β-CD со степенью замещения 10–20%. Показана возможность получения частиц с заданными параметрами в широком диапазоне: размер 202–589 нм, ζ-потенциал от +23 до +43 мВ. Эти характеристики важны при подборе оптимального носителя лекарств. Эффективность инкапсуляции кетопрофена в наночастицы хитозана с 20% CD выше в 1.36 раза, чем у немодифицированного полимера. Скорость и время высвобождения препарата из наночастиц контролируется pH и количеством CD. Таким образом, Chit-CD может быть использован в качестве биодеградируемой системы доставки малорастворимых в воде лекарств с регулируемыми параметрами высвобождения лекарственного средства и, следовательно, заданного воздействия на целевые клетки.
Приведем результаты исследования свойств маннозосодержащего CD-носителя и его комплекса с шапероновыми белками 6S-NOI-NJ и 6S-NAdB-NJ (которые в данном случае используются для лечения болезни Гоше) [97]. Для исследования способности носителя (ManS)3-β-CD (маннозные остатки связаны через спейсер, рис. 13б) и соответствующих комплексов с белками нацеливаться на маннозоспецифические лектины было проведено сравнительное исследование их связывающей способности с ConA методом изотермической титрующей калориметрии. Определены изменения энергии Гиббса при комплексообразовании ConA с CD и его конъюгатами (табл. 4). Стехиометрия, определенная для комплексов, составляла 1 : 1, т.е. маннозилированный дендрон в (ManS)3-β-CD взаимодействует исключительно с одной единицей ConA. Включение шаперона в полость β-CD существенно не влияло на сродство лектина. Полученные значения свидетельствуют о повышении аффинности циклодекстринового носителя на 2 порядка по сравнению с метил-α-D-маннопиранозидом (Kd = 156 мкМ). Итак, трехвалентный маннозный остаток в разработанном носителе (ManS)3-β-CD эффективно распознается рецепторами лектина за счет многовалентного эффекта – в десятки раз лучше, чем маннопиранозид. При этом циклодекстриновая система характеризуется также оптимальными параметрами включения целевого вещества.
Таблица 4.
Термодинамические параметры и константы диссоциации (Kd) для системы ConA с (ManS)3-βCD и соответствующими комплексами с фармакологическими шаперонами 6S-NOI-NJ и 6S-NAdB-NJ [97]
| Молекула | Изменение энергии при комплексообразовании, ΔG°, кДж/моль | Kd комплекса, мкМ |
|---|---|---|
| (ManS)3-βCD | –32.4 ± 1.0 | 2.1 ± 0.7 |
| 6S-NOI-NJ + (ManS)3-βCD | –33.0 ± 3.1 | 1.6 ± 0.1 |
| 6S-NAdB-NJ + (ManS)3-βCD | –31.0 ± 1.3 | 3.6 ± 1.5 |
Огромный спектр носителей лекарств на основе CD описан в обзорной статье Titov et al. [35], в которой рассмотрены основные методы получения моно- и олигодентатных гликоконъюгатов на основе циклоуглеводных матриц и их взаимодействие с лектинами, в том числе рассмотрены маннозные гликоконъюгаты. Само по себе взаимодействие олигосахаридных лигандов с лектинами относительно слабое (Kd = 10–6–10–3 М). Низкая эффективность единичных взаимодействий компенсируется увеличением их количества за счет кластеризации многих копий углеводных лигандов и их рецепторов. Получающееся в результате более прочное кооперативное связывание – кластерный эффект, который используют при планировании и разработке новых классов углеводсодержащих лекарств. Гликоконъюгаты были в 16–17 раз эффективнее, чем метил-α-маннопиранозид, за счет кластерного эффекта и использования спейсера. Гептавалентный конъюгат, содержащий С5-спейсеры CD, оказался более чем в 40 раз активнее, чем CD с маннозными остатками без спейсеров. Поэтому в процессе связывания гликоконъюгата и лектина важна определенная пространственная организация лектиновых лигандов. Эти данные подтверждаются зависимостями структуры и Kd комплексов маннозных олигопептидов и ConA (обсуждаются выше в подразделе “Флуоресцентная спектроскопия”) (табл. 2). Определяющее значение имеет расположение мономеров относительно друг друга в олигосахариде.
В работе Titov et al. [35] описана серия экспериментов по определению способности гликокластера CD и маннозы стимулировать клеточную линию МФ RAW 264.7 на выработку провоспалительного цитокина TNF-α в системах in vivo. С помощью измерения интенсивности флуоресценции было показано, что конъюгат связывается с плазматической мембраной МФ. Конъюгат при концентрации 400 мкг/мл стимулировал образование провоспалительного цитокина TNF-α приблизительно на том же уровне, что и липополисахарид, моделирующий поверхности бактерии. Таким образом, продемонстрирован терапевтический потенциал конъюгата CD-Man.
ЗАКЛЮЧЕНИЕ
Исходя и вышерассмотренных примеров, можно заключить, что применение маннозилированных средств адресной доставки лекарственных препаратов посредством нацеливания на МР макрофагов – перспективная стратегия лечения различных заболеваний. С помощью варьирования степени маннозилирования или соотношения компонентов в конъюгате продемонстрирована возможность регулировать фармакокинетические параметры, а также биораспределение носителя с лекарством по организму. Пример эффективного носителя – β-циклодекстрин с семью остатками 3,6-ди-O-(β(1,2)-GlcNAc-маннопиранозил)-α-маннопираноз, связанными через спейсеры так, чтобы расстояние между маннозными остатками примерно соответствовало расстоянию между сайтами в ConA. Такие носители позволяют повысить специфичность к маннозным рецепторам в десятки раз за счет оптимальной кластеризации Man-остатков. При использовании наночастиц из биодеградируемых полимеров и лигандов, обеспечивающих направленное действие, открывается возможность создания новых лекарственных форм с пролонгированным действием и адресной доставкой, что позволит снизить нагрузку лекарственных препаратов на организм, уменьшить токсичность, существенно сократить сроки лечения, значительно улучшить ситуацию с антибиотикорезистентностью, а главное – увеличить эффективность лечения.
Список литературы
Pittet M.J., Nahrendorf M., Swirski F.K. // Ann. N.Y. Acad. Sci. 2014. V. 1319. P. 1–18. https://doi.org/10.1111/nyas.12393
Allard B., Panariti A., Martin J.G. // Front. Immunol. 2018. V. 9. P. 1777–1783. https://doi.org/10.3389/fimmu.2018.01777
Yuk J.-M., Jo E.-K. // J. Bacteriol. Virol. 2011. V. 41. P. 225–235. https://doi.org/10.4167/jbv.2011.41.4.225
Cambi A., Figdor C. // Curr. Biol. 2009. V. 19. P. 375–378. https://doi.org/10.1016/j.cub.2009.03.032
Dheda K., Schwander S.K., Zhu B., van Zyl-Smit R.N., Zhang Y. // Respirol. 2010. V. 15. P. 433–450. https://doi.org/10.1111/j.1440-1843.2010.01739.x
Taylor P.R., Martinez-Pomares L., Stacey M., Lin H.-H., Brown G.D., Gordon S. // Annu. Rev. Immunol. 2005. V. 23. P. 901–944. https://doi.org/10.1146/annurev.immunol.23.021704.115816
Yonekawa A., Saijo S., Hoshino Y., Miyake Y., Ishikawa E., Suzukawa M., Yamasaki S. // Immunity. 2014. V. 41. P. 402–413. https://doi.org/10.1016/j.immuni.2014.08.005
Ezekowitz R.A., Sastry K., Bailly P., Warner A. // J. Exp. Med. 1990. V. 172. P. 1785–1794. https://doi.org/10.1084/jem.172.6.1785
Filatova L.Y., Klyachko N.L., Kudryashova E.V. // Russ. Chem. Rev. 2018. V. 87. P. 374–391. https://doi.org/10.1070/rcr4740
Martínez-Pomares L., Mahoney J.A., Káposzta R., Linehan S.A. // J. Biol. Chem. 1998. V. 273. P. 23376–23380. https://doi.org/10.1074/jbc.273.36.23376
East L., Isacke C.M. // Biochim. Biophys. Acta. 2002. V. 1572. P. 364–386. https://doi.org/10.1016/S0304-4165(02)00319-7
Leteux C., Chai W., Loveless R.W., Yuen C.T. // J. Exp. Med. 2000. V. 191. P. 1117–1126. https://doi.org/10.1084/jem.191.7.1117
Feinberg H., Jégouzo S.A.F., Lasanajak Y., Smith D.F., Drickamer K., Weis W.I., Taylor M.E. // J. Biol. Chem. 2021. V. 296. P. 100368–100385. https://doi.org/10.1016/j.jbc.2021.100368
Drickamer K. // Curr. Opin. Struct. Biol. 1999. V. 9. P. 585–590. https://doi.org/10.1016/S0959-440X(99)00009-3
Napper C.E., Drickamer K., Taylor M.E. // Biochem. J. 2006. V. 395(3). P. 579–586. https://doi.org/10.1042/bj20052027
Fiete D.J., Beranek M.C., Baenziger J.U. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 2089–2093. https://doi.org/10.1073/pnas.95.5.2089
Liu Y., Chirino A.J., Misulovin Z., Leteux C., Feizi T., Nussenzweig M.C., Bjorkman P.J. // J. Exp. Med. 2000. V. 191. P. 1105–1116. https://doi.org/10.1084/jem.191.7.1105
Feinberg H., Park-Snyder S., Kolatkar A.R., Heise C.T., Taylor M.E., Weis W.I. // J. Biol. Chem. 2000. V. 275. P. 21539–21548. https://doi.org/10.1074/jbc.M002366200
Taylor M.E., Drickamer K. // J. Biol. Chem. V. 268. P. 399–404. https://doi.org/10.1016/s0021-9258(18)54164-8
Mullin N.P., Hail K.T., Taylor M.E. // J. Biol. Chem. 1994. V. 269. P. 28405–28413. https://doi.org/10.1016/S0021-9258(18)46942-6
Weis W.I., Drickamer K. // Annu. Rev. Biochem. 1996. V. 65. P. 441–473. https://doi.org/10.1146/annurev.bi.65.070196.002301
Weis W.I., Drickamer K., Hendrickson W.A. // Nature. 1992. V. 360. P. 127–134. https://doi.org/10.1038/360127a0
Sheriff S., Chang C., Ezekowitz R. // Nat. Struct. Mol. Biol. 1994. V. 1. P. 789–794. https://doi.org/10.1038/nsb1194-789
Thiel S., Vorup-Jensen T., Stover C., Schwaeble W., Laursen S.B., Poulsen K., Willis A.C., Eggleton P., Hansen S., Holmskov U., Reid K.B.M., Jensenius J.C. // Nature. 1997. V. 386. P. 506–510. https://doi.org/10.1038/386506a0
Suzuki Y., Shirai M., Asada K. // Sci. Rep. 2018. V. 8. P. 13129. https://doi.org/10.1038/s41598-018-31565-5
Mazlan M.K.N., Tazizi M.H.D., Ahmad R., Noh M.A.A., Bakhtiar A., Wahab H.A., Gazzali A. // Antibiotics. 2021. V. 10. P. 908. https://doi.org/10.3390/antibiotics10080908
Liener I.E., Sharon N., Goldstein I.J. // The Lectins Properties, Functions and Applications in Biology and Medicine. Orlando: Academic Press, 1986.
Loris R., Hamelryck T., Bouckaert J., Wyns L. // Biochim. Biophys. Acta.1998. V. 1383. P. 9–36. https://doi.org/10.1016/S0167-4838(97)00182-9
Olson M.O.J., Liener I.E. // Biochemistry. 1967. V. 6. P. 105–111. https://doi.org/10.1021/bi00853a018
Senear D.F., Teller D.C. // Biochemistry. 1981. V. 20. P. 3083–3091. https://doi.org/10.1021/bi00514a015
Brewer C.F., Brown R.D., Koenig S.H. // J. Biomol. Str. Dyn. 1983. V. 1. P. 961–997. https://doi.org/10.1080/07391102.1983.10507497
Kaushik S., Mohanty D., Surolia A. // Biophys. J. 2009. V. 96. P. 21–34. https://doi.org/10.1529/biophysj.108.134601
Naismith J.H., Emmerich C., Habash J., Harrop S.J., Helliwell J.R., Hunter W.N., Yariv J. // Acta Cryst. Sect. D Biol. Cryst. 1994. V. 50. P. 847–858. https://doi.org/10.1107/s0907444994005287
Le-Deygen I.M., Mamaeva P.V., Skuredina A.A., Kudryashova E.V. // Moscow Univ. Chem. Bull. 2020. V. 75. P. 213–217. https://doi.org/10.3103/S0027131420040045
Титов Д.В., Генинг М.Л., Цветков Ю.Е., Нифантьев Н.Э. // Биоорг. химия. 2013. Т. 39. С. 509–546. [Titov D.V., Gening M.L., Tsvetkov Yu.E., Nifantiev N.E. // Russ. J. Bioorg. Chem. 2013. V. 39. P. 451–487.] https://doi.org/10.1134/S1068162013050142
Naismith J.H., Field R.A. // J. Biol. Chem. 1996. V. 271. P. 972–976. https://doi.org/10.1074/jbc.271.2.972
Gerlits O.O., Coates L., Woods R.J., Kovalevsky A. // Biochemistry. 2017. V. 56. P. 4747–4750. https://doi.org/10.1021/acs.biochem.7b00654
Sukumaran S. // Protein Secondary Structure Elucidation Using FTIR Spectroscopy. Thermo Fisher Scientific. Inc. BioCell, 2018.
Кудряшова Е.В. // Функционирование и структура белков на поверхностях раздела фаз. Новые методы исследования. Москва: Palmarium Academic Publishing, 2013. С. 1–146.
Itagaki H. Fluorescence Spectroscopy // In: Experimental Methods in Polymer Science: Modern Methods in Polymer Research and Technology / Ed. Tanaka T. Academic Press, 2000. P. 155–260.
Злотников И.Д., Ваничкин Д.А., Кудряшова Е.В. // Биотехнология. 2021. Т. 37. № 5. С. 28–40. https://doi.org/10.21519/0234-2758-2021-37-5-28-40
Lakowicz J.R. // Principles of Fluorescence Spectroscopy. Springer-Verlag US, 1999. https://doi.org/10.1007/978-1-4757-3061-6
Кудряшова Е.В., Гладилин А.К., Левашов А.В. // Усп. биол. химии. 2002. Т. 42. С. 257–294.
Landshcoot A., Loontiens F.G., De Bruyne C.K. // Eur. J. Biochem. 1978. V. 83. P. 277–285. https://doi.org/10.1111/j.1432-1033.1978.tb12092.x
Landschoot A., Loontiens F.G., De Bryune C.K. // Eur. J. Biochem. 1980. V. 103. P. 307–312. https://doi.org/10.1111/j.1432-1033.1980.tb04316.x
Yuasa H., Kamata Y., Kurono S., Hashimoto H. // Bioorg. Med. Chem. Lett. 1998. V. 8. P. 2139–2144. https://doi.org/10.1016/S0960-894X(98)00364-3
Mandal D.K., Kishore N., Brewer C.F. // Biochemistry. 1994. V. 33. P. 1149–1156. https://doi.org/10.1021/bi00171a014
Dam T.K., Roy R., Das S.K., Oscarson S., Brewer C.F. // J. Biol. Chem. 2000. V. 275. P. 14223–14230. https://doi.org/10.1074/jbc.275.19.14223
Maverakis E., Kim K., Shimoda M., Gershwin M.E., Patel F., Wilken R., Raychaudhuri S., Ruhaak L.R., Lebrilla C.B. // J. Autoimmun. 2015. V. 57. P. 1–13. https://doi.org/10.1016/j.jaut.2014.12.002
Aizpurua-Olaizola O., Torano J.S., Pukin A., Fu O., Boons G.J., de Jong G.J., Pieters R.J. // Electrophoresis. 2018. V. 39. P. 344–347. https://doi.org/10.1002/elps.201700207
Introduction to Affinity Chromatography, https://www. bio-rad.com/ru-ru/applications-technologies/introduction-affinity-chromatography?ID=MWHAVG4VY
Hage D. // Clin. Chem. 1999. V. 45. P. 593–615. https://doi.org/10.1093/clinchem/45.5.593
Freeze H.H. // Curr. Protocols Prot. Sci. 1995. P. 9.1.1–9.1.9. https://doi.org/10.1002/0471140864.ps0901s00
Беккер Ю. // Хроматография. Инструментальная аналитика. Методы хроматографии и капиллярного электрофореза. Москва: Техносфера, 2009. 472 с.
Argayosa A.M., Bernal R.A.D., Luczon A.U., Arboleda J.S. // Aquaculture. 2011. V. 310. P. 274–280. https://doi.org/10.1016/j.aquaculture.2010.11.002
Andon N.L., Eckert D., Yates J.R., Haynes P.A. // Proteomics. 2003. V. 3. P. 1270–1278. https://doi.org/10.1002/pmic.200300447
Pawley J.B. // Handbook of Biological Confocal Microscopy (3rd ed.). Berlin: Springer. 2006.
Wilson T. // Confocal Microscopy. Encyclopedia of Modern Optics. London: Academic, 2005. P. 194–202.
Ghotbi Z., Haddadi A., Hamdy S., Hung R.W., Samuel J., Lavasanifar A. // J. Drug Target. 2010. V. 19. P. 281–292. https://doi.org/10.3109/1061186X.2010.499463
Chen P., Zhang X., Jia L., Prud’homme R.K., Szekely Z., Sinko P.J. // J. Control. Rel. 2014. V. 194. P. 341–349. https://doi.org/10.1016/j.jconrel.2014.09.006
Picot J., Guerin C.L., Le Van Kim, C., Boulanger C.M. // Cytotechnology. 2012. V. 64. P. 109–130. https://doi.org/10.1007/s10616-011-9415-0
Givan A.L. // In: Flow Cytometry Protocols / Eds. Hawley T., Hawley R. Meth. Mol. Biol. (Methods and Protocols). V. 699. Humana Press, 2011. https://doi.org/10.1007/978-1-61737-950-5_1
Roederer M. // Cytometry. 2001. V. 45. P. 194–205. https://doi.org/10.1002/1097-0320(20011101)45:3<194: :AID-CYTO1163>3.0.CO;2-C
Ying W., Cheruku P.S., Bazer F.W., Safe S.H., Zhou B. // J. Vis. Exp. 2013. V. 76. P. 50323–50330. https://doi.org/10.3791/50323
Gordon S. // Nat. Rev. Immunol. 2003. V. 3. P. 23–35. https://doi.org/10.1038/nri978
Arkan M.C., Hevener A.L., Greten F.R., Maeda S., Li Z.W., Long J.M., Wynshaw-Boris A., Poli G., Olefsky J., Karin M. // Nat. Med. 2005. V. 11. P. 191–198. https://doi.org/10.1038/nm1185
Rapoport E.M., Sapot’ko Y.B., Pazynina G.V., Bojenko V.K., Bovin N.V. // Biochemistry (Moscow). 2005. V. 70. P. 330–338. https://doi.org/10.1007/s10541-005-0119-y
Cornish A.L., Freeman S., Forbes G., Ni J., Zhang M., Cepeda M., Gentz R., Augustus M., Carter K.C., Crocker P.R. // Blood. 1998. V. 92. P. 2123–2132. https://doi.org/10.1182/blood.V92.6.2123
Barkal A.A., Brewer R.E., Markovic M., Kowarsky M., Barkal1 S.A., Zaro B.W., Krishnan V., Hatakeyama J., Dorigo O., Barkal L.J., Weissman I.L. // Nature. 2019. V. 572. P. 392–396. https://doi.org/10.1038/s41586-019-1456-0
Rodrigues Mantuano N., Natoli M., Zippelius A., Läubli H. // J. ImmmunoTher. Cancer. 2020. V. 8. P. e001222. https://doi.org/10.1136/jitc-2020-001222
Satoh T., Suzuki K., Yamaguchi T., Kato K. // PLoS One. 2014. V. 9. P. e87963. https://doi.org/10.1371/journal.pone.0087963
Moothoo D.N., Canan B., Field R.A., Naismith J.H. // Glycobiology. 1999. V. 9. P. 539–545. https://doi.org/10.1093/glycob/9.6.539
Freichels H., Wagner M., Okwieka P., Meyer R.G., Mailänder V., Landfester K., Musyanovych A. // J. Mater. Chem. B. 2013. V. 1. P. 4338–4348. https://doi.org/10.1039/C3TB20138D
Monsigny M., Roche A.C., Midoux P., Mayer R. // Adv. Drug Deliv. Rev. 1994. V. 14. P. 1–24. https://doi.org/10.1016/0169-409X(94)90003-5
Garg M., Jain N.K. // J. Drug Target. 2006. V. 14. P. 1–11. https://doi.org/10.1080/10611860500525370
Chono S., Kaneko K., Yamamoto E., Togami K., Morimoto K. // Drug Dev. Ind. Pharm. 2010. V. 36. P. 102–107. https://doi.org/10.3109/03639040903099744
Kawakami S., Sato A., Nishikawa M., Yamashita F., Hashida M. // Gene Ther. 2000. V. 7. P. 292–299. https://doi.org/10.1038/sj.gt.3301089
Wijagkanalan W., Kawakami S., Takenaga M., Igarashi R., Yamashita F., Hashida M. // J. Control. Rel. 2008. V. 125. P. 121–130. https://doi.org/10.1016/j.jconrel.2007.10.011
Nimje N., Agarwal A., Saraogi G.K., Lariya N., Rai G., Agrawal H., Agrawal G.P. // J. Drug Target. 2009. V. 17. P. 777–787. https://doi.org/10.3109/10611860903115308
Grenha A., Al-Qadi S., Seijo B., Remunan-Lopez C. // J. Drug Deliv. Sci. Technol. 2010. V. 20. P. 33–43. https://doi.org/10.1016/S1773-2247(10)50004-2
Chung Y.C., Tsai C.F., Li C.F. // Fish. Sci. 2006. V. 72. P. 1096–1103. https://doi.org/10.1111/j.1444-2906.2006.01261.x
Il’ina A.V., Kulikov S.N., Chalenko G.I., Gerasimova N.G., Varlamov V.P. // Appl. Biochem. Microbiol. 2008. V. 44. P. 551–558. https://doi.org/10.1134/S0003683808050177
Asthana G.S., Asthana A., Kohli D.V., Vyas S.P. // BioMed Res. Int. 2014. V. 2014. P. 1–17. https://doi.org/10.1155/2014/526391
Budzynska R., Nevozhay D., Kanska U., Jagiello M., Opolski A., Wietrzyk J., Boratynski J. // Oncol. Res. 2007. V. 16. P. 415–421. https://doi.org/10.3727/000000007783980837
Sharma A., Porterfield J.E., Smith E., Sharma R., Kannan S., Kannan R.M. // J. Control. Rel. 2018. V. 283. P. 175–189. https://doi.org/10.1016/j.jconrel.2018.06.003
Dutta T., Agashe H.B., Garg M., Balasubramanium P., Kabra M., Jain N.K. // J. Drug Target. 2007. V. 15. P. 89–98. https://doi.org/10.1080/10611860600965914
Kumar P.V., Asthana A., Dutta T., Jain N.K. // J. Drug Target. 2006. V. 14. P. 546–556. https://doi.org/10.1080/10611860600825159
Le-Deygen I.M., Kudryashova E.V. // Moscow Univ. Chem. Bull. 2018. V. 73. P. 69–73. https://doi.org/10.3103/S0027131418020074
Deygen I.M., Seidl C., Kölmel D.K., Kudryashova E.V., Brase S., Schepers U. // Langmuir. 2016. V. 32. P. 10861–10869. https://doi.org/10.1021/acs.langmuir.6b01023
Parveen S., Sahoo S. // Clin. Pharmacokinet. 2006. V. 45. P. 965–988. https://doi.org/10.2165/00003088-200645100-00002
Rajan M., Raj V. // Int. J. Pharm. Pharm. Sci. 2012. V. 4. P. 255. https://doi.org/10.1016/j.ijpharm.2013.06.030
Raviv L., Jaron-Mendelson M., David A. // Mol. Pharm. 2015. V. 12. P. 453–462. https://doi.org/10.1021/mp5005492
Gou M.L., Dai M., Li X., Yang L., Huang M., Wang Y., Kan B., Lu Y., Wei Y., Qian Z. // Coll. Surf. B Biointer. 2008. V. 64. P. 135–139. https://doi.org/10.1016/j.colsurfb.2007.12.014
D’Addio S.M., Baldassano S., Shi L., Cheung L., Adamson D.H., Bruzek M., Anthony J.E., Laskin D.L., Sinko P.J., Prud’homme R.K. // J. Control. Rel. 2013. V. 168. P. 41–49. https://doi.org/10.1016/j.jconrel.2013.02.004
Gómez-García M., Benito J.M., Rodríguez-Lucena D., Yu J.-X., Chmurski K., Mellet C.O., Gallego R.G., Maestre A., Defaye J., Fernández J.M.G // J. Am. Chem. Soc. 2005. V. 127. P. 7970–7971. https://doi.org/10.1021/ja050934t
Yuan Z., Ye Y., Gao F., Yuan H., Lan M., Lou K., Wang W. // Int. J. Pharm. 2013. V. 446. P. 191–198. https://doi.org/10.1016/j.ijpharm.2013.02.024
Rodríguez-Lavado J., de la Mata M., Jiménez-Blanco J.L., García-Moreno M.I., Benito J.M., Díaz-Quintana A., Sánchez-Alcázar J.A., Higaki K., Nanba E., Ohno K., Suzuk Y., Mellet C.O., García Fernández J.M. // Org. Biomol. Chem. 2014. V. 12. P. 2289–2301. https://doi.org/10.1039/C3OB42530D
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия