Биоорганическая химия, 2022, T. 48, № 2, стр. 223-231
Компьютерное моделирование дырочного транспорта по центральной спирали малой субъединицы рибосомы
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: sosorev@physics.msu.ru
Поступила в редакцию 23.07.2021
После доработки 16.08.2021
Принята к публикации 19.08.2021
- EDN: VJWZCQ
- DOI: 10.31857/S0132342322020221
Аннотация
Слаженная работа различных частей рибосомы в процессе синтеза белка предполагает наличие механизма, который координирует их действия, однако этот механизм до сих пор неизвестен. Роль такого механизма может играть транспорт носителей заряда (электронов или дырок) по молекулам рРНК и тРНК и локализация этих носителей заряда в функционально значимых областях рибосомы. В настоящей работе на основе расчетов методом теории функционала плотности показана возможность дырочного транспорта по центральному элементу малой субъединицы рибосомы – спирали h44. С помощью метода Монте-Карло выявлено, что дырки имеют тенденцию к локализации в определенных функционально значимых областях исследуемого фрагмента РНК, которые расположены вблизи декодирующего центра и межсубъединичных мостиков. На основании полученных данных предположено, что транспорт и локализация дырок в пределах спирали h44 координируют относительное движение субъединиц рибосомы с другими процессами, происходящими при трансляции.
ВВЕДЕНИЕ
Рибосома – молекулярная машина, отвечающая за процесс трансляции (синтеза белка из аминокислот на основе матрицы мРНК) во всех живых организмах. За последние десятилетия структура рибосомы изучена достаточно хорошо [1], и выявлены ее масштабные изменения при трансляции [2–5]. Однако физические механизмы, обусловливающие работу этой молекулярной машины, до сих пор остаются предметом дискуссии. В частности, экспериментальные данные говорят о том, что относительное движение и изменение конформации участников процесса трансляции – рибосомы, тРНК и мРНК – скоррелированы между собой [4–7]. Например, движение тРНК через рибосому синхронизовано с движением мРНК [3, 6, 8], масштабными изменениями конформации тРНК [9] и рибосомы [4, 5, 10, 11], а также химическими реакциями – гидролизом GTP в факторах трансляции [9] и присоединением аминокислоты к растущей пептидной цепи [12]. Кроме того, при комплементарном связывании кодона мРНК с антикодоном тРНК в декодирующем центре тРНК изменяет свою форму (происходит аккомодация тРНК) [13], а плечо малой субъединицы рибосомы сдвигается, запуская процесс гидролиза GTP в факторе трансляции EF-Tu [13, 14]. При этом функционально активные центры рибосомы и тРНК, в которых происходят вышеупомянутые процессы (в том числе декодирующий центр, каталитический центр, области существенных изменений конформации), удалены друг от друга на значительное расстояние (до 9 нм).
Слаженная работа различных частей рибосомы позволяет предположить наличие механизма, который координирует их действия [6, 15, 16], однако этот механизм до сих пор неизвестен. Относительно него было выдвинуто несколько гипотез, в основном механистического характера [6, 15, 16]. Нами было недавно предположено, что согласованное действие элементов рибосомы может быть обусловлено транспортом зарядов (дырок) вдоль молекул рРНК и тРНК, что приводит к локализации зарядов в определенных областях и последующим конформационным изменениям последних [17]. Электронный/дырочный (не ионный) транспорт зарядов по РНК возможен благодаря π-стэкингу азотистых оснований, который может приводить к значительному перекрыванию π-электронных систем нуклеотидов. Адекватность выдвинутой гипотезы была подтверждена с помощью компьютерного моделирования: показано, что эффективный дырочный транспорт возможен по молекуле тРНК, а также по участку рРНК, соединяющему железно-серный кластер Fe4S4 и декодирующий центр. Однако возможность транспорта заряда по другим участкам рибосомы (структурная основа которой – молекулы рРНК), а следовательно, возможность “электронной” координации их работы, не были исследованы.
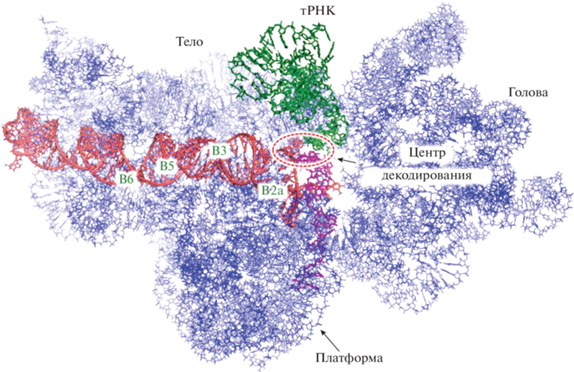
Рибосома состоит из двух субъединиц, большой и малой, в пространство между которыми поступают и передвигаются по нему молекулы тРНК и мРНК. Один из важных элементов малой субъединицы рибосомы – спираль h44, расположенная в центре субъединицы со стороны межсубъединичного пространства (рис. 1). Эта спираль принимает непосредственное участие в процессе декодирования: в частности, входящие в нее консервативные нуклеотиды А1492 и А1493 (здесь и далее нумерация нуклеотидов соответствует принятой для бактериальной рибосомы Escherichia coli) детектируют комплементарность антикодона кодону [2]. Спираль h44 играет также важную роль при инициации трансляции [18]. Наконец, нуклеотиды спирали h44 включены в ряд межсубъединичных мостиков (например, B2, B3, B5, B6), необходимых для поддержания структурной целостности рибосомы [1, 19] и/или модулирующих относительное движение субъединиц [5, 20]. Важная роль спирали h44 в процессе трансляции подчеркивается тем, что мутации в ней [21] и связывание с ней антибиотиков [22] критически влияют на функционирование рибосомы.
Рис. 1.
Положение спирали h44 относительно других элементов малой субъединицы рибосомы, тРНК и мРНК. Спираль h44 показана красным цветом, тРНК в А-сайте – зеленым, мРНК – малиновым, рРНК (кроме h44) – синим. Межсубъединичные мостики, образованные с участием h44, обозначены B2a–B6.
Цель настоящей работы – демонстрация возможности дырочного транспорта по спирали h44 с помощью компьютерного моделирования, а именно расчетов методом теории функционала плотности (DFT) и кинетического метода Монте-Карло.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для моделирования транспорта заряда по спирали h44 использовали модель прыжкового транспорта, качественно описывающую движение локализованного носителя заряда при наличии энергетического беспорядка [23, 24]. В качестве сайтов, между которыми происходят прыжки носителей заряда, рассматривали азотистые основания – π-сопряженные части нуклеотидов, по которым возможен электронный и дырочный транспорт [25] (несопряженный сахаро-фосфатный остов считали не вовлеченным в транспорт). Скорости переходов между сайтами описывали с использованием формулы Маркуса [26]:
(1)
${{k}_{{ab}}} = \frac{{2\pi }}{\hbar }\frac{{J_{{ab}}^{2}}}{{\sqrt {2\pi {{\lambda }_{{ab}}}{{k}_{{\text{B}}}}T} }}\exp \left( { - \frac{{{{{\left( {\Delta {{E}_{{ab}}} - {{\lambda }_{{ab}}}} \right)}}^{2}}}}{{4{{\lambda }_{{ab}}}{{k}_{{\text{B}}}}T}}} \right),$Рассчитанные с помощью DFT значения энергии азотистых оснований Ea, встречающихся в исследуемом фрагменте РНК, представлены на рис. 2а. Наибольшую энергию HOMO имеет гуанин, а наименьшую энергию LUMO – урацил, данные результаты находятся в согласии с предыдущими работами [17, 27]. Метилированные цитозины 5MC и 4MC имеют несколько более высокие уровни энергии, чем цитозин. Поскольку по уравнению (1) перенос заряда с сайта с большей энергией на сайт с меньшей энергией более вероятен, чем обратный перенос, основания с наиболее низкими значениями энергии носителя заряда (в случае дырочного транспорта – с наиболее высоким уровнем HOMO, в случае электронного – наиболее низким уровнем LUMO) могут оказываться центрами локализации [17]. Таким образом, дырки должны иметь тенденцию к локализации на гуанинах, а электроны – на урацилах. Стоит также отметить, что уровни энергии LUMO всех азотистых оснований находятся выше –1 эВ, что препятствует эффективному транспорту электронов по азотистым основаниям [28]. Напротив, уровни энергии HOMO лежат в диапазоне, благоприятном для транспорта дырок [28]. В связи с этим в настоящей работе рассмотрен только дырочный транспорт. Энергии реорганизации при переносе дырки, представленные на рис. 2б, велики для всех азотистых оснований, кроме цитозина, и превышают 500 мэВ. Это уменьшает вероятность переноса заряда на основание с большей энергией и, соответственно, способствует локализации дырок на гуанинах. Энергия реорганизации для метилированных цитозинов несколько превышает таковую для цитозина.
Рис. 2.
Энергии HOMO, LUMO (а) и энергии реорганизации (б) различных азотистых оснований с метильной группой в 1-м положении. Помимо значений для стандартных азотистых оснований РНК (G, A, C, U), на рисунке отмечены значения для модифицированных цитозинов – 5-метилцитозина (5MC) и 4-метилцитозина (4МC), присутствующих в исследуемом фрагменте.
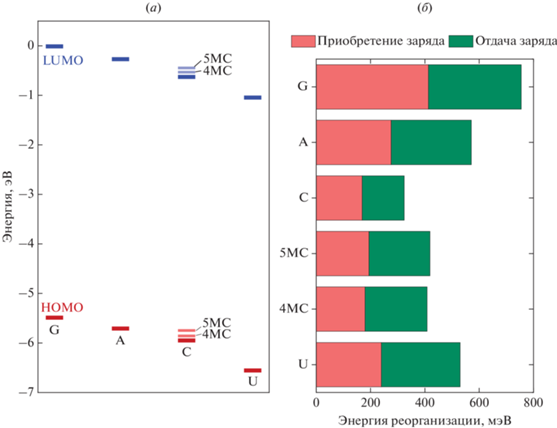
Рис. 3.
Интегралы переноса дырки между различными азотистыми основаниями спирали h44. Толщина цилиндров отражает величину интегралов переноса, интегралы переноса <5 мэВ не показаны.
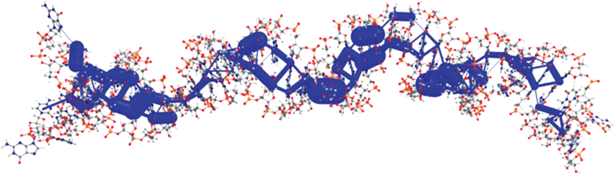
Интегралы переноса дырки между различными азотистыми основаниями спирали h44 представлены на рис. 3. Из этого рисунка видно, что практически между всеми соседними азотистыми основаниями имеются значительные интегралы переноса, превышающие 25 мэВ – характерную энергию тепловых флуктуаций при комнатной температуре. Наличие существенных интегралов переноса обеспечивает принципиальную возможность транспорта зарядов по h44. Многие из интегралов переноса превышают 100 мэВ (типичное значение J в органических полупроводниках с высокой подвижностью зарядов [29]), а максимальные значения J достигают 180 мэВ. Поскольку скорость перехода носителя заряда между основаниями возрастает с увеличением Jab (см. уравнение (1)), есть все основания полагать, что дырка может перемещаться вдоль спирали h44. Это наблюдение согласуется с результатами нашей предыдущей работы [17], в которой с помощью компьютерного моделирования была показана возможность транспорта дырок по тРНК и участку рРНК, а также теоретических [27, 30, 31] и экспериментальных [32, 33] работ по транспорту заряда в близкой по структуре молекуле – ДНК. Наконец, стоит отметить, что некоторые нуклеотиды спирали h44 имеют ненулевые интегралы переноса (до 15 мэВ) с нуклеотидами спиралей h13 и h18, что обусловливает возможность перехода дырки со спирали h44 на соседние элементы рибосомы и/или обратно.
Полученное в результате моделирования транспорта заряда методом Монте-Карло распределение вероятности обнаружения дырки на различных сайтах в зависимости от ее начального положения представлено на рис. 4a. Диагональ, проходящая через точку (0.0) на этом рисунке, соответствует случаю, когда дырки не покидают начальных сайтов. Наличие большого числа точек вне этой диагонали свидетельствует о перемещении дырки по РНК. При этом наличие вертикальных полос говорит о тенденции дырок к локализации на определенных основаниях, а сами эти полосы соответствуют сайтам, которые “собирают” дырки со своего окружения (т.е. сайтам локализации дырок). На рис. 4б показаны суммарные вероятности обнаружения дырки на различных сайтах (при условии равновероятного распределения ее начального положения), что позволяет более наглядно выявить потенциальные сайты локализации. Из этого рисунка следует, что такими сайтами являются, в первую очередь, нуклеотиды G1405, G1475 и G1496, кроме того, высока вероятность локализации на G1416, G1432 и G1454. Как и ожидалось (см. выше), все они – гуанины. Отметим, что в настоящей работе не учитывался тот факт, что наличие рядом с гуанином других гуанинов способствует локализации дырки при большом интеграле переноса, поскольку такая последовательность имеет более высокую энергию HOMO [34], учет данного факта может усилить тенденцию к локализации дырок на G1416, G1454 и G1475.
Рис. 4.
Локализация дырок на спирали h44. (a) – Вероятность обнаружения дырки на различных основаниях в течение 10 нс в зависимости от ее начального положения. Нумерация сайтов начинается с 1400; (б) – усредненная по начальному положению дырки вероятность ее обнаружения на различных основаниях; (в) – расположение сайтов локализации дырок на h44. Цвет оснований соответствует их типам: зеленый – G, бирюзовый – A, желтый – C, красный – U, оранжевый – 5MC (5-метилцитозин), фиолетовый – 4MC (4-метилцитозин). Межсубъединичные мостики, расположенные вблизи сайтов локализации, обозначены B2a, B3, B5 и B6.
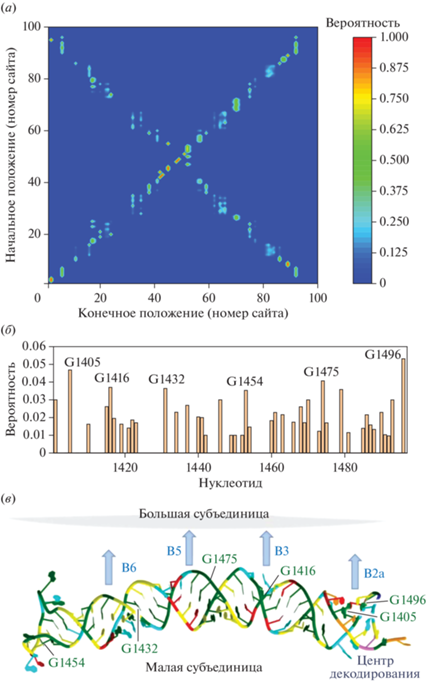
Расположение выявленных сайтов локализации дырки на спирали h44 представлено на рис. 4в. Из этого рисунка можно сделать вывод о том, что эти сайты находятся вблизи функционально важных областей рибосомы – декодирующего центра и субъединичных мостиков. В частности, G1405 и G1496 – сайты с наибольшей вероятностью локализации дырки – находятся в непосредственной близости от декодирующего центра и являются частью межсубъединичного мостика B2а, G1475 – часть мостика B5, а G1416 и G1432 находятся вблизи мостиков B3 и B6 соответственно [21, 35]. Локализация дырки на межсубъединичных мостиках может влиять на относительное движение субъединиц, являющееся неотъемлемой частью транслокации – перемещения тРНК и мРНК при трансляции. В связи с этим мы предполагаем, что такая локализация может играть роль “защелки”, которая обеспечивает согласование транслокации с другими процессами, необходимыми для трансляции [2, 5], препятствуя относительному движению субъединиц в определенные моменты времени. В пользу данной гипотезы говорит тот факт, что замена гуанинов G1475 и G1476 на урацил подавляет синтез белка рибосомами при определенных условиях [21]. Локализация дырки вблизи декодирующего центра может привести к ее переходу на тРНК в случае комплементарного связывания кодона и антикодона и конформационным изменением последней, необходимым для ее аккомодации [17].
На спирали h44 можно выделить ряд “бассейнов”, попав в каждый из которых, дырка локализуется на соответствующем сайте. В рамках использованной модели переход дырки между бассейнами не происходит, несмотря на наличие значительных интегралов переноса на протяжении всей спирали h44, которые обусловливают принципиальную возможность транспорта зарядов. Однако использовавшаяся в данной работе прыжковая модель транспорта зарядов – одна из наиболее простых, применяемых для описания транспорта зарядов по нуклеиновым кислотам [27]. В частности, она не учитывает влияние окружения на энергии сайтов, возможную делокализацию заряда по нескольким сайтам, модуляцию интегралов переноса заряда и энергий сайтов низкочастотными колебаниями и другие эффекты. Последний фактор может в значительной мере способствовать переходам заряда между бассейнами. Действительно, известно, что для кристаллических органических полупроводников тепловые флуктуации энергии носителей заряда на молекулах (сайтах) и интегралов переноса между молекулами приводит к “выбиванию” носителей заряда из ловушек (сайтов с наиболее низкой энергией носителя заряда – аналог сайтов локализации) [36, 37]. Иными словами, динамический беспорядок сглаживает статический, тем самым значительно увеличивая подвижность зарядов при определенных условиях [36]. Аналогичный эффект может проявляться и для рРНК (в частности, спирали h44), у которой стандартное отклонение энергий сайтов за счет тепловых флуктуаций должно быть больше, чем в более жестких кристаллических органических полупроводниках (50–100 мэВ [38]). Принципиальное условие для этого эффекта – наличие интегралов переноса между сайтами, показанное выше (рис. 3).
Для проверки предположения о влиянии тепловых флуктуаций на возможность перехода носителя заряда между бассейнами локализации нами были проведены оценочные расчеты, в которых скорости переходов между сайтами из уравнения (1) умножали на фактор exp(–dE/4kT), где отличие энергии от равновесного значения, dE, – случайная величина с гауссовым распределением, нулевым средним значением и стандартным отклонением σ. Добавление указанного фактора – не строгое следствие уравнения (1) при наличии гауссова беспорядка энергий сайтов, но в нулевом приближении это позволяет оценить влияние флуктуаций на скорости переходов при σ ~ λ (см. дополнительные материалы, уравнения (S1) и (S2)). Полученное распределение вероятности обнаружения дырки на различных сайтах в зависимости от ее начального положения, представленное в дополнительных материалах (рис. S1 ), показывает, что при тепловых флуктуациях энергии сайтов действительно возможен переход носителя заряда из одного бассейна в другой, вследствие чего сайты локализации с наименьшей энергией собирают дырки с большего числа сайтов. Более того, носители заряда могут переноситься из одного бассейна в другой нелинейными локализованными волнами возмущения конформации нуклеиновой кислоты, подобными бризерам в ДНК [39].
На основе вышеизложенного мы предполагаем, что за счет динамического беспорядка и/или возмущений конформации могут происходить переходы носителя заряда между различными бассейнами, обеспечивающие возможность транспорта заряда по спирали h44 на значительные расстояния. Такой транспорт заряда на дальние расстояния может быть особенно важен для “электронного управления” работой рибосомы. Однако моделирование транспорта заряда с учетом влияния тепловых флуктуаций энергий сайтов и возмущений конформации требует дальнейших исследований, значительно выходящих за рамки настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Параметры прыжковой модели транспорта зарядов (см. уравнение (1)) – Eab, Jab, λ – были рассчитаны методом DFT в пакете GAMESS [40, 41] с использованием функционала CAM-B3LYP (для энергий реорганизации) или B3LYP (в остальных случаях) и базисного набора 6-31g(d). Это приближение хорошо описывает различные свойства нуклеотидов [42–45], в том числе зарядово-транспортные свойства [46]. Энергии носителя заряда на сайтах аппроксимировали энергиями граничных орбиталей – HOMO для дырок и LUMO для электронов. Для расчета требуемых параметров нуклеотиды были заменены азотистыми основаниями с метильными группами вместо сахаро-фосфатных остатков. Интегралы переноса Jab рассчитывали с помощью проекционного метода (DIPRO) [47–49]. Расчеты были проведены для вакуума; ранее было показано, что учет растворителя (воды) изменяет Jab не более чем на 20% [17]. Энергию реорганизации рассчитывали в рамках стандартной модели адиабатических потенциалов [50] как сумму энергий релаксации при потере носителя заряда сайтом a, λa,dis, и при приобретении носителя заряда сайтом b, λb,ch:
ЗАКЛЮЧЕНИЕ
С помощью компьютерного моделирования показано, что между нуклеотидами центрального элемента малой субъединицы рибосомы (спирали h44) имеется сильное электронное взаимодействие – существенные интегралы переноса дырки, способствующие дырочному транспорту вдоль спирали h44. Выявлены сайты локализации дырок, “собирающие” дырки с окружающих нуклеотидов, эти области расположены вблизи важных функциональных элементов рибосомы – декодирующего центра и межсубъединичных мостиков. На основе полученных данных предположено, что локализация дырки в упомянутых сайтах может влиять на относительное движение субъединиц и являться “защелкой”, согласующей это движение с другими процессами, происходящими при трансляции. Полученные результаты могут внести значительный вклад в понимание процесса трансляции, в частности способствовать выявлению механизма, координирующего согласованную работу различных частей рибосомы.
Список литературы
Schuwirth B.S., Borovinskaya M.A., Hau C.W., Zhang W., Vila-Sanjurjo A., Holton J.M., Cate J.H.D. // Science. 2005. V. 310. P. 827–834. https://doi.org/10.1126/science.1117230
Agirrezaballa X., Frank J. // Q. Rev. Biophys. 2009. V. 42. P. 159–200. https://doi.org/10.1017/S0033583509990059
Prabhakar A., Choi J., Wang J., Petrov A., Puglisi J.D. // Protein Sci. 2017. V. 26. P. 1352–1362. https://doi.org/10.1002/pro.3190
Ling C., Ermolenko D.N. // WIREs RNA. 2016. V. 7. P. 620–636. https://doi.org/10.1002/wrna.1354
Finkelstein A.V., Razin S.V., Spirin A.S. // Mol. Biol. 2018. V. 52. P. 799–811. https://doi.org/10.1134/S0026893318060080
Makarova T.M., Bogdanov A.A. // Biochimie. 2019. V. 167. P. 179–186. https://doi.org/10.1016/j.biochi.2019.09.019
Noller H.F., Yusupov M.M., Yusupova G.Z., Baucom A., Cate J.H.D. // FEBS Lett. 2002. V. 514. P. 11–16. https://doi.org/10.1016/S0014-5793(02)02327-X
Belardinelli R., Sharma H., Caliskan N., Cunha C.E., Peske F., Wintermeyer W., Rodnina M.V. // Nat. Struct. Mol. Biol. 2016. V. 23. P. 342–348. https://doi.org/10.1038/nsmb.3193
Li W., Agirrezabala X., Lei J., Bouakaz L., Brunelle J.L., Ortiz-Meoz R.F., Green R., Sanyal S., Ehrenberg M., Frank J. // EMBO J. 2008. V. 27. P. 3322–3331. https://doi.org/10.1038/emboj.2008.243
Noller H.F., Lancaster L., Mohan S., Zhou J. // Q. Rev. Biophys. 2017. V. 50. P. e12. https://doi.org/10.1017/S0033583517000117
Paci M., Fox G.E. // RNA Biol. 2016. V. 13. P. 524–530. https://doi.org/10.1080/15476286.2015.1114204
Gindulyte A., Bashan A., Agmon I., Massa L., Yonath A., Karle J. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 13327–13332. https://doi.org/10.1073/pnas.0606027103
Loveland A.B., Demo G., Grigorieff N., Korostelev A.A. // Nature. 2017. V. 546. P. 113–117. https://doi.org/10.1038/nature22397
Rodnina M.V., Fischer N., Maracci C., Stark H. // Phil. Trans. R. Soc. B. 2016. V. 372. P. 20160182. https://doi.org/10.1098/rstb.2016.0182
Poirot O., Timsit Y. // Sci. Rep. 2016. V. 6. P. 26485. https://doi.org/10.1038/srep26485
Kürkçüoğlu Ö. // Turk. J. Biol. 2018. V. 42. P. 392–404. https://doi.org/10.3906/biy-1802-77
Sosorev A.Yu., Kharlanov O.G. // Phys. Chem. Chem. Phys. 2021. V. 23. P. 7037–7047. https://doi.org/10.1039/D0CP04970K
Qin D., Liu Q., Devaraj A., Fredrick K. // RNA. 2012. V. 18. P. 485–495. https://doi.org/10.1073/pnas.1507703112
Gao H., Sengupta J., Valle M., Korostelev A., Eswar N., Stagg S.M., Van Roey P., Agrawal R.K., Harvey S.C., Sali A., Chapman M.S., Frank J. // Cell. 2003. V. 113. P. 789–801. https://doi.org/10.1016/s0092-8674(03)00427-6
Shaikh T.R., Yassin A.S., Lu Z., Barnard D., Meng X., Lu T.-M., Wagenknecht T., Agrawal R.K. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 9822–9827. https://doi.org/10.1073/pnas.1406744111
Sun Q., Vila-Sanjurjo A., O’Connor M. // Nucleic Acids Res. 2010. V. 39. P. 3321–3330. https://doi.org/10.1093/nar/gkq1253
Prokhorova I., Altman R.B., Djumagulov M., Shrestha J.P., Urzhumtsev A., Ferguson A., Chang C.-W.T., Yusupov M., Blanchard S.C., Yusupova G. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. E10899–E10908. https://doi.org/10.1073/pnas.1715501114
Köhler A., Bässler H. // Electronic Processes in Organic Semiconductors: an Introduction. Wiley-VCH, Weinheim, 2015.
Oberhofer H., Reuter K., Blumberger J. // Chem. Rev. 2017. V. 117. P. 10319–10357. https://doi.org/10.1021/acs.chemrev.7b00086
Sosorev A.Yu., Dominskiy D.I., Chernyshov I.Yu., Efremov R.G. // Int. J. Mol. Sci. 2020. V. 21. P. 5654–5654. https://doi.org/10.3390/ijms21165654
Marcus R.A. // J. Chem. Phys. 1956. V. 24. P. 966–978. https://doi.org/10.1063/1.1742723
Venkatramani R., Keinan S., Balaeff A., Beratan D.N. // Coord. Chem. Rev. 2011. V. 255. P. 635–648. https://doi.org/10.1016/j.ccr.2010.12.010
Kotadiya N.B., Mondal A., Blom P.W.M., Andrienko D., Wetzelaer G.-J.A.H. // Nat. Materials. 2019. V. 18. P. 1182–1186. https://doi.org/10.1038/s41563-019-0473-6
Sosorev A.Yu. // Materials & Design. 2020. V. 192. P. 10873. https://doi.org/10.1016/j.matdes.2020.108730
Lakhno V.D. // Int. J. Quant. Chem. 2008. V. 108. P. 1970–1981. https://doi.org/10.1002/qua.21717
Troisi A., Orlandi G. // J. Phys. Chem. B. 2002. V. 106. P. 2093–2101. https://doi.org/10.1021/jp0133182
O’Brien E., Holt M.E., Thompson M.K., Salay M.E., Ehlinger A.C., Chazin W.J., Barton J.K. // Science. 2017. V. 355. P. eaag1789. https://doi.org/10.1126/science.aag1789
McDonnell K.J., Chemler J.A., Bartels P.L., O’Brien E., Marvin M.L., Ortega J., Stern R.H., Raskin L., Li G.-M., Sherman D.H., Barton J.K, Gruber S.B. // Nat. Chem. 2018. V. 10. P. 873–880. https://doi.org/10.1038/s41557-018-0068-x
Rooman M., Wintjens R. // J. Biomol. Struct. Dyn. 2014. V. 32. P. 532–545. https://doi.org/10.1080/07391102.2013.783508
Liu Q., Fredrick K. // J. Mol. Biol. 2016. V. 428. P. 2146–2164. https://doi.org/10.1074/jbc.M115.697789
Ortmann F., Roche S. // Phys. Rev. B. 2011. V. 84. P. 180302(R). https://doi.org/10.1103/PhysRevB.84.180302
Fratini S., Mayou D., Ciuchi S. // Adv. Funct. Mater. 2016. V. 26. P. 2292–2315. https://doi.org/10.1002/adfm.201502386
Yavuz I., Martin B.N., Park J., Houk K.N. // J. Am. Chem. Soc. 2015. V. 137. P. 2856−2866. https://doi.org/10.1021/ja5076376
Четвериков А.П., Сергеев К.С., Лахно В.Д. // Мат. биол. и биоинф. 2018. Т. 13. С. 1–12. https://doi.org/10.17537/2018.13.1
Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T., Gordon M.S., Jensen J.H., Koseki S., Matsunaga N., Nguyen K.A., Su S., Windus T.L., Dupuis M., Montgomery J.A., Jr. // J. Comput. Chem. 1993. V. 14. P. 1347–1363. https://doi.org/10.1002/jcc.540141112
Gordon M.S., Schmidt M.W. // In: Theory and Applications of Computational Chemistry: the First Forty Years / Eds. Dykstra C.E., Frenking G., Kim K.S., Scuseria, G.E. Amsterdam: Elsevier, 2005. P. 1167–1189. https://doi.org/10.1016/b978-044451719-7/50084-6
Lopes R.P., Marques M.P.M., Valero R., Tomkinson J., de Carvalho L.A.E.B. // J. Spectroscopy. 2012. V. 27. P. 168286. https://doi.org/10.1155/2012/168286
Ivanov A.Yu., Stepanian S.G., Karachevtsev V.A., Adamowicz L. // Low Temperature Physics. 2019. V. 45. P. 1008–1017. https://doi.org/10.1063/1.5121271
Adhikary A., Kumar A., Khanduri D., Sevilla M.D. // J. Am. Chem. Soc. 2008. V. 130. P. 10282–10292. https://doi.org/10.1021/ja802122s
Szekeres Z., Bogár F., Ladik J. // Int. J. Quantum Chem. 2005. V. 102. P. 422–426. https://doi.org/10.1002/qua.20394
Kitoh-Nishioka H., Ando K. // Chem. Phys. Lett. 2015. V. 621. P. 96–101. https://doi.org/10.1016/j.cplett.2014.12.057
Baumeier B., Kirkpatrick J., Andrienko D. // Phys. Chem. Chem. Phys. 2010. V. 12. P. 11103–11113. https://doi.org/10.1039/C002337J
Kirkpatrick J. // Int. J. Quantum Chem. 2008. V. 108. P. 51–56. https://doi.org/10.1002/qua.21378
Kobayashi H., Kobayashi N., Hosoi S., Koshitani N., Murakami D., Shirasawa R., Kudo Y., Hobara D., Tokita Y., Itabashi M. // J. Chem. Phys. 2013. V. 139. P. 014707. https://doi.org/10.1063/1.4812389
Li Y., Coropceanu V., Brédas J.-L. // Wspc Reference on Organic Electronics: Organic Semiconductors / Eds. Marder S.R., Brédas J.-L. Singapore: World Scientific Publishing Company, 2016. Chapter 7. P. 193–230.
Rozov A., Khusainov I., Omari K.E., Duman R., Mykhaylyk V., Yusupov M., Westhof E., Wagner A., Yusupova G. // Nat. Commun. 2019. V. 10. P. 2519–2519. https://doi.org/10.1038/s41467-019-10409-4
Дополнительные материалы
- скачать ESM.docx
- ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ К ПУБЛИКАЦИИ
Рис. S1. Распределение вероятности найти дырку на различных основаниях в течение 100 нс в зависимости от ее начального положения.
Рис. S2. Оценка усредненной по начальному положению дырки вероятности ее обнаружения на различных сайтах (нуклеотидах) с учетом флуктуаций энергии сайтов (σ = 500 мэВ).
Инструменты
Биоорганическая химия


