Биоорганическая химия, 2022, T. 48, № 2, стр. 207-216
Современные сведения о казеинах молока
С. Ю. Петрова 1, *, С. В. Хлгатян 1, О. Ю. Емельянова 1, Л. А. Пищулина 1, В. М. Бержец 1
1 ФГБНУ “Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова” Министерства науки и высшего образования Российской Федерации
105064 Москва, Малый Казённый переулок, 5а, Россия
* E-mail: laball@yandex.ru
Поступила в редакцию 23.05.2021
После доработки 06.08.2021
Принята к публикации 17.08.2021
- EDN: FSAULZ
- DOI: 10.31857/S0132342322020178
Аннотация
Коровье молоко – один из наиболее частых триггеров пищевой аллергии у детей. Полагают, что главную роль в развитии клинических симптомов аллергических реакций у взрослых играют белки казеины, входящие в состав молока. К настоящему времени изучены основные физико-химические и иммунобиологические свойства казеинов и определена их первичная структура. Однако вопрос об особенностях структурной организации казеиновых мицелл коровьего молока до сих пор вызывает много научных споров. Расшифровка конформационной структуры казеинов, поиск новых IgE-связывающих эпитопов позволят выявить механизмы снижения аллергенной активности казеинов коровьего молока. Цель данного обзора – обобщить имеющиеся данные о структуре и свойствах казеиновых белков молока и определить их роль в формировании сенсибилизации к молочным продуктам. В обзоре описаны молекулярные характеристики, физико-химические свойства и иммунобиологические функции казеинов коровьего молока, а также изложены основные теоретические знания о структуре казеиновой мицеллы. Детально разобрана первичная структура различных типов казеинов: αs1-, αs2-, β- и κ-казеинов. Проведен сравнительный анализ содержания аминокислотных остатков в полипептидных цепях казеинов вышеуказанных типов. Выявлены участки гликозилирования, гидрофобные и гидрофильные области молекул. Проведена сравнительная характеристика основных казеинов женского грудного (β-казеин, κ-казеин) и коровьего молока. Затронуты актуальные вопросы аллергенной активности казеинов коровьего молока и их перекрестной реактивности с белками молока других видов млекопитающих. Дальнейшее изучение физико-химических и иммунобиологических свойств казеинов будет способствовать разработке различных стратегий снижения аллергических реакций, вызванных потреблением молока. Одни подходы будут направлены на изменение структуры аллергена методом технологической обработки молока, другие – на снижение чувствительности к аллергенам молока с помощью иммунотерапии.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.......................................................207
ХАРАКТЕРИСТИКА КАЗЕИНОВ..................208
СТРОЕНИЕ КАЗЕИНОВОЙ МИЦЕЛЛЫ......210
КАЗЕИНЫ ЖЕНСКОГО ГРУДНОГО МОЛОКА...........................................................212
АЛЛЕРГИЯ НА БЕЛКИ КОРОВЬЕГО МОЛОКА...........................................................212
ЗАКЛЮЧЕНИЕ..................................................214
СПИСОК ЛИТЕРАТУРЫ.................................214
ВВЕДЕНИЕ
Питание ребенка первого года жизни оказывает огромное влияние на созревание его иммунной системы, обеспечивает гармоничное физическое и психическое развитие. Женское грудное молоко признано “золотым стандартом” питания детей грудного возраста [1, 2]. При невозможности грудного вскармливания используют искусственные заменители материнского молока [2]. Основа большинства молочных смесей – коровье молоко. Начиная с первого года и в течение всей жизни, коровье молоко и производимые из него продукты составляют весомую часть пищевого рациона человека [3]. Аллергия на коровье молоко – это наиболее распространенная форма пищевой аллергии в раннем возрасте [4].
Сообщается, что в настоящее время 0.6–3.0% детей в возрасте до 6 лет, 0.3% детей старшего возраста и подростков и менее 0.5% взрослых страдают аллергией на коровье молоко. Интересно, что большинство детей с аллергией на молоко справляются, “перерастают” ее и в дальнейшем могут без вреда для здоровья потреблять молоко и молочные продукты. Однако у 15% детей аллергия на молоко сохраняется и во взрослой жизни [5].
В женском грудном молоке содержание белка составляет ~9 г/л, в то время как в коровьем – 32 г/л [2, 6]. В коровьем молоке преобладает казеиновая фракция, она составляет 76–86%, а на фракцию сывороточных белков приходится 14–24% от общего содержания белка в молоке. Иное соотношение казеиновых и сывороточных белков выявлено в женском грудном молоке, оно составляет 40 и 60% соответственно [6, 7]. Кроме того, имеются различия в соотношениях и содержании подклассов белков в составе коровьего и женского грудного молока [2]. Фракция αS1 семейства α-казеинов составляет самую большую долю в коровьем молоке. В отличие от коровьего, в женском грудном молоке преобладают β-казеины [6, 7]. Полагают, что пять IgE-связывающих эпитопов казеинов: два у αs1-казеина, один у αs2-казеина и два у κ-казеина – играют важную роль в формировании персистирующей аллергии, в связи с чем их считают основными аллергенами коровьего молока у взрослых [7].
Цель данного обзора заключается в обобщении имеющихся данных о структуре и свойствах казеиновых белков молока и определении их роли в формировании сенсибилизации к молочным продуктам.
ХАРАКТЕРИСТИКА КАЗЕИНОВ
Казеины (от лат. caseus – сыр) – основная белковая фракция молока, они составляют ~80% от содержания всех белков молока. В созданную в последние годы информационную базу аллергенов включены аллергены коровьего молока. В официальном списке Всемирной организации здравоохранения и Подкомитета по номенклатуре аллергенов Союза иммунологических обществ аллергены коровьего молока обозначаются латинским названием источника аллергена – bos domesticus (корова домашняя) [8, 9]. Согласно официальному списку аллергенов, казеины классифицируются под общим обозначением Bos d 8 [9]. Однако, несмотря на это общее название, отдельные компоненты казеинов получили различные идентифицирующие названия. Наиболее важными являются αs1- (Bos d 9), αs2- (Bos d 10), β- (Bos d 11) и κ- (Bos d 12) казеины [8], составляющие 40, 12.5, 35 и 12.5% фракции казеина в молоке соответственно. Казеины кодируются различными генами, расположенными в одной хромосоме [5]. Аллельный полиморфизм генов, кодирующих казеины молока, обусловливает их разнообразие [7]. Варианты полиморфизма представлены точечной заменой аминокислот, делецией пептидных фрагментов различного размера или посттрансляционными модификациями, такими как гликозилирование, фосфорилирование или частичный гидролиз, которые могут влиять на их свойства и аллергенный потенциал [10–12].
Казеины – фосфопротеины [7], они содержат 1–11 остатков фосфорной кислоты (органический фосфор), которые образуют сложноэфирную связь, главным образом, с гидроксигруппой серина. Содержание остатков серинфосфата в полипептидных цепях белка определяет его чувствительность к ионам кальция [6, 12–14]. По своей функции αs1-, αs2- и β-казеины – кальций-связывающие белки, κ-казеин – стабилизирующий белок [5].
Изучены физико-химические свойства и расшифрована первичная структура всех фракций казеина [11, 15]. Показано, что все казеины имеют молекулярную массу 19.0–25.2 кДа, изоэлектрическая точка (рI) 4.7. Первичная структура αs1-, αs2-, β- и κ-казеинов не имеет высокой гомологии [6, 15, 16]. Полипептидная цепь содержит большое количество пролина (17 Pro в αs1; 10 Pro в αs2; 35 Pro в β-казеине и 20 Pro в κ-казеине) [12]. Вторичные структуры, такие как α-спирали и β-листы, встречаются нечасто, что делает казеины гибкими, развернутыми или случайными спиральными пептидами, способными создавать межмолекулярные взаимодействия, например, электростатические, водородные и гидрофобные. Третичная структура – рыхлая невыраженная глобула [7, 12, 17, 18]. Четвертичная структура казеина называется мицеллой [7, 16, 17]. Она характеризуются центральным гидрофобным ядром (чувствительные к кальцию αs1-, αs2- и β-казеины) и периферическим гидрофильным слоем (κ-казеин) [11, 17].
В молоке казеины имеют выраженные кислотные свойства. Свободные карбоксильные группы аминокислот и гидроксильные группы фосфорной кислоты легко взаимодействуют не только с ионами кальция, но и другими солями щелочных и щелочноземельных металлов (Na+, К+, Mg2+), образуя казеинаты [14].
α-Казеин – самая крупная фракция коровьего молока, включает в себя фосфопротеины, способные осаждаться при низких концентрациях кальция [12, 14, 19].
αs1-Казеин (Bos d 9) – основная фракция казеина с молекулярной массой 23.6 кДа, содержащая 199 а.о., из которых 8.4% представлены пролином [15]. Фрагмент белка, содержащий отрицательный заряд, расположен между 41 и 80 а.о. и содержит восемь кислых фосфосеринов. Три гидрофобные области молекулы располагаются между 1–40, 90–110 и 130–199 а.о. [16, 19] (рис. 1).
Рис. 1.
Принципиальная схема линейного распределения заряженных гидрофильных и гидрофобных областей при рН 6.6 в наиболее распространенных генетических типах казеинов коровьего молока (по данным Konrad Т., 2017 [19]).
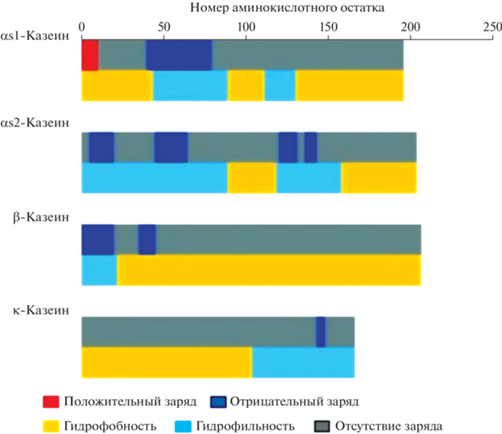
αs1-Казеин встречается в четырех модификациях (A, B, C и D), из которых наиболее распространена модификация B. Молекула представляет собой неорганизованную структуру, описываемую как “случайный клубок”, в которой имеется небольшое количество α-спиралей и β-листов, главным образом, вокруг поворотов [12, 16].
В недавних исследованиях показано, что αs1-казеины обладают свойством молекулярного шаперона. Они участвуют в сохранении и восстановлении правильной конформации некоторых внутриклеточных макромолекул в стрессовых условиях. αs1-Казеины могут стабилизировать белковые молекулы молока, в частности β-казеин и сывороточные белки, такие как β-лактоглобулин и бычий сывороточный альбумин, предотвращая их денатурацию и выпадение в осадок [12].
αs2-Казеины (Bos d 10) имеют молекулярную массу 25.2–25.4 кДа и содержат 207 а.о. Этот белок самый гидрофильный и имеет 10–13 остатков серинфосфата [15, 19]. Гидрофобные области расположены в диапазоне 90–120 и 160–207 а.о. [19] (рис. 1). Вторичная структура имеет мало α-спиралей и β-листов [12].
β-Казеин (Bos d 11) имеет молекулярную массу 24 кДа и содержит 209 а.о. Он представляет неорганизованный “случайный клубок”, в нем присутствуют струтуры β-листа и β-поворотов [12, 19]. β-Казеин – наиболее гидрофобный из всех казеинов [19, 20]. Он встречается в пяти генетических вариантах: А (A1, A2 и A3), B, C, D и E [11, 12, 21]. Бычий β-казеин обычно присутствует в виде одной формы с пятью фосфатами на остатках серина: Ser15, Ser17, Ser18, Ser19 и Ser35. Из них первые четыре образуют центр фосфорилирования [14, 20]. Только два генетических варианта данного белка (С и D), по-видимому, имеют измененные профили фосфорилирования [20]. β-Казеин имеет отрицательно заряженную гидрофильную N-концевую область (1–40 а.о.). Гидрофобные свойства белка возрастают от N- к С-концу с 136 по 209 а.о. [15, 19, 20, 22]. Вышеперечисленные свойства β-казеина, в отличие от других неструктурированных и неупорядоченных белков, при физиологических условиях и даже в кислой среде обусловливают его способность к самосборке в мицеллы. При этом гидрофобная часть молекулы β-казеина находится внутри мицеллы, а гидрофильная, в которой находится центр фосфорилирования – снаружи [19, 20, 23] (рис. 1). β-Казеин, как и αs1-казеин, обладает шаперонной активностью [12].
Ранее в качестве отдельной фракции рассматривался γ-казеин, содержание которого составляет 3% от общего количества казеина. Позже было показано, что γ-казеин идентичен С-концевой части β-казеина [22, 24]. Рядом исследователей высказано предположение, что γ-казеин – продукт деградации β-казеина, образующийся в результате трипсиноподобного протеолиза последнего [5, 22]. Показано, что β-казеин гидролизуется протеиназами молока (плазмин) в трех участках, в результате чего образуются γ1-, γ2- и γ3-казеины, протеазы и пептоны (термостабильные, растворимые в кислоте фосфопротеины) [24].
В отличие от α- и β-казеинов, κ-казеин (Bos d 12) – гликопротеид, содержащий ~5% углеводов. Молекула κ-казеина имеет молекулярную массу 19 кДа и состоит из 169 а.о. (в том числе двух остатков цистеина) и единичной фосфатной группы, связанной с серином [19]. Фрагмент 1–105 а.о. этой цепи гидрофобен и назван пара-κ-казеином. Гидрофильный С-концевой участок молекулы (гликомакропептид), 106–169 а.о., имеет отрицательный заряд при pH 6.6 и может нести тетрасахаридные цепи [15, 25, 26]. Гликозилированию подвергаются аминокислотные остатки треонина (Thr121, Thr131, Thr133, Thr135, Thr142, Thr165) и серина (Ser141) [27]. Олигосахарид на С-конце имеет отрицательно заряженную N-ацетилнейраминовую кислоту, что повышает отрицательный заряд С-концевой части данного казеина [25] (рис. 1 и 2).
Рис. 2.
Аминокислотная последовательность κ-казеина коровьего молока [8]. Красным цветом выделен фосфорилированный остататок серина, зеленым – остатки цистеина, способные образовывать дисульфидные связи, желтым – гликозилированные остатки треонина, голубым – вариантные аминокислотные остатки. Стрелкой отмечено место отщепления сычужным ферментом гликомакропептида от пара-κ-казеина.
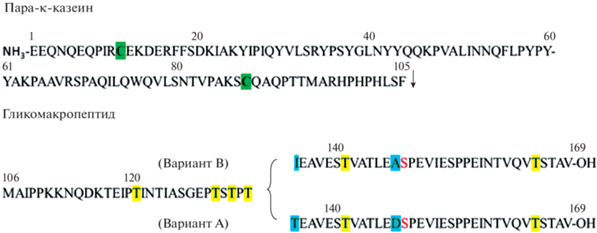
В зависимости от степени гликозилирования в молоке могут сосуществовать несколько изоформ κ-казеина. В зависимости от количества присоединенных олигосахаридов различают 11 вариантов κ-казеина. Количество сайтов гликозилирования может варьировать от 0 до 7, поэтому в молоке существуют как негликозилированные, так и гликозилированные изоформы [5]. Пара-κ-казеин встречается в двух основных вариантах А и В [11].
κ-Казеин содержит два остатка цистеина и может образовывать дисульфидные связи (Cys11 и Cys88) [25, 28, 29]. Показано, что κ-казеин, как и другие казеины, не имеет устойчивой трехмерной структуры, что позволяет ему при различных рН менять свою конформацию [30]. По сравнению с кальций-чувствительными αs- и β-казеинами, κ‑казеин нечувствителен к относительно высокому уровню кальция [26].
СТРОЕНИЕ КАЗЕИНОВОЙ МИЦЕЛЛЫ
Казеины формируют сложные агрегаты (мицеллы) [5, 12]. Фактическая внутренняя структура казеиновой мицеллы не до конца изучена, и для ее описания были построены различные модели [5, 16, 17]. Поскольку казеин является секретом эпителиальных клеток [14], структура мицеллы представляет собой результат эволюции и играет важную биологическую роль. Фосфат кальция связывается c казеиновыми молекулами, чтобы предотвратить образование амилоидных фибрилл в ткани молочных желез. Это позволяет женщине кормить новорожденного без негативных последствий [19].
В классической теории мицелла состоит из субмицелл [7, 31]. Электронно-микроскопические методы исследования доказывают субмицеллярное строение мицелл казеина [16, 27]. Показано, что тело мицеллы состоит из дискретных блоков и имеет не совсем сферическую форму. Образование мицелл протекает поэтапно в аппарате Гольджи [31, 32]. В зависимости от типа казеина образовавшаяся полипептидная цепочка подвергается гликозилированию (т.е. осуществляется присоединение углеводов к поверхности белковой глобулы) или/и фосфорилированию [26, 31, 32].
Диаметр субмицелл составляет 12–15 нм. Белки казеина в субмицеллах ориентированы гидрофобной частью в центр мицеллы, а гидрофильной – наружу. Связи между молекулами в субмицеллах – водородные, гидрофобные и электростатические [6, 17]. Молекулы казеинов, содержащие значительное количество фосфатных эфиров, несут большой отрицательный заряд. По мере насыщения субмицелл ионами Са2+ и фосфатов, субмицеллы начинают сливаться, образуя мицеллы [31, 32]. Субмицеллы соединяются коллоидным фосфатом кальция, последний имеет свободную связь и может образовывать кальциевый мостик между карбоксильными и серин-фосфатными группами молекул казеина [11, 32]. При присоединении кальция к гидроксильной группе остатка фосфорной кислоты образуется казеинат-кальций-фосфатный комплекс [14, 31, 32] (рис. 3).
Рис. 3.
Казеинат-кальций-фосфатный комплекс (по данным Рогожина В.В., 2014 [32]): (а) – связывание карбоксильных групп, (б) – связывание серинфосфатных групп.
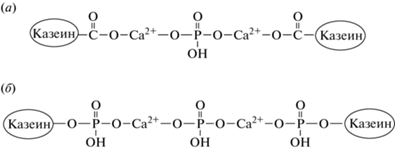
Таким образом, мицеллы казеина представляют собой упорядоченные белковые структуры, в образовании которых принимают участие ионы кальция и остатки фосфорной кислоты. При соединении кальция с остатками фосфорной кислоты формируются кальций-фосфатные мостики, связывающие между собой молекулы казеина. В образовавшийся таким образом казеин-кальций-фосфатный комплекс могут входить и некоторые другие полярные соединения (лимонная и уксусная кислоты, витамины и др.) и ионы (Na+, К+, Mg2+, Cl– и др.) [27, 32].
κ-Казеин находится преимущественно на внешней стороне мицелл, что подтверждается электронной микроскопией [31]. Гидрофильная, обладающая электроотрицательным зарядом С-концевая часть большинства молекул κ-казеина торчит из мицеллы в виде гибких “волосков” [12, 22, 27]. Гидродинамическая толщина волосистого слоя составляет ~7 нм [16]. Мицеллы образуются при наличии стабилизирующего фактора (κ-казеина) и представляют собой коллоидную суспензию [33].
Образование казеиновых мицелл объясняет нанокластерная теория. Согласно данной теории, мицелла представляет собой гомогенную матрицу казеинов [11]. На однородность распределения массы внутри мицеллы казеина указывают исследования с помощью нейтронного и рентгеновского рассеяния света [12, 34]. Внутри гомогенной матрицы казеинов располагаются коллоидные нанокластеры фосфата кальция [12, 17, 31], диспергированные на очень мелкие (~2 нм) “вишневые косточки”, расстояние между которыми в среднем составляет 18.6 нм. К поверхности нанокластеров прикреплены центры фосфорилирования (3–5 соседних фосфорилированных остатков) казеинов. Данные центры сшивают белки, что приводит к образованию сетевой структуры мицеллы или матрицы [34]. Мицелла стабилизируется κ-казеином [17, 31, 34]. Известно, что отношение κ-казеина к другим компонентам казеина выше в маленьких мицеллах и ниже в больших мицеллах [35]. Агрегация мицелл предотвращается электростатическим и стерическим отталкиванием за счет κ-казеинового слоя [34].
Таким образом, несмотря на то, что третичная структура одиночной молекулы казеина представляет собой неорганизованный клубок, несколько белковых молекул казеина при ионном и гибком межмолекулярном взаимодействии образуют жесткую структуру – мицеллу, равновесие которой поддерживается благодаря наружному κ‑казеиновому слою, который препятствует дальнейшему росту мицеллы, реакции с ионами кальция и, соответственно, выпадению в осадок.
Функциональные особенности казеинов зависят напрямую от их структурной видоспецифичности и количественных соотношений в молоке. Главная физиологическая функция мицеллы казеина состоит в поставке белков, фосфатов и кальция новорожденным [16]. Кроме того, во время переваривания β-казеина и быка, и человека происходит образование β-казоморфинов, которые могут выступать лигандами к опиоидным рецепторам. В экспериментах на животных показано, что пероральное применение β-казоморфинов влияет на моторику пищеварительного тракта и проявляет анальгетический эффект [5, 21, 23, 36].
КАЗЕИНЫ ЖЕНСКОГО ГРУДНОГО МОЛОКА
κ-Казеин человека по своей структуре сходен с κ-казеином быка и, подобно последнему, располагается на поверхности мицеллы и способствует ее стабилизации [36].
κ-Казеин женского грудного молока представляет собой полипептидную цепь, состоящую из 158 а.о. Гидрофобный участок 1–93 а.о. содержит один цистеин (Cys4), что обусловливает образование димера – пара-κ-казеина. Наличие в κ-казеине быка двух остатков цистеина свидетельствует о его способности образовывать полимеры [35, 37, 38]. В κ-казеине человека углеводный компонент составляет ~55% молекулы, а в κ-казеине быка –только 5% [35, 36, 39]. Гидрофильный фрагмент 94–158 а.о. κ-казеина человека представляет собой гликомакропептид, обладающий сильной антипатогенной и бифидогенной активностью [36, 40, 41]. Кроме того, показано, что κ-казеины способны ингибировать адгезию Helicobacter pylori к клеткам слизистой оболочки желудка [36, 41].
Функциональные и структурные особенности разных типов казеинов (α-, β-, κ-), их соотношение определяют основные отличия мицеллы женского грудного молока от коровьего [25]. Как и в коровьем молоке, казеины женского молока образуют с коллоидным фосфатом кальция устойчивый казеинат-кальций-фосфатный комплекс. В основе образования мицеллы лежат агрегационные свойства β-казеина [35]. Средний размер мицелл в коровьем молоке составляет 150–180 нм, в женском – 60–80 нм [24, 30, 41, 42]. Проводимые исследования доказали, что β-казеины женского молока, имеющие меньше сайтов фосфорилирования [43], в большинстве случаев образуют полимеры меньшего размера. При увеличении групп фосфорилирования β-казеины агрегируют. Показано, что крупные мицеллы содержат наименьшее количество углеводов (~25%) в κ-казеине. Таким образом, уровень гликозилирования κ‑казеина связан с размером мицелл [25, 35].
В женском грудном молоке также содержится множество специфических минорных белков, ассоциированных с мицеллой казеина. Методом жидкостной хроматографии и масс-спектрометрии в мицелле казеина идентифицированы 82 белка, 18 из которых не присутствуют в их сывороточной фракции; 32 белка, специфически связанные с мицеллой казеина, ранее не были идентифицированы в женском грудном молоке или молозиве [44].
Полученные данные позволяют по-новому взглянуть на протеомный профиль мицеллы казеина грудного молока и его физиологическое значение.
АЛЛЕРГИЯ НА БЕЛКИ КОРОВЬЕГО МОЛОКА
В связи с тем, что казеины имеют гибкую некомпактную структуру, их относят к слабым аллергенам [5]. Кроме того, они эффективно расщепляются в пищеварительном тракте. Некоторые пептидные фрагменты казеинов, присутствующие в молоке и образующиеся в результате протеолиза, представляют собой консервативные участки молекулы казеина. Именно они обусловливают аллергенность нативных белков [6]. Отсутствие четкой третичной структуры казеинов предполагает наличие преимущественно линейных эпитопов [11]. На современном этапе выявлено 33 IgE-связывающих эпитопов у казеинов: шесть у αs1-казеина, десять у αs2-казеина, девять у β-казеина и восемь у κ-казеина [5].
Из восьми основных IgE-связывающих эпитопов, обнаруженных в κ-казеине, три распознаются в 93% образцах сывороток крови пациентов с аллергией на коровье молоко, а именно IgE-связывающие области между 9–26, 21–44 и 47–68 а.о. Таким образом, область между остатками в позициях 9–68 (на N-конце) может играть важную роль в аллергенности этого белка [5].
Белки казеина, присутствующие в молоке различных видов жвачных животных, обладают высокой гомологией (>80–90%) и имеют сходные структурные, функциональные и биологические свойства [7, 11]. Например, последовательности αs1-, αs2- и β-казеинов коровы, козы и овцы имеют 87–98% гомологии [5].
Консервативные области казеинов, ответственные за IgE-перекрестную реактивность, включают участки с сериновыми остатками, по которым происходит фосфорилирование [10]. IgE-связывающие эпитопы α-казеинов недоступны, т.к. локализованы в гидрофобной области молекулы. Поэтому антигенные свойства α-казеинов проявляются только у расщепленных или денатурированных молекул. У детей с аллергией на коровье молоко выявлена сенсибилизация (93–98%) к казеину овцы и козы [5–7].
β-Казеины человека и крупного рогатого скота имеют ~50%-ную гомологию [5, 11, 45]. Bernard et al. показали перекрестную IgE-реактивность β-казеина грудного и коровьего молока [7, 45]. В исследовании Han et al. продемонстрировано существование двух потенциальных перекрестно-реактивных IgE-связывающих эпитопов κ-казеинов человека и быка [46]. Данные факты позволяют предположить возможность формирования перекрестных видов пищевой аллергии даже к такому идеальному источнику питания, как женское молоко, особенно при использовании смешанного вида вскармливания или после начала введения прикорма.
В НИИВС им. И.И. Мечникова было проведено исследование 273 сывороток детей с IgE-опосредованными аллергическими реакциями на пищевые и респираторные аллергены. Диагностическая панель включала 20 основных респираторных и пищевых аллергенов, в том числе белки коровьего молока: α-лактальбумин, β-лактоглобулин, казеин и бычий сывороточный альбумин. Сенсибилизация к белкам коровьего молока обнаружена в сыворотках 156 обследуемых детей (57.1%) [3].
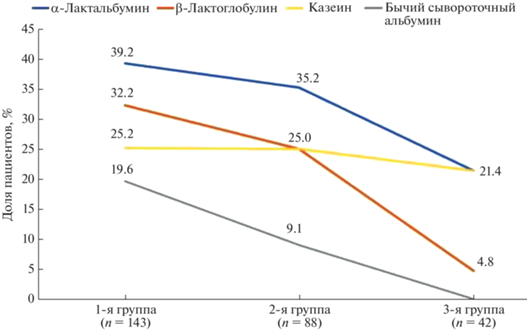
Для выявления особенностей сенсибилизации к коровьему молоку дети (n = 273) были распределены по возрастным группам: 1-я группа (от 5 месяцев до 3 лет, n = 143), 2-я группа (3–6 лет, n = = 88), 3-я группа (6–16 лет, n = 42). Обнаружено, что в отличие от большинства сывороточных фракций молока (β-лактоглобулина и бычьего сывороточного альбумина), сенсибилизация к которым существенно и достоверно уменьшается с возрастом, частота сенсибилизации к казеинам достоверно не изменяется в исследуемых возрастных группах пациентов (рис. 4) [3].
Рис. 4.
Сенсибилизация к белкам коровьего молока в возрастных группах детей (n = 273): 1-я группа (от 5 месяцев до 3 лет), 2-я группа (3–6 лет), 3-я группа (6–16 лет). По оси ординат представлена процентная доля пациентов с сенсибилизацией к белку коровьего молока от общего числа пациентов с IgE-опосредованной аллергией.
Для изучения особенностей сенсибилизации к белкам молока у детей исследовали сыворотки крови 156 детей (от 5 месяцев до 16 лет), у которых была обнаружена сенсибилизация к коровьему молоку. Необходимо отметить, что большинство обследованных пациентов имели полисенсибилизацию (множественную аллергию к двум и более белкам молока). Более чем у половины обследованных детей была выявлена сенсибилизация к сывороточным белкам молока – 89 детей (57%). Одна треть пациентов проявляла повышенную чувствительность как к сывороточным, так и к казеиновым фракциям белков (53 ребенка, 34%), и лишь 14 детей (9%) – только к казеинам.
Сравнительный анализ частоты встречаемости сенсибилизации к протеиновым фракциям молока (n = 156) показал, что основная часть детей имела специфические IgE к сывороточным белкам: α-лактальбумину – 96 детей (62%) и β-лактоглобулину – 70 детей (45%). Количество сывороток со специфическими IgE к α-лактальбумину статистически значимо превышало количество сывороток со специфическими IgE к β-лактоглобулину. Сенсибилизация к казеину была обнаружена у 67 пациентов (43%) и встречалась достоверно чаще, чем к БСА – у 33 пациентов (21%), р < 0.05. Достоверной разницы в частоте выявления аллергочувствительности между β-лактоглобулином и казеином выявлено не было (р > > 0.05) [3].
ЗАКЛЮЧЕНИЕ
В настоящее время не существует лечения аллергии на молоко. Как только диагноз поставлен, профилактика аллергической реакции зависит в основном от элиминационных мероприятий. Тем не менее полное избегание потребления молока может вызвать снижение нутритивного статуса и повлиять на рост младенцев и детей. Преодолеть эту проблему можно с помощью оптимизации новых стратегий переработки молока с целью разрушения или модификации структуры аллергенных протеинов и, следовательно, снижения или устранения их аллергенности, а также разработки методов аллерген-специфической иммунотерапии данными аллергенами. Обнадеживает, что в пероральной иммунотерапии белками коровьего молока достигнуты определенные успехи [47, 48].
Список литературы
Nguyen T., Mathisen R., Tran H. // BMJ. 2020. V. 371. P. 1–4. https://doi.org/10.1136/bmj.m4243
Лукоянова О.Л. // Вопросы современной педиатрии. 2012. Т. 11. С. 111–115.
Петрова С.Ю., Хлгатян С.В., Бержец В.М., Пищулина Л.А., Васильева А.В. // Рос. аллергологич. журнал. 2019. Т. 16. С. 38–44.
Альбанова В.И., Пампура А.Н. // Атопический дерматит. М.: ГЭОТАР-Медиа, 2020. С. 94–95.
Villa C., Costa J., Oliveira M., Mafra I. // Comprehensive Reviews in Food Science and Food Safety. 2018. V. 17. P. 137–164. https://doi.org/10.1111/1541-4337.12318
Hernell O. // Nestlé Nutrition Institute Workshop, Pediatric Program. 2011. V. 67. P. 17–28. https://doi.org/10.1159/000325572
Головач Т.Н., Курченко В.П. // Труды БГУ. 2010. Т. 5. С. 1–55.
Allergen 2021. (WHO/IUIS) Allergen Nomenclature Sub-Committee. http://www.allergen.org/
Allergome 2021. Allergome – a database of allergenic molecules. http://www.allergome.org/
Pilolli R., Nitride Ch., Gillard N., Huet A., Van Poucke Ch., Loose M., Tranquet O., Larre C., Adel-Patient K., Bernard H., Mills E.N., Monaci L. // Food Res. Int. 2019. V. 128. P. 108747. https://doi.org/10.1016/j.foodres.2019.108747
Wal J. // Allergy. 2001. V. 56. P. 35–38. https://doi.org/10.1034/j.1398-9995.2001.00911.x
Treweek T. // Milk Protein / Ed. Hurley W. IntechOpen, 2012. P. 85–118. https://doi.org/10.5772/48348
Богатова О.В., Догарева Н.Г. // Химия и физика молока. Учебное пособие. Оренбург: ГОУ ОГУ, 2004. С. 1–137.
Савелькина Н.А. // Биохимия и микробиология молока и молочных продуктов. Учебное пособие. Брянск: Мичуринский филиал ФГБОУ ВО “Брянский государственный аграрный университет”, 2015. С. 1–129.
Maity S., Bhat A.H., Giri K., Ambatipudi K. // J. Proteomics. 2020. V. 215. P. 103648. https://doi.org/10.1016/j.jprot.2020.103648
Huppertz T., Fox P.F., Kelly A.L. // Proteins in Food Processing (2nd ed.) / Ed. Yada R.Yu. Cambridge: Woodhead Publishing, 2018. P. 49–92. https://doi.org/10.1016/B978-0-08-100722-8.00004-8
Horne D.S. // Curr. Opin. Coll. Interf. Sci. 2006. V. 11. P. 148–153. https://doi.org/10.1016/j.cocis.2005.11.004
Kalyankar D., Khedkar C.D., Patil A.M., Deosarkar S.S. // Encyclopedia of Food and Health / Eds. Caballero B., Finglas P., Toldrá F. Oxford: Academic Press, 2016. P. 741–747. https://doi.org/10.1016/B978-0-12-384947-2.00463-3
Konrad T., Boratyński J. // Top. Curr. Chem. 2017. V. 375. P. 71. https://doi.org/10.1007/s41061-017-0158-z
Thompson A. // Milk Proteins. From Expression to Food / Eds. Boland M., Singh H. London: Academic Press, 2014. P. 1–552.
Ковалюк Н.В., Якушева Л.И., Шахназарова Ю.Ю., Кесем А.А. // Сб. науч. трудов СКНИИЖ. 2019. Т. 8. С. 4–8. https://doi.org/10.34617/4a9q-wn62
Regan J.O., Ennis M.P., Mulvihill D.M. // Handbook of Hydrocolloids (2nd ed.) / Eds. Phillips G., Williams P. Cambridge: Woodhead Publishing, 2009. P. 298–343. https://doi.org/10.1533/9781845695873.298
Portnaya I., Ben-Shoshan E., Cogan U., Khalfin R., Fass D., Ramon O., Danino D. // J. Agric. Food Chem. 2008. V. 56. P. 2192–2198. https://doi.org/10.1021/jf072630r
Cho Y., Jones O.G. // Adv. Food Nutr. Res. 2019. V. 88. P. 47–84. https://doi.org/10.1016/bs.afnr.2019.01.002
Sood S.M., Erickson G., Slattery C.W. // J. Dairy Sci. 2003. V. 86. P. 2269–2275. https://doi.org/10.3168/jds.S0022-0302(03)73818-1
Шляпникова С.В., Батырова Э.Р. // Биомика. 2017. Т. 9. С. 33–41.
Dumpler J. // On the Heat Stability of Concentrated Milk Systems. Heidelberg: Springer Spektrum, 2017. P. 143–179. https://doi.org/10.1007/978-3-658-19696-7
Farrell H.M., Malin E.L., Brown E.M., Qi P.X. // Curr. Opin. Colloid Interface Sci. 2006. V. 11. P. 135–147. https://doi.org/10.1016/j.cocis.2005.11.005
Livney Y.D. // Curr. Opin. Colloid Interface Sci. 2010. V. 15. P. 73–83. https://doi.org/10.1016/j.cocis.2009.11.002
Mirdha L., Chakraborty H. // Int. J. Biol. Macromolecules. 2019. V. 131. P. 89–96. https://doi.org/10.1016/j.ijbiomac.2019.03.040
Rocha-Mendoza D., Jiménez-Flores R. // In: Encyclopedia of Dairy Sciences (3rd ed.). Academic Press, 2022. P. 870–880. https://doi.org/10.1016/B978-0-12-818766-1.00277-4
Рогожин В.В. // Биохимия сельскохозяйственной продукции. Санкт-Петербург: ГИОРД, 2014. С. 393–446.
Eskin N.A., Shahidi F. // Biochemistry of Foods (3rd ed.). London: Academic Press, 2013. P. 319–323.
de Kruif C.G., Huppertz T., Urban V.S., Petukhov A.V. // Adv. Colloid Interface Sci. 2012. V. 171–172. P. 36–52. https://doi.org/10.1016/j.cis.2012.01.002
Sood S.M., Erickson G., Slattery C.W. // J. Dairy Sci. 2002. V. 85. P. 472–477. https://doi.org/10.3168/jds.S0022-0302(02)74097-6
Demmelmair H., Prell C., Timby N., Lönnerdal B. // Nutrients. 2017. V. 9. P. 817. https://doi.org/10.3390/nu9080817
Wakerley J.B. // Knobil and Neill’s Physiology of Reproduction (3rd ed.) / Ed. Neill J.D. London: Academic Press, 2006. P. 3129–3191.
Zhu J., Dingess K.A. // Nutrients. 2019. V. 11. P. 1834. https://doi.org/10.3390/nu11081834
Kim Y.J., Park S., Oh Y.K., Kang W., Kim H.S., Lee E.Y. // Protein Expression and Purification. 2005. V. 41. P. 441–446. https://doi.org/10.1016/j.pep.2005.02.021
Jauregui-Rincón J., Salinas E., Vela N., Jiménez M. // In: Whey – Biological Properties and Alternative Uses / Ed. Gigli I. IntechOpen, 2018. https://doi.org/10.5772/intechopen.82144
Vasques da Costa A., Purcell Goes C., Gama P. // Physiol. Rep. 2021. V. 9. P. e14744. https://doi.org/10.14814/phy2.14744
Dewettinck K., Herman L. // Food Control. 2014. V. 42. P. 188–201. https://doi.org/10.1016/j.foodcont.2014.01.045
Sood S.M., Slattery C.W. // J. Dairy Sci. 2001. V. 84. P. 2163–2169. https://doi.org/10.3168/jds.S0022-0302(01)74662-0
Wang X., Zhao X., Huang D., Pan X., Qi Y., Yang Y., Zhao H., Cheng G. // Sci. Rep. 2017. V. 27. P. 43020. https://doi.org/10.1038/srep43020
Costa J., Villa C., Verhoeckx K., Cirkovic T., Schrama D., Roncada P., Rodrigues P., Piras C., Martín-Pedraza L., Monaci L., Molina E., Mazzucchelli G., Mafra I., Lupi R., Lozano-Ojalvo D., Larre C., Klüber J., Gelencser E., Bueno-Díaz C., Holzhauser T. // Clin. Rev. Allerg. Immunol. 2021. https://doi.org/10.1007/s12016-020-08826-1
Han N., Järvinen K., Cocco R., Busse P., Sampson H., Beyer K. // Allergy. 2008. V. 63. P. 198–204. https://doi.org/10.1111/j.1398-9995.2007.01539.x
Ebrahimi M., Gharagozlou M., Mohebbi A., Hafezi N., Azizi G., Movahedi M. // Iran J. Allergy Asthma Immunol. 2017. V. 16. P. 183–192.
Ebisawa M., Ito K., Fujisawa T. // Allergol. Int. 2017. V. 66. P. 248–264. https://doi.org/10.1016/j.alit.2017.02.0
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


