Электрохимия, 2019, T. 55, № 11, стр. 1349-1362
Допированные азотом полые углеродные микросферы с иерархической системой пор для электрохимического преобразования энергии
Л. Дон a, b, С. Чен a, Ж. Ма c, К. Шао a, А. Ли a, В. Ян a, *, Ж. Жан a, **
a Шанхайский Университет
200444 Шанхай, КНР
b Компания Чжаоцин Леоч Баттери Текнолоджи
518000 Шэньчжэнь, КНР
c Научно-технологический Шанхайский Университет
200093 Шанхай, КНР
* E-mail: yveayan@shu.edu.cn
** E-mail: jiujun.zhang@i.shu.edu.cn
Поступила в редакцию 12.01.2019
После доработки 01.04.2019
Принята к публикации 20.05.2019
Аннотация
Допированные азотом полые углеродные микросферы с иерархической системой пор синтезированы с использованием меламино-формальдегидной смолы в качестве источника углерода и азота, микросфер из сульфированного полистирола в качестве шаблона ядра и наночастиц SiO2 в качестве агента, стимулирующего образование мезопор. Полученные микросферы имеют ядро из сульфированного полистирола и оболочку из композита меламино-формальдегидной смолы и SiO2. Эти микросферы прокаливали и подвергали кислотной обработке для получения допированных азотом полых углеродных микросфер с иерархической системой пор. В процессе прокаливания ядро из сульфированного полистирола удалялось, а в оболочке образовывались микропоры в результате термического разложения меламино-формальдегидной смолы. После химического вытравливания наночастиц SiO2 в углеродной оболочке образовывались мезопоры. Свежеприготовленные образцы допированных азотом полых углеродных микросфер с иерархической системой пор имеют большую площадь поверхности и большой объем пор; они демонстрируют каталитическую активность по отношению к реакции восстановления кислорода. Электрокаталитическую активность допированных азотом полых углеродных микросфер с иерархической системой пор можно приписать атомам допанта-азота, но также и иерархической структуре пор.
ВВЕДЕНИЕ
Морфологически управляемый синтез – это “горячая” тема в химии, потому что свойства материалов определяются его структурой и составом, а именно от этих свойств зависит и применение материала [1]. Недавно все возрастающее внимание было приковано к полым углеродным микросферам, благодаря их уникальным физико-химическим свойствам и потенциально широкому применению. Благодаря внутренним полостям, эти микросферы имеют большую площадь поверхности и низкую удельную плотность, а их полости можно использовать для запасания различного содержимого. Полые углеродные микросферы используют во многих областях техники, таких как топливные элементы, суперконденсаторы, катализаторы, литий-ионные аккумуляторы, металл-воздушные аккумуляторы, сенсоры и адсорбенты [2, 3].
В настоящее время для изготовления полых углеродных сфер применяются методы шаблонов в твердой и жидкой фазе и внутреннего шаблона. Из них для изготовления полых углеродных сфер часто используется метод шаблона в твердой фазе, путем покрытия поверхности сферического шаблона ядра (core) углеродным прекурсором; за этим следует карбонизация в инертной атмосфере с последующим вытравливанием шаблона. Хотя получаемые в форме полых углеродных сфер материалы обладают рядом привлекательных свойств, таких как большое отношение поверхность/объем, низкая плотность и большая доля внутренних полостей, но закрытый характер последних затрудняет использование внутреннего пространства этих полостей. Имея это в виду, для образования пор в углеродной оболочке используют как методы химической активации [4], так и растворяющиеся шаблоны [5]. В электрохимии на работу электродных материалов оказывает большое влияние их пористая структура. Было показано, что макропоры (>50 нм), мезопоры (2‒50 нм) и микропоры (<2 нм) играют разные роли: макропоры служат буферными резервуарами для ионов, уменьшая расстояние диффузии; мезопоры предлагают эффективный путь переноса для реакций на подложках с ограниченно доступной площадью поверхности, а микропоры сохраняют преимущество избирательности по отношению к форме и размеру молекулы-“гостя” [6–8]. Имея в виду эти продвинутые функциональности, исследователи повсюду фокусируют свое внимание на создании полых углеродных микросфер с иерархической системой пор, состоящих из макропористого ядра и микро/мезопористой оболочки, рассчитывая на их потенциальные электрохимические применения [9–11].
Дальнейшее усовершенствование поведения таких электродных материалов, а именно допированного азотом углерода, стало предметом широких исследований. Причина этого в том, что атомы азота могут повышать полярность поверхностей и электропроводность, создавая как оснóвные места на поверхности, так и электроно-донорную тенденцию углеродной матрицы; результатом этого является улучшение электрохимического поведения [12, 13]. По этой причине ожидается, что допированные азотом полые углеродные микросферы с иерархической системой пор будут демонстрировать улучшенные электрохимические свойства, благодаря комбинации атомов допанта-азота и структуры пор. Для синтеза допированных азотом полых углеродных микросфер с иерархической системой пор используют полимеры, содержащие азот, включая полидопамин [14], полиакриламид [15] и полианилин [16]. меламино-формальдегидная смола – это полимер с высоким содержанием азота, поскольку сам по себе меламин – богатая азотом молекула (67 вес. % N) [17]. Насколько нам известно, до сих пор опубликованы лишь отдельные сообщения о синтезе допированных азотом полых углеродных микросфер с иерархической системой пор или хотя бы допированных азотом полых углеродных микросфер с помощью метода шаблона в твердой фазе с использованием меламино-формальдегидной смолы в качестве прекурсора. Так, полые углеродные микросферы получали нагреванием микросфер из меламино-формальдегидной смолы диаметром приблизительно 5 мкм в атмосфере азота при 800°C в течение 5 ч. В работе [18] были приготовлены микросферы из меламино-формальдегидной смолы диаметром 1.5 мкм. После их прогрева в аргоне при 1000°C получались твердые углеродные сферы. В работе [19] получены микросферы из SiO2, покрытые меламино-формальдегидной смолой. В наших опытах мы обнаружили, что допированный азотом углерод, полученный из меламино-формальдегидной смолы, очень твердый, и что он способен сохранять исходную морфологию даже после продолжительного измельчения растиранием. Таким образом, причина может заключаться в том, что оболочка настолько жесткая и замкнутая, что химическим реагентам трудно проникнуть внутрь нее, чтобы удалить SiO2–микросферу–ядро. Однако, было опубликовано сообщение [20] об изготовлении допированных азотом твердых мезопористых углеродных сфер путем прокаливания композитных сфер из наночастиц меламино-формальдегидной смолы/SiO2 с последующим вытравливанием наночастиц SiO2 во фтористоводородной кислоте (HF).
В настоящей работе мы синтезировали образцы допированных азотом полых углеродных микросфер с иерархической системой пор, используя меламино-формальдегидную смолу в качестве источника углерода и азота, микросферы из сульфированного полистирола в качестве шаблона ядра и наночастицы SiO2 в качестве агента, стимулирующего образование мезопор. В этом синтезе вначале получаются микросферы с ядром из сульфированного полистирола и оболочкой из композита меламино-формальдегидной смолы и SiO2, а затем, в результате прокаливания и химического травления, – допированные азотом полые углеродные микросферы с иерархической системой пор. В процессе прокаливания ядро из сульфированного полистирола удаляется, а в оболочке образуются микропоры в результате термического разложения меламино-формальдегидной смолы. После химического вытравливания наночастиц SiO2 в углеродной оболочке образуются мезопоры. Образцы допированных азотом полых углеродных микросфер с иерархической системой пор демонстрируют каталитическую активность по отношению к реакции восстановления кислорода. Для сравнения мы также приготовили допированные азотом полые углеродные микросферы с помощью пиролиза микросфер, состоящих из ядра из сульфированного полистирола и оболочки из меламино-формальдегидной смолы. Мы обнаружили, что такие микросферы содержат только макропоры, образовавшиеся в результате удаления ядра из сульфированного полистирола, и микропоры, образовавшиеся в результате термического разложения меламино-формальдегидной смолы. Эти допированные азотом полые углеродные микросферы проявляют более низкую электрокаталитическую активность по отношению к реакции восстановления кислорода, чем вышеупомянутые микросферы с иерархической системой пор. Полученные результаты показывают, что существует тесная связь между иерархической системой пор и электрохимическими свойствами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Поливиниловый спирт (средний молекулярный вес 1750) был приобретен у компании Sinopharm Chemical Reagents Co. Ltd. (Шанхай, КНР). Катализатор Pt/C (20% Pt на саже Vulcan XC-72, HiSPEC 2000) был приобретен у компании Johnson Matthey. Раствор нафиона (Nafion®, 5 вес. %) и наночастицы SiO2 (Ludox SM-30, 30 вес. % оксида кремния в воде, номинальный диаметр 7 нм) были приобретены у компании Sigma-Aldrich. Меламин, водный раствор формальдегида (37 вес. %), ледяная уксусная кислота, стирол, метакриловая кислота, персульфат калия (K2S2O8), фтористоводородная кислота (HF), серная кислота (H2SO4, 98%) и кислый карбонат натрия (NaHCO3) имели квалификацию “ч. д. а.” и были приобретены у компании Aladdin Co. Ltd. Перед употреблением стирол и метакриловую кислоту перегоняли при пониженном давлении, а K2S2O8 очищали перекристаллизацией. Все остальные реактивы использовались без дополнительной очистки. Во всех опытах пользовались деионизованной водой.
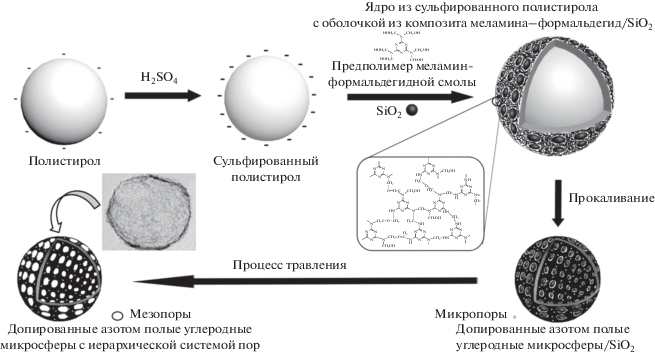
При создании допированных азотом полых углеродных микросфер с иерархической системой пор в качестве шаблона ядра использовали сферы из сульфированного полистирола (диаметр около 195 нм). Микросферы из полистирола были приготовлены полимеризацией, не содержащей мыла эмульсии, согласно методике, описанной в работе [21]. Микросферы из полистирола были выделены центрифугированием, промыты и диспергированы в этаноле. Сульфирование микросфер из полистирола было проведено путем смешивания полученной суспензии с H2SO4. Это сульфирование проводили при 40°C в течение 12 ч, затем микросферы из сульфированного полистирола были выделены центрифугированием, промыты и диспергированы в воде (содержание диспергированных веществ в суспензии 4 мг мл–1). Предполимер меламина–формальдегида готовили, смешивая 2.8 г меламина с 5.3 мл раствора формальдегида. Смесь перемешивали в течение 20 мин при 60°C до получения прозрачного раствора.
Процесс синтеза допированных азотом полых углеродных микросфер с иерархической системой пор иллюстрируется схемой. По ходу синтеза 30 мл суспензии микросфер из сульфированного полистирола смешивали с раствором поливинилового спирта (5 вес. %) и перемешивали в течение нескольких минут при 60°C, а затем добавляли 4 мл наночастиц SiO2. Затем добавляли предполимер меламина–формальдегида, значение pH смеси доводили до 4.5 с помощью ледяной уксусной кислоты. Через 7 мин микросферы с ядром из сульфированного полистирола и оболочкой из композита меламино-формальдегидной смолы и SiO2 отделяли центрифугированием, промывали дистиллированной водой и лиофилизировали. Микросферы с ядром из сульфированного полистирола и оболочкой из композита меламино-формальдегидной смолы готовили таким же способом, но без добавления наночастиц SiO2.
Схема. Схематическая иллюстрация процесса синтеза допированных азотом полых углеродных микросфер с иерархической системой пор.
После нагревания микросфер с ядром из сульфированного полистирола и оболочкой из композита меламино-формальдегидной смолы и SiO2 до 800°C в течение 2 ч при скорости нагрева 5°C мин–1 в атмосфере азота получались полые микросферы с оболочкой из допированного азотом углерода и SiO2. Удаление наночастиц SiO2 из этих микросфер проводили их обработкой в 10%‑ном растворе фтористоводородной кислоты (HF) в течение 24 ч. Затем эти допированные азотом полые углеродные микросферы с иерархической системой пор отделяли центрифугированием, промывали и сушили при 60°C в печи в течение ночи. Допированные азотом полые углеродные микросферы синтезировали простым прокаливанием микросфер с ядром из сульфированного полистирола и оболочкой из композита меламино-формальдегидной смолы в атмосфере азота.
ИССЛЕДОВАНИЕ ХАРАКТЕРИСТИК МИКРОСФЕР
Морфологию образцов исследовали с помощью просвечивающего электронного микроскопа JEM-200CX, работающего при ускоряющем напряжении 120 кэВ. Изображения поверхности получали методом просвечивающей электронной микроскопии (ТЕМ) и просвечивающей электронной микроскопии высокого разрешения (HRTEM) на приборе JEM-2100F при ускоряющем напряжении 200 кВ. Инфракрасные спектры с преобразованием Фурье получали на спектрометре Nicolet Avatar 370 FTIR (Thermo Nicolet, США), используя таблетку KBr. Рентгеновские дифрактограммы записывали на дифрактометре 18KW D/MAX2500V, управляемом персональным компьютером, с графитовым монохроматором, с CuKα-излучением (λ = 0.15406 нм). Рамановские спектры снимали на приборе Jobin-Yvon LabRam HR с охлаждаемым жидким азотом многоканальным детектором – прибором с зарядовой связью – на длине волны 633 нм. Дзета-потенциал (ζ) измеряли на светорассеивающем оборудовании Zetasizer 3000HSA (Malvern). Химический состав образцов определяли с помощью рентгеновской фотоэлектронной спектроскопии (РФЭС) на спектрометре VG ESCALAB 250 (Thermo Electron, Великобритания), используя источник рентгеновского AlKα-излучения (1486 эВ). Перед РФЭС-измерениями все образцы тщательно измельчали. Изотермы адсорбции–десорбции азота снимали при 77 K на анализаторе площади поверхности NOVA 2000 (Quantachrome). Удельную площадь поверхности и распределение пор по размерам рассчитывали на основе метода Брунауэра–Эмметта–Теллера (BET) и модели функциональной теории плотности (модель QSDFT).
Электрохимические измерения проводили в трехэлектродной ячейке на электрохимическом комплексе CHI760e (Chenghua, КНР). Рабочим электродом служил стеклоуглеродный электрод (3 мм в диаметре) с нанесенным катализатором, противоэлектродом и электродом сравнения – соответственно, платиновая проволока и Hg/HgO/1 M KOH-электрод. Электролитом служил водный 0.1 M раствор KOH, продуваемый азотом или кислородом в течение 30 мин перед электрохимическими измерениями. Вольтамперограммы при линейной развертке потенциала снимали на вращающемся дисковом электроде (Autolab, RDE). Каталитическую печатную краску готовили, диспергируя 2 мг катализатора (допированные азотом полые углеродные микросферы, допированные азотом полые углеродные микросферы с иерархической системой пор, Pt/C или RuO2) и 25 мкл раствора нафиона в 0.5 мл смеси вода–изопропанол (1/1 по объему) под воздействием ультразвука в течение 30 мин до получения однородной дисперсии. Электрод с нанесенным катализатором получали, наливая 2.0 мкл каталитической печатной краски на поверхность предварительно отполированного стеклоуглеродного электрода с последующей сушкой при 60°C в течение 2 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Допированные азотом полые углеродные микросферы с иерархической системой пор синтезированы с использованием микросфер из сульфированного полистирола в качестве шаблона ядра и наночастиц SiO2 в качестве агента, стимулирующего образование мезопор. Процесс их образования контролировали с помощью метода просвечивающей электронной микроскопии (TEM). На рис. 1а показана TEM-микрофотография микросфер из полистирола. Эти микросферы демонстрируют регулярную сферическую морфологию с весьма равномерным размером частиц: 195 нм. Дзета-потенциал микросфер из полистирола равняется –42.0 мВ. Это показывает, что микросферы заряжены отрицательно, благодаря присутствию карбоксильных групп на их поверхности [21]. После сульфирования, дзета-потенциал сульфированного полистирола снизился до –57.1 мВ, что является следствием появления сульфогрупп (–SO3H) на поверхности. На рис. 1б показана TEM-микрофотография сульфированного полистирола, на которой видно, что частицы сульфированного полистирола по-прежнему сохраняют сферическую морфологию. После сульфирования размер частиц уменьшился до 189 нм.
Рис. 1.
TEM-микрофотографии: (а) полистирола, (б) сульфированного полистирола, (в) композита меламин–формальдегид/SiO2 вокруг ядра из сульфированного полистирола, (г) композита меламин–формальдегид вокруг ядра из сульфированного полистирола, (д) допированных азотом полых углеродных микросфер/SiO2, (е) допированных азотом полых углеродных микросфер, (ж) допированных азотом полых углеродных микросфер с иерархической системой пор; (з) HRTEM-микрофотографии высокого разрешения допированных азотом полых углеродных микросфер с иерархической системой пор.

Каждая молекула меламина содержит три первичных аминогруппы (–NH2), которые могут прореагировать с одной–шестью молекулами формальдегида с образованием молекул гидроксиметилмеламина (предполимер меламина–формальдегида) [22]. Эти гидроксиметильные группы могут быть подвержены перекрестному “сшиванию” в результате реакции конденсации, с образованием метилен-эфирных (–CH2OCH2–) и метиленовых (–CH2–) мостиков в меламин-формальдегидной смоле [17, 22]. При смешивании наночастиц SiO2 с предполимером меламина–формальдегида и суспензией сульфированного полистирола, группы Si–OH на наночастицах SiO2 могут участвовать в этой реакции конденсации, образуя оболочку из композита меламин–формальдегид/SiO2 вокруг ядра из сульфированного полистирола. Как показано на рис. 1в, наночастицы SiO2 равномерно распределены в меламин-формальдегидной матрице, результатом чего является шероховатая поверхность. Напротив, поверхность частиц сульфированного полистирола с оболочкой из композита меламино-формальдегидной смолы намного более гладкая (рис. 1г). Диаметр таких частиц с SiO2 составляет около 255 нм, показывая, что оболочка из композита меламин–формальдегид/SiO2 имеет толщину около 33 нм. Однако диаметр частиц сульфированного полистирола с оболочкой из меламино-формальдегидной смолы составляет 317 нм; отсюда, меламин-формальдегидная оболочка имеет толщину около 64 нм. Таким образом, оболочка из композита меламин–формальдегид/SiO2 вдвое тоньше, чем оболочка, состояшая только из меламино-формальдегидной смолы, потому что наночастицы SiO2 могут участвовать в вышеупомянутой реакции конденсации, так что в композитной оболочке, содержащей SiO2, остается намного меньше меламино-формальдегидной смолы. Благодаря остаточным аминогруппам на меламино-формальдегидной оболочке, дзета-потенциал сульфированного полистирола после покрытия меламино-формальдегидной оболочкой меняется с –57.1 до +18.3 мВ. Однако, дзета-потенциал частиц сульфированного полистирола в оболочке из композита меламин–формальдегид/SiO2 равняется –21.3 мВ, так как дзета-потенциал наночастиц SiO2 равен –31.3 мВ.
Прокаливание сульфированного полистирола с оболочками из композита меламин–формальдегид и меламин–формальдегид/SiO2 проводили в атмосфере азота при 800°C в течение 2 ч. На рис. 1д и 1е даны TEM-микрофотографии допированных азотом полых углеродных микросфер, соответственно, с SiO2 и не содержащих SiO2. В обоих случаях их полая структура доказывается резким контрастом между темными оболочками и серыми центральными областями. Диаметр полого пространства микросфер с SiO2 составляет около 178 нм, а без SiO2 – только около 105 нм. Благодаря усадке, вызванной разложением ядра из сульфированного полистирола и меламин-формальдегидной оболочки в ходе пиролиза, диаметр полого пространства в допированных азотом полых углеродных микросферах намного меньше диаметра частиц сульфированного полистирола. Однако, в ходе карбонизации сульфированного полистирола с меламино-формальдегидной/SiO2-оболочкой неорганические наночастицы SiO2 ведут себя, как жесткий “скелет”, предохраняя оболочку от съеживания в радиальном направлении. Поэтому диаметр полого пространства в допированных азотом полых углеродных микросферах/SiO2 всего лишь на 11 нм меньше, чем диаметр частиц сульфированного полистирола.
Допированные азотом полые углеродные микросферы с иерархической системой пор получаются в результате травления допированных азотом полых углеродных микросфер в HF. На рис. 1ж показаны TEM-микрофотографии допированных азотом полых углеродных микросфер с иерархической системой пор. Полученный после травления в HF образец сохраняет полую структуру. Диаметр полого пространства в нем все еще равняется 175 нм, как и в допированных азотом полых углеродных микросферах с SiO2. В результате удаления наночастиц SiO2 возникает мезопористость, заметная на TEM- и HRTEM-микрофотографиях образцов (соответственно, рис. 1ж и 1з). HRTEM-микрофотография допированных азотом полых углеродных микросфер с иерархической системой пор содержит интерференционные полосы от разупорядоченной решетки, указывающие на слабую графитизацию углеродной оболочки.
Измерения методом рентгеновской фотоэлектронной спектроскопии были проведены для определения химического состава и конфигурации связывания. На рис. 2а дан РФЭС-спектр допированных азотом полых углеродных микросфер с иерархической системой пор и, для сравнения, спектр допированных азотом полых углеродных микросфер. В обоих спектрах наблюдаются пики углерода (C1s ~284 эВ), кислорода (O1s ~532 эВ) и азота (N1s ~400 эВ). Отношение углерод/кислород (C/O) для этих двух типов образцов равняется, соответственно, 20.05 и 11.27. В ходе процесса пиролиза высвобождается большое количество кислородсодержащих молекул в результате разложения меламин-формальдегидной смолы [23]. Эти кислородсодержащие молекулы, такие как формальдегид и оксид углерода, могут способствовать внедрению атомов кислорода в углеродную матрицу. Поскольку композитная меламин-формальдегидная оболочка с SiO2 содержит гораздо меньше меламин–формальдегида, она высвобождает меньше кислородсодержащих молекул, а потому внедряется меньше атомов кислорода. Дополнительно, кислотное травление может удалять атомы кислорода, связанные с атомами Si. Поэтому отношение C/O в допированных азотом полых углеродных микросферах с иерархической системой пор намного больше, чем в допированных азотом полых углеродных микросферах. Содержание азота в первых (2.94%) меньше, чем во вторых (3.42%), что также можно объяснить меньшим содержанием меламин-формальдегидной смолы в образце сульфированного полистирола с меламино-формальдегидной/SiO2-оболочкой.
Рис. 2.
Рентгеновские фотоэлектронные спектры (а) допированных азотом полых углеродных микросфер с иерархической системой пор и допированных азотом полых углеродных микросфер. РФЭС-спектры фотоэлектронов внутренних оболочек C1s: (б) допированных азотом полых углеродных микросфер с иерархической системой пор и (в) допированных азотом полых углеродных микросфер. РФЭС-спектры фотоэлектронов внутренних оболочек N1s: (г) допированных азотом полых углеродных микросфер с иерархической системой пор и (д) допированных азотом полых углеродных микросфер.

На рис. 2б и 2в даны спектры фотоэлектронов внутренних оболочек C1s для образцов, соответственно, допированных азотом полых углеродных микросфер с иерархической системой пор и допированных азотом полых углеродных микросфер. В спектрах наблюдаются четыре пика с центрами при 284.5, 286.1, 287.8 и 289.0 эВ, относящиеся, соответственно, к sp2C и связям C–N, C=N и O–C=O [24, 25]. Общий вклад связей C‒N и C=N для допированных азотом полых углеродных микросфер равен 18.49%, а в микросферах с иерархической системой пор он увеличивается до 20.40%. На рис. 2в и 2г даны спектры фотоэлектронов внутренних оболочек N1s, соответственно, для тех же двух образцов микросфер. В этих спектрах обоих образцов наблюдаются четыре пика с центрами при 398.1, 399.8, 401.1 и 403.3 эВ, относящиеся, соответственно, к N в пиридине, пирроле, графите и оксиде N [26]. “Пиридиновый” азот – это атомы N, находящиеся на ребрах графеновых граней, где каждый атом N связан с двумя атомами углерода и отдает один p-электрон ароматической системе. “Пирроловый” азот относится к атомам N, встроенным в пятиатомные гетероциклические кольца, которые связаны с двумя атомами углерода и отдают π-системе два p-электрона. “Графитовые” атомы N встроены в графеновый слой, где они замещают атомы углерода графеновых граней, а N-оксидные атомы связаны с системой двух атомов углерода и одного атома кислорода [27]. В табл. 1 даны рассчитанные по рис. 2 процентные содержания различных азотсодержащих остатков в допированных азотом полых углеродных микросферах с иерархической системой пор и в допированных азотом полых углеродных микросферах. В первом образце содержание “графитового” N равняется 0.62, что близко к содержанию во втором. Содержание “пиридинового” N в первом образце равно 1.21, что больше чем вдвое превышает его содержание во втором образце. Чем выше содержание “пиридинового” N, тем выше электрокаталитическая активность по отношению к реакции восстановления кислорода [28].
Таблица 1.
Процентные содержания различных азот-содержащих остатков в допированных азотом полых углеродных микросферах с иерархической системой пор и в допированных азотом полых углеродных микросферах
| Образец | Общий N | Пиридиновый N | Пирроловый N | Графитовый N | Оксидный N |
|---|---|---|---|---|---|
| (ат. %) | |||||
| Допированные азотом полые углеродные микросферы с иерархической системой пор | 2.94 | 1.21 | 0.96 | 0.62 | 0.15 |
| Допированные азотом полые углеродные микросферы | 3.42 | 0.59 | 1.86 | 0.69 | 0.28 |
На рис. 3а показаны ИК-спектры с преобразованием Фурье образцов сульфированного полистирола с меламино-формальдегидной и с меламино-формальдегидной/SiO2-оболочками. Для сравнения дан такой же спектр для меламино-формальдегидных микросфер. (Описание процесса синтеза меламино-формальдегидных микросфер можно найти в работе [29].) В спектре меламино-формальдегидных микросфер широкая полоса поглощения при 3378 cм–1 относится к валентным колебаниям групп NH2 [26, 30]. Пики поглощения при 1565, 1505, 1342 и 813 cм–1 отвечают колебаниям в плоскости триазинового кольца [20]. В спектре сульфированного полистирола с меламино-формальдегидной оболочкой можно наблюдать все характеристические пики поглощения меламино-формальдегидных микросфер. Дополнительно можно видеть еще два пика при 752 и 697 cм–1, относящихся к валентным колебаниям в однозамещенном фенильном кольце полистирольной группы [31]. В ИК-спектре с преобразованием Фурье образца сульфированного полистирола с меламино-формальдегидной/SiO2-оболочкой, помимо характеристических пиков поглощения сульфированного полистирола с меламино-формальдегидной оболочкой, видны асимметричные валентные колебания (1112 cм–1), симметричные валентные колебания (810 cм–1) и изгибные колебания (478 cм–1) связей Si–O–Si [32, 33]. Это указывает на то, что наночастицы SiO2 успешно внедрены в оболочку из меламино-формальдегидной смолы.
Рис. 3.
(а) ИК-спектры с преобразованием Фурье композита меламин–формальдегид/SiO2 вокруг ядра из сульфированного полистирола, композита меламин–формальдегид вокруг ядра из сульфированного полистирола и меламин-формальдегидных микросфер. (б) ИК-спектры с преобразованием Фурье допированных азотом полых углеродных микросфер с иерархической системой пор, допированных азотом полых углеродных микросфер с SiO2 и без SiO2.

На рис. 3в показаны ИК-спектры с преобразованием Фурье образцов допированных азотом полых углеродных микросфер, допированных азотом полых углеродных микросфер с SiO2 и допированных азотом полых углеродных микросфер с иерархической системой пор. В спектрах допированных азотом полых углеродных микросфер характеристические пики меламино-формальдегидной смолы исчезли; появились широкие слабые полосы поглощения между 1350 и 1650 cм–1. Их можно приписать валентным колебаниям связей C–N и C=N [29]. По-видимому, при 800°C протекают термически индуцированные реакции (включая разрыв первоначальных метиленовых мостиков, разложение метилоловых групп, удаление карбонильной группы из свободного формальдегида и сублимацию меламина, входящего в состав меламино-формальдегидной смолы), и это приводит к исчезновению характеристических особенностей поглощения меламино-формальдегидных микросфер [18, 29]. В спектре допированных азотом полых углеродных микросфер с SiO2, благодаря присутствию наночастиц SiO2, наблюдаются характеристические пики поглощения Si–O–Si (1108, 810 и 474 cм–1). Полосу при 3442 cм–1 можно отнести за счет валентных колебаний Si–OH-групп. После удаления наночастиц SiO2 исчезают и относящиеся к ним пики в спектре, и в ИК-спектре с преобразованием Фурье образцов допированных азотом полых углеродных микросфер с иерархической системой пор остаются только пики поглощения связей C–N и C=N.
Рамановская спектроскопия – это прямой и неразрушающий способ для того, чтобы охарактеризовать структуру углеродных материалов. На рис. 4а показаны Рамановские спектры допированных азотом полых углеродных микросфер с иерархической системой пор и допированных азотом полых углеродных микросфер. В обоих спектрах видны два пика, соответственно, при 1336 cм–1 (полоса D) и 1588 cм–1 (полоса G). Полоса D возникла как дыхательная мода колебаний κ-точечных фононов A1g, а полоса G соответствует фононам E2g атомов sp2C. Относительная интенсивность полосы D в сравнении с полосой G (ID/IG) дает возможность выявить изменение в электронном сопряжении. Значение ID/IG для допированных азотом полых углеродных микросфер равняется 0.857; для допированных азотом полых углеродных микросфер с иерархической системой пор оно возрастает до 1.026. Обычно величина sp2-доменов с ростом числа допантов уменьшается. Хотя содержание азота в допированных азотом полых углеродных микросферах с иерархической системой пор меньше, чем в обычных допированных азотом полых углеродных микросферах, величина ID/IG в первом случае много больше, чем во втором, из-за оболочки из композита меламин–формальдегид/SiO2. Эти наночастицы SiO2 могут играть такую же роль, что и гетероатомы, т.е. уменьшать sp2-домены в углеродной матрице. На рис. 4б приведены рентгеновские дифрактограммы образцов допированных азотом полых углеродных микросфер с иерархической системой пор и допированных азотом полых углеродных микросфер. На дифрактограммах образцов второго типа мы видим репрезентативный пик (002) при угле 24.6°, отвечающий межслойному расстоянию d, равному d002 = 3.6 Å. Пик (002) допированных азотом полых углеродных микросфер с иерархической системой пор расположен при 25.6°, что соответствует межслойному расстоянию d, равному d002 = = 3.5 Å. Меньшую величину межслойного расстояния в допированных азотом полых углеродных микросферах с иерархической системой пор можно объяснить меньшим содержанием в них азота.
Рис. 4.
(а) Рамановские спектры, (б) рентгеновские дифрактограммы, (в) изотермы адсорбции–десорбции азота, (г) кривые распределения пор по размеру допированных азотом полых углеродных микросфер с иерархической системой пор и допированных азотом полых углеродных микросфер, (д) кривые термогравиметрического анализа композита меламин–формальдегид/SiO2 вокруг ядра из сульфированного полистирола, композита меламин–формальдегид вокруг ядра из сульфированного полистирола и сульфированного полистирола.

Площадь поверхности и структуру пор в допированных азотом полых углеродных микросферах и в допированных азотом полых углеродных микросферах с иерархической системой пор анализировали, снимая изотермы адсорбции–десорбции азота (рис. 4в) и кривые распределения пор по размеру (рис. 4г). Удельная площадь поверхности допированных азотом полых углеродных микросфер с иерархической системой пор равняется 777 м2 г–1, что намного больше, чем у допированных азотом полых углеродных микросфер (232 м2 г–1). Из рис. 4в видно, что во втором случае наблюдается изотерма типа I с небольшим гистерезисом; это, в общем, скорее указывает на микропористую структуру [34]. Изотерма допированных азотом полых углеродных микросфер с иерархической системой пор относится к типу IV, с отчетливым гистерезисом типа H2, что указывает на совместное присутствие микропор и мезолор [35]. Как видно на рис. 4г, на кривой распределения пор по размеру имеется интенсивный пик при 1.28 нм. Наблюдались и мезопоры размером от 2.9 до 14.5 нм; это показывает, в целом, что термический нагрев произвел в оболочке большое число микропор и сравнительно немного мезопор. На кривой распределения пор по размеру в допированных азотом полых углеродных микросферах с иерархической системой пор также виден интенсивный резкий пик при 1.3 нм. Дополнительно наблюдаются и мезопоры вследствие удаления наночастиц оксида кремния; у них широкое распределение по размеру – следствие удаления наночастиц SiO2 и их агрегатов. Удельный объем пор в допированных азотом полых углеродных микросферах равен 0.33 cм3 г–1, а в допированных азотом полых углеродных микросферах с иерархической системой пор – 1.56 cм3 г–1. Наночастицы SiO2 действуют как шаблон, производящий много мезопор, что приводит к росту объема пор в допированных азотом полых углеродных микросферах с иерархической системой пор.
На рис. 4д приведена кривая термогравиметрического анализа для сульфированного полистирола с оболочкой из композита меламино-формальдегидной смолы и SiO2. Для сравнения даны также кривые для сульфированного полистирола и для сульфированного полистирола с оболочкой из меламино-формальдегидной смолы, не содержащей SiO2. На кривой для сульфированного полистирола наблюдаются два главных процесса потери массы. Непрерывная потеря массы от комнатной температуры и до 370°C отвечает потере воды, а потеря массы от 370 до 430°C связана с разложением сульфированного полистирола. В отличие от собственно полистирола, от которого почти ничего не остается при температурах выше 450°C, процент остаточного веса сульфированного полистирола составляет 5.36%, что можно объяснить присутствием солей натрия [36]. На кривой термогравиметрического анализа для сульфированного полистирола с оболочкой из композита меламино-формальдегидной смолы наблюдаются три главных процесса потери массы. Непрерывная потеря массы от комнатной температуры до 300°C, вероятно, связана с потерей воды и свободного формальдегида [37], а потеря массы между 300 и 500°C, по-видимому, есть результат разложения ядра сульфированного полистирола, а также индуцированных нагревом реакций меламино-формальдегидной смолы [29]. Дальнейшая потеря массы от 500 до 800°C может быть связана с выделением аммиака и цианистого водорода [29]. Процент остаточного веса для сульфированного полистирола с оболочкой из меламино-формальдегидной смолы равен 21.1%, а для того же материала с наночастицами SiO2 – 54.9%; это указывает на то, что содержание SiO2 в образце составляет около 33.8%.
Электрокаталитическую активность в допированных азотом полых углеродных микросферах с иерархической системой пор в отношении реакции восстановления водорода исследовали с помощью электрохимического комплекса с системой вращающегося дискового электрода из исследуемого материала. На рис. 5а даны циклические вольтамперограммы, снятые в 0.1 M растворах KOH, насыщенных азотом или кислородом. Для сравнения приведены циклические вольтамперограммы, снятые на электроде из полых углеродных микросфер и на Pt/C-электроде в тех же 0.1 M растворах KOH. Как видно из рис. 5а, Pt/C-электрод проявляет электрокаталитическую активность по отношению к реакции восстановления водорода. В растворе KOH, насыщенном азотом, допированные азотом полые углеродные микросферы как с иерархической системой пор, так и без нее демонстрируют лишенный характерных черт емкостной фоновый ток в форме “столика” между –0.7 и 0.2 В. Напротив, в растворе KOH, насыщенном кислородом, на циклических вольтамперограммах допированных азотом полых углеродных микросфер наблюдается небольшой пик тока катодного восстановления кислорода при –0.31 В, характеризующий их каталитическую активность в отношении реакции восстановления кислорода. На циклических вольтамперограммах допированных азотом полых углеродных микросфер с иерархической системой пор пик тока реакции восстановления кислорода наблюдается при –0.17 В, т.е. приблизительно на 140 мВ положительнее, чем на углеродных микросферах без иерархической системы пор, причем плотность тока в пике также выше. Этот “положительный” сдвиг потенциала пика тока, как и рост плотности тока в пике, ясно свидетельствует о том, что допированные азотом полые углеродные микросферы с иерархической системой пор могут придать электроду дополнительную электрокаталитическую активность в отношении реакции восстановления кислорода.
Рис. 5.
(а) Циклические вольтамперограммы электродов из допированных азотом полых углеродных микросфер с иерархической системой пор, допированных азотом полых углеродных микросфер и Pt/C в 0.1 M растворах KOH, насыщенных кислородом (сплошные линии) и азотом (пунктир), снятые при скорости развертки потенциала 5 мВ с–1. (б) Вольтамперограммы при линейной развертке потенциала электродов из допированных азотом полых углеродных микросфер с иерархической системой пор, допированных азотом полых углеродных микросфер и Pt/C, снятые в 0.1 M растворе KOH, насыщенном кислородом, при скорости развертки потенциала 5 мВ с–1 и скорости вращения электрода 1600 об/мин. (в) Оценка долговременной устойчивости электродов из допированных азотом полых углеродных микросфер с иерархической системой пор и Pt/C в течение 24000 с при потенциале –0.3 В и скорости вращения электрода 1600 об/мин. (г) Хроноамперограммы реакции восстановления кислорода на электродах из допированных азотом полых углеродных микросфер с иерархической системой пор и Pt/C при потенциале –0.3 В в 0.1 M растворе KOH, насыщенном кислородом, в присутствии 1.0 M метанола, снятые за 200 с. Стрелками показано добавление 1.0 M метанола к электролиту. (д) Вольтамперограммы при линейной развертке потенциала электродов из допированных азотом полых углеродных микросфер с иерархической системой пор в 0.1 M растворе KOH, насыщенном кислородом, снятые при скорости развертки потенциала 5 мВ с–1 и скорости вращения электрода от 250 до 2000 об/мин. (е) Графики Коутецкого–Левича для реакции восстановления кислорода, снятые на электроде из допированных азотом полых углеродных микросфер с иерархической системой пор. Врезка: число перенесенных в реакции восстановления кислорода электронов (n) в зависимости от потенциала на электроде из допированных азотом полых углеродных микросфер с иерархической системой пор.

Для дальнейшего исследования поведения допированных азотом полых углеродных микросфер с иерархической системой пор в реакции восстановления кислорода были предприняты вольтамперометрические измерения при линейной развертке потенциала со скоростью 5 мВ с–1 в насыщенном кислородом 0.1 M растворе KOH при скорости вращения электрода 1600 об/мин. Как показано на рис. 5б, потенциал начала реакции восстановления кислорода на допированных азотом полых углеродных микросферах с иерархической системой пор составляет приблизительно –0.016 В, что на 68 мВ положительнее, чем на допированных азотом полых углеродных микросферах. Плотность предельного тока реакции восстановления кислорода при потенциале –0.7 В на электроде из допированных азотом полых углеродных микросфер с иерархической системой пор составляет 3.15 мA cм–2, что выше, чем на допированных азотом полых углеродных микросферах (2.41 мA cм–2). Тот факт, что допированные азотом полые углеродные микросферы с иерархической системой пор демонстрируют гораздо более высокую электрокаталитическую активность в реакции восстановления кислорода, чем просто допированные азотом полые углеродные микросферы, можно объяснить большей площадью поверхности, более высоким содержанием “пиридинового” N и наличием иерархической системы пор. Хотя электрокаталитическая активность Pt/C-электрода в реакции восстановления кислорода еще выше, но его долговременная устойчивость в этой реакции намного хуже, чем у электрода из допированных азотом полых углеродных микросфер с иерархической системой пор. Как показано на рис. 5в, на последнем относительный ток составляет приблизительно 94% от своей первоначальной активности по прошествии 24 000 с, в то время как Pt/C-электрод потерял 24%.
Был исследован также возможный эффект кроссовера метанола в реакции восстановления кислорода на этих двух электродах; результат представлен на рис. 5г. Он заключается в том, что электрод из допированных азотом полых углеродных микросфер с иерархической системой пор отличается более высокой избирательностью по отношению к реакции восстановления кислорода, чем Pt/C-электрод, и большей устойчивостью против возможного эффекта кроссовера метанола.
С помощью уравнений Коутецкого–Левича было определено число электронов на молекулу кислорода, переносимых в реакции восстановления кислорода, катализируемой допированными азотом полыми углеродными микросферами с иерархической системой пор:
(2)
${{j}_{{\text{L}}}} = 0.62nF{{D}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}{{\nu }^{{ - {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}}}}{{c}_{{\text{O}}}}{{\omega }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$На рис. 5д показаны вольтамперограммы с линейной разверткой потенциала, снятые на электроде из допированных азотом полых углеродных микросфер с иерархической системой пор при скоростях вращения электрода от 250 до 2000 об/мин, а на рис. 5е – графики Коутецкого–Левича, полученные из этих вольтамперограмм. Значения n можно получить из наклонов графиков Коутецкого–Левича, пользуясь уравнениями (1) и (2). Число переносимых электронов при потенциале –0.7 В равняется 2.9, при уменьшении потенциала до –0.55 В оно падает до 2.3, указывая на то, что кислород восстанавливается одновременно по двухэлектронному и четырехэлектронному механизмам.
ЗАКЛЮЧЕНИЕ
Допированные азотом полые углеродные микросферы с иерархической системой пор синтезированы по методу шаблона в твердой фазе, с использованием меламино-формальдегидной смолы в качестве источника углерода и азота. Благодаря атомам допанта-азота и иерархической системе пор, эти свежеприготовленные допированные азотом полые углеродные микросферы с иерархической системой пор демонстрируют как хорошую электрокаталитическую активность, так и стабильность в реакции восстановления кислорода. Ожидается, что этот материал можно будет использовать в качестве электрокатализатора катодов как металл-воздушных аккумуляторов, так и низкотемпературных топливных элементов.
Список литературы
Khan, M.A., Zhao, H., Zou, W., Chen, Z., Cao, W., Fang, J., Xu, J., Zhang, L., and Zhang, J., Electrochem. Energ. Rev., 2018, vol. 1, p. 483.
Wang, X., Feng, J., and Bai, Y., Chem. Rev., 2016, p. 10983.
Li, S., Pasc, A., Fierro, V., and Celzard, A., J. Mater. Chem. A, 2016, p. 12686.
Ng, S., Yilmaz, G., and Ong, W.L., Appl. Catal. B Environ., 2018, vol. 220, p. 533.
Roberts, A.D., Li, X., and Zhang, H., Chem. Soc. Rev., 2014, p. 4341.
Gong, Y., Wei, Z., and Wang, J. P., Sci. Rep., 2014, vol. 4, p. 6349.
Du, G., Bian, Q., and Zhang, J., Rsc Adv., 2017, vol. 7, p. 46329.
Cychosz, K.A., Guillet-Nicolas, R., and Garcia-Martinez, J., Chem. Soc. Rev., 2017, vol. 46, p. 389.
Liu, J., Wickramaratne, N.P., and Qiao, S.Z., Nat. Mater., 2015, vol. 14, p. 763.
Zhang, W., Cui, T., and Yang, L., J. Colloid Interface Sci., 2017, vol. 497, p. 108.
Wenelska, K., Ottmann, A., and Moszyński, D., J. Colloid Interface Sci., 2018, vol. 511, p. 203.
Wang, H., Maiyalagan, T., and Wang, X., Acs Catal., 2012, vol. 2, p. 781.
Geng, D., Ding, N., and Hor, T.S.A., J. Mater. Chem. A, 2015, vol. 3, p. 1795.
Zhou, W., Xiao, X., and Cai, M., Nano. Lett., 2014, vol. 14, p. 5250.
Chen, X.Y., Chen, C., Xe, D.H., and Zhang, J.C., Ind. Eng. Chem. Res., 2013, vol. 52, p. 12025.
Han, J., Xu, G., and Ding, J. Mater. Chem. A, 2014, vol. 2, p. 5352.
Wang, L., Gao, Z., and Chang, J., Acs Appl. Mater. Interfaces, 2015, vol. 7, p. 20234.
Friedel, B. and Greulich-Weber, S., Small, 2006, vol. 2, p. 859.
Mou, S., Lu, Y., and Jiang, Y., Appl. Surf. Sci., 2016, vol. 384, p. 258.
Li, W., Chen, D., and Li, Z., Carbon, 2007, vol. 9, p. 1757.
Zhang, J., Wang, M., and Ge, J., Colloid Interface Sci., 2011, vol. 353, p. 16.
Wu, Y., Li, Y., and Qin, L., J. Mater. Chem. B, 2013, vol. 1, p. 204.
Hay, J.N., Br. Polym. J., 1971, vol. 3, p. 74.
Yamamoto, K., Koga, Y., and Fujiwara, S., Jpn. J. Appl. Phys., 2001, vol. 40, p. 123.
You, S., Ma, M., and Wang, W., Adv. Energy Mater., 2017, vol. 7, p. 1601364.
Sun, G., Ma, L., and Ran, J., Electrochim. Acta, 2016, vol. 194, p. 168.
Yan, W., Wang, L., and Chen, C., Electrochim. Acta, 2016, vol.188, p. 230.
Guo, D., Shibuya, R., and Akiba, C., Science, 2016, vol. 22, p. 361.
Ma, F., Zhao, H., and Sun, L., J. Mater. Chem., 2012, vol. 22, p. 13464.
Li, M., Zhang, Y., and Yang, L., Electrochim. Acta, 2015, vol. 166, p.310.
Tan, Y.,T., Ran, F., and Wang, L.R., J. Appl. Polym. Sci., 2013, vol. 127, p. 1544.
Sun, D., Zhang, R., and Liu, Z., Macromolecules, 2005, vol. 38, p. 5617.
Liu, C., Ge, C., and Wang, A., Korean J. Chem. Eng., 2011, vol. 28, p. 1458.
Qian, Y., Hu, Z., and Ge, X., Carbon, 2017, vol. 111, p. 641.
Lin, Z., Waller, G.H., and Liu, Y., Carbon, 2013, vol. 53, p. 130.
Jiang, D.D., Yao, Q., and McKinney, M.A., Polym. Degr. Stab., 1999, vol. 63, p. 423.
Zhou, Y., Yu, J., and Wang, X., Fiber. Polym., 2015, vol. 16, p. 1772.
Wang, Y.-J., Fang, B., Zhang, D., Li, A., Wilkinson, D.P., Ignaszak, A., Zhang, L., and Zhang, J., Electrochem. Energ. Rev., 2018, vol. 1, p. 1.
Дополнительные материалы отсутствуют.