Электрохимия, 2019, T. 55, № 11, стр. 1343-1348
Смешанный платиново-никелевый катализатор реакции восстановления кислорода
Т. А. Стельмашук a, Е. В. Алексеева a, *, О. В. Левин a
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
* E-mail: alekseeva_ev@yahoo.com
Поступила в редакцию 31.01.2019
После доработки 20.04.2019
Принята к публикации 20.05.2019
Аннотация
В результате синтеза и последующего щелочного гидролиза тонких полимерных пленок поли[Ni(Salen)], в поры которого были предварительно электроосаждены платиновые наночастицы, был получен смешанный катализатор на основе платины и оксида никеля. Эффективность работы катализатора была протестирована на примере реакции электровосстановления кислорода в щелочной среде. Отличительной особенностью катализатора является высокая, по сравнению с коммерческими аналогами, активность и толерантность к примесям метанола.
ВВЕДЕНИЕ
В настоящее время топливные элементы (ТЭ) рассматриваются как перспективная технология для перехода на экологически чистую энергетику. Платина долгое время рассматривалась, как один из основных катализаторов реакции восстановления кислорода (РВК) на катоде ТЭ [1–4]. Однако чистые платиновые катализаторы характеризуются крайне высокой стоимостью, а также низкой стабильностью по отношению к метанолу и другим примесям, что значительно снижает срок службы как катализатора, так и всей системы ТЭ в целом, при высокой стоимости производимой ими энергии. В результате это делает коммерческое применение ТЭ нерентабельным [5, 6]. Поэтому одной из ключевых задач при разработке ТЭ является создание новых каталитических систем восстановления кислорода с частичной или полной заменой металлов платиновой группы на такие переходные металлы как никель, кобальт, железо, марганец (и/или их оксиды) [7–13]. Было доказано, что сочетание благородных и переходных металлов кроме снижения стоимости и увеличения стабильности катализаторов, приводит также к увеличению активности полученных смешанных систем [7, 9, 14–16]. Среди биметаллических катализаторов системы Pt/Ni привлекают особое внимание благодаря низкой стоимости и доступности никеля, его относительной экологической безопасности и высокой активности полученного смешанного катализатора [12, 13, 17, 18]. Кроме того, введение никеля в состав биметаллического катализатора значительно повышает его толерантность к метанолу, что критически важно для использования катализатора в метанольных ТЭ. Так, в работе [19] было показано, что толерантность к метанолу и стабильность для катализатора Pt/Ni/С значительно выше, чем в случае платинового катализатора при более высокой активности биметаллического катализатора в РВК. Аналогичные результаты были получены и в других работах [7, 20–22]. Эффективные катализаторы должны содержать наноразмерные и равномерно диспергированные активные частицы. Однако при модификации различных поверхностей каталитическими слоями возникает задача по подбору подходящей методики их нанесения [23, 24]. В данной работе представлена новая методика темплатного синтеза смешанных катализаторов платина–оксид никеля (Pt/NiOx), которые обладают большей эффективностью в сравнении с платиной и коммерческим угольно-платиновым катализатором (E-TEK).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электрохимические измерения проводились в трехэлектродной ячейке. В качестве рабочего электрода использовался стеклоуглеродный диск (0.07 см2). В качестве электрода сравнения в водных растворах использовался хлоридсеребряный электрод (ХСЭ), Ag|AgCl(KCl нас), а в неводных растворах – нитратсеребряный Ag|AgNO3(0.1 M) (НСЭ) (E = 0.35 В относительно ХСЭ); вспомогательный электрод – платиновая пластина 1 см2. Все потенциалы далее приведены относительно ХСЭ. Электрохимические исследования были выполнены на потенциостате-гальваностате Metrohm Autolab PGSTAT12 с вращающимся дисковым электродом (Eco-Chemie, Нидерланды).
Синтез смешанного катализатора состоял из трех стадий: синтез полимерной пленки, ее модификация платиной и щелочной гидролиз модифицированного полимера. Методики синтеза полимера и его гидролиза описаны в работе [25]. Для модификации пленки poly[Ni(Salen)], толщина которой составляла около 10 нм, частицами платины использовали электроосаждение из водного раствора 6.4 × 10–3 М K2PtCl6 (Sigma-Aldrich) и 0.6 М HCl (“х. ч.”, Нева-Реактив), насыщенного азотом, путем линейной развертки потенциала (50 мВ/с) от потенциала разомкнутой цепи до ‒0.3 В, с последующим потенциостатическим осаждением в течение 1 с при потенциале –0.3 В (ХСЭ) (заряд, пошедший на электроосаждение платины, составлял ≈2 мКл). Загрузка платины в смешанном катализаторе Pt/NiOx составила 8.3 мкг/см2.
Циклические вольтамперограммы (ЦВА) катализатора Pt/NiOx были получены для электролита, последовательно насыщенного аргоном и кислородом, при различных скоростях вращения диска 0, 500, 831, 1000, 1247, 1747, 2331, 2500, 3000, 3500, 4000 об/мин.
Изучение морфологии методом сканирующей электронной микроскопии (СЭМ) и состава поверхности методом энергодисперсионной рентгеновской спектроскопии (ЭРС) проводилось на приборе SUPRA 40VP (Carl Zeiss, Германия), а изучение структуры поверхности методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на приборе Thermo Fischer Scientific Escalab 250Xi.
Стабильность катализатора изучалась в насыщенном кислородом растворе 0.2 М NaOH в потенциостатическом режиме с потенциалом –0.3 В (ХСЭ) на ВДЭ при скорости вращения 1000 об/мин. Толерантность к метанолу изучалась при помощи введения в эту систему добавки чистого спирта, которая обеспечивала концентрацию 5 М CH3OH в растворе.
В качестве сравнения в работе приведены также данные по каталитической активности и стабильности коммерческого платинового катализатора E-TEK (20% Pt/Vulcan XC72), нанесенного на электрод с использованием связующего Nafion по методике, описанной в работе [26]. Загрузка платины на электроде, модифицированном катализатором E-TEK, составила 28 мкг/см2.
Все измерения проводились на воздухе при комнатной температуре (20 ± 2)°C без термостатирования ячейки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование поверхности смешанного катализатора Pt/NiOx
На рис. 1 представлены СЭМ-изображения поверхности полимерной пленки комплекса поли[Ni(Salen)] до (а) и после модификации платиной (б), а также полученного после удаления полимера катализатора Pt/NiOx (в).
Рис. 1.
Исследование поверхности катализатора Pt/NiOx: (а) СЭМ-изображение поли[Ni(Salеn)]; (б) СЭМ-изображение композита поли[Ni(Salеn)]/Pt до окислительного гидролиза; (в) СЭМ-изображение катализатора Pt/NiOx; (г) СЭМ-изображение электрода, покрытого катализатором E-TEK; (д) РФЭС-спектры смешанных катализаторов Pt/NiOx; (е) ЭРС-спектр частицы, отмеченной на рис. 1в.

Исходный полимер поли[Ni(Salen)] состоит из отдельных глобул, образующих пористую структуру. При модификации полимера платиной происходит осаждение частиц в поры и толщу полимера, при этом платиновые частицы равномерно распределены по поверхности пленки (рис. 1б). После гидролиза полимерной пленки (рис. 1в) частицы платины остаются равномерно распределены по поверхности электрода. По данным анализа, проведенного в программе ImageJ, их средний размер составляет 100 ± 50 нм.
Исследования, проведенные методами РФЭС и ЭРС (рис. 1д, 1e) позволили установить, что на поверхности платиновых частиц содержится слой гидроксида никеля(II), на что указывает характерные полосы на спектре в области Ni2p [27].
Каталитическая активность смешанного катализатора Pt/NiOx
Прирост тока ЦВА, зарегистрированный при переносе модифицированного электрода из атмосферы аргона в атмосферу кислорода (рис. 2а), подтверждает отнесение пика в районе –0.2 В к реакции восстановления кислорода на исследуемом катализаторе.
Рис. 2.
(а) ЦВА электрода, покрытого Pt/NiOx, в 0.2 М растворе NaOH, насыщенном аргоном (пунктирная линия) и кислородом (сплошная линия), 0 об/мин; (б) ЦВА вращающихся дисковых электродов, покрытых Pt/NiOx, и, для сравнения, слоем катализатора Е‑ТЕК, в электролите насыщенным кислородом; скорость вращения 2500 об/мин. Здесь и далее ток отнесен к видимой поверхности электрода.
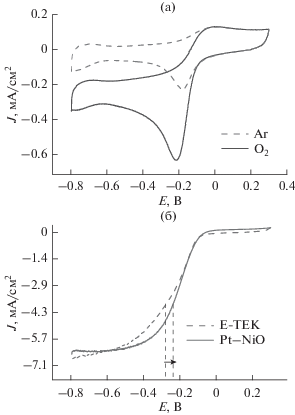
При регистрации циклических вольтамперограмм на вращающемся дисковом электроде наблюдается характерная волна восстановления кислорода (рис. 2б). Потенциал полуволны восстановления кислорода для Pt/NiOx сдвинут в область более положительных потенциалов (–0.22 В) по сравнению с E-TEK (–0.25 В). Это дает основания предполагать, что наличие никеля на платиновой поверхности улучшает ее каталитическую активность.
Кинетика реакции восстановления кислорода на смешанном катализаторе Pt/NiOx была изучена на вращающимся дисковом электроде при различных скоростях вращения (рис. 3) [28, 29]. По углу наклона зависимостей в координатах Левича–Каутецкого (врезка рис. 3) [28] было рассчитано, что в реакции восстановления кислорода для катализатора Pt/NiOx участвуют 4 электрона, это значит, что кислород восстанавливается полностью до воды. Таким образом, никель в смешанном катализаторе Pt/NiOx промотирует платину, но не изменяет механизм электровосстановления кислорода, в результате на данном катализаторе, как и на чистой платине [29], происходит четырехэлектронное восстановление кислорода до гидроксильных ионов.
Исследование стабильности катализаторов в присутствии метанола в растворе
Важным фактором, влияющим на оценку перспективности использования новых катализаторов, является их толерантность к потенциальным примесям, входящим в состав электролита ТЭ.
Как видно из хроноамперограмм, представленных на pис. 4, на платиновом катализаторе при добавлении метанола в фоновый электролит наблюдается резкое уменьшение тока восстановления кислорода. При изучении в аналогичных условиях катализатора Pt/NiOx, несмотря на меньшую загрузку платины (8.3 мкг/см2 против 28 мкг/см2 у E-TEK), отмечается лишь незначительное снижение катодного тока при добавке метанола, что говорит об устойчивости его каталитических характеристик в присутствии спирта и, следовательно, перспективности применения данного катализатора в спиртовых топливных элементах. Как известно из литературы, для протекания реакции окисления метанола требуется как минимум три соседних атома платины, в то время как РВК протекает на двух атомах [21]. В результате, присутствие никеля в составе смешанного катализатора приводит к снижению концентрации частиц платины на его поверхности, что приводит к меньшему количеству “тройных” активных центров, пригодных для протекания реакции окисления метанола. С другой стороны, скорость этой реакции уменьшается при уменьшении размера частиц платины [30–32]. Таким образом, увеличение толерантности к метанолу смешанного платиново-никелевого катализатора по сравнению с платиновым аналогом согласуется с ожиданиями, основанными на литературных данных.
Рис. 4.
Зависимости плотности катодного тока от времени в реакции электровосстановления кислорода, зарегистрированные в потенциостатическом режиме на СУ-электроде, модифицированном катализаторами Pt/NiOx (сплошная линия) и Е-ТЕК (пунктирная линия) в 0.2 М растворе NaOH, насыщенном кислородом, с добавлением 5 М метанола на 180-й с (–0.3 В, 1000 об/мин).

ЗАКЛЮЧЕНИЕ
В работе был изучен смешанный катализатор Pt/NiOх, полученный методом темплатного синтеза. Было показано, что данный катализатор проявляет большую активность в реакции восстановления кислорода и стабильность при добавлении метанола в электролит по сравнению с коммерческим платиновым катализатором Е-ТЕК.
Список литературы
Escudero-Escribano, M., Jensen, K.D., and Jensen, A.W., Recent advances in bimetallic electrocatalysts for oxygen reduction: design principles, structure-function relations and active phase elucidation, Curr. Opin. Electrochem., 2018, vol. 8, p. 135.
Imaoka, T., Kitazawa, H., Chun, W.J., and Yamamoto, K., Finding the Most Catalytically Active Platinum Clusters with Low Atomicity, Angew. Chem. – Int. Ed., 2015, vol. 54, p. 9810.
Wang, H., Yin, S., Eid, K., Li, Y., Xu, Y., Li, X., Xue, H., and Wang, L., Fabrication of Mesoporous Cage-Bell Pt Nanoarchitectonics as Efficient Catalyst for Oxygen Reduction Reaction, ACS Sustain. Chem. Eng, 2018, vol. 6, p. 11768.
Hoque, M.A., Hassan, F.M., Jauhar, A.M., Jiang, G., Pritzker, M., Choi, J.Y., Knights, S., Ye, S., and Chen, Z., Web-like 3D Architecture of Pt Nanowires and Sulfur-Doped Carbon Nanotube with Superior Electrocatalytic Performance, ACS Sustain. Chem. Eng., 2018, vol. 6, p. 93.
Zhang, J., Yang H., Fang, J., and Zou, S., Synthesis and oxygen reduction activity of shape-controlled Pt3Ni nanopolyhedra, Nano Lett, 2010, vol. 10, p. 638.
Joo, S.H., Lee, H.I., You, D.J., Kwon, K, Kim, J.H., Choi, Y.S., Kang, M., Kim, J.M., Pak, C., Chang, H., and Seung, D., Ordered mesoporous carbons with controlled particle sizes as catalyst supports for direct methanol fuel cell cathodes, Carbon, 2008, vol. 46, p. 2034.
Zou, L., Fan, J., Zhou, Y., Wang, C., Li, J., Zou, Z., and Yang, H., Conversion of PtNi alloy from disordered to ordered for enhanced activity and durability in methanol-tolerant oxygen reduction reactions, Nano Research, 2015, vol. 8, p. 2777.
Prabu, M., Ketpang, K., and Shanmugam, S., Hierarchical nanostructured NiCo2O4 as an efficient bifunctional non-precious metal catalyst for rechargeable zinc–air batteries, Nanoscale, 2014, vol. 6, p. 3173.
Huang, L., Jiang, Z., Gong, W., and Shen, P.K., Facile Fabrication of Radial PtCo Nanodendrites for Enhanced Methanol Oxidation Electrocatalysis, ACS App. Nano Mat., 2018, vol. 1, p. 5019.
Huang, X., Li, Y., Li, Y., Zhou, H., Duan, X., and Huang, Y., Synthesis of PtPd Bimetal Nanocrystals with Controllable Shape, Composition, and Their Tunable Catalytic Properties, Nano Lett., 2012, vol. 12, p. 4265.
Qu, X., Cao, Z., Zhang, B., Tian, X., Zhu, F., Zhang, Z., Jiang, Y., and Sun, S., One-pot synthesis of single-crystalline PtPb nanodendrites with enhanced activity for electrooxidation of formic acid, Chem. Commun., 2016, vol. 52, p. 4493.
Huang, X., Zhu, E., Chen, Y., Li, Y., Chiu, C.-Y., Xu, Y., Lin, Z., Duan, X., and Huang, Y., A Facile Strategy to Pt3Ni Nanocrystals with Highly Porous Features as an Enhanced Oxygen Reduction Reaction Catalyst, Adv. Mater., 2013, vol. 25, p. 2974.
Oh, A., Baik, H., Choi, D. S., Cheon, J. Y., Kim, B., Kim, H., Kwon, S.J., Joo, S.H., Jung, Y., and Lee, K., Skeletal Octahedral Nanoframe with Cartesian Coordinates via Geometrically Precise Nanoscale Phase Segregation in a Pt@Ni Core–Shell Nanocrystal, ACS Nano, 2015, vol. 9, p. 2856.
Wang, Q., Tian, Y., Chen, G., and Zhao, J., Theoretical insights into the energetics and electronic properties of MPt12 (M = Fe, Co, Ni, Cu, and Pd) nanoparticles supported by N-doped defective graphene, Appl. Surf. Sci., 2017, vol. 397, p. 199.
Zhang, C., Shen, X., Pan, Y., and Peng, Z., A review of Pt-based electrocatalysts for oxygen reduction reaction, Fron. in Energy, 2017, vol. 11, p. 268.
Shao, M., Chang, Q., Dodelet, J.-P., and Chenitz, R., Recent Advances in Electrocatalysts for Oxygen Reduction Reaction, Chem. Rev., 2016, vol. 116, p. 3594.
Niu, G., Zhou, M., Yang, X., Park, J., Lu, N., Wang, J., Kim, M.J., Wang, L., and Xia, Y., Synthesis of Pt–Ni Octahedra in Continuous-Flow Droplet Reactors for the Scalable Production of Highly Active Catalysts toward Oxygen Reduction, Nano Lett., 2016, vol. 16, p. 3850.
Chen, L., Zhu, J., Wang, J., Xiao, W., Lei, W., Zhao, T., Huang, T., Zhu, Y., and Wang, D., Phase conversion of Pt3Ni2/C from disordered alloy to ordered intermetallic with strained lattice for oxygen reduction reaction, Electrochim. Acta, 2018, vol. 283, p. 1253.
Liu, J., Lan, J., Yang, L., Wang, F., and Yin, J., PtM (M = Fe, Co, Ni) Bimetallic Nanoclusters as Active, Methanol-Tolerant, and Stable Catalysts toward the Oxygen Reduction Reaction, ACS Sustain. Chem. Eng, 2019, vol. 7, p. 6541.
Asteazaran, M., Cespedes, G., Bengió, S., Moreno, M.S., Triaca, W.E., and Castro, A.M. Luna, Research on methanol-tolerant catalysts for the oxygen reduction reaction, J. Appl. Electrochem., 2015, vol. 45, p. 1187.
Zignani, S.C., Baglio, V., Sebastián, D., Rocha, T.A., Gonzalez, E.R., and Aricò, A.S., Investigation of PtNi/C as methanol tolerant electrocatalyst for the oxygen reduction reaction, J Electroanal. Chem., 2016, vol. 763, p. 10.
Yang, H., Coutanceau, C., Léger, J.-M., Alonso-Vante, N., and Lamy, C., Methanol tolerant oxygen reduction on carbon-supported Pt–Ni alloy nanoparticles, J. Electroanal. Chem., 2005, vol. 576, p. 305.
Lee, D.U., Kim B.J., and Chen Z., One-pot synthesis of a mesoporous NiCo2O4 nanoplatelet and graphene hybrid and its oxygen reduction and evolution activities as an efficient bi-functional electrocatalyst, J Mater Chem A, 2013, vol. 1, p. 4754.
Al-Enizi, A.M., Elzatahry, A.A., Soliman, A.R.I., and Al-Theyab, S.S., Electrospinning synthesis and electrocatalytic performance of cobalt oxide/carbon nanofibers nanocomposite based PVA for fuel cell applications, Int. J. Electrochem. Sci., 2012, vol. 7, p. 12646.
Kuznetsov, N., Yang P., Gorislov, G., Zhukov, Y., Bocharov, V., Malev, V., and Levin, O., Electrochemical transformations of polymers formed from nickel(II) complexes with salen-type ligands in aqueous alkaline electrolytes, Electrochim. Acta, 2018, vol. 271, p. 190.
Schmidt, T.J., Gasteiger, H.A., Stäb, G.D., Urban, P.M., Kolb, D.M., and Behm, R.J., Characterization of high-surface-area electrocatalysts using a rotating disk electrode configuration, J. Elchem. Soc., 1998, vol. 145, p. 2354.
Matienzo, J., Yin, L.I., Grim, S.O., and Swartz, W.E., X-ray photoelectron spectroscopy of nickel compounds, Inorg. Chem., 1973, vol.12, p. 2762.
Коутецкий, Я., Левич, В.Г. Применение вращающегося дискового электрода к изучению кинетических и каталитических процессов в электрохимии. Журн. физ. химии. 1958. № 32(7). С. 1565. [Koutecky, Y. and Levich V.G., Using of a rotating disk electrode to the study of kinetic and catalytic processes in electrochemistry (in Russian), 1958, no. 32(7), p. 40.]
Liang, Y., Li, Y., Wang, H., Zhou, J., Wang, J., Regier, T., and Dai, H., Co3O4 nanocrystals on graphene as a synergistic catalyst for oxygen reduction reaction, Nature Mat., 2011, vol. 10, p. 780.
Salgado, J.R.C., Antolini, E., and Gonzalez, E.R., Carbon supported Pt–Co alloys as methanol-resistant oxygen-reduction electrocatalysts for direct methanol fuel cells, App. Catal. B: Envir., 2005, vol. 57, p. 283.
Greeley, J., Rossmeisl, J., Hellman, A., and Nørskov, J.K., Theoretical trends in particle size effects for the oxygen reduction reaction, Zeits. Physikal. Chem., 2007, vol. 221, p. 1209.
He, W., Liu, J., Qiao, Y., Zou, Z., Zhang, X., Akins, D.L., and Yang, H., Simple preparation of Pd–Pt nanoalloy catalysts for methanol-tolerant oxygen reduction, J. Power Sources, 2010, vol. 195, p. 1046.
Дополнительные материалы отсутствуют.



