Электрохимия, 2020, T. 56, № 12, стр. 1115-1130
Моделирование разряда никель-кадмиевых аккумуляторов
Ю. Л. Гунько a, *, О. Л. Козина a, А. А. Мюнц a, Н. О. Кузякин a, Е. Ю. Ананьева a, **, М. Г. Михаленко a
a Нижегородский государственный технический университет им. Р.Е. Алексеева,
Институт физико-химических технологий и материаловедения
603950 Нижний Новгород, ул. Минина, 24, Россия
* E-mail: cn-gunko2008@yandex.ru
** E-mail: ananieva.elena@yandex.ru
Поступила в редакцию 27.05.2019
После доработки 12.04.2020
Принята к публикации 15.05.2020
Аннотация
Представлен компьютерный анализ математической модели разряда никель-кадмиевого аккумулятора с различными типами электродов. Модель включает в себя анализ процессов в положительном оксидно-никелевом и отрицательном кадмиевом электродах и позволяет оценить зависимость поляризации электродов и напряжения аккумулятора от концентрации электролита, плотности тока разряда, конструктивных особенностей электродов. При расчетах учитывались механизмы процессов в положительном и отрицательном электродах, диффузионный, миграционный и конвективный перенос компонентов электролита как в электродах, так и в межэлектродном пространстве. Полученные расчетные данные показали применимость разработанной модели для изучения влияния различных факторов на разрядные характеристики никель-кадмиевых аккумуляторов.
ВВЕДЕНИЕ
Никель-кадмиевый аккумулятор (НКА) – один из самых надежных типов источников тока, поэтому рынок промышленных щелочных аккумуляторов большой емкости для железнодорожного транспорта, авиации, систем автономного энергообеспечения и других ответственных областей применения остается практически монопольным для НКА разного конструктивного применения. Положительным электродом в никель-кадмиевом аккумуляторе служит оксидно-никелевый электрод (ОНЭ), а отрицательным – кадмиевый электрод, электролитом служит концентрированный раствор KOH.
Для электродов НКА большой емкости наиболее распространена ламельная конструкция. Электроды ламельной конструкции характеризуются высокой механической прочностью, высокой механизацией процесса изготовления, большим сроком службы. Недостатками являются: относительно высокое внутреннее сопротивление, обусловленное малым общим сечением отверстий в ламелях, большое межэлектродное расстояние (для предотвращения коротких замыканий вследствие разбуханий электродов), невысокие удельные характеристики.
Кроме того, существуют безламельные конструкции электродов: металлокерамические, фольговые, намазные, вальцованные, прессованные, металловойлочные. Такие электроды, в отличие от ламельных, не имеют внешней металлической оболочки, токоотводы у них расположены в теле электрода и занимают меньший объем и массу, что повышает удельные характеристики, коэффициент использования активной массы и улучшает их работоспособность при высоких плотностях тока и низких температурах [1].
Разработка новых типов НКА, сочетающих различные конструкции положительных и отрицательных электродов, весьма длительна и трудоемка. Значительно упростить и ускорить процесс конструирования можно с помощью создания математических моделей процессов, происходящих в оксидно-никелевом и кадмиевом электродах и межэлектродном пространстве. Создание таких моделей позволит оптимизировать габариты электродов, а также рекомендовать технологию изготовления положительных и отрицательных электродов с оптимальным составом активной массы, исходя из конкретных условий работы аккумулятора.
Различают статистические, структурные, конструктивные и динамические модели. Статистические моделирование [2–4] заключается в поиске аналитических уравнений, описывающих электрические характеристики аккумуляторов. Структурные модели [5–7] основаны на импедансном методе. Конструктивные [8–10] и динамические [11–13] модели используют фундаментальные законы переноса, между ними нет четкой границы. Конструктивные модели отличает слабая структуризация, непоследовательный учет процессов переноса, использование экспериментальных зависимостей. Наибольший интерес представляют динамические модели, основанные на математическом описании физико-химических процессов, протекающих в аккумуляторе.
Для достаточно точного описания разряда НКА необходимо знать механизмы процессов, протекающих на электродах при разряде аккумулятора.
Согласно современным представлениям, электродные процессы в ОНЭ протекают по твердофазному механизму без промежуточного перехода ионов никеля в раствор. При этом электрохимические реакции идут на границе раздела гидроксид/электролит или сдвинуты вглубь твердой фазы. Анодное окисление гидроксида никеля(II) в щелочном растворе и соответственно восстановление высших оксидов никеля протекает путем удаления протонов из решетки гидроксида в раствор при заряде и внедрения протонов в кристаллическую решетку высших оксидов никеля при разряде [14]. Потенциал электрода определяется концентрацией активного кислорода в поверхностном слое электродных частиц [15]. С этим связано наличие двух видов диффузионной поляризации у оксидно-никелевых электродов: поляризация первого типа вызвана разностью содержания активного кислорода во внешних и внутренних зонах активных частиц, поляризация второго типа определяется разностью активностей потенциалопределяющих ионов в двойном электрическом слое и в общем объеме электролита.
В общем виде процесс разряда ОНЭ описывается реакцией (1) восстановления оксигидроксида никеля до гидроксида [1]:
(1)
${\text{NiOOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{e}} \to {\text{Ni(OH}}{{)}_{2}} + {\text{O}}{{{\text{H}}}^{ - }}.$Однако согласно экспериментальным данным степень окисления никеля в окисленной активной массе ОНЭ больше трех, а емкость электрода превышает рассчитанную по уравнению (1). Экспериментальные данные объясняются сложным фазовым составом активного вещества ОНЭ. Общепринято существование двух форм оксигидроксида никеля: β-NiOOH со степенью окисления никеля +3 и γ-NiOOH со степенью окисления между +3.5 и +3.8. Фаза β-NiOOH имеет кристаллическую структуру, а фаза γ-NiOOH – нерегулярную с включениями молекул воды и катионов. Для полностью восстановленной активной массы ОНЭ характерно существование двух форм Ni(OH)2 со степенью окисления +2: α‑Ni(OH)2 и β-Ni(OH)2. Фаза α-Ni(OH)2 имеет аморфную структуру с включением молекул воды, а фаза β-Ni(OH)2 – безводную кристаллическую структуру. На рис. 1 приведена схема реакций между четырьмя описанными фазами соединений никеля, предложенная Боде с соавторами [16]. Для ОНЭ возможны два разрядных процесса: восстановление β-NiOOH до β-Ni(OH)2 с получением одного электрона, и восстановление γ‑NiOOH до α-Ni(OH)2 с переходом 1.5–1.8 электронов. Эти два процесса связаны за счет электрохимического перехода β-NiOOH в γ-NiOOH при перезаряде и автоматической дегидратации α-Ni(OH)2 до β-Ni(OH)2.
Работы, посвященные анодному окислению кадмия в щелочных растворах, сводятся к существованию двух механизмов данного процесса: жидкофазного [17, 18] и твердофазного [19, 20]. Ряд исследователей приходили к выводу о возможности протекания процесса параллельно по двум механизмам [21, 22].
В результате протекания процесса по жидкофазному механизму по реакции (2) образуется пересыщенный раствор гидроксокомплексов кадмия, который по реакции (3) образует твердую фазу Cd(OH)2 с низкой удельной электропроводностью:
(2)
${\text{Cd}} + {\text{4O}}{{{\text{H}}}^{--}}--{\text{2e}} = {\text{Cd}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}} - }},$(3)
${\text{Cd}}\left( {{\text{OH}}} \right)_{4}^{{2 - }} \leftrightarrow {\text{Cd}}{{\left( {{\text{OH}}} \right)}_{2}} + 2{\text{O}}{{{\text{H}}}^{ - }}.$Гидроксид кадмия, осаждаясь на частицах активного вещества, приводит к уменьшению электрохимически активной поверхности и изменению физико-химических свойств границы раздела электрод/раствор.
Твердофазный механизм окисления кадмия по реакции (4) включает стадию переноса заряда через разделительную пленку гидроксида кадмия. Этот механизм становится возможным из‑за наличия у электрохимически образующегося Cd(OH)2p-типа проводимости [20]:
В [21] указывается, что, только учитывая оба вышеописанных механизма, можно с достаточной гибкостью описать анодное окисление и пассивацию кадмиевого электрода.
Авторами работы [23] методом хронопотенциометрии так же было показано параллельное протекание анодного окисления кадмия по твердофазному и жидкофазному механизмам.
По данным работ [24, 25], пассивация обусловлена образованием только CdO. Некоторые исследователи [26, 27] указывают на образование только Cd(OH)2, вероятна также двойная структура пленки, имеющая вид Cd/CdO и Cd(OH)2/OH–. В последнем случае поверхность экранируется тонкой пленкой окиси кадмия, а пленка Cd(OH)2 имеет рыхлую структуру, проницаемую для электролита [28, 29]. Ряд авторов рассматривают анодную пассивацию кадмия с позиций адсорбционного механизма [30], предполагающего образование адсорбционного слоя однозарядных ионов кислорода. В работе [31] предполагается два типа закрытия зерен металлического кадмия: тонким слоем активной гидроокиси кадмия или толстым слоем неактивной гидроокиси. В работе [32] методом фарадеевского импеданса было показано вероятное существование двухслойной барьерной пленки, состоящей из внутренней плотной и внешней рыхлой частей.
Ввиду распространенности НКА, его математическому моделированию посвящено большое количество работ с использованием различных подходов (статистические, структурные, конструктивные и динамические модели) [2–13]. Кроме того, в ряде статей отдельно рассматриваются процессы в оксидно-никелевых [33–35] и кадмиевых электродах [36–38]. ОНЭ, являющийся положительным электродом, во многих системах источников тока со щелочным электролитом также описывается в математических моделях соответствующих электрохимических систем [13, 39, 40].
Авторы современных работ стремились учесть наиболее значимые факторы, влияющие на потенциал положительного электрода, степень проработки ОНЭ и работоспособность кадмиевого электрода.
Наиболее полное описание физико-химических процессов отражено в работах [41–44].
Ю.Л. Гунько и О.Л. Козиной с соавторами были представлены модели разряда ОНЭ [41], а также разряда [42], заряда [43] и циклирования [44] кадмиевого электрода. При составлении модели процессов в ОНЭ учитывается возможность существования в заряженном состоянии β- и γ-фаз NiOOH и различия в проводимости этих фаз и коэффициентах диффузии протонов. Преимуществом моделей кадмиевого электрода являются учет строения и свойств образующихся двухслойных поверхностных пленок продуктов реакции, жидкофазного и твердофазного механизмов анодного окисления кадмия, переноса гидроксокадматных ионов в порах продуктов реакции. Объединение этих работ позволяет получить модель, способную с достаточной точностью оценить влияние различных физико-химических процессов и конструкции электродов на разрядные характеристики аккумулятора.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Математическая модель никель-кадмиевого аккумулятора
Схема моделируемого НК-аккумулятора изображена на рис. 2. В общем случае для ламельной конструкции электродов можно выделить следующие области: активная масса ОНЭ, ламельная лента положительного электрода, межэлектродное пространство с сепаратором, ламельная лента отрицательного электрода, активная масса кадмиевого электрода. Все компоненты являются пористыми материалами. В безламельной конструкции на границе с сепаратором ламельная лента отсутствует.
Рис. 2.
Схематичное изображение никель-кадмиевого аккумулятора ламельной конструкции: 1 – активная масса оксидно-никелевого электрода; 2 – ламель оксидно-никелевого электрода; 3 – межэлектродное пространство с сепаратором; 4 – ламель кадмиевого электрода; 5 – активная масса кадмиевого электрода.

Макроструктура пористых электродов аккумулятора имеет капиллярное строение (рис. 3). В телах капиллярного строения среда моделируется системой извилистых каналов с определенными геометрическими свойствами. Простейшая модель представляется капиллярными трубками постоянного диаметра, уложенными с постоянным периодом и направленными перпендикулярно поверхности электрода. Так как такие модельные поры имеют одинаковые геометрические размеры, то при описании работы пористого электрода можно рассматривать процессы, происходящие только в одной поре, что значительно упрощает моделирование зарядно-разрядных процессов [45]. Извилистость пор в этом случае учитывается коэффициентом извилистости.
Рис. 3.
Структура пористого электрода: 1 – электропроводная основа; 2 – активная масса; 3 – электролит.

При моделировании использовалась планарная система координат, так как радиус пор электродов примерно в 20–100 раз больше толщины слоя активного вещества.
При составлении моделей электродов были приняты следующие допущения:
1. Ток в электролите пор переносится ионами K+ (Na+), ОН–, ${\text{Cd}}({\text{OH}})_{4}^{{2 - }}.$
2. Числа переноса ионов не зависят от концентрации электролита.
3. Температурные градиенты в теле электродов отсутствуют.
4. Движение ионов в электролите происходит независимо друг от друга.
Поведение пористого электрода может быть описано следующим уравнением (5):
(5)
$\left\{ {\begin{array}{*{20}{l}} \begin{gathered} \frac{{\partial {{c}_{j}}}}{{\partial \tau }} = D_{j}^{{{\text{эф}}}}\frac{{{{d}^{2}}{{c}_{j}}}}{{d{{x}^{2}}}} + \frac{{{{n}_{j}}}}{{{{z}_{j}}F{\text{П}}}}\frac{{d{{i}_{{{\text{тв}}}}}}}{{dx}} \pm {{q}_{j}} - \upsilon \frac{{d{{c}_{j}}}}{{dx}}; \hfill \\ {\text{grad}}{{\Psi }_{{\text{р}}}} = - \frac{1}{{\chi _{{\text{р}}}^{{{\text{эф}}}}}}{{i}_{{\text{р}}}} - \frac{{RT}}{F}\sum\limits_{j = 1}^K {\frac{{{{n}_{j}}}}{{{{z}_{j}}}}} {\text{grad}}\ln {{c}_{j}}{\text{;}} \hfill \\ \end{gathered} \\ {{\text{grad}}{{\Psi }_{{{\text{тв}}}}} = - \frac{1}{{\chi _{{{\text{тв}}}}^{{{\text{эф}}}}}}{{i}_{{{\text{тв}}}}}{\text{;}}} \\ {{{{\Psi }}_{{{\text{тв}}}}} - {{{\Psi }}_{{\text{р}}}} - {{U}_{{{\text{ом}}}}} - \left| {{{u}_{j}}} \right| = f{\text{(}}J{\text{);}}} \\ {J = \frac{1}{{{{S}_{{{\text{уд}}}}}}}\frac{{d{{i}_{{{\text{тв}}}}}}}{{dx}}{\text{;}}} \\ \begin{gathered} {{i}_{{\text{р}}}} + {{i}_{{{\text{тв}}}}} = {{I}_{{\text{р}}}}{\text{;}} \hfill \\ {{i}_{{\text{р}}}} = - {{i}_{{{\text{тв}}}}}{\text{,}} \hfill \\ \end{gathered} \end{array}} \right.$Первое уравнение системы описывает изменение концентрации щелочи и гидроксокадмата калия во времени в порах электродов. Второе уравнение системы (5) показывает изменение потенциала в растворе при прохождении тока по жидкой фазе, третье уравнение дает изменение потенциала в твердой фазе, состоящей из активного вещества и электропроводящей добавки. Возникающая разность потенциалов между твердой и жидкой фазами вызывает протекание электрохимической реакции с плотностью тока J (четвертое уравнение системы (5)). Функция f(J) дает величину поляризации. Протеканию тока через границу раздела фаз препятствуют омическое сопротивление активного вещества Uом и изменение равновесного потенциала ui при изменении концентрации электролита и степени окисленности активного вещества (для ОНЭ).
Расчет плотности тока производится по пятому уравнению системы (5). Для безламельных электродов должно соблюдаться условие, описываемое шестым уравнением системы (5), для ламельных – седьмым уравнением, где iр и iтв – токи по жидкой и твердой фазам и Iр – разрядная плотность тока.
В связи с большой удельной поверхностью пористого электрода можно полагать, что плотность фарадеевского тока на границе раздела фаз мала и функция f(J) линейно зависит от плотности тока.
Эффективная электропроводность твердой фазы складывалась из электропроводностей электропроводящих добавок и активной массы уравнение (6):
(6)
$\chi _{{{\text{тв}}}}^{{{\text{эф}}}} = \chi _{{{\text{эл}}}}^{{{\text{эф}}}} + \chi _{{{\text{ак}}{\text{.в}}}}^{{{\text{эф}}}}.$Эффективная электропроводность электропроводящих добавок вычислялась по формуле (7):
где ${{\chi }_{0}}$ – удельная проводимость электропроводящих добавок, См/см; $E_{{\text{Э}}}^{k}$ – содержание вещества в электроде, см3/см3; k – коэффициент, зависящий от структуры пористого каркаса.Вычисление электропроводности активной массы зависело от принятой модели пористой среды.
Эффективная электропроводность электролита зависит от коэффициента извилистости и пористости электрода и рассчитывается по формуле:
(8)
$\chi _{{\text{р}}}^{{{\text{эф}}}} = {{\chi }_{{\text{р}}}}\frac{{\text{П}}}{{{{{\beta }}^{{\text{2}}}}}},$Изменение проводимости электролита в зависимости от активности КОН и температуры было получено обработкой справочных данных, приведенных в [46].
Поляризация пористого электрода включала в себя отклонение электродного потенциала от равновесного значения за счет концентрационных изменений, падение напряжения в электролите и твердой фазе и рассчитывалось по уравнению:
(9)
$\begin{gathered} \eta = \int\limits_0^x { - \frac{1}{{\chi _{{{\text{тв}}}}^{{{\text{эф}}}}}}{{j}_{{{\text{тв}}}}}} dx + \int\limits_x^L { - \frac{1}{{\chi _{{\text{p}}}^{{{\text{эф}}}}}}({{I}_{{\text{p}}}} - {{j}_{{{\text{тв}}}}})dx} + \\ + \,\,\frac{{RT}}{F}\sum\limits_{i = 1}^K {\frac{{{{n}_{i}}}}{{{{z}_{i}}}}} \int\limits_x^L {{\text{grad}}\ln {{c}_{i}}} + {{E}_{{{\text{диф}}}}} + {{U}_{{{\text{ом}}}}} + \left| {\eta (x)} \right|, \\ \end{gathered} $Математическое описание разряда аккумулятора характеризуется некоторыми особенностями. При разряде, особенно большими токами, происходит разогрев аккумулятора за счет выделения Джоулева тепла. Изменение температуры источника тока зависит от плотности разрядного тока, теплопроводности материала сосуда, теплоемкости электродных веществ, электролита и конструкционных элементов. Для такой сложной системы, как аккумулятор, оценить температурные изменения, протекающие в нем, довольно сложно, поэтому их учет проводился по приближенной эмпирической формуле. На основе экспериментальных данных [1] было установлено, что в процессе разряда изменение температуры зависит от толщины электродов, времени начала разряда и плотности тока.
Разрядное напряжение никель-кадмиевого аккумулятора рассчитывалось по формуле (10):
(10)
${{U}_{{{\text{разр}}}}} = E - {{{\eta }}_{{{\text{ОНЭ}}}}} + {{{\eta }}_{{{\text{Cd}}}}} - {\Delta }{{U}_{{{\text{ом}}}}} - {{E}_{{{\text{диф}}}}},$Область оксидно-никелевого электрода
Схематичные изображения строения поры оксидно-никелевого электрода в рамках модели единичной цилиндрической поры представлены на рис. 4а и 4б.
Рис. 4.
(a) Схематичное изображение поры оксидно-никелевого электрода безламельной конструкции: 1 – поровое пространство, заполненное электролитом (раствором КОН); C(Ni) – электропроводящая добавка (графит, спеченный карбонильный никель или никелированные полимерные волокна); NiO1 + θ – слой высших оксидов никеля; L – полутолщина электрода; Iр – разрядный ток; iфi – фарадеевский ток; d – толщина слоя активного вещества. (б) Схематичное изображение поры оксидно-никелевого электрода ламельной конструкции: 1 – поровое пространство, заполненное электролитом (раствором КОН); 2 – ламельная лента (токоотвод); C – электропроводящая добавка (графит); NiO1 + θ – слой высших оксидов никеля; L – полутолщина электрода; Iр – разрядный ток; iфi – фарадеевский ток; d – толщина слоя активного вещества.

Исходя из модельных представлений о структуре активного вещества, удельная поверхность пористого электрода может быть приблизительно оценена по уравнению (11), как и в [47].
где d – размер частиц активного вещества; E – содержание активной массы.Пористость оксидно-никелевого электрода по уравнению (12) после его изготовления равна
(12)
${\text{П}} = 1 - {{E}_{{{\text{Ni(OH}}{{{\text{)}}}_{{\text{2}}}}}}} - {{E}_{{{\text{доб}}}}},$Для приведения никель-кадмиевого аккумулятора в рабочее состояние обычно проводят несколько зарядно-разрядных циклов, в результате которых в заряженном оксидно-никелевом электроде происходит накопление β- и γ-NiOOH и меняется объем активного вещества из-за различия в плотностях Ni(OH)2 и высших оксидов никеля.
В модели учитывалось разбухание электрода при образовании более объемной γ-формы NiOOH. Принималось, что соотношение β- и γ-фаз NiOOH определяется только концентрацией щелочного электролита, так как предполагается, что заряд аккумуляторов проводится стандартными режимами.
Мольная доля γ-NiOOH рассчитывалась по эмпирическому линейному уравнению, исходя из предположения, что в 1 М растворе щелочи γ-фаза практически отсутствует, а в 14 М растворе щелочи ее доля близка к 1.
Исходя из начального содержания Ni(OH)2 рассчитывалось содержание β- и γ-фаз уравнения (13), (14):
(13)
${{E}_{\beta }} = {{E}_{{{\text{Ni(OH}}{{{\text{)}}}_{{\text{2}}}}}}} \times \left( {1 - Mg} \right) \times {{4.1} \mathord{\left/ {\vphantom {{4.1} {4.15}}} \right. \kern-0em} {4.15}},$(14)
${{E}_{{\gamma }}} = {{E}_{{{\text{Ni(OH}}{{{\text{)}}}_{{\text{2}}}}}}}Mg \times {{4.1} \mathord{\left/ {\vphantom {{4.1} {3.85}}} \right. \kern-0em} {3.85}},$В расчетах предполагалось, что пористость электрода оставалась постоянной и вычислялась по уравнению (12), а разница в объемном содержании ${{E}_{{{\text{Ni(OH}}{{{\text{)}}}_{{\text{2}}}}}}}$ и суммы удельных объемных содержаний β- и γ-NiOOH (Еγ + Еβ) компенсировалась увеличением толщины электрода.
Электрохимически активные поверхности β- и γ-NiOOH рассчитывались по уравнению (11).
Токи восстановления различных форм высших оксидов никеля связаны между собой соотношением
где I – ток электрохимической реакции.Для расчета эффективной электропроводности активной массы ОНЭ и различных фаз высших оксидов никеля в зависимости от степени окисленности использовались экспериментальные данные, приводимые Л.В. Сагояном [48].
Отклонение потенциала ОНЭ от равновесного значения, зависящее от активности воды $\left( {{{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \right),$ щелочи $\left( {{{a}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}} \right),$ степени окисленности активного вещества (θ) поверхностной зоны зерна активного вещества, рассчитывалось по уравнению (16), приведенному в [49]:
(16)
$E_{{{\text{диф}}}}^{{{\text{ОНЭ}}}} = E_{0}^{{{\text{ОНЭ}}}} + \frac{{RT}}{F}{\text{ln}}\left( {\frac{{{{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{{{{a}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}\frac{\theta }{{1 - \theta }}} \right),$Для расчета изменения концентрации щелочи при разряде ОНЭ учитывались ее увеличение за счет протекания фарадеевского процесса, а также потоки диффузии и миграции:
(17)
$\frac{{\partial {{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{\partial \tau }} = {{D}_{{{\text{эф}}}}}\frac{{{{\partial }^{2}}{{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{\partial {{x}^{2}}}} - \frac{{{{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{{{z}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}F{{{\text{П}}}^{{{\text{ОНЭ}}}}}}}\frac{{\partial {{I}_{{{\text{тв}}}}}}}{{\partial x}} + \frac{{\partial {{I}_{{{\text{тв}}}}}}}{{{{П}^{{{\text{ОНЭ}}}}}F\partial x}},$Эффективный коэффициент диффузии Dэф учитывает тормозящее действие пористой среды на процесс диффузии и может быть выражен через коэффициент извилистости пор (βОНЭ) и пористость электрода (ПОНЭ) по формуле
Уравнение (17) решалось при следующих начальных и граничных условиях:
(19)
${\text{начальное условие при}}\,\,\,\,\tau = 0\,\,\,\,\,\,\,\,\,{{c}_{i}} = {{c}_{{{\text{нач}}}}},$(21)
${\text{граница ОНЭ/токоотвод}}\,\,\,\,x = L\,\,\,\,\,{{\left. {\frac{{\partial c}}{{\partial x}}} \right|}_{{x = L}}} = 0.$Концентрация протонов в твердой фазе $\left( {{{c}_{{{{{\text{H}}}^{ + }}}}}} \right)$ оксидно-никелевого электрода при его разряде может быть выражена через степени окисленности активного вещества (θ) и мольный объем активного вещества (Vа.в), соответственно, β- и γ‑формы высших оксидов никеля следующим образом:
(22)
${{c}_{{{{{\text{H}}}^{ + }}}}} = \frac{{2 \times (1 - \theta )}}{{{{V}_{{{\text{а}}{\text{.в}}}}}}}.$При моделировании восстановления высших оксидов никеля поверхность токопроводящей основы и соответственно слоя активного вещества можно считать плоской, и распределение концентрации протонов по глубине слоя β- и γ-фаз высших оксидов никеля можно описать диффузионным уравнением второго порядка в планарных координатах:
(23)
$\frac{{\partial {{c}_{{{{{\text{H}}}^{{\text{ + }}}}}}}}}{{\partial \tau }} = {{D}_{{{{{\text{H}}}^{{\text{ + }}}}}}}\frac{{{{\partial }^{2}}{{c}_{{{{{\text{H}}}^{{\text{ + }}}}}}}}}{{\partial {{{(y)}}^{2}}}},$При описании твердофазной диффузии протонов в оксидно-никелевом электроде не учитывалась миграция протонов в твердой фазе вдоль поры электрода.
Для уравнения (23) начальным условием было $c = c_{{{{{\text{H}}}^{{\text{ + }}}}}}^{{\text{н}}}$ (рассчитывается по начальной степени окисленности активного вещества), а граничными – поток протонов за счет электрохимической реакции, протекающей на границе твердая фаза/раствор электролита y = 0) и нулевой поток на границе активное вещество–токоподвод (y = d):
(24)
$y = 0\,\,\,\,{{J}_{0}} = \frac{{d{{j}_{ }}}}{{zF}} = \frac{{{{D}_{{{{{\text{H}}}^{{\text{ + }}}}}}}d{{c}_{{{{{\text{H}}}^{{\text{ + }}}}}}}}}{{dy}},$(25)
$y = d\,\,\,\,{{\left. {\frac{{\partial {{c}_{{{{{\text{H}}}^{{\text{ + }}}}}}}}}{{\partial y}}} \right|}_{{y = d}}} = 0.$Влияние температуры на коэффициент диффузии протонов для разных фаз учитывалось аппроксимацией данных, приведенных в [50].
Область кадмиевого электрода
Пористость активной массы кадмиевого электрода (ПСdЭ) рассчитывалась, исходя из текущего содержания металлического кадмия (ЕСd), гидроксида кадмия (${{E}_{{{\text{Cd(OH}}{{{\text{)}}}_{{\text{2}}}}}}}$), электропроводящих и активирующих добавок (Едоб) по уравнению
(26)
${{{\text{П}}}^{{{\text{CdЭ}}}}} = 1 - {{Е}_{{{\text{Cd}}}}} - {{Е}_{{{\text{Cd(OH}}{{{\text{)}}}_{{\text{2}}}}}}} - {{Е}_{{{\text{доб}}}}}.$Изменение пористости при разряде кадмиевого электрода происходит за счет окисления металлического кадмия, химической реакции разложения гидроксокомплексов кадмия по жидкофазному механизму по реакции (3), и за счет реакции (4), протекающей по твердофазному механизму. Поэтому оно может быть рассчитано через изменение содержания твердых фаз электрода по уравнению
(27)
$\begin{gathered} \frac{{\partial {{{\text{П}}}^{{{\text{CdЭ}}}}}}}{{\partial \tau }} = - \frac{{{{V}_{{{\text{Cd}}}}}}}{{zF}}\frac{{d{{i}_{{{\text{тв}}}}}}}{{dx}} + K\left( {c_{{{\text{Cd(OH}})_{4}^{{2 - }}}}^{{{\text{тек}}}} - c_{{{\text{Cd(OH)}}_{4}^{{2 - }}}}^{{{\text{насыщ}}}}} \right) \times \\ \times \,\,{{V}_{{{\text{Cd(OH}}{{{\text{)}}}_{{\text{2}}}}}}}{{{\text{П}}}^{{{\text{CdЭ}}}}} + \frac{{(1 - \alpha ){{V}_{{{\text{Cd(OH}}{{{\text{)}}}_{{\text{2}}}}}}}}}{{zF}}\frac{{d{{i}_{{{\text{тв}}}}}}}{{dx}}, \\ \end{gathered} $Распределение тока по глубине кадмиевого электрода рассчитывалось согласно уравнениям системы (5).
Для расчета эффективной проводимости твердой фазы активное вещество кадмиевого электрода было представлено в виде цепочки кристаллов металлического кадмия с растущим на них слоем гидроксида (рис. 5). Частицы кадмия имеют определенную площадь соприкосновения, которая условно определялась коэффициентом перекрытия (k), зависящим от структуры частиц активного вещества. В ходе разряда размер частиц металлического кадмия уменьшается, и далее между ними образуется слой оксида и гидроксида кадмия с низкой электропроводностью. Такое модельное представление изменения состава и структуры твердой фазы позволяет учесть потерю контакта между электропроводными частицами кадмия в ходе разряда и уменьшение истиной удельной поверхности за счет окисления кадмия.
Рис. 5.
Схематичное представление твердой фазы кадмиевого электрода: 1 – продукты электрохимической реакции; 2 – кристаллы активного вещества; 3 – пора.

Удельная истинная поверхность электрода рассчитывалась исходя из геометрических представлениях о структуре частиц пористой среды.
При возникновении на поверхности частиц активного вещества продуктов электрохимической реакции окисления кадмия учитывалось двухслойное строение оксидной пленки. Сопротивление на границе твердая фаза/электролит рассчитывалось как сумма сопротивлений тонкой почти безпористой барьерной пленки и сопротивления переносу заряда в пористой оксидной пленке.
Сопротивление переносу заряда (фарадеевское сопротивление) определяется по формуле
где i0 – плотность тока обмена, А/см2.Удельное сопротивление барьерной пленки из оксида кадмия определяется по формуле
(29)
${{R}_{{{\text{Б}}{\text{.Пл}}}}} = {{\delta }_{{{\text{Б}}{\text{.Пл}}}}} \times \frac{1}{{{{\chi }_{{{\text{Б}}{\text{.Пл}}}}}}},$Для кадмиевого электрода отклонение потенциала от равновесного рассчитывалось, исходя из концентрационных изменений в электролите по уравнению
(30)
$E_{{{\text{диф}}}}^{{{\text{Cd}}}} = E_{0}^{{{\text{Cd}}}} + \frac{{RT}}{{zF}}{\text{ln}}\left( {\frac{{{{{\left[ {{\text{Cd(OH}})_{4}^{{2 - }}} \right]}}^{{{\text{тек}}}}}{{{\left( {a_{{{\text{O}}{{{\text{H}}}^{ - }}}}^{0}} \right)}}^{4}}}}{{{{{\left( {a_{{{\text{O}}{{{\text{H}}}^{ - }}}}^{{{\text{тек}}}}} \right)}}^{4}}{{{\left[ {{\text{Cd(OH}})_{4}^{{2 - }}} \right]}}^{0}}}}} \right).$В уравнении для расчета концентраций компонентов электролита включались члены, учитывающие диффузию, миграцию, конвекцию, изменение концентрации щелочи и гидроксокомплексов кадмия за счет протекания электрохимической и химической реакций $\left( {q_{i}^{{{\text{х}}{\text{.р}}}}} \right).$
В основу модели заложено, что растворение кадмия происходит по двум параллельным механизмам: жидкофазному – уравнения (2), (3) и твердофазному – уравнение (4).
Изменение концентрации компонентов за счет протекания химической реакции, согласно разряду по предложенной схеме, можно определить с помощью уравнений (31) и (32).
Для гидроксильных ионов:
(31)
$q_{{{\text{О}}{{{\text{Н}}}^{ - }}}}^{{{\text{х}}{\text{.р}}}} = 2K\left( {{{c}_{{{\text{Cd(OH}})_{4}^{{2 - }}}}} - c_{{{\text{Cd(OH}})_{4}^{{2 - }}}}^{{{\text{насыщ}}}}} \right)$для гидроксокомплекса кадмия соответственно:
(32)
$q_{{{\text{Cd(OH}})_{4}^{{2 - }}}}^{{{\text{х}}{\text{.р}}}} = - K\left( {{{c}_{{{\text{Cd(OH}})_{4}^{{2 - }}}}} - c_{{{\text{Cd(OH}})_{4}^{{2 - }}}}^{{{\text{насыщ}}}}} \right),$Распределение концентрации щелочи по поре кадмиевого электрода может быть рассчитано по уравнению (33).
(33)
$\begin{gathered} \frac{{\partial {{c}_{{{\text{KOH}}}}}}}{{\partial \tau }} = \frac{{{{\partial }^{2}}{{c}_{{{\text{KOH}}}}}}}{{\partial {{x}^{2}}}}\frac{{{{D}_{{{\text{KOH}}}}}{{{\text{П}}}^{{{\text{Cd}}}}}}}{{{{\beta }^{2}}}} + \frac{{({{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}} - (1 + {{K}_{{\text{ж}}}}))}}{{zF{\text{П}}}} \times \\ \times \,\,\frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}} + q_{{{\text{O}}{{{\text{H}}}^{ - }}}}^{{{\text{х}}{\text{.р}}}} - \frac{\nu }{{{{{\text{П}}}^{{{\text{Cd}}}}}}}\frac{{\partial {{c}_{{{\text{KOH}}}}}}}{{\partial x}}. \\ \end{gathered} $Для гидроксокомплексов кадмия уравнение (33) примет вид (34):
(34)
$\begin{gathered} \frac{{\partial {{c}_{{{{K}_{2}}[{\text{Сd(OH}}{{)}_{4}}]}}}}}{{\partial \tau }} = \frac{{{{\partial }^{2}}{{c}_{{{{K}_{2}}[{\text{Сd(OH}}{{)}_{4}}]}}}}}{{\partial {{x}^{2}}}}\frac{{{{D}_{{{{K}_{2}}[{\text{Сd(OH}}{{)}_{4}}]}}}{{{\text{П}}}^{{{\text{Cd}}}}}}}{{{{\beta }^{2}}}} + \\ + \,\,\frac{{({{n}_{{{\text{Сd(OH}})_{4}^{{2 - }}}}} + {{K}_{{\text{ж}}}})}}{{zFП}}\frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}} + q_{{{\text{Cd(OH}})_{4}^{{2 - }}}}^{{{\text{х}}{\text{.р}}{\text{.}}}} - \frac{\nu }{{{{{\text{П}}}^{{{\text{Cd}}}}}}}\frac{{\partial {{c}_{{{{K}_{2}}[{\text{Сd(OH}}{{)}_{4}}]}}}}}{{\partial x}}, \\ \end{gathered} $Величина конвективного потока по толщине связана с изменением пористости электрода определяется уравнением
(35)
$\frac{{\partial \nu }}{{\partial x}} = - \frac{{\partial {{{\text{П}}}^{{{\text{Cd}}}}}}}{{\partial \tau }}.$Уравнение диффузии для щелочи решались при следующих начальных и граничных условиях:
(36)
$\begin{gathered} {\text{начальные условия}}\,\,\left( {\tau = 0} \right)\,\,\,c = {{c}_{{{\text{нач}}}}}; \\ \upsilon = 0;\,\,\,{\text{П}} = {{{\text{П}}}_{{{\text{нач}}}}}; \\ \end{gathered} $(37)
$\begin{gathered} {\text{граничные условия}}\,\,\left( {x = 0} \right)\,\,{{c}_{j}} = {{c}_{{{\text{гран}}}}}; \\ x = L\,\,\,\,\,{{\left. {\frac{{\partial c}}{{\partial x}}} \right|}_{{x = L}}} = 0;\,\,\,\,\,{{\left. {\frac{{\partial \upsilon }}{{\partial x}}} \right|}_{{x = L}}} = 0, \\ \end{gathered} $Поскольку концентрация гидроксокомплексов кадмия значительно меньше, чем концентрация щелочи, то перенос гидроксокомплексов кадмия из электродного пространства в межэлектродное не учитывался, и граничные условия по гидроксокомплексам кадмия записывались следующим образом:
(38)
$\begin{gathered} {\text{начальные условия}}\,\,\left( {\tau = 0} \right)\,\,\,{{c}_{j}} = {{c}_{{{\text{нач}}}}}; \\ \upsilon = 0;\,\,\,{\text{П}} = {{{\text{П}}}_{{{\text{нач}}}}}; \\ \end{gathered} $(39)
$\begin{gathered} {\text{граничные условия}}\,\,x = 0\,\,\,\,\,{{\left. {\frac{{\partial c}}{{\partial x}}} \right|}_{{x = 0}}} = 0; \\ x = L\,\,\,\,\,{{\left. {\frac{{\partial c}}{{\partial x}}} \right|}_{{x = L}}} = 0;\,\,\,\,\,{{\left. {\frac{{\partial \upsilon }}{{\partial x}}} \right|}_{{x = L}}} = 0. \\ \end{gathered} $Концентрационные изменения в одном из электродов сказываются на концентрации электролита в объеме другого электрода, так как происходит процесс диффузии и миграции ионов через сепаратор.
Область межэлектродного пространства
Для расчета концентраций щелочи в положительном и отрицательном электродах необходимо знать ее значение на границах электрод/сепаратор. Концентрация щелочи может быть определена из условия неразрывности потока вещества через границу кадмиевый электрод/сепаратор и оксидно-никелевый электрод/сепаратор.
Для определения граничных концентраций щелочи решалась система уравнений:
(40)
$\left\{ \begin{gathered} \frac{{{{D}_{j}}{{{\text{П}}}^{{{\text{Cd}}}}}}}{{\beta _{{{\text{Cd}}}}^{2}}}{{\left. {\frac{{d{{c}_{j}}}}{{dx}}} \right|}_{{x = 0}}} - \frac{{{{D}_{j}}{{{\text{П}}}_{{{\text{лам}}}}}}}{{\beta _{{{\text{лам}}}}^{2}}}\frac{{d{{с}_{j}}}}{{d{{x}_{{{\text{лам}}}}}}} = 0 \hfill \\ \frac{{{{D}_{j}}{{{\text{П}}}_{{{\text{лам}}}}}}}{{\beta _{{{\text{лам}}}}^{2}}}\frac{{d{{с}_{j}}}}{{d{{x}_{{{\text{лам}}}}}}} - \frac{{{{D}_{j}}{{{\text{П}}}_{{\text{С}}}}}}{{\beta _{{\text{С}}}^{2}}}\frac{{d{{с}_{j}}}}{{d{{x}_{{\text{C}}}}}} = 0 \hfill \\ \frac{{{{D}_{j}}{{{\text{П}}}_{{{\text{лам}}}}}}}{{\beta _{{{\text{лам}}}}^{2}}}\frac{{d{{с}_{j}}}}{{d{{x}_{{{\text{лам}}}}}}} - \frac{{{{D}_{j}}{{{\text{П}}}_{{\text{С}}}}}}{{\beta _{{\text{С}}}^{2}}}\frac{{d{{c}_{j}}}}{{d{{x}_{{\text{C}}}}}} = 0 \hfill \\ \frac{{{{D}_{j}}{{{\text{П}}}^{{{\text{ОНЭ}}}}}}}{{\beta _{{{\text{ОНЭ}}}}^{2}}}{{\left. {\frac{{d{{c}_{j}}}}{{dx}}} \right|}_{{x = 0}}} - \frac{{{{D}_{j}}{{{\text{П}}}_{{\text{С}}}}}}{{\beta _{{\text{С}}}^{2}}}\frac{{d{{c}_{j}}}}{{d{{x}_{{\text{C}}}}}} = 0 \hfill \\ \end{gathered} \right.,$Результаты расчета по разработанной модели
Разработанная на основе вышеприведенных уравнений программа расчетов на ЭВМ выполняет следующие функции: позволяет рассчитать потенциалы ОНЭ и кадмиевого электрода, разрядное напряжение аккумулятора, работоспособность кадмиевого и оксидно-никелевого электродов при различных режимах эксплуатации источника тока, оценить равномерность распределения тока по толщине пористых электродов, учесть изменение концентрации электролита и состава активной массы в процессе разряда.
Проверка работоспособности модели была проведена при анализе разрядных характеристик НК-аккумуляторов с ламельными и безламельным конструкциями электродов, взятыми из [1]. Характеристики электродов определяются их толщиной, пористостью, размером частиц активного вещества и видом электропроводной добавки. Общими для всей системы параметрами являются первоначальная концентрация электролита, температура и разрядная плотность тока. Активная масса оксидно-никелевого электрода содержит β- и γ-NiOOH, кадмиевого электрода – металлический кадмий, гидроксид кадмия и добавки. Ограничителем емкости принимался оксидно-никелевый электрод как для аккумулятора ламельной конструкции [51], так и для аккумулятора с металлокерамическими электродами [1].
Проверка работоспособности модели была проведена при анализе разрядных характеристик НК-аккумуляторов с ламельными и безламельным конструкциями электродов. Разработанная модель позволяет удовлетворительно описывать работу НК-аккумулятора при различных условиях эксплуатации (рис. 6 и 7).
Рис. 6.
Расчетные и экспериментальные разрядные кривые НК-аккумулятора с ламельными электродами: 1 – расчетная разрядная кривая ОНЭ; 2 – расчетная разрядная кривая кадмиевого электрода; 3 – расчетная разрядная кривая НК-аккумулятора; 4 – экспериментальная разрядная кривая для НК-аккумуляторов типа М (по [1]); токи разряда: а ‒ 0.1 С; б – 1 С.

Рис. 7.
Расчетные и экспериментальные разрядные кривые аккумулятора НКГ-8К при комнатной температуре: 1 – расчетная разрядная кривая ОНЭ; 2 – расчетная разрядная кривая кадмиевого электрода; 3 – расчетная разрядная кривая НК-аккумулятора; 4 – экспериментальная разрядная кривая (по [1]); токи разряда: а – 2 А; б – 25 А. Тип электродов – металлокерамические.

Расхождение между экспериментальными и расчетными значениями емкостей зависит от условий разряда и, в основном, не превышает 5–8%.
Как видно из рис. 6, расчетные и экспериментальные кривые разрядного напряжения никель-кадмиевых аккумуляторов с ламельными электродами близки как по времени разряда, так и по величине разрядного напряжения. Увеличение тока разряда в 10 раз (до 1 С) приводит к сокращению времени разряда приблизительно в 11.5 раза как для экспериментальных, так и для расчетных разрядных кривых. В то же время модель позволяет оценить работу не только всего аккумулятора, но и отдельно положительных и отрицательных электродов. Так, например, при увеличении тока разряда в 10 раз ограничителем емкости аккумулятора с ламельными электродами остается положительный оксидно-никелевый электрод, а его средний разрядный потенциал снижается примерно на 100 мВ (кривые 3, рис. 6). Повысилась поляризация и отрицательного электрода (кривые 2, рис. 6). При этом разрядное напряжение уменьшается приблизительно на 150 мВ (кривые 3, рис. 6).
Лучшей работоспособностью обладают никель-кадмиевые аккумуляторы с безламельными металлокерамическими электродами (рис. 7). Если при средних режимах разряда величина разрядного напряжения ламельных и безламельных никель-кадмиевых аккумуляторов примерно одинакова, то увеличение разрядного тока до величин более 3 С (утроенной номинальной емкости) (ток разряда 25 мА), что в 3 раза больше, чем для ламельных аккумуляторов, привело к уменьшению разрядного напряжения всего на 100 мВ (рис. 7а и 7б).
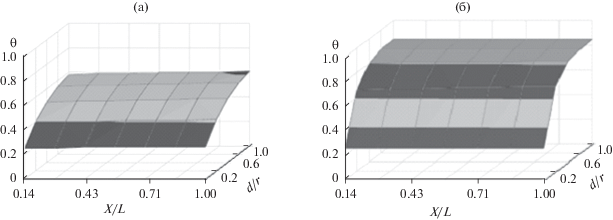
Предложенная модель разряда никель-кадмиевых аккумуляторов с различными конструкциями положительных и отрицательных электродов позволяет выяснить причины ухудшения работоспособности аккумуляторов, например, при возрастании разрядного тока. Так, например, уменьшение разрядной емкости аккумулятора с безламельными металлокерамическими электродами при росте тока разряда в основном обусловлено неполной проработкой как β-, так и γ-форм активного вещества положительного электрода (рис. 8а и 8б) при значительном снижении степени окисленности поверхностных зон зерен активного вещества.
Рис. 8.
Распределение степени окисленности (θ) активного вещества по глубине зерна и по поре электрода в конце разряда аккумулятора НКГ-8К при токе разряда 25 А: а – для β-NiOOH; б – для γ-NiOOH.
Наибольший вклад в величину поляризации оксидно-никелевого электрода на малых разрядных токах вносит поверхностная концентрация протонов в зернах активного вещества. При больших разрядных токах на величину поляризации положительного электрода начинает оказывать влияние омическое падение напряжения в активной массе и в электролите. Изменение степени окисленности поверхностных зон определяется величиной коэффициента диффузии протонов в твердой фазе и размером активных частиц.
При средних режимах разряда β-NiOOH прорабатывается равномерно практически на всю глубину зерен активного вещества (рис. 9а). В то же время во внутренних областях зерен активного вещества степень окисленности γ-NiOOH остается довольно высокой (около 0.45).
Рис. 9.
Распределение степени окисленности (θ) активного вещества по глубине зерна и по поре электрода в конце разряда аккумулятора c металлокерамическими электродами при токе разряда 2 А: а – для β-NiOOH; б – для γ-NiOOH.

Распределение тока в положительном электроде определяется соотношением сопротивлений активной массы электродов, электролита и поляризуемости электродных процессов в положительном и отрицательном электродах. В реальном оксидно-никелевом электроде соотношения сопротивления активной массы и электролита приблизительно одинаковы, что приводит к сосредоточению в начале разряда электрохимического процесса на внешней границе электрода (рис. 10).
Рис. 10.
Распределение тока по толщине электродов в различные моменты разряда НК-аккумулятора с металлокерамическими электродами. Время с начала разряда: 1 – 1 мин, 2 – 5 мин, 3 – 7 мин 20 с. Ток разряда 25 А.

По мере восстановления высших оксидов никеля происходит значительное изменение окислительно-восстановительного потенциала электрода и увеличение омического сопротивления активного вещества, что приводит к постепенному смещению зоны реакции вглубь электрода (рис. 10).
Аналогичные закономерности наблюдаются и при разряде оксидно-никелевого электрода малыми токами. Однако в этом случае градиенты величины тока по глубине электрода не столь значительны (рис. 11).
Рис. 11.
Распределение тока по толщине электродов в различные моменты разряда НК-аккумулятора с металлокерамическими электродами. Время с начала разряда: 1 – 4 мин, 2 – 2 ч, 3 – 3 ч 40 мин. Ток разряда 2 А.

Как при интенсивных режимах разряда, так и при средних наибольший вклад в поляризацию электрода вносит γ-NiOOH, что связано с более низким коэффициентом диффузии протонов в этой фазе.
В отрицательном электроде в начальный момент времени, как при малых, так и при больших разрядных плотностях тока, окисление кадмия происходит в поверхностных зонах электрода (рис. 10, 11). Перекрытие поверхности активных частиц продуктами реакции, увеличение сопротивления активной массы и уменьшение концентрации щелочи (рис. 12, 13) в этих зонах приводят к некоторому сдвигу зоны реакции во внутренние слои электрода. Протекание электрохимической реакции в теле электрода вызывает значительное снижение содержания щелочи в порах (рис. 12 и 13). Наибольшее изменение концентрации щелочи в порах кадмиевого электрода наблюдается при больших разрядных токах (рис. 12).
Рис. 12.
Распределение концентрации щелочи в электродах и межэлектродном пространстве в различные моменты разряда НК-аккумулятора с металлокерамическими электродами. Время с начала разряда: 1 – 1 мин, 2 – 5 мин, 3 – 7 мин 20 с. Ток разряда 25 А.

Рис. 13.
Распределение концентрации щелочи в электродах и межэлектродном пространстве в различные моменты разряда НК-аккумулятора с металлокерамическими электродами. Время с начала разряда: 1 – 4 мин, 2 – 2 ч, 3 – 4 ч 24 мин. Ток разряда 2 А.

В кадмиевом электроде при малых плотностях тока наряду со снижением концентрации щелочи на емкость электрода начинает оказывать влияние исключение из процесса разряда части активного вещества из-за образования между частицами металлического кадмия слоя оксидов с низкой электропроводностью. Уменьшение степени контакта частиц между собой и с токоотводом приводит к сокращению времени разряда.
При разряде большими токами основным фактором, влияющим на величину поляризации кадмиевого электрода, является концентрация щелочи и величина электрохимически активной поверхности. Это приводит к затруднению фарадеевского процесса и к увеличению омического сопротивления в порах электрода. Указанные факторы не позволяют распространиться зоне реакции вглубь кадмиевого электрода (рис. 10 и 11).
Согласно модели сепаратор практически не оказывает затруднений в переносе щелочи от положительного к отрицательному электроду. Максимальные градиенты концентрации наблюдаются в зоне оксидно-никелевого электрода, особенно при повышенных плотностях тока (рис. 12).
ВЫВОДЫ
Таким образом, разработанная модель разряда никель-кадмиевого аккумулятора позволяет адекватно описать изменение при различных условиях эксплуатации электрических характеристик и предсказать влияние различных факторов (электрохимически активной поверхности частиц активного вещества, концентрации КОН, проводимости активной массы и величины разрядной плотности тока конструктивных особенностей электродов и т.д.) на отдаваемую емкость.
Так, например, повышение разрядной плотности тока увеличивает поляризацию электродов и, соответственно, снижает разрядное напряжение, что связано с большими концентрационными затруднениями в положительном и отрицательном электродах. Для оксидно-никелевого электрода кроме того наблюдается большая неравномерность степени окисленности вещества по глубине зерна. Резкое изменение напряжения аккумулятора в конце разряда на малых плотностях тока (рис. 6а и 7а) связано с практически полным израсходованием активного вещества положительного электрода в его поверхностных зонах.
На больших разрядных токах не наблюдается резкого изменения напряжения НК-аккумуляторов с ламельными и безламельными электродами в конце разряда (рис. 6б, 7б). Это связано с практически линейным изменением поляризации кадмиевого электрода. Однако и в этом случае ограничителем емкости остается положительный электрод из-за затрудненности диффузии протонов в активном веществе оксидно-никелевого электрода.
Список литературы
Коровин, Н.В., Скундин, А.М. Химические источники тока. Справочник. М.: Изд-во МЭИ, 2003. 740 с. [Korovin, N.V. and Skundin, A.M., Chemical current sources. Handbook (in Russian), M.: Izdatelstvo MEI, 2003, 740 p.]
Теньковцев, В.В., Центер, Б.И. Основы теории эксплуатации герметичных НК аккумуляторов. Л.: Энергоатомиздат, 1985. 96 с. [Tenkovtsev, V.V. and Tsenter, B.I., Osnovy of the theory of operation of a sealed NK batteries (in Russian), Leningrad: Energoatomizdat, 1985. 96 p.]
Хаскина, С.М., Даниленко, И.Ф. Математическое моделирование разрядных кривых химических источников тока. Сборник работ по ХИТ. Л.: Энергия, 1981. С. 34. [Jaskina, S.M. and Danilenko, I.F., Matematicheskoe modelirovanie razryadnyh krivyh himicheskih istochnikov toka, Collection of works on HIT (in Russian), Leningrad: Energiya, 1981. p. 34.]
Галушкин, Д.Н., Язвинская, Н.Н. Уравнение разряда щелочных аккумуляторов. Активационно-омическая поляризация. Электрохим. энергетика. 2008. Т. 8. С. 118. [Galushkin, N.E. and Yazvinskaya, N.N., The equation of the discharge of alkaline batteries. Activation-ohmic polarization, Russ. Electrochem. energy (in Russian), 2008, vol. 8, p. 118.]
Keddam, M., Stoynov, Z., and Takenouti, H., Impedance measurement on Pb/H2SO4 batteries, J. Appl. Electrochem., 1977, vol. 7, p. 539.
Таганова, А.А. Импедансные характеристики герметичных никель-кадмиевых аккумуляторов. Сборник работ по ХИТ. Л.: Энергоатомиздат., 1987. С. 109. [Taganova, A.A., The Impedance characteristics of sealed nickel-cadmium batteries. Collector work on HIT (in Russian), Leningrad: Energoatom-date, 1987. p. 109.]
Galushkin, N., Yazvinskaya, N., and Galushkin, D., Nonlinear structural model of the battery, Int. J. Electrochem. Sci., 2014, vol. 9, p. 6305.
Хаскина, С.М., Даниленко, И.Ф. Математическая модель процесса заряда окисноникелевого электрода. Сборник работ по ХИТ. Л.: Энергия, 1984. С. 70–72. [Haskina, S.M. and Danilenko, I. F., Matematicheskaya model’ processa zaryada okisnonikelevogo elektroda, Collector works on HIT (in Russian), Leningrad: Energy, 1984. p. 70.]
Чирков, Ю.Г., Хомская, Е.А., Печенкин, В.В. Математическое моделирование процесса заряда в герметичном самодозирующемся аккумуляторе. Сборник трудов. Исследование в области прикладной электрохимии. Саратов: СГТУ, 1984. С. 13. [Chirkov, Yu.G., Chomsky, E.A., and Pechenkin, V.V., Matematicheskoe modelirovanie processa zaryada v germetichnom samodoziruyushchemsya akkumulyatore. Collected works. Research in the field of applied electrochemistry (in Russian), Saratov: SGTU, 1984. p. 13.]
Галушкин, Н.Е. Моделирование работы химических источников тока. Шахты: ДГАС, 1998. 223 с. [Galushkin, N.E., Modeling of operation of chemical current sources (in Russian), Mines: DGAS, 1998. 223 p.]
Fan, D. and White, R.E., Mathematical modeling of a nickel-cadmium battery, J. Electrochem. Soc., 1991, vol. 138, p. 2952.
Vidts, P.De. and White, R.E., Mathematical Modeling of a Nickel-Cadmium Cell: Proton Diffusion in the Nickel Electrode, J. Electrochem. Soc., 1995, vol. 142, p. 1509.
Gu, W.B., Wang, C.Y., and Liaw, B.Y., Micro-Macroscopic Coupled Modeling of Batteries and Fuel Cells II. Application to Nickel–Cadmium and Nickel–Metal Hydride Cells, J. Electrochem. Soc., 1998, vol. 145, p. 3418.
Кучинский, Е.М., Эршлер, Б.В. О механизме действия оксидно-никелевого электрода. Журн. физической химии. 1946. Т. 20. С. 539. [Kuchinsky, E.M. and Ershler, B.V., On the mechanism of action of the oxide-Nickel electrode, Russ. J. Physical Chemistry, 1946, vol. 20, p. 539.]
Луковцев, П.Д., Темерин, С.А. О природе потенциала и электрохимическом поведении реальных окисных электродов. Труды совещания по электрохимии. М.: АН СССР, 1953. 588 с. [Lukovtsev, P.D. and Temerin, S.A., O prirode potenciala i elektrohimicheskom povedenii real’nyh okisnyh elektrodov. Proceedings of the meeting on electrochemistry (in Russian), M.: Akademii Nauk USSR, 1953. 588 p.]
Bode, H., Dehmelt, K., and Witte, J., Zur Kenntnis der Nickelhydroxidelektrode – I. über das Nickel(II)-Hydro-xidhydrat, Electrochim. Acta, 1966, vol. 11, p. 1079.
Розенцвейг, С.А., Эршлер, Б.В., Штурм, Е.А., Останина, М.М. Электрохимические свойства кадмия в щелочных растворах. Труды Совещания по электрохимии. М.: АН СССР, 1953. 571 с. [Rosenzweig, S.A., Ershler, B.V., Sturm, E.A., and Ostanina, M.M., Elektrohimicheskie svojstva kadmiya v shchelochnyh rastvorah. Proceedings of the conference on electrochemistry (in Russian), M.: Akademii Nauk USSR, 1953. p. 571.]
Huber, K.J., Anodic Formation of Coatings on Magnesium, Zinc, and Cadmium, Electrochem. Soc., 1953, vol. 100, no. 8, p. 376.
Грачев, Д.К., Львова Л.А., Покатова, Г.М. О пассивации гладкого кадмиевого электрода в растворах щелочи. Исследования в области химических источников тока. Саратов: Саратовский университет, 1970. С. 10. [Grachev, D.K., Lvov, L.A., and Okatova, G.M., O passivacii gladkogo kadmievogo elektroda v rastvorah shchelochi. Studies in the field of chemical current sources (in Russian), Saratov: Saratov state University, 1970. p. 10.]
Groft, J.T. and Tuomi, D., A Model for Electrochemical Reaction Kinetics of Solid-State Phase Transformations in Reversible Electrodes, J. Electrochem. Soc., 1961, vol. 108, no. 10, p. 915.
Casey, E.J. and Garder, C.L., Anodic Passivation by “CdO” Studied by ESR, J. Electrochem. Soc., 1975, vol. 122, no. 7, p. 851.
Will, F.G. and Hess, H.I., Morphology and Capacity of a Cadmium Electrode Studies on a Simulated Pore, J. Electrochem. Soc., 1973, vol. 120, no. 1, p. 1.
Москвичев, А.А. Закономерности массопереноса в пористом кадмиевом электроде никель-кадмиевых аккумуляторов, дис. канд. тех. наук. Н. Новгород, 2008, 168 с. [Moskvichev, A.A., The Laws of mass transfer in a porous electrode of cadmium, Nickel-cadmium batteries, Ph. D. thesis, N. Novgorod, 2008, 168 p.]
Abdul-Azim, A.A. and El-Sobki, On the mechanism of passivation of the cadmium electrode in alkaline solutions, Electrochem. Acta., 1972, vol. 17, no. 4, p. 601.
Казаринов, И.А., Кадникова, Н.В., Львова, Л.А. Влияние условий гидратации окиси кадмия на электрические свойства кадмиевых электродов. Журн. прикл. химии. 1978. Т. 51. № 9. С. 1950. [Kazarinov, I.A., Kadnikova, N.In., and Lvov, L.A., Influence of cadmium oxide hydration conditions on the electrical properties of cadmium electrodes. J. Appl. Chem., 1978, vol. 51, no. 9, p. 1590.]
Okinaka, J., On the Oxidation-Reduction Mechanism of the Cadmium Metal-Cadmium Hydroxide Electrode, J. Electrochem. Soc., 1970, vol. 117, no. 3, p. 289.
Львова, Л.А., Грачев, Д.К., Объедков, Ю.И., Казаринов, И.А. Гальваностатические измерения при анодном окислении кадмиевого электрода в растворах КОН. Электрохимия. 1974. Т. 10. С. 964. [Lvovа, A.L., Grachev, D.K., Obyedkov, Y.I., and Kazarinov, I.A., Galvanostatic measurements during anodic oxidation of a cadmium electrode in solutions КОН, Russ. J. Electrochem., 1974, vol. 10, p. 964.]
Lake, P.E. and Casey, E.J., The Anodic Oxidation of Cadmium I. Mechanism of Film Formation, J. Electrochem. Soc., 1958, vol. 105, no. 1, p. 52.
Lake, P.E. and Casey, E.J., The Anodic Oxidation of Cadmium II. Electrical Properties of the Film, J. Electrochem. Soc., 1959, vol. 106, no. 11, p. 913.
Левина, В.И. Процессы, происходящие на кадмиевом электроде в щелочном растворе, Сборник работ по химическим источникам тока. Л.: Энергия, 1972. вып. 7. с. 138. [Levina, V.I., Processes occurring on a cadmium electrode in an alkaline solution, Collection of works on chemical current sources (in Russian), Leningrad:Energiya, 1972, vol. 7, p. 138.]
Аксютенок, М.В., Гунько, Ю.Л., Москвичев, А.А., Козина, О.Л., Михаленко, М.Г. Особенности окисления кадмия в ограниченном объеме щелочного электролита. Вестник Нижегородского университета им. Н.И. Лобачевского. 2012. № 4-1. С. 154. [Aksiutenok, M.B., Gun’ko, Y.L., Moskvichev, A.A., Kozina, O.L., and Mikhalenko, M.G., Features of cadmium oxidation in a limited volume of alkaline electrolyte. Bulletin of the Nizhny Novgorod University. N.I. Lobachevsky (in Russian), 2012, no. 4-1, p. 154].
Аксютенок, М.В. Макрокинетика процессов в щелочном аккумуляторе с модифицированным электродом, автореферат дис.канд. техн. наук, Н. Новгород, 2012, 138 с. [Aksiutenok, M.B., Macrokinetics of processes in the alkaline battery with modified electrode, abstract of Ph. D. thesis, N. Novgorod, 2012, 138 p.]
Micka, K. and Rousar, R., Theory of porous electrodes–XVI. The nickel hydroxide electrode, Electrochim. Acta, 1980, vol. 25, p. 1085.
Motupally, S., Streinz, C.C., and Weidner, J.W., Proton Diffusion in Nickel Hydroxide Prediction of Active Material Utilization, J. Electrochem. Soc., 1998, no. 29, p. 29.
Srinivasan, V., Weidner, J.W., and White, R.E., Mathematical models of the nickel hydroxide active material, J. Solid State Electrochem, 2000, vol. 4, p. 67.
Micka, K. and Rousar, R., Theory of porous electrodes–XV. The cadmium electrode, Electrochim. Acta, 1978, vol. 23, p. 1031.
Selanger, P., Analysis of porous alkaline Cd-electrodes. II. Potential recovery transients after a period of discharge, J. Electrochem., 1974. vol. 4, no. 3, p. 263.
Barnard, R., Edwards, G.S., Lee, J.A., and Tye, F.L., Effects of charge rate and cycling on the morphology of Cd and Cd(OH)2 in sintered plate electrodes, J. Appl. Electrochem., 1976, vol. 6, no. 5. p. 431.
Mao, Z., Vidts, P. De., White, R.E., and Newman, J., Theoretical Analysis of the Discharge Performance of a NiOOH/H2 Cell, J. Electrochem. Soc., 1994, no. 141, p. 54.
Гунько, Ю.Л., Пасманник, Е.В., Михаленко, М.Г. Моделирование процесса разряда никель-цинкового аккумулятора. Тез. докл. IX Всессеросс. конф. “Химическая информатика”. Черноголовка, 1991. С. 288. [Gun’ko, Y.L., Pasmanik, E.V., and Mikhalenko, M.G., Simulation of the discharge process of a Nickel-zinc battery. Proc. Doс. 9 all-Russian conference “Chemical Informatics” (in Russian), Chernogolovka, 1991. p. 288.]
Гунько, Ю.Л., Козина, О.Л., Михаленко, М.Г., Лоскутов, А.Б. Мюнц, А.А. Математическое моделирование разряда безламельного оксидно-никелевого электрода никель-кадмиевого аккумулятора. Электрохимия. 2015. Т. 51. С. 1060. [Gunko, Y.L., Kozina, O.L., Mikhalenko, M.G., Loskutov, A.B., and Myunts, A.A., Mathematical simulation of discharge of sintered-type nickel oxide electrode of nickel–cadmium battery, Russ. J. Electrochem., 2015, vol. 51, p. 935.]
Москвичев, А.А, Козина, О.Л., Гунько, Ю.Л., Михаленко, М.Г. Моделирование разряда пористого кадмиевого электрода щелочных источников тока. Электрохимия. 2009. Т. 45. С. 791. [Moskvichev, A.A., Kozina, O.L., Gunko, Y.L., and Mikhalenko, M.G., Porous cadmium electrode of alkaline batteries: discharge simulation, Russ. J. Electrochem., 2009, vol. 45, p. 736.]
Москвичев, А.А, Козина, О.Л., Гунько, Ю.Л., Михаленко, М.Г., Москвичев, А.Н. Математическое моделирование процесса заряда пористого кадмиевого электрода щелочных источников тока. Электрохимия. 2011. Т. 47. С. 880. [Moskvichev, A.A., Kozina, O.L., Gunko, Yu.L., Mikhalenko, M.G., and Moskvichev, A.N., Mathematical simulation of charging of process for porous cadmium electrode in alkaline batteries, Russ. J. Electrochem., 2011, vol. 47, p. 825.]
Москвичев, А.А, Козина, О.Л., Леонтьев, О.А., Гунько, Ю.Л., Михаленко, М.Г., Москвичев, А.Н. Математическое моделирование длительного циклования пористого кадмиевого электрода щелочных источников тока. Электрохимия. 2014. Т. 50. С. 260. [Moskvichev, A.A., Kozina, O.L., Leontiev, O.A., Gunko, Y.L., Mikhalenko, M.G., and Moskvichev, A.N., Mathematical modeling of prolonged cycling of a porous cadmium electrode in alkaline power sources, Russ. J. Electrochem., 2014, vol. 50, p. 231.]
Winsel, A., Beiträge zur Kenntnis der Stromverteilung in porösen Elektroden, Zeitschrift für Elektrochemie, вerichte der Bunsengesellschaft für physikalische Chemie, 1962, vol. 66, p. 287.
Дибров, И.А., Григорьева, Т.В. Термодинамические свойства γ-NiOOH. Электрохимия. 1979. Т.15. С. 281. [Dibrov, I.A. and Grigorieva, T.V., Thermodynamic properties of y-NiOOH, Russ. J. Electrochem., 1979, vol. 15, p. 281.]
Sunni, W.G. and Bennion, D.N., Transient and failure analyses of the porous zinc electrode II, J. Electrochem. Soc., 1980, vol. 127, p. 2007.
Сагоян, Л.Н. Некоторые проблемы теории, расчета и оптимизации конструкции, технологии производства оксидно-никелевого электрода щелочного аккумулятора, Дис. … докт. хим. наук. Днепропетровск, 1974, 372 с. [Sagoyan, L.N., Some problems of theory, calculation and optimization of design, technology of production of oxide-Nickel electrode of alkaline battery, Dis. … Doc. chem. sciences, Dnepropetrovsk, 1974, p. 372.]
Козина, О.Л. Разработка никель-железных аккумуляторов с повышенными удельными характеристикам, автореферат дис. канд. техн. наук. Н. Новгород, 1998, 148 с. [Kozina, O.L., Development of Nickel-iron batteries with increased specific characteristics, abstract of Ph. D. thesis, N. Novgorod, 1998, 148 p.]
Briggs, G.W.D. and Snodin, P.R., Ageing and the diffusion process at the nickel hydroxide electrode, Electrochimica Acta, 1982, vol. 27, p. 565.
Флеров, В.Н. Сборник задач по прикладной электрохимии. М.: Высшая школа, 1987. 317 с. [Flerov, V.N., Collection of problems in applied electrochemistry (in Russian), M.: High school, 1987. 317 p.]
Дополнительные материалы отсутствуют.



