Электрохимия, 2023, T. 59, № 1, стр. 43-55
Структура, подвижность кислорода и электрохимические характеристики материалов La1.7Ca0.3Ni1 – xCuxO4 + δ
В. А. Садыков a, *, Е. М. Садовская a, Н. Ф. Еремеев a, Т. Ю. Максимчук b, c, С. М. Пикалов d, Е. А. Филонова c, Н. С. Пикалова c, d, А. Р. Гилев c, Е. Ю. Пикалова b, c, **
a Федеральный исследовательский центр Институт катализа им. Г.К. Борескова СО РАН
Новосибирск, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
c Уральский федеральный университет
Екатеринбург, Россия
d Институт металлургии УрО РАН
Екатеринбург, Россия
* E-mail: sadykov@catalysis.ru
** E-mail: e.pikalova@list.ru
Поступила в редакцию 09.07.2022
После доработки 15.08.2022
Принята к публикации 30.08.2022
- EDN: JXVFCN
- DOI: 10.31857/S0424857023010206
Аннотация
Фазы Раддлесдена–Поппера являются одними из наиболее многообещающих материалов со смешанной ионной-электронной проводимостью, предназначенных для таких устройств, как кислородпроводящие мембраны, твердооксидные топливные элементы (ТОТЭ) и электролизеры (ТОЭ), работающих в области средних температур. Перспективность этих материалов в данных применениях обеспечивается их высокими значениями общей проводимости и подвижности кислорода. В настоящей работе было проведено исследование структурных свойств, подвижности кислорода и электрохимических характеристик перспективных материалов La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0–0.4). По данным прецизионного РФА, все полученные материалы являются однофазными и обладают тетрагональной структурой. Параметр элементарной ячейки c и объем ячейки увеличиваются при допировании медью. Содержание сверхстехиометрического междоузельного кислорода уменьшается при допировании, составы с высоким содержанием меди становятся дефицитными по кислороду. Для образцов характерна неоднородность подвижности кислорода. В целом наблюдается тенденция уменьшения кислородной подвижности в серии образцов La1.7Ca0.3Ni1 –xCuxO4 + δ при увеличении содержания Cu. Исследование электродов с La1.7Ca0.3Ni1 –xCuxO4 + δ функциональными слоями методом импедансной спектроскопии показало значительное увеличение электрохимической активности электродов с содержанием меди x > 0.2. Проведен анализ факторов, влияющих на производительность электродов. Результаты, полученные в исследовании, демонстрируют, что материал La1.7Ca0.3Ni0.6Cu0.4O4 + δ является перспективным для применения в качестве воздушных электродов в электрохимических устройствах.
ВВЕДЕНИЕ
Твердооксидные топливные элементы (ТОТЭ) – это электрохимические устройства прямого преобразования химической энергии топлива в электрическую энергию [1]. В настоящее время внимание исследований в технологии ТОТЭ с перспективой их коммерциализации акцентировано на снижении их рабочей температуры с целью уменьшения высокотемпературной деградации, снижения времени запуска устройств и возможного расширения выбора более дешевых функциональных материалов для уменьшения общей стоимости устройств [2, 3]. Твердооксидные топливные элементы с рабочими температурами 500–750°C получили название среднетемпературных (СТ-ТОТЭ) и ориентированы на использование в переносных устройствах и автомобилях, а также обеспечение теплом и электроэнергией удаленных хозяйств [1]. Однако, снижение рабочей температуры приводит к увеличению омического сопротивления электролита и поляризации электродов, особенно катода, из-за сложного механизма электрохимической реакции восстановления кислорода. Решением проблемы высокого поляризационного сопротивления катодного материала ТОТЭ при снижении рабочей температуры будет являться использование материалов, которые являются проводниками смешанного типа, обладающими как высокой электронной, так и значительной кислород-ионной проводимостью, включая таковые с перовскитоподобной структурой [2–6].
Высокую электронную проводимость, значительную подвижность ионов кислорода и требуемую устойчивость для использования в среднетемпературных ТОТЭ имеют сложнооксидные фазы со структурой Раддлесдена–Поппера: Ln2 –хMхNiO4 + δ (Ln – редкоземельный элемент (РЗЭ), M = Ca, Sr, Ba) [6, 7]. При рабочей температуре СТ-ТОТЭ (700°C) в базовом составе La2NiO4 + δ содержание междоузельного сверхстехиометрического кислорода δ в зависимости от метода синтеза может достигать 0.17, при этом материал демонстрирует высокие значения коэффициента кислородной диффузии (D* = 2 × 10−7 см2/с) и константы поверхностного обмена (k* = 2 × 10−6 см/с) [7]. Содопирование La2NiO4 + δ в позициях лантана и никеля влияет на физические и химические свойства, в том числе может приводить к увеличению электронной проводимости, снижению коэффициента термического расширения (КТР) и, в ряде случаев, приводит к улучшению электрохимических свойств [6, 8–10].
В среднетемпературном диапазоне кальций является лучшим допантом среди щелочноземельных металлов с точки зрения увеличения электронной проводимости базового состава La2NiO4 + δ [9, 10]. С другой стороны, известно, что замещение кальцием снижает ионную проводимость и электрохимические свойства материала [11]. Поэтому актуальными становятся исследования по поиску частично замещенных на переходные металлы в B-позиции оксидов La2 –xCaxNiO4 + δ, что может улучшить их ионную проводимость за счет появления вакансий в перовскитных слоях [12–17] и, соответственно, улучшить электрохимические свойства.
В связи с высокой функциональностью оксидов La1.7Ca0.3NiO4 + δ в качестве катодных материалов перед настоящим исследованием была поставлена цель по изучению возможности Cu-допирования в Ni-позиции оксида La1.7Ca0.3Ni1 –xCuxO4 + δ и выявлению факторов, влияющих на функциональные свойства данных материалов и электрохимическую активность электродов в симметричных ячейках в контакте с Ce0.8Sm0.2O1.9 (SDC), перспективным твердым электролитом для СТ-ТОТЭ [3, 18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика исходных материалов и приготовление керамических подложек электролита
Образцы La1.7Ca0.3Ni1 –xCuxO4 + δ были синтезированы методом твердофазной реакции. Исходные реактивы La2O3 (чистота 99.999%), CaCO3 (чистота 99.4%), Ni(CH3COO)2∙4H2O и CuO (чистота 99.0%) смешивали и прокаливали при 1000°C в течение 10 ч с последующим измельчением в планетарной мельнице Retsch Pulverizette 7 (Германия) со скоростью 250 об./мин в изопропиловом спирте в течение 1 ч в агатовом барабане с измельчающими шарами из нержавеющей стали, взятыми к массе порошка в соотношении 5 : 1. Необходимые количества исходных веществ рассчитывали по уравнению реакции (1) с образованием сложного оксида, углекислого газа CO2 и воды H2O:
(1)
$\begin{gathered} 0.3{\text{ CaC}}{{{\text{O}}}_{3}} + 0.85{\text{ L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + (1--x){\text{ Ni}}{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{COO}}} \right)}_{2}}\cdot4{\text{ }}{{{\text{H}}}_{{\text{2}}}}{\text{O }} + x{\text{CuO}} + {{{\text{O}}}_{2}} \to \\ \to {\text{L}}{{{\text{a}}}_{{{\text{1}}{\text{.7}}}}}{\text{C}}{{{\text{a}}}_{{{\text{0}}{\text{.3}}}}}{\text{N}}{{{\text{i}}}_{1}}_{{\,--\,x}}{\text{C}}{{{\text{u}}}_{x}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Финальный отжиг проводили при 1200°C в течение 10 ч для порошков с x = 0.0–0.2 и при 1150°С в течение 10 ч для порошков с x = 0.3–0.4. Снижение температуры синтеза обусловлено более высокой спекающей способностью материалов с большим содержанием меди. Удельная площадь поверхности порошков, определенная после окончательного измельчения в мельнице в течение 1 ч и сушки с помощью анализатора META SORBI N.4.1 (Россия), находилась в диапазоне 0.94–1.16 м2/г. Содержание примесей в порошках, полученных в результате измельчения, определяли с помощью оптического эмиссионного спектрометра с индуктивно связанной плазмой OPTIMA 4300 DV (Perkin Elmer, США). Содержание примесей после помола составило приблизительно 0.3 (Fe) и 0.4 (Si) мас. %.
Электролит состава Ce0.8Sm0.2O1.9 (SDC) синтезировали по керамической технологии из CeO2 марки “CeO-Л” и Sm2O3 марки “СмО-Л” с двухстадийным отжигом при температурах 950 и 1050°C с механоактивацией исходных и промежуточных продуктов в планетарной мельнице в течение 1 ч. Полученные таким образом порошки SDC прессовали под давлением 200 МПа в диски диаметром 15 мм. Спекание образцов проводили при 1620°C в течение 3 ч, скорость нагрева/охлаждения печи составляла 100°C/ч. Полученные подложки шлифовали на алмазном диске до толщины 1 мм, разрезали на 4 части для дальнейшего использования в качестве основы симметричных ячеек. Размеры измеряли с помощью электронного микрометра, разброс по толщине подложки составил не более 3 мкм. Для измерения слоевой проводимости аналогичным способом были изготовлены образцы с размерами 5 × 25 × 1 мм.
Методика рентгеновских исследований
Рентгеновские данные, необходимые для определения фазового состава образцов La1.7Ca0.3Ni1– xCuxO4 + δ, получали на воздухе при Т = 25°C на дифрактометре Shimadzu XRD-7000 (Япония) CuKα-излучении (плоский графитовый монохроматор). Съемку рентгенограмм проводили в интервале углов 23° < 2θ < 83° с шагом 0.02° и выдержкой 5 с в точке.
Идентификацию фаз осуществляли при помощи программного пакета fpeak. Уточнение параметров кристаллической структуры однофазных образцов La1.7Ca0.3Ni1– xCuxO4 + δ (x = 0.0–0.4) проводили методом полнопрофильного анализа Ритвелда [19] в модели Ле-Бейля при помощи программы FullProf [20].
Методика измерения содержания кислорода в образцах
Определение содержания кислорода в образцах La1.7Ca0.3Ni1 –xCuxO4 + δ (у = 0.0–0.4) проводили методом термогравиметрии с помощью термоанализатора NETZSCH STA 449 F3 Jupiter (Netzsch, Германия) в смеси 50% H2/50% Ar.
Метод определения содержания кислорода в образцах состоит в измерении относительного изменения массы образца как функции внешних условий (от температуры). Величина Δδ (изменение нестехиометрии) связана с регистрируемым изменением массы при переходе от начальных условий к текущим, по уравнению:
где g0 – масса оксида при начальных условиях, Δg – изменение массы при переходе от начальных условий к текущим, M – молекулярная масса оксида исследуемого оксида, MO – атомная масса кислорода.Методика изучения подвижности кислорода в образцах
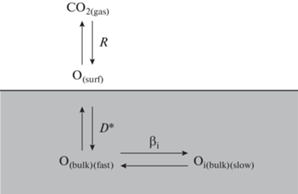
Подвижность кислорода была изучена методом термопрограммированного изотопного обмена кислорода с C18O2 в проточном реакторе. Образцы (фракция 0.25–0.5 мм) загружали в кварцевый реактор с внутренним диаметром 3 мм, который помещали в ток подаваемой газовой смеси (скорость подачи 25 мл/мин). Тренировку проводили в потоке 1% O2 в He при 700°C в течение 30 мин. Эксперимент проводили в потоке 1% C18O2 в He при нагреве от 50 до 800°C со скоростью нагрева 5°C/мин. Состав газовой смеси на выходе из реактора анализировали с помощью масс-спектрометра SRS UGA-200 (США). По полученным данным рассчитывали экспериментальные зависимости доли атомов 18O (α) и молекул C16O18O (f16–18) в газовой фазе от времени, по которым с использованием математического моделирования вычисляли коэффициент самодиффузии кислорода (D*) и его кажущуюся энергию активации (ED). Погрешность оценки определяемых величин составляла примерно ±10%.
Сканирующая электронная микроскопия
Микроструктуру и химический состав электродов La1.7Ca0.3Ni1 –xCuxO4 + δ, контактирующих с подложкой электролита SDC, исследовали с помощью сканирующего электронного микроскопа VEGA 3 (Tescan, Чехия), оснащенного детектором Ultim Max 40 (Oxford Instruments, Великобритания). Обработку полученных снимков осуществляли в программе ImageJ.
Методика измерения поляризационных характеристик и слоевой проводимости
Для исследования электрохимических характеристик электродов изготавливали ячейки с электролитом SDC толщиной около 1 мм с нанесенными с обеих сторон симметрично электродами. Функциональные слои составов La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0.0–0.4) наносили толщиной 30 мкм. Припекание слоев проводили при температуре 1000°C в течение 2 ч.
Поляризационное сопротивление электродов измеряли методом импедансной спектроскопии с помощью потенциостата SI 1260 и электрохимического интерфейса SI 1287 (Solartron Industries Inc.) в частотном диапазоне 0.01–500 кГц при амплитуде возмущающего переменного напряжения 30 мВ. Исследования проводили в температурном диапазоне 500–850°С в воздушной среде. За каждым измерением следовала запись общего сопротивления ячейки постоянного тока (Rdc). Функции распределения времен релаксации (DFRTs) были получены с помощью регуляризации Тихонова (TR) в версии MATLAB программного обеспечения DRTtools [21, 22]. Расчеты проводили с использованием функции гауссовского типа с параметром регуляризации (RP), равным 0.001.
Для измерения слоевой проводимости на электролит нанесли электроды La1.7Ca0.3Ni1 –xCuxO4 + δx = 0.0, 0.2 и 0.4 толщиной 100 мкм и припекали при температуре 1000°С. Измерения проводили четырехзондовым методом на постоянном токе с использованием контроллера Zirconia M (Россия) в интервале температур от 550 до 850°С на воздухе. Для организации электродов использовали платиновую проволоку с подмазкой со стороны электродного слоя платиновой пастой с ее последующим припеканием при 900°С, 2 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовая и структурная аттестация и определение содержания кислорода в La1.7Ca0.3Ni1 – xCuxO4 + δ
Анализ данных рентгеновской дифракции прецизионного РФА образцов La1.7Ca0.3Ni1 –xCuxO4 + δ (рис. 1) свидетельствует об образовании гомогенных оксидных материалов в интервале составов x = 0.0–0.4. Установлено, что на воздухе при 25°С оксиды обладают тетрагональной кристаллической решеткой (пространственная группа I4/mmm). Результаты структурного уточнения, полученные методом полнопрофильного анализа Ритвелда, представлены в табл. 1. Анализ концентрационной зависимости объема элементарной ячейки в исследуемом ряду демонстрирует увеличение объема ячейки с увеличением содержания меди вследствие замещения части ионов Ni на ионы Cu большего размера [23]. При этом следует отметить, что изменения параметров элементарной ячейки с увеличением допирования проявляют антибатный характер: параметр a немного уменьшился, а параметр c увеличился, что можно объяснить образованием удлиненных октаэдров Ni(Cu)O6 вместо октаэдров NiO6 [24, 25]. Образование более деформированных октаэдров Ni(Cu)O6 подтверждается данными расчетов межатомных расстояний в ряду La1.7Ca0.3Ni1 –xCuxO4 + δ. Длина связи Ni/Cu–O1, соответствующая параметру a, уменьшилась, тогда как увеличение длин связей La/Ca–La/Ca и Ni/Cu–O2 в сумме с небольшим уменьшением длины (La/Ca–O2) × 1 привело к общему увеличению параметра c.
Рис. 1.
Дифрактограммы образцов La1.7Ca0.3Ni1 –xCuxO4 + δ, x = 0.0 (а), 0.1 (б), 0.2 (в), 0.3 (г), 0.4 (д).
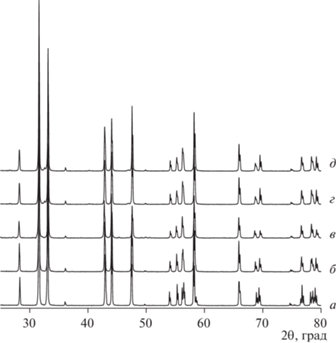
Таблица 1.
Параметры элементарной ячейки, выбранные длины связей и значения абсолютной кислородной нестехиометрии для образцов La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0.0–0.4)
| x | 0.0 | 0.1 | 0.2 | 0.3 | 0.4 | |
|---|---|---|---|---|---|---|
| a, Å | 3.8288(1) | 3.8236(1) | 3.8200(1) | 3.8104(1) | 3.8033(1) | |
| c, Å | 12.5984(2) | 12.6443(2) | 12.6761(3) | 12.7583(4) | 12.8036(3) | |
| V, Å3 | 184.69(1) | 184.86(1) | 184.97(1) | 185.23(1) | 185.21(1) | |
| L, Å | La/Ca–La/Ca | 3.480(2) | 3.491(2) | 3.502(2) | 3.519(2) | 3.534(2) |
| Ni/Cu–O1 × 4 | 1.9144(1) | 1.9118(1) | 1.9100(1) | 1.9052(1) | 1.9017(1) | |
| Ni/Cu–O2 × 2 | 2.20(1) | 2.21(1) | 2.23(1) | 2.25(1) | 2.26(1) | |
| La/Ca–O2 × 1 | 2.35(1) | 2.36(1) | 2.36(1) | 2.37(1) | 2.37(1) | |
| χ2 | 6.01 | 5.55 | 5.79 | 3.53 | 3.56 | |
| δTGA | 0.06(1) | 0.00(1) | 0.01(1) | –0.01(1) | 0.02(1) | |
Из данных полного восстановления образцов La1.7Ca0.3Ni1 –xCuxO4 + δ были рассчитаны значения δ, которые приведены в табл. 1, из которой можно сделать вывод, что допирование образцов медью приводит к снижению δ по сравнению с недопированным образцом. Снижение абсолютного содержания кислорода в образцах La1.7Ca0.3Ni1 –xCuxO4 + δ с увеличением Cu-допирования можно объяснить акцепторным действием катионов меди, что приводит к снижению средней степени окисления катионов никеля [26] и, соответственно, к снижению содержания междоузельного кислорода, компенсирующего напряжения в решетке, возникающие между перовскитными слоями и слоями каменной соли [27].
Подвижность кислорода в La1.7Ca0.3Ni1 – xCuxO4 + δ
На рис. 2 показаны кривые, полученные методом термопрограммированного изотопного обмена с C18O2 в проточном реакторе. Как видно из данных, процесс изотопного обмена кислорода начинается в области низких температур (200–300°C) для всех образцов, что говорит о высокой подвижности кислорода. Для образцов характерна неоднородность подвижности кислорода, что проявляется наличием нескольких пиков на кривых, полученных методом изотопного обмена (двух для x = 0.0 и трех для x = 0.1–0.4). Пик, расположенный при более низких температурах (около 400°C), соответствует изотопному замещению формы кислорода с большей подвижностью, в то время как пики, расположенные при более высоких температурах (более 500°C), соответствует изотопному замещению форм кислорода с меньшей подвижностью. При увеличении допирования Cu возрастает площадь высокотемпературных пиков на кривых изотопного обмена, что говорит о возрастании вклада форм кислорода с меньшей подвижностью. Для всех образцов, за исключением x = 0.3 и 0.4, наблюдается почти полное замещение кислорода объема образцов в течение эксперимента; для образцов с x = 0.3 и 0.4 в ходе эксперимента замещается около 70 и 60% кислорода объема, соответственно.
Рис. 2.
Кривые термопрограммированного изотопного обмена кислорода с C18O2 для образцов La1.7Ca0.3Ni1 –xCuxO4 + δ.

Для сопоставления с ранее исследованными образцами допированных кальцием никелатов лантана [11] была выбрана аналогичная модель, включающая один быстрый канал диффузии, в котором участвует наиболее слабосвязанный кислород и последующий обмен с близлежащими более прочно связанными атомами кислорода из решетки оксида (уравнения (3), рис. 3).
(3)
$\begin{gathered} \frac{{\partial {{\alpha }_{{\text{g}}}}}}{{\partial t}} + \frac{1}{\tau }\frac{{\partial {{\alpha }_{{\text{g}}}}}}{{\partial \xi }} = \frac{{{{N}_{{\text{S}}}}}}{{{{N}_{{\text{g}}}}}}R\left( {{{\alpha }_{{\text{S}}}} - {{\alpha }_{{\text{g}}}}} \right), \hfill \\ \frac{{\partial {{\alpha }_{{\text{S}}}}}}{{\partial t}} = \left( {{{\alpha }_{{\text{g}}}} - {{\alpha }_{{\text{S}}}}} \right) - \frac{{{{N}_{{\text{S}}}}}}{{{{N}_{{{{\theta }_{1}}}}}}}\frac{D}{{{{h}^{2}}}}{{\left. {\frac{{\partial {{\alpha }_{{{{\theta }_{1}}}}}}}{{\partial \eta }}} \right|}_{{\eta = 0}}}, \hfill \\ \frac{{\partial {{\alpha }_{{{{\theta }_{1}}}}}}}{{\partial t}} = \frac{D}{{{{h}^{2}}}}\left. {\frac{{{{\partial }^{2}}{{\alpha }_{{{{\theta }_{1}}}}}}}{{\partial {{\eta }^{2}}}}} \right| - \sum\limits_{i = 1}^n {\frac{{{{N}_{{{{\theta }_{{i + 1}}}}}}}}{{{{N}_{{{{\theta }_{1}}}}}}}} {{\beta }_{i}}\left( {{{\alpha }_{{{{\theta }_{1}}}}} - {{\alpha }_{{{{\theta }_{{i + 1}}}}}}} \right), \hfill \\ \frac{{\partial {{\alpha }_{{{{\theta }_{{i + 1}}}}}}}}{{\partial t}} = {{\beta }_{i}}\left( {{{\alpha }_{{{{\theta }_{1}}}}} - {{\alpha }_{{{{\theta }_{{i + 1}}}}}}} \right)\,\,\,i = 1, \ldots .n, \hfill \\ t = 0\,\,\,\,\,\,\,\,\,{{\alpha }_{i}} = 0, \hfill \\ \xi = 0\,\,\,\,\,\,\,\,{{\alpha }_{{\text{g}}}} = \alpha _{{\text{g}}}^{{{\text{input}}}}, \hfill \\ \end{gathered} $На образце без Сu (La2NiO4 + δ) четко выделяются две формы кислорода, различные по скорости замещения. На образцах c Сu как минимум три формы кислорода. Поэтому модель на образцах c Сu включала два типа обмена, характеризуемыми различными коэффициентами обмена β1 и β2. Параметры обмена указаны в табл. 2. Результаты моделирования представлены на рис. 4. Из таблицы видно, что процентное содержание наиболее подвижной части кислорода (θ1) падает с увеличением концентрации Сu, и на соответствующую величину увеличивается доля наименее подвижной части кислорода θ3, в то время как доля средней по подвижности части кислорода θ2 изменяется незначительно (рис. 4). Коэффициенты обмена практически не изменяются (рис. 5).
Таблица 2.
Значения коэффициентов самодиффузии кислорода (D*) и коэффициентов обмена (βi) при 700°C, их кажущихся энергий активаций (E) и доля каждой формы кислорода (θi) для образцов La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0.0–0.4)
| x | Формы кислорода | Диффузия θ1 | Обмен θ1 ↔ θ2 | Обмен θ1 ↔ θ3 | |||||
|---|---|---|---|---|---|---|---|---|---|
| θ1, % | θ2, % | θ3, % | D* × 109, см2/с | ED, кДж/моль | β1 × 102, 1/с | ${{E}_{{{{\beta }_{1}}}}},$ кДж/моль | β2 × 102, 1/с | ${{E}_{{{{\beta }_{2}}}}},$ кДж/моль | |
| 0.0 | 65 | 35 | – | 1.4 | 100 | 1.1 | 80 | – | 80 |
| 0.1 | 53 | 32 | 15 | 1.1 | 1.2 | 0.57 | |||
| 0.2 | 43 | 32 | 25 | 0.75 | 1.2 | 0.57 | |||
| 0.3 | 20 | 28 | 52 | 0.62 | 1.2 | 0.47 | |||
| 0.4 | 17 | 30 | 53 | 0.50 | 0.95 | 0.47 | |||
Рис. 4.
Кривые термопрограммированного изотопного обмена кислорода с C18O2 для образцов La1.7Ca0.3Ni1 –xCuxO4 + δ, x = 0.0 (а), 0.3 (б). Площади заштрихованных областей соответствуют долям различных по подвижности форм кислорода.
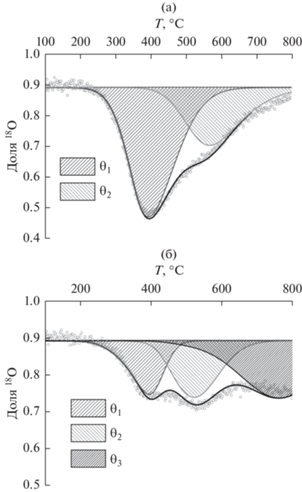
Высокая подвижность кислорода в оксидных образцах, имеющих структуру Раддлесдена–Поппера, обеспечивается кооперативным механизмом переноса кислорода, охватывающим решеточные и высокоподвижные междоузельные анионы кислорода [7, 28–30]. Коэффициент диффузии несколько уменьшается при увеличении содержания Cu. Аналогичная тенденция наблюдалась в серии образцов Nd1.6Ca0.4Ni1 –xCuxO4 + δ [30]. Возможно, это связано с частичным нарушением кооперативного переноса, которое предположительно связано с уменьшением содержания высокоподвижного междоузельного кислорода, что согласуется с данными ТГА и литературными данными [30, 31], а также с тем, что с уменьшением количества наиболее подвижных атомов кислорода в решетке оксида увеличивается среднее расстояние между ними. Тем не менее, для всех образцов значения коэффициента самодиффузии кислорода остаются достаточно высокими (рис. 5).
По-видимому, наиболее подвижная часть кислорода с процентным содержанием θ1, характеризуемая коэффициентом диффузии D*, переносится согласно кооперативному механизму. Перенос менее подвижной части кислорода с процентным содержанием θ2 и θ3, описываемый коэффициентами обмена β1 и β2 соответственно, связан с обменом между наиболее подвижной частью кислорода и соседними более прочно связанными анионами кислорода, который, по-видимому, происходит в слоях со структурой перовскита [11, 32]. Наличие двух менее подвижных форм кислорода при этом может быть связано с влиянием локальных искажений перовскитоподобной структуры вблизи катионов меди, которые, в свою очередь, влияют на энергию связи кислорода. Однако, для выяснения природы данных форм кислорода необходимы дополнительные исследования.
Исследование свойств электродов с функциональными слоями La1.7Ca0.3Ni1 – xCuxO4 + δ
Микроструктура электродов. На рис. 6 показаны СЭМ-изображения симметричных ячеек La1.7Ca0.3Ni1– xCuxO4 + δ (x = 0.0–0.4)/SDC, спеченных при 1000°C.
Рис. 6.
Микрофотографии поперечного сечения симметричных ячеек La1.7Ca0.3Ni1 –xCuxO4 + δ/SDC (а) и поверхности исследованных электродов (б).

Из рис. 6а видно, что полученные электродные слои демонстрируют высокую пористость без явных дефектов или отслоения от электролита, что указывает, вероятно, на хорошую термическую совместимость материала катода и электролита. Как нами было показано ранее, допирование медью приводит к снижению КТР в системе Nd1.6Ca0.4Ni1– xCuxO4 + δ, что увеличивает их совместимость с SDC и другими твердыми электролитами [33]. Прочность сцепления катодного слоя с электролитом важна, поскольку она приводит к меньшему контактному сопротивлению и способствует переносу заряда на границе раздела катода и электролита.
Ввиду того, что образцы были синтезированы при достаточно высокой температуре и в последующем диспергированы с использованием шаровой мельницы, микроструктура электродов представлена не только сравнительно маленькими частицами (<1 мкм), но и значительно более крупными не размолотыми зернами (>3–4 мкм). В особенности это выражено для электродов с содержанием меди x = 0.1 и 0.2, размер частиц в которых может быть существенно больше 3–4 мкм (см. рис. 6). При большем содержании меди (x = = 0.3 и 0.4) различие в размерах зерен становится менее выраженным, что приводит к более однородной микроструктуре электродов. Несмотря на это, количество мелких зерен существенно превышает число крупных зерен, и средний размер частиц составляет 0.4, 0.5, 0.5, 0.9 и 1.1 мкм при содержании меди (x) 0, 0.1, 0.2, 0.3 и 0.4 соответственно. Однако, следует отметить, что выявленная неоднородность микроструктуры электродов может иметь отрицательный эффект на общее поляризационное сопротивление данных материалов. Следует также упомянуть, что постепенное увеличение среднего размера зерен с ростом x свидетельствует об улучшении спекаемости La1.7Ca0.3Ni1 –xCuxO4 + δ при допировании медью.
Изучение электрохимических свойств. На рис. 7a представлены результаты измерений поляризационного сопротивления симметричных ячеек La1.7Ca0.3Ni1 –xCuxO4 + δ/SDC в виде спектра и его фитинга (электроды припечены при 1000°C, без коллектора). Сравнение графиков импеданса, измеренных при 600°C, показывает, что поляризационное сопротивление исследуемых ячеек при небольших содержаниях меди незначительно увеличивается, а затем начинает заметно уменьшаться при x ≥ 0.3. Принимая во внимание полученные выше результаты, первоначальное увеличение поляризационного сопротивления электродов при допировании можно объяснить уменьшением содержания междоузельного кислорода, определяющего ионную проводимость материала и, следовательно, влияющего на его электрохимические свойства [7]. С другой стороны, наблюдаемое увеличение может быть также связано с неоднородной микроструктурой полученных электродов (x = 0.1 и 0.2). Присутствие крупных зерен (>3–4 мкм) в электроде будет уменьшать общую площадь поверхности доступную для адсорбции кислорода, а также ограничивать подвод газообразного кислорода к зоне электрохимической реакции.
Рис. 7.
Спектры импеданса (а), полученные при 600°C, и температурные зависимости поляризационного сопротивления (б) электродов La1.7Ca0.3Ni1 –xCuxO4 + δ, припеченных на SDC подложках при 1000°С.

При дальнейшем увеличении содержания меди происходит улучшение спекаемости материала и, как следствие, улучшается адгезия к электролиту. Это способствует улучшению переноса заряда на границе электрод/электролит и, следовательно, может повышать активность электрода в целом. Температурные зависимости поляризационного сопротивления Rp показаны на рис. 7б. Для состава La1.7Ca0.3Ni0.6Cu0.4O4 + δ наблюдаются наименьшие значения поляризационного сопротивления во всем температурном интервале. При 850°C Rp равно 0.15 Ом см2, что в 4 раза ниже, чем для базового состава La1.7Ca0.3NiO4 + δ (0.60 Ом см2), энергия активации электродного процесса снижается с 1.68 до 1.38 эВ.
Для выяснения возможного влияния на электрохимические свойства проводимости слоя электрода, была измерена слоевая проводимость тонких слоев La1.7Ca0.3Ni1 –xCuxO4 + δ (100 мкм), припеченных на электролите Ce0.8Sm0.2O1.9 при 1000°C. Обнаружено, что минимальное значение сопротивления соответствует образцу с x = 0.2 (рис. 8), таким образом влияние проводимости слоя на поляризационные характеристики в данном случае не является определяющим. Более того, в ряде работ отмечается уменьшение общей проводимости материалов при допировании медью [24, 26] и прямой корреляции с электрохимическими свойствами электродов также не наблюдается.
Для дальнейшего выяснения факторов, приводящих к улучшению электрохимических свойств La1.7Ca0.3Ni1 –xCuxO4 + δ электродов, было проведено выделение парциальных вкладов различных электродных процессов с помощью анализа функции распределения времен релаксации (DFRT). Выделенный высокочастотный процесс Rhigh (рис. 9а) с характеристической емкостью 10–6 Ф/см2, согласно имеющимся в литературе данным [34, 35], характеризует перенос заряда на границе раздела электрод/электролит. Среднечастотный процесс (Rmid) с емкостью 10–4 Ф/см2 может соответствовать переносу заряда в активной зоне MIEC-электрода. Энергия активации данного процесса ~1 эВ. Процесс с характеристической емкостью 10–3–10–4 Ф/см2 (Rlow) связан с диффузионными процессами, характерными для электродов на основе MIECs, – твердотельной диффузией и поверхностным обменом кислорода. Энергия активации низкочастотного процесса порядка 1.8 эВ. В диапазоне температур 500–750°С диффузионные процессы вносят наиболее существенный вклад в суммарное поляризационное сопротивление, относительный вклад процессов переноса заряда заметно возрастает при более высоких температурах. Процесс с емкостью порядка 1 Ф/см2 (RS) может быть связан с газофазной диффузией кислорода в порах электродов [35]. Высокая энергия активации данного процесса порядка 2 эВ позволяет предположить, что вклад RS характеризует более сложный процесс, включающий не только газофазную диффузию кислорода, но и кислородный обмен на границе раздела электрод/газовая фаза. Увеличение содержания меди до x = 0.2 мало влияет на поляризационное сопротивление исследуемых образцов (рис. 9б), при x ≥ 0.3 значения Rlow и RS значительно уменьшаются. Такой результат свидетельствует о том, что замещение медью может способствовать поверхностному кислородному обмену в La1.7Ca0.3Ni1 –xCuxO4 + δ, вероятно, за счет уменьшения междоузельного кислорода и образования кислородных вакансий. Согласно [36], адсорбированный кислород в структуре слоистого никелата сначала перемещается в апикальную кислородную вакансию и только после этого перемещается в междоузлие. В рамках этой концепции образование кислородных вакансий в La1.7Ca0.3Ni1 –xCuxO4 + δ при замещении медью должно способствовать поверхностному обмену, что хорошо согласуется с результатами настоящей работы по электрохимическим характеристикам электродов. Следует отметить, что суммарное поляризационное сопротивление оптимизированного однослойного La1.7Ca0.3Ni0.6Cu0.4O4 + δ электрода при 700°С составляет 1.96 Ом см2, что существенно ниже, чем таковое для электродов состава La1.7Ca0.3NiO4 + δ + + x мас. % СuO, где x = 1–3 с токовым коллектором LaNi0.6Fe0.4O3 – δ (6.5–11.5 Ом см2 в зависимости от содержания меди и температуры припекания [37]). Таким образом, рассмотренный в данной работе метод введения меди в качестве допанта можно считать более предпочтительным по сравнению с введением оксида меди в материал электрода непосредственно перед его изготовлением. Более того, данный метод при достаточно высоком содержании допанта позволяет добиться низкого поляризационного сопротивления электродов без применения коллектора. Таким образом, в целом технология изготовления электрода упрощается, что дает определенные преимущества при дальнейшем масштабировании технологии.
ЗАКЛЮЧЕНИЕ
В данной работе сложные оксиды состава La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0.0–0.4) были синтезированы твердофазным методом. Для полученных материалов было установлено, что:
• оксиды на воздухе при комнатной температуре обладают тетрагональной структурой с пространственной группой I4/mmm;
• с увеличением содержания меди параметр элементарной ячейки c и объем ячейки увеличиваются, а абсолютное содержание кислорода в образцах уменьшается;
• выявлено несколько форм кислорода, различных по подвижности, при этом с увеличением содержания меди коэффициенты самодиффузии кислорода немного уменьшаются, но остаются достаточно высокими для всех образцов;
• в ряду La1.7Ca0.3Ni1 –xCuxO4 + δ (x = 0.0–0.4) допирование медью снижает поляризационное сопротивление электродов на подложках электролита Ce0.8Sm0.2O1.9 с 0.6 (x = 0.0) до 0.15 Ом см2 (x = 0.4) при 850°C на воздухе.
Следовательно, сложный оксид состава La1.7Ca0.3Ni0.6Cu0.4O4 + δ можно рассматривать как наиболее перспективный катод для использования в ТОТЭ в области средних температур. Предложенный в работе метод введения меди в качестве допанта можно считать более предпочтительным по сравнению с введением оксида меди в материал электрода непосредственно перед его изготовлением.
Список литературы
Твердооксидные топливные элементы: проблемы, пути решения, перспективы развития и коммерциализации. Аналитический обзор [Электронный ресурс]: ФГБНУ “НИИ – Республиканский исследовательский научно-консультационный центр экспертизы”. Москва, 2015. 21 с. – Режим доступа: https:// studylib.ru/doc/2616406/tverdooksidnye-toplivnye-e-lementy-problemy-puti-resheniya (дата обращения: 05.07.2022).
Ahmad, M.Z., Ahmad, S.H., Chen, R.S., Ismail, A.F., Hazan, R., and Baharuddin, N.A., Review on recent advancement in cathode material for lower and intermediate temperature solid oxide fuel cells application, Int. J. Hydrog. Energy, 2022, vol. 47, no. 2, p. 1103.
Kilner, J.A. and Burriel, M., Materials for intermediate-temperature solid-oxide fuel cells, Ann. Rev. Mat. Res., 2014, vol. 44, no. 1, p. 365.
Hanif, M.B., Motola, M., Rauf, S., Li, C.J., and Li, C.X., Recent advancements, doping strategies and the future perspective of perovskite-based solid oxide fuel cells for energy conversion, Chem. Eng. J., 2022, vol. 428, p. 132603.
Han, N., Shen, Z., Zhao, X., Chen, R., and Thakur, V.K., Perovskite oxides for oxygen transport: chemistry and material horizons, Sci. Total Environ., 2022, vol. 806, no. 3, p.151213.
Tarutin, A.P., Lyagaeva, J.G., Medvedev, D.A., Bi, L., and Yaremchenko, A.A., Recent advances in layered Ln2NiO4 + δ nickelates: fundamentals and prospects of their applications in protonic ceramic fuel and electrolysis cells, J. Mater. Chem. A., 2021, vol. 9, p. 154.
Садыков, В.А., Садовская, Е.М., Еремеев, Н.Ф., Скрябин, П.И., Краснов, А.В., Беспалко, Ю.Н., Павлова, С.Н., Федорова, Ю.Е., Пикалова, Е.Ю., Шляхтина, А.В. Подвижность кислорода материалов твердооксидных топливных элементов и каталитических мембран (обзор). Электрохимия. 2019. Т. 55. С. 899. [Sadykov, V.A., Sadovskaya, E.M., Eremeev, N.F., Skriabin, P.I., Krasnov, A.V., Bespalko, Yu.N., Pavlova S.N., Fedorova Yu.E., Pikalova E.Yu., and Shlyakhtina, A.V., Oxygen mobility in the materials for solid oxide fuel cells and catalytic membranes (review), Russ. J. Electrochem., 2019, vol. 55, p. 701.]
Shen, Y., Zhao, H., Xu, J., Zhang, X., Zheng, K., and Świerczek, K., Effect of ionic size of dopants on the lattice structure, electrical and electrochemical properties of La2 –xMxNiO4 + δ (M = Ba, Sr) cathode materials, Int. J. Hydrog. Energy, 2014, vol. 39, p. 1023.
Wu, X., Gu, C., Cao, J., Miao, L., Fu, C., and Liu, W., Investigations on electrochemical performance of La2NiO4 + δ cathode material doped at A-site for solid oxide fuel cells, Mat. Res. Express, 2020, vol. 7, no. 2, p. 065507.
Кольчугин, А.А., Пикалова, Е.Ю., Богданович, Н.М., Бронин, Д.И., Филонова, Е.А. Электрохимические свойства электродов на основе допированного никелата лантана. Электрохимия. 2017. Т. 53. С. 928. [Kol’chugin, A.A., Pikalova, E.Yu., Bogdanovich, N.M., Bronin, D.I., and Filonova, E.A., Electrochemical properties of doped lantanum–nickelate-based electrodes, Russ. J. Electrochem., 2017, vol. 53, p. 826.]
Pikalova, E., Sadykov, V., Sadovskaya, E., Yeremeev, N., Kolchugin, A., Shmakov, A., Vinokurov, Z., Mishchenko, D., Filonova, E., and Belyaev V., Correlation between structural and transport properties of Ca-doped La nickelates and their electrochemical performance, Crystals, 2021, vol.11, p. 297.
Tealdi, C., Ferrara, C., Mustarelli, P., and Islam, M.S., Vacancy and interstitial oxide ion migration in heavily doped La2 –xSrxCoO4 ± δ, J. Mater. Chem., 2012, vol. 22, no. 18, p. 8969.
Aspera, S.M., Sakaue, M., Wungu, T.D.K., Alaydrus, M., Linh, T.P.T., Kasai, H., Nakanishi, M., and Ishihara, T., Analysis of structural and electronic properties of Pr2NiO4 through first-principles calculations, J. Phys. Condens. Matter., 2012, vol. 24, p. 405504.
Forslund, R.P., Hardin, W.G., Rong, X., Abakumov, A.M., Filimonov, D., Alexander, C.T., Mefford, J.T., Iyer, H., Kolpak, A.M., Johnston, K.P., and Stevenson, K.J., Exceptional electrocatalytic oxygen evolution via tunable charge transfer interactions in La0.5Sr1.5Ni1 –xFexO4 ± δ Ruddlesden–Popper oxides, Nat. Commun., 2018, vol. 9, p. 3150.
Meyer, T.L., Jacobs, R., Lee, D., Jiang, L., Freeland, J.W., Sohn, C., Egami, T., Morgan, D., and Lee, H.N., Strain control of oxygen kinetics in the Ruddlesden-Popper oxide La1.85Sr0.15CuO4, Nat. Commun., 2018, vol. 9, no. 1, p. 92.
Lee, D. and Lee, H.N., Controlling oxygen mobility in Ruddlesden–Popper oxides, Materials, 2017, vol. 10, no. 4, p. 368.
Allan, N.L. and Mackrodt, W.C., Oxygen ion migration in La2CuO4, Philos. Mag. A, 1991, vol. 64, p. 1129.
Пикалова, Е.Ю., Калинина, Е.Г. Подходы к повышению эффективности твердооксидных топливных элементов на основе керамических мембран со смешанной проводимостью. Успехи химии. 2021. Т. 90. № 6. С. 703. [Pikalova, E.Yu. and Kalinina, E.G., Solid oxide fuel cells based on ceramic membranes with mixed conductivity: improving efficiency, Russ. Chem. Rev., 2021, vol. 90, no. 6, p. 703.]
Rietveld, H.M., A profile refinement method for nuclear and magnetic structures, J. Appl. Crystallogr., 1969, vol. 2, p. 65.
FullProf Suite. Crystallographic tools for Rietveld, profile matching and integratedintensity refinements of X‑ray and/or neutron data. – Режим доступа: https://www.ill.eu/sites/fullprof/ (дата обращения: 05.07.2022).
Wan, T.H., Saccoccio, M., Chen, C., and Ciucci, F., Influence of the discretization methods on the Distribution of Relaxation Times deconvolution: implementing radial basis functions with DRTtools, Electrochim. Acta, 2015, vol. 184, p. 483.
Гаврилюк, А.Л., Осинкин, Д.А., Бронин, Д.И. О применении метода регуляризации Тихонова для вычисления функции распределения времен релаксации в импедансной спектроскопии. Электрохимия. 2017. Т. 53. С. 651. [Gavrilyuk, A.L., Osinkin, D.A., and Bronin, D.I., The use of Tikhonov regularization method for calculating the distribution function of relaxation times in impedance spectroscopy, Russ. J. Electrochem., 2017, vol. 53, p. 575.]
Shannon, R.D., Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides, Acta Crystallogr., 1976, vol. 32, p. 7851.
Tarutin, A.P., Lyagaeva, J.G., Farlenkov, A.S., Vylkov, A.I., and Medvedev, D.M., Cu-substituted La2NiO4 + δ as oxygen electrodes for protonic ceramic electrochemical cells, Ceram. Int., 2019, vol. 45, p. 16105.
Sakai, M., Wang, C., Okiba, T., Soga, H., Niwa, E., and Hashimoto, T., Thermal analysis of structural phase transition behavior of Ln2Ni1 –xCuxO4 + δ (Ln = Nd, Pr) under various oxygen partial pressures, J. Therm. Anal. Calorim., 2019, vol. 135, p. 2765.
Gilev, A.R., Kiselev, E.A., Zakharov, D.M., and Cherepanov, V.A., Effect of calcium and copper/iron co-doping on defect–induced properties of La2NiO4-based materials, J. Alloy. Compd., 2018, vol. 27, p. 491.
Nakamura, T., Oike, R., Ling, Y., Tamenori, Y., and Amezawa, K., Determining factor for the interstitial oxygen formation in Ruddlesden–Popper type La2NiO4-based oxides, Phys. Chem. Chem. Phys., 2015, vol. 18, no. 3, p. 491.
Sadykov, V.A., Eremeev, N.F., Sadovskaya, E.M., Shlyakhtina, A.V., Pikalova, E.Y., Osinkin, D.A., and Yaremchenko, A.A., Design of materials for solid oxide fuel cells, permselective membranes, and catalysts for biofuel transformation into syngas and hydrogen based on fundamental studies of their real structure, transport properties, and surface reactivity, Curr. Opin. Green Sustain. Chem., 2022, vol. 33, p. 100558.
Li, X. and Benedek, N.A., Enhancement of ionic transport in complex oxides through soft lattice modes and epitaxial strain, Chem. Mater., 2015, vol. 27, p. 2647.
Maksimchuk, T., Filonova, E., Mishchenko, D., Eremeev, N., Sadovskaya, E., Bobrikov, I., Fetisov, A., Pikalova, N., Kolchugin, A., Shmakov, A., Sadykov, V., and Pikalova, E., High-temperature behavior, oxygen transport properties, and electrochemical performance of Cu-substituted Nd1.6Ca0.4NiO4 + δ electrode materials, Appl. Sci., 2022, vol. 12, no. 8, p. 3747.
Miyoshi, S., Furuno, T., Sangoanruang, O., Matsumoto, H., and Ishihara, T., Mixed conductivity and oxygen permeability of doped Pr2NiO4-based oxides, J. Electrochem. Soc., 2007, vol. 154, p. B57.
Sadykov, V.A., Sadovskaya, E.M., Filonova, E.A., Eremeev, N.F., Belyaev, V.D., Tsvinkinberg, V.A., and Pikalova, E.Yu., Oxide ionic transport features in Gd-doped La nickelates, Solid State Ionics, 2020, vol. 357, p. 115462.
Filonova, E.A., Pikalova, E.Yu., Maksimchuk, T.Y., Vylkov, A.I., Pikalov, S.M., and Maignan, A., Crystal structure and functional properties of Nd1.6Ca0.4Ni1 –yCuyO4 + δ as prospective cathode materials for intermediate temperature solid oxide fuel cells, Int. J. Hydrog. Energy, 2021, vol. 46, no. 32, p. 17037.
Escudero, M.J., Aguadero, A., Alonso, J.A., and Daza, L.A., Kinetic study of oxygen reduction reaction on La2NiO4 cathodes by means of impedance spectroscopy, J. Electroanal. Chem., 2007, vol. 611, nos. 1–2, p. 107.
Antonova, E.P., Khodimchuk, A.V., Usov, G.R., Tropin, E.S., Farlenkov, A.S., Khrustov, A.V., and Ananyev, M.V., EIS analysis of electrode kinetics for La2NiO4 cathode in contact with Ce0.8Sm0.2O1.9 electrolyte: from DRT analysis to physical model of the electrochemical process, J. Solid State Electrochem., 2019, vol. 23, p. 1279.
Li, Z., Haugsrud, R., and Norby, T., Oxygen bulk diffusion and surface exchange in Sr-substituted La2NiO4 + δ, Solid State Ionics, 2011, vol. 184, no. 1, p. 42.
Кольчугин, А.А., Пикалова, Е.Ю., Богданович, Н.М., Бронин, Д.И. Влияние меди на свойства катодов на основе La1.7Ca0.3NiO4+δ для твердооксидных топливных элементов. Электрохимия. 2015. Т. 51. С. 556. [Kolchugin, A.A., Pikalova, E.Yu., Bogdanovich, N.M., and Bronin, D.I., The effect of copper on the properties of La1.7Ca0.3NiO4 + δ-based cathodes for solid oxide fuel cells, Russ. J. Electrochem., 2015, vol. 51, p. 483.]
Дополнительные материалы отсутствуют.