Электрохимия, 2023, T. 59, № 1, стр. 16-28
Влияние массового содержания платины в катализаторе и состояния поверхности носителя на путь реакции восстановления кислорода в щелочном электролите
И. Е. Вернигор a, *, В. А. Богдановская a, **, М. В. Радина a, В. Н. Андреев a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: msnoviinna@gmail.com
** E-mail: bogd@elchem.ac.ru
Поступила в редакцию 11.07.2022
После доработки 04.08.2022
Принята к публикации 30.08.2022
- EDN: JZHBWY
- DOI: 10.31857/S0424857023010255
Аннотация
Исследовано влияние природы носителя и массы платины на стабильность и электрохимические характеристики моноплатиновых катализаторов и путь реакции электровосстановления кислорода (РВК) в щелочном электролите. Катализаторы с массовым содержанием Pt 10, 20, 40, 60 мас. % были синтезированы полиольным методом на углеродных нанотрубках (УНТ), функционализованных в NaOH и допированных азотом. Активность, процент образовавшегося пероксида водорода и число электронов, участвующих в РВК, определяли по данным, полученным методом вращающегося дискового электрода с кольцом. Наибольшая селективность в РВК до воды наблюдается для катализаторов, синтезированных на УНТ, допированных азотом, и возрастает с увеличением поверхности Pt на электроде, поскольку уменьшается вклад поверхности носителя в суммарную РВК. Наличие пероксида водорода и снижение стабильности наблюдается при снижении содержания платины в составе катализатора.
ВВЕДЕНИЕ
Реакция восстановления кислорода (РВК) по-прежнему остается в центре внимания исследователей, поскольку является скоростьопределяющей в катодном процессе в топливных элементах (ТЭ) и металл-воздушных батареях. Наиболее изученными и используемыми на практике являются низкотемпературные водородно-воздушные ТЭ с кислым или щелочным электролитом [1]. Элементы со щелочным электролитом имеют определенные преимущества, поскольку кинетика катодной реакции восстановления кислорода является более благоприятной по сравнению с кислым электролитом. Кроме того, относительно низкая коррозионная активность щелочного электролита позволяет расширить круг конструкционных материалов и материалов, пригодных для создания электрокатализаторов [2].
РВК является многостадийной и протекает со значительным перенапряжением, достигающим нескольких сотен милливольт. В водных растворах электролитов она протекает в основном по двум возможным путям. Первый – это прямое восстановление кислорода до воды, с переносом четырех электронов. Второй путь включает восстановление О2 через промежуточное образование Н2О2 с переносом двух электронов. Пероксид водорода может выходить в объем раствора или каталитически разлагаться с образованием воды. В щелочном электролите эти процессы представлены следующими реакциями [3]:
Платина на углеродных носителях является наиболее эффективным и распространенным катализатором анодного и катодного процессов в водородно-воздушных ТЭ в широком диапазоне pH. Однако высокая стоимость и низкая стабильность моноплатиновых систем в условиях работы ТЭ стимулируют проведение многочисленных исследований, направленных на снижение содержания платины и уменьшение деградации металла и носителя, при сохранении эффективности в течение длительного времени эксплуатации [4‒6]. В работе [7] были изготовлены высокодисперсные катализаторы с равномерным распределением наночастиц металлической Pt (2–5 нм) на саже. Однако в этом случае катализатор характеризовался меньшей стабильностью [8]. Было предложено несколько механизмов деградации катализаторов Pt/C [5, 9]. Во-первых, это разрушение углеродного носителя, которое непосредственно инициирует осыпание наночастиц Pt. Во-вторых, это растворение мелких частиц Pt при высоких потенциалах электрода. В-третьих, это рост частиц Pt вследствие агломерации и созревания по Оствальду. Данный механизм снижения электрохимически активной поверхности включает повторное осаждение частиц Pt на более крупные частицы и агломерацию наночастиц Pt посредством миграции на поверхности углеродного носителя [9].
Разработка материала носителя является одной из первоочередных задач, стоящих на пути коммерциализации ТЭ, т. к. они в значительной степени влияют на стоимость и ресурс работы катализатора, а значит, и всей системы в целом [10‒12]. К материалам, носителям катализатора, предъявляются следующие требования: высокая удельная поверхность, мезопористая структура, которая обеспечивает транспорт реагентов, стабильность в щелочных и кислых средах в условиях работы ТЭ, электронная проводимость, прочная связь между наночастицами металла и материалом носителя, которая повышает стабильность катализатора. Тип носителя и состав его поверхности влияют на такие параметры катализатора, как дисперсность металлических наночастиц и снижение степени их агрегации. Исследования носителей, в основном, сосредоточенны на углеродных материалах, благодаря ряду химических, механических и структурных свойств, которые делают их перспективными носителями по сравнению с неуглеродными материалами [13–15]. Углеродные нанотрубки (УНТ) представляют значительный интерес для использования в электрокатализе, так как они отвечают основным предъявляемым требованиям [16]. Кроме того, существует возможность целенаправленно изменять их электронную структуру посредством модификации поверхности различными гетероатомами [17–19]. Так, при допировании азотом, значительная разница в электроотрицательности между N (3.0) и C (2.55) вызывает смещение электронной плотности от атомов C к соседним атомам N, а наличие неподеленной пары электронов на атоме N способствует повышению электронодонорной способности УНТ. Такое изменение электронной плотности на атомах C, соседних с N, обеспечивает хемосорбцию O2 в ориентации, благоприятной для ослабления (разрыва) связи O–O [20].
Значительные успехи в установлении пути РВК были достигнуты при использовании метода вращающегося дискового электрода с кольцом (ВДЭК) [21]. Gloaguen с соавторами [22] одни из первых предложили использовать метод ВДЭК для изучения активности дисперсных катализаторов в РВК. Однако при наличии толстого слоя катализатора на электроде и высокой концентрации нафиона в активном слое наблюдалось высокое сопротивление диффузии, что мешало установить кинетику протекающего процесса. В более поздних работах [23, 24] показано, что метод ВДЭК можно успешно применять для определения электрокаталитической активности нанесенных на электрод дисперсных катализаторов с большой площадью поверхности при соблюдении ряда требований. В первую очередь, это нанесение на дисковый электрод предельно тонкого активного слоя. Кроме того, в этих условиях можно непосредственно определить плотность кинетического тока из экспериментальных измерений.
Метод ВДЭК позволяет количественно определить промежуточный продукт РВК – пероксид водорода (${\text{HO}}_{2}^{ - }$ в щелочном электролите) [21], поскольку позволяет одновременно измерять токи на дисковом и кольцевом электродах в зависимости от потенциала на диске. При восстановлении кислорода на дисковом электроде образующийся в ходе реакции пероксид водорода вынужденной конвекцией (вращение электрода) переносится на кольцевой электрод и окисляется при заданном потенциале.
Целью данного исследования является определение влияния состава поверхности УНТ и количества платины в составе катализатора на стабильность и активность платиновых катализаторов и определение пути реакции восстановления кислорода в щелочном электролите.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Реагенты и материалы
В работе использовали углеродные нанотрубки Таунит производства “НаноТехЦентр, ООО”, (Тамбов, Россия), Sуд = 260–270 м2/г и реактивы: меламин (C3H6N6, >99.0%) производства Alfa Aesar (Ward Hill, USA); калия гидроксид (KOH, 99.0%) и натрия гидроксид (NaOH, 99.0%) производства ООО Химмед (Москва, Россия).
Электрохимические измерения
Эксперименты проводили в трехэлектродной электрохимической ячейке с разделенными электродными пространствами. Исследования методом ВДЭК проводили при использовании дискового электрода, выполненного из углеситалла (Sгеом диска= 0.196 см2) и кольцевого электрода из платины (Sгеом кольца= 0.110 см2). В качестве вспомогательного электрода использовали платиновую проволоку. Измерения проводили в 0.1 М КОН, pH которого составляло 13. Измерения рН проводили на лабораторном рН-метре (НПП ЭКОНИКС, ЭКОТЕСТ-120). Электрод сравнения Hg/HgO помещали в рабочий электролит. Для пересчета потенциала используемого электрода сравнения относительно о.в.э. вводили поправку в величину $Е_{{{\text{с}}{\text{.в}}{\text{.э}}{\text{.}}}}^{0},$ равную 0.098 В [25], на pH электролита. Величина потенциала электрода сравнения относительно о.в.э. в рабочем электролите, рассчитанная по уравнению Ео.в.э. = Е0 + + 0.059 × 13, составляет 0.865 В.
Все значения потенциалов приведены относительно обратимого водородного электрода (о.в.э). Измерения выполнены на установке Pine Instrument Company Bipotentiostat Model AFCBP1.
Перед началом проведения измерений методом ВДЭК проводили платинирование кольцевого электрода в 2–3% H2PtCl6·6H2O в растворе 0.5 H2SO4 в гальваностатическом режиме (1 мА/см2) [18]. Затем рассчитывали величину поверхности платины кольцевого электрода по области десорбции водорода на ЦВА, записанной в области потенциалов 0.02–1.22 В в 0.5 М H2SO4. Фактор шероховатости платинированного кольца рассчитывали как отношение истинной площади поверхности к геометрической. Величина фактора шероховатости составляла 80–90.
Дисковый и кольцевой электроды (раздельно) перед каждым экспериментом активировали путем циклирования потенциала в диапазоне 0.03–1.23 В в деаэрированном аргоном электролите. Как правило, после 15 циклов со скоростью 0.05 В/с достигалась типичная вольтамперограмма, характеризующая состояние поверхности электродов: углеситалла (диск) и платины (кольцо). Для исследования дисперсных материалов, готовили каталитические чернила: 2.2 мг материала (модифицированные УНТ, либо платиновый катализатор) диспергировали в 500 мкл воды. Суспензию наносили на поверхность дискового электрода с помощью микропипетки в объеме 5 мкл (~100 мкг/см2). Электрод сушили на воздухе при комнатной температуре.
Электрохимически активную поверхность (SЭАП) Pt в исследуемых дисперсных катализаторах, нанесенных на дисковый электрод, определяли путем интегрирования заряда на ЦВА, записанных в 0.1 М KOH, пошедшего на десорбцию водорода (0.03–0.45 В). Принимая, что 0.210 мКл/см2 необходимо для монослойного заполнения водородом 1 см2 поверхности Pt, рассчитывали SЭАП платины. ЦВА для модифицированных УНТ записывали в 0.1 М KOH в диапазоне 0.03–1.23 В. Величины SЭАП УНТ оценивали по величине заряда ЦВА, как 1/2Q, где Q – количество электричества, пошедшее на заряжение поверхности исследуемого материала, рассчитанное по формуле:
где I – ток (мА), Е – потенциал (В), v – скорость развертки (В/с). Так как ЦВА включает сумму катодного и анодного хода, которые эквивалентны между собой, то именно 1/2Q характеризует поверхность, участвующую в реакции. По величине заряда на ЦВА проводили сравнение характеристик УНТ после различных обработок. Чем больше величина 1/2Q, тем большая поверхность участвует в электрохимической реакции.Определение коэффициента эффективности переноса промежуточного продукта реакции с дискового на кольцевой электрод. Для обоснования возможности применения метода ВДЭК и определения влияния толщины слоя исследуемого катализатора на величину коэффициента эффективности переноса (N) использовали модифицированную методику, описанную в работе [23]. Исследование проводили с использованием обратимой системы [Fe(CN)6]4–/[Fe(CN)6]3– в концентрации 0.01 М K3Fe(CN)6 в 1 М KOH. Потенциал кольцевого электрода поддерживали равным 1.45 В. Записывали поляризационные кривые на диске в диапазоне 1.4–0.4 В, со скоростью развертки 0.01 В/с, при различных скоростях вращения электрода. На дисковый электрод наносили катализаторы в количестве 20, 100, 200 и 400 мкг/см2. Установлено, что 100 мкг/см2 является оптимальной массой, обеспечивающей равнодоступность поверхности, т.е. предельно тонкий слой катализатора на дисковом электроде. Экспериментально определенная величина N составила 0.286 ± 0.005, что согласуется с табличными данными [21]. Расчеты проводили по методике, описанной в дополнительных материалах (представлены в английской и русской on-line версиях журнала).
Определение активности в РВК методом ВДЭК. Для определения активности исследуемых материалов в РВК записывали поляризационные кривые в электролите, насыщенном кислородом. Скорость наложения потенциала составляла 5 мВ/с при скорости вращения электрода от 650 до 2800 об./мин. Потенциал кольцевого электрода составлял 1.2 В. Каталитическую активность катализатора (дисковый электрод) в РВК определяли по потенциалу полуволны (Е1/2, В) и плотности тока в кинетической области потенциалов (ikin, А/см2) при 0.90 В. Кроме того, были рассчитаны величины числа переноса электронов (n) и выход пероксида водорода (% ${\text{HO}}_{2}^{ - }$) по формулам (2), (3) [26]:
(3)
$\% {\text{HO}}_{2}^{ - } = 100 \times \frac{{2{{I}_{{\text{к}}}}}}{{{{I}_{{\text{д}}}}N + {{I}_{{\text{к}}}}}},$Определение стабильности. Для определения коррозионной устойчивости каталитических систем использовали метод ускоренного коррозионного тестирования. Метод заключается в циклировании потенциала электрода в интервале 0.6–1.3 В (о. в. э.) при отсутствии деполяризатора (кислорода) в растворе электролита (0.1 М KOH), со скоростью 100 мВ/с в течение 1000 циклов. После 100, 500 и 1000 циклов определяли SЭАП по ЦВА в атмосфере аргона и активность в РВК по поляризационным кривым, измеренным в растворе, насыщенном кислородом.
Определение содержания платины в исходных катализаторах. Метод основан на измерении оптической плотности раствора комплекса Pt с хлоридом двухвалентного олова (SnCl2) в широком диапазоне концентраций. Измерение оптической плотности исследуемого раствора проводили на спектрофотометре SPECORD M40. Более подробная методика измерений представлена в работе [27].
Структурные методы исследования
Рентгеновская фотоэлектронная спектроскопия (РФЭС). РФЭС получали на оже-спектрометре (Vacuum Generators, Великобритания) с приставкой CLAM2 для измерения спектров XPS. Вакуум в камере анализатора достигал 10–8 Торр. Источником монохроматического излучения служила рентгеновская трубка с анодом из алюминия при мощности излучения 200 Вт. Положение пиков стандартизировано относительно положения C1s пика с энергией 285.0 эВ. Для количественных соотношений использовали коэффициенты чувствительности, указанные в программе обработки спектров VG1000. Состав поверхностного слоя определяли до глубины 10 нм.
Метод эталонной контактной порометрии (МЭКП). Для исследования пористой структуры и гидрофильно-гидрофобных свойств УНТ использовали метод контактной эталонной порометрии [28]. Этот метод позволяет изучать не только пористую структуру любого материала в максимально широком диапазоне радиусов пор от 1 до 3 × 105 нм, но и их гидрофобно-гидрофильные свойства. При использовании в качестве измерительной жидкости октана получаемые зависимости включают все поры образца, при использовании воды в качестве измерительной жидкости измеряются только гидрофильные поры.
Методы модификации УНТ
Обработка УНТ щелочью. Навеску исходных УНТ (400 мг) помещали в колбу с обратным холодильником и приливали 200 мл 1 М NaOH. Затем, при непрерывном перемешивании (магнитная мешалка) суспензию УНТ выдерживали в течение часа при температуре 100°C. Далее отмывали деионизованной водой до нейтрального значения рН. Осадок сушили в вакуумном шкафу при 90°C до полного удаления влаги.
Допирование азотом. Функционализированные УНТ смешивали с меламином (C3H6N6) в качестве прекурсора азота в соотношение 1 : 0.7 и размалывали на шаровой мельнице в течение 1 ч при 800 об./мин. Полученную порошкообразную смесь помещали в кварцевую трубку и подвергали термической обработке в атмосфере Ar при 600°C в течение 1 ч.
Полиольный метод синтеза Pt-катализаторов. Навеску УНТ после обработки помещали в этиленгликоль (“ос. ч.”, ЗАО “ЭКОС-1”, Россия) и подвергали ультразвуковому диспергированию в течение 1 ч. Затем суспензию УМ в этиленгликоле помещали в трехгорлую круглодонную колбу, снабженную капельной воронкой, обратным холодильником и капилляром для барботирования аргона. Колбу устанавливали в лабораторную баню, заполненную глицерином. Через капельную воронку добавляли в этиленгликоль раствор, содержащий H2PtCl6·6H2O (фирма “Аурат”). Баню нагревали до 110–130°С. Температурную обработку продолжали в течение 1.5 ч при барботировании аргоном. Полученную смесь отстаивали, промывали водой, твердый осадок отделяли на центрифуге и помещали в сушильный шкаф. Были синтезированы катализаторы с содержанием Pt 10, 20, 40, 60 мас. % на двух типах модифицированных УНТ: УНТNaOH и УНТNaOH + N. Отклонение содержания Pt в образцах составляет не более 2 мас. %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
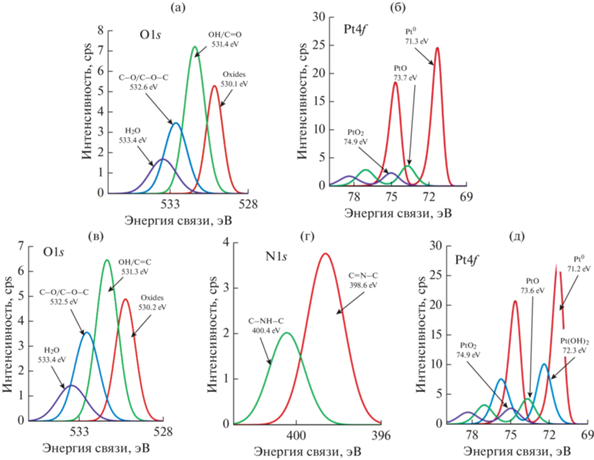
Для оценки влияния состава поверхности носителя на свойства платиновых катализаторов в качестве носителей выбраны два типа УНТ – функционализованные в щелочи и функционализованные с последующим допированием азотом. Функционализация раствором NaOH приводит к мягкому окислению поверхности, в результате чего образуется один тип кислородсодержащих групп – гидроксильные (табл. 1). В результате последующего допирования азотом на поверхности УНТ наблюдаются пиридиновые и пиррольные формы азота (табл. 1).
Таблица 1.
Состав поверхности и пористая структура носителей и катализаторов с содержанием 20 мас. % Pt
| Носитель | Элемент, ат. % | Vпор, см3/г | Dпор, нм | Катализатор | Элемент, ат. % | Vпор, см3/г | Dпор, нм |
|---|---|---|---|---|---|---|---|
| УНТNaOH | O/2.18 | 1.21 | 21.5 | 20Pt/УНТNaOH | O/2.8 Pt0/1.21 PtO/0.78 PtO2/0.18 |
1.18 | 21.3 |
| УНТNaOH + N | O/10.08 N/1.15 |
0.86 | 14.25 | 20Pt/УНТNaOH + N | O/2.97 N/1.58 Pt0/1.6 Pt(OH)2/0.74 PtO/0.33 PtO2/0.24 |
0.73 | 14.3 |
Согласно данным РФЭС (рис. 1в–1д; табл. 1), при использовании в качестве носителя УНТNaOH + N, при одинаковом массовом содержании платины на поверхности катализатора наблюдается больше платины, которая в основном находится в металлическом состоянии – Pt0 (71.3 эВ).
Рис. 1.
РФЭ спектры O1s (а) и Pt4f (б) на Pt/УНТNaOH и O1s (в), N1s (г) и Pt4f (д) на 20Pt/УНТNaOH + N.
Полиольный метод синтеза является одним из наиболее распространенных и простых методов, используемых для синтеза электрокатализатора на основе Pt. Данный метод позволяет сохранить мезопористую структуру носителей – объем (Vпор) и диаметр (Dпор) пор (табл. 1), которая обеспечивает высокую удельную площадь поверхности и эффективную диффузию реагентов к каталитическим центрам.
Как было показано в предыдущих исследованиях [29, 30], в результате обработки УНТ в NaOH незначительно изменяются электрохимические характеристики исходных УНТ. Однако, последующее допирование атомами N приводит к росту площади гидрофильной поверхности (Sуд, определенная при использовании воды), обеспечивает более высокую SЭАП и способствует увеличению активности в РВК.
На рис. 2 представлены поляризационные кривые восстановления O2 на дисковом электроде с нанесенными на него модифицированными УНТ и соответствующие им кривые окисления ${\text{HO}}_{2}^{ - }$ на кольцевом электроде. Видно, что на исследуемых УНТ увеличение тока окисления пероксида водорода происходит пропорционально току восстановления кислорода, т.е. наблюдаемый процесс протекает с образованием ${\text{HO}}_{2}^{ - }$ по двухэлектронному пути. На УНТNaOH + N наблюдается смещение потенциала полуволны (Е1/2) в положительную сторону на 0.17 В по сравнению с УНТNaOH. При этом число электронов, участвующих в реакции, составляет 3.2, а процент образовавшейся перекиси снижается в 2 раза (табл. 2). Таким образом, на УНТNaOH + N увеличивается вклад четырехэлектронного процесса восстановления кислорода.
Рис. 2.
Поляризационные кривые восстановления O2 на дисковом электроде и соответствующие им кривые окисления ${\text{HO}}_{2}^{ - }$ на кольцевом электроде для УНТNaOH и УНТNaOH + N, 0.1 М KOH, 100 мкг/см2, 5 мВ/с, 1500 об./мин, Eкольцо = 1.2 В.

Таблица 2.
Характеристики поверхности (Sуд, м2/г, измеренная по октану/воде), заряд поверхности (в виде 1/2Q, Кл/г, определенный по ЦВА) и электрохимические параметры носителей
| Материал | Sуд, м2/г октан//вода |
1/2Q, Кл/г исходная |
Е1/2, В | n | % ${\text{HO}}_{2}^{ - }$ | 1/2Q, Кл/г после 1000 циклов |
|---|---|---|---|---|---|---|
| УНТNaOH | 333.5//49.2 | 21.5 | 0.64 | 1.7 | 81.2 | 20.8 |
| УНТNaOH + N | 268.8//154.2 | 60 | 0.81 | 3.2 | 42 | 58.1 |
Исследование стабильности УНТ, подвергнутых обработке в NaOH и допированию азотом (табл. 2), показало, что снижение SЭАП после 1000 циклов не превышает 3%.
Электрохимические характеристики Pt-содержащих катализаторов. Ранее было показано в [31], что использование допированных УНТ позволяет синтезировать катализаторы с увеличенной поверхностью платины. Это связано с тем, что допирование азотом приводит к образованию большого числа активных центров, по которым происходит формирование частиц Pt. Таким образом, при одинаковом массовом содержании Pt большое число активных центров на поверхности УНТNaOH + N позволяет синтезировать большее число частиц Pt с меньшими размерами, это приводит к росту поверхности Pt (рис. 3, табл. 3).
Рис. 3.
ЦВА, записанные на катализаторах с содержанием 20 мас. % Pt, 0.1 М KOH, 50 мВ/с, 100 мкг/см2.

Таблица 3.
Величина поверхности Pt/УНТ катализаторов до и после коррозионного тестирования
| Катализатор | Pt, мас. % | SPtна электроде, см2 | SPt, м2/г | SPt, м2/г после 500 циклов | SPt, м2/г после 1000 циклов |
|---|---|---|---|---|---|
| Pt/УНТNaOH | 10 | 1.0 | 52.2 | 31.8 | 19.3 |
| 20 | 2.3 | 58.7 | 36.4 | 22 | |
| 40 | 4.6 | 57.3 | 58.0 | 25.7 | |
| 60 | 5.4 | 45 | 32.1 | 23.4 | |
| Pt/УНТNaOH + N | 10 | 1.6 | 80 | 52.8 | 34.4 |
| 20 | 3.3 | 81.9 | 51.6 | 36.8 | |
| 40 | 6.3 | 78.6 | 57.8 | 41.6 | |
| 60 | 7.0 | 58.5 | 40.2 | 33.9 |
При содержании 60 мас. % удельная поверхность Pt снижается за счет укрупнения частиц Pt, т.е. зарождение новых частиц не происходит, так как недостаточно активных центров, а осаждение платины происходит на имеющихся частицах.
На основании ЦВА рассчитана поверхность Pt на рабочем электроде. Ее величина возрастает с увеличением массового содержания Pt. Предполагая, что величина поверхности одного типа носителя постоянна для ряда катализаторов, то при увеличении Pt, мас. %, отношение поверхности носителя к поверхности Pt на электроде падает, т.е. уменьшается доля поверхности свободной от платины.
Важнейшей характеристикой электрокатализаторов является их стабильность. На рис. 4 представлена диаграмма относительного снижения SPt в процессе циклирования для Pt/УНТNaOH и Pt/УНТNaOH + N с различным массовым содержанием Pt. По полученным результатам можно сделать вывод, что на стабильность оказывают влияние несколько факторов: во-первых, это поверхность носителя. Согласно литературным данным [32], азот в составе поверхности увеличивает прочность связи металла с носителем за счет изменения электронной структуры УНТ. Таким образом, катализаторы на допированных УНТ проявляют более высокую стабильность по сравнению с катализаторами на УНТNaOH. Во-вторых, размер частиц платины. Видно, что при большем содержании платины, где частички крупнее, деградация ее поверхности происходит медленнее.
Рис. 4.
Диаграммы изменения относительной величины поверхности платины в ходе ускоренного коррозионного тестирования для 10, 40 и 60 мас. % Pt, 0.1 М KOH, 50 мВ/с, 100 мкг/см2.

Согласно полученным данным (табл. 3, рис. 4), наибольшая скорость деградации платины наблюдается в течение первых 500 циклов, когда происходит растворение и переосаждение мелких наночастиц Pt. Другими словами, прежде всего растворяются мелкие частицы Pt, которые могут осаждаться на более крупных за счет разницы в поверхностной свободной энергии [33]. Более крупные частицы менее подвержены деградации, в результате снижение поверхности Pt замедляется.
Активность исследуемых катализаторов в РВК в щелочном электролите. На рис. 5 представлены поляризационные кривые восстановления кислорода на дисковом и окисления пероксида водорода на кольцевом электродах. Видно, что окисление перекиси происходит при значительно менее положительных потенциалах, чем начало восстановления кислорода. Таким образом, в кинетической области потенциалов (1.0–0.75 В) восстановление происходит напрямую до воды по 4-электронному пути. При достижении ~0.7 В наблюдается рост тока на кольце. Образование пероксида водорода при этом потенциале, вероятно, связано с увеличением вклада тока восстановления кислорода на поверхности носителя, свободной от платины, в общий ток РВК. При этом, так как на УНТNaOH + N токи окисления пероксида водорода ниже, чем на УНТNaOH (рис. 2), то и на катализаторах Pt/УНТNaOH + N образуется меньше перекиси, что свидетельствует о значительной роли поверхности носителя в процессе восстановления кислорода.
Рис. 5.
Поляризационные кривые восстановления O2 на дисковом электроде и соответствующие им кривые окисления ${\text{HO}}_{2}^{ - }$ на кольцевом электроде на: Pt/УНТNaOH (а) и Pt/УНТNaOH + N (б), с различным содержанием Pt (указано на рисунке), 0.1 М KOH, 100 мкг/см2, 5 мВ/с, 1500 об./мин, Eкольцо = 1.2 В.

Катализаторы на допированных УНТ характеризуются большими значениями потенциала полуволны и числом электронов, участвующих в реакции, а также меньшим выходом пероксида водорода (табл. 4), что говорит об их большей селективности в отношении прямого восстановления кислорода до воды. Наибольший ток в кинетической области (iкин) соответствует высокому содержанию платины, 40 и 60 мас. %. Таким образом, чем выше активность носителя, тем меньше выход пероксида водорода. При этом с увеличением содержания платины увеличивается и потенциал полуволны, и число электронов, участвующих в реакции. Соответственно, выход пероксида водорода снижается, т.к. уменьшается доля поверхности, свободной от платины.
Таблица 4.
Электрохимические характеристики Pt-катализаторов
| Катализатор | Pt, мас. % | Е1/2, В | iкин, мА/см2, при 0.90 В |
n при 0.4 В | ${\text{HO}}_{2}^{ - }$, % , при 0.4 В | k1/k2 при 0.7 В |
|---|---|---|---|---|---|---|
| Pt/УНТNaOH | 10 | 0.81 | 0.41 | 3.4 | 30.0 | 5.2 |
| 20 | 0.84 | 0.80 | 3.44 | 29.0 | 6.8 | |
| 40 | 0.87 | 1.40 | 3.66 | 15.4 | 11 | |
| 60 | 0.88 | 1.75 | 3.75 | 12.1 | 20 | |
| Pt/УНТNaOH + N | 10 | 0.81 | 0.80 | 3.62 | 18.6 | 7 |
| 20 | 0.87 | 1.45 | 3.72 | 14.2 | 9.8 | |
| 40 | 0.89 | 1.85 | 3.80 | 8.5 | 29 | |
| 60 | 0.90 | 2.18 | 3.86 | 6.8 | 41 |
Для дальнейших исследований влияния массы платины на электрокаталитические характеристики была выбрана система на допированных УНТ. Для катализаторов с содержанием 10, 20, 40 и 60 мас. % Pt, синтезированных на УНТNaOH + N, были записаны поляризационные кривые при различных скоростях вращения электрода (рис. 6). Основные различия для исследуемых катализаторов состоят в величине токов окисления пероксида водорода на кольцевом электроде. В ряду увеличения Pt, мас. %, величина токов на кольцевом электроде снижается, как и выход пероксида водорода (табл. 4).
Рис. 6.
Поляризационные кривые восстановления O2 на дисковом электроде и соответствующие им кривые окисления ${\text{HO}}_{2}^{ - }$ на кольцевом электроде для катализаторов на УНТNaOH + N с различным содержанием Pt (указано на рисунке), 0.1 М KOH, 100 мкг/см2, 5 мВ/с, Eкольцо = 1.2 В.

На рис. 7 представлена зависимость числа электронов (n) и выхода пероксида водорода от потенциала электрода. Видно, что с увеличением поляризации снижается число электронов, участвующих в реакции (кривые 1'–4') и возрастает выход пероксида водорода (кривые 1–4). Это указывает на то, что при потенциалах ниже 0.7 В, суммарный ток восстановления кислорода включает ток 2-электронного восстановления О2 на поверхности носителя, свободной от платины.
Рис. 7.
Зависимость числа электронов (n), участвующих в реакции (1 ', 2 ', 3 ', 4 ') и выхода пероксида водорода (1, 2, 3, 4) от потенциала электрода для Pt/УНТNaOH + N с содержанием Pt 1, 1 ' – 10 мас. %, 2, 2 ' – 20 мас. %, 3, 3 ' – 40 мас. %, 4, 4 ' – 60 мас. %, 0.1 М KOH, 1500 об./мин, 100 мкг/см2.

Были рассчитаны константы реакций прямого восстановления кислорода до воды k1, и через промежуточное образование пероксида водорода k2.
На первом этапе строили зависимость $I_{{\text{д}}}^{{{\text{теор}}}}$ – ${{I_{{\text{д}}}^{*}N} \mathord{\left/ {\vphantom {{I_{{\text{д}}}^{*}N} {{{I}_{{\text{к}}}}}}} \right. \kern-0em} {{{I}_{{\text{к}}}}}}$ от w0.5, где $I_{{\text{д}}}^{{{\text{теор}}}}$ – теоретический предельный диффузионный ток на дисковом электроде, рассчитанный при определенной скорости вращения электрода w. В этих координатах наклон прямой (tg α) равен
где ${{Z}_{{{{{\text{O}}}_{2}}}}} = 0.62D_{{{{{\text{O}}}_{2}}}}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}{{\nu }^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 6}} \right. \kern-0em} 6}}}},$ ${{D}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ – коэффициент диффузии кислорода в растворе электролита (2 × × 10‒5 см2/с), ν – кинематическая вязкость раствора (0.905 × 10–2 см2/с) [34].Затем строили зависимости в координатах ${{I_{{\text{д}}}^{*}N} \mathord{\left/ {\vphantom {{I_{{\text{д}}}^{*}N} {{{I}_{{\text{к}}}}}}} \right. \kern-0em} {{{I}_{{\text{к}}}}}}$ от w–0.5. Прямые в этих координатах отсекают на оси ординат отрезок, равный 1 + 2k1/k2, что позволяет определить отношение констант k1/k2. Зная величину константы k2, константу k1 определяли из их отношения [21].
Наибольшее отношение k1/k2 (табл. 4) наблюдается для катализатора 60Pt/УНТNaOH + N и снижается при уменьшении Pt, мас. %. Это происходит за счет увеличения константы ${{k}_{2}}$, которая отвечает за образование пероксида водорода. При смещении потенциала электрода в сторону меньших значений отношение констант снижается (рис. 8а), т.е. возрастает скорость реакции восстановления кислорода до пероксида водорода. При этом наибольшее значение k2 соответствует наименьшему содержанию платины – 10 мас. %, и составляет 44.9 × 10–3 см/с при 0.7 В.
Рис. 8.
(а) Зависимость отношения каталитических констант k1/k2 от потенциала электрода для Pt/УНТNaOH + N с различным массовым содержанием Pt. (б) Зависимость каталитической константы реакции с образованием пероксида водорода (k2) от потенциала электрода для Pt/УНТNaOH + N с различным содержанием платины (указано на рисунке).

Таким образом, в ряду увеличения массового содержания платины константа k2 и выход перекиси снижаются. И это является еще одним фактором увеличения стабильности рассматриваемых систем.
ЗАКЛЮЧЕНИЕ
Синтезированы Pt-катализаторы с различным массовым содержанием Pt: 10, 20, 40, 60 мас. %, на двух типах модифицированных УНТ: функционализованных NaOH и допированных атомами N.
На УНТ, допированных атомами азота, число электронов, участвующих в РВК, возрастает до 3.2, это свидетельствует об увеличении селективности в реакции, протекающей непосредственно до воды на этом типе нанотрубок.
Показано влияние типа модификации поверхности носителя – при одинаковом количестве нанесенной Pt, чем больше активных центров на поверхности носителя, тем больше поверхность платины за счет осаждения большего числа частиц Pt с меньшими размерами.
Чем больше отношение поверхности Pt к поверхности носителя, тем меньше пероксида водорода образуется в ходе реакции. Наибольшая селективность в РВК при непосредственном восстановлении кислорода до воды наблюдается для катализаторов с высоким содержанием платины 40 и 60 Pt/УНТNaOH + N, при этом величина n близка к 4. Для этих катализаторов отношение поверхности платины к поверхности носителя наибольшее.
Таким образом, по совокупности результатов настоящего исследования катализаторы с 60 и 40 мас. % Pt/УНТNaOH + N являются наиболее перспективными для щелочных топливных элементов. Однако, с целью уменьшения стоимости катодных электрокатализаторов дальнейшие исследования должны быть направлены на разработку методов модификации углеродных материалов, в том числе увеличение степени допирования азотом УНТ, что позволит значительно увеличить долю прямой реакции электровосстановления кислорода до воды.
Список литературы
Thandavarayan, S. and Viswanathan, S., Electrocatalysts for Low Temperature Fuel Cells. Fundamentals and Recent Trends, Weinheim, Germany: Wiley VCH, 2017. 616 p.
Ramaswamy, N. and Mukerjee, S., Alkaline Anion-Exchange Membrane Fuel Cells: Challenges in Electrocatalysis and Interfacial Charge Transfer, Chem. Rev., 2019, vol. 119, p. 11945.
Xing, W., Yin, G., and Zhang, J., Rotating Electrode Methods and Oxygen Reduction Electrocatalysts, 1st ed, Amsterdam, The Netherlands: Elsevier, 2014. p. 322.
Shinozak, K., Zack, J.W., Richards, R.M, Pivovar, B.S., and Kocha, S.S., Oxygen Reduction Reaction Measurements on Platinum Electrocatalysts Utilizing Rotating Disk Electrode Technique: I. Impact of Impurities, Measurement Protocols and Applied Corrections, J. Electrochem. Soc., 2015, vol. 162, no.10, p. 162.
Li, L., Hu, L., Li, J., and We, Z., Enhanced stability of Pt nanoparticles electrocatalysts for fuel cells, Nano Res., 2015, vol. 3, p. 418.
Capelo, A., Esteves, M.A., de Sa, A.I., Silva, R.A., Cangueiro, L., Almeida, A., Vilar, R., and Rangel, C.M., Stability and durability under potential cycling of Pt/C catalyst with new surface-functionalized carbon support, Internat. J. Hydrogen Energy, 2016, vol. 41, p. 12962.
Su, L., Jia, W.Z., Li, C.M., and Lei, Y., Mechanisms for enhanced performance of platinum-based electrocatalysts in proton exchange membrane fuel cells, ChemSusChem., 2014, vol. 7, p. 361.
Timperman, L., Feng, Y.J., Vogel, W., and Alonso-Vant, N., Substrate effect on oxygen reduction electrocatalysis, Electrochim. Acta, 2010, vol. 55, p. 7558.
Dubau, L., Castanheira, L., Maillard, F., Chatenet, M., Lottin, O., Maranzana, G., Dillet, J., Lamibrac, A., Perrin, J.C., and Moukheiber, E., A review of PEM fuel cell durability: Materials degradation, local heterogeneities of aging and possible mitigation strategies, WIREs: Energy Environ, 2014, vol. 3, p. 540.
Wang, Y.-J., Fang, B., Li, H., Bi, X.T., and Wang, H., Progress in modified carbon support materials for Pt and Pt-alloy cathode catalysts in polymer electrolyte membrane fuel cells, Progress in Mater. Science, 2016, vol. 82, p. 445.
Kang, S., Kim, H., and Chung, YH., Recent developments of nano-structured materials as the catalysts for oxygen reduction reaction, Nano Converg, 2018, vol. 5, no. 13.
Molina-Garcíaa, M.A. and Rees, N.V., Effect of catalyst carbon supports on the oxygen reduction reaction in alkaline media: a comparative study, RSC Adv., 2016, vol. 6, p. 94669.
Samad, S., Loh, K.S., Wong, W.Y., Lee, T.K., Sunarso, J., Chong, S.T., and Wan Dau, W.R., Carbon and non-carbon support materials for platinum-based catalysts in fuel cells, Internat. J. Hydrogen Energy, 2018, vol. 43, p. 7823.
Ramli, Z.A.C. and Kamarudin, S.K., Platinum-Based Catalysts on Various Carbon Supports and Conducting Polymers for Direct Methanol Fuel Cell Applications: a Review, Nanoscale Res Lett, 2018, vol. 13, no. 410.
Ortíz-Herrera, J.C., Tellez-Cruz, M.M., Solorza-Feria, O., and Medina, D.I., Effect of Different Carbon Supports on the Activity of PtNi Bimetallic Catalysts toward the Oxygen Reduction, Catalysts, 2022, vol. 12, p. 477.
Zhang, Q., Huang, J.-Q., Qian, W.-Z., Zhang, Y.-Y., and Wei, F., The Road for Nanomaterials Industry: A Review of Carbon Nanotube Production, Post Treatment, and Bulk Applications for Composites and Energy Storage, Small, 2013, vol. 9, p. 1237.
Paraknowitsch, J.P. and Thomas, A., Doping carbons beyond nitrogen: an overview of advanced heteroatom doped carbons with boron, sulphur and phosphorus for energy applications, Energy Environ. Sci., 2013, vol. 6, p. 2839.
Hu, C. and Dai, L., Doping of carbon materials for metal-free electrocatalysis, Adv. Mater., 2019, vol. 31, p. 1804672.
Singh, S.K, Takeyasu, K., and Nakamura, J., Active sites and mechanism of oxygen reduction reaction electrocatalysis on nitrogen-doped carbon materials, Adv. Mater., 2019, vol. 31, p. 1804297.
Zhang, X., Zhang, X., Zhao, S., Wang, Y.Q., Lin, X., Tian, Z.Q., Shen, P.K., and Jiang, S.P., Precursor modulated active sites of nitrogen doped graphene-based carbon catalysts via one-step pyrolysis method for the enhanced oxygen reduction reaction, Electrochim. Acta, 2021, vol. 370, p. 137712.
Тарасевич, М.Р., Хрущева, Е.И. Филиновский, В.Ю., Вращающийся дисковый электрод с кольцом, М.: Наука, 1987. 248 с.
Gloaguen, F., Andolfatto, F., Durand, R., and Ozil, P., Kinetic study of electrochemical reactions at catalyst-recast ionomer interfaces from thin active layer modelling, J. Appl. Electrochem., 1994, vol. 24, p. 863.
Paulus, U.A., Schmidt, T.J., Gasteiger, H.A., and Behm, R.J., Oxygen reduction on a high-surface area Pt/Vulcan carbon catalyst: a thin-film rotating ring-disk electrode study, J. Electroanal. Chem., 2001, vol. 495, p. 134.
Cardoso, E.S.F., Fortunato, G.V., and Gilberto, M., Use of Rotating Ring-Disk Electrodes to Investigate Graphene Nanoribbon Loadings for the Oxygen Reduction Reaction in Alkaline Medium, ChemElectroChem., 2018, vol. 5, p. 1691.
Мищенко, К.П., Равдель, А.А., ред. Краткий справочник физико-химических величин. Л.: Химия, 1974. С. 134. [Mishchenko, K.P. and Ravdel, A.A., eds. Kratkiy spravochnik fiziko-khimicheskikh velichin. (in Russian). Leningrad: Khimiya, 1974, p. 134.]
Jiaa, Z., Yina, G., and Zhang, J., Rrotating ring-disk electrode method, in Rotating Electrode Methods and Oxygen Reduction Electrocatalysts. Xing, W., Yin, G., and Zhang, J., Eds, Amsterdam: Elsevier Science Ltd., 2014, p. 199.
Богдановская, В.А., Кузов, А.В., Радина, М.В., Филимонов, В.Я., Сударев, Г.М., Осина, М.А. Устойчивость к деградации и активность катализаторов с различным содержанием платины, синтезированных на углеродных нанотрубках. Электрохимия. 2020. Т. 56. С. 1083. [Bogdanovskaya, V.A., Kuzov, A.V., Radina, M.V., Filimonov, V.Ya, Sudarev, G.M., and Osina, M.A., Stability against Degradation and Activity of Catalysts with Different Platinum Load Synthesized at Carbon Nanotubes, Russ. J. Electrochem., 2020, vol. 56, p. 969.]
Volfkovich, Y.M., Sakars, A.V., and Volinsky, A.A., Application of the standard porosimetry method for nanomaterials, Internat. J. Nanotechnol., 2005, vol. 2, p. 292.
Bogdanovskaya, V.A, Vernigor, I.E., Radina, M.V., Sobolev, V.D., Andreev, V.N., and Nikolskaya, N.F., Modified Carbon Nanotubes: Surface Properties and Activity in Oxygen Reduction Reaction, Catalysts, 2021, vol. 11, p. 1354.
Bogdanovskaya, V.A, Vernigor, I.E., Radina, M.V., Andreev, V.N., Korchagin, O.V., and Novikov, V.T., Carbon Nanotube Modified by (O, N, P) Atoms as Effective Catalysts for Electroreduction of Oxygen in Alkaline Media, Catalysts, 2020, vol. 10, p. 892.
Богдановская, В.А., Вернигор, И.Е., Радина, М.В., Панченко, Н.В., Андреев, В.Н. Реакция электровосстановления кислорода на модифицированных углеродных нанотрубках в щелочном электролите. Электрохимия. 2022. Т. 58. С. 523. [Bogda-novskaya, V.A., Vernigor, I.E., Radina, M.V., Panchenko, N.V., and Andreev, V.N., Oxygen electroreduction reaction on modified carbon nanotubes in an alkaline electrolyte, Russ. J. Electrochem., 2022, vol. 58, p. 755.]
Perazzolo, V., Brandiele, R., Durante, C., Zerbetto, M., Causin, V., Rizzi, G.A., Cerri, I., Granozzi, G., and Gennaro, A., Density Functional Theory (DFT) and experimental evidences of metalesupport interaction in platinum nanoparticles supported on nitrogen- and sulfur-doped mesoporous carbons: synthesis, activity, and stability, ACS Catal, 2018, vol. 8, p. 1122.
Hansen, T.W., DeLaRiva, A.T., Challa, S.R., and Datye, A.K., Sintering of catalytic nanoparticles: Particle migration or Ostwald ripening? Acc. Chem. Res., 2013, vol. 46, p. 1720.
Кнастер, М.Б., Апельбаум, Л.А. Растворимость водорода и кислорода в концентрированных растворах едкого кали. Журн. физ. химии. 1964. № 8. С. 223. [Knaster, M.B. and Apelbaum, L.A., Solubility of hydrogen and oxygen in concentrated solutions of caustic potash, J. Phys. Chem. (in Russian), 1964, no. 8, p. 223.]
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Экспериментальное определение коэффициента эффективности переноса N.


