Координационная химия, 2023, T. 49, № 4, стр. 229-245
Влияние природы ароматического лиганда и условий синтеза на структуру пентафторбензоатных комплексов меди
В. В. Ковалев 1, М. А. Шмелев 1, *, Г. Н. Кузнецова 1, В. И. Ерахтина 2, Г. А. Разгоняева 1, Т. М. Иванова 1, М. А. Кискин 1, А. А. Сидоров 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Школа № 1449 им. Героя Советского Союза М.В. Водопьянова
Москва, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 23.11.2022
После доработки 11.01.2023
Принята к публикации 12.01.2023
- EDN: FZBNGP
- DOI: 10.31857/S0132344X22600503
Аннотация
Разработаны методы синтеза и охарактеризованы новые пентафторбензоатные (Рfb) комплексы меди с 2,3- и 3,5-лутидином (2,3- и 3,5-Lut соответственно), хинолином (Quin), 1,10-фенантролином (Рhen) состава [Cu2(MeCN)2(Рfb)4] (I), [Cu(2,3-Lut)2(Pfb)2] (II), [Cu(3,5-Lut)4(Pfb)2] (III), [Cu(Quin)2(Pfb)2] (IV), [Cu2(Phen)2(Pfb)4] (V). Также получено необычное гетероанионное пентафторбензоат-бензоатное (Вnz) ионное соединение [Cu2(Рhen)2(Рfb)3]+(Рnz)– (VI). Показано, что четырехмостиковый биядерный металлоостов комплекса I в реакциях с различными производными пиридина не сохраняется, а в случае таких α-замещенных пиридинов, как 2,3-лутидин и хинолин, состав и строение конечных продуктов взаимодействия с пентафторбензоатом меди не зависит от исходного соотношения реагентов и условий кристаллизации. С использованием анализа поверхности Хиршфельда выявлено, что основной вклад в стабилизацию кристаллических упаковок полученных комплексов вносят взаимодействия π···π, C–F···π, C–H···F и F···F.
Изучение новых подходов направленного синтеза полиядерных координационных соединений заданного состава и строения лежит в основе многих исследований, ориентированных на получение функциональных материалов на их основе [1–5]. Развитие новых эффективных методологий является необходимым условием для поиска координационных соединений с нужным набором физико-химических свойств, перспективных для решения различных практических задач, в том числе включающих создание новых фотоактивных молекул и материалов на их основе [6, 7]. Как правило, пошаговое изменение состава, геометрии молекулы и кристаллической упаковки соединений позволяет выявить влияние ряда факторов на физико-химические свойства новых соединений и таким образом установить корреляции структура–свойство [8–13]. Использование сочетаний ароматических лигандов с донорными и акцепторными заместителями, для которых характерно формирование сильных нековалентных взаимодействий, могут обеспечивать управление геометрией молекул и физико-химическими свойствами за счет различных внутри- и межмолекулярных нековалентных взаимодействий (C–H···Hal, Hal···Hal, Hal···π, π···π, N–O···π, NO2···NO2, водородные связи и др.) [14–16]. Например, совмещение в составе одной молекулы аниона пентафторбензойной кислоты с различными нефторированными ароматическими лигандами может оказаться удобным и эффективным инструментом для направленного формирования соединений заданного молекулярного и кристаллического строения [17–22].
Наш интерес к пентафторбензоатным комплексам меди также связан с разнообразием поведения ее соединений в зависимости от типа координационного окружения [23]. Так, находясь в октаэдрическом окружении, ионы меди способны образовывать такие же комплексы, как ионы марганца и кадмия. К примеру, медь и марганец образуют трифторацетатный координационный полимер {M2(Рhen)2(OOCCF3)4}n [24, 25]. Это оказывается возможным благодаря Ян-Теллеровскому искажению координационного полиэдра атома Cu(II) и наличию двух связей, которые могут достигать 2.6 Å [26]. С другой стороны, ион меди легко переходит в квадратное окружение и формирует карбоксилатные комплексы, типичные для палладия [27–31].
Поскольку в случае пентафторбензоатов кадмия нами были получены координационные полимеры с 2,3-лутидином и изохинолином [32], то можно было ожидать в случае октаэдрического окружения иона меди формирования аналогичных координационных полимеров на основе сильно искаженного биядерного четырехмостикового фрагмента. Анализ имеющихся литературных данных показал, что для пентафторбензоатов меди известны биядерные четырехмостиковые фрагменты со структурой “китайского фонарика”, но во всех этих известных примерах [33, 34] в роли нейтрального аксиального лиганда была координирована неароматическая молекула. Пентафторбензоаты меди с координированными производными пиридина или другими ароматическими гетероциклическими лигандами также известны [35–40], но среди них нет ни одного биядерного комплекса со структурой “китайского фонарика”. Следует обратить внимание, что четырехмостиковые карбоксилатные комплексы со структурой “китайского фонарика” наиболее типичны именно для меди, поэтому существовавшая для известных пентафторбензоатов меди ситуация представляется крайне необычной.
Ясно, что при очень большом количестве исследований, посвященных карбоксилатам меди, такое положение дел не может быть случайным. Эту ситуацию, несомненно, прояснит исследование продуктов реакций пентафторбензоата меди с α-замещенными пиридинами. Как известно, использование таких лигандов в очень большом количестве случаев обеспечивало формирование карбоксилатных комплексов со структурой “китайского фонарика”, причем в подавляющем большинстве случаев эти комплексы были единственным продуктом реакции, а избыток, даже очень значительный, α-замещенного пиридина никакой роли не играл [40].
Цель нашей работы – установить, какие молекулы будут формироваться в случае пентафторбензоатов меди при взаимодействии с 2,4-лутидином и хинолином. Для выяснения наличия или отсутствия специфической роли α-замещенных пиридинов было целесообразно сравнить результат взаимодействия пентафторбензоата меди и с 3,5-лутидином. Как будет показано ниже, результаты исследования оказались достаточно неожиданными, поэтому был расширен круг исследуемых пентафторбензоатных комплексов меди, что в итоге себя полностью оправдало.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом комплексов, выполняли на воздухе с использованием MeCN (99%), EtOH (96%), Cu(NO3)2 · 6H2O (“х. ч.”), Eu(NO3)3 · 5H2O (99.99%, Ланхит), пентафторбензойной кислоты (HPfb, 98%, P&M-Invest), бензойной кислоты (HBnz, “х. ч.”) KOH (“х. ч.”), 2,3-лутидина (2,3-Lut, 98%, Aldrich), 3,5-лутидина (3,5-Lut, 98%, Aldrich), хинолина (Quin, 98%, Sigma-Aldrich), 1,10-фенантролина (Phen, 99%, Alfa Aesar). ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (Perkin Elmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Элементный анализ выполняли на CHNS-анализаторе EuroEA-3000 (EuroVector).
Синтез [Cu2(MeCN)2(Pfb)4] (I). К 0.392 г (7.000 ммоль) КОН в 50 мл метанола прибавляли 1.484 г (7.000 ммоль) HPfb и перемешивали при 50°С до полного растворения исходных продуктов. К полученному раствору добавляли 0.962 г (3.500 ммоль) Cu(NO3)2 · 6H2O и перемешивали при 50°С в течении 20 мин. Образовавшийся при перемешивании осадок KNO3 отфильтровывали, а полученный голубой раствор упаривали при комнатной температуре до полного удаления растворителя. Образовавшийся синий осадок растворяли в 20 мл ацетонитрила и выдерживали при комнатной температуре и медленном испарении. Синие кристаллы, пригодные для РСА, получали через 7 сут. Кристаллы I отфильтровывали, промывали холодным ацетонитрилом и высушивали на воздухе. Выход I 1.520 г (82.5% в расчете на Cu(NO3)2 · 6H2O).
ИК-спектр (НПВО; ν, см–1): 3649 сл, 3610 сл, 3510 сл, 2415 сл, 1649 с, 1578 с, 1491 с, 1374 с, 1255 сл, 1111 ср, 992 с, 902 сл, 889 ср, 758 с, 521 ср, 452 ср, 428 ср, 405 ср.
Синтез [Cu(2,3-Lut)2(Pfb)2] (II). К 0.079 г (1.410 ммоль) КОН в 10 мл метанола прибавляли 0.300 г (1.410 ммоль) HPfb и перемешивали при 50°С до полного растворения исходных продуктов. К полученному раствору добавляли 0.210 г (0.705 ммоль) Cu(NO3)2 · 6H2O и перемешивали при 50°С в течении 15 мин. Образовавшийся при перемешивании осадок KNO3 отфильтровали, а к полученному голубому раствору прибавляли 0.388 мл (2.820 ммоль, Cu : 2,3-Lut = 1 : 4) 2,3-лутидина. Полученный раствор выдерживали при комнатной температуре и медленном испарении. Малиновые кристаллы, пригодные для РСА, получали через 5 сут. Кристаллы II отфильтровывали, промывали холодным ацетонитрилом и высушивали на воздухе. Выход II 0.202 г (40.9% в расчете на Cu(NO3)2 · 6H2O).
ИК-спектр (НПВО; ν, см–1): 3426 сл, 3095 сл, 2974 сл, 2925 сл, 2626 сл, 2392 сл, 1625 с, 1516 с, 1482 с, 1354 с, 1279 с, 1214 ср, 1198 ср, 1137 ср, 1105 ср, 989 с, 924 сл, 802 ср, 754 с, 717 ср, 612 ср, 585 ср, 517 ср, 441 сл.
Синтез [Cu(3,5-Lut)4(Pfb)2] (III) выполняли по методике, аналогичной для II, с использованием 0.388 мл (2.820 ммоль, Cu : 3,5-Lut = 1 : 4) 3,5-лутидина вместо 2,3-лутидина. Получить кристаллы, пригодные для РСА, не удалось вплоть до полного удаления растворителя. Полученный поликристаллический осадок перерастворяли в 8 мл EtOH и медленно упаривали при комнатной температуре. Синие кристаллы, пригодные для РСА, получали через 7 сут. Кристаллы III отфильтровывали, промывали холодной водой и высушивали на воздухе. Выход составил III 0.532 г (43.2% в расчете на Cu(NO3)2 · 6H2O).
ИК-спектр (НПВО; ν, см–1): 3425 сл, 3099 сл, 2976 сл, 2929 сл, 2627 сл, 2254 сл, 1652 с, 1607 с, 1497 с, 1389 с, 1351 с, 1275 ср, 1186 ср, 1155 ср, 1091 с, 986 с, 921 ср, 870 ср, 829 ср, 747 с, 698 с, 582 ср, 522 ср.
Синтез [Cu(Quin)2(Pfb)2] (IV). К раствору 0.100 г (0.095 ммоль) комплекса I в 10 мл MeCN прибавляли 0.024 мл (0.190 ммоль, Cu : Quin = 1 : 1) хинолина. Полученный раствор выдерживали при комнатной температуре и медленном испарении. Фиолетовые кристаллы, пригодные для РСА, получали через 3 сут. Кристаллы IV отфильтровывали, промывали холодным ацетонитрилом и высушивали на воздухе. Выход IV составил 0.023 г (36.2% в расчете на Quin).
ИК-спектр (НПВО; ν, см–1): 3459 сл, 3091 сл, 2997 сл, 2325 сл, 2254 сл, 1907 сл, 1618 ср, 1511 с, 1485 с, 1365 с, 1318 ср, 1284 ср, 1232 сл, 1134 сл, 1104 ср, 1052 сл, 991 с, 928 ср, 808 с, 762 с, 739 ср, 703 ср, 637 ср, 617 ср, 584 сл, 524 ср, 498 ср, 463 ср.
Синтез [Cu2(Phen)2(Pfb)4] (V). К 0.019 г (0.336 ммоль) КОН в 10 мл этанола прибавляли 0.041 г (0.336 ммоль) HBnz и перемешивали при 50°С до полного растворения исходных продуктов. К полученному раствору добавляли навеску 0.048 г (0.112 ммоль) Eu(NO3)3 · 5H2O и перемешивали при 50°С в течении 15 мин. Образовавшийся при перемешивании осадок KNO3 отфильтровывали, а к полученному раствору прибавляли 0.060 г (0.056 ммоль) комплекса I и 0.020 г (0.112 ммоль) 1,10-фенантролина. Полученный раствор перемешивали при 50°С в течение 2 ч и выдерживали при комнатной температуре и медленном испарении. Голубые кристаллы, пригодные для РСА, получали через 6 сут. Кристаллы V отфильтровывали, промывали холодным ацетонитрилом и высушивали на воздухе. Выход V 0.016 г (21.3% в расчете на комплекс I).
ИК-спектр (НПВО; ν, см–1): 3425 сл, 3070 сл, 2287 сл, 1632 ср, 1532 с, 1491 с, 1390 с, 1331 ср, 1284 ср, 1232 сл, 1170 ср, 1122 ср, 1089 сл, 990 с, 945 с, 807 ср, 760 ср, 709 сл, 639 ср, 619 сл, 589 сл, 549 сл, 490 сл, 469 ср.
Синтез [Cu2(Phen)2(Pfb)3] · Bnz (VI). К 0.019 г (0.336 ммоль) КОН в 10 мл этанола прибавляли 0.041 г (0.336 ммоль) HBnz и перемешивали при 50°С до полного растворения исходных продуктов. К полученному раствору добавляли навеску 0.050 г (0.168 ммоль) Cu(NO3)2 · 6H2O и перемешивали при 50°С в течении 15 мин. Образовавшийся при перемешивании осадок KNO3 отфильтровывали, а к полученному голубому раствору прибавляли 0.089 г (0.084 ммоль) комплекса I и 0.061 г (0.336 ммоль) 1,10-фенантролина. Полученный раствор перемешивали при 50°С в течение 30 мин и выдерживали при комнатной температуре и медленном испарении. Синие кристаллы, пригодные для РСА, получали через 10 сут. Кристаллы VI отфильтровывали, промывали холодным ацетонитрилом и высушивали на воздухе. Выход VI 0.037 г (35.8% в расчете на комплекс I).
ИК-спектр (НПВО; ν, см–1): 3070 ср.о.ш, 2551 ср, 1070 с, 1651 ср, 1558 ср, 1489 ср, 1404 ср, 1323 с, 1285 с, 1180 ср, 1111 ср, 1072 сл, 997 с, 931 с, 806 ср, 760 ср, 712 с, 689 с, 556 ср, 543 ср, 454 ср, 420 ср.
РСА монокристаллов выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) [41]. Введена полуэмпирическая поправка на поглощение по программе SADABS [42]. Структуры решены прямым методом и уточнены МНК сначала в изотропном, а затем в анизотропном приближении по $F_{{hkl}}^{2}.$ Позиции атомов водорода рассчитаны геометрически и уточнены в изотропном приближении по модели наездника. Все расчеты проведены с помощью комплекса программ SHELXL-2018/3 [43] с использованием Olex2 [44]. В структуре I пентафторфенильные фрагменты разупорядочены по двум позициям с заселенностями 0.642/0.358. В структуре V атом кислорода O(4) карбоксильной группы разупорядочен по двум позициям с заселенностями 0.72/0.28. Геометрия полиэдров атомов металлов определена с использованием программы SHAPE 2.1 [45]. Кристаллографические параметры и детали уточнения структур I–VI приведены в табл. 1 и 2.
Таблица 1.
Кристаллографические параметры и детали уточнения структур I–III
| Параметр | Знaчение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C32H6N2O8F20Cu2 | C28H18N2O4F10Cu | C42H36N4O4F10Cu |
| М | 1053.47 | 699.98 | 914.29 |
| Т, K | 296(2) | 100(2) | 100(2) |
| Сингония | Моноклинная | Триклинная | Моноклинная |
| Пр. группа | C2/c | $P\bar {1}$ | P21/n |
| a, Å | 13.776(3) | 7.5374(5) | 12.8343(10) |
| b, Å | 17.410(4) | 8.8184(7) | 9.0410(7) |
| c, Å | 14.837(3) | 10.3150(7) | 17.6667(14) |
| α, град | 90 | 85.157(3) | 90 |
| β, град | 91.08(3) | 84.742(3) | 104.398(3) |
| γ, град | 90 | 75.366(3) | 90 |
| V, Å3 | 3557.8(12) | 659.25(8) | 1985.6(3) |
| Z | 4 | 1 | 2 |
| ρ(выч.), г/см3 | 1.967 | 1.763 | 1.529 |
| μ, мм–1 | 1.356 | 0.940 | 0.646 |
| θmax, град | 25.999 | 25.995 | 25.998 |
| Число измеренных рефлексов | 8757 | 5608 | 11 466 |
| Число независимых рефлексов | 3409 | 2489 | 3884 |
| Число рефлексов с I > 2σ(I) | 2679 | 2224 | 3088 |
| Rint | 0.0565 | 0.0647 | 0.0402 |
| Число уточняемых параметров | 3519 | 3435 | 3815 |
| GOOF | 1.114 | 1.036 | 1.027 |
| R1 (I > 2σ(I)) | 0.0610 | 0.0467 | 0.0374 |
| wR2 (I > 2σ(I)) | 0.1150 | 0.1190 | 0.0861 |
| Δρmin/Δρmax, е Å–3 | –0.713/0.430 | –0.961/0.726 | –0.405/0.308 |
Таблица 2.
Кристаллографические параметры и детали уточнения структур IV–VI
| Параметр | Знaчение | ||
|---|---|---|---|
| IV | V | VI | |
| Брутто-формула | C32H14CuF10N2O4 | C52H16Cu2F20N4O8 | C52H21Cu2F15N4O8 |
| М | 743.99 | 1331.77 | 1241.81 |
| Т, K | 150(2) | 296(2) | 100(2) |
| Сингония | Триклинная | Триклинная | Ромбическая |
| Пр. группа | $P\bar {1}$ | $P\bar {1}$ | Pnna |
| a, Å | 7.3250(5) | 9.5223(10) | 25.0562(19) |
| b, Å | 9.4595(6) | 10.6768(12) | 13.8791(10) |
| c, Å | 10.3994(6) | 12.7802(12) | 15.6130(13) |
| α, град | 84.816(2) | 81.280(4) | 90 |
| β, град | 82.975(2) | 71.143(5) | 90 |
| γ, град | 78.030(2) | 81.832(5) | 90 |
| V, Å3 | 698.05(8) | 1209.4(2) | 5429.5(7) |
| Z | 1 | 1 | 4 |
| ρ(выч.), г/см3 | 1.770 | 1.829 | 1.519 |
| μ, мм–1 | 0.894 | 1.020 | 0.890 |
| θmax, град | 30.597 | 30.509 | 24.713 |
| Число измеренных рефлексов | 7805 | 15 098 | 36 099 |
| Число независимых рефлексов | 4218 | 7320 | 4643 |
| Число рефлексов с I > 2σ(I) | 3843 | 5801 | 3309 |
| Rint | 0.0166 | 0.0279 | 0.1041 |
| Число уточняемых параметров | 4822 | 856 | 4137 |
| GOOF | 0.936 | 1.051 | 1.039 |
| R1 (I > 2σ(I)) | 0.0305 | 0.0496 | 0.0634 |
| wR2 (I > 2σ(I)) | 0.1151 | 0.1005 | 0.1580 |
| Δρmin/Δρmax, е Å–3 | –0.418/0.428 | –0.370/0.330 | –1.135/1.053 |
Структурные данные соединений I–VI депонированы в Кембриджском банке структурных данных (CCDC № 2214307 (I), 2214304 (II), 2214305 (III), 2214306 (IV), 2218311 (V), 2217785 (VI)) и доступны по адресу deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif.
Для оценки вклада различных нековалентных взаимодействий в кристаллические упаковки полученных комплексов мы проанализировали поверхность Хиршфельда с помощью программы Crystal Explorer 17 [46, 47].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии нитрата меди с калиевой солью пентафторбензойной кислоты (полученной без выделения при взаимодействии гидроксида калия с пентафторбензойной кислотой) в смеси метанол–ацетонитрил образуются кристаллы соединения [Cu2(MeCN)2(Pfb)4] (I, схема 1 ) со структурой “китайского фонарика”, типичной для биядерных комплексов меди. Однако сохранить четырехмостиковый биядерный металлоостов комплекса I в реакциях с различными производными пиридина не удалось.
Общая схема синтеза комплексов I–VI представлена на схеме 1 .
Схема 1 .
Реакция пентафторбензоата меди с четырехкратным избытком 2,3-лутидина или 3,5-лутидина приводила к формированию моноядерных комплексов [Cu(2,3-Lut)2(Рfb)2] (II, схема 1 ) и [Cu(3,5-Lut)4(Рfb)2] (III, схема 1 ). Четырехкратный избыток 2,3-Lut и 3,5-Lut использовали для увеличения выхода ожидаемого продукта реакции, поскольку наш предыдущий опыт указывал на то, что в случае образования соединений со структурой “китайского фонарика” такой избыток позволял практически количественно получать однофазный комплекс [40].
C учетом состава соединения II, в реакции комплекса I c хинолином соотношение Cu : Quin было уменьшено до 1 : 1, а в качестве растворителя использовали ацетонитрил. Это привело к получению аналогичного комплексу II соединения [Cu(Quin)2(Pfb)2] (IV, схема 1 ), т.е. в случае таких α-замещенных пиридинов как 2,3-лутидин и хинолин состав и строение конечных продуктов взаимодействия с пентафторбензоатом меди был одним и тем же при варьировании исходного соотношения реагентов и состава раствора.
Поскольку для кадмия и цинка описаны гетерометаллические {Cd2Ln2} и {Zn2Ln2} пентафторбензоаты [48–51], то для получения более полного представления о пентафторбензоатах меди целесообразно также синтезировать комплексы Cu(II)-Ln(III). Ранее аналогичные комплексы были описаны для анионов других монокарбоновых кислот [52–55]. Неожиданным для нас оказался результат синтеза, в котором мы планировали получить гетерометаллический комплекс Cu(II)-Ln(III) с 1,10-фенантролином, поскольку вместо ожидаемого молекулярного соединения [Cu2Eu2(Phen)2(Pfb)10] был выделен гомометаллический комплекс [Cu2(Phen)2(Pfb)4] (V, схема 1 ), который ранее был зафиксирован в составе сольвата [Cu2(Phen)2(Pfb)4] · 2НPfb [56].
Образование V показывает, что гетерометаллический пентафторбензоат Cu(II)-Ln(III), по-видимому, неустойчив в использованной нами системе. Здесь следует отметить, что одним из результатов действия нековалентных взаимодействий типа арен-перфторарен в исследуемых нами системах является разрушение гетерометаллических фрагментов, которые в случае большинства других карбоксилатных анионов (пивалатных, бензоатных, фуроатных) проявляют очень высокую устойчивость. Так, многие гетерометаллические комплексы типа [M2Li2L2(OOCR)6], [M2MgL2(OOCR)6], [M2Ln2L2(OOCR)10] или [M2LnL2(OOCR)7] (М = = Ni(II), Co(II), Cu(II), Zn(II), Cd(II), L = монодентатный или хелатирующий N-донорный лиганд) устойчивы к действию многократного избытка монодентатных и хелатирующих производных пиридина [57–62]. Подобную “деструктивную” роль ароматических N-донорных лигандов мы наблюдали в случае пентафторбензоатов кадмия, где при попытках синтеза комплексов с 2,4-лутидином и изохинолином удалось выделить только гомометаллические соединения кадмия [32]. С монодентатным N-донорным лигандом нам удалось получить гетерометаллический комплекс [Cd2Ln2(Ру)4(Рfb)10], который, однако, легко разрушался небольшим избытком пиридина до [Cd(Ру)3(Рfb)2] [32]. При этом c 1,10-фенанатролином кадмий формировал устойчивые соединения Cd(II)-Ln(III) [51]. В случае меди мы наблюдаем еще более “деструктивную” роль ароматических лигандов. В данном случае, это проявляется в том, то гетерометаллический комплекс Cu(II)-Ln(III) не удается получить даже с хелатирующим лигандом, хотя в случае других карбоксилатных анионов такие соединения образуются [55, 63].
Столь специфичное поведение меди в пентафторбензоатных системах показывает, что практически невозможно прогнозировать результаты реакций, которые в случае кадмия и цинка мы исследовали детально и можем уверенно планировать. Именно это заставило нас воспроизвести эксперимент, в котором в случае кадмия не был получен ожидаемый результат. Мы пытались получить гетероанионное соединение кадмия, в котором сочетались бы пентафторбензоатные и бензоатные анионы c 1,10-фенантролином. Вместо этого с высоким выходом были выделены только кристаллы известного координационного полимера {Cd(Рhen)(Рfb)2}n [64]. При взаимодействии бензоата и пентафторбензоата меди с 1,10-фенантролинов в этаноле удалось выделить крайне необычное гетероанионное ионное соединение [Cu2(РhenРfb)3]+(Вnz)– (VI, схема 1 ).
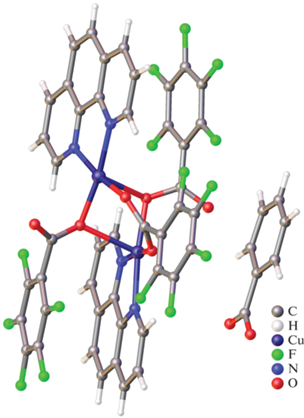
Комплекс I кристаллизуется в моноклинной пространственной группе С2/с. Соединение I состоит из двух катионов меди, связанных между собой четырьмя мостиковыми μ2-η1:η1 Рfb– анионами (рис. 1, расстояние Cu···Cu 2.724(1) Å; длины связей Cu–O лежат в узком диапазоне 1.971(4)–1.978(3) Å). Каждый ион меди дополнительно координирует атом азота молекулы MeCN (Cu(1)–N(1) 2.147(2) Å). Длины связей Cu–O и Cu–N, а также расстояние Cu···Cu для соединения I лежат в диапазоне, характерном для комплексов меди со структурой “китайского фонарика” [65–67]. Также не наблюдается значительного искажения геометрии соединения I по сравнению с бензоатным комплексом меди [Cu2(MeCN)2(Вnz)4] [68]. Геометрия координационного полиэдра CuO4N проанализирована с помощью программы Shape2.1 и соответствует тетрагональной пирамиде (Sq(Cu) = = 0.323, ион меди выходит из основания пирамиды O4 на 0.234(2) Å).
В кристаллической упаковке комплекса I наблюдается параллельная ориентация пентафторбензоатных анионов соседних молекул, что может свидетельствовать о наличии взаимодействий π···π между ароматическими фрагментами (табл. 3). Также можно выделить межмолекулярные нековалентные взаимодействия C–F···π (табл. 4), F···F (табл. 5), C–H···F и C–H···O (табл. 6), которые приводят к стабилизации супрамолекулярной каркасной структуры. Выявлено, что основной вклад в поверхность Хиршфельда комплекса I вносят взаимодействия F···F, H···F, C···F, F···O, C···C (табл. 7).
Таблица 3.
Bзаимодействия π···π в кристаллической упаковке комплексов I–VI*
| Взаимодействие | Cg···Cg, Å | Код симметрии | Cg···Perp, Å | α, град |
|---|---|---|---|---|
| I | ||||
| Pfb···Pfb | 3.650(3) | 2 – x, y, 1/2 – z | 3.541(2) | 15.9(2) |
| Pfb···Pfb | 3.621(4) | 1 – x, 1 – y, 1 – z | 3.465(3) | 0.0(3) |
| Pfb···Pfb | 3.634(8) | 1 – x, 1 – y, 1 – z | 3.465(3) | 7.8(6) |
| Pfb···Pfb | 3.756(10) | 1 – x, 1 – y, 1 – z | 3.357(7) | 0.0(8) |
| II | ||||
| 2,3-Lut···2,3-Lut | 3.7261(18) | 1 – x, y, 1 – z | 3.4135(12) | 0.00(14) |
| Pfb···Pfb | 3.5397(18) | 2 – x, 1 – y, – z | 3.2713(13) | 0.00(15) |
| III | ||||
| 3,5-Lut···3,5-Lut | 3.7173(11) | 1 – x, 2 – y, 1 – z | 3.3475(8) | 0.02(10) |
| IV | ||||
| Pfb···Pfb | 3.4921(9) | –x, 1 – y, 2 – z | 3.3316(6) | 0.00(7) |
| Quin···Quin | 3.8262(7) | 1 – x, 1 – y, 2 – z | 3.5040(5) | 0.02(4) |
| V | ||||
| Phen···Pfb | 3.5860(16) | 1 – x, 1 – y, 1 – z | 3.3622(11) | 7.29(13) |
| Phen···Phen | 3.5726(16) | 1 – x, 2 – y, 1 – z | 3.4509(11) | 0.00(13) |
| VI | ||||
| Phen···Pfb | 3.600(3) | x, 3/2– y, 3/2– z | 3.396(2) | 2.2(2) |
| Phen···Phen | 3.592(3) | 1 – x, 1 – y, 2 – z | 3.3958(19) | 0.2(2) |
| Bnz···Pfb | 3.629(3) | x, y, z | 3.4555(19) | 3.1(3) |
| Pfb···Pfb | 3.777(3) | 1 – x, 1 – y, 1 – z | 3.497(2) | 0.0(3) |
Таблица 4.
Взаимодействия С–F···π в кристаллической упаковке комплексов I, II, IV–VI*
| Взаимодействие | F···Cg, Å | Код симметрии | F···Perp, Å | Угол C–O···Cg, град |
|---|---|---|---|---|
| I | ||||
| С(11A)–F(11A)···π(Рfb) | 3.441(7) | x, 1 – y, 1/2 + z | 3.328 | 106.8(5) |
| C(13A)–F(13A)···π(Рfb) | 3.211(7) | 1 – x, y, 3/2 – z | 3.068 | 104.6(4) |
| C(14A)–F(14A)···π(Рfb) | 3.573(10) | 1 – x, 1 – y, 1 – z | 3.130 | 69.4(4) |
| C(11B)–F(11B)···π(Рfb) | 3.360(9) | x, 1 – y, 1/2 + z | 2.994 | 97.0(8) |
| C(13B)–F(13B)···π(Рfb ) | 3.492(9) | 1 – x, y, 3/2 – z | 3.025 | 115.1(8) |
| C(14B)–F(14B)···π(Рfb) | 3.660(16) | 1 – x, y, 3/2 – z | 3.399 | 69.2(10) |
| II | ||||
| С(4)–F(4)···π(Рfb) | 3.491(2) | 2 –x, 1 – y, –z | 3.212 | 69.31(15) |
| С(5)–F(5)···π(2,3-Lut) | 3.171(2) | 1 + x, y, –1 + z | 3.048 | 147.79(18) |
| IV | ||||
| C(3)–F(3)···π(Pfb) | 3.5189(12) | 1 – x, 1 – y, 1 – z | 3.312 | 152.47(8) |
| C(4)–F(4)···π(Pfb) | 3.6652(13) | –x, 1 – y, 2 – z | 3.263 | 65.62(8) |
| C(5)–F(5)···π(Quin) | 3.3138(13) | –1 + x, y, 1 + z | 3.174 | 142.94(10) |
| V | ||||
| C(3)–F(3)···π(Phen) | 3.648(2) | 2 – x, 1 – y, 1 – z | 3.441 | 19.36 |
| C(6)–F(6)···π(Phen) | 3.639(2) | 1 – x, 1 – y, 1 – z | 3.277 | 25.77 |
| C(7)–F(7)···π(Phen) | 3.4746(19) | 1 – x, 1 – y, 1 – z | 3.102 | 26.77 |
| C(10)–F(10)···π(Phen) | 3.373(2) | 1 – x, 1 – y, 1 – z | 3.244 | 15.90 |
| C(13)–F(13)···π(Pfb) | 3.249(2) | 2 – x, 1 – y, –z | 3.159 | 13.54 |
| C(14)–F(14)···π(Pfb) | 3.635(2) | 2 – x, 1 – y, 1 – z | 3.209 | 28.03 |
| VI | ||||
| C(4)–F(4)···π(Phen) | 3.701(4) | x, 3/2 – y, 3/2 – z | 3.376 | 67.0(3) |
| C(6)–F(6)···π(Phen) | 3.536(5) | x, 3/2 – y, 3/2 – z | 3.312 | 71.5(3) |
| C(7)–F(7)···π(Phen) | 3.484(5) | x, 3/2 – y, 3/2 – z | 3.433 | 91.1(3) |
| C(10)–F(10)···π(Bnz) | 3.773(4) | 3/2 – x, 1/2 + y, 3/2 – z | 3.411 | 66.5(3) |
Таблица 5.
Взаимодействия F···F в кристаллической упаковке комплексов I, IV, VI
| Взаимодействие F···F |
d, Å | Код симметрии | % от суммы ван-дер-ваальсовых радиусов |
|---|---|---|---|
| I | |||
| F(3)···F(10B) | 2.898(11) | 98.5 | |
| F(5)···F(10B) | 2.711(12) | x, 1 – y, –1/2 + z | 92.2 |
| F(6)···F(11B) | 2.879(9) | 3/2 – x, 1/2 + y, 1/2 – z | 97.9 |
| F(6)···F(14A) | 2.894(8) | 1/2 + x, 3/2 – y, –1/2 + z | 98.4 |
| F(7)···F(14A) | 2.702(8) | 1/2 + x, 3/2 – y, –1/2 + z | 91.9 |
| IV | |||
| F(4)···F(5) | 2.880(2) | 2 – x, 2 – y, 1 – z | 97.9 |
| V | |||
| F(3)···F(4) | 2.930(3) | 1 – x, 1 – y, 2 – z | 98.6 |
| VI | |||
| F(6)···F(11) | 2.738(5) | –1/2 + x, 3/2 – y, –1/2 + z | 93.1 |
| F(5)···F(5) | 2.828(4) | x, 3/2 – y, 3/2 – z | 95.9 |
| F(12)···F(11) | 2.719(4) | x, 3/2 – y, 3/2 – z | 92.2 |
Таблица 6.
Взаимодействия С–H···F и С–H···O в кристаллической упаковке комплексов I, III–VI
| D–H···A | Расстояние, Å | Код симметрии | Угол D–H···A, град |
||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| I | |||||
| C(10)–H(10)···F(7) | 0.95 | 2.49 | 3.280(4) | 1 – x, –y, 1 – z | 141 |
| C(11)–H(11)···O(2) | 0.95 | 2.49 | 3.193(4) | 1 + x, y, z | 130 |
| C(13)–H(13C)···F(3) | 0.98 | 2.49 | 3.305(4) | 1 – x, 1 – y, 1 – z | 141 |
| III | |||||
| C(8)–H(8)···O(1) | 0.95 | 2.25 | 2.974(3) | 152 | |
| C(12)–H(12)···O(1) | 0.95 | 2.41 | 3.142(3) | 1 – x, 1 – y, 1 – z | 159 |
| C(14)–H(14C)···F(5) | 0.95 | 2.53 | 3.494(3) | 3/2 – x, –1/2 + y, 3/2 – z | 173 |
| C(15)–H(15)···O(1) | 0.95 | 2.43 | 3.038(3) | 158 | |
| C(19)–H(19)···O(2) | 0.95 | 2.30 | 3.204(3) | 1 – x, 1 – y, 1 – z | 144 |
| IV | |||||
| C(9)–H(9)···O(1) | 0.95 | 2.42 | 3.175(5) | 1 + x, y, z | 136 |
| C(15)–H(15)···F(4) | 0.95 | 2.55 | 3.254(2) | x, 1 + y, –1 + z | 131 |
| V | |||||
| C(25)–H(25)···O(2) | 0.93 | 2.39 | 3.192(3) | 1 – x, 2 – y, 1 – z | 144 |
| C(26)–H(26)···O(4B) | 0.93 | 2.38 | 3.238(10) | 1 – x, 2 – y, 1 – z | 152 |
| VI | |||||
| C(5S)–H(5S)···F(3) | 0.95 | 2.49 | 3.236(10) | 135 | |
| C(13)–H(13)···F(10) | 0.95 | 2.39 | 3.232(6) | 148 | |
| C(17)–H(17)···F(5) | 0.95 | 2.40 | 3.153(6) | x, y, 1 + z | 136 |
Таблица 7.
Вклад нековалентных взаимодействий в общую поверхность Хиршфельда комплексов I–VI
| Взаимодействие | Соединение | |||||
|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | |
| % | ||||||
| C···C | 7.1 | 5.0 | 2.1 | 8.3 | 8.3 | 10.8 |
| C···F | 18.3 | 14.7 | 6.6 | 14.6 | 7.8 | 2.8 |
| H···F | 23.0 | 35.7 | 33.4 | 36.7 | 40.4 | 32.7 |
| F···F | 27.9 | 6.7 | 2.1 | 6.0 | 17.2 | 11.0 |
| O···F | 10.5 | 3.8 | 2.0 | 4.5 | 4.1 | 3.0 |
| O···H | 3.9 | 8.4 | 1.9 | 6.2 | 8.8 | 11.3 |
Комплексы II и IV кристаллизуются в триклинной пространственной группе P$\mathop 1\limits^\_ $ с центром инверсии на ионе металла и имеют сходное строение. Ионы меди в структурах II и IV координируют два атома кислорода двух анионов η1-Pfb– (рис. 2, Cu(1)–O(1) 1.970(2) Å для комплекса II и Cu(1)–O(2) 1.969(1) Å для комплекса IV) и два атома N двух монодентатных лигандов (Cu(1)–N(1) 1.996(2) Å для комплекса II и Cu(1)–N(1) 2.010(2) Å для комплекса IV), формируя квадратное окружение (Sq(Cu) = 0.010 для комплекса II; Sq(Cu) = 0.011 для комплекса IV). Расстояние между ионами меди и не участвующими в координации атомами О карбоксильных групп составляет Cu(1)–O(2) 2.767(2) Å для комплекса II и Cu(1)–O(1) 2.628(1) Å для комплекса IV, что может рассматриваться как относительно слабое взаимодействие [29, 31]. Монодентатный тип координации пентафторбензоатного аниона также подтверждается значительным различием в длинах связей C–O карбоксильных групп (C(1)–O(1) 1.227(3); C(1)–O(2) 1.270(3) Å для комплекса II; C(1)–O(1) 1.230(2); C(1)–O(2) 1.269(1) Å для комплекса IV) [31]. Двугранные углы между плоскостями, образованными ароматическими фрагментами пентафторбензоатных анионов и N-донорных лигандов составляют 87.66(10)° для комплекса II и 88.43(10)° для комплекса IV. Близкие значения длин связей и углов в структурах соединений II и IV указывают, что замена молекулы 2,3-Lut на Quin не оказывает существенного влияния на геометрию полученных комплексов.
В кристаллической упаковке II и IV наблюдается формирование взаимодействий π···π между парами молекул N-донорных лигандов и анионами Pfb, тогда как взаимодействия типа арен-перфторарен отсутствуют (рис. 3, табл. 3). Согласно анализу поверхности Хиршфельда, основной вклад в стабилизацию кристаллической упаковки вносят взаимодействия C···C, C···F, H···F, F···F, O···H (табл. 4–7), причем замена 2,3-лутидина на хинолин в структуре комплекса не приводит к значительному изменению схемы нековалентных взаимодействий.
Рис. 3.
Фрагмент кристаллической упаковки комплекса IV. Пунктирной линией связаны ароматические циклы, между которыми реализуются взаимодействия π···π.

Подобных II и IV карбоксилатных соединений меди с квадратным окружением металлоцентра получено намного меньше по сравнению с гораздо более типичными комплексами со структурой “китайского фонарика”. Для сочетаний конкретного карбоксилатного аниона и N-донорного лиганда, способных формировать моноядерные комплексы такого типа, как правило, получены также и биядерные соединения со структурой “китайского фонарика”. Так, известен монохлорацетат с 2-метилпиридином [Cu(L)2(OOCR)2] [69] и биядерный комплекс [Cu2(L)2(µ-OOCR)4] [70]. Такая же ситуация с бензоатными комплексами с 2‑аминопиридином [71], причем бензоаты образуют биядерные комплексы [Cu2(L)2(µ-OOCR)4] и с другими ароматическими N-донорными лигандами [67, 72, 73].
Комплекс III кристаллизуется в моноклинной пространственной группе P21/n с центром инверсии на ионе металла. Октаэдрическое окружение ионов меди в структуре III сформировано за счет двух атомов кислорода двух анионов η1-Pfb– и четырех атомов азота четырех молекул 3,5-Lut (рис. 4, Sq(Cu) = 0.946). Незначительное искажение полиэдра иона металла также подтверждается валентными углами N(1)Cu(1)N(2) 89.90(7)°, N(1)Cu(1)O(1) 92.49(6)°. Расстояния Cu–N (2.060(2) и 2.030(2) Å) в III типичны для связей Cu–N, тогда как связь Cu(1)–O(1) значительно удлиняется (2.483(4) Å). Атомы O(2) не задействованы в координации к ионам меди и расстояние Cu(1)···O(2) составляет 4.155(2) Å.
Как и в случае комплексов II и IV, в кристаллической упаковке соединения III отсутствуют взаимодействия типа арен–перфторарен, тогда как пары молекул 3,5-Lut формируют взаимодействия π···π (табл. 3). Также в стабилизацию кристаллической упаковки вносят вклад межмолекулярные нековалентные взаимодействия C–H···F и C–H···O (табл. 6), которые приводят к стабилизации супрамолекулярной каркасной структуры. Согласно анализу поверхности Хиршфельда, основной вклад в стабилизацию кристаллической упаковки вносят взаимодействия C···F, H···F (табл. 7), тогда как вклад взаимодействий C···C, F···F, O···H значительно снижается по сравнению с комплексами II, IV.
Согласно анализу КБСД, в литературе описано только несколько примеров комплексов меди состава [Cu(RCOO)2(L)4], где RCOO – анион карбоновой кислоты, L – монодентатный N-донорный лиганд [74–80]. Также описано незначительное количество подобных III комплексов с ионами 3d-металлов, большинство из которых были получены при кристаллизации безводных карбоксилатов из раствора пиридина [74, 81–87]. Поскольку для синтеза пивалата и ацетата железа [Fe(Рy)4-(OOCR)2] [84, 85] инертная атмосфера и отсутствие воды были необходимы, то для трифторацетатов марганца [88], меди [79], кобальта [87] такие условия возможно были излишними. Вероятно, в случае сильных карбоновых кислот образование комплексов типа [М(Ру)4(OOCR)2] будет происходить и во многих других случаях.
Комплекс V кристаллизуется в триклинной пространственной группе $P\bar {1}$ с центром инверсии между двумя ионами меди. В структуре комплекса V ионы металлов связаны между собой двумя анионами η1-Рfb– с формированием биядерного металлоостова (рис. 5, Cu(1)–O(1) 1.968(2), Cu···Cu 3.3681(3) Å, угол Cu(1)O(1)Cu(1) 100.81(8)°). Каждый ион меди достраивает свое окружение до квадратной пирамиды за счет координации аниона Рfb– и хелатно-связанной молекулы Рhen (Cu(1)–O(3) 1.939(1), Cu(1)–N(1) 2.018(2), Cu(1)–N(2) 2.026(2) Å, Sq(Cu) = 1.667). Атомы O(2) и O(4) не задействованы в координации к ионам меди и расстояние Cu(1)···O(2) и Cu(1)···O(4) составляет 2.997(4) Å и 3.084(2) Å соответственно, что превышает суммы ван-дер-ваальсовых радиусов.
Ароматические фрагменты анионов Рfb– в кристаллической упаковке V задействованы в формировании взаимодействий π···π типа арен–перфторарен с молекулами 1,10-Рhen для образования супрамолекулярной цепи, направленной вдоль оси а (рис. 6, табл. 3). Также кристаллическая упаковка стабилизирована взаимодействиями F···F, C–F···π, C–H···O (табл. 4–6) с формированием слоистой супрамолекулярной структуры. Согласно анализу поверхности Хиршфельда основной вклад в стабилизацию кристаллической структуры вносят взаимодействия H···F, F···F, O···H, C···C (табл. 7).
Рис. 6.
Фрагмент кристаллической упаковки комплекса V. Пунктирной линией связаны ароматические циклы, между которыми реализуются взаимодействия π···π.

Биядерные комплексы меди, имеющие аналогичное соединению V строение, ранее были получены для ряда моно- [56, 89–97] и дикарбоновых кислот [93, 98–101. Также ранее были получены аналогичные V биядерные пентафторбензоатные комплексы меди с сольватными молекулами пентафторбензойной кислоты состава [Cu2(Рhen)2(Рfb)4] · 2HРfb [56] и с 2,2'-дипиридилом (Вpy) в качестве N-донорного лиганда [Cu2(Вpy)2(Рfb)4] [94]. Замена молекулы Вpy на Рhen в структуре биядерного пентафторбензоатного комплекса меди не приводит к значительному изменению геометрии молекулы, однако наблюдается сближение ароматических циклов пентафторбензоатных анионов и молекул N-донорных лигандов на ~0.3 Å, что может указывать на усиление нековалентных взаимодействий типа арен–перфторарен. Введение сольватной молекулы кислоты приводит к формированию дополнительных взаимодействий π···π между ароматическими анионами и сольватными молекулами кислоты, что также не оказывает существенного влияния на геометрию биядерной молекулы.
Особенность комплекса V заключается в том, что он имеет практически такое же строение, как биядерный фрагмент координационного полимера {Cd(Рhen)(Рfb)2}n [64]. Однако, хотя соединение V имеет структуру, предорганизованную для полимеризации, его молекула весьма устойчива благодаря тому, что атом меди координационно насыщен. И в координационном полимере {Cd(Рhen)(Рfb)2}n, и в биядерном комплексе V реализуются стэкинг-взаимодействия между координированными молекулами Рhen и пентафторфенильными заместителями карбоксилатных анионов. Благодаря этому ароматические фрагменты ориентированы параллельно и формируют “сплюснутую” структуру. Если “вырезать” из координационного полимера {Cd(Рhen)(Рfb)2}n биядерный фрагмент, то он будет иметь разблокированные координационно ненасыщенныe металлоцентры. Такая структура в реальных условиях может быть устойчива только будучи частью полимерной цепи или при стабилизации ее за счет координации дополнительных лигандов, как это происходило при образовании необычных биядерных 2,3,4,5-тетрафторбензоатных комплексов [Cd2(H2O)2(Рhen)2(OOCC6F4H)4] и [Cd2(H2O)2-(Quin)2(OOCC6F4H)4] [64].
Комплекс VI кристаллизуется в ромбической пространственной группе Pnna. Соединение VI состоит из биядерного катиона [Cu2(Pfb)3(Phen)2]+ и внешнесферного аниона бензойной кислоты. Два иона меди в составе биядерного катиона связаны между собой одним μ2-η1:η1 Pfb– и двумя η1-Рfb– анионами (рис. 7, Cu(1)–O(1) 2.324(3), Cu(1A)–O(1A) 1.951(3), Cu(1)–O(3) 1.942(3), Cu···Cu 3.237(1) Å). Каждый анион меди достраивает окружение до тетрагональной пирамиды за счет координации двух атомов азота молекулы Phen (Cu(1)–N(2) 1.991(4), Cu(1)–N(1) 2.003(5) Å; Sq(Cu) = 2.482). Атом O(2) не участвует в координации к ионам меди и расстояние Cu(1)···O(2) составляет 2.991(4) Å.
Необычность соединения VI заключается в том, что координированными оказываются анионы более сильной карбоновой кислоты, а внешнесферным анионом оказывается анион значительно более слабой (pKa(HBnz) = 4.20; pKa(HPfb) = 1.48). Как правило, бензоатные анионы в карбоксилатных системах не бывают внешнесферными, тогда как для анионов сильных карбоновых кислот эта функция является достаточно обычной [102–104]. Следует указать, что известно некоторое количество трехмостиковых катионных комплексов меди с анионами монокарбоновых кислот, подобных соединению VI [105–110], однако во всех известных примерах противоионами были анионы более сильных кислот.
Все ароматические фрагменты в соединении VI задействованы вo взаимодействиях π···π (рис. 8). В структуре биядерного катиона наблюдаются стэкинг-взаимодействия между координированными молекулами 1,10 фенантролина и пентафторфенильными заместителями анионов (табл. 3). Один пентафторбензоатный анион не участвует во внутримолекулярном стэкинге, однако задействован во взаимодействиях π···π с внешнесферным анионом бензойной кислоты, что приводит к формированию супрамолекулярных цепочек, направленных вдоль оси b. Также кристаллическая упаковка VI стабилизирована рядом взаимодействий C–F···π, C–H···F и F···F (табл. 4–6). Основной вклад в поверхность Хиршфельда вносят взаимодействия H···F, F···F, O···H, C···C. Также можно отметить увеличение роли взаимодействий O···H, C···C и значительное снижение роли взаимодействий H···F, F···F при введении бензоатного аниона в структуру гетероанионного комплекса VI по сравнению с пентафторбензоатным комплексом V (табл. 7).
Рис. 8.
Схема межмолекулярных контактов в супрамолекулярной цепи соединения VI. Пунктирной линией связаны ароматические циклы, между которыми реализуются взаимодействия π···π.

Таким образом, мы показали, что замещение координированных молекул ацетонитрила в комплексе I на ароматические гетероциклические N-донорные лиганды приводит к разрушению биядерного металлоостова и формированию различных моноядерных соединений. Вероятно, именно из-за того что в рассмотренных системах атом меди не образует октаэдрического окружения, никаких аналогов пентафторбензоатных координационных полимеров кадмия с гетероциклическими монодентатными N-донорными лигандами получить не удалось. Устойчивость биядерного комплекса [Cu2(Рhen)2(Рfb)4] определяется тетрагонально-пирамидальным окружением атомов меди, которые в этом комплексе координационно насыщены. На примере гетероанионного бензоатно-пентафторбензоатного комплекса меди было показано, что введение второго типа ароматического аниона приводит к стабилизации ионного соединения нетипичного строения, где в качестве внешнесферного противоиона выступает анион более слабой кислоты.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Zhang Z., Zaworotko M.J. // Chem. Soc. Rev. 2014. V. 43. P. 5444.
Bradberry S.J., Savyasachi A.J., Martinez-Calvo M., Gunnlaugsson T. // Coord. Chem. Rev. 2014. V. 273–274. P. 226.
Chen D.-M., Zhang N.-N., Liu C.-S., Du M. // J. Mater. Chem. C. 2017. V. 5. P. 2311.
Kohnke F.H., Mathias J.P., Fraser Stoddart J. // Angew. Chem. 1989. V. 28. № 8. P. 1103.
Bazhina E.S., Bovkunova A.A., Shmelev M.A. et al. // Polyhedron. 2022. V. 228. Art. 116174.
Barry D.E., Caffreya D.F., Gunnlaugsson T. // Chem. Soc. Rev. 2016. V. 45. P. 3244.
Su J., Yuan S., Cheng Y.-X. et al. // Chem. Sci. 2021. V. 12. P. 14254.
Shmelev M.A., Kuznetsova G.N., Gogoleva N.V. et al. // Russ. Chem. Bull. 2021. V. 7. № 5. P. 830.
Bondarenko M.A., Novikov A.S., Sokolov M.N., Adonin S.A. // Organics. 2022. V. 10. № 10. P. 151.
Adonin S.A., Bondarenko M.A., Novikov A.S. et al. // Crystals. 2020. V. 10. P. 289.
Shmelev M.A., Chistyakov A.S., Razgonyaeva G.A. et al. // Crystals. 2022. V. 12. P. 508.
Zhou W.-L., Chen Y., Lin W., Liu Y. // Chem. Commun. 2021. V. 57 P. 11443.
Koshevoy I.O., Krause M., Klein A. // Coord. Chem. Rev. 2020. V. 405. P. 213094.
Adonin S.A., Novikov A.S., Sokolov M.N., Fedin V.P. // Russ. J. Coord. Chem. 2020. V. 46. P. 302.
Adonin S.A., Novikov A.S., Fedin V.P. // Russ. J. Coord. Chem. 2020. V. 46. P. 37.
Shmelev M.A., Voronina J.K., Evtyukhin M.A. et al. // Inorganics. 2022. V. 10. № 11. Art. 194.
Sharma R.P., Saini A., Kumar S. et al. // J. Mol. Struct. 2017. V. 1128. P. 135.
Shmelev M.A., Voronina Yu.K., Chekurova S. S. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 551.
Kong Y.-J., Han L.-J., Fan L.-T. et al. // J. Fluor. Chem. 2016. V. 186. P. 40.
Han L.-J., Kong Y.-J. // Z. Anorg. Allg. Chem. 2014. V. 640. № 10. P. 2007.
Shmelev M.A., Voronina Yu. K. Gogoleva N.V. et al. // Russ. J. Coord. Chem. 2022. V. 48. № 4. P. 224.
Malkerova I.P., Kayumova D.B., Belova E.V. et al. // Russ. J. Coord. Chem. 2022. V. 48. № 10. P. 608.
Pinto C.B., Dos Santos L.H.R., Rodrigues B.L. // J. A-ppl. Crystallogr. 2020. V. 53. P. 1321.
Sen S., Saha M.K., Gupta T. et al. // J. Chem. Crystallogr. 1998. V. 28. P. 771.
Andruh M., Roesky H.W., Noltemeyer M., Schmidt H.-G. // Polyhedron. 1993. V. 12. № 23. P. 2901.
Harding M.M. // Acta Crystallogr. D. 2000. V. 56. P. 857.
Bondarenko M.A., Abramov P.A., Novikov A.S. et al. // Polyhedron. 2022. V. 214. Art. 15644.
Li Z., Yuan Y., Zhang Y. et al. // Z. Anorg. Allg. Chem. 2017. V. 643. № 10. P. 647.
Sanchez-Sala M., Pons J., Álvarez-Larena Á. et al. // ChemistrySelect. 2017. V. 2. № 35. P. 11574.
Obaleye J.A., Ajibola A.A., Bernardus V.B., Hosten E.C. // J. Mol. Struct. 2020. V. 1203. Art.127435.
Rajakannu P., Kaleeswaran D., Banerjee S. et al. // Inorg. Chim. Acta. 2019. V. 486. P. 283.
Shmelev M.A., Gogoleva N.V., Kuznetsova G.N. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 8. P. 557.
Larionov S.V., Glinskaya L.A., Klevtsova R.F. et al. // Z. Neorg. Khim. 1991. V. 36. P. 2514.
Han L.-J., Kong Y.-J., Huang M.-M. // Inorg. Chim. Acta. 2020. V. 514. Art. 120019.
Hashim I.I., Scattolin T., Tzouras N.V. et al. // Dalton Trans. 2022. V. 51. P. 231.
Makoto H., Yoshiyuki I., Taku Y. et al. // Bull. Chem. Soc. Jpn. 2009. V. 82. № 10. P. 1277.
Han L.-J., Kong Y.-J. // Acta Crystallogr. C. 2014. V. 70. № 11. P. 1017.
Sharma R.P., Saini A., Singh S. et al. // J. Fluor. Chem. 2010. V. 131. № 4. P. 456.
Ge C., Zhang X., Yu F. et al. // J. Chem. Crystallogr. 2008. V. 38. P. 501.
Kuznetsova G.N., Nikolaevskii S.A., Yambulatov D.S. et al. // J. Struct. Chem. V. 62. № 2. P. 184.
SMART (control) and SAINT (integration). Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Spek A.L. // Acta Crystallogr. D. 2009. V. 65. № 2. P. 148.
Dolomanov O.V., Bourhis L.J., Gildea R. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Spackman P.R., Turner M.J., McKinnon J.J. et al. // J. Appl. Cryst. 2021. V. 54. P. 1006.
Edwards A.J., Mackenzie C.F., Spackman P.R. et al. // Faraday Discuss. 2017. V. 203. P. 93.
Shmelev M.A., Gogoleva N.V., Ivanov V.K. et al. // Russ. J. Coord. Chem. 2022. V. 48. № 9. P. 539.
Shmelev M.A., Polunin R.A. Gogoleva N.V. et al. // Molecules. 2021. V. 26. № 14. P. 4296.
Belousov Y.A., Kiskin M.A., Sidoruk A.V. et al. // Aust. J. Chem. 2022. V. 75. № 9. P. 572.
Shmelev M.A., Kiskin M.A., Voronina J.K. et al. // Materials. 2020. V. 13. № 24. P. 5689.
Sidorov A.A., Gogoleva N.V., Bazhina E.S. et al. // Pure Appl. Chem. 2020. V. 92. № 7. P. 1093.
Bovkunova A.A., Bazhina E., Evstifeev I.S. et al. // Dalton Trans. 2021. V. 50. P. 12275.
Pushikhina O.S., Kozlyakova E.S., Karpova E.V., Tafeenko V.A. // Z. Anorg. Allg. Chem. 2021. V. 647. № 22. P. 2023.
Li Y., Zhang C., Yu J.-W. et al. // Inorg. Chim. Acta. 2016. V. 445. P. 110.
Ge C., Zhang X., Yin J., Zhang R. // Chin. J. Chem. 2010. V. 28. № 10. P. 2083.
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Inorg. Chim. Acta. 2021. V. 515. P. 120050.
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // ChemSelect. 2020. V. 5. № 28. P. 8475.
Shmelev M.A., Voronina Yu.K., Gogoleva N.V. et al. // Russ. Chem. Bull. 2020. V. 69. P. 1544.
Melnikov S.N., Evstifeev I.S., Nikolaveskii S.A. et al. // New J. Chem. 2021. V. 45. P. 13349.
Nikolaevskii S.A., Petrov P.A., Sukhikh T.S. et al. // Inorg. Chim. Acta. 2020. V. 508. P. 119643.
Gogoleva N.V., Kuznetsova G.N., Shmelev M.A. et al. // J. Solid State Chem. 2021. V. 294. Art. 121842.
Wu B., Lu W., Zheng X. // Transition Met. Chem. 2003. V. 28. P. 323.
Shmelev M.A., Kuznetsova G.N., Dolgushin F.M. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 127.
Yambulatov D.S., Nikolaevskii S.A., Lutsenko I.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 772.
Zeng Z., Cai J., Li F. et al. // RSC Adv. 2021. V. 11. P. 40040.
Sharma P., Dutta D., Gomila R.M. et al. // Polyhedron. 2021. V. 208. Art. 115409.
Lah N., Giester G., Segedin P., Murn A. et al. // Acta Crystallogr. C. 2001. V. 57. P. 546.
Davey G., Stephens F.S. // J. Chem. Soc. A. 1971. P. 1917.
Davey G., Stephens F.S. // J. Chem. Soc. A. 1970. P. 2803.
Kozlevcar B., Lah N., Zlindra D. et al. // Acta Chim. Slov. 2001. V. 48. P. 363.
Kozlevcar B., Murn A., Podlipnik K. et al. // Croat. Chem. Acta. 2004. V. 77. P. 613.
Buijs W., Comba P., Corneli D. et al. // Eur. J. Inorg. Chem. 2001. P. 3143.
Li L.-M., Guo H.-M., Li Y.-F. // Z. Krist New – Cryst. Struct. 2012. V. 227. P. 257.
Dickie D.A., Schatte G., Jennings M.C. et al. // Inorg. Chem. 2006. V. 45. № 4. P. 1646.
Pradilla S.J., Chen H.W., Koknat F.W., Fackler J.P., Jr. // Inorg. Chem. 1979. V. 18. № 12. P. 3519.
Gajewska M.J., Ching W.-M., Wen Y.-S., Hung C.-H. // Dalton Trans. 2014. V. 43. P. 14726.
Ghosh S.K., Bharadwaj P.K. // Inorg. Chem. 2004. V. 43. № 22. P. 6887.
Pretorius J.A., Boeyens J.C.A. // J. Inorg. Nucl. Cchem. 1978. V. 40. № 10. P. 1745.
Baruah J.B., Singh W., Karmakar A. // J. Mol. Struct. 2008. V. 892. № 1–3. P. 84.
Neary M.C., Parkin G. // Polyhedron. 2016. V. 116. P. 189.
Edema J.J.H., Hao S., Gambarotta S., Bensimon C. // Inorg. Chem. 1991. V. 30. № 12. P. 2584.
Li L.-M., Jian F.-F., Ren X.-Y. // Acta Crystrallog. E. V. 65. P. m1041.
Çelenligil-Çetin R., Staples R. J., Stavropoulos P. // Inorg. Chem. 2000. V. 39. № 25. P. 5838.
Singh B., Long J. R., Papaefthymiou G.C., Stavropoulos P. // J. Am. Chem. Soc. 1996. V. 118. № 24. P. 5824.
Tapper A.E., Long J.R., Staples R.J., Stavropoulos P. // Angew. Chem. 2000. V. 39. № 13. P. 2343.
Morozov I.V., Karpova E.V., Glazunova T.Yu. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 647.
Hubner K., Roesky H.W., Noltemeyer M., Bohra R. // Chem. Ber. 1991. V. 124. P. 515.
He X., Chen F., Zhang D. et al. // Z. Anorg. Allg. Chem. 2019. V. 645. № 23. P. 1341.
Sánchez-Féreza F., Bayés L., Font-Bardia M., Pons J. // Inorg. Chim. Acta. 2019. V. 494. P. 112.
Iqbala M., Sirajuddin M., Ali S. et al. // Inorg. Chim. Acta. 2016. V. 440. P. 129.
Iqbal M., Ali S., Tahir M.N. // J. Struct. Chem. 2018. V. 59. P. 1619.
Ghosh D., Dhibar S., Dey A. et al. // ChemSelect. 2020. V. 5. № 1. P. 75.
Han L.-J., Kong Y.-J., Yan T.-J. et al. // Dalton Trans. 2016. V. 45. P. 18566.
Baur A., Bustin K. A., Aguilera E. et al. // Org. Chem. Front. 2017. V. 4. P. 5194.
Eremina J.A., Lider E.V., Sukhikh T.S. et al // Inorg. Chim. Acta. 2020. V. 510. № 119778.
Mushtaq A., Ali S., Nawaz Tahir M., Haider A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1365.
Wang K.-H., Gao E.-J. // Inorg. Chim. Acta. 2018. V. 482. P. 221.
Zhao X., Liang D., Liu S. et al. // Inorg. Chem. 2008. V. 47. № 16. P. 7133.
Zhang H.-R., Gu J.-Z., Kirillova M.V., Kirillov A.M. // Inorg. Chem. Front. 2021. V. 8. P. 4209.
Jiang X., Xia H., Zhu Y.-F. et al. // Z. Anorg. Allg. Chem. 2011. V. 637. № 14–15. P. 2273.
Mehrani A., Morsali A., Ebrahimpour P. // J. Coord. Chem. 2013. V. 66. № 5. P. 856.
Revathi P., Mohan J.S., Balakrishnan T. et al. // Acta Crystallogr. E. 2019. V. 75. P. 134.
Orts-Arroyo M., Castro I., Lloreta F., Martínez-Lillo J. // Dalton Trans. 2020. V. 49. P. 9155.
Lazarou K.N., Chadjistamatis I., Terzis A. et al. // Inorg. Chim. Acta. 2010. V. 363. № 1. P. 107.
Le X.-Y., Zhou X.-H., Yu K.-B., Ji L.-N. // Chin. J. Chem. 2000. V. 18. P. 638.
Lazarou K.N., Chadjistamatis I., Terzis A. // Polyhedron. 2010. V. 29. № 2. P. 833.
Li D.-P., Liang X.-Q., Xu Y. et al. // Chin. J. Struct. Chem. 2013. V. 32. P. 1724.
Tian Y.-P., Zhang X.-J., Wu J.-Y. et al. // New J. Chem. 2002. V. 26. P. 1468.
Ghosh A.K., Ghoshal D., Zangrando E. et al. // Inorg. Chem. 2007. V. 46. № 8. P. 3057.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия