Координационная химия, 2023, T. 49, № 4, стр. 217-228
Катионные комплексы 3a,6a-диаза-1,4-дифосфапенталенов
В. В. Сущев 1, Ю. С. Панова 1, А. В. Христолюбова 1, Н. В. Золотарева 1, М. Д. Гришин 1, Е. В. Баранов 1, Г. К. Фукин 1, А. Н. Корнев 1, *
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: akornev@iomc.ras.ru
Поступила в редакцию 05.07.2022
После доработки 27.07.2022
Принята к публикации 02.08.2022
- EDN: CXIBGQ
- DOI: 10.31857/S0132344X23700214
Аннотация
Взаимодействие аннелированных 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталенов (DDPCl2) с 1 экв. триметилсилилтрифлата (ТMSOTf) приводит к замещению одного атома хлора на трифлатную группу и образованию диазадифосфапенталенов катионного типа [ClDDP]+[TfO]−. В присутствии 2 экв. TMSOTf и 2 экв. 4-диметиламинопиридина (DMAP) образуется дикатион DDP, стабилизированный двумя молекулами DMAP – [DDP(DMAP)2]2+[(CF3SO3)−]2. Молекулы DMAP располагаются с одной стороны DDP-каркаса и лежат в параллельных плоскостях. В растворах [DDP(DMAP)2]2+[(CF3SO3)−]2 в CH2Cl2 методами ЭСП и ЦВА обнаружено присутствие свободного диазадифосфапенталена, что предполагает его диспропорционирование в данных условиях. В разбавленных растворах соединение неустойчиво и распадается с количественным образованием [DMAP · HOTf]. Кристаллографическая информация для полученных структур: CCDC № 2182881–2182883).
3a,6a-Диаза-1,4-дифосфапенталены (DDP) относятся к молодому классу фосфорорганических гетероциклов, проявляющих свойства скрытых (маскированных) фосфиниденов [1, 2]. Двойственная реакционная способность DDP обусловлена изменением электронной конфигурации атома фосфора под действием поляризующих факторов, в роли которых обычно выступают ионы металлов и кислоты Льюиса (схема 1 ) [3, 4].
Схема 1 .
Благодаря такой мобилизации электронной плотности к одному атому фосфора диазадифосфапенталены способны координировать от одного (E = Ph3B, InI3, [SbCl4]–, GeCl2, HgCl2, cхема 2А) [1, 3, 5] до двух электрофильных центров (Е = Ph2BCl, схема 2 В) [4]. При координации одного электрофильного центра он располагается над плоскостью гетероцикла.
Схема 2 .
Всестороннее изучение координационной активности диазадифосфапенталенов показало, что атомы фосфора в данных гетероциклах могут служить не только донорами свободных электронных пар, но и сами становятся электрофильными координационными центрами в условиях дефицита электронной плотности.
В настоящей работе изучено взаимодействие дихлоридов DDP с триметилсилилтрифлатом, приводящее к катионным производным диазадифосфапенталенов, которые могут быть стабилизированы донорными лигандами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы соединений проводили в условиях вакуума и атмосфере высокочистого аргона. Тетрагидрофуран (ТГФ) очищали кипячением и перегонкой над натрием в присутствии бензофенона (кетил-Na). Хлористый метилен и толуол перегоняли над P2O5. Пиридин кипятили и перегоняли над KOH. 4-Диметиламинопиридин (DMAP) (≥99%, Sigma-Aldrich) и триметилсилилтрифлат (Me3SiOSO2CF3, TMSOTf) (≥99%, Sigma-Aldrich) использовали без предварительной очистки и хранили в ампулах под аргоном.
Синтез [(DDP)(DMAP)2](OTf)2 (II). К раствору циклогексан-аннелированного 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталена (I, [6]) (0.32 г, 1.0 ммоль) в 15 мл хлористого метилена последовательно добавляли при 0°С раствор триметилсилилтрифлата (0.44 г, 2.0 ммоль) и 4-диметиламинопиридина (0.24 г, 2.0 ммоль) в том же растворителе (по 10 мл). Реакционную смесь выдерживали 1 ч при комнатной температуре и концентрировали. Выпавшие бесцветные кристаллы продукта перекристаллизовывали из ацетонитрила. Выход II 0.72 г (92%).
| Найдено, %: | C 42.37; | H 4.63; | N 10.56; | P 7.84. |
| Для C28H36F6N6O6P2S2 (М = 792.69) | ||||
| вычислено, %: | C 42.43; | H 4.58; | N 10.60; | P 7.81. |
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.80 (с.уш., 4 H, Py); 6.95 (д. 3JH,H = 6 Гц, 4 H, Py), 3.25 (с., 12H, CH3), 3.10–1.40 (м., 16 H, cHex). Спектр ЯМР 31P{1H} (CDCl3; δ, м.д.): 72.3 (c.). Спектр ЯМР 19F (CDCl3; δ, м.д.): –78.4 (с.).
ИК-спектр (ν, см–1): 1788 ср, 1533 сл, 1460 ср, 1400 ср, 1382 ср, 1318 сл, 1265 с,1219 ср, 1146 с, 1028 с, 996 ср, 920 ср, 856 сл, 833 ср, 801 с, 767 с, 752 ср, 719 сл, 636 ос, 574 ос.
Синтез [(DDP)Cl](OTf) (III). К раствору циклогексан-аннелированного 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталена (I, [6]) (0.32 г, 1.0 ммоль) в 15 мл хлористого метилена добавляли при 0°С раствор триметилсилилтрифлата (0.22 г, 1.0 ммоль) в том же растворителе (10 мл). Реакционную смесь выдерживали 1 ч при комнатной температуре, летучие компоненты удаляли в вакууме, твердый остаток перекристаллизовывали из толуола. Выход III 0.31 г (73%).
| Найдено, %: | C 34.87; | H 3.75; | N 6.40; | P 14.19. |
| Для C13H16ClF3N2O3P2S (М = 434.74) | ||||
| вычислено, %: | C 35.92; | H 3.71; | N 6.44; | P 14.25. |
Спектр ЯМР 1Н (CDCl3; δ, м.д.): 3.05–1.43 (м., 16 H, cHex). Спектр ЯМР 31P{1H} (CDCl3; 223 K; δ, м.д.): 228.4 (д., 3JP,P = 20 Гц), 98.3 (д., 3JP,P = 20 Гц). ЯМР 19F (CDCl3; δ, м.д.): –78.0 (с.).
ИК-спектр (ν, см–1): 1626 ср, 1251 ср. уш., 1148 ср.уш., 1024 с, 910 ср, 854 ср, 816 сл, 800 ср, 726 ср, 636 с, 590 сл, 571 ср, 548 ср, 515 с, 493 сл, 479 ср, 462 с.
Синтез [(DDP*)Cl](OTf) (V). К раствору тетрагидронафталин-аннелированного 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталена (IV, [1]) (0.42 г, 1.0 ммоль) в 15 мл хлористого метилена добавляли при 0°С раствор триметилсилилтрифлата (0.44 г, 2.0 ммоль) в том же растворителе (10 мл). Реакционную смесь выдерживали 1 ч при комнатной температуре и концентрировали. Выпавшие желтые кристаллы продукта перекристаллизовывали из хлористого метилена. Выход V 0.36 г (69%).
| Найдено, %: | C 47.49; | H 3.08; | N 5.32; | P 11.63. |
| Для C21H16ClF3N2O3P2S (M = 530.82) | ||||
| вычислено, %: | C 47.52; | H 3.04; | N 5.28; | P 11.67. |
Спектр ЯМР 1Н (CDCl3; δ, м.д.): 8.5–7.0 (м., 8H, aryl), 3.0–1.8(м., 8H, –CH2–). Спектр ЯМР 31P{1H} (CDCl3; δ, м.д.): 230.0 (с.уш.), 110.0 (с.уш.). 19F (CDCl3; δ, м.д.): –81.0 (с.).
ИК-спектр (ν, см–1): 1604 ср, 1335 сл, 1300 сл, 1275 ср, 1238 ср, 1159 ср, 1087 ср, 1027 с, 903 сл, 887 сл, 805 ср, 775 ср, 764 ср, 726 ср, 693 сл, 673 сл, 653 сл, 635 с, 608 сл, 573 сл, 540 сл, 518 ср, 493 ср, 458 сл.
Спектры ЯМР 1Н, 31Р, 19F регистрировали на приборе Bruker AV400 (400 МГц). Электронные спектры поглощения (ЭСП) записывали на Perkin-Elmer Lambda UV−Vis-спектрометре. ИК-спектры полученных соединений в виде суспензий в вазелиновом масле регистрировали на ИК Фурье-спектрометре “ФСМ 1201” в диапазоне от 4000 до 400 см–1. Элементный анализ выполняли с использованием элементного анализатора “Elementar vario EL cube”, позволяющего определять содержание H, C, N. Aнализ на P проводили по сухому остатку в ходе пиролиза с гравиметрическим окончанием. Измерение окислительно-восстановительных потенциалов соединений II, III, DMAP и трифлата диметил(1H-пиридин-4-илиден)аммония (с = 5 мМ) проводили методом циклической вольтамперометрии (ЦВА) в стандартной трехэлектродной ячейке с помощью потенциостата-гальваностата “Corrtest CS300” (Китай) в среде аргона. Рабочий электрод – стеклоуглеродный электрод (1 мм), вспомогательный – платиновая проволока, электрод сравнения – Ag/AgCl/NaCl. Скорость развертки потенциала 100 мВ/с. Фоновый электролит – 0.1 М nBu4NPF6 (≥99%, Sigma-Aldrich). Компенсацию потери омического напряжения проводили методом положительной обратной связи, а численное значение сопротивления определяли методом прерывания электрохимической цепи.
РСА II, III и V. Кристаллографические данные собраны на автоматических монокристальных дифрактометрах Bruker D8 Quest (для II и III) и Agilent Xcalibur E (для V) (МоKα-излучение, φ- и ω-сканирование, λ = 0.71073 Å). Сбор дифракционных данных, начальное индицирование отражений и уточнение параметров элементарной ячейки произведен с использованием программ APEX3 [7] (для II и III) и CrysAlisPro (для V) [8]. Экспериментальные наборы интенсивностей интегрированы с помощью программ SAINT [9, 10] (для II и III) и CrysAlisPro (для V) [8]. Структуры расшифрованы прямыми методами по “dual-space” алгоритму в программе SHELXT [11]. Неводородные атомы уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении с помощью программного пакета SHELXTL [12, 13]. Учет поглощения произведен в программах SADABS [14] и SCALE3 ABSPACK [15] для II, III и V соответственно. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели наездника (Uизо(H) = 1.5Uэкв(C) для CH3-групп, Uизо(H) = 1.2Uэкв(C) для остальных групп). Cy-фрагменты в комплексах II, V и один трифлат-анион в II разупорядочены соответственно по двум и трем положениям. Основные кристаллографические характеристики и параметры уточнения для II, III и V представлены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры уточнения для II, III и V
| Параметр | Значение | ||
|---|---|---|---|
| II | III | V | |
| Брутто-формула | C28H36F6N6O6P2S2 | C13H16N2O3F3P2SCl | C21H16N2O3F3P2SCl |
| М | 792.69 | 434.73 | 530.81 |
| Температура, K | 200(2) | 100(2) | 100(2) |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. группа | C2/c | P21/c | P21/c |
| a, Å | 20.3575(7) | 12.1776(4) | 8.3692(5) |
| b, Å | 18.3048(6) | 14.9308(5) | 21.0036(11) |
| c, Å | 19.3626(7) | 9.5362(3) | 13.1038(7) |
| α, град | 90 | 90 | 90 |
| β, град | 104.411(1) | 92.860(1) | 105.481(6) |
| γ, град | 90 | 90 | 90 |
| V, Å–3 | 6988.2(4) | 1731.72(10) | 2219.9(2) |
| Z | 8 | 4 | 4 |
| ρ, мг м–3 | 1.507 | 1.667 | 1.588 |
| μ, мм–1 | 0.326 | 0.573 | 0.464 |
| F(000) | 3280 | 888 | 1080 |
| Размер кристалла, мм | 0.43 × 0.30 × 0.12 | 0.44 × 0.19 × 0.15 | 0.36 × 0.21 × 0.13 |
| Область сбора данных по θ, град | 2.17–26.73 | 2.54–30.12 | 3.19–30.00 |
| Интервалы индексов отражений | –25 ≤ h ≤ 25, –23 ≤ k ≤ 23, –24 ≤ l ≤ 24 | –17 ≤ h ≤ 17, –21 ≤ k ≤ 21, –13 ≤ l ≤ 13 | –11 ≤ h ≤ 10, –25 ≤ k ≤ 29, –18 ≤ l ≤ 17 |
| Измерено отражений | 53 162 | 39 494 | 12 888 |
| Независимых отражений | 7423 | 5080 | 6466 |
| Отражений с I > 2σ(I) | 6154 | 4240 | 4600 |
| Rint | 0.0281 | 0.0297 | 0.0419 |
| Число параметров уточнения | 520 | 234 | 298 |
| GOOF (F 2) | 1.005 | 1.037 | 1.017 |
| R1, wR2 (I > 2σ(I)) | 0.0396, 0.1124 | 0.0486, 0.1082 | 0.0536, 0.1204 |
| R1, wR2 (по F 2 для всех отражений) | 0.0506, 0.1211 | 0.0616, 0.1147 | 0.0860, 0.1313 |
| Остаточная электронная плотность (ρmin/ρmax), e Å–3 | 0.510/–0.378 | 0.968/–0.985 | 0.736/–0.538 |
Таблица 2.
Основные длины связей (Å) и валентные углы (град) в комплексах II, III и V
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| II | |||
| P(1)–N(1) | 1.703(2) | N(1)P(1)C(1) | 87.80(8) |
| P(1)–N(3) | 1.815(2) | N(1)P(1)N(3) | 105.03(7) |
| P(1)–C(1) | 1.800(2) | C(1)P(1)N(3) | 99.67(8) |
| C(1)–C(2) | 1.349(3) | ||
| N(1)–N(2) | 1.425(2) | P(1)N(1)N(2) | 115.35(11) |
| N(1)–C(8) | 1.382(2) | P(2)N(2)N(1) | 115.02(11) |
| N(2)–C(2) | 1.386(2) | ||
| С(7)–С(8) | 1.352(3) | N(2)P(2)C(7) | 88.10(8) |
| С(7)–P(2) | 1.791(2) | N(2)P(2)N(5) | 104.36(7) |
| N(2)–P(2) | 1.700(2) | C(7)P(2)N(5) | 100.78(8) |
| N(5)–P(2) | 1.813(2) | ||
| III | |||
| Cl(1)–P(1) | 2.080(1) | N(1)P(1)C(1) | 86.90(10) |
| P(1)–N(1) | 1.775(2) | N(1)P(1)Cl(1) | 97.33(7) |
| P(1)–C(1) | 1.811(2) | C(1)P(1)Cl(1) | 98.51(8) |
| P(2)–N(2) | 1.685(3) | ||
| P(2)–C(7) | 1.739(3) | N(2)P(2)C(7) | 89.28(10) |
| N(1)–C(8) | 1.351(3) | ||
| N(1)–N(2) | 1.363(3) | N(2)N(1)P(1) | 114.88(15) |
| N(2)–C(2) | 1.414(3) | N(1)N(2)P(2) | 114.50(15) |
| C(1)–C(2) | 1.342(3) | ||
| C(7)–C(8) | 1.392(3) | ||
| V | |||
| Cl(1)–P(1) | 2.096(1) | N(1)P(1)C(1) | 87.62(10) |
| P(1)–N(1) | 1.771(2) | N(1)P(1)Cl(1) | 101.24(7) |
| P(1)–C(1) | 1.798(2) | C(1)P(1)Cl(1) | 98.75(8) |
| P(2)–N(2) | 1.691(2) | ||
| P(2)–C(7) | 1.727(2) | N(2)P(2)C(7) | 89.47(10) |
| N(1)–C(8) | 1.352(3) | ||
| N(1)–N(2) | 1.385(3) | N(2)N(1)P(1) | 113.88(14) |
| N(2)–C(2) | 1.411(3) | N(1)N(2)P(2) | 115.05(14) |
| C(1)–C(2) | 1.347(3) | ||
| C(7)–C(8) | 1.397(3) | ||
Кристаллографическая информация для структур депонирована в Кембриджском банке структурных данных (CCDC № 2182881 (II), 2182882 (III) и 2182883 (V); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Дефицит электронной плотности в гетеропенталеновом каркасе можно создать, заменив ковалентно связанный атом галогена в дихлориде DDP трифлат-анионом, что реализуется действием триметилсилилтрифлата на соответствующий дихлорид диазадифосфапенталена.
Анализ реакционной смеси циклогексан-аннелированного 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталена (I) с TMSOTf (1 : 2) в хлористом метилене методом ЯМР 31P продемонстрировал отсутствие каких-либо сигналов при комнатной температуре. Между тем добавление к данной реакционной смеси 2 экв. DMAP привело к появлению синглета при 72.3 м.д. Удаление растворителя и летучих продуктов в вакууме дало высокий выход комплексной соли II (cхема 3), которую удалось охарактеризовать методом РСА.
Схема 3 .
Молекулярная и кристаллическая структуры дикатионной части комплекса II представлены на рис. 1, 2.
Рис. 1.
Молекулярная структура катионной части комплекса II с тепловыми эллипсоидами 30%-ной вероятности в двух проекциях. Атомы водорода опущены для ясности.

Рис. 2.
Суперпозиция двух стереоизомерных форм [DDP(DMAP)2]2+ комплекса II (а); фрагмент упаковки молекул [DDP(DMAP)2]2+ в кристалле II (б).

Асимметричная часть ячейки II содержит дикатион [DDP(DMAP)2]2+ (рис. 1) и два трифлат-аниона. В кристалле II дикатион [DDP(DMAP)2]2+ присутствует в двух энантиомерных формах, отличающихся расположением 4-диметиламинопиридиновых заместителей относительно плоскости DDP фрагмента (pис. 2а). Пятичленные гетероциклы имеют строение, близкое к планарному. Среднее отклонение атомов от плоскостей N(1)N(2)P(1)C(2)C(1) и N(2)N(1)P(2)C(8)C(7) не превышает 0.029 и 0.049 Å соответственно. Сумма валентных углов при атомах азота гетеропенталенового каркаса составляет 359.09° для N(1) и 358.41° для N(2). Молекулы DMAP координируются на атомах P(1) и P(2) с одной стороны DDP-каркаса, образуя углы 105.26° и 104.25° соответственно с плоскостями пятичленных гетероциклов. Значения длин координационных связей P(1)–N(3) 1.815(2) и P(2)–N(5) 1.813(2) Å близки к сумме ковалентных радиусов соответствующих элементов (1.82 Å) [16]. Примечательно то, что DMAP-лиганды являются плоскими, что свидетельствует о sp2-гибридизации атомов азота групп Me2N и о значительном переносе положительного заряда с атомов фосфора на эти фрагменты. Интересно также, что молекулы DMAP расположены во взаимно параллельных плоскостях.
Анализ кристаллической упаковки II показывает, что каждый стереоизомер [DDP(DMAP)2]2+ укладывается в одномерные цепочки вдоль оси с (pис. 2б). Цепочки изомеров чередуются вдоль оси а. Отметим, что в цепочках вдоль оси с молекулы [DDP(DMAP)2]2+ выстраиваются попарно, ориентируясь друг к другу гетеропенталеновыми основаниями на расстоянии около 3.5 Å.
4-Диметиламинопиридин известен своими донорными свойствами, что используется, в частности, и для стабилизации фосфор-центрированных катионов, например [(DMAP)PPh2]+ [17], [(DMAP)-(PBut)3-Me]+ [18], [P3N3(DMAP)6]6+ [19].
Кристаллы комплекса II бесцветны, однако растворы имеют все признаки сольватохромии. В хлористом метилене вместе с интенсивной полосой 280 нм, принадлежащей комплексу, появляется полоса 439 нм (рис. 3). Эта полоса может принадлежать свободному диазадифосфапенталену (438 нм/TГФ [5]), образовавшемуся в растворе при равновесном диспропорционировании II (схема 4 ).
Схема 4 .
Свободный 4-диметиламинопиридин имеет в электронном спектре поглощения интенсивную полоcу при 258 нм (CH2Cl2) [20]; в растворе II данная полоса не наблюдается.
Подобные процессы диспропорционирования мы наблюдали в растворах дихлоридов DDP в донорных растворителях [21]. Изучение растворов II методом циклической вольтамперометрии показало наличие потенциалов пиков окисления 0.32, 0.50 В, что подтверждает присутствие в растворе молекул DDP, способных легко окисляться (рис. 4). Значение потенциалов первого и второго пиков окисления свободного циклогексан-аннелированного DDP составляет 0.15 и 0.39 В в хлористом метилене [4]. 4-Диметиламинопиридин в тех же условиях окисляется при более высоком потенциале (1.36 В, рис. 5а). Восстановление трифлата диметил(1H-пиридин-4-илиден)аммония происходит при достаточно высоком потенциале –1.9 В (рис. 5б).
Рис. 5.
ЦВА 4-диметиламинопиридина (a) и трифлата диметил(1H-пиридин-4-илиден)аммония (б) в CH2-Cl2/Bu4NPF6 (0.1 M), скорость сканирования 100 мВ/с, отн. Ag/AgCl.-

Важно заметить, что разбавленные растворы соединения II в эфирных растворителях (TГФ) неустойчивы, очевидно, из-за конкурирующего процесса замещения лиганда DMAP молекулами растворителя с последующими превращениями продуктов замещения. Так, при разбавлении растворов II в TГФ до концентрации ~1 мг/мл происходит разрушение комплекса с количественным образованием трифлата диметил(1H-пиридин-4-илиден)аммония [(Me2NC6H4NH)+(CF3SO3)−] и смолообразного неидентифицированного продукта. Растворение комплекса II в дейтерированном тетрагидрофуране привело к образованию кристаллического осадка, который также оказался трифлатом диметил(1H-пиридин-4-илиден)аммония (но не трифлатом диметил(1D-пиридин-4-илиден)аммония судя по ИК-спектру), что свидетельствует о том, что источником протона являются циклогексильные фрагменты комплекса (схема 5 ). Молекулярная структура трифлата диметил(1H-пиридин-4-илиден)аммония была изучена методом РСА и полностью соответствовала изученной ранее [22].
Схема 5 .
Отметим, что использование незамещенного пиридина вместо DMAP в реакции с TMSOTf не дает устойчивого комплекса.
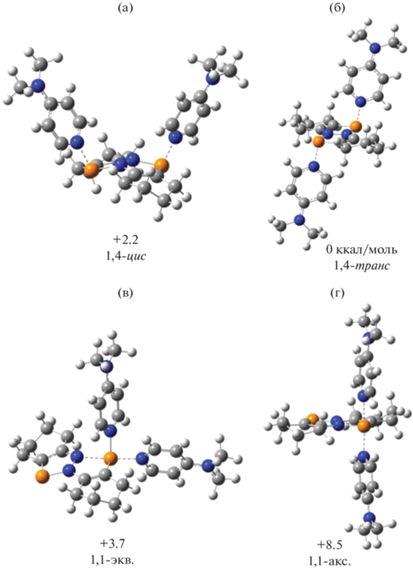
Спектры ЯМР 31P комплекса II при комнатной температуре в CD2Cl2, CDCl3 представлены широкими синглетами, что предполагает динамическое поведение в растворе. Мы провели оптимизацию геометрии методом DFT/B3LYP в базисе 6-31G(d) возможных изомерных дикатионов, содержащих лиганды DMAP в различных положениях (рис. 6). 1,4-Цис- (a) и 1,4-транс (б) изомеры имеют достаточно близкие значения общих энергий, различающиеся на 2.2 ккал/моль. Однако наиболее устойчивый 1,4-изомер (б) в кристаллическом состоянии экспериментально не наблюдается, очевидно, вследствие менее выгодной упаковки по сравнению с 1,4-цис-изомером. 1,1-Изомеры (в, г) имеют более высокие значения общей энергии.
Рис. 6.
DFT/B3LYP/6-31G(d)-оптимизированные структуры изомерных дикатионов [DDP(DMAP)2]2+ и их относительные общие энергии (ккал/моль).
Детальное изучение системы дихлорид DDP–TMSOTf показало, что при их соотношении 1 : 1 образуются индивидуальные соединения, представляющие собой продукты замещения одного атома хлора на трифлатную группу. Такие реакции мы наблюдали с дихлоридами диазадифосфапенталенов I и IV (схема 6 ).
Схема 6 .
Монокристаллы соединений III и V были получены перекристаллизацией из толуола и хлористого метилена соответственно. Молекулярные структуры катионных частей комплексов III и V изображены на рис. 7а, 7б.
Рис. 7.
Молекулярные структуры катионных фрагментов комплексов III (а) и V (б) с тепловыми эллипсоидами 30%-ной вероятности (атомы водорода не представлены для ясности); суперпозиция двух стереоизомерных форм [ClD-DP]+ комплексов III (в) и V (г).

Согласно данным РСА, комплексы III и V состоят из разделенных ионов [ClDDP]+ и [TfO]−. В кристаллах III и V (как и в II) содержатся пары геометрических изомеров [ClDDP]+ (рис. 7в, 7г). Несмотря на близость структурных параметров, строение DDP-каркасов в комплексах III и V различаются (рис. 7а, 7б). Геометрия DDP-каркаса III близка к планарной со средним отклонением атомов от плоскости в 0.02 Å. В то же время молекула V имеет изгиб по связи N−N, что заметно из значений торсионных углов P(1)N(1)N(2)P(2) 157.5(1)°, C(2)N(2)N(1)C(8) 165.1(2)° (для III аналогичные величины близки к 180° и составляют 176.1(1)° и 175.7(2)°).
Пятичленные гетероциклы, содержащие двух- и трехкоординированные атомы фосфора, различаются по структурным параметрам. Длины связей в пятичленных гетероциклах, включающих двухкоординированый атом фосфора, соответствуют таковым в ароматических диазафосфолах [23]. В частности, кратные (полуторные) связи углерод−углерод C(7)−C(8) 1.397(3) Å (V) и 1.392(3) Å (III) заметно длиннее таковых в соседних циклах C(1)−C(2) 1.347(3) Å (V) и 1.342(3) (III), типичных для алкенов. Связи P(1)−Cl(1) 2.080(1) Å (III) и 2.096(1) Å (V) несколько укорочены по сравнению с исходным дихлоридом I (2.1762(6)), что соответствуют сумме ковалентных радиусов элементов P и Cl (2.10 Å) [16].
В кристалле III трифлат-анионы образуют короткие контакты P···O с двухкоординированным (P(2)···O(1) 2.881(2) Å) и трехкоординированным (P(1)···O(2) 2.874(2) Å) атомами фосфора, образуя цепочки комплексов вдоль оси а (рис. 8а). Аналогичные контакты P···O в кристалле V с расстояниями 2.886(2) Å (P(1)···O(1)) и 2.958(2) Å (P(2)···O(2)) приводят к образованию димерных мотивов комплекса V (pис. 8б).
Интересно, что в кристаллической структуре комплекса II контакты P···O отсутствуют вовсе, что, очевидно, связано со значительным перемещением положительного заряда к атомам азота групп Me2N. С другой стороны, в структуре II имеются укороченные контакты O···H с участием атомов водорода пиридильного фрагмента (~2.2 Å).
Поведение соединения III в растворе изучено методами ЯМР, циклической вольтамперометрии (ЦВА) и электронной спектроскопии поглощения (ЭСП). При комнатной температуре спектр ЯМР 31P в хлороформе представляет собой два очень широких синглета при 230.1 и 100.5 м.д., которые при понижении температуры до 223 K переходят в два дублета (228.4 и 98.3 м.д.) с константой спин-спинового взаимодействия 3JP,P = = 20 Гц. В хлористом метилене, толуоле и ТГФ сигнал 31P в спектре ЯМР при 295 K не проявляется, что мы связываем с ассоциативным динамическим поведением соединения III в растворе. В ЭСП (рис. 9) наблюдаются полосы поглощения при 357, 291 нм, в диапазоне, характерном для дихлоридов диазадифосфапенталенов [21].
В сравнении со стабилизированным дикатионом II соединение III заметно легче как восстанавливается, так и окисляется. Пик восстановления наблюдается при 0.16 В (отн. Ag/AgCl, рис. 10). Пиковые потенциалы окисления III составляют 1.53 и 1.84 В, в то время как соединение II в условиях эксперимента в хлористом метилене (рис. 4) не окисляется.
Известно, что борсодержащие кислоты Льюиса, в частности BCl3, способны активно присоединять галогенид-анионы с образованием устойчивых комплексных анионов. Нами было изучено взаимодействие дихлорида DDP (I) с трихлоридом бора, которое показало, что смесь этих реагентов является равновесной и не приводит к индивидуальным соединениям. Тем не менее стоит упомянуть о спектрах ЯМР 31P, в которых наблюдаются интересные закономерности. Сигнал ЯМР 31P исходного дихлорида I (106.0 м.д., синглет) смещается в область слабого поля (155.5 м.д.) при добавлении 2 экв. BCl3 в толуоле. Кроме того, при охлаждении образца от 293 до 233 K происходит существенное уширение сигнала и снижение его интенсивности. Это говорит о том, что точка коалесценции находится ниже температуры эксперимента (233 K). Замена растворителя (толуола) на донорный тетрагидрофуран приводит к исходному дихлориду I и BCl3 · THF.
Таким образом, в результате проведенной работы было показано, что в 1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталенах в отсутствие координирующих агентов можно заместить лишь один атом хлора на трифлат-анион с образованием DDP катионного типа [ClDDP]+[TfO]−. Замещение двух атомов хлора на трифлат-анионы возможно лишь в условиях стабилизации дикатиона DDP донорными молекулами, в частности, 4-диметиламинопиридином с образованием комплексной соли [DDP(DMAP)2]2+- [(CF3SO3)−]2 (II). В разбавленных растворах соединение II распадается с образованием трифлата диметил(1H-пиридин-4-илиден)аммония и неидентифицированных фосфорсодержащих продуктов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Kornev A.N., Panova Y.S., Sushev V.V. et al. // Inorg. Chem. 2019. V. 58. P. 16144.
Kornev A.N., Panova Y.S., Sushev V.V. // Phosphorus, Sulfur, Silicon, Relat. Elem. 2020. V. 195. P. 905.
Корнев А.Н., Панова Ю.С., Сущев В.В. и др. // Коорд. химия. 2020. Т. 46. № 2. С. 91 (Kornev A.N., Panova Y.S., Sushev V.V. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 2. P. 98). https://link.springer.com/article/10.1134/ S1070328420020050.
Panova Yu., Khristolyubova A., Zolotareva N. et al. // Dalton Trans. 2021. V. 50. P. 5890.
Kornev A.N., Sushev V.V., Panova Yu.S. et al. // Inorg. Chem. 2014. V. 53. P. 3243.
Kornev A.N., Gorak O.Y., Lukoyanova O.V. et al. // Z. Anorg. Allg. Chem. 2012. V. 638. № 7–8. P. 1173.
APEX3. Bruker Molecular Analysis Research Too. Version 2016.9. Madison (WI, USA): Bruker AXS Inc., 2016.
Data Collection, Reduction and Correction Program. CrysAlisPro 1.171.38.46. Software Package, Rigaku OD, 2015.
SAINT Data Reduction and Correction Program. Version 8.37A. Madison (WI, USA): Bruker AXS Inc., 2012.
Krause L., Herbst-Irmer R., Sheldrick G. M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Bruker AXS, 2003.
Sheldrick G.M. SADABS. Version 2016/2. Bruker/Siemens Area Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS Inc., 2016.
SCALE3 ABSPACK: Empirical Absorption orrection. CrysAlisPro 1.171.38.46. Software Package, Rigaku OD, 2015.
Pyykkö P., Atsumi, M. // Chem. Eur. J. 2009. V. 15. № 1. P. 186.
Burford N., Losier P., Phillips A.D. et al. // Inorg. Chem. 2003. V. 42. P. 1087.
Robertson A.P.M., Dyker C.A., Gray P.A. et al. // J. Am. Chem. Soc. 2014. V. 136. P. 14941.
Boomishankar R., Ledger J., Guilbaud J.-B. et al. // Chem. Commun. 2007. P. 5152.
Huang C.H., Wen M., Wang C.Y. et al. // Dalton Trans. 2017. V. 4. № 5. P. 1413.
Панова Ю.С., Христолюбова А.В., Сущев В.В. и др. // Изв. АН. Сер. хим. 2021. Т. 10. С. 1973 (Panova Yu.S., Khristolyubova A.V., Sushev V.V. et al. // Russ. Chem. Bull., Int. Ed. 2021. V. 70. № 10. P. 1973). https:// link.springer.com/article/10.1007/s11172-021-3305-1.
Bock H., Nather C., John A. et al. // CSD Communication (Private Communication), 2007. CCDC 228884.
Nyulaszi L., Veszpremi T., Reffy J. et al. // J. Am. Chem. Soc. 1992. V. 114. № 23. P. 9080.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия













