Координационная химия, 2023, T. 49, № 4, стр. 205-216
Получение водорастворимых комплексов цинка(II) с этилендиаминтетрауксусной кислотой. Молекулярная структура тригидрата этилендиаминтетраацетата цинка
В. В. Семенов 1, *, Н. В. Золотарева 1, О. В. Новикова 1, Б. И. Петров 1, Н. М. Лазарев 1, Р. В. Румянцев 1, М. А. Лопатин 1, Т. И. Лопатина 1, Т. А. Ковылина 1, Е. Н. Разов 2, 3
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
3 Институт проблем машиностроения РАН – филиал Федерального исследовательского центра
“Институт прикладной физики РАН”
Нижний Новгород, Россия
* E-mail: vvsemenov@iomc.ras.ru
Поступила в редакцию 28.06.2022
После доработки 16.10.2022
Принята к публикации 02.11.2022
- EDN: CULYTK
- DOI: 10.31857/S0132344X22600436
Аннотация
Малорастворимый этилендиаминтетраацетатоцинкат цинка Zn[ZnL] реагирует с натриевой Na4L, калиевой K4L, аммониевой (NH4)4L, 2-аминийэтанольной (H3NCH2CH2OH)4L и гексаметилен-1,6-диаминиевой {H3N(CH2)6NH3}2L солями этилендиаминтетрауксусной кислоты H4L, образуя хорошо растворимые этилендиаминтетраацетатоцинкаты натрия Na2[ZnL], калия K2[ZnL], аммония (NH4)2[ZnL], 2-аминийэтанола (H3NCH2CH2OH)2[ZnL] и гексаметилен-1,6-диаминия {H3N(CH2)6NH3}[ZnL]. Тетракис(триэтиламиниевая) соль {(C2H5)3NH}4L в реакции с Zn[ZnL] образует не ожидаемый этилендиаминтетраацетатоцинкат бис(триэтиламиния) {(C2H5)3NH}2[ZnL], а этилендиаминтетраацетатоцинкат моно(триэтиламиния) – {(C2H5)3NH}H[ZnL], который в водном растворе генерирует малорастворимый этилендиаминтетраацетат цинка H2[ZnL(H2O)] · 2H2O, структура которого исследована методом РСА (CCDC № 2172274).
Координационные соединения цинка, полученные на основе промышленных комплексонов с карбоксильными и фосфоновыми группами, используются [1] в медицине, сельском хозяйстве, машиностроении. Для практических приложений чаще всего необходимы водные растворы. В то же время многие из известных соединений имеют плохую растворимость. Хорошо растворяются производные щелочных металлов. Комплексы 3d-металлов с фосфоновыми лигандами обычно растворяются лучше, чем с карбоксильными. Высокая дентатность лиганда способствует повышению растворимости. Предложенные так называемые промоторы растворимости [2] представляют собой амины с гидроксильными или олигоэтиленоксидными фрагментами. Наиболее доступными из них являются производимые химическими предприятиями хорошо растворимые в водной среде моно-, ди- и триэтаноламины. Присоединяясь к молекуле комплексоната, они легко переводят его в водную фазу. Присоединение может происходить не только к катиону металла, но также к оставшимся свободными кислотным группам.
В [3] показана возможность переведения комплексоната в водную фазу обработкой аминами, неимеющими гидрофильных группировок (триэтиламин, трибутиламин, трет-бутиламин). Их действие объясняется деструкцией координационного полимера. В настоящей работе исследованы реакции оксида цинка с этилендиаминтетрауксусной кислотой (ЭДТА, H4L) и последующие превращения полученных продуктов. В кристаллическом состоянии и в растворе ЭДТА имеет бетаиновое строение [1].
Комплексобразование цинка с ЭДТА изучалось спектрофотометрическим [4], полярографическим [5] методами и дифференциальной импульсной вольтамперометрией [6]. Методом радиоизотопного обмена была измерена кинетика замещение катиона цинка(II) в его комплексе с ЭДТА [7]. Проведены испытания возможности применения этилендиаминтетраацетата цинка в качестве пищевой добавки в корм животных [8]. На примере ячменя, картофеля, горчицы и люпина изучены [9, 10] поглощение и перенос цинка корневыми побегами растений из почвы, загрязненной цинком при возрастающих концентрациях ЭДТА в почве.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали динатриевую соль ЭД-ТА (Трилон-Б) квалификации “ч.” (АО “Химреактив”, Н. Новгород); 2-аминоэтанол квалификации “ч.” (ООО “Синтез ОКА”, г. Дзержинск); ЭДТА получали обработкой динатриевой соли соляной кислотой.
Синтез этилендиаминтетраацетатоцинкат цинка(II) дигидрата Zn[ZnL] · 2Н2О (I). Смешивали и растирали в ступке 5.00 г (1.72 × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 50 мл Н2О при перемешивании. Через 15 мин суспензия растворялась. Смесь упаривали, остаток сушили при 110°С, смешивали с 200 мл Н2О, нагревали до кипения и фильтровали в горячем виде. Осадок на фильтре сушили при 110°С. Выход I 5.15 г в виде белой массы, легко размалывающейся до белого порошка.
ИК-спектр (ν, см–1): 3300, 3026, 1694, 1611, 1584, 1450, 1420, 1402, 1388, 1331, 1310, 1286, 1262, 1239, 1125, 1107, 1006, 981, 970, 935, 920, 866, 815, 771, 726, 661, 619, 586, 562, 532, 503, 470.
Фильтрат упаривали, остаток сушили при 110°С. Дополнительный выход I 1.80 г, всего 6.95 г (1.51 × 10–2 моль, 88%). Растворимость 0.98 г в 100 мл Н2О при 80°С.
Синтез Na2[ZnL] (II). Смешивали и растирали в ступке 5.00 г (1.72 × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 50 мл Н2О при перемешивании. Через 20 мин суспензия растворилась. К реакционной смеси присыпали мелкими порциями 6.40 г (1.72 × 10–2 моль) соль Na2H2L и затем прибавляли по каплям 1.40 г (3.44 × 10–2 моль) NaOH в 10 мл Н2О. Прозрачный бесцветный раствор (рН 6) упаривали, остаток сушили при 110°С. Выход II 13.50 г (3.38 × 10–2 моль, 98%) в виде белого мягкого порошка.
ИК-спектр (ν, см–1): 3583, 3446, 3363, 3285, 1614, 1590, 1459, 1435, 1393, 1322, 1292, 1247, 1173, 1110, 1006, 979, 964, 860, 842, 804, 762, 720, 658, 640, 583, 538, 515, 467.
| Найдено, %: | C 30.55; | H 3.56; | N 7.14. |
| Для C10H12N2O8Na2Zn (II) | |||
| вычислено, %: | C 30.06; | H 3.03; | N 7.01. |
Синтез K2[ZnL] · H2O (III). Смешивали и растирали в ступке 5.00 г (1.72 × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 50 мл Н2О при перемешивании. Через 20 мин к реакционной смеси приливали 30 мл раствора соли K4L, полученной из 5.00 г (1.72 × 10–2 моль) ЭДТА и 3.86 г (6.88 × 10–2 моль) КОН. Через 12 ч из прозрачной смеси выпадал осадок. Смесь упаривали, остаток сушили при 110°С. Выход 13.00 г (3.01 × 10–2 моль, 88%) III в виде белой прочной твердой массы, размалывающейся до белого порошка. Из пересыщенного водного раствора выпадали очень мелкие кристаллы в форме коротких палочек.
ИК-спектр (ν, см–1): 3607 пл, 3402 ш, 1718 пл, 1614, 1593, 1447, 1402, 1325, 1307, 1280, 1268, 1110, 1003, 979, 932, 854, 717, 640, 595, 532, 506, 461.
| Найдено, %: | C 26.77; | H 3.45; | N 6.48. |
| Для C10H14N2O9K2Zn (III) | |||
| вычислено, %: | C 26.70; | H 3.14; | N 6.23. |
Синтез (NH4)2[ZnL] · H2O (IV). Смешивали и растирали в ступке 5.00 г (1.72 × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 50 мл Н2О при перемешивании. Через 20 мин к реакционной смеси приливали 20 мл раствора соли (NH4)4L, полученной из 5.00 г (1.72 × 10–2 моль) ЭДТА и 6.63 мл раствора NH4ОН 10.37 моль л–1 (6.88 × 10–2 моль). Через 12 ч смесь фильтровали, фильтрат упаривали, остаток сушили при 110°С. Выход 11.80 г (3.03 × × 10–2 моль, 95%) IV в виде мягкого белого порошка. Из пересыщенного водного раствора выпадали мелкие кристаллы в форме иголок.
ИК-спектр (ν, см–1): 3440, 3214, 1709, 1590, 1459, 1444, 1396, 1331, 1319, 1310, 1268, 1247, 1221, 1173, 1110, 1006, 976, 935, 917, 854, 810, 768, 723, 646, 610, 589, 538, 506, 461.
Реакция Zn[ZnL] · 2Н2О с 2-аминоэтанолом. К суспензии 4.60 г (1.00 × 10–2 моль) Zn[ZnL] · 2Н2О в 30 мл Н2О прибавляли по каплям 1.22 г (2.00 × × 10–2 моль) H2NCH2CH2OH в 10 мл Н2О. Смесь кипятили при перемешивании 1 ч, охлаждали, фильтровали, осадок промывали метанолом, сушили при 110°С. Получили 1.30 г твердой массы, размалывающейся до белого порошка. Фильтрат упаривали, остаток сушили при 110°С. Выход 3.80 г (7.95 × 10–3 моль, 79%) (H3NCH2CH2OH)2[ZnL] (V) в виде белой пены, размалывающейся до белого порошка.
ИК-спектр (ν, см–1): 3500–2200 ш., 1727, 1599, 1459, 1393, 1379, 1319, 1274, 1221, 1113, 1066, 1015, 1006, 970, 920, 860, 723, 649, 595, 515, 467.
Синтез этилендиаминтетраацетатоцинката 2-аминийэтанола (H3NCH2CH2OH)2[ZnL] (V). Смешивали и растирали в ступке 5.00 г (1.72 × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 30 мл Н2О при перемешивании. Через 20 мин к реакционной смеси приливали 20 мл раствора соли (NH3CH2CH2OH)4L, полученной из 5.00 г (1.72 × 10–2 моль) ЭДТА и 4.20 г (6.88 × 10–2 моль) 2-аминоэтанола. Смесь фильтровали, фильтрат упаривали, остаток сушили при 110°С. Выделили 16.60 г светло-желтой массы в виде парафина, плавящегося при нагревании до 100°С. После нагревания в вакууме до 175°С выход V в виде рыхлой пены, размалывающейся до белого порошка, составил 13.00 г (2.72 × × 10–2 моль, 79%). Соединение умеренно растворяется в метаноле и образует на стекле прозрачную бесцветную пленку, не растворяется в диоксане, ацетоне и ацетонитриле, не подвергается пере-осаждению из водного раствора при добавлении вышеуказанных органических растворителей.
ИК-спектр (ν, см–1): 3279, 3086, 1733, 1587, 1459, 1390, 1379, 1322, 1310, 1274, 1221, 1176, 1116, 1069, 1015, 1003, 973, 923, 860, 810, 723, 649, 592, 518, 467.
Синтез этилендиаминтетраацетатоцинката гексаметилен-1,6-диаминия {H3N(CH2)6NH3}[ZnL] (VI). Смешивали и растирали в ступке 5.24 г (1.81 × × 10–2 моль) ЭДТА и 2.94 г (3.61 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 30 мл Н2О при перемешивании. Через 20 мин к реакционной смеси приливали раствор соли {H3N(CH2)6NH3}2L, полученной из 5.24 г (1.81 × × 10–2 моль) ЭДТА и 4.20 г (3.61 × 10–2 моль) гексаметилен-1,6-диамина в 20 мл Н2О. Смесь фильтровали, фильтрат упаривали, остаток сушили при 110°С. Получили 16.90 г твердой массы, размягчающейся при нагревании до 100°С. После нагревания в вакууме до 165°С выход VI 14.15 г (3.00 × 102 моль, 83%) в виде светло-желтых крупных кусков, легко размалывающихся до кремового порошка.
ИК-спектр (ν, см–1): 3443, 3133, 3000–2200 ш., 2091, 1602, 1483, 1462, 1390, 1379, 1325, 1271, 1173, 1110, 1000, 964, 917, 863, 839, 723, 658, 625, 589, 550, 509, 461.
Соединение растворяется в метаноле, этиленгликоле, плохо растворяется в ацетонитриле и ДМСО, не растворяется в ацетоне. Из раствора в метаноле образует на стекле прозрачную пленку.
Синтез этилендиаминтетраацетатоцинката триэтиламиния гидрата {(C2H5)3NH}H[ZnL] · H2O (VII). Смешивали и растирали в ступке 5.00 г (1.72 × × 10–2 моль) ЭДТА и 2.80 г (3.45 × 10–2 моль) ZnO. Полученный белый порошок присыпали к 30 мл Н2О при перемешивании. Через 20 мин к реакционной смеси приливали раствор соли {(C2H5)3NH}4L, полученной из 5.00 г (1.72 × 10–2 моль) ЭДТА и 6.96 г (6.88 × 10–2 моль) триэтиламина в 20 мл Н2О. Смесь фильтровали, фильтрат упаривали, остаток сушили при 110°С. Получили 14.90 г твердой белой массы, с трудом размалывающейся до белого порошка. После нагревания порошка в вакууме до 150°С выход VII 14.30 г (2.56 × 10–2 моль, 74%).
ИК-спектр (ν, см–1): 3583, 3476, 3378, 3294, 3011 пл., 2684, 2636, 2576, 2499, 1715, 1656, 1620, 1587, 1447, 1429, 1405, 1376, 1346, 1319, 1301, 1262, 1206, 1170, 1113, 1066, 1033, 1006, 982, 932, 917, 884, 857, 845, 810, 765, 723, 646, 589, 556, 526, 464.
Синтез этилендиаминтетраацетат цинка тригидрата H2[ZnL(H2O)] · 2H2O (VIII). Насыщали 10 мл Н2О соединением {(C2H5)3NH}H[ZnL] · H2O (растворилось 10.40 г (2.19 × 10–2 моль) при перемешивании без нагревания. Через 2 сут из раствора выпадали крупные кристаллы кубической формы. Кристаллы отфильтровывали, промывали метанолом, ацетоном, сушили на воздухе. Выход VIII 1.80 г (4.23 × 10–3 моль, 19%).
ИК-спектр (ν, см–1): 3372, 3214, 2657, 2526, 2231, 1927, 1712, 1605, 1465, 1390, 1367, 1331, 1313, 1292, 1253, 1116, 1003, 970, 932, 914, 860, 726, 681, 646, 604, 562, 506, 455.
| Найдено, %: | C 28.94; | H 5.09; | N 6.86. |
| Для C10H20N2O11Zn (VIII) | |||
| вычислено, %: | C 29.32; | H 4.92; | N 6.84. |
Синтез KH[ZnL] (IX). К 7 мл дистиллированной воды добавили 2.60 г (5.78 × 10–2 моль) K2[ZnL], размешивали, добавляли 7 капель 8 N H2SO4. От выпавшего обильного осадка смесь загустевала. Осадок отильтровывали, промывали водой, сушили при 110°С. Выход IX 0.85 г (2.16 × × 10–2 моль, 37%) в виде белого порошка.
ИК-спектр (ν, см–1): 2705, 2576, 2492, 1911, 1724, 1691, 1593, 1462, 1441, 1429, 1396, 1322, 1304, 1253, 1197, 1176, 1113, 1009, 970, 929, 908, 881, 860, 812, 759, 723, 696, 634, 598, 577, 503, 467.
ИК-спектры соединений в виде суспензии в вазелиновом (область 1400–400 см–1) и фторированном (4000–1400 см–1) маслах между пластинами KBr регистрировали на ИК Фурье-спектрометре ФСМ 1201. Элементный анализ выполняли на автоматическом элементном анализаторе Vario EL cube (Elementar Analysensysteme GmbH) в конфигурации CHNS, газ-носитель – гелий марки 6.0. Электронные спектры поглощения (ЭСП) водных растворов измеряли нa спектрофотометре Perkin-Elmer Lambda 25. Оптическая микроскопия выполнена на микроскопе Микромед 3 производства “Нингбо Шепт Хенг Оптикс энд Электроникс Ко., ЛТД” с цифровой камерой ToupCam14MP, КНР; ООО “Наблюдательные приборы”, С.-Петербург. Рентгенофазовый анализ (РФА) выполняли на рентгеновском дифрактометре Shimadzu XRD-7000, термогравиметрический анализ (ТГА) – на приборе синхронного термического анализа TGA/DSC 3+ METTLER TOLEDO (скорость нагрева 5 град/мин, скорость подачи аргона 20 мл/мин). Измерения проводили в температурном интервале от 25 до 500°С.
Для регистрации масс-спектров соединений использовали хромато-масс-спектрометр Trace GC Ultra/Polaris Q (Thermo Electron Corporation, США), оснащeнный системой прямого ввода, масс-анализатор – ионная ловушка. Исследуемое вещество в количестве, достаточном для создания ионного тока, превышающего фоновый в 100 раз, втирали во внутреннюю поверхность стандартного стеклянного тигля системы прямого ввода. После предварительного вакуумирования тигель с веществом с помощью штока помещали в непосредственной близости от источника ионизации. Масс-спектры в режиме положительных ионов регистрировали при энергии ионизирующих электронов 70 эВ в диапазоне массовых чисел 50–700. Температуру образца изменяли по следующей программе: мгновенный нагрев до 50°С, изотерма в течение 1 мин, нагрев со скоростью 100°С мин–1 до 450°С. Температура ионного источника составляла 230°С.
Сканирующую электронную микроскопию (СЭМ) выполняли на сканирующем электронном микроскопе Tescan VEGA II. Микрорельеф исследовали при увеличениях от 500× до 50 000×. Съемку проводили при ускоряющем напряжении 20 кВ и рабочем расстоянии 2–8 мм, использовали детекторы вторичных электронов (SE) и обратно рассеянных электронов (BSE).
РСА соединения VIII проведен на дифрактометре Oxford Xcalibur Eos (графитовый монохроматор, МоKα-излучение, ω-сканирование, λ = 0.71073 Å) при 298(2) К. Экспериментальные наборы интенсивностей интегрированы с помощью программы CrysAlisPro [11]. Поправки на поглощение введены с использованием алгоритма масштабирования SCALE3 ABSPACK, реализованного в программе CrysAlisPro. Структура решена с использованием программы SHELXT [12] и уточнена полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для всех неводородных атомов с помощью программы SHELXL [13]. Атомы водорода H(1)–H(4) локализованы объективно из разностного Фурье-синтеза и уточнены в изотропном приближении. Остальные атомы водорода помещены в геометрически рассчитанные положения и уточнены в изотропном приближении с использованием модели “наездника” (Uизо(H) = 1.2 Uэкв(C)). Основные кристаллографические характеристики комплекса VIII приведены в табл. 1.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры VIII
| Параметр | Значение |
|---|---|
| Брутто-формула | C10H20N2O11Zn |
| М | 409.65 |
| Пр. группа | С2/c |
| a, Å | 10.97710(9) |
| b, Å | 9.75975(7) |
| c, Å | 14.56413(13) |
| β, град | 95.5401(8) |
| V, Å3 | 1553.02(2) |
| Z | 4 |
| ρ(выч.), г/см3 | 1.752 |
| μ, см–1 | 1.644 |
| Т, K | 298 |
| Размеры кристалла, мм | 0.55 × 0.45 × 0.35 |
| F(000) | 848 |
| Пределы h, k, l | –15 ≤ h ≤ 15, –13 ≤ k ≤ 13, –20 ≤ l ≤ 20 |
| (sin θ/λ)max | 0.704 |
| Число отражений измеренных/независимых | 45 657/2283 |
| Rint | 0.0199 |
| Число параметров | 127 |
| S | 1.058 |
| R1/wR2 (все отражения) | 0.0198/0.0572 |
| R1/wR2 (I > 2σ(I)) | 0.0204/0.0576 |
| Коэффициент экстинкции | 0.0087(5) |
| Δρmin/Δρmax, е/Å3 | 0.517/–0.364 |
Полный набор рентгеноструктурных параметров cтруктуры H2[ZnL(H2O)] · 2H2O депонирован в Кембриджском банке структурных данных (CCDC № 2172274; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Этилендиаминтетраацетаты двухвалентных металлов M[МL] ∙ nH2O, M = Mn2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Pb2+) получают взаимодействием суспензий их оксидов и карбонатов с ЭДТА, или водорастворимых солей металлов с натриевыми производными ЭДТА [4]. Соединения отличаются малой растворимостью в водной среде. Для марганца она составляет 0.13 моль/л, а для цинка 0.039 моль/л. Производное цинка I взаимодействует с солью Na4L, образуя растворимый этилендиаминтетраацетатоцинкат натрия II [14]:
(1)
$\begin{gathered} {\text{Zn}}\left[ {{\text{ZnL}}} \right] + {\text{N}}{{{\text{a}}}_{{\text{4}}}}{\text{L}} = 2{\text{N}}{{{\text{a}}}_{2}}\left[ {{\text{ZnL}}} \right] \hfill \\ \,\,\,\,\,\,({\text{I}})\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{II}}) \hfill \\ \end{gathered} $Синтез соединения I из оксида цинка и ЭДТА протекает в две стадии. На первой получается хорошо растворимый мономерный (или олигомерный) продукт, который через 10–12 ч выпадает из раствора в виде крупных кристаллов. Хранение раствора или его упаривание и сушка остатка вызывают полимеризацию мономера и приводят к получению малорастворимого соединения. Реакция (1) реализуется не только для натриевой, но также для калиевой, аммониевой, моноэтаноламиниевой и гексаметилен-1,6-диаминиевой солей ЭДТА. Все эти производные K2[ZnL] (III), (NH4)2[ZnL] (IV), (H3NCH2CH2OH)2[ZnL] (V), {H3N(CH2)6NH3}[ZnL] (VI) имеют высокую растворимость в водной среде.
(2)
$\begin{gathered} {\text{Zn}}\left[ {{\text{ZnL}}} \right] + {{\left( {{{{\text{H}}}_{{\text{3}}}}{\text{NC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}} \right)}_{4}}{\text{L}} = 2{{\left( {{{{\text{H}}}_{{\text{3}}}}{\text{NC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}} \right)}_{2}}\left[ {{\text{ZnL}}} \right] \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{I}})\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{V}}) \hfill \\ \end{gathered} $(3)
$\begin{gathered} {\text{Zn[ZnL]}} + {{{\text{\{ }}{{{\text{H}}}_{{\text{3}}}}{\text{N(C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{6}}}}{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\text{\} }}}_{{\text{2}}}}{\text{L}} = 2{\text{\{ }}{{{\text{H}}}_{{\text{3}}}}{\text{N(C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{6}}}}{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\text{\} [ZnL}}] \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{I}})\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{VI}}) \hfill \\ \end{gathered} $Иначе ведет себя тетракис(триэтиламиниевая) соль ЭДТА. В реакции с Zn[ZnL] образуется не ожидаемый этилендиаминтетраацетатоцинкат бис(триэтиламиния) {(C2H5)3NH}2[ZnL], а этилендиаминтетраацетатоцинкат моно(триэтиламиния).
(4)
$\begin{gathered} {\text{Zn[ZnL}}] + {{{\text{\{ (}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{)}}}_{{\text{3}}}}{\text{NH\} }}}_{{\text{4}}}}{\text{L}} = \\ = 2{\text{\{ (}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{)}}}_{{\text{3}}}}{\text{NH\} H[ZnL}}] + 2{{{\text{(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{)}}}_{{\text{3}}}}{\text{N}}. \\ \end{gathered} $После сушки при 110°С соединение удерживает в своем составе одну молекулу воды и представляет собой моногидрат {(C2H5)3NH}H[ZnL] · · H2O (VII). Его ИК-спектр существенным образом отличается от производных первичных аминов V и VI. На рис. 1 показаны ИК-спектры VII и VI. Известно, что соли третичных аминов поглощают при 2700–2250 см–1. В спектре VII в этой области присутствует широкая интенсивная полоса поглощения. Соли первичных аминов поглощают в еще более широком диапазоне от 3300 до 2200 см–1, как это видно из спектра производного гексаметилен-1,6-диаминия VI. Существенная разница в спектрах этих соединений наблюдается в области валентных (3600–3250 см–1) и деформационных (1750–1550 см–1) колебаний связей N‒H и О–Н. Характерная особенность ИК-спектра соединения VII заключается в наличии двух интенсивных острых полос поглощения 3583 и 3476 см–1. Отнести их к колебаниям связи N–H не представляется возможным. Следовательно, они могут быть обусловлены валентными колебаниями связей О–Н в молекуле координационно связанной воды и свободной группы –СОО–Н кислоты. Наличие группы –СОО–Н подтверждается полосой поглощения при 1715 см–1 в области деформационных колебаний О–Н. Поглощение в области 1600 см–1 обусловлено валентными колебаниями связи С=О карбоксилатного аниона –СОО–, свободной группы –СООН и деформационных колебаний связи N–H.
Попытка произвести перекристаллизацию {(C2H5)3NH}H[ZnL] из пересыщенного водного раствора неожиданно привела к получению нового соединения – этилендиаминтетраацетата цинка H2[ZnL] · 2H2O.
(5)
$\begin{gathered} {\text{\{ (}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{)}}}_{{\text{3}}}}{\text{NH\} H[ZnL]}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {{{\text{H}}}_{{\text{2}}}}{\text{[ZnL(}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}] \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{)}}}_{{\text{3}}}}{\text{N}}. \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,({\text{VIII}}) \hfill \\ \end{gathered} $Комплекс цинка VIII выпал в осадок в виде крупных кристаллов кубической формы (рис. 2) и связал три молекулы воды. ИК-спектр VIII (рис. 1) характеризуется очень интенсивным поглощением в области валентных колебаний связей О–Н трех кристаллизационных молекул воды и фрагмента –СОО–Н. Наличие последнего отчетливо проявляется в диапазоне деформационных колебаний О–Н при 1712 см–1.
Формирование кристаллической структуры представляет собой сложный процесс, как это следует из данных СЭМ (рис. 3). Процесс начинается с появления в растворе нано- и микрокристаллов, которые слипаются до крупных “глыб”. В “глыбы” впечатаны (рис. 3а) успевшие вырасти до крупных размеров кристаллы. Из данных РФА следует, что выпавший осадок практически не содержит аморфной составляющей (рис. 4, 3), которая могла бы выступить в качестве связующего при образовании крупных агломератов из мелких кристаллов. По-видимому, в качестве связующего выступают образования нанометрового размера. Выпадение из матрицы микрокристаллов приводит к образованию нерегулярной ячеистой структуры (рис. 3б) с размером ячейки 1.5–2.5 мкм. Благоприятным фактором, способствующим удачному проведению рентгеноструктурного эксперимента, является наличие “свободных” достаточно крупных кристаллов. При большом увеличении видно, что они не монолитны (рис. 3в). На их поверхности можно заметить параллельно расположенные нанотрещины.
Для соединений III–VIII был выполнен рентгенофазовый анализ. Производное 2-аминоэтанола V оказалось аморфным, в то время как остальные – кристаллическими. Аморфный характер V проявился во внешнем поведении. После синтеза оно представляло собой воскоподобное вещество, которое вспучивалось при нагревании в вакууме. На рис. 4 представлены рентгенограммы комплексов VI–VIII, из которых следует, что они кристаллизуются в различных кристаллографических формах. Аморфная составляющая практически отсутствовала. Соединение VI, несмотря на его высококристалличный характер, не удалось перекристаллизовать (переосадить) из концентрированного водного раствора смешиванием с диоксаном или метанолом. Насыщения также не удалось достигнуть. Очень высокая растворимость в водной среде выразилась в получении вязкого раствора, переходящего в смолу. Аналогичными качествами обладало также производное 2-аминоэтанола V. Чрезвычайно высокой оказалась и растворимость соединения VII (10.4 г в 10 мл Н2О). Однако насыщенный раствор не был стабильным и генерировал осаждение нового соединения VIII.
Водные растворы комплексов цинка не окрашены. В ЭСП отсутствовали явно выраженные полосы в диапазоне 250–400 нм (рис. 5). Только раствор соединения VI имел слабый желтый оттенок. В ЭСП присутствовала полоса поглощения с максимумом при 280 нм, простирающаяся с убывающей интенсивностью до 400 нм (рис. 5, 3).
Рис. 5.
ЭСП комплексов цинка с ЭДТА: IV (1), V (2), VI (3), VII (4), где c, моль л–1 = 1.2 × 10–1, 4.8 × 10–2, 9.2 × 10–2, 8.2 × 10–2 соответственно.

Как было сказано выше, ион цинка не имеет полос поглощения в УФ-области спектра, поскольку электронные переходы в 3d-конфигурации для иона цинка не характерны. Положение спектральных полос в исследованных комплексах определяется полем лигандов и зависит от характера лигандов. В целом тенденция сдвига имеет гипсохромный характер, причем этот сдвиг не зависит от природы центрального атома. По этой причине отнесение полосы 280 нм в спектре соединения VI к переходу лиганд–металл маловероятно. Возможная причина появления серии полос в этой области – фото- или термохимические изменения в лиганде, которые могут инициировать появление примесей в процессе очистки комплекса. Общеизвестна склонность аминов при действии света и тепла приобретать желтый цвет из-за появления полос поглощения в ближней УФ-области спектра. Сплошное поглощение до 270 нм появляется также (рис. 5, 2) и у раствора производного 2-аминоэтанола V.
По данным термогравиметрического анализа, соединения IV–VI начинают быстро терять вес только при температуре 290–300°С (рис. 6). Производное триэтиламина VII и продукт его дезаминирования VIII менее устойчивы. Массы положительно заряженной части (${\text{NH}}_{4}^{ + },$ H3N+CH2CH2OH, H3N+(CH2)6${\text{NH}}_{3}^{ + },$ (C2H5)3NH+) комплексов в соединениях IV, V, VI, VII составляют соответственно 13, 25, 25, 25% (для IV и VII вместе с Н2О). Полное удаление этой наиболее летучей части происходит при достижении 300, 370, 360, 260°С. В низкотемпературной области (до 150°С) соединение VIII наименее устойчиво. В диапазоне 100–140°С происходит быстрая потеря 14% массы. Данная ступень на кривой ТГА отражает удаление трех молекул воды. Комплекс VII интенсивно разлагается с образованием летучих продуктов в две стадии: при 220–280 и 350–400°С. Из всех исследованных комплексов он теряет наибольшее количество массы (74%) при достижении 500°С.
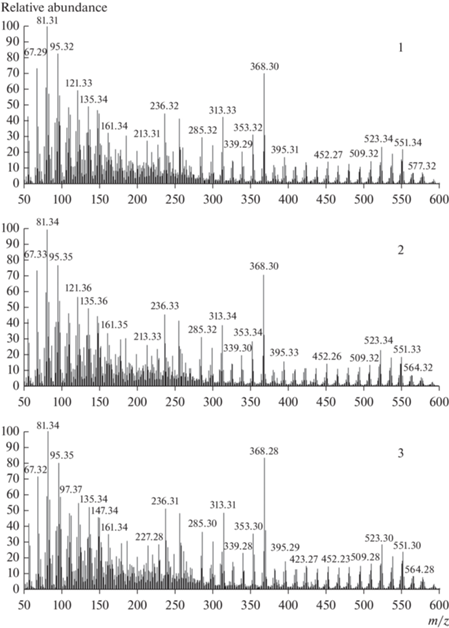
Структурное родство серии соединений вытекает при анализе их масс-спектров. Обычно наблюдается наличие достаточно большой серии осколочных ионов, характерных для каждого соединения [3]. Полной аналогии не наблюдается, особенно относительно интенсивностей. В настоящей работе мы наблюдали полную аналогию масс-спектров для всех изученных соединений I–VIII. На рис. 7 в качестве примера показаны три масс-спектра для существенно различающихся по химическому составу соединений III, V и VIII. Абсолютное совпадение спектров возможно в том случае, когда в результате электронной бомбардировки положительно заряженная часть комплекса превращается в нейтральную молекулу (или атом для I–III) и не регистрируется. Ионизации с получением положительно заряженных осколков подвергается “ядро”, одинаковое для всего ряда соединений, т.е. [ZnL]2–, вследствие чего и наблюдается практически полное совпадение спектров исследованных комплексов. Молекулярный ион был зарегистрирован только для комплекса VIII, однако его интенсивность невелика. Интересно, что для комплекса III при отсутствии молекулярного иона были зарегистрированы осколочные ионы [K2[ZnL]]+ и [K[ZnL] · H2O]+, однако их интенсивность также мала. Для других комплексов подобных осколочных ионов зарегистрировано не было.
Комплекс VIII изоструктурен ранее опубликованному аналогу H2[FeL(H2O)] · 2H2O [15]. В независимой области ячейки находится половина молекулы комплекса и одна сольватная молекула воды. Дианион этилендиаминтетрауксусной кислоты связан с атомом цинка четырьмя атомами кислорода и двумя атомами азота. Кроме того, одна молекула воды координирована на атом цинка (рис. 8). Таким образом, координационное число атома цинка равно семи, а координационное окружение представляет собой пентагональную бипирамиду. Расстояния Zn–O до двух независимых карбоксильных групп лиганда существенно отличаются (табл. 2). Связи C(1)–O(1) (1.2034(16) Å) и C(3)–O(4) (1.2381(14) Å) существенно короче по сравнению со связями C(1)–O(2) (1.3045(15) Å) и C(3)–O(3) (1.2728(13) Å).
Рис. 8.
Молекулярная структура комплекса VIII. Тепловые эллипсоиды приведены с 30%-ной вероятностью. Некоторые атомы водорода не приведены для наглядности.

Таблица 2.
Избранные длины связей (Å) и углы (град) в комплексе VIII
| Связь, Å | VIII | Угол, град | VIII |
|---|---|---|---|
| Zn(1)–O(3) | 2.0311(8) | O(3)Zn(1)O(3A) | 165.95(5) |
| Zn(1)–O(5) | 2.0376(13) | O(3)Zn(1)O(5) | 97.02(2) |
| Zn(1)–N(1) | 2.2715(9) | O(3)Zn(1)N(1) | 79.97(3) |
| Zn(1)–O(1) | 2.4273(12) | O(3A)Zn(1)N(1) | 89.18(3) |
| O(1)–C(1) | 1.2034(16) | O(5)Zn(1)N(1) | 140.38(2) |
| O(2)–C(1) | 1.3045(15) | O(3)Zn(1)N(1A) | 89.18(3) |
| O(3)–C(3) | 1.2728(13) | O(3A)Zn(1)N(1A) | 79.97(3) |
| O(4)–C(3) | 1.2381(14) | N(1)Zn(1)N(1A) | 79.24(5) |
| N(1)–C(4) | 1.4756(14) | O(3)Zn(1)O(1) | 89.59(5) |
| N(1)–C(2) | 1.4696(14) | O(3A)Zn(1)O(1) | 94.66(5) |
| N(1)–C(5) | 1.4781(15) | O(5)Zn(1)O(1) | 72.34(3) |
| C(1)–C(2) | 1.5021(18) | N(1)Zn(1)O(1) | 68.16(4) |
| C(3)–C(4) | 1.5251(15) | N(1A)Zn(1)O(1) | 147.07(4) |
| C(5)–C(5A*) | 1.519(2) | N(1A)Zn(1)O(1A) | 68.16(4) |
| O(1)Zn(1)O(1A) | 144.69(5) |
Таким образом, связь Zn(1)–O(1) (2.4273(12) Å) является координационной в отличие от связи Zn(1)–O(3) (2.0311(8) Å). Подобная тенденция распределения длин связей в координационной сфере атома металла наблюдалась и в родственном комплексе железа [15].
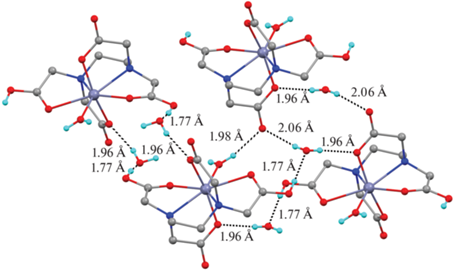
Атомы водорода карбоксильных групп C(1)O(1)O(2)H(1) комплекса VIII в кристалле направлены на атомы кислорода сольватных молекул воды. Расстояние H(1)…O(6) 1.77(3) Å свидетельствует о наличии сильного межмолекулярного специфического взаимодействия [16]. В свою очередь, атомы водорода молекул воды принимают участие в формировании межмолекулярных взаимодействий O–H…O с другими молекулами комплекса (табл. 3). Расстояния H…O варьируются в интервале 1.96(2)–2.06(2) Å, что также позволяет отнести данные межмолекулярные взаимодействия к сокращенным контактам [16]. В результате формируется 3D-сеть водородных связей (рис. 9).
Таблица 3.
Геометрические характеристики, соответствующие взаимодействиям O–H…O в кристалле VIII
| D-H…O | Расстояние, Å | Угол DΗΟ, град | ||
|---|---|---|---|---|
| D–H | H…O | D…O | ||
| O(2)–H(1)…O(6) | 0.83(3) | 1.77(3) | 2.5803(18) | 166(3) |
| O(5)–H(2)…O(4B*) | 0.83(2) | 1.98(2) | 2.7938(12) | 169(2) |
| O(6)–H(3)…O(4B) | 0.83(2) | 2.06(2) | 2.8620(15) | 161(2) |
| O(6)–H(4)…O(3C*) | 0.78(2) | 1.96(2) | 2.7208(13) | 167(2) |
Рис. 9.
3D-сеть водородных связей в кристалле VIII. Некоторые атомы водорода не приведены для наглядности.
Необычное поведение VII в сравнении с производными М2[ZnL] (М = калий, аммоний, моноэтаноламиний, гексаметилен-1,6-диаминий), возможно, объясняется присутствием в его молекуле свободной (не анионной) группoй –СООН, создающей в водном растворе слабую кислотную среду. Проверка на соединении калия показала, что подкисление его водного раствора не привело к образованию этилендиаминтетраацетата цинка. Вместо этого наблюдалось быстрое выпадение труднорастворимого осадка IX в виде мелкодисперсных частиц.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
Семенов В.В., Золотарева Н.В., Петров Б.И. Патент РФ 2015110362/04 (016255) // БИ. 2017. № 4.
Семенов В.В., Золотарева Н.В., Новикова О.В. и др. // Изв. АН. Сер. хим. 2022. № 5. С. 980.
Леонтьева М.В., Дятлова Н.М. // Коорд. химия. 1990. Т. 16. С. 823.
Lakshminarayanan R. // J. Electrochem. Soc. India. 1997. V. 46. P. 45.
Borowiec M., Hoffmann K., Hoffmann J. // Intern. J. Environmen. Anal. Chem. 2009. V. 89. P. 717. https://doi.org/10.1080/03067310802691672
Jervis R.E., Krishnan S.S. // J. Inorg. Nucl. Chem. 1967. V. 29. P. 97. https://doi.org/10.1016/0022-1902(67)80149-0
Bampidis V., Azimonti G., de Lourdes Bastos M. et al. // Eur. Food Safety Authority. 2020. V. 18. e06145. https://doi.org/10.2903/j.efsa.2020.6024
Collins R.N., Merrington G., McLaughlin M.J., Knudsen C. // Environ. Toxicol. Chem. 2002. V. 21. P. 1940. https://doi.org/10.1002/etc.5620210923
Soulages O.E., Acebal S.G., Grassi R.L., Vuano B.M. // Anales de la Asociacion Quimica Argentina. 1997. V. 85. P. 261.
Rigaku Oxford Diffraction. CrysAlis Pro Software System. Version 1.171.41.122a. Wroclaw (Poland): Rigaku Corporation, 2021.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Фридман А.Я., Леонтьева М.В., Дятлова Н.М. // Коорд. химия. 1986. Т. 12. С. 736.
Mizuta T., Wang J., Miyoshi K. // Inorg. Chim. Acta. 1995. V. 230. P. 119. https://doi.org/10.1016/0020-1693(94)04311-I
Зефиров Ю.В., Зоркий П.М. // Успехи химии. 1995. Т. 64. С. 446 (Zefirov Yu.V., Zorky P.M. // Russ. Chem. Rev. 1995. V. 64. P. 415). https://doi.org/10.1070/RC1995v064n05ABEH000157
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия