Микробиология, 2023, T. 92, № 5, стр. 477-489
Образование метана в пресном озере умеренного пояса в период интенсивного цветения цианобактерий
А. Ю. Каллистова a, *, А. И. Косякова a, И. И. Русанов a, В. В. Кадников a, А. В. Белецкий a, Д. Д. Коваль a, С. К. Юсупов a, И. Зеккер b, Н. В. Пименов a
a ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Университет Тарту
50411 Тарту, Эстония
* E-mail: kallistoanna@mail.ru
Поступила в редакцию 15.05.2023
После доработки 18.05.2023
Принята к публикации 22.05.2023
- EDN: KAVSYX
- DOI: 10.31857/S0026365623600256
Аннотация
Сезонное цветение цианобактерий оказывает негативное влияние на пресноводные экосистемы. Участие цианобактерий в образовании метана и их взаимоотношения с метаногенными археями к настоящему времени изучены недостаточно. Целью работы было выявление особенностей процесса метаногенеза в водной толще и осадках центральной части пресного оз. Сенеж (Московская область) в период активного цветения цианобактерий. В работе использовали аналитические, радиоизотопные, микроскопические, молекулярно-биологические и инкубационные методы. Выявлено защелачивание и перенасыщение кислородом водного слоя 0‒2 м за счет интенсивного фотосинтеза. В придонной воде (4 м) условия были рН-нейтральные и гипоксидные; осадки были восстановленные. Метан детектировался по всему профилю водной толщи: его концентрация в поверхностном водном слое была на порядок ниже, чем в придонной воде и на 4 порядка ниже, чем в осадках. В фотической зоне доминировали цианобактерии вида Microcystis aeruginosa (до 30% от общего количества фрагментов гена 16S рРНК). Также детектированы последовательности цианобактерий и пресноводных представителей клады SAR11, которые потенциально могут участвовать в аэробном метаногенезе при разложении метилфосфонатов (MPn). В перенасыщенных кислородом водах выявлены последовательности гидрогенотрофных метаногенов рода Methanoregula, которые потенциально могут осуществлять метаногенез в кооперации с цианобактериями. В восстановленных осадках преобладали гидрогенотрофный и ацетокластический пути метаногенеза. Детектированы последовательности метаногенов порядков Methanomicrobiales, Methanobacteriales, Methanosarciniales и Methanomassiliicoccales. Цветение цианобактерий способствовало процессу метаногенеза как в фотической зоне оз. Сенеж за счет разложения MPn и ассоциированного с цианобактериальными агрегатами анаэробного метаногенеза, так и в придонной воде и осадках за счет создания дефицита кислорода и избытка субстратов при осаждении и разложении цианобактериальной биомассы.
Сезонное цветение фитопланктона оказывает негативное воздействие на пресноводные экосистемы, т.к. приводит к образованию избыточного количества органического вещества (ОВ) и токсинов, снижению освещенности и дефициту кислорода в водной толще, расположенной ниже фотической зоны. Источником токсинов являются цианобактерии, которые имеют более высокие температурные оптимумы роста и более толерантны к повышенным температурам, чем другие представители фитопланктона (Wetzel, 2001), поэтому повышение температуры водоемов, происходящее в результате изменения климата, вызывает большое беспокойство (Huisman et al., 2018; Smucker et al., 2021). Интенсивное цветение цианобактерий может происходить и при пониженных температурах (<15°C), в том числе, в подледный сезон (Reinl et al., 2023).
Известно, что в водных экосистемах цианобактерии опосредовано и напрямую участвуют в круговороте парникового газа метана. В первую очередь, это связано с включением их биомассы в микробную пищевую цепь. Осаждение и интенсивное разложение избыточного ОВ биомассы цианобактерий приводит к быстрому истощению растворенного кислорода и созданию гипоксидных и анаэробных условий ниже фотической зоны (Diaz, Rosenberg, 2008). В анаэробных условиях ОВ продолжает разлагаться до субстратов – непосредственных предшественников метаногенеза (Xu et al., 2020). Таким образом, цветение цианобактерий создает в воде и верхнем слое осадков благоприятные условия для метаногенеза – анаэробиоз и доступность субстратов. Цианобактерии могут также напрямую снабжать метаногенов субстратами, например, водородом (Berg et al., 2014; Bizik, 2020; Самылина и соавт., 2023) и С1-метилированными соединениями (Zhu et al., 2022). Этот процесс может происходить, в том числе, в бескислородных микронишах внутри плавающих цианобактериальных (Microcystis sp.) агрегатов, где выявлено одновременное присутствие и активность метаногенных и метанотрофных сообществ (Li et al., 2021).
Помимо стимуляции классического анаэробного метаногенеза, цианобактерии способны самостоятельно осуществлять аэробный метаногенез путем деметилирования метилфосфонатов (MPn) (Bizik, 2020). Гены, отвечающие за разложение фосфонатов (phn), широко распространены у филаментных цианобактерий, в том числе, и у представителей, вызывающих цветение водоемов. MPn является альтернативным источником фосфора для цианобактерий, имеющих phn гены. Выделение метана в присутствии MPn в основном происходит в световой период и подавляется ортофосфатом (Zhao et al., 2022). В последние годы появляется все больше данных о том, что цианобактерии могут образовывать метан и по другим, неизвестным механизмам, непосредственно связанным с их основным фототрофным метаболизмом (Bizik, 2020).
Таким образом, интенсивное цветение цианобактерий должно приводить к усилению как анаэробного, так и аэробного метаногенеза. Существуют, однако, данные о том, что токсины цианобактерий оказывают ингибирующее влияние на микробные сообщества. Например, среди цианобактерий рода Microcystis (M. aeruginosa) ‒ наиболее распространенных в мире агентов цветения пресных водоемов (Wilhelm et al., 2020) ‒ встречаются как токсичные, так и нетоксичные штаммы, и их соотношение в водоеме динамично меняется. Токсичные штаммы образуют микроцистины, которые подавляют метаногенез: в присутствии токсичных штаммов M. aeruginosa относительное обилие метаногенов и образование метана на единицу общего углерода заметно ниже, чем в присутствии нетоксичных штаммов (Xu et al., 2020). При этом известно, что цианобактерии рода Microcystis образуют меньше токсинов на клетку, когда растут при более высоких температурах (около 25°C). При более низких температурах (около 18°C) скорости роста ниже, образуется меньше биомассы, но клетки, тем не менее, образуют больше токсинов (Wilhelm et al., 2020). Образование токсинов у многих цианобактерий также снижается при дефиците фосфора (Zhao et al., 2022).
Целью настоящей работы было исследование особенностей процесса метаногенеза в водной толще и осадках пресного озера умеренного пояса в период интенсивного цветения цианобактерий рода Microcystis.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования и пробоотбор. Объектами исследования являлись образцы воды и осадков по профилю экспериментальной точки (глубина 4 м), расположенной в центральной части пресного оз. Сенеж (56°12′34.6′′ N, 36°59′53.0′′ E). Характеристика оз. Сенеж (Солнечногорский район, Московская обл.) приведена в предыдущей публикации (Kallistova et al., 2023). Отбор проб и полевые измерения проводили в августе 2022 г. Воду отбирали с помощью 1 л стеклянного батометра Руттнера, осадки – лимнологическим стратометром. Для большинства лабораторных исследований (химический и молекулярный анализ, определение потенциальных активностей) использовали интегральные пробы воды с глубин 0, 2, 4 м и осадков с глубин 0‒10, 10‒20 и 20‒30 см, т.е. 3 образца (биологические повторности) отбирали с конкретной глубины на площади 1 м2 и сливали в одну склянку. Образцы хранили без доступа воздуха при 15°С в течение 24 ч до начала всех анализов.
Аналитические методы. Температуру воды, концентрацию растворенного кислорода и процент насыщения воды кислородом определяли in situ на глубинах 0, 1, 2, 3, 4 м с помощью портативного оксиметра Oxi 340i (“WTW”, Германия), оснащенного кислородным датчиком CellOx 325 (“WTW”, Германия). Освещенность воды определяли на тех же глубинах с использованием люксметра ТКА-ПКМ (Россия). Для определения концентрации метана по профилю воды (0, 0.5, 1, 1.5, 2, 2.5, 3, 3.5, 4 м) и осадков (0‒2, 2‒5, 5‒10, 10‒15, 15‒20, 20‒25, 25‒30 см) использовали метод фазово-равновесной дегазации (McAuliffe, 1971). Содержание метана в газовой фазе определяли на газовом хроматографе Кристалл 2000 (“Хроматэк”, Россия) с пламенно-ионизационным детектором и 3-х м колонкой с сорбентом Hayesep N (температура инжектора – 100°С, температура колонки ‒ 60°C, расход газа-носителя азота – 30 мл/мин). Измерение рН проводили с помощью рН-метра SevenCompact pH/Ion S220 (“Mettler-Toledo AG”, Швейцария). Eh осадков определяли с помощью портативного иономера WTW 3310 (Германия). Общую щелочность определяли набором стандартных реактивов (“Aquamerck”, Германия). Концентрацию PO$_{4}^{{3 - }}$ определяли фотометрическим методом с восстановлением аскорбиновой кислотой с использованием спектрофотометра UNICO 1200/1201 (“United Products & Instruments, Inc.”, США). Содержание хлорофилла а (хл а) в интегральных пробах воды (0, 2 и 4 м) определяли с помощью спектрофотометра NanoPhotometer NP80 (“Implen”, Германия). Для этого образцы воды фильтровали через фильтры GF/F, хл а экстрагировали 90% раствором ацетона в течение 24 ч при 5°С; расчет (в мкг/л) производили по формулам (Намсараев, 2009).
Микроскопия. Состав природных фототрофных сообществ изучали в нативных препаратах (“раздавленная капля”) под световым микроскопом Jenaval с фотоустановкой Zeiss Bundle Canon PS G9 (“Carl Zeiss”, Jena, Германия).
Молекулярные методы. Таксономический состав микробных сообществ определяли в интегральных образцах воды (0, 2, 4 м) и осадков (0‒10, 10‒20 и 20‒30 см). Клетки микроорганизмов из образцов воды предварительно концентрировали на фильтрах с диаметром пор 0.22 мкм, фильтр гомогенизировали, растирая с жидким азотом. Препарат метагеномной ДНК выделяли с помощью Power Soil DNA Isolation Kit (“MO BIO Laboratories Inc.”, США). Состав сообщества прокариот определяли на основании анализа последовательностей вариабельного региона V3–V4 гена 16S рРНК, амплифицированного с помощью ПЦР с использованием праймеров PRK341F (5'-CCTACGGGRBGCASCAG-3') и PRK806R (5'-GGACTACYVGGGTATCTAAT-3') (Frey et al., 2016). ПЦР фрагменты были баркодированы с помощью Nextera XT Index Kit v.2 (“Illumina”, США) и очищены с использованием Agencourt AMPure beads (“Beckman Coulter”, США). Концентрация полученных ПЦР продуктов была определена с помощью Qubit dsDNA HS Assay Kit (“Invitrogen”, США). Затем ПЦР фрагменты были смешаны в эквимолярных количествах и секвенированы на Illumina MiSeq (2 × 300 нт с обоих концов). Парные чтения были объединены с использованием FLASH v.1.2.11 (Magoc, Salzberg, 2011). Полученные последовательности были кластеризованы в операционные таксономические единицы (ОТЕ) при 97% идентичности с помощью программы Usearch (Edgar, 2010); низкокачественные чтения, химерные и единичные последовательности были удалены при кластеризации.
Таксономическая идентификация ОТЕ была выполнена по базе SILVA v.138 с использованием алгоритма VSEARCH (Rognes et al., 2016). Для образцов воды с глубин 0, 2 и 4 м было получено 9927, 39 270 и 51 430 последовательностей соответственно. Для образцов осадков с глубин 0‒10, 10‒20 и 20‒30 см было получено 4306, 43 766, 58 516 последовательностей соответственно. Полученные последовательности были депонированы в базе данных NCBI Sequence Read Archive (SRA) в рамках проекта PRJNA972532.
Проведен поиск генов синтеза (pepM, ppd), транспорта и разложения (phnC-P) MPn в геноме Ca. “Fonsibacter ubiquis” (номер в Генбанке CP024034.1). Гены pepM, ppd, phnC-P идентифицировали с помощью поиска rpsblast v.2.9.0 с пороговым значением e-value ‒ 1e-10 по базе данных консервативных доменов (Conserved Domain Database, CDD).
Радиоизотопные методы. Для измерения интенсивности процесса фотосинтеза использовали радиоуглеродный метод с добавлением NaH14CO3, в соответствии со стандартной методикой (Sorokin, Kadota, 1972). Радиоактивность конечных продуктов определяли на сцинтилляционном счетчике TRI-Carb TR2400 (“Packard”, США). Пробы воды отбирали батометром Руттнера и сразу наливали в стеклянные флаконы объемом 120 мл с помощью силиконовой трубки с двойной промывкой и с изливом половины объема склянки. Флаконы закрывали пенициллиновой пробкой без пузырька воздуха, закрепляя их алюминиевым колпачком с перфорацией для ввода реактивов. Все склянки при отборе были затемнены. Для определения первичной продукции использовали две прозрачные склянки и две темные, покрытые алюминиевой фольгой. В затемненном помещении во все флаконы добавляли 100 мкл стерильного раствора NaH14CO3 (специфическая активность 2.04 ГБк ммоль; 1.5 мкКи/проба). Затем последовательно снимали общие затемняющие чехлы и каждую склянку помещали в индивидуальный чехол, калиброванный по степени пропускания фотосинтетически активной радиации, соответствующей освещенности на горизонте отбора пробы. Флаконы с пробами инкубировали в течение 24 ч в специальном бассейне с водой, при освещенности и температуре, близким к условиям in situ. По завершении экспозиции содержимое флаконов фиксировали 1 мл 0.05 н HCl. Интенсивность суммарного фотосинтеза (Iфот) рассчитывали по разнице интенсивностей в светлой и темной склянках. Интегральную продукцию фотосинтеза под квадратным метром рассчитывали как сумму величин активности в каждом кубометре водного столба, от поверхности до дна водоема.
Инкубационные эксперименты. Потенциальную метаногенную активность определяли в интегральных образцах осадков (0‒10 и 10‒20 см) путем инкубации осадков с субстратами, обеспечивающими ацетокластический (ацетат), гидрогенотрофный (формиат), метилотрофный (триметиламин, ТМА; метанол, МеОН; диметилсульфоксид, ДМСО) и метил-редуцирующий (смесь ТМА + Н2; МеОН + Н2; ДМСО + Н2). Готовили серию из девяти параллельных инкубаций с добавлением различных субстратов из расчета конечной концентрации каждого субстрата (ацетат, формиат, МеОН, ДМСО, ТМА) – 10 мМ. Смеси с водородом содержали по 10 мМ МеОН, ДМСО, ТМА и 1.5 об. % Н2. По мере исчерпания Н2 из газовой фазы, его добавляли во флаконы с помощью шприца. В контрольный вариант, показывающий эндогенный метаногенез в осадках, субстраты не вносили. Подробная методика описана в предыдущей публикации (Kallistova et al., 2023). Количество образованного метана рассчитывали на 1 г сухого вещества (СВ) осадка; СВ определяли высушиванием образца до постоянного веса при 105°С. Все инкубации проводили при комнатной температуре (25.3 ± 1.3°С) в течение месяца. Потенциальные скорости метаногенеза оценивали как количество метана, образованное на 3, 7, 13 и 17 сут с начала инкубации. Результаты представлены как средние значения для 3-х повторностей.
РЕЗУЛЬТАТЫ
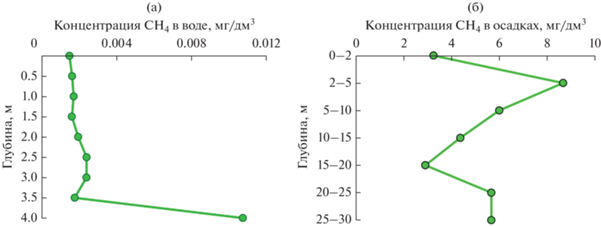
Физико-химические параметры. Свет проникал до дна водоема, однако освещенность придонной воды составляла всего 0.13% от поверхностной. Слой воды 0‒2 м был перенасыщен (до 200%) кислородом, за счет активности оксигенных фототрофов. Ниже 2 м концентрация кислорода резко падала до 30% насыщения, и, начиная с 3 м, в толще воды создавались гипоксидные условия (2.7‒2.5 мг О2/дм3). Осадки (0‒30 см) были восстановленные: величина Eh изменялась от ‒188 до ‒358 мВ вниз по профилю. Следствием интенсивного фотосинтеза являлось защелачивание (рН > 9) слоя воды 0‒2 м; в придонной воде рН снижалась до нейтральных значений. Дефицит фосфата также наблюдался в слое воды 0‒2 м; его концентрация увеличивалась в 3 раза на глубине 4 м (табл. 1). Концентрация СН4 в водном слое 0‒3.5 м изменялась в диапазоне 1.5‒2.4 мкг/дм3. Небольшое увеличение концентрации СН4 (с 1.6 до 2.4 мкг/дм3) наблюдалось в интервале глубин 2‒3 м. На глубине 3.5 м концентрация СН4 снижалась до 1.8 мкг/дм3, а на глубине 4 м (придонная вода) возрастала более чем в 5 раз, достигая 10.7 мкг/дм3 (рис. 1а). Концентрация СН4 в восстановленных осадках была в среднем в 500 раз выше, чем в придонной воде (средняя по профилю 0‒30 см – 5.2 ± 1.95 мг/дм3). Профиль СН4 в осадках имел волнообразный характер: минимальные значения наблюдались в поверхностном слое 0‒2 см, что может быть связано как с окислением, так и с диффузией в водную толщу; в слое осадков 2‒5 см концентрация метана увеличивалась в 2 раза; ниже ‒ постепенно снижалась до минимальных значений на глубине 15‒20 см; затем снова увеличивалась и оставалась постоянной до глубины 30 см (рис. 1б).
Таблица 1.
Физико-химические параметры, активность и доля фототрофных микроорганизмов в водной толще оз. Сенеж
| Параметр | Глубина, м | ||
|---|---|---|---|
| 0 м | 2 м | 4 м | |
| Температура, °C | 24 | 23 | 22.5 |
| Освещенность, лк | 15 560 | 805 | 20 |
| O2, мг/дм3 | 17 | 14.6 | 2.5 |
| pH | 9.25 | 9.2 | 7.5 |
| ${\text{PO}}_{4}^{{3 - }}$, мг/дм3 | <0.05 | 0.06 | 0.18 |
| хл а, мкг/дм3 | 43.3 | 40.6 | 20.3 |
| Iфот, мкг C/дм3/сут | 351.6 | 224.2 | 194.6 |
| Доля Cyanobacteriota, % от общего количества последовательностей 16S рРНК | 24.6 | 30.1 | 14.4 |
| Доля аноксигенных фототрофов, % от общего количества последовательностей 16S рРНК | 2.02 | 1.39 | 0.81 |
Рис. 1.
Концентрация метана в воде (а) и осадках (б) по профилю экспериментальной точки глубоководной части оз. Сенеж.
Активность фотосинтеза. Средняя величина суммарной интенсивности фотосинтеза оксигенных и аноксигенных фототрофов (Iфот) по профилю водной толщи составляла 256.8 ± 83.4 мкг С/дм3/сут. Интегральная величина первичной продукции составляла 994.6 мг С/м2/сут, что позволяет отнести оз. Сенеж к мезотрофно-евтрофному трофическому статусу. Iфот в поверхностном водном слое (0 м) была в 1.8 раз выше, чем в придонной воде (351.6 vs 194.6 мкг C/дм3/сут). Содержание хл а в водных пробах также снижалось в 2 раза на глубине 4 м по сравнению с поверхностью, а общая доля представителей филума Cyanobacteriota ‒ в 1.7 раз (табл. 1). На глубине 2 м интенсивность фотосинтеза была в 1.5 раза ниже, чем у поверхности (0 м), однако концентрация хл а снижалась незначительно (43.3 vs 40.6 мкг/л), а доля цианобактерий, наоборот, возрастала (24.6 vs 30.1%). Содержание хл а по профилю водной толщи довольно хорошо коррелировало с относительным количеством цианобактерий (коэффициент корреляции Пирсона, r = 0.8986) и хуже с Iфот (r = 0.7223). Коэффициент корреляции между Iфот и долей цианобактерий был низким (r = 0.3456), что может быть связано с тем, что часть ДНК была выделена из физиологически неактивных или мертвых клеток цианобактерий. В фотической зоне также детектированы последовательности, аффилированные с различными таксонами аноксигенных фототрофов (пурпурных серных и несерных, а также зеленых серных бактерий). При этом, несмотря на перенасыщение воды кислородом, суммарное относительное количество аноксигенных фототрофов было максимальным (2%) в поверхностном слое (табл. 1) и лучше коррелировало с Iфот (r = 0.9476), чем количество цианобактерий.
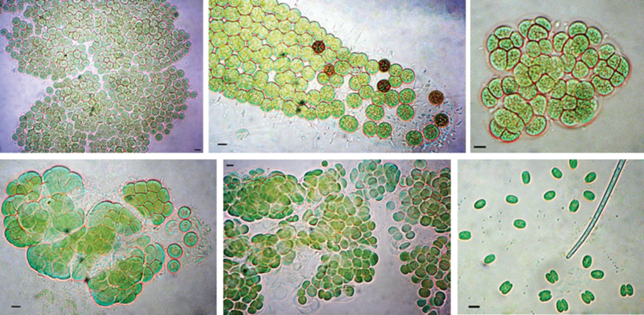
Разнообразие оксигенных и аноксигенных фототрофов. Общее разнообразие микроорганизмов в воде и осадках оз. Сенеж будет представлено в другой публикации (готовится к печати). Преобладающие в водной толще оз. Сенеж морфологические формы цианобактерий представлены на рис. 2. По данным анализа фрагментов генов 16S рРНК цианобактерии составляли абсолютное большинство в микробном сообществе водной толщи озера (до 30% в фотической зоне; табл. 1). В воде доминировали (11.9‒26.5%) цианобактерии, близкородственные (99.2% сходства) представителям вида Microcystis aeruginosa (LC557463.1); их доля превышала долю остальных микроорганизмов в 4‒20 раз. Помимо микроцистисов в воде детектированы последовательности, близкородственные (>98% сходства) цианобактериям видов Aphanizomenon flos-aquae (0.45‒2%), Cuspidothrix (Anabaena) issatschenkoi (0.3‒1%), Planktothrix agardhii (0.2‒0.7%), Woronichinia naegeliana (0.2‒0.5%), Synechococcus sp. (0.3‒0.4%) и Pseudanabaena mucicola (0.06‒0.11%). Доля представителей видов Dolichospermum (Anabaena) lemmermannii, D. brachiatum, Radiocystis geminata, Synechococcus rubescens, Snowella sp., а также некультивируемых представителей порядка Chroococcales и неидентифицированных цианобактерий была <0.1% для каждого из таксонов. Перечисленные цианобактерии были также детектированы в осадках (0‒30 см), где их доля снижалась вниз по профилю с 0.7 до 0.14%.
Рис. 2.
Преобладающие в водной толще оз. Сенеж морфологические формы цианобактерий. Масштабная метка соответствует 5 мкм.
Последовательности аноксигенных фототрофов, детектированные в оз. Сенеж, были аффилированы с пурпурными несерными бактериями семейств Rhodobacteraceae, Rhodospirillaceae, Comamonadaceae (род Rhodoferax), пурпурными серными бактериями семейства Chromatiaceae и факультативными фототрофами семейства Roseiflexaceae. Выявлены последовательности некультивируемых представителей филума Chlorobiota (0.4‒1.2%, максимум на глубине 0 м), который включает зеленых серных бактерий. Суммарная доля аноксигенных фототрофов в воде составляла 0.8‒2% (максимум на глубине 0 м, табл. 1), в осадках ‒ 0.06‒0.4% (максимум в слое 0‒10 см).
Разнообразие метаногенов. По всему профилю водной толщи (0‒4 м) выявлены последовательности (5‒6%), близкородственные (99.25% сходства) пресноводным представителям клады SAR11 (Pelagibacterales) ‒ Ca. “Fonsibacter ubiquis” (CP024034.1), которые, возможно, участвуют в аэробном образовании метана (Carini et al., 2014). Их доля в осадках составляла 0.02‒0.12%. В геноме Ca. “Fonsibacter ubiquis” выявлены потенциальные гомологи генов синтеза, транспорта и разложения MPn (pepM, phnC, phnK, phnL, phnP). Гомология rpsblast (с консенсусной последовательностью домена из базы CDD) варьировала от 25 до 46% (табл. S1 ).
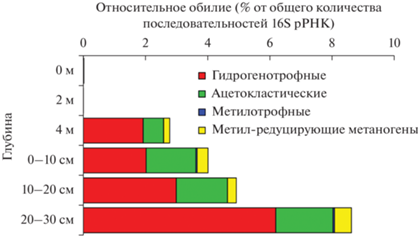
В перенасыщенных кислородом водах (0‒2 м) детектированы последовательности (0.01‒0.024%) классических анаэробных гидрогенотрофных метаногенных архей рода Methanoregula и порядка Methanomicrobiales. Наибольшего разнообразия метаногены достигали в гипоксидном слое (4 м), где наряду с гидрогенотрофными появлялись ацетокластические, метилотрофные и метил-редуцирующие метаногены. В слое осадков 0‒10 см гидрогенотрофные и ацетокластические метаногены присутствовали в одинаковом соотношении 1 : 1 (доля каждой группы около 2%). На нижних горизонтах осадков доля ацетокластических метаногенов оставалась на том же уровне, а гидрогенотрофных – увеличивалась до 6.2%. По профилю осадков (0‒30 см) доминировали представители гидрогенотрофных метаногенов родов Methanoregula (1.2‒2.5%), Methanolinea (0.4‒1.2%), Methanobacterium (0.2‒1.1%), а также некультивируемые представители порядка Methanomicrobiales (0.1‒1.1%). Доля ацетокластических метаногенов рода Methanotrix возрастала с 0.66 до 1.84% в диапазоне глубин 4 м‒30 см. Метилотрофные метаногены были представлены последовательностями, близкородственными (98.9% сходства) метаногенам вида Methanosarcina subterranea (NR_134763.1), которые используют С1-метилированные соединения, но не ацетат, формиат и Н2/СО2. Метилотрофы могли также присутствовать среди детектированных последовательностей некультивируемых представителей порядка Methanosarciniales. Доля метилотрофных метаногенов в оз. Сенеж была очень низкой (<0.05%). Доля последовательностей некультивируемых метил-редуцирующих метаногенов порядка Methanomassiliicoccales увеличивалась с 0.2 до 0.5% в диапазоне глубин 4 м‒30 см (рис. 3).
Рис. 3.
Относительная численность последовательностей, относящихся к разным группам метаногенов, по профилю воды и осадков оз. Сенеж.
Потенциальная активность метаногенеза. Потенциальную метаногенную активность в осадках определяли на разных субстратах метаногенеза в инкубационных экспериментах (рис. 4а). В контроле без добавления субстратов (эндогенный метаногенез) в образце осадка с глубины 0‒10 см наблюдалось стабильное образование метана с постоянной скоростью (3.25 ± 0.16 мкмоль CH4/г СВ/сут) в течение всего периода инкубации (27 сут). При добавлении субстратов потенциальная скорость метаногенеза зависела от времени инкубации (табл. 2). Так, в первые 3 сут с начала инкубации максимальная скорость метаногенеза наблюдалась на формиате (6.1 мкмоль CH4/г СВ/сут), что было в 2 раза выше, чем в контроле и на ацетате. Поскольку образование метана при добавлении формиата начиналось сразу (без лаг-фазы) и с высокой скоростью (рис. 4б), то, вероятно, гидрогенотрофные метаногены были наиболее активны в осадках in situ. В процессе инкубации скорость гидрогенотрофного метаногенеза сначала снизилась (на 7 сут), затем процесс прекратился, что вероятнее всего связано с исчерпанием субстрата. Скорость ацетокластического метаногенеза в начале инкубации также была высокой (2.9 мкмоль CH4/г СВ/сут) и увеличивалась со временем, что указывает на прирост ацетокластических метаногенов в процессе культивирования. Полученные результаты согласуются с данными молекулярного анализа, выявившими преобладание гидрогенотрофных и ацетокластических метаногенов в слое осадков 0‒10 см (рис. 3). Фаза задержки в образовании метана наблюдалась при инкубации с С1-метилированными соединениями, в течение которой предположительно происходила адаптация сообщества и постепенное (в течение 2-х нед.) накопление метилотрофных метаногенов. Вероятно, в условиях in situ в осадках имелся недостаток С1-метилированных субстратов, что согласуется с крайне низким относительным обилием метилотрофных метаногенов. При добавлении ДМСО лимитирующей стадией, очевидно, являлась стадия перехода ДМСО в диметилсульфид (ДМС) ‒ непосредственный субстрат метаногенеза, для которой необходимо присутствие в сообществе определенных сульфатредуцирующих бактерий. Этим объясняется длительная задержка (больше 2-х нед.) начала образования метана из ДМСО. Небольшая скорость метаногенеза на ТМА (0.88 мкмоль CH4/г СВ/сут) в первые сутки инкубации, далее снижение потенциальной активности, а затем резкое увеличение может быть связано с присутствием в сообществе метаногенов с разным отношением к ТМА: в первые сутки инкубации были активны организмы, использующие разные С1-метилированные соединения, ко второй неделе инкубации накопились метаногены, предпочитающие в качестве субстрата ТМА. Динамика образования метана на смеси С1-метилированных соединений с Н2 указывает скорее на отсутствие метил-редуцирующего метаногенеза. При добавлении МеОН + Н2 наблюдалась та же тенденция, что и при добавлении МеОН без водорода, что может быть связано с активностью исключительно метилотрофных метаногенов, потребляющих МеОН. В случае с ДМСО + Н2, относительно высокая активность в первые 3 сут, вероятнее всего, связана с гидрогенотрофным метаногенезом на добавленном Н2 и эндогенно образованном СО2. Затем происходило переключение на метилотрофный метаногенез. При добавлении ТМА + Н2, вероятнее всего, метилотрофный метаногенез протекал одновременно с гидрогенотрофным. Для более точных выводов о соотношении метил-редуцирующего, гидрогенотрофного и метилотрофного путей метаногенеза в условиях одновременного присутствия С1-метилированных субстратов и Н2 необходим анализ динамики изменения таксономического состава метаногенной популяции в процессе инкубации обогащенных субстратами образцов осадков.
Рис. 4.
Образование метана при инкубации осадков на разных субстратах метаногенеза: (а) ‒ инкубация в течение 27 сут (красным цветом обозначены осадки с глубины 0‒10 см, зеленым ‒ 10‒20 см, желтым – аэробное окисление метана в осадках с глубины 0‒10 см); (б) ‒ инкубация образцов осадков с глубины 0‒10 см в течение первых 6 сут; (в) ‒ инкубация образцов осадков с глубины 10‒20 см в течение первых 6 сут. Номера кривых соответствуют: 1 – ацетат; 2 ‒ формиат; 3 ‒ TMA + H2; 4 ‒ DMSO + H2; 5 ‒ TMA; 6 ‒ МеОН + H2; 7 ‒ контроль (без добавления субстрата); 8 ‒ МеОН; 9 ‒ DMSO.
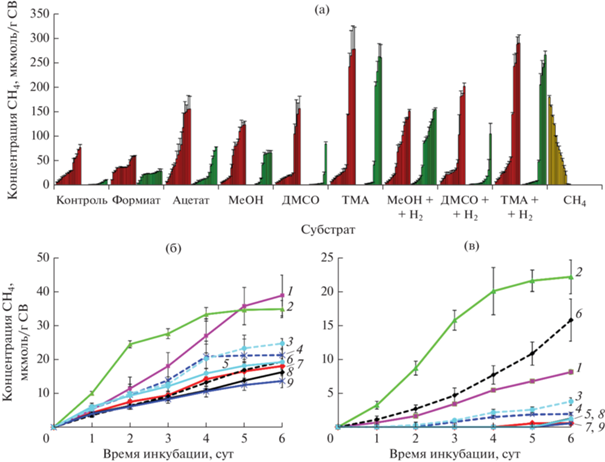
Таблица 2.
Потенциальные скорости метаногенеза (мкмоль CH4/г СВ/сут) при инкубации образцов осадков на разных субстратах
| Субстрат | Глубина, см | Время инкубации, сут | |||
|---|---|---|---|---|---|
| 3 | 7 | 13 | 17 | ||
| Контроль (эндогенная активность) | 0‒10 | 3.13 | 3.23 | 3.48 | 3.15 |
| 10‒20 | 0 | 0.13 | 0.21 | 0.25 | |
| Опыт – Контроль* | |||||
| Формиат | 0‒10 | 6.05 | 1.75 | 0 | 0 |
| 10‒20 | 5.27 | 3.09 | 1.44 | 1.25 | |
| Ацетат | 0‒10 | 2.86 | 4.33 | 5.53 | 5.44 |
| 10‒20 | 1.14 | 1.30 | 1.72 | 2.03 | |
| МеОН | 0‒10 | 0 | 1.69 | 3.30 | 3.26 |
| 10‒20 | 0 | 0.14 | 4.52 | 3.44 | |
| ДМСО | 0‒10 | 0 | 0 | 0 | 2.97 |
| 10‒20 | 0 | 0 | 0 | 0 | |
| TMA | 0‒10 | 0.88 | 0.12 | 7.51 | 11.05 |
| 10‒20 | 0 | 0.08 | 2.92 | 11.67 | |
| MeОН + H2 | 0‒10 | 0 | 1.99 | 4.30 | 4.00 |
| 10‒20 | 1.56 | 5.09 | 8.23 | 6.94 | |
| ДМСО + H2 | 0‒10 | 1.48 | 0.10 | 0 | 2.88 |
| 10‒20 | 0.25 | 0.17 | 0.32 | 0.40 | |
| TMA + H2 | 0‒10 | 1.11 | 1.27 | 7.61 | 11.11 |
| 10‒20 | 0.32 | 0.51 | 3.40 | 11.78 | |
| Суммарный метаногенез на всех субстратах | 0‒10 | 15.52 | 14.47 | 31.72 | 43.86 |
| 10‒20 | 8.54 | 10.51 | 22.76 | 37.76 | |
| Аэробное метанокисление** | 0‒10 | 18.88 | 16.95 | 13.70 | 10.49 |
В нижнем слое осадков (10‒20 см) как эндогенная, так и потенциальные активности метаногенеза на разных субстратах были ниже, чем в верхнем слое (0‒10 см) (рис. 4а, 4в), несмотря на довольно близкое относительное количество метаногенов в этих слоях (4 и 4.9% соответственно). Отличия нижнего слоя осадков от верхнего касались динамики метаногенеза на С1-метилированных соединениях в присутствии и отсутствии Н2. Метилотрофный метаногенез имел большую задержку на МеОН и ТМА в нижнем слое осадков по сравнению с верхним, а также полностью отсутствовал на ДМСО. Метил-редуцирующий метаногенез можно с определенной долей вероятности предположить в варианте инкубации с добавлением МеОН + Н2, т.к. скорость метаногенеза в этом варианте, начиная с 7 сут инкубации и до конца эксперимента, превышала суммарную скорость на МеОН, формиате и в эндогенном контроле (табл. 2).
Таким образом, основными путями метаногенеза в осадках оз. Сенеж являлись гидрогенотрофный и ацетокластический. Метилотрофные метаногены малочисленны и малоактивны in situ, вероятно, из-за нехватки доступного субстрата. Активность метил-редуцирующих метаногенов можно предположить в нижнем слое осадков 10‒20 см. Для сравнения в табл. 2 приведена потенциальная активность аэробного метанокисления для слоя осадков 0‒10 см (подробные результаты будут представлены в другой публикации). Максимальная потенциальная активность аэробного метанокисления наблюдалась в первые сутки инкубации (18.9 мкмоль CH4/г СВ/сут). Она превышала суммарную потенциальную скорость метаногенеза (15.5 мкмоль CH4/г СВ/сут) за тот же период времени для того же слоя осадков, что указывает на более быстрый ответ аэробных метанотрофов на снятие лимита по субстрату (в данном случае по кислороду) по сравнению с метаногенами. Метаногенам требуется больше времени для адаптации и накопления биомассы при переходе в более благоприятные по субстрату условия. Только через 2 нед. инкубации суммарная потенциальная скорость метаногенеза стала выше потенциальной скорости аэробного метанокисления за тот же период.
ОБСУЖДЕНИЕ
В перенасыщенной кислородом фотической зоне оз. Сенеж присутствовал метан в концентрации 1.9 ± 0.35 мкг/дм3 (среднее значение на глубине 0‒3.5 м), что может быть связано: 1) с физическим транспортом из осадков в сочетании с низкой скоростью аэробного метанокисления; 2) с процессом метаногенеза в этой зоне. Косвенным доказательством последнего может служить локальное увеличение концентрации метана в диапазоне глубин 2‒3 м (рис. 1а). Микробный метаногенез в аэробных условиях может быть связан: 1) с активностью цианобактерий и других микроорганизмов, разлагающих в условиях фосфатного голодания MPn с выделением метана в качестве побочного продукта; 2) с активностью метаногенов внутри бескислородных зон, в том числе в цианобактериальных агрегатах. Наши данные указывают на возможность протекания в аэробной зоне оз. Сенеж обоих путей метаногенеза. Способность отдельных штаммов пресноводных цианобактерий к образованию метана при разложении фосфонатов продемонстрирована в работе Zhao et al. (2022). Отвечающий за разложение фосфонатов генный кластер (phn), представленный phn опероном, который включает комплекс транспорта фосфоната (phnC-E), ген-регулятор транскрипции (phnF), С-Р-лиазный комплекс (phnG-M) и несколько дополнительных генов (phnN-P), присутствует в основном в геномах филаментных цианобактерий (Zhao et al., 2022). В оз. Сенеж выявлены последовательности представителей как филаментных (Aphanizomenon, Cuspidothrix (Anabaena), Planktothrix, Pseudanabaena, Dolichospermum (Anabaena)), так и одноклеточных колониальных (Microcystis, некультивируемые C-hroococcales, Snowella, Radiocystis, Woronichinia) и неколониальных (Synechococcus) цианобактерий, а также неизвестные цианобактерии. Большинство детектированных оз. Сенеж цианобактерий, включая доминирующих представителей (Microcystis, Aphanizomenon, Cuspidothrix, Woronichinia и Dolichospermum), не имеют в геномах ни генов синтеза, ни генов транспорта и разложения фосфонатов (согласно списку цианобактерий из статьи Zhao et al., 2022). Из всех цианобактерий, обнаруженных в оз. Сенеж, только три рода Pseudanabaena, Synechococcus и Planktothrix могут потенциально участвовать в синтезе (Synechococcus и Planktothrix) и разложении (Pseudanabaena, Synechococcus) фосфонатов. Их суммарная доля в фотической зоне (0‒2 м) оз. Сенеж составляла 0.5‒0.8% и увеличивалась до 1.2% в придонной воде за счет увеличения доли представителей рода Planktothrix, которые участвуют в синтезе, но не в разложении MPn.
По всей водной толще оз. Сенеж доминировали (на 3-м месте по относительному количеству среди всех прокариот) последовательности, близкородственные (99.25% сходства) Ca. “Fonsibacter ubiquis” (CP024034.1). Это широко распространенные в пресных водоемах аэробные хемогетеротрофы, являющиеся представителями клады SAR11 (Pelagibacterales) (Henson et al., 2018). У морских представителей клады SAR11 выявлены гены синтеза и разложения MPn, и в условиях фосфатного голодания они используют MPn в качестве источника фосфора с побочным выделением метана в эквимолярных количествах (Carini et al., 2014). В работе Хенсона и соавт. (2018) проведен геномный анализ Ca. “F. ubiquis”, однако нет информации ни о наличии, ни об отсутствии генов синтеза (pepM и ppd) и разложения (phn) MPn у этого организма (Henson et al., 2018), а также у других представителей рода Ca. “Fonsibacter” (Tsementzi et al., 2019). Мы обнаружили в геноме Ca. “Fonsibacter ubiquis” потенциальные гомологи генов метаболизма MPn. Однако для обоснованного утверждения того, что данный организм способен к аэробному метаногенезу, необходим более детальный геномный анализ, а также физиологические эксперименты.
Кроме того, в насыщенных кислородом водах оз. Сенеж детектированы последовательности классических анаэробных гидрогенотрофных метаногенов рода Methanoregula. Данные метаногены были выявлены ранее в аэробной водной толще пресного бореального оз. Светлое (Kallistova et al., 2018), а также в поверхностных водах пяти пресных озер, содержащих крупные агрегаты Microcystis sp. (Li et al., 2021). Согласно сравнительному геномному анализу, основной пул антиоксидантных генов присутствует у различных метаногенов порядков Methanobacteriales, Methanocellales, Methanococcales, Methanomicrobiales (включает род Methanoregula), Methanosarcinales и Methanopyrales. Этот пул в числовом выражении шире представлен у метаногенов порядков Methanocellales, Methanomicrobiales и Methanosarcinales. Представители этих порядков лучше адаптированы к окисленным условиям и поэтому чаще встречаются в различных аэробных местообитаниях (Lyu, Lu, 2018). Прямая передача водорода от цианобактерий к гидрогенотрофным метаногенам выявлена как в лабораторных модельных экспериментах (Berg et al., 2014), так и в природных цианобактериальных сообществах (Самылина и соавт., 2023). Водород является облигатным продуктом нитрогеназной активности в реакции фиксации азота цианобактериями. При этом нитрогеназа необратимо инактивируется кислородом, и поэтому для фиксации азота необходимы аноксидные условия. Диазотрофные цианобактерии по-разному решают эту проблему. У нитчатых цианобактерий, в том числе у детектированных в оз. Сенеж представителей родов Aphanizomenon, Cuspidothrix и Dolichospermum, имеются специализированные клетки – гетероцисты, которые защищают нитрогеназу от действия кислорода, т.е. процессы фотосинтеза и азотфиксации разделены в пространстве. У многих аэробных диазотрофных негетероцистных цианобактерий фиксация N2 с образованием Н2 может происходить как в темновой период в условиях чередования режима свет/темнота, так и при непрерывном освещении. Например, цианобактерии рода Gloeothece реализуют стратегию разделения во времени процессов фотосинтеза и фиксации N2 в условиях непрерывного освещения: активность нитрогеназы достигает пика в период, когда активность фотосинтеза снижается (подробнее см. Stal, 2015). Несмотря на то, что доминирующие в оз. Сенеж цианобактерии вида M. aeruginosa не способны к фиксации азота, они образуют Н2 в анаэробных условиях в темноте за счет активности гидрогеназы при разложении эндогенных запасных веществ, таких как гликоген (Asada, Kawamura, 1984; Asada et al., 1998; Rashid et al., 2009). В природе дефицит кислорода, необходимый для гидрогеназной активности цианобактерий рода Microcystis и гидрогенотрофной активности метаногенов рода Methanoregula, может наблюдаться, например, в бентосных цианобактериальных матах, где условия обычно становятся аноксидными ночью, когда фотосинтез прекращается, а высокая скорость дыхания приводит к быстрому истощению кислорода (Stal, 2015). Гидрогенотрофные и ацетокластические метаногены были также выявлены в бескислородных микронишах внутри плавающих агрегатов цианобактерий рода Microcystis (Li et al., 2021). Последнее может также иметь место в оз. Сенеж, где компактные цианобактериальные агрегаты выявлены с помощью микроскопии (рис. 2). Таким образом, гидрогенотрофные метаногены рода Methanoregula, находясь в кооперации с цианобактериями, потенциально способны к образованию метана в аэробной водной толще.
В восстановленных осадках оз. Сенеж наблюдалась типичная для пресных озер картина образования метана ‒ преобладание гидрогенотрофного и ацетокластического путей метаногенеза (Borrel et al., 2011; Peura et al., 2015; Rissanen et al., 2017; Kallistova et al., 2018, 2021; Lyautey et al., 2021; Li et al., 2021). Низкие скорости и низкое относительное количество метилотрофных и метил-редуцирующих метаногенов могут быть связаны с дефицитом метилированых С1-соединений, характерных для пресных озер (Borrel et al., 2011). Однако цианобактерии в период цветения могут служить источником метилированных соединений и значительно стимулировать активность метилотрофного метаногенеза (Zhu et al., 2022). В работе Риссанена (2017) показано, что доля метаногенов в архейном сообществе зоны литорали пресного озера была выше, чем в его глубоководной части. Как следует из более низкого отношения C : N, на поросшем растительностью литоральном участке было больше доступного для микроорганизмов ОВ по сравнению с глубоководной частью озера. Этим объясняются более высокие потенциальные скорости образования метана и общего неорганического углерода, а также более высокая относительная численность метаногенов в зоне литорали. Относительное количество гидрогенотрофных представителей семейства Methanobacteriaceae было выше в зоне литорали, чем в глубоководной части озера, и, напротив, ацетокластические представители семейства Methanosaetaceae преобладали в глубоководной части (Rissanen et al., 2017). Сравнение данных 2022 г., полученных для глубоководной части оз. Сенеж (настоящая работа), и данных 2021 г., полученных для зоны литорали (Kallistova et al., 2023), показывает, что в верхнем слое осадков соотношение гидрогенотрофных и ацетокластических метаногенов, как в зоне литорали, так и в глубоководной части озера, было близким (⁓1 : 1). При этом, однако, концентрация метана, общее относительное количество метаногенов, скорость эндогенного метаногенеза и метаногенеза на разных субстратах были выше в глубоководной части озера по сравнению с литоралью. Мы предполагаем, что цветение цианобактерий создало благоприятные условия для метаногенеза в глубоководной части озера, т.к. способствовало анаэробиозу и избыточному поступлению метаногенных субстратов. В период исследования литорали цветения цианобактерий не происходило, и основными первичными продуцентами в озере были диатомовые водоросли (Kallistova et al., 2023).
Таким образом, интенсивное цветение цианобактерий способствует усилению метаногенеза в пресном озере умеренного климата, как напрямую в водной толще за счет аэробного метаногенеза при разложении MPn и снабжения Н2 гидрогенотрофных метаногенов, ассоциированных с цианобактериальными агрегатами, так и опосредованно в придонной воде и осадках за счет создания дефицита кислорода и снабжения метаногенов субстратами при осаждении и разложении избыточной биомассы цианобактерий.
Список литературы
Каллистова А.Ю., Кадников В.В., Саввичев А.С., Русанов И.И., Дворников Ю.А., Лейбман М.О., Хомутов А.В., Равин Н.В., Пименов Н.В. Сравнительное исследование путей метаногенеза в осадках термокарстовых и полигенетических ямальских озер // Микробиология. 2021. Т. 90. С. 236‒242.
Kallistova A.Yu., Kadnikov V.V., Savvichev A.S., Rusanov I.I., Dvornikov Yu.A., Leibman M.O., Khomutov A.V., Ravin N.V., Pimenov N.V. Comparative study of methanogenic pathways in the sediments of thermokarst and polygenetic Yamal lakes // Microbiology (Moscow). 2021. V. 90. P. 261–267.
Намсараев З.Б. Использование коэффициентов поглощения для расчета концентрации хлорофиллов и бактериохлорофиллов // Микробиология. 2009. Т. 78. С. 836‒839.
Namsaraev Z.B. Application of extinction coefficients for quantification of chlorophylls and bacteriochlorophylls // Microbiology (Moscow). 2009. V. 78. P. 794–797.
Самылина О.С., Меркель А.Ю., Пименов Н.В. Суточная динамика метана в цианобактериальном сообществе содового озера Горчина 1 (Кулундинская степь, Алтайский край) // Микробиология. 2023. Т. 92. С. 233–239.
Samylina O.S., Merkel A.Y., Pimenov N.V. Diurnal methane dynamics in the cyanobacterial community of soda Lake Bitter 1 (Kulunda Steppe, Altai Krai) // Microbiology (Moscow). 2023. V. 92. P. 293–299.
Asada Y., Kawamura S. Hydrogen evolution by Microcystis aeruginosa in darkness // Agric. Biol. Chem. 1984. V. 48. P. 2595‒2596.
Asada Y., Miyake M., Koike Y., Aoyama K., Uemura I., Miyake J. Hydrogenase-mediated hydrogen metabolism in a non-nitrogen-fixing cyanobacterium, Microcystis aeruginosa // BioHydrogen / Eds. Zaborsky O.R., Benemann J.R., Matsunaga T., Miyake J., San Pietro A. Boston: Springer, 1998. P. 173‒179. https://doi.org/10.1007/978-0-585-35132-2_23
Berg A., Lindblad P., Svensson B.H. Cyanobacteria as a source of hydrogen for methane formation // World J. Microbiol. Biotechnol. 2014. V. 30. P. 539‒545.
Bižic M., Grossart H.-P., Ionescu D. Methane Paradox // eLS / Chichester: John Wiley & Sons, Ltd., 2020. P. 1‒11. https://doi.org/10.1002/9780470015902.a0028892
Borrel G., Jézéquel D., Biderre-Petit C., Morel-Desrosiers N., Morel J.P., Peyret P., Fonty G., Lehours A.C. Production and consumption of methane in freshwater lake ecosystems // Res. Microbiol. 2011. V. 162. P. 832−847.
Carini P., White A.E., Campbell E.O., Giovannoni S.J. Methane production by phosphate-starved SAR11 chemoheterotrophic marine bacteria // Nat. Commun. 2014. V. 5. Art. 4346. https://doi.org/10.1038/ncomms5346
Diaz R.J., Rosenberg R. Spreading dead zones and consequences for marine ecosystems // Science. 2008. V. 321. P. 926−929.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460‒2461.
Frey B., Rime T., Phillips M., Stierli B., Hajdas I., Widmer F., Hartmann M. Microbial diversity in European alpine permafrost and active layers // FEMS Microbiol. Ecol. 2016. V. 92. Art. fiw018. https://doi.org/10.1093/femsec/fiw018
Henson M.W., Lanclos V.C., Faircloth B.C., Thrash J.C. Cultivation and genomics of the first freshwater SAR11 (LD12) isolate // ISME J. 2018. V. 12. P. 1846‒1860.
Huisman J., Codd G.A., Paerl H.W., Ibelings B.W., Verspagen J.M.H., Visser P.M. Cyanobacterial blooms // Nat. Rev. Microbiol. 2018. V. 16. P. 471–483.
Kallistova A., Kadnikov V., Rusanov I., Kokryatskaya N., Beletsky A., Mardanov A., Savvichev A., Ravin N., Pimenov N. Microbial communities involved in aerobic and anaerobic methane cycling in a meromictic ferruginous subarctic lake // Aquat. Microbial Ecol. 2018. V. 82. P. 1‒18.
Kallistova A.Yu., Koval D.D., Kadnikov V.V., Toshchakov S.V., Yusupov S.K., Izotova A.O., Vinogradova E.N., Zekker I., Pimenov N.V. Methane cycle in a littoral site of a temperate freshwater lake // Microbiology (Moscow). 2023. V. 92. P. 153–170.
Li C., Hambright K.D., Bowen H.G., Trammell M.A., Grossart H.P., Burford M.A., Hamilton D.P., Jiang H., Latour D., Meyer E.I., Padisák J., Zamor R.M., Krumholz L.R. Global co-occurrence of methanogenic archaea and methanotrophic bacteria in Microcystis aggregates // Environ. Microbiol. 2021. V. 23. P. 6503‒6519.
Lyautey E., Billard E., Tissot N., Jacquet S., Domaizon I. Seasonal dynamics of abundance, structure, and diversity of methanogens and methanotrophs in lake sediments // Microb. Ecol. 2021. V. 82. P. 559−571.
Lyu Z., Lu Y. Metabolic shift at the class level sheds light on adaptation of methanogens to oxidative environments // ISME J. 2018. V. 12. P. 411−423.
Magoč T., Salzberg S.L. FLASH: fast length adjustment of short reads to improve genome assemblies // Bioinformatics. 2011. V. 27. P. 2957‒2963.
McAuliffe C.C. GC determination of solutes by multiple phase equilibration // Chem. Technol. 1971. V. 1. P. 46−51.
Peura S., Sinclair L., Bertilsson S., Eiler A. Metagenomic insights into strategies of aerobic and anaerobic carbon and nitrogen transformation in boreal lakes // Sci. Rep. 2015. V. 5. Art. 12102. https://doi.org/10.1038/srep12102
Rashid N., Song W., Park J., Jin H.-F., Lee K. Characteristics of hydrogen production by immobilized cyanobacterium Microcystis aeruginosa through cycles of photosynthesis and anaerobic incubation // Ind. Eng. Chem. 2009. V. 15. P. 498‒503.
Reinl K.L., Harris T.D., North R.L., Almela P., Berger S.A., Bizic M., Burnet S.H., Grossart H.-P., Ibelings B.W., J-akobsson E., Knoll L.B., Lafrancois B.M., McElarney Y., Morales-Williams A.M., Obertegger U., Ogashawara I., Paule-Mercado M.C., Peierls B.L., Rusak J.A., Sarkar S., Sharma S., Trout-Haney J.V., Urrutia-Cordero P., Venkiteswaran J.J., Wain D.J., Warner K., Weyhenmeyer G.A., Yokota K. Blooms also like it cold // Limnol. Oceanogr. Lett. 2023. https://doi.org/10.1002/lol2.10316
Rissanen A.J., Karvinen A., Nykänen H., Peura S., Tiirola M., Mäki A., Kankaala P. Effects of alternative electron acceptors on the activity and community structure of methane-producing and consuming microbes in the sediments of two shallow boreal lakes // FEMS Microbiol. Ecol. 2017. V. 93. Art. fix078. https://doi.org/10.1093/femsec/fix078
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open source tool for metagenomics // PeerJ. 2016. V. 4. Art. e2584. https://doi.org/10.7717/peerj.2584
Smucker N.J., Beaulieu J.J., Nietch C.T., Young J.L. Increasingly severe cyanobacterial blooms and deep water hypoxia coincide with warming water temperatures in reservoirs // Glob. Change Biol. 2021. V. 27. P. 2507‒2519.
Sorokin Y.I., Kadota H. Techniques for the assessment of microbial production and decomposition in fresh waters // IBP Handbook 23 / Oxford and London: Blackwell Scientific Publ., 1972. 112 p.
Stal L.J. Nitrogen fixation in cyanobacteria // eLS / Chichester: John Wiley & Sons, Ltd., 2015. P. 1‒9. https://doi.org/10.1002/9780470015902.a0021159.pub2
Tsementzi D., Rodriguez-R L.M., Ruiz-Perez C.A., Meziti A., Hatt J.K., Konstantinidis K.T. Ecogenomic characterization of widespread, closely-related SAR11 clades of the freshwater genus “Candidatus Fonsibacter” and proposal of Ca. Fonsibacter lacus sp. nov. // Syst. Appl. Microbiol. 2019. V. 42. P. 495‒505.
Wetzel R.G. Limnology: Lake and River Ecosystems // Academic Press, 2001, 3rd edn. https://doi.org/10.1016/C2009-0-02112-6
Wilhelm S.W., Bullerjahn G.S., McKay R.M.L. The complicated and confusing ecology of Microcystis blooms // mBio. 2020. V. 11. Art. e00529-20. https://doi.org/10.1128/mBio.00529-20
Xu H., Liu Y., Tang Z., Li H., Li G., He Q. Methane production in harmful algal blooms collapsed water: The contribution of non-toxic Microcystis aeruginosa outweighs that of the toxic variety // J. Cleaner Product. 2020. V. 276. Art. 124280. https://doi.org/10.1016/j.jclepro.2020.124280
Zhao L., Lin L.Z., Chen M.Y., Teng W.K., Zheng L.L., Peng L., Lv J., Brand J.J., Hu C.X., Han B.P., Song L.R., Shu W.S. The widespread capability of methylphosphonate utilization in filamentous cyanobacteria and its ecological significance // Water Res. 2022. V. 217. Art. 118385. https://doi.org/10.1016/j.watres.2022.118385
Zhu Y., Chen X., Yang Y., Xie S. Impacts of cyanobacterial biomass and nitrate nitrogen on methanogens in eutrophic lakes // Sci. Total. Environ. 2022. V. 848. Art. 157570. https://doi.org/10.1016/j.scitotenv.2022.157570
Дополнительные материалы
- скачать ESM.zip
- Приложение 1.
Table S1. Потенциальные гомологи генов синтеза и разложения фосфоната в геноме Ca. “Fonsibacter ubiquis” (CP024034.1).


