Неорганические материалы, 2019, T. 55, № 6, стр. 635-641
Фазовые равновесия в системах Sm2O3–CaO–NiO и Sm2O3–NiO–CoO
А. П. Галайда 1, 2, Н. Е. Волкова 1, *, Л. Я. Гаврилова 1, В. А. Черепанов 1
1 Институт естественных наук и математики, Уральский федеральный университет имени первого
Президента России Б.Н. Ельцина
620083 Екатеринбург, пр. Ленина, 51, Россия
2 Институт высокотемпературной электрохимии УрО Российской академии наук
620990 Екатеринбург, ул. Академическая, 20, Россия
* E-mail: nadezhda.volkova@urfu.ru
Поступила в редакцию 08.10.2018
После доработки 18.12.2018
Принята к публикации 17.01.2019
Аннотация
Фазовые равновесия в системах 1/2 Sm2O3–CaO–NiO и 1/2 Sm2O3–NiO–CoO систематически изучены при 1100°С на воздухе. Установлено образование двух типов твердых растворов – Sm2– yCayNiO4 – δ (0.5 ≤ y ≤ 0.55) и SmCo1– xNixO3 – δ (0 < x ≤ 0.15), кристаллизующихся в структурном типе K2NiF4 и перовскита соответственно. Методами высокотемпературной термогравиметрии и дихроматометрического титрования определено содержание кислорода в образцах в температурном интервале 25–1100°С на воздухе. Предложены изобарно-изотермические разрезы диаграмм состояния 1/2 Sm2O3–CaO–NiO и 1/2 Sm2O3–NiO–CoO при 1100°С и ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 0.21 атм.
ВВЕДЕНИЕ
Системы R–M–M'–O (R – редкоземельный элемент, M – Ca, Ba, Sr; M' – 3d-металл) привлекают внимание исследователей вследствие существования в них сложных оксидов, перспективных для использования в высокотемпературных топливных элементах, полупроводниковых газовых сенсорах, в качестве кислородных мембран [1–6]. Кобальтиты и никелаты РЗЭ обладают уникальным сочетанием физико-химических свойств [2, 4, 5, 7]. В отличие от никелатов RNiO3 и R2NiO4 с лантаноидами больших радиусов (R = = La, Pr, Nd) [7–15] сложные оксиды с меньшими РЗЭ нестабильны [16–18]. Известно, что частичное замещение РЗЭ щелочноземельными металлами приводит к стабилизации упомянутых структур в ограниченных интервалах составов [3, 19, 20]. Последнее связано с возможностью варьирования содержания кислорода и, следовательно, реализации выгодной степени окисления 3d-переходного металла [21, 22].
Бинарная система Sm2O3–CoO при 1100°C на воздухе изучена ранее [5, 23–27]. Единственным стабильным соединением является кобальтит самария SmCoO3 с орторомбически искаженной структурой перовскита [24] (a = 5.357 Å, b = 5.294 Å, c = 7.513 Å, пр. гр. Pbnm [27]).
Кобальтит никеля NiCo2O4, кристаллизующийся в кубической ячейке (пр. гр. Fd3m) с параметром a = 8.114 Å [28], разлагается при температурах выше 400°C с образованием оксидов NiO и Co3O4 [29]. При высоких температурах оксиды CoO и NiO образуют непрерывный ряд твердых растворов Co1– aNiaO [30].
В бинарной системе Sm2O3–CaO при 1100°С на воздухе установлено образование твердых растворов на основе оксида самария Sm2 – zCazO3 – δ (0 < z ≤ 0.1) с моноклинной структурой (пр. гр. C2/m) [25].
Сведения, касающиеся формирования оксидов в бинарных Sm2O3–NiO и CaO–NiO и тройных системах Sm2O3–CaO–NiO и Sm2O3–CoO–NiO, в литературе отсутствуют.
Настоящая работа посвящена установлению фазовых равновесий, кристаллической структуры фаз, образующихся в системах Sm2O3–CaO–NiO и Sm2O3–CoO–NiO при температуре 1100°C на воздухе, и определению содержания в них кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов осуществляли по глицерин-нитратной технологии. Для приготовления образцов использовали оксид самария Sm2O3 (СмО-Л), карбонат кальция CaCO3 (“ч. д. а.”), ацетат никеля Ni(CH3COO)2 ⋅ 4H2O (“ос. ч.”), оксалат железа FeC2O4 ⋅ 2H2O (“ч. д. а.”), а также металлический кобальт, азотную кислоту и глицерин. Металлический кобальт получали восстановлением из оксида Co3O4 (“ос. ч.”) при 600°C в токе водорода. Навески исходных компонентов растворяли в 4М HNO3 при нагревании, добавляли глицерин и выпаривали в фарфоровой чашке. После обезвоживания вязкий гель при нагревании превращался в коричневый порошок. Сухой остаток ступенчато нагревали до температуры 1100°C. Суммарное время отжигов при 1100°C на воздухе составило 120 ч. В зависимости от целей образцы либо медленно охлаждали (скорость охлаждения 100°C/ч) или закаливали (скорость закалки 400°С/мин) на комнатную температуру.
Фазовый состав определяли на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, 2θ = 20°–90°, шаг 0.01°–0.04°, экспозиция 2–10 с) при комнатной температуре на воздухе. Фазы идентифицировали с использованием базы данных ICDD. Уточнение структуры проводили методом полнопрофильного анализа Ритвельда с помощью программы Fullprof 2008.
Термогравиметрические исследования выполнены на термоанализаторе STA 409 PC (Netzsch Gmbh) в интервале температур 25–1100°С на воздухе (скорость нагрева/охлаждения 2°С/мин). Абсолютные значения кислородного дефицита определяли методом восстановления образцов в токе водорода непосредственно в ТГ-установке (H2 : N2 = 90 : 10) в двух параллелях до исходных оксидов Sm2O3, CaO и металлических Co и Ni. Водород получали электролизом воды в стандартном генераторе водорода “Спектр-12”. Перед восстановлением воздух из ТГ-установки вытесняли азотом.
В дихроматометрическом методе навеску образца, медленно охлажденного до комнатной температуры (~0.2 г), растворяли в 2М соляной кислоте с добавлением известного избытка соли Мора Fe(NH4)2(SO4)2 ⋅ 6H2O, после чего избыток по отношению к реакции (1) ионов Fe2+ оттитровывали 0.1 Н раствором дихромата:
(1)
$(n - 2){\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{M}}}^{{'n{\text{ + }}}}} \leftrightarrow (n - 2){\text{F}}{{{\text{e}}}^{{3 + }}} + {{{\text{M}}}^{{'2{\text{ + }}}}},$(2)
$6{\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}} + {\text{C}}{{{\text{r}}}_{2}}{\text{O}}_{7}^{{2 - }} + 14{{{\text{H}}}^{ + }} \leftrightarrow 6{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}} + 2{\text{C}}{{{\text{r}}}^{{3 + }}} + 7{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Конечную точку титрования фиксировали потенциометрически с использованием автоматического титратора “Аквилон” АТП-02. Величину средней степени окисления кобальта в образцах рассчитывали по формуле
(3)
${{n}^{ + }} = 2 + \left( {\frac{{{{g}_{0}}}}{{{{M}_{{{\text{(Fe(N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}}{{{{\text{(S}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}}_{{\text{2}}}}\, \cdot \,{\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}}}}}} - \frac{{{{{(NV)}}_{{{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}}}}}}{{1000}}} \right)\frac{M}{g},$Значение абсолютной нестехиометрии δ рассчитано по формулам
где n+ – средняя степень окисления кобальта и никеля в образце.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Система 1/2 Sm2O3–CaO–NiO. Для изучения фазовых равновесий в тройной системе 1/2 Sm2O3–CaO–NiO (t = 1100°C, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.21 атм) по глицерин-нитратной технологии было приготовлено 25 образцов с различным составом.
Для проверки возможности образования твердых растворов со структурой типа K2NiF4 были синтезированы образцы общего состава Sm2 – yCayNiO4 – δ с y = 0.4, 0.45, 0.5, 0.55, 0.6, 0.7, 1.0.
По данным РФА закаленных образцов установлено, что однофазные твердые растворы Sm2 – yCayNiO4 – δ, обладающие ромбической структурой (пр. гр. Bmab), образуются в интервале 0.5 ≤ y ≤ 0.55. На рис. 1 в качестве примера приведена рентгенограмма твердого раствора Sm1.45Ca0.55NiO4 – δ, обработанная методом полнопрофильного анализа Ритвельда (а), и модель его элементарной ячейки, построенная с помощью пакета Diamond (б).
Рис. 1.
Рентгенограмма образца Sm1.45Ca0.55NiO4 – δ, обработанная по методу Ритвельда (a), и структурная модель элементарной ячейки Sm2– yCayNiO4 – δ (б).
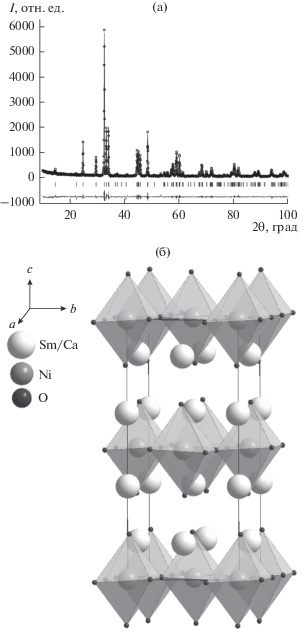
Для всех сложных оксидов ряда Sm2– yCayNiO4 – δ были рассчитаны параметры элементарной ячейки и координаты атомов (табл. 1).
Таблица 1.
Параметры элементарной ячейки и координаты атомов твердых растворов SmCo1 – xNixO3 – δ и Sm2 – yCayNiO4 – δ
| Твердые растворы | SmCo1 – xNixO3 – δ | Sm2 – yCayNiO4 – δ | |||||
|---|---|---|---|---|---|---|---|
| Пр. гр. | Pbnm | Bmab | |||||
| x/y | 0.0 | 0.05 | 0.1 | 0.15 | 0.55 | 0.5 | |
| a, Å | 5.286(1) | 5.289(1) | 5.292(1) | 5.296(1) | 5.387(1) | 5.397(1) | |
| b, Å | 5.353(1) | 5.361(1) | 5.369(1) | 5.378(1) | 5.263(1) | 5.266(1) | |
| c, Å | 7.499(1) | 7.504(1) | 7.508(1) | 7.514(1) | 12.112(1) | 12.111(1) | |
| x | Sm | –0.0113(2) | –0.0092(2) | –0.0081(2) | –0.0106(2) | 0 | 0 |
| y | –0.0486(3) | –0.0467(3) | –0.0473(3) | –0.0478(3) | –0.0013(3) | 0.0020(3) | |
| z | 0.2500 | 0.2500 | 0.2500 | 0.2500 | 0.3597(3) | 0.3601(3) | |
| x | Co/Ni | 0.5 | 0.5 | 0.5 | 0.5 | 0 | 0 |
| y | 0 | 0 | 0 | 0 | 0 | 0 | |
| z | 0 | 0 | 0 | 0 | 0 | 0 | |
| x | O1 | 0.0991(4) | 0.0904(4) | 0.0841(4) | 0.0808(4) | 0.2500 | 0.2500 |
| y | 0.5140(4) | 0.5119(4) | 0.5128(4) | 0.5143(4) | 0.2500 | 0.2500 | |
| z | 0.2500 | 0.2500 | 0.2500 | 0.2500 | 0.0193(3) | 0.0112(3) | |
| x | O2 | –0.2234(3) | –0.2221(3) | –0.2192(3) | –0.2146(3) | 0 | 0 |
| y | 0.1961(3) | 0.1924(3) | 0.2026(3) | 0.2038(3) | –0.0090(3) | –0.0198(3) | |
| z | 0.0400(3) | 0.0417(3) | 0.0412(3) | 0.0423(3) | 0.1798(3) | 0.1751(3) | |
Содержание кислорода в Sm1.5Ca0.5NiO4 – δ при комнатной температуре, определенное из данных по восстановлению в токе водорода и методом дихроматометрического титрования, составило 3.97 ± 0.01 и 3.96 ± 0.04 соответственно. Методом ТГА показано, что содержание кислорода слабо зависит от температуры во всем изученном интервале (рис. 2).
Рис. 2.
Температурные зависимости содержания кислорода в образцах Sm1.5Ca0.5NiO4 – δ и SmCo0.85Ni0.15O3 – δ.

Используя принцип электронейтральности и значение содержания кислорода в Sm1.5Ca0.5NiO4 – δ, можно рассчитать, что 42–44% ионов никеля имеют степень окисления 3+, остальные 2+. По-видимому, при таком соотношении ионов никеля в различных степенях окисления Ni3+/Ni2+ (среднее значение 2.42–2.44) происходит стабилизация структуры типа K2NiF4, в то время как недопированные кальцием “SmNi3+O3” и “Sm2Ni2+O4” в этих условиях не образуются.
Аналогично родственным кобальтсодержащим системам Sm2O3–MO–CoO (M = Ca, Sr) [25, 26, 31] замена стронция на кальций существенно уменьшает область гомогенности образующихся твердых растворов. Область гомогенности у Sm2 – ySryNiO4 – δ для тех же условий составляет 0.4 ≤ ≤ y ≤ 1 [3], тогда как у Sm2– yCayNiO4 – δ – 0.5 ≤ y ≤ ≤ 0.55. Это можно объяснить тем, что меньший по размеру в сравнении со стронцием ион кальция прочнее удерживает кислород в решетке, уменьшая пределы варьирования содержания кислорода. Последнее препятствует большему гетеровалентному замещению самария на кальций без изменения степени окисления 3d-переходного металла.
Все другие исследуемые образцы системы вне области гомогенности твердого раствора Sm2 –yCayNiO4 – δ были неоднофазными и, помимо последнего, содержали лишь исходные оксиды или твердый раствор CaO в Sm2O3 с узкой областью гомогенности. Диаграмма состояния системы 1/2 Sm2O3–CaO–NiO при 1100°С на воздухе была разделена на 5 фазовых полей (рис. 3).
Рис. 3.
Диаграмма состояния системы 1/2 Sm2O3–CaO–NiO при 1100°С на воздухе: 1 – Sm2O3 – δ, Sm1.5Ca0.5CoO4 – δ, NiO; 2 – Sm2– yCayNiO4 – δ (0.5 ≤ y ≤ 0.55), NiO; 3 – Sm1.45Ca0.55CoO4 – δ, NiO, CaO; 4 – Sm1.45Ca0.55CoO4 – δ, Sm1.9Ca0.1O3 – δ, CaO; 5 – Sm2– yCayNiO4 – δ (0.5 ≤ y ≤ 0.55), Sm2 –zCazO3 – δ (0 ≤ z ≤ 0.1).

Система 1/2 Sm2O3–CoO–NiO. Для определения фазовых отношений в системе 1/2 Sm2O3–CoO–NiO было синтезировано 13 образцов с различным составом.
Согласно РФА закаленных с 1100°С на воздухе образцов установлено образование единственного ряда твердых растворов SmCo1 – xNixO3 – δ с 0 < < x ≤ 0.15. Подобно незамещенному кобальтиту самария, рентгенограммы SmCo1 – xNixO3 – δ удовлетворительно описываются в рамках ромбической ячейки (пр. гр. Pbnm). На рис. 4 в качестве примера приведена рентгенограмма твердого раствора SmCo0.9Ni0.1O3 – δ, обработанная по методу Ритвельда (а), и модель его кристаллической структуры (б). Для всех однофазных образцов SmCo1 – xNixO3 – δ рассчитаны параметры элементарной ячейки (табл. 1).
Рис. 4.
Рентгенограмма образца SmCo0.9Ni0.1O3 – δ, обработанная по методу Ритвельда (a), и структурная модель элементарной ячейки SmCo1 – xNixO3 – δ (б).

Зависимость параметров элементарной ячейки от концентрации никеля в соответствии с правилом Вегарда является линейной (рис. 5).
Увеличение параметров и объема элементарной ячейки при увеличении содержания никеля позволяет предположить, что ионы никеля, или заметная их часть, находятся в степени окисления 2+. Действительно, ионные радиусы ионов Co3+ и Ni3+ довольно близки между собой (${{r}_{{{\text{N}}{{{\text{i}}}^{{{\text{3}} + }}}({{LS} \mathord{\left/ {\vphantom {{LS} {HS}}} \right. \kern-0em} {HS}})}}}$ = = 0.56/0.6 Å; ${{r}_{{{\text{C}}{{{\text{o}}}^{{{\text{3}} + }}}({{LS} \mathord{\left/ {\vphantom {{LS} {HS}}} \right. \kern-0em} {HS}})}}}$ = 0.545/0.61 Å [32]), в то время как радиус Ni2+ заметно больше (${{r}_{{{\text{N}}{{{\text{i}}}^{{{\text{2}} + }}}}}}$ = = 0.69 Å [32]).
Содержание кислорода в образце SmCo0.85Ni0.15O3 – δ, рассчитанное из данных по восстановлению, приведенное к комнатной температуре, составило 2.98 ± 0.01 и остается практически постоянным вплоть до 1100°C (рис. 2). Такой дефицит по кислороду свидетельствует о том, что по крайней мере треть всех ионов никеля имеет степень окисления 2+.
Таким образом, несмотря на близость ионных радиусов кобальта и никеля, узкая область гомогенности SmCo1 – xNixO3 – δ при замещении кобальта на никель (0 ≤ x ≤ 0.15) связана с тем, что даже допированный никелем кобальтит самария не проявляет большего увеличения дефицита по кислороду, и, следовательно, дополнительно вводимый никель не может понижать свою степень окисления до состояния 2+.
По результатам РФА всех исследуемых образцов, закаленных на комнатную температуру, диаграмма состояния системы 1/2 Sm2O3–CoO–NiO при 1100°С на воздухе была разделена на 3 фазовых поля (рис. 6).
ЗАКЛЮЧЕНИЕ
Фазовые равновесия в системах 1/2 Sm2O3–CaO–NiO и 1/2 Sm2O3–CoO–NiO изучены при температуре 1100°С на воздухе. Методом РФА установлено образование двух твердых растворов: Sm2– yCayNiO4 – δ (0.5 ≤ y ≤ 0.55) и SmCo1 – xNixO3 – δ (0 < х ≤ 0.15), обладающих ромбической структурой с пр. гр. Bmab и Pbnm соответственно.
Построены зависимости параметров элементарной ячейки от состава твердого раствора. Показано, что при увеличении степени замещения кобальта на никель в SmCo1 – xNixO3 – δ происходит монотонное увеличение параметров и объема элементарных ячеек. Значения содержания кислорода в образцах Sm1.5Ca0.5NiO4 – δ и SmCo0.85Ni0.15O3 – δ составили 3.97 ± 0.01 и 2.98+0.01 соответственно. Показано, что в обоих твердых растворах, как со структурой перовскита, так и в фазе Руддлесдена–Поппера типа K2NiF4, ионы никеля находятся в переменной степени окисления 3+ и 2+ в соизмеримых количествах.
Построены диаграммы состояния систем 1/2 Sm2O3–CaO–NiO и 1/2 Sm2O3–CoO–NiO.
Список литературы
Petric A., Huang P., Tietz F. Evaluation of La–Sr–Co–Fe–O Perovskites for Solid Oxide Fuel Cells and Gas Separation Membranes // Solid State Ionics. 2000. V. 135. № 1–4. P. 719–725.
Tsipis E.V., Kharton V.V. Electrode Materials and Reaction Mechanisms in Solid Oxide Fuel Cells: a Brief Review. III. Recent Trends and Selected Methodological Aspects // J. Solid State Electrochem. 2011. V. 15. № 5. P. 1007–1040.
Chaudhari V.N., Khandale A.P., Bhoga S.S. An Investigation on Strontium Doped Sm2NiO4 + δ Cathode for Intermediate Temperature Solid Oxide Fuel Cells // J. Power Sources. 2014. V. 248. P. 647–654.
Amow G., Davidson I.J., Skinner S.J. A Comparative Study of the Ruddlesden-Popper Series, Lan + 1NinO3n + 1 (n = 1, 2 and 3), for Solid-Oxide Fuel-Cell Cathode Applications // Solid State Ionics. 2006. V. 177. P. 1205–1210.
Michel C.R., Delgado E., Santillan G., Martínez A.H., Chavez-Chavez A. An Alternative Gas Sensor Material: Synthesis and Electrical Characterization of SmCoO3 // Mater. Res. Bull. 2007. V. 42. P. 84–93.
Tu H.Y., Takeda Y., Imanishi N., Yamamoto O. Ln1 – xSrxCoO3 (Ln = Sm, Dy) for the Electrode of Solid Oxide Fuel Cells // Solid Stare Ionics. 1997. V. 100. P. 283–288.
Takahashi S., Nishimoto S., Matsuda M., Miyake M. Electrode Properties of the Ruddlesden – Popper Series, Lan + 1NinO3n + 1 (n = 1, 2, and 3), as Intermediate-Temperature Solid Oxide Fuel Cells // J. Am. Ceram. Soc. 2010. V. 93. № 8. P. 2329–2333.
Murata A., Hai C., Matsuda M. Cathode Property and Thermal Stability of Pr and Nd Mixed Ni-Based Ruddlesden – Popper Oxide for Low-Temperature Operating Solid Oxide Fuel Cell // Mater. Lett. 2014. V. 136. P. 292–294.
Vibhu V., Rougier A., Nicollet C., Flura A., Grenier J.-C., Bassat J.-M. La2– xPrxNiO4 + δ as Suitable Cathodes for Metal Supported SOFCs // Solid State Ionics. 2015. V. 278. P. 32–37.
Tong X., Zhou F., Yang S., Zhong S., Wei M., Liu Y. Performance and stability of Ruddlesden – Popper La2NiO4 + δ Oxygen Electrodes under Solid Oxide Electrolysis Cell Operation Conditions // Ceram. Int. 2017. V. 43. № 14. P. 10927–10933.
Niwa E., Nakamura T., Mizusaki J., Hashimoto T. Analysis of Structural Phase Transition of Nd2NiO4 + δ by Scanning Thermal Measurement under Controlled Oxygen Partial Pressure // Thermochim. Acta. 2011. V. 523. № 1–2. P. 46–50.
Mauvy F., Lalanne C., Bassat J.M., Grenier J.C., Zhao H., Dordor P., Stevens Ph. Oxygen Reduction on Porous Ln2NiO4 + δ Electrodes // J. Eur. Ceram. Soc. 2005. V. 25. 2669–2672.
Черепанов В.А., Петров А.Н., Гримова Л.Ю., Новицкий Е.М. Термодинамические свойства системы La–Ni–O // Журн. физ. химии. 1983. Т. 57. № 4. С. 859–863.
Petrov A.N., Cherepanov V.A., Zuyev A.Yu., Zhukovsky V.M. Thermodynamic Stability of Ternary Oxides in Ln–M–O Systems (Ln = La, Pr, Nd; M = Co, Ni, Cu) // J. Solid State Chem. 1988. V. 77. № 1. P. 1–14.
Bannikov D.O., Cherepanov. V.A. Thermodynamic Properties of Complex Oxides in the La–Ni–O System // J. Solid State Chem. 2006. V. 179. № 8. P. 2721–2727.
Ha S.D., Otaki M., Jaramillo R., Podpirka A., Ramanathan S. Stable Metal–Insulator Transition in Epitaxial SmNiO3 Thin Films // J. Solid State Chem. 2012. V. 190. P. 233–237.
Colin J.P., Blakely K., Poltavets V.V. Low Temperature High-Pressure Synthesis of LnNiO3 (Ln = Eu, Gd) in Molten Salts // Solid State Sci. 2013. V. 17. P. 72–75.
Alonso J.A., Martínez-Lope M.J., Rasines I. Preparation, Crystal Structure, and Metal-to-Insulator Transition of EuNiO3 // J. Solid State Chem. 1995. V. 120. № 1. P. 170–174.
Falcóna H., Martínez-Lope M.J., Alonso J.A., Fierro J.L.G. Large Enhancement of the Catalytic Activity for CO Oxidation on Hole Doped (Ln, Sr)NiO3 (Ln = Pr, Sm, Eu) Perovskites // Solid State Ionics. 2000. V. 131. № 3–4. P. 237–248.
Li Q., Fan Y., Zhao H., Sun L.-P., Huo L.-H. Preparation and Electrochemical Properties of a Sm2 – xSrxNiO4 cathode for an IT-SOFC // J. Power Sources. 2007. V. 167. P. 64–68.
Cherepanov V.A., Barkhatova L.Yu., Petrov A.N. Phase Equilibria in the Ln–Mn–O System (Ln = Pr, Nd) and General Aspects of the Stability of the Perovskite Phase LnMeO3 // J. Phys. Chem. Solids. 1994. V. 55. № 3. P. 229–235.
Aksenova T.V., Vakhromeeva A.E., Elkalashy Sh.I., Urusova A.S., Cherepanov V.A. Phase Equilibria, Crystal Structure, Oxygen Nonstoichiometry and Thermal Expansion of Complex Oxides in the Nd2O3–SrO–Fe2O3 System // J. Solid State Chem. 2017. V. 251. P. 70–78.
Петров А.Н., Кропанев А.Ю., Жуковский В.М., Черепанов В.А., Неудачина Г.К. Условия и механизм твердофазного синтеза кобальтитов РЗЭ состава RCoO3 (R = La, Pr, Nd, Sm, Gd) // Журн. неорган. химии. 1981. Т. 26. № 12. С. 3190–3194.
Кропанев А.Ю., Петров А.Н., Жуковский В.М. Фазовые диаграммы систем Ln–Co–O (Ln = Sm, Eu, Gd, Tb, Dy, Ho) // Журн. неорган. химии. 1983. Т. 28. № 11. С. 2938–2943.
Galayda A.P., Volkova N.E., Gavrilova L.Ya., Cherepanov V.A. Phase equilibria, structure and properties of intermediate phases in the Sm2O3–Fe2O3–CoO and Sm2O3–CaO–CoO systems // J. Alloys Compd. 2017. V. 718. P. 288–297.
Wong-Ng W., Laws W., Lapidus S.H., Kaduk J.A. Phase Equilibria and Crystal Chemistry of the CaO–1/2Sm2O3–CoOz System at 885°C in Air // Solid State Sci. 2015. V. 48. P. 31–38.
Tu H.Y., Takeda Y., Imanishi N., Yamamoto O. Ln1– xSrx-CoO3 (Ln = Sm, Dy) for the Electrode of Solid Oxide Fuel Cells // Solid Stare Ionics. 1997. V. 100. P. 283–288.
Knop O., Sutarno R., Nakagawa Y. Chalkogenides of the Transition Elements. VI. X-Ray, Neutron, and Magnetic Investigation of the Spinels Co3O4, NiCo2O4, Co3S4, and NiCo2S4 // Can. J. Chem. 1968. V. 46. P. 3463–3476.
Wu Y.Q., Xiang Y.C., Ji P.T., Zhou Q.Q. Sol–Gel Approach for Controllable Synthesis and Electrochemical Properties of NiCo2O4 Crystals as Electrode Materials for Application in Supercapacitors // Electrochim. Acta. 2011. V. 56. P. 7517–7522.
Takayama E. Different Scanning Coulometric Titrometry: Application to the System Co–Ni–O at 1000°C // J. Solid State Chem. 1983. V. 50. P. 70–78.
Volkova N.E., Maklakova A.V., Gavrilova L.Ya., Cherepanov V.A. Phase Equilibria, Crystal Structure, and Properties of Intermediate Oxides in the Sm2O3–SrO–CoO System // Eur. J. Inorg. Chem. 2017. P. 3285–3292.
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides // Acta Crystallogr. 1976. V. 32. P. 751–767.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы




