Неорганические материалы, 2019, T. 55, № 6, стр. 623-627
Гидротермальный синтез пленок Cu2O на поверхности металлической меди в растворе NaOH
Д. С. Зимбовский 1, Б. Р. Чурагулов 1, А. Н. Баранов 1, *
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: anb@inorg.chem.msu.ru
Поступила в редакцию 05.10.2018
После доработки 27.11.2018
Принята к публикации 03.12.2018
Аннотация
Гидротермальной обработкой медной подложки в водных растворах NaOH различной концентрации получены пленки состава Cu2O на поверхности металлической меди и определены оптимальные параметры их формирования. Показано, что гидротермальная обработка медной пластины в 0.3 М растворе NaOH, насыщенном кислородом, при 180°С в течение 1 ч позволяет получать сплошные пленки Cu2O максимальной толщины на поверхности металлической меди.
ВВЕДЕНИЕ
Среди оксидных полупроводниковых материалов одним из наиболее перспективных является оксид меди(I), который представляет собой полупроводник p-типа с шириной запрещенной зоны 2.0–2.2 эВ. Cu2O в настоящее время рассматривают в качестве материала для газовых сенсоров, катализатора органического синтеза, дырочного слоя в современных солнечных элементах, а также как эффективный фотокатализатор разложения воды под действием солнечного света [1, 2].
Пленка оксида меди(I), полученная непосредственно на поверхности металлической меди, обладает хорошим контактом с подложкой, что повышает эффективность разделения зарядов, генерируемых под действием света, и стимулирует процесс фотоэлектрохимического разложения воды. При использовании пленок Cu2O в качестве фотокатализатора к ним предъявляются следующие требования: они должны обладать развитой поверхностью, быть равномерными по всей площади, иметь толщину более 1 мкм [3].
Пленки оксида меди(I) получают самыми разными способами: окислением металлической меди, восстановлением солей Cu2+ с помощью электроосаждения [4], спрей-пиролизом [5], растворными методами [6], включая гидротермальный [7, 8], химическим окислением с последующим термическим восстановлением [9] и т.д. Среди перечисленных методов можно отметить гидротермальный синтез, который позволяет путем варьирования давления, температуры, продолжительности процесса и pH раствора получать хорошо закристаллизованный продукт с необходимыми составом и морфологией.
Например, в работе [7] осуществлялась гидротермальная обработка медной пластины в присутствии солей двухвалентной меди: CuCl2, Cu(NO3)2, CuSO4. В результате окислительно-восстановительного взаимодействия между ионами Cu2+ и металлической медью на поверхности пластины образовывалась пленка состава Cu2O. Тип выбранного аниона влиял на морфологию получаемой пленки и, соответственно, на фотоактивность материала. Показано, что в случае применения хлорид-аниона образуются стержневидные структуры оксида меди(I), которые проявляют повышенную стабильность и фотокаталитическую активность. В работе [8] металлическую медь окисляли мягким окислителем, в качестве которого использовали оксид графена. Полученный композит, в состав которого входят восстановленный оксид графена, оксид меди(I) и металлическая медь, обладает повышенной устойчивостью к фотодеградации светопоглощающего слоя, однако непостоянство состава оксида графена может влиять на воспроизводимость данного метода.
В настоящей работе предложен гидротермальный метод получения пленок Cu2O на поверхности медных пластин в растворе NaOH без добавления дополнительных окисляющих агентов. В качестве окислителя выступает кислород, присутствующий непосредственно в растворе и в объеме газовой фазы гидротермальной ячейки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза пленок Cu2O на поверхности металлической меди в качестве подложки использовали медные пластины (марка М1, чистота 99.9%) с размерами 10 × 15 × 0.5 мм. Пластины предварительно очищали с использованием УЗ-ванн в течение 5 мин последовательно в следующих растворах: смеси изопропилового спирта и ацетона (1 : 1), 10%-ном растворе соляной кислоты, дистиллированной воде. Очищенные медные пластины закрепляли на фторопластовых подставках. Гидротермальный синтез проводили в растворах NaOH “ч. д. а.” с концентрациями от 0.05 до 3 моль/л (объем растворителя 35 мл) при температуре 180°С в течение 1 ч, степень заполнения ячейки составляла 70%.
Фазовый состав полученных образцов исследовали методами рентгенофазового анализа (РФА) и спектроскопии комбинационного рассеяния (КР). РФА проводили с помощью рентгеновского дифрактометра с вращающимся анодом Rigaku D/MAX 2500 (${{\lambda }_{{{\text{Cu}}{{K}_{\alpha }}}}}$ = 1.54178 Å). Спектры КР снимали с помощью КР-микроскопа Renishaw InVia с длиной волны лазера 514 нм (Ar, 20 мВт) и мощностью 50%. Снимки поверхности образцов получали на растровом электронном микроскопе (РЭМ) Supra 50 VP (LEO).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На изображениях РЭМ (рис. 1) видно, что после гидротермальной обработки медной пластины в растворе NaOH поверхность подложки покрывается пленкой, состоящей из кристаллов в форме различных полиэдров, средний размер которых увеличивался с ростом концентрации раствора в результате процесса рекристаллизации от 1.5 (0.05 М) до 4 мкм (3 М) [10].
Рис. 1.
Микрофотографии, полученные с помощью растрового электронного микроскопа: а – медная пластина после обработки в 0.3 М растворе NaOH, б – в 3 М растворе NaOH.

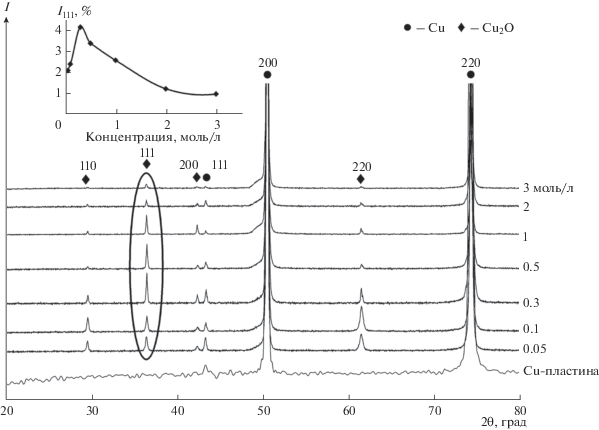
На рентгенограммах полученных образцов (рис. 2) присутствуют максимумы металлической меди (карточка JCPDS № 4-836), которые относятся к материалу подложки, а также максимумы кубической фазы Cu2O (карточка JCPDS № 78-2076). Интенсивности пиков фазы Cu2O увеличиваются с повышением концентрации NaOH от 0.05 до 0.3 М, достигая максимального значения, и далее уменьшаются при концентрациях от 0.5 до 3 М (см. вставку на рис. 2).
Рис. 2.
Рентгенограммы образцов, полученных после гидротермальной обработки медных пластин в растворах NaOH различной концентрации; на вставке – зависимость интенсивности пика 111 фазы Cu2O от концентрации раствора щелочи.
Метод КР-спектроскопии более чувствителен к небольшим количествам компонентов и позволяет детектировать примесные компоненты в образце, которые не удается определить РФА. Полученные спектры КР (рис. 3) содержат максимумы, соответствующие фононным модам Cu2O. Данные максимумы соответствуют КР-фононной моде $2\Gamma _{2}^{ - }$ (218 см–1), а также дипольным фононам $\Gamma _{{15}}^{{ - \left( 1 \right)}}$ (150 см–1) и $\Gamma _{{15}}^{{ - \left( 2 \right)}}$ (630 см–1), где $\Gamma _{{15}}^{{ - \left( 2 \right)}}$ является главной ионной модой кристалла. Пик при 413 см–1 связан с мультифононными процессами. Также на спектрах КР можно выделить максимум, соответствующий фононной моде Ag фазы CuO, но его интенсивность находится на уровне фона [11].
Рис. 3.
Спектры КР образцов, полученных после гидротермальной обработки медных пластин в растворах NaOH различной концентрации.

Согласно данным [12, 13], в процессе гидротермальной обработки металлической меди протекает несколько параллельных процессов:
окисления металлической меди кислородом
окисления-восстановления с участием гидроксид анионов
Из вышеприведенных уравнений видно, что количество образующейся фазы Cu2O зависит как от содержания кислорода в системе, так и от концентрации гидроксида натрия.
При синтезе образцов в растворах NaOH различной концентрации получена нелинейная зависимость количества образующейся фазы оксида меди(I) от концентрации щелочи, что связано с двумя конкурирующими процессами: ростом и растворением образовавшейся пленки. Количество фазы Cu2O увеличивается с ростом концентрации щелочи до 0.3 М. Дальнейшее увеличение концентрации NaOH приводит к уменьшению количества оксида вследствие образования растворимого комплекса ${\text{Cu}}\left( {{\text{OH}}} \right)_{4}^{{2 - }}$ [14]
Для подтверждения того, что окисляющим агентом в системе выступает растворенный кислород, были проведены опыты с двумя растворами 0.3 М NaOH. Через первый раствор пропускали в течение 30 мин ток кислорода, через второй – ток азота. Обнаружено, что во втором случае образуются только следовые количества оксидного слоя, а в первом случае с увеличением содержания кислорода в растворе NaOH увеличивается количество фазы оксида меди(I) на поверхности.
По микрофотографиям РЭМ (для образца, полученного в 0.3 М р-ре NaOH) было оценено количество образовавшегося оксида меди(I) (13 × × 10–6 моль) и сопоставлено со средним содержанием кислорода в ячейке, которое, согласно [15], приблизительно составляло 8 × 10–6 моль. Таким образом, толщина пленки может варьироваться в зависимости от растворенного или находящегося над водным раствором в гидротермальной ячейке количества кислорода.
ЗАКЛЮЧЕНИЕ
В работе показано, что гидротермальная обработка медной пластины в растворе NaOH позволяет получать прочные и сплошные пленки Cu2O на поверхности металлической меди. Наибольшее содержание фазы Cu2O на поверхности подложки достигается обработкой медной фольги при 180°С в течение 1 ч в 0.3 М растворе NaOH, насыщенном кислородом. При указанных параметрах синтеза образуются частицы в форме полиэдров со средним размером 2 мкм.
Список литературы
Saraswat S.K., Rodene D.D., Gupta R.B. Recent Advancements in Semiconductor Materials for Photoelectrochemical Water Splitting for Hydrogen Production Using Visible Light // Renew. Sustain. Energy Rev. 2018. V. 89. P. 228–248.
Gavrilov A.I., Balakhonov S.V., Gavrilova D.Yu., Churagulov B.R., Goodilin E.A. Hydrothermal Synthesis of Sodium and Potassium Titanates and Their Photocatalytic Properties in Water and Methanol / Water Splitting // Dokl. Chem. 2014. V. 455. № 1–2. P. 58–61.
Luo J., Steier L., Son M.K., Schreier M., Mayer M.T., Grätzel M. Cu2O Nanowire Photocathodes for Efficient and Durable Solar Water Splitting // Nano Lett. 2016. V. 16. № 3. P. 1848–1857.
Xi Q., Liu L., Gao G., Yang W., Zhou H., Wu C., Zhao Y., Wang L., Xu J. Shape Evolution of Cu2O Crystals Prepared by Surfactant-Free Electrodeposition // J. Electrochem. Soc. 2016. V. 163. № 7. P. 332–335.
Niu L., Kang Z. Spray Deposition Process to Fabricate Cu2O Superhydrophobic Surfaces on Brass Mesh for Efficient Oil-Water Separation // Mater. Lett. 2018. V. 210. P. 97–100.
Ho J.Y., Huang M.H. Synthesis of Submicrometer-Sized Cu2O Crystals with Morphological Evolution from Cubic to Hexapod Structures and Their Comparative Photocatalytic Activity // J. Phys. Chem. C. 2009. V. 113. № 32. P. 14159–14164.
Pan L., Zou J.J., Zhang T., Wang S., Li Z., Wang L., Zhang X. Cu2O Film via Hydrothermal Redox Approach: Morphology and Photocatalytic Performance // J. Phys. Chem. C. 2014. V. 118. № 30. P. 16335–16343.
Dong X., Wang K., Zhao C., Qian X., Chen S., Li Z., Liu H., Dou S. Direct Synthesis of RGO/Cu2O Composite Films on Cu Foil for Supercapacitors // J. Alloys Compd. 2014. V. 586. P. 745–753.
Зимбовский Д.С., Чурагулов Б.Р. Пленки Cu2O и CuO, полученные методами химического и анодного окисления на поверхности медной фольги // Неорган. материалы. 2018. Т. 54. № 7. С. 694–702.
Byrappa K., Masahiro Y. Handbook of Hydrothermal Technology. New Jersey: Noyes Publications, 2001. 870 p.
Deng Y., Handoko A.D., Du Y., Xi S., Yeo B.S. In Situ Raman Spectroscopy of Copper and Copper Oxide Surfaces during Electrochemical Oxygen Evolution Reaction: Identification of CuIII Oxides as Catalytically Active Species // ACS Catal. 2016. V. 6. № 4. P. 2473–2481.
Ganzha S.V., Maksimova S.N., Grushevskaya S.N., Vvedenskii A.V. Formation of Oxides on Copper in Alkaline Solution and Their Photoelectrochemical Properties // Prot. Met. Phys. Chem. Surf. 2011. V. 47. № 2. P. 191–202.
Vvedenskii A.V., Grushevskaya S.N., Ganzha S.V., Eliseev D. Copper Oxides: Kinetics of Formation and Semiconducting Properties. Part I. Polycrystalline Copper and Copper-Gold Alloys // J. Solid State Electrochem. 2014. V. 18. № 10. P. 2755–2770.
Giri S.D., Sarkar A. Electrochemical Study of Bulk and Monolayer Copper in Alkaline Solution // J. Electrochem. Soc. 2016. V. 163. № 3. P. 252–259.
Массовая концентрация растворенного кислорода в водах. Методика выполнения измерений йодометрическим методом: РД 52.24.419-2005: утв. заместителем руководителя Росгидромета 15.06.2005: ввод. в действие с 01.07.05.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


