Неорганические материалы, 2023, T. 59, № 4, стр. 384-393
Атомно-слоевое осаждение алюминий-молибденовых оксидных пленок с использованием триметилалюминия, оксотетрахлорида молибдена и воды
А. М. Максумова 1, И. С. Бодалёв 2, С. И. Сулейманов 1, Н. М.-Р. Алиханов 1, И. М. Абдулагатов 1, *, М. Х. Рабаданов 1, А. И. Абдулагатов 1
1 Дагестанский государственный университет
367000 Махачкала, ул. Гаджиева, 43-а, Россия
2 Санкт-Петербургский государственный технологический институт
190013 Санкт-Петербург, Московский пр., 24-26/49 лит. А, Россия
* E-mail: ilmutdina@gmail.com
Поступила в редакцию 13.01.2023
После доработки 28.02.2023
Принята к публикации 01.03.2023
- EDN: GMHSWK
- DOI: 10.31857/S0002337X2304005X
Аннотация
В работе продемонстрировано атомно-слоевое осаждение (АСО) алюминий-молибденовых оксидных пленок (AlxMoyOz) с использованием триметилалюминия (ТМА, Al(CH3)3), оксотетрахлорида молибдена (MoOCl4) и воды. Исследование процесса роста пленок осуществляли in situ с использованием кварцевых пьезоэлектрических микровесов и ex situ рентгеновскими методами анализа тонких пленок. АСО AlxMoyOz проводили с использованием суперциклов, состоящих из субциклов ТМА/H2O и MoOCl4/H2O. В работе получены два типа пленок, где соотношение субциклов составляло 1 : 1 (1Al1MoO) и 1 : 7 (1Al7MoO). При 150°C показана линейность роста пленок с постоянной роста 3.0 и 5.7 Å/суперцикл для 1Al1MoO и 1Al7MoO соответственно. Плотность полученных пленок составила 3.6 и 3.9 г/см3 для 1Al1MoO и 1Al7MoO соответственно, а шероховатость была в пределах 20 Å. Степень окисления молибдена в полученных пленках составляла 6+, 5+ и 4+. Рентгендифракционный анализ показал, что полученные пленки имели аморфную структуру.
ВВЕДЕНИЕ И ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Алюминий-молибденовые смешанные оксиды AlxMoyOz, их гетерогенные смеси/наноламинаты Al2O3–MoOx, молибдат алюминия Al2(MoO4)3 применяются или имеют перспективы применения в качестве твердофазных электролитов [1], пассивирующих промежуточных слоев в солнечных элементах [2, 3], катализаторов [4, 5], при создании цветных стекол для фотоэлектрических элементов [6], а также в качестве красящих пигментов для керамики [7]. Другой потенциальной областью применения AlxMoyOz-покрытий являются сухие смазки. Как и в случаях с твердыми растворами CuO–MoO3, ZnO–MoO3, Cs2O–MoO3 и др., пленки AlxMoyOz могут обеспечивать значительное снижение трения и износа при высоких температурах [8, 9].
Ранее тонкие пленки AlxMoyOz получали методом плазменно-стимулированного атомно-слоевого осаждения (ПС-АСО) с использованием триметилалюминия Al(CH3)3, бис-(трет-бутилимидо)-бис-(диметиламино)молибдена(VI) Mo(NtBu)2(NMe2)2 и O2 [10]. Метод АСО [11, 12] является одним из продвинутых методов получения высококонформных сложных оксидов типа AxByOz с заданным соотношением элементов, которое обеспечивается регулированием соотношения циклов обработки соответствующими прекурсорами [13]. Прецизионность данного метода достигается за счет самоограничивающихся поверхностных реакций, в результате которых формируются монослойные и субмонослойные атомарные слои нанопленки. В данной работе алюминий-молибденовые оксидные пленки получали методом термического АСО. В отличие от ПС-АСО в предложенном нами процессе рост пленки осуществляется за счет термически стимулированных поверхностных реакций без использования дорогостоящего источника плазмы. Использование в ПС-АСО оксидов О2 плазмы может привести к неконтролируемому окислению подложки и модификации границы раздела пленка/подложка из-за потока высокореакционных радикалов кислорода [14].
Предлагаемый способ роста AlхМоyOz можно представить как объединение двух процессов АСО Al2O3 и МоO3 в одном. Ранее для АСО Al2O3 в качестве прекурсора алюминия в основном применяли хлорид алюминия AlCl3, бромид алюминия AlBr3, хлорид диметилалюминия Al(CH3)2Cl, триметилалюминий Al(CH3)3, триэтилалюминий Al(C2H5)3, триэтоксид алюминия Al(OC2H5)3, триизопропилоксид алюминия Al(OiPr)3 в комбинации с O2, H2O или O3 [15]. Наиболее привлекательным и часто используемым прекурсором алюминия является триметилалюминий ввиду его высокой летучести, термической стабильности и высокой реакционной способности. В качестве прекурсоров молибдена в АСО ранее были использованы гексакарбонил молибдена Mo(CO)6 [16]; бис-этилбензол молибдена MoC16H20 [17]; диоксобис-(N,N'-диизопропилацетоамидинат) молибдена MoO2(iPr2amd)2) [18]; бис-(трет-бутилимидо)-бис-(диметиламино)молибден Mo(NtBu)2(NMe2)2 [19]; диоксобис-(2,2,6,6-тетраметилгептан-3,5-дионато)молибден MoO2(thd)2 [20]; диоксобис-(N,N'-третбутилацетоамидинато)молибден MoO2(tBuamd)2 [21] и оксотетрахлорид молибдена(VI) MoOCl4 [22] в комбинации с H2O, O3 и H2O + O3.
В данной работе в качестве прекурсоров алюминия использовали Al(CH3)3, молибдена – MoOCl4, кислорода – H2O. Целью работы является подтверждение применимости данных прекурсоров на основании исследования механизма поверхностных реакций и состава получаемых нанопленок. Комбинация данных прекурсоров для осаждения пленок AlxMoyOz используется впервые. Оксотетрахлорид молибдена привлекателен тем, что относительно легко переходит в газовую фазу сублимацией. Возможность получения АСО-пленок MoO3 с использованием MoOCl4 в комбинации с H2O былa ранее изучена в работax [22, 23].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
АСО оксидных пленок проводили на оборудовании компании OOO АСО НаноТех (г. Махачкала, Россия). Экспериментальная установка оборудована вакуумной камерой с горячими стенками, которая продувалась потоком инертного газа. АСО всех пленок проводили при 150°C. В качестве инертного газа использовали азот (ОСЧ, ООО “Гермес-газ”, 99.999%). Давление в реакторе поддерживалось около отметки 1.0 Торр. Чистота Al(CH3)3 (CAS номер 75241, Sigma-Aldrich) и MoOCl4 (CAS номер 13814750, Sigma-Aldrich) составляла ~97.0%. MoOCl4 загружали в контейнер для подачи реагента в перчаточном боксе в атмосфере аргона. Вода перед использованием подвергалась деионизации и дегазации. Во время АСО MoOCl4 грели до 60°C для достижения достаточного давления паров. Температура плавления MoOCl4 составляет 105°C [24]. Из литературных источников известно, что MoOCl4 термически нестабилен и при комнатной температуре медленно разлагается [25]. Несмотря на это, визуально изменения цвета прекурсора после нагревания в контейнере до 60°C не наблюдалось.
Мониторинг процесса роста пленок проводили в режиме реального времени (in situ) с использованием кварцевых пьезоэлектрических микровесов (КПМ) [26]. Разрешение КПМ по массе составляет ~0.3 нг/см2. Погрешности КПМ для каждой из точек в кривых насыщения прекурсоров рассчитывали по стандартным отклонениям не менее 10 измерений.
Для осаждения пленок в качестве подложек использовали кремниевые пластины Si(100) размером 1.5 × 1.5 см со слоем естественного оксида кремния толщиной ~20 Å. Перед использованием подложки последовательно очищали ацетоном, изопропанолом, деионизированной водой и высушивали в потоке N2 “ос. ч.”. До начала осаждения подложки выдерживали в реакционной камере в течение ~30 мин. До начала АСО AlxMoyOz поверхность кварцевого кристалла или кремниевой подложки Si(100) покрывали в том же реакторе пленкой АСО-Аl2O3 толщиной примерно 60 Å, для этого использовали триметилалюминий (ТМА) и H2O.
Данные рентгеновской рефлектометрии и рентгендифракционного анализа получены с помощью исследовательского комплекса Bruker D8 Discover (Bruker, Германия). Для моделирования слоев в составе пленок для рентгеновской рефлектометрии использован пакет программ Bruker Diffrac.Suite. Методом рентгеновской рефлектометрии была получена информация о толщине, плотности и поверхностной среднеквадратичной шероховатости (RMS) полученных пленок, а методом рентгендифракционного анализа – информация об их кристаллической структуре.
С помощью рентгеновской фотоэлектронной спектроскопии (РФЭС) исследован атомный состав и определена энергия связей элементов в пленке. РФЭС-данные получены с использованием комплексного спектрометра Escalab 250Xi (Thermo Fisher Scientific, Великобритания), снабженного монохроматическим AlKα-рентгеновским источником (1486.6 эВ), с энергией пропускания 100.0 эВ для обзорных спектров и 50.0 эВ для спектров высокого разрешения. Размер шага сканирования составлял 0.5 эВ для обзорных спектров и 0.1 эВ для спектров высокого разрешения. Все спектры были откалиброваны по пику С 1s с центром при 284.8 эВ. Разложение спектральных фотоэлектронных линий провели функцией Гаусса, фоновую составляющую вычитали методом Ширли. Удаление приповерхностного слоя ионами Ar+ до снятия спектров не проводили из-за возможной модификации химического состава пленок.
Время напуска и продувки прекурсоров во время одного АСО-суперцикла AlxMoyOz обозначали как τ1/τ2/τ3/τ4/τ5/τ6/τ7/τ8, где τ1 – время напуска паров TМА; τ2, τ4, τ6 τ8 – время продувки (30 с); τ3, τ7 – время напуска паров H2O; τ5 – время напуска паров MoOCl4. Соотношение субциклов TМА-H2O и MoOCl4–H2O в процессе АСО AlxMoyOz варьировали, меняя количество субциклов τ5/τ6/τ7/τ8 в суперцикле. Парциальные давления MoOCl4, TМА и H2O при времени напуска в течение 1.0 с составляли ~5, ~20 и ~70 мТорр соответственно.
Все термохимические расчеты проводили с использованием программы HSC Chemistry (Версия 9.0).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
АСО AlxMoyOz осуществляли за счет поверхностных реакций паров Al(CH3)3, MoOCl4 и H2O в заданной последовательности. Полученные пленки обозначили как 1Al1MoО и 1Al7MoO, где коэффициенты соответствуют количеству субциклов Al(CH3)3/H2O и MoOCl4/H2O в суперцикле. Для осаждения 1Al1MoО использовали восьмиступенчатый АСО-суперцикл, состоящий из последовательного напуска паров Al(CH3)3, H2O, MoOCl4, H2O и продувок между ними, как показано на рис. 1.
КПМ. На рис. 2 показаны КПМ-данные по изменению массы при напуске и продувке реагентов в процессе осаждения пленок 1Al1MoО при 150°C. Для данного процесса использовали параметры цикла 1/30/1/30/1/30/1/30, где Al(CH3)3, MoOCl4 и H2O напускали в течение 1.0 с, а время продувки было 30 с. Прирост массы после Al(CH3)3/H2O-субцикла составил 59.0 нг/см2, что почти вдвое выше прироста массы, наблюдаемого в процессе роста Al2O3 (~32.0 нг/см2) с использованием ТМА и Н2О при схожих условиях [27, 28].
Рис. 2.
Наблюдаемый при КПМ прирост массы при напуске реагентов в процессе АСО AlxMoyOz (1Al1MoО) для двух суперциклов.

Прирост массы оксида алюминия более чем в два раза превышает теоретический прирост массы для одного монослоя Al2O3, равный 26.4 нг/см2 и рассчитанный из уравнения
где М – молярная масса AlO3/2 (г/моль), σ – эффективная посадочная площадка для молекул ТМА (нм2), NA – число Авогадро (ат./моль). Эффективную посадочную площадку рассчитывали по формуле Брунауэра–Эмметта–Теллера где М – молярная масса TMA (г/моль), ρ – плотность жидкого ТМА (г/см3). Из уравнения (2) посадочная площадка ТМА равна 0.320 нм2.Экспериментально наблюдаемое значение прироста массы для Al2O3 отличается от теоретического в пределах 20%, что объяснимо ошибкой формулы Брунауэра–Эмметта–Теллера, не учитывающей конкретное количество и конфигурацию лигандов. Следовательно, в случае АСО Al2O3 присоединяется один монослой, а для АСО AlxMoyOz – два монослоя.
Прирост массы после MoOCl4/H2O-субцикла составил 48.0 нг/см2, что на ~41.0 нг/см2 выше значения прироста массы, наблюдаемого в процессе АСО MoO3 (7.0 нг/см2) с использованием MoOCl4 и H2O [29]. Однако данное значение (48 нг/см2) существенно меньше массы теоретического монослоя, рассчитанного из формулы (1): Δm(МоО3) = = 78.1 нг/см2 (MoOCl4, σ = 0.320 нм2), что говорит о субмонослойном режиме роста. Увеличение прироста массы за MoOCl4/H2O-субцикл может быть обусловлено увеличением количества реакционных поверхностных групп вследствие включения алюминий-оксидных слоев.
Согласно приведенной выше схеме (рис. 1), реакция алюминийметилированной поверхности с Н2О (реакция II) должна привести к замещению ‒СН3-групп на –ОН и, соответственно, к прибавке массы [26, 28], а в случае реакции поверхностных молибденоксохлоридных групп с Н2О (реакция IV) – к ее снижению. Из рис. 2 видно, что напуск ТМА или MoOCl4 приводит к приросту массы, а после напуска паров воды для случая Al(CH3)3/H2O не наблюдается ожидаемой прибавки массы, тогда как в случае MoOCl4/H2O происходит ее снижение примерно на 2 нг/см2.
Зависимость прироста массы, приходящегося на один суперцикл, от продолжительности напуска реагентов приведена на рис. 3. Данные эксперименты проведены для определения самонасыщаемости поверхностных реакций прекурсоров, что является необходимым условием АСО. Кривые насыщения для Al(CH3)3 или MoOCl4 получали, фиксируя время напуска H2O (2.0 с) и одного из прекурсоров металла (1.5 с). Прирост массы за цикл достигал насыщения уже при времени напуска паров Al(CH3)3 и MoOCl4 в течение примерно 1.0 с. Кривая насыщения для ТМА имеет самоограничивающийся характер, тогда как кривая насыщения MoOCl4 – менее идеальна. На рис. 3 также представлены результаты для поверхностной реакции H2O, полученные фиксированием времени напуска паров MoOCl4 и Al(CH3)3 в течение 1.5 с. Прирост массы за цикл достигал насыщения при времени напуска H2O в течение 1.0 с. Следовательно, поверхностная реакция H2O при рассмотренной температуре имеет самоограничивающийся характер. Время продувки прекурсоров во всех случаях составило 30 с.
Рис. 3.
Зависимости прироста массы за АСО-суперцикл AlxMoyOz от времени напуска паров TMA, MoOCl4 и H2O при 150°C.

Для увеличения относительного содержания молибдена в получаемых пленках АСО проводили с использованием одного субцикла Al(CH3)3/H2O и семи субциклов MoOCl4/H2O в суперцикле (пленки 1Al7MoО). На рис. 4 приведены данные КПМ для одного АСО-суперцикла 1Al7MoО, проводимого с временны́ми параметрами напуска и продувки 1/30/1/30/((1/30/3/30) × 7).
Рис. 4.
КПМ-данные прироста массы для одного суперцикла в процессе АСО AlxMoyOz (1Al7MoO) при 150°C.

Прирост массы после субцикла Al(CH3)3/H2O составил 57.0 нг/см2, а после семи MoOCl4/H2O-субциклов – 145.0 нг/см2, что соответствует массе примерно двух мономолекулярных слоев для обоих субциклов. Прирост массы после субцикла Al(CH3)3/H2O для 1Al7MoО на 2.0 нг/см2 ниже, чем в процессе АСО 1Al1MoO (59.0 нг/см2). Как видно из рис. 4, включение одного субцикла ТМА/Н2О после 7 субциклов MoOCl4/H2O позволяет значительно регенерировать реакционность поверхности и стимулировать рост слоя МоОх, который в противном случае имеет затухающий характер, как и на первых циклах в процессе АСО MoO3 на подложке Al2O3.
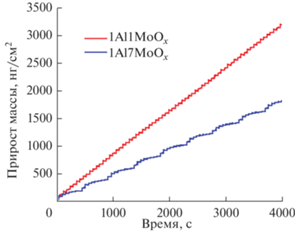
КПМ-данные зависимости прироста массы от времени (количества циклов) в процессе роста 1Al1MoО и 1Al7MoО при 150°C представлены на рис. 5. Видны линейность роста пленок с количеством АСО-циклов, а также высокая повторяемость процесса от цикла к циклу. Угол наклона линии прироста массы для 1Al1MoО выше и, соответственно, скорость роста пленки в данном случае выше, чем для 1Al7MoО.
Рис. 5.
Прирост массы в процессе роста AlхМоyOz-пленок с разным соотношением субциклов при устоявшемся режиме (после нуклеации).
Рентгеновская рефлектометрия и рентгендифракционный анализ пленок. На кремниевые подложки AlхМоyOz-пленки осаждали при температуре 150°C, где продолжительность напуска Al(CH3)3, MoOCl4 и H2O составляла 1.0 с, а продувки – 30 с. Все пленки осаждали на затравочном слое АСО-Al2O3, полученном при той же температуре после 50 циклов ТМА и Н2О. Затравочный слой использовали для улучшения нуклеации пленок.
Методом рентгеновской рефлектометрии определили постоянную роста пленок, которая составила 3.0 и 5.7 Å/суперцикл для 1Al1MoО и 1Al7MoО соответственно. Средняя плотность пленок 1Al1MoО составила 3.6 г/см3, а 1Al7MoО – 3.9 г/см3. Увеличение плотности пленок с повышением количества MoOCl4/H2O-субциклов объясняется повышением концентрации молибдена. Для сравнения плотность аморфной АСО-пленки MoO3, полученной при той же температуре с использованием MoOCl4 и Н2О, составляет 3.9 г/см3 [23], а АСО-пленки Al2O3 – примерно 3.0 г/см3 [30]. Исходя из этих значений вычислили расчетную плотность синтезированных пленок по правилу смесей:
(3)
${{\rho }_{{{\text{см}}}}} = 1{\text{/}}({{w}_{1}}{\text{/}}{{\rho }_{1}} + {{w}_{2}}{\text{/}}{{\rho }_{2}}),$РФЭС-анализ. Элементный состав полученных пленок определяли из обзорных РФЭС. Анализ пленки 1Al1MoO показал следующий состав (ат. %): Al – 26.00, Mo – 8.15, O – 65.85, С – 31.57, а пленки 1Al7MoO: Al – 19.76, Mo – 11.66, O – 68.58, С – 25.74. Содержание атомов хлора в пленках было ниже чувствительности прибора (<0.5 ат. %). Присутствие примесей углерода скорее всего обусловлено загрязнением поверхности образцов при контакте с воздухом в промежутке между осаждением и РФЭС-анализом. Увеличение количества субциклов MoOCl4/H2O от одного (1Al1MoО) до семи (1Al7MoО) привело к увеличению концентрации молибдена примерно в 1.4 раза.
Для обоих типов АСО-пленок содержание алюминия превышает содержание молибдена, следовательно, реальный механизм роста пленок AlxMoyOz отличается от предложенной программы синтеза, представленной на рис. 1. Используя основанное на правиле смесей уравнение, предложенное в работе [31]
(4)
$\begin{gathered} {{\chi }_{{{\text{КПМ}}}}} = {{n}_{{{\text{Mo}}}}}{\text{/}}\left( {{{n}_{{{\text{Al}}}}} + {\text{ }}{{n}_{{{\text{Mo}}}}}} \right) = \\ = \,\,1{\text{/}}\left( {1 + 2\left( {{{M}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}}{\text{/}}{{M}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}} \right)\left( {\Delta {{m}_{{sub{\text{,Al}} - {\text{O}}}}}{\text{/}}\Delta {{m}_{{sub{\text{,Mo}} - {\text{O}}}}}} \right)} \right), \\ \end{gathered} $(5)
$\begin{gathered} {{\chi }_{{{\text{КПМ}}}}} = {{n}_{{{\text{Mo}}}}}{\text{/(}}{{n}_{{{\text{Al}}}}}_{{}} + {{n}_{{{\text{Mo}}}}}) = 1{\text{/}}(1 + \\ + \,\,(2{{M}_{{{\text{Mo}}{{{\text{O}}}_{3}}}}}{\text{/}}{{M}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}})(\Delta {{m}_{{sub,{\text{Al}} - {\text{O}}}}} + \\ + \,\,\Delta {{m}_{{etch}}}_{{,{\text{Mo}} - {\text{O}}}}){\text{/(}}\Delta {{m}_{{sub}}}_{{,{\text{Mo}} - {\text{O}}}} - \Delta {{m}_{{etch}}}_{{,{\text{Mo}} - {\text{O}}}})), \\ \end{gathered} $(6)
$\begin{gathered} \Delta {{m}_{{etch{\text{,Mo}} - {\text{O}}}}} = \left( {\Delta {{m}_{{sub{\text{,Mo}} - {\text{O}}}}}({\text{1/}}{{\chi }_{{{\text{КПМ}}}}} - {\text{ }}1)} \right. \times \\ \times \left. {\,\,{{M}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{\text{/(}}2{{M}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}} - {\text{ }}\Delta {{m}_{{sub{\text{,Al}} - {\text{O}}}}}{\text{)}}} \right){\kern 1pt} {\text{/}}{\kern 1pt} \left( {\left( {1{\text{/}}{{\chi }_{{{\text{КПМ}}}}} - {\text{ }}1} \right) \times } \right. \\ \left. { \times \,\,{{M}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}/\left( {2{{M}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}} + {\text{ }}1} \right)} \right). \\ \end{gathered} $Для 1Al7MoO Δmetch,Mo–O = 18.8 нг/см2, что составляет 13% от общего количества присоединенного молибдена. Согласно уравнению реакции травления, стравливание оксида молибдена должно привести к образованию такого же количества оксида алюминия, масса которого составит 13.3 нг/см2. Общая масса синтезированного за суперцикл оксида алюминия будет равна ΔmAl = BΔmsub,Al–O + + Δmetch,Mo–O = 75.8 нг/см2, из которых 13.3 нг/см2 – за счет травления оксида молибдена, а остальное (62.5 нг/см2) – за счет традиционного АСО. Как видим, это значение только увеличилось по сравнению с приростом без травления и оно по-прежнему около двух монослоев. Таким образом, процесс конверсии (травления), хотя и позволяет понять отклонение χКПМ от χРФЭС, но не объясняет сверхмонослойный рост на субцикле оксида алюминия.
Для детального определения химического состояния молибдена в полученных пленках провели РФЭС-сканирование высокого разрешения в области спектральных линий 3d-уровня Мо. Для сравнения на рис. 6 приведен РФЭС для АСО-пленки МоО3 (на затравочном Al2O3), полученной при той же температуре с использованием MoOCl4 и Н2О. В спектре остовных уровней Mo 3d преобладает спин-орбитальный дублет Mo 3d3/2–Mo 3d5/2. Позиция пика Mo 3d5/2 с энергией связи 233.2 эВ находится в пределах литературных значений для МоО3, где Mo имеет степень окисления 6+ [38], что соответствует степени окисления молибдена в прекурсоре (MoOCl4).
Рис. 6.
РФЭС линии Mo 3d высокого разрешения с моделями для АСО-пленки MoO3, полученной при 150°C с использованием MoOCl4 и Н2О.

Спектральные данные и модели линий остовного уровня Mo 3d для 1Al1MoO и 1Al7MoO представлены на рис. 7а и 7б соответственно. Спектры данных пленок более сложные и состоят из суперпозиции пиков, характерных для оксида молибдена в различных степенях окисления. Для пленки 1Al1MoO (рис. 7а) два новых пика Mo 3d5/2 с энергиями связи 231.4 и 229.9 эВ отнесли к молибдену со степенями окисления 5+ [39, 40] и 4+ [40] соответственно. Расчет площади фотоэлектронных линий новых Mo3d-пиков показал, что относительная концентрация ионов Mo в степени окисления 4+ превышает значение для 5+.
Рис. 7.
РФЭС линии Mo 3d высокого разрешения с моделями для пленок 1Al1MoO (а) и 1Al7MoO (б), полученных при 150°C.

Для пленки 1Al7MoO (рис. 7б) два новых пика Mo 3d5/2 с энергиями связи 231.6 и 230.2 эВ также отнесли к молибдену со степенями окисления 5+ и 4+ соответственно [41]. В данном случае относительная концентрация Мо5+ выше концентрации Mo4+. Из рис. 7а и 7б видно, что с увеличением количества субциклов MoOCl4/Н2О в суперцикле относительная концентрация Мо6+ увеличивается в сравнении с Мо4+ и Мо5+. Относительная концентрация Мо6+ для обоих типов пленок может быть завышена из-за возможного окисления на воздухе [40] верхних слоев пленок.
РФЭС-сканы высокого разрешения, полученные в области энергий связи атомов алюминия (65–84 эВ, Al 2p) для 1Al1MoO и 1Al7MoO, показали синглетные пики с энергиями связи 74.6 и 74.75 эВ соответственно, что согласуется с данными [42] для Al2O3 и соответствует Al3+ в ТМА.
Частичное восстановление Mo6+ до Mo4+ и Mo5+ в процессе роста AlxMoyOz-пленок связано с восстановительной способностью ТМА. Восстановление катионов оксидов металлов в реакциях с TMA наблюдали и в ряде других работ [27, 34, 43, 44]. Так, восстановление Si4+ в составе SiO2 при реакции с газофазным ТМА в работе [34] связывали с тем, что метильные группы ТМА имеют меньшее значение электроотрицательности по сравнению с атомами кислорода, связанными с Si. Таким образом, ТМА помимо образования связей Mo–O–Al может способствовать восстановлению Mo6+. Термодинамические расчеты процессов восстановления MoO3 до MoO2 с участием CH4, являющегося побочным продуктом поверхностных реакций TMA и H2O (реакции I и II) (рис. 1), дали следующий результат: 4MoO3 + CH4(г.) → 4MoO2 + + CO2(г.) + 2H2O(г.), где ∆G (150°C) = –71.7 ккал, и/или 3MoO3 + CH4(г.) → 3MoO2 + CO(г.) + + 2H2O(г.), где ∆G (150°C) = –42.7 ккал. Данные расчеты показывают, что эти процессы возможны, однако из литературных данных известно, что процессы восстановления MoO3 метаном начинают протекать с выраженной интенсивностью только при достижении температуры реакционной среды ~700°C [42]. Другим путем восстановления MoO3, связанного с присутствием триметилалюминия в системе, может быть реакция 3MoO3 + 2Al(CH3)3(г.) → 3MoO2 + Al2O3 + 3C2H6(г.), где ∆G (150°C) = –301.1 ккал, что указывает на более выраженные восстановительные свойства ТМА по сравнению с CH4. Интересно, что данный процесс более термодинамически выгоден в сравнении с реакцией ТМА с Н2О: 3H2O(г.) + 2Al(CH3)3(г.) → → Al2O3 + 6CH4(г.), где ∆G (150°C) = –282.7 ккал.
Возможный механизм восстановления поверхностных молибденоксидных групп схематически представлен на рис. 8. Предположительно, восстановление Mo6+ до Mo4+ в результате реакции с ТМА осуществляется за счет параллельно происходящих процессов: образования ковалентной связи по донорно-акцепторному механизму между терминальным кислородом Mo=O: и атомом алюминия в ТМА, отщепления поверхностной ОН-группы от молибдена и ее присоединения к Al, отщепления СН3-лигандов ТМА и их рекомбинации в молекулы C2H6. Механизм дополняется реакцией замещения между ТМА и поверхностными OH-группами с выделением CH4.
По предложенному выше механизму во время стадии напуска ТМА может появиться ОН-группа, которая открывает возможность обеспечения хемосорбции дополнительной молекулы ТМА, за счет чего почти вдвое может увеличиться прибавка массы, что и наблюдалось на КПМ (рис. 2 и 4). Oценить эту возможность количественно можно с использованием уравнения (4). Если предположить, что на ТМА/Н2О-субцикле наряду с присоединением оксида алюминия происходит восстановление оксида молибдена, в результате которого он теряет атомы кислорода в количестве Δmred,O (нг/см2), то уравнение (4) примет вид:
(7)
$\begin{gathered} {{\chi }_{{{\text{КПМ}}}}} = {{n}_{{{\text{Mo}}}}}{\text{/(}}{{n}_{{{\text{Al}}}}}_{{}} + {{n}_{{{\text{Mo}}}}}) = 1{\text{/}}(1 + \\ + \,\,(2{{M}_{{{\text{Mo}}{{{\text{O}}}_{3}}}}}{\text{/}}{{M}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}})(\Delta {{m}_{{sub}}}_{{,{\text{Al}} - {\text{O}}}} + \\ + \,\,\Delta {{m}_{{red}}}_{{{\text{,O}}}}){\text{/}}(\Delta {{m}_{{sub}}}_{{,{\text{Mo}} - {\text{O}}}})), \\ \end{gathered} $(8)
$\begin{gathered} \Delta {{m}_{{red}}}_{{{\text{,O}}}} = \Delta {{m}_{{sub}}}_{{,{\text{Mo}} - {\text{O}}}}\left( {1{\text{/}}{{\chi }_{{{\text{КПМ}}}}} - {\text{ }}1} \right) \times \\ \times \,\,({{M}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}{\text{/}}(2{{M}_{{{\text{Mo}}{{{\text{O}}}_{3}}}}}) - \Delta {{m}_{{sub}}}_{{,{\text{Al}} - {\text{O}}}}. \\ \end{gathered} $Для 1Al7MoO Δmred,О = 30.1 нг/см2 или 1.88 нмоль/см2. Согласно уравнению реакции восстановления, на каждые 3 моля триоксида молибдена, восстановленного до диоксида, образуется 1 моль оксида алюминия. Таким образом, по реакции восстановления должно образоваться 0.63 нмоль/см2 (63.9 нг/см2) оксида алюминия. Общая же масса синтезированного за суперцикл оксида алюминия будет равна ΔmAl = BΔmsub,Al-O + + Δmred,O = 87.1 нг/см2. Таким образом, на традиционное АСО Al2O3 остается 23.2 нг/см2, что находится в пределах мономолекулярного слоя, тогда как сверхмонослойный рост происходит по реакции восстановления, в ходе которой OH-группы не расходуются.
Таким образом, процесс восстановления оксида молибдена ТМА позволяет объяснить как отклонение χКПМ от χРФЭС, так и сверхмонослойный рост на субцикле оксида алюминия. Следует, однако, отметить, что расчетное количество восстановленного за суперцикл триоксида молибдена (1.88 нмоль/см2) превышает его наличное количество, присоединяемое за семь Mo-полуциклов (145 нг/см2, что соответствует 1.01 нмоль/см2). Это противоречие может объясняться либо более глубоким восстановлением (до степени окисления 2+, которая в природе встречается редко и не обнаружена в РФЭС, что легко объяснить окислением на воздухе), либо уменьшением числа OH-групп в ходе Al-субцикла (в данном случае влияние этого процесса на изменение массы сопоставимо с влиянием восстановления). В любом случае можно утверждать, что процесс восстановления молибдена ТМА согласуется со всеми имеющимися наблюдениями на полуколичественном уровне.
ЗАКЛЮЧЕНИЕ
Таким образом, в данной работе с привлечением известных физико-химических подходов к выбору прекурсоров и режимов процесса АСО разработана новая программа синтеза алюминий-молибденовых оксидных пленок с использованием ТМА, оксотетрахлорида молибдена и воды. Полученные пленки были исследованы in situ и ex situ с привлечением комплекса современных методов анализа. Пленки имели аморфную структуру. In situ-мониторинг роста пленок показал высокую реакционную способность MoOCl4 в процессах роста AlxMoyOz и перспективность его использования для получения других смешанных оксидов.
Анализ КПМ-данных показал, что в процессах 1Al1MoO и 1Al7MoO в каждом суперцикле к поверхности присоединяются два алюминийоксидных монослоя, а присоединение молибденоксидных слоев происходит в субмонослойном режиме для процесса 1Al1MoO и сопровождается присоединением двух мономолекулярных молибденоксидных слоев для 1Al7MoO.
Анализ РФЭС-данных полученных пленок указывает на частичное восстановление Mo6+ до Mo5+ и Mo4+ в процессе роста пленки, что связано с восстановительной способностью ТМА.
Анализ данных рентгеновской рефлектометрии показал, что плотности и постоянные роста для полученных пленок имели значения, близкие к ожидаемым, рассчитанным с использованием РФЭС и КПМ-данных соответственно.
Выявленные закономерности формирования алюминий-молибденовых оксидных пленок на поверхности кремниевой подложки могут способствовать пониманию процессов “конверсии” и окислительно-восстановительных процессов, связанных с присутствием ТМА в реакционной системе, а также более детальному анализу ростовых характеристик процессов АСО многокомпонентных оксидных пленок.
Список литературы
Matsumoto Y., Shimanouchi R. Synthesis of Al2(MoO4)3 by Two Distinct Processes, Hydrothermal Reaction and Solid-State Reaction // Procedia Eng. 2016. V. 148. P. 158–162. https://doi.org/10.1016/j.proeng.2016.06.507
Davis B.E., Strandwitz N.C. Aluminum Oxide Passivating Tunneling Interlayers for Molybdenum Oxide Hole-Selective Contacts // IEEE J. Photovolt. 2020. V. 10. № 3. P. 722–728. https://doi.org/10.1109/jphotov.2020.2973447
Chowdhury S., Khokhar M.Q., Pham D.Ph., Yi J. Al2O3/MoOx Hole-Selective Passivating Contact for Silicon Heterojunction Solar Cell // ECS J. Solid State Sci. Technol. 2022. V. 11. № 1. P. 015004. https://doi.org/10.1149/2162-8777/ac4d83
Харлампова Р.Н., Зайдман Н.М., Плясова Л.М., Мипова Л.П., Нагаева Л.А., Шкарин А.В. Дисперсность активного компонента в алюмомолибденовых катализаторах // Кинетика и катализ. 1973. Т. 14. № 6. С. 1538–1543.
Haber J. The Role of Molybdenum in Catalysi. London: Climax Molybdenum Co, 1981. P. 479.
Gasonoo A., Ahn H.-S., Jang E.-J., Kim M.-H., Gwag J.S., Lee J.-H., Choi Y. Fabrication of Multi-Layer Metal Oxides Structure for Colored Glass // Materials. 2021. V. 14. P. 2437. https://doi.org/10.3390/ma14092437
Dondi M., Matteucci F., Baldi G., Barzanti A., Cruciani G., Zama I., Bianchi C.L. Gray–Blue Al2O3–MoOx Ceramic Pigments: Crystal Structure, Colouring Mechanism and Performance // Dyes Pigm. 2008. V. 76. № 1. P. 179–186. https://doi.org/10.1016/j.dyepig.2006.08.021
Erdemir A. A Crystal-Chemical Approach to Lubrication by Solid Oxides // Tribol. Lett. 2000. V. 8. № 2–3. P. 97–102. https://doi.org/10.1023/A:1019183101329
Erdemir A. A Crystal Chemical Approach to the Formulation of Self-Lubricating Nanocomposite Coatings // Surf. Coat. Technol. 2005. V. 200. № 5–6. P. 1792–1796. https://doi.org/10.1016/j.surfcoat.2005.08.054
Vitale S.A., Hu W., D’Onofrio R., Soares T., Geis M.W. Interface State Reduction by Plasma-Enhanced ALD of Homogeneous Ternary Oxides // ACS Appl. Mater. Interfaces. 2020. V. 12. № 38. P. 43250–43256. https://doi.org/10.1021/acsami.0c11882
Кольцов С.И., Алесковский В.Б. Некоторые закономерности реакций МН // Тез. докл. Науч.-техн. конф. ЛТИ им. Ленсовета. Ленинград. 1965. С. 67.
Малыгин А.А. С.И. Кольцов – главный создатель метода молекулярного наслаивания // Сб. тез. докл. III Междунар. семинара “Атомно-слоевое осаждение: Россия, 2021”. Санкт-Петербург. 2021. С. 13–14.
Mackus A.J.M., Schneider J.R., MacIsaac C., Baker J.G., Bent S.F. Synthesis of Doped, Ternary, and Quaternary Materials by Atomic Layer Deposition: A Review // Chem. Mater. 2019. V. 31. № 4. P. 1142–1183. https://doi.org/10.1021/acs.chemmater.8b02878
Profijt H.B., Potts S.E., Van de Sanden M.C.M., Kessels W.M.M. Plasma-Assisted Atomic Layer Deposition: Basics, Opportunities, and Challenges // Vac. Sci. Technol. A. 2011. V. 29. № 5. P. 050801. https://doi.org/10.1116/1.3609974
Ponraj J.S., Attolini G., Bosi M. Review on Atomic Layer Deposition and Applications of Oxide Thin Films // Crit. Rev. Solid State Mater. Sci. 2013. V. 38. № 3. P. 203–233. https://doi.org/10.1080/10408436.2012.736886
Diskus M., Nilsen O., Fjellva H. Growth of Thin Films of Molybdenum Oxide by Atomic Layer Deposition // J. Mater. Chem. 2011. V. 21. P. 705–710. https://doi.org/10.1039/C0JM01099E
Drake T.L., Stair P.C. Vapor Deposition of Molybdenum Oxide Using Bis(ethylbenzene) Molybdenum and Water // Vac. Sci. Technol. A. 2016. V. 34. P. 051403. https://doi.org/10.1116/1.4959532
Jurca T., Peters A.W., Mouat A.R., Farha O.K., Hupp J.T., Lohr T.L., Delferro M., Marks T.J. Second-Generation Hexavalent Molybdenum Oxo-Amidinate Precursors for Atomic Layer Deposition // Dalton Trans. 2017. V. 46. P. 1172–1178. https://doi.org/10.1039/C6DT03952A
Vos M.F.J., Macco B., Thissen N.F.W., Bol A.A., Kessels W.M.M. Atomic Layer Deposition of Molybdenum Oxide from (NtBu)2(NMe2)2Mo and O2 Plasma // Vac. Sci. Technol. A. 2016. V. 34. P. 01A103. https://doi.org/10.1116/1.4930161
Mattinen M., King P.J., Khriachtcheva L., Heikkilä M.J., Fleming B., Rushworth S., Mizohatac K., Meinander K., Räisänen J., Ritala M., Leskelä M. Atomic Layer Deposition of Crystalline Molybdenum Oxide Thin Films and Phase Control by Post-Deposition Annealing // Mater. Today Chem. 2018. V. 9. P. 17–27. https://doi.org/10.1016/j.mtchem.2018.04.005
Mouat A.R., Mane A.U., Elam J.W., Delferro M., Marks T.J., Stair P.C. Volatile Hexavalent Oxo-Amidinate Complexes: Molybdenum and Tungsten Precursors for Atomic Layer Deposition // Chem. Mater. 2016. V. 28. № 6. P. 1907–1919. https://doi.org/10.1021/acs.chemmater.6b00248
Kvalvik J.N., Borgersen J., Hansen P.-A., Nilsen O. Area-Selective Atomic Layer Deposition of Molybdenum Oxide // Vac. Sci. Technol. A. 2020. V. 38. P. 042406. https://doi.org/10.1116/6.0000219#suppl
Maksumova A.M., Abdulagatov I.M., Palchaev D.K., Rabadanov M.Kh., Abdulagatov A.I. Studying the Atomic Layer Deposition of Molybdenum Oxide and Titanium–Molybdenum Oxide Films Using Quartz Crystal Microbalance // Russ. J. Phys. Chem. A. 2022. V. 96. № 10. P. 2206–2214. https://doi.org/10.31857/S0044453722100181
Haynes W.M. CRC Handbook of Chemistry and Physics. 95ed. Boca Raton: CRC, 2014. P. 4–77.
Pershina V., Fricke B. Group 6 Oxychlorides MOCl4, where M = Mo, W, and Element 106 (Sg): Electronic Structure and Thermochemical Stability // Russ. J. Phys. Chem. 1995. V. 99. № 1. P. 144–147.
Elam J.W., Groner M.D., George S.M. Viscous Flow Reactor with Quartz Crystal Microbalance for Thin Film Growth by Atomic Layer Deposition // Rev. Sci. Instrum. 2002. V. 73. № 8. P. 2981–2987. https://doi.org/10.1063/1.1490410
Абдулагатов А.И., Максумова А.М., Палчаев Д.К., Рабаданов М.Х., Абдулагатов И.М. Атомно-слоевое осаждение и термические превращения алюминий-ванадиевых оксидных тонких пленок // ЖОХ. 2022. Т. 92. № 8. С. 1310–1324. https://doi.org/10.31857/S0044460X22080182
Wind R.A., George S.M. Quartz Crystal Microbalance Studies of Al2O3 Atomic Layer Deposition Using Trimethylaluminum and Water at 125°C // J. Phys. Chem. A. 2010. V. 114. № 3. P. 1281–1289. https://doi.org/10.1021/jp9049268
Максумова А.М., Абдулагатов И.М., Палчаев Д.К., Рабаданов М.Х., Абдулагатов А.И. Исследование процесса атомно-слоевого осаждения оксида молибдена и титан-молибденовых оксидных пленок методом кварцевого пьезоэлектрического микровзвешивания // ЖФХ. 2022. Т. 96. № 10. С. 1490–1498. https://doi.org/10.31857/S0044453722100181
Groner M.D., Fabreguette F.H., Elam J.W., George S.M. Low-Temperature Al2O3 Atomic Layer Deposition // Chem. Mater. 2004. V. 16. № 4. P. 639–645. https://doi.org/10.1021/cm0304546
Larsson F., Keller J., Primetzhofer D., Riekehr L., Edoff M., Törndahl T. Atomic Layer Deposition of Amorphous Tin-Gallium Oxide Films // J. Vac. Sci. Technol. A. 2019. V. 37. № 3. P. 030906. https://doi.org/10.1116/1.5092877
Mackus A.J.M., Schneider J.R., MacIsaac C., Baker J.G., Bent S.F. Synthesis of Doped, Ternary, and Quaternary Materials by Atomic Layer Deposition: A Review // Chem. Mater. 2019. V. 31. № 4. P. 1142–1183. https://doi.org/10.1021/acs.chemmater.8b02878
Myers T.J., Cano A.M., Lancaster D.K., Clancey J.W., George S.M. Conversion Reactions in Atomic Layer Processing with Emphasis on ZnO Conversion to Al2O3 by Trimethylaluminum // J. Vac. Sci. Technol. A. 2021. V. 39. № 2. P. 021001. https://doi.org/10.1116/6.0000680
DuMont J.W., Marquardt A.E., Cano A.M., George S.M. Thermal Atomic Layer Etching of SiO2 by a “Conversion-Etch” Mechanism Using Sequential Reactions of Trimethylaluminum and Hydrogen Fluoride // ACS Appl. Mater. Interfaces. 2017. V. 9. № 11. P. 10296–10307. https://doi.org/10.1021/acsami.7b01259
Coll M., Napari M. Atomic Layer Deposition of Functional Multicomponent Oxides // Apll. Mater. 2019. V. 7. № 11. P. 110901. https://doi.org/10.1063/1.5113656
Абдулагатов А.И., Максумова А.М., Палчаев Д.К., Рабаданов М.Х., Абдулагатов И.М. Атомно-слоевое осаждение и термические превращения титан-ванадиевых оксидных тонких пленок // ЖПХ. 2021. Т. 94. № 7. С. 835–848. https://doi.org/10.1134/S1070427221070053
Roessler B., Kleinhenz S., Seppelt K. Pentamethylmolybdenum // Chem. Commun. 2000. V. 12. P. 1039–1040. https://doi.org/10.1039/B000987N
Plyuto Yu.V., Babich I.V., Plyuto I.V., Van Langeveld A.D., Moulijn J.A. XPS Studies of MoO3/Al2O3 and MoO3/SiO2 Systems // Appl. Surf. Sci. 1997. V. 119. № 1–2. P. 11–18.
Clayton C.R., Lu Y.C. Electrochemical and XPS Evidence of the Aqueous Formation of Mo2O5 // Surf. Interface. 1989. V. 14. № 1–2. P. 66–70.
Choi J.G., Thompson L.T. XPS Study of As-Prepared and Reduced Molybdenum Oxides // Appl. Surf. Sci. 1996. V. 93. № 2. P. 143–149. https://doi.org/10.1063/1.370690
Baltrusaitis J., Mendoza-Sanchez B., Fernandez V., Veenstra R., Dukstiene N., Roberts A., Fairley N. Generalized Molybdenum Oxide Surface Chemical State XPS Determination via Informed Amorphous Sample Model // Appl. Surf. Sci. 2015. V. 326. P. 151–161. https://doi.org/10.1016/j.apsusc.2014.11.077
NIST Standard Reference Database.
Bellenger F., Houssa M., Delabie A., Afanasiev V., Conard T., Caymax M., Meuris M., Meyer K.De., Heyns M.M. Passivation of Ge(100)/GeO2/high-k Gate Stacks Using Thermal Oxide Treatments // J. Electrochem. Soc. 2008. V. 155. № 2. P. G33–G38. https://doi.org/10.1149/1.2819626
Abdulagatov A.I., Sharma V., Murdzek J.A., Cavanagh A.S., George S.M. Thermal Atomic Layer Etching of Germanium-Rich SiGe Using an Oxidation and “Conversion-Etch” Mechanism // J. Vac. Sci. Technol. A. 2021. V. 39. № 2. P. 022602. https://doi.org/10.1116/6.0000834
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы




