Расплавы, 2022, № 4, стр. 418-429
Электровосстановление смесей хлорида никеля(II) и фторида кобальта(II) в термоактивируемом химическом источнике тока
О. В. Волкова a, *, В. В. Захаров a, Е. А. Ильина a, Б. Д. Антонов a, А. А. Панкратов a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: olga@ihte.uran.ru
Поступила в редакцию 10.03.2022
После доработки 24.03.2022
Принята к публикации 04.04.2022
- EDN: UCUNOH
- DOI: 10.31857/S0235010622040107
Аннотация
Исследованы разрядные характеристики элементов термоактивируемого химического источника тока (ТХИТ), содержащих в качестве положительного электрода смеси NiCl2–CoF2. Установлено, что использование смесей вместо чистого хлорида никеля позволяет снизить температуру разряда элемента ТХИТ без потери мощностных характеристик. Минимальная температура фиксации устойчивого разрядного плато 460°С. Максимальная емкость разрядного плато составляет 0.3 А ⋅ ч ⋅ г–1. Определены состав и морфология продуктов восстановления исследуемых катодных материалов. Установлено, что в процессе разряда элемента ТХИТ происходит восстановление исходных хлорида никеля и фторида кобальта до металлов. Процесс восстановления сопровождается диффузией галогенидов лития из сепаратора в катодное пространство. Восстановленные металлы (Ni, Co) образуют сеть разветвленных дендритов, покрытых солевой пленкой на основе галогенидов лития. Температура плавления солевой фракции продуктов восстановления для катодов, содержащих 10–20 мас. % CoF2, составляет 460–470°С. В зоне катодной реакции в состав расплава солевой фракции входят активные компоненты катода, образуя твердые растворы и смесь комплексных соединений системы Li, Ni, Co||Cl, Br, F. Показано, что процесс восстановления ионов переходных металлов до металлов протекает по расплавному механизму в режиме диффузионной кинетики.
ВВЕДЕНИЕ
Современные устройства спецназначения нуждаются в компактных энергоустановках, обладающих высокой мощностью, способных работать в широком диапазоне климатических условий и адаптированных к значительным механическим нагрузкам. Среди всего многообразия генераторов энергии, термоактивируемые химические источники тока (ТХИТ) наиболее соответствуют предъявляемым требованиям [1–12]. Данные источники работоспособны при температуре окружающей среды от –60 до +60°С, устойчивы к воздействию внешних электромагнитных полей и механическим нагрузкам (линейное ускорение до 20 000 g, скорость вращения до 12 000 об./мин.). Наиболее распространенными ТХИТ являются сульфидные батареи на основе систем Li–Al/FeS2; Li–Si/FeS2. Однако, их эксплуатационная удельная энергоемкость не превышает 30 Вт ⋅ ч ⋅ кг–1. Это обусловлено низким коэффициентом использования электродных компонентов и повышенными требованиями безопасности к конструкционным материалам, из-за высокой коррозионной активности FeS2. Потенциал тугоплавких сплавов Li–Al, Li–Si близок к металлическому литию, а их емкость, при содержание лития порядка 50%, достигает 0.8 и 1.5 А ⋅ ч ⋅ г–1 соответственно. Однако, вследствие того, что электрические характеристики Li–Al и Li–Si определяются скоростью диффузии лития по твердой фазе сплава, на практике данные аноды работоспособны лишь при сравнительно низких плотностях тока (1–4 кА ⋅ м–2). Разрядные кривые ТХИТ на основе выше указанных анодных материалов имеют тенденцию к быстрому снижению рабочего напряжения из-за образования на границе сплавов с сепаратором соединений с меньшим содержанием лития.
Положительный электрод сульфидных ТХИТ обладает относительно низкой стоимостью и достаточно высокой теоретической емкостью (0.89 А ⋅ ч ⋅ г–1 для суммарной электрохимической реакции FeS2 → Fe). Но практическое применение ограничено лишь стадией FeS2 → Li3Fe2S4, которой соответствует теоретическая емкость 0.33 А ⋅ ч ⋅ г–1. Это обусловлено существенным уменьшением напряжения разряда на последующих стадиях восстановления дисульфида железа. Попытки улучшить электрические характеристики сульфидных ТХИТ за счет введения в катодное пространство электролита, деполяризаторов и электронпроводящих добавок, приводит к дополнительному снижению удельной энергоемкости батареи.
Для реализации удельной энергоемкости свыше 30 Вт ⋅ ч ⋅ кг–1, используют ТХИТ на основе электрохимической пары LiB–NiCl2. К несомненным преимуществам данных ТХИТ относятся высокая емкость литий–борного композита (до 2.5 А ⋅ ч ⋅ г–1), возможность снимать плотности тока до 20 кА ⋅ м–2, а также технологичность электродных материалов. Максимальный коэффициент использования литий–борного композита, в интервале 200–350°С в нитратных расплавах, слабо зависит от температуры и составляет 80–90% при плотности тока 0.2 А ⋅ см–2 [13]. При дальнейшем росте скорости разряда, вплоть до 2 А ⋅ см–2, наблюдается незначительный спад коэффициента использования до 75–80%. Хлорид никеля обладает высокими значениями плотности токов обмена [14] и достаточно низкой коррозионной активностью. Теоретическая емкость хлорида никеля существенно ниже емкости анодного материала, и составляет 0.413 А ⋅ ч ⋅ г–1. Однако, благодаря высокому коэффициенту использования (до 80% от теоретической емкости), позволяет хлориду никеля успешно конкурировать с сульфидными катодами (FeS; FeS2).
Для повышения мощности батареи ТХИТ на основе хлорида никеля(II), в катодный материал вводят оксидные добавки (V2O3, MoO3) [9, 12, 15]. Данные добавки способствуют стабилизации и повышению напряжения разрядных кривых, но снижают удельную энергоемкость катода, так как не участвуют в токообразующей реакции.
Поэтому представляет интерес поиск катодных материалов, состоящих лишь из активных компонентов и позволяющих реализовать высокие электрические характеристики. Ранее нами были исследованы катодные материалы на основе смесей NiCl2–CoCl2. Было установлено, что рассматриваемые катодные материалы позволяют получать разрядные плато при более низких температурах без потери удельных мощностных характеристик. Однако, в процессе разряда элементов ТХИТ наблюдалась диффузия хлоридов переходных металлов и продуктов их восстановления из катода в электролит. Это явление может оказывать негативное влияние при продолжительных временах работы ТХИТ, вследствие деградации электролита.
В данной работе проведено исследование разрядных характеристик и продуктов восстановления элементов ТХИТ на основе смесей хлорида никеля(II) и фторида кобальта(II). Обладая более низкой растворимостью, чем хлориды, фториды переходных металлов способны образовывать пассивационную пленку на границе катода с сепаратором, препятствуя растворению активных катодных компонентов в электролите.
Целью работы является исследование разрядных характеристик ТХИТ на основе смесей хлорида никеля(II) и фторида кобальта(II), и определение механизма восстановления твердофазного катода. Понимание данного процесса существенно облегчит в дальнейшем выбор катодного материала для батарей ТХИТ с заданными характеристиками.
МЕТОДИКА ЭКСПЕРИМЕНТА
При изготовлении элементов ТХИТ были использованы реактивы марки “ч. д. а.”. Исходные навески хлорида никеля(II) и фторида кобальта(II) гомогенизировали в агатовой ступке и спрессовывали в таблетки. При формировании элемента ТХИТ использовали токоотводы чашечной конструкции, в которые помешались активные электродные компоненты. В качестве отрицательного электрода использовали литий – борный композит с содержанием бора 24 мас. % [16]. Анодный материал брали в избыточном количестве, что гарантировало лимитирующую роль катода в разрядных характеристиках элемента ТХИТ. В качестве сепаратора применяли низкоплавкую смесь галогенидов лития 22LiF–31LiCl–47LiBr (мол. %) с температурой плавления 430°С, загущенную γ-LiAlO2. Все операции по изготовлению элемента ТХИТ проводили в сухом аргоновом боксе.
Разряд электрохимических ячеек проводили в гальваностатическом режиме с помощью электрохимической рабочей станции “Zahner IM6”.
Морфологию продуктов восстановления катода исследовали с помощью растрового электронного микроскопа (РЭМ) с безазотным энергодисперсионным детектором X-Act ADD + JSM-5900LV (Jeol, Япония), пространственное разрешение 3 нм (2.5 нм с катодом LaB6).
Рентгенофазовый анализ (РФА) образцов проводили при комнатной температуре на дифрактометре “Rigaku D/MAX-2200VL/PC” (Rigaku, Япония) с использованием CuKα излучения в диапазоне брегговских углов 2θ от 10° до 85° с шагом 0.02°.
Для синхронного термического анализа (СТА) использовали термический анализатор “STA 449 F1 Jupiter” (NETZSCH). Измерения проводили в графитовых тиглях в интервале температур 35–650°С, скорость нагрева/охлаждения – 10°С/мин. Измерительную ячейку с образцом продували аргоном со скоростью 50 мл/мин. Полученные данные были обработаны с помощью программного обеспечения “NETZSCH Proteus”.
Потенциодинамические кривые снимали на двухэлектродной ячейке при помощи потенциостата/гальваностата “Model 263A”. Площадь рабочего электрода составлял 0.07 см2. В качестве противоэлектрода использовали таблетку Li–B композита площадью 2.3 см2. Поляризация противоэлектрода не превышала 10 мВ. Малая величина поляризации противоэлектрода позволяет использовать его в качестве электрода сравнения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В рамках данной работы были исследованы разрядные характеристики элементов ТХИТ на основе твердофазных катодных смесей NiCl2–CoF2 и проведен сравнительный анализ полученных данных с аналогичными параметрами, изученных нами ранее смесей NiCl2–CoCl2. Восстановление катодных материалов проводили в температурном интервале 450–550°С, в токовом диапазоне от 0.25 до 1 А/см2. Установлено, что при температурах ниже 500°С и плотности тока более 0.25 А/см2, напряжение разряда элементов ТХИТ на основе катодных смесей NiCl2–CoF2 заметно выше, чем напряжение элементов ТХИТ с хлоридом никеля и смесями NiCl2–CoCl2 (рис. 1). Нижняя граница температурного интервала, позволяющего реализовать разрядное плато в токовом диапазоне до 0.5 А/см2, составляет 460°С. Оптимальный состав катодной смеси зависит от температуры и плотности тока разряда, и варьируется в диапазоне 10–20 мас. % CoF2. Максимальная длительность разрядного плато составляет 0.3 А ⋅ ч ⋅ г–1. При более высокой концентрации CoF2 в составе исходной катодной смеси, наблюдается снижение напряжения разряда (рис. 2, кривая 4). Мы считаем, что это обусловлено повышением температуры плавления солевых фракций, образующихся в процессе восстановления катодной смеси. При разряде используемой нами конструкции элементов ТХИТ, граница катодной реакции смещается от сепаратора вглубь катода (рис. 1, врезка). Подвод носителей заряда в зону реакции осуществляется через формирующийся слой восстановленного катода. Поэтому продукты восстановления при рабочих температурах должны обладать достаточно высокой ионной проводимостью. Электронную проводимость способны обеспечить металлические никель и кобальт, образующиеся в процессе восстановления катодной смеси в соответствие с электрохимическими реакциями: NiCl2 + Li+ + 2e– → Ni + 2LiCl; CoF2 + Li+ + 2e– → Co + 2LiF. Высокую ионную проводимость, в интересующем нас температурном интервале, может реализовать расплав на основе галогенидов лития эвтектического состава LiCl–LiF (30 мол. %) (температура плавления 488°С). Отклонение солевой фракции от эвтектического состава, ведет к уменьшению удельного объема расплава в продуктах восстановления катода, и к росту затруднений доставки Li+ в зону катодной реакции. При температурах выше 500°С в исследуемом токовом диапазоне, существенных различий в электрических характеристиках ТХИТ на основе NiCl2–CoF2 и NiCl2–CoCl2 не наблюдается. Следует отметить, что элементы ТХИТ с катодом NiCl2–CoF2 (20 мас. %), хотя и показывают в ряде случаев наиболее высокие значения напряжения разряда, как правило, являются нестабильными (рис. 2, 3).
Рис. 1.
Разрядные кривые элементов ТХИТ с различными катодами: 1 – NiCl2–CoF2 (20 мас. %); 2 – NiCl2–CoCl2 (20 мас. %); 3 – NiCl2. Плотность тока разряда 0.5 A ⋅ см–2. Тразряда: а – 480; б – 460°С. Врезка: схема конструкции элемента ТХИТ.

Рис. 2.
Разрядные кривые элементов ТХИТ с различным составом катодной смеси NiCl2–CoF2. (х мас. %), х: 1 – 5; 2 – 10; 3 – 20; 4 – 30 мас. %. Плотность тока разряда 0.5 A ⋅ см–2, Тразряда = 500°С.

Рис. 3.
Разрядные кривые элементов ТХИТ с различным составом катодной смеси: 1 – NiCl2–CoF2 (10 мас. %); 2 – NiCl2–CoF2 (20 мас. %). Плотность тока разряда: а – 0.25; б – 1 A ⋅ см–2. Тразряда = 500°С.

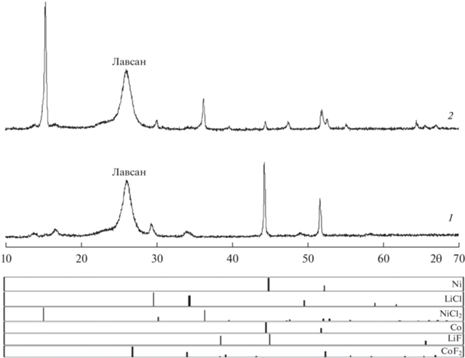
Исследование состава катода с помощью рентгенофазового анализа показало, что в процессе разряда элементов ТХИТ, при максимальном отборе емкости, образцы содержат лишь галогениды лития и металлы никеля и кобальта (рис. 4, дифрактограмма 1). При разрядах с меньшим отбором емкости, на дифрактограммах дополнительно присутствуют линии исходных компонентов катодных смесей.
Рис. 4.
Дифрактограммы продуктов восстановления катодных смеси NiCl2–CoF2 (10 мас. %) при различном отборе емкости: 1 – $0.9{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}};$ 2 – $0.44{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}.$ Плотность тока разряда 0.5 A ⋅ см–2, Тразряда = 500°С.
Микрофотографии продуктов катодной реакции представлены на рис. 5. Сравнение морфологии образцов, полученных при восстановлении смесей NiCl2–CoF2 и чистого NiCl2, позволяет сделать вывод о том, что добавка фторида кобальта ведет к образованию более рыхлых осадков с более крупными металлическими дендритами. Металлические дендриты смесей представляют собой интерметаллиды никеля и кобальта. Формирование более крупных дендритов может свидетельствовать о снижении катодной поляризации, вследствие роста растворимости активных компонентов катода в солевой фракции в присутствии фторида лития. Энергодисперсионный анализ солевой составляющей показал, что в исследуемых образцах помимо фтора и хлора в небольшом количестве присутствует бром. Наличие этого элемента в разряженном катоде обусловлено диффузией бромида лития из сепаратора в процессе разряда элемента ТХИТ. Топология LiBr аналогична расположению LiCl в образце. Поэтому мы предполагаем образование твердых растворов LiCl–LiBr. В пользу этого предположения так же говорит и уширение линий LiCl на дифрактограммах продуктов восстановления катодных смесей. Диффузионные процессы на границе катод | сепаратор, не оказывают существенного влияния на состав и свойства электролита.
Рис. 5.
СЭМ поперечный скол продуктов катодной реакции элементов ТХИТ, полученных при разряде плотностью тока 0.5 A ⋅ см–2, Тразряда = 460°С: 1 – NiCl2–CoF2 (20 мас. %) $0.9{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}};$ 2 – NiCl2.

Результаты СТА продуктов восстановления исследуемых катодных материалов показали, что при стационарном режиме работы элемента ТХИТ, когда содержание активных компонентов в расплаве солевой фракции достигает придельной концентрации, ДСК кривые для смесей, содержащих 10–20 мас. % CoF2, имеют один пик с максимумом в области 460–470°С (рис. 6). Так как данный пик достаточно широк, мы предполагаем, что он соответствует совместному плавлению тройной смеси галогенидов лития LiF–LiCl–LiBr и эвтектики двойной системы LiF–LiCl, в которых растворены галогениды переходных металлов. Концентрация NiCl2 и CoF2 в расплаве, также влияет на характер ДСК кривых. При максимальном отборе емкости ($0.9{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$ в данном токовом режиме), активные компоненты катода практически полностью восстановлены, и их содержание в расплаве солевой фракции незначительно. В данных условиях, состав солевой фракции, образующейся при восстановлении смеси NiCl2–CoF2 (20 мас. %), должен быть близок к эвтектике LiCl–LiF (30 мол. %) и иметь температуру плавления 488°С. Это хорошо согласуется с полученными нами экспериментальными данными. Максимум высокотемпературного пика ДСК кривой продуктов восстановления смеси NiCl2–CoF2 (20 мас. %), составляет 487°С (рис. 7).
Рис. 6.
ДСК кривые продуктов восстановления различных катодов элементов ТХИТ: 1 – NiCl2–CoF2 (5 мас. %); 2 – NiCl2–CoF2 (10 мас. %); 3 – NiCl2–CoF2 (20 мас. %); 4 – NiCl2–CoF2 (30 мас. %); 5 – NiCl2–CoCl2 (20 мас. %). Условия разряда элементов ТХИТ: отбор емкости $0.44{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}},$ плотность тока разряда 1 A ⋅ см–2, Тразряда = 500°С.

Рис. 7.
ДСК кривые продуктов восстановления различных катодов элементов ТХИТ: 1 – NiCl2; 2 – NiCl2–CoF2 (10 мас. %); 3 – NiCl2–CoF2 (20 мас. %); 4 – CoF2. Условия разряда элементов ТХИТ: отбор емкости $0.9{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}},$ плотность тока разряда 1 A ⋅ см–2, Тразряда = 500°С.

Для уточнения природы процессов, протекающих при восстановлении катодных смесей, был использован хроновольтамперометрический метод. Съемка потенциодинамических кривых проводилась при температуре 500°С, скорость развертки (υ) варьировалась от 5 до 100 мВ/с, смещение потенциала от НРЦ ±1.5 В. Пять первых циклов служили для формирования поверхности рабочего электрода и исключались из дальнейшего анализа. В качестве рабочих электродов были использованы смеси NiCl2–CoF2, содержащие от 5 до 30 мас. % фторида кобальта. Для всех образцов, содержащих в качестве сепаратора низкоплавкую смесь галогенидов лития LiF–LiCl–LiBr и загущенную γ-LiAlO2, на потенциодинамических кривых фиксировались два катодных пика (рис. 8). При замене сепаратора на твердый электролит, не содержащий анион Br–, первый (от НРЦ) пик исчезает (рис. 8, врезка б). Так как твердые растворы на основе хлорида и бромида лития при добавлении третьего компонента (LiF) не распадаются, мы считаем, что данный пик соответствует восстановлению комплексных соединений [MeBrxCly]n– (Me – переходный металл). Природа второго пика, очевидно, отвечает процессу совместного восстановления переходных металлов из галогенидного расплава LiCl–LiF–NiCl2–CoF2. Электродная реакция является одностадийной. Уширение катодного пика обусловлено увеличением дисперсности поверхности рабочего электрода в процессе роста дендритов металлического никеля и кобальта. Зависимость тока пиков от корня квадратного из скорости развертки потенциала в диапазоне скоростей от 5 до 50 мВ/с, имеет линейный характер (рис. 8, врезка а). Это свидетельствует о том, что электрохимическая реакция протекает в режиме диффузионной кинетики. При более высоких скоростях развертки потенциала, корректно разделить пики не удалось. Соотношение исходных компонентов смесей рабочего электрода влияет на концентрацию катионов никеля и кобальта в зоне катодной реакции, и как следствие, на величину тока катодных пиков на потенциодинамических кривых. Максимальные токи соответствую составу NiCl2–CoF2 (15 мас. %). Очевидно, рост токовых показателей обусловлен увеличением количества эвтектического расплава на основе галогенидов лития LiCl–LiF (30 мол. %), образующегося при восстановлении смесей рабочего электрода. Образование жидкой фазы снижает затруднения по доставке катионов лития в зону электрохимической реакции. Следует отметить, что данному составу соответствует наибольшее смещение максимумов пиков потенциодинамических кривых от НРЦ.
Рис. 8.
Циклические вольтамперные кривые, снятые на различных электродах: 1 – NiCl2–CoF2 (5 мас. %); 2 – NiCl2–CoF2 (10 мас. %); 3 – NiCl2–CoF2 (15 мас. %); 4 – NiCl2–CoF2 (20 мас. %); 5 – NiCl2–CoF2 (30 мас. %), скорость развертки 50 мВ/с. Врезки: а – зависимость плотности тока катодных пиков от скорости развертки потенциала, снятые на электроде NiCl2–CoF2 (20 мас. %); б – циклическая вольтамперная кривая, снятая на электроде NiCl2–CoF2 (15 мас. %) для ячейки с твердым электролитом (Li4SiO4–Li3PO4) (скорость развертки 10 мВ/с).

ЗАКЛЮЧЕНИЕ
Исследованы разрядные характеристики элементов ТХИТ, содержащих в качестве положительного электрода смеси NiCl2–CoF2. Установлено, что рассматриваемые катодные материалы позволяют снизить температуру разряда элементов ТХИТ до 460°С. Максимальная емкость разрядного плато 0.3 А ⋅ ч ⋅ г–1. Оптимальный состав катодной смеси для различных режимов работы элементов ТХИТ варьируется в диапазоне 10–20 мас. % CoF2. В процессе разряда элементов ТХИТ наблюдается диффузия электролита в катодную область. Однако это не приводит к существенной деградации сепаратора. Продукты восстановления исследуемых катодных материалов содержат дендритную губку из металлического никеля и кобальта, покрытую солевой пленкой на основе галогенидов лития. Дисперсность и морфология дендритов (при прочих равных условиях разряда ТХИТ) определяется соотношением компонентов в исходной катодной смеси. По мере роста металлической губки, зона катодной реакции смещается вглубь положительного электрода. Солевая составляющая разряженного катода содержит смесь комплексных соединений [MeBrxCly]n– (Me – Ni, Co) и раствор галогенидов переходных металлов на основе эвтектики двойной системы LiF–LiCl. Для катодных смесей с оптимальным соотношением компонентов, температура плавления солевой фракции продуктов восстановления составляет 460–470°С. Наличие жидкой фазы в катоде облегчает доставку токообразующего иона в зону катодной реакции и ведет к повышению напряжения разряда и понижению области рабочих температур. Восстановление катодных смесей NiCl2–CoF2 протекает по двухэлектронному механизму в режиме диффузионной кинетики.
Исследования выполнены с использованием оборудования ЦКП “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Masset P.J., Guidotti R.A. Thermal activated (“thermal”) battery technology Part IIIa: FeS2 cathode material // J. Power Sources. 2008. 177. P. 595–609.
Butler P., Wagner C., Guidotti R., Francis I. Long-life, multi-tap thermal battery development // J. Power Sources. 2004. 136. P. 240–245.
Nelson P.A. Advanced high-temperature batteries // J. Power Sources. 1990. 29. P. 565–577.
Au M. Nanostructured thermal batteries with high power density // J. Power Sources. 2003. 115. P. 360–366.
Guidotti R., Reinhardt F.W., Dai J., Reisner D.E. Performance of thermal cells and batteries made with plasma-sprayed cathodes and anodes // J. Power Sources. 2006. 160. P. 1456–1464.
Masset P.J., Guidotti R.A. Thermal activated (“thermal”) battery technology Part IIIb. Sulfur and oxide-based cathode materials // J. Power Sources. 2008. 178. P. 456–466.
Masset P.J. Thermal stability of FeS2 cathode material in “thermal” batteries: effect of dissolved oxides in molten salt electrolytes // Z. Naturforsch. 2008. 63a. P. 596–602.
Volkova O.V., Zakharov V.V., Reznitskikh O.G. Electroreduction of chromium(III) chloride in a thermal battery // Russian Metallurgy. 2017. 8. P. 655–659.
Volkova O.V., Zakharov V.V. Electroreduction of chromium (III) chloride and molybdenum(VI) oxide mixtures in a thermally activated battery // Russian Metallurgy. 2018. 2. P. 201–204.
Volkova O.V., Zakharov V.V., Plaksin S.V., Il’ina E. A., Pankratov A.A. Electroreduction of cobalt(II) chloride and cobalt(II) fluoride mixtures in a thermally activated chemical current source // Russian Metallurgy. 2021. 2. P. 159–164.
Volkova O.V., Zakharov V.V., Il’ina E.A., Pankratov A.A. Electroreduction of nickel(II) chloride and cobalt(II) chloride mixtures in a heat activated battery // Russian Metallurgy. 2021. 2. P. 118–128.
Волкова О.В., Захаров В.В., Вовкотруб Э.Г., Плаксин С.В., Першина С.В. Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI) в термоактивируемом химическом источнике тока // Расплавы. 2019. № 5. С. 411–422.
Волгин М.А., Иванов А.С., Денисова Л.Н. Анодное поведениелитий-борного сплава в расплаве эвтектики нитратов лития, калия и натрия // Электрохимия. 1988. 24. № 9. С. 1281–1283.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
Барнашов С.А., Елисеев А.И., Щеткин Н.М., Загайнов В.А., Королева И.В., Радецкая Е.В., Бондаренко А.И. и др. Тепловая батарея. Патент РФ № 2 369 944, 2007.
Захаров В.В. и др. Способ изготовления литий-борного композита и реактор. Патент РФ № 2 395 603, 2010.
Дополнительные материалы отсутствуют.


