Теоретические основы химической технологии, 2022, T. 56, № 1, стр. 56-71
Современное состояние и перспективы исследований структурообразования в экстракционных системах с соединениями металлов
Н. М. Мурашова a, *, Е. В. Юртов a
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: namur_home@mail.ru
Поступила в редакцию 26.11.2020
После доработки 20.05.2021
Принята к публикации 12.07.2021
- EDN: WYGBBV
- DOI: 10.31857/S0040357121060075
Аннотация
Рассмотрено современное состояние исследований в области структурообразования в экстракционных системах с соединениями металлов. Структурообразование происходит как за счет образования координационных полимеров и частиц твердой фазы, формирующих осадки и гели, которые, в свою очередь, могут стабилизировать эмульсии, так и при ассоциации амфифильных молекул с образованием мицелл, микроэмульсий и лиотропных жидких кристаллов. Представлены примеры структурообразования в области границы раздела водной и органической фаз и в объеме одной из жидких фаз. Рассмотрены перспективные направления по применению структурообразования в экстракционных системах для разработки новых и усовершенствования имеющихся технологий, таких как процессы экстракции с использованием обратных мицелл или микроэмульсий, выщелачивание металлов с помощью экстрагентсодержащих микроэмульсий, извлечение металлов с помощью прямых мицелл, синтез наночастиц в экстракционных системах.
ВВЕДЕНИЕ
Жидкостная экстракция широко используется для извлечения, разделения и очистки цветных металлов (Co, Ni, Cu), редких металлов (разделение Zr и Hf, Nb и Ta, разделение и очистка лантаноидов), в технологии урана, при переработке отработавшего ядерного топлива, для очистки сточных вод [1, 2]. Одной их проблем жидкостной экстракции металлов, привлекающей внимание исследователей и технологов на протяжении нескольких десятилетий, является проблема структурообразования в экстракционных системах. Исследование структурообразования, в том числе на уровне размеров в нанометры, дает возможность улучшать характеристики существующих экстракционных процессов и разрабатывать новые технологии разделения и выделения металлов.
Цель настоящей работы – проанализировать современные подходы к проблеме структурообразования в экстракционных системах с соединениями металлов и описать новые направления исследований в этой области.
С точки зрения механизма структурообразование в экстракционных системах с солями металлов может происходить за счет образования координационных полимеров и частиц твердой фазы с аморфной или кристаллической структурой, формирующих осадки, гидрогели и органогели, которые, в свою очередь, могут стабилизировать эмульсии, и при ассоциации амфифильных молекул с образованием мицелл, микроэмульсий и лиотропных жидких кристаллов.
СТРУКТУРООБРАЗОВАНИЕ ЗА СЧЕТ ОБРАЗОВАНИЯ КООРДИНАЦИОННЫХ ПОЛИМЕРОВ И ЧАСТИЦ ТВЕРДОЙ ФАЗЫ
Образование стабильных эмульсий, гелей и осадков вблизи границы раздела жидких фаз при экстракции. Образование стабильных эмульсий, гелей и осадков вблизи границы раздела жидких фаз – это одно из наиболее известных осложнений технологического процесса жидкостной экстракции металлов [1]. В экстракционной технологии материал в виде геля или стабилизированной твердыми частицами эмульсии, обычно собирающийся на границе раздела водной и органической фаз в экстракторе, обозначают словом “crud”. В русскоязычной литературе этот материал называют “медузы”. Образование медуз серьезно затрудняет работу экстракторов, так как ухудшает разделение жидких фаз, вызывает потери экстрагента и извлекаемого металла. Образование медуз наблюдается в различных экстракционных процессах, например при экстракционной переработке отработавшего ядерного топлива, в ходе экстракции циркония, меди, рения, хрома, ванадия и других металлов [3–10].
Химический состав медуз специфичен для каждого конкретного завода и применяемой технологии, поэтому общую причину их образования определить не удается [3, 11]. Образцы медуз могут содержать водную фазу, органический растворитель, экстрагент, продукты разложения экстрагента, соединения извлекаемых металлов (в том числе с продуктами разложения экстрагента), органические примеси и примеси твердых частиц, внесенные с водной фазой, продукты коррозии оборудования и т.д. Причины, приводящие к формированию медуз, можно объединить в две группы: 1) внесение извне, вместе с питающим водным раствором, твердых частиц, органических примесей, например, гуминовых кислот, и склонных к гелеобразованию веществ, например, соединений кремния; 2) образование малорастворимых соединений в ходе экстракционного процесса, например, при высоком содержании извлекаемого металла в органической фазе, в присутствии растворимых соединений кремния и циркония, а также катионов Al, Mg, Ca, Co, Fe и других, склонных к гидролизу и образованию гидролитических полимеров, при высоких значениях рН водной фазы, способствующих гидролизу, при наличии примесей в коммерческих экстрагентах, при накоплении продуктов разложения экстрагента, например, продуктов радиолиза трибутилфосфата, при нарушении технологического регламента; часто к образованию медуз приводит сочетание указанных выше причин [3–11]. Чтобы эффективно предотвращать возникновение медуз и разрушать уже появившиеся, необходимо знание механизмов образования и стабилизации этих структур.
Образование “межфазных пленок” и органогелей в области границы раздела фаз и их влияние на кинетику экстракции. Структурообразование в экстракционных системах может наблюдаться в виде формирования так называемых межфазных пленок в ходе экстракции соединений металлов, склонных к гидролизу и полимеризации. Описано образование слоев толщиной до 1 мкм вблизи границы раздела водной и органической фаз, обладающих повышенной вязкостью или механической прочностью, при экстракции циркония, тантала, ниобия, лантаноидов растворами ди-(2-этилгексил)фосфорной кислоты (Д2ЭГФК) [12–14]. Установлено, что при экстракции европия и самария Д2ЭГФК на границе водной и органической фазы при определенных концентрациях H+, экстрагента и солей металла образуются твердые пленки, состоящие из кристаллов промежуточного комплекса Ln(Д2ЭГФ)3 (т.е. средней соли), в то время как в растворе в равновесии присутствует стабильный комплекс Ln(Д2ЭГФ ⋅ Д2ЭГФК)3 (т.е. кислая соль) [15]. В последние годы детальные исследования структурообразования на межфазной границе в экстракционных системах с хлоридами и нитратами редкоземельных элементов (Er, Pr, Nd, Ho, Yt) и растворами Д2ЭГФК и трибутилфосфата в гептане, толуоле и тетрахлорметане были проведены в научной группе Н.Ф. Кизима и Е.Н. Голубиной. Показано формирование пленок органогеля, образованного полимерами ди-(2-этилгексил)фосфатов лантаноидов на границе раздела водной и органической фазы, изучены их реологические свойства в зависимости от состава экстракционной системы, изучена кинетика накопления лантаноидов в межфазном слое экстракционных систем [16, 17].
Образование межфазных пленок влияет на кинетику экстракции. Постепенный рост межфазной пленки в ходе экстракции в случае слабого обновления поверхности контакта фаз вызывает дополнительное сопротивление массопереносу, что приводит к снижению скорости экстракции задолго до достижения равновесия в системе. Снижение скорости экстракции при образовании межфазных пленок показано, например, при извлечении циркония и гафния из водных растворов в алкилфосфорные кислоты, в экстракционных системах с лантаноидами и Д2ЭГФК [13, 14]. Межфазная пленка, образованная полимеризованными формами кремниевой кислоты, препятствует массопередаче при экстракции HCl, HNO3 и нитрата циркония в трибутилфосфат [18].
Основной причиной формирования межфазных пленок, осадков и гелей в ходе экстракции считают образование координационных полимеров промежуточными и/или конечными соединениями металлов и экстрагентов при определенных составах водной и органической фаз. Например, было изучено образование солями ди-(2-этилгексил)фосфорной кислоты в органических растворителях координационных полимеров, где в качестве “мостика” выступает фосфатная группа, связанная координационными связями с атомами металла. Показано образование координационных полимеров ди-(2-этилгексил)фосфатов уранила в бензоле и четыреххлористом углероде. Кислые ди-(2-этилгексил)фосфаты циркония и гафния могут образовывать смешанные координационные полимеры с катионами других металлов, например Fe3+ и Eu3+ и повышать их экстракцию [19, 20]. Описаны стержнеобразные координационные полимеры с длиной цепи до 53 нм и радиусом 0.9–1.0 нм среднего ди-(2-этилгексил)фосфата кобальта(II) в дейтериобензоле, при этом соли кобальта(II) и таких экстрагентов, как 2-этилгексиловый эфир 2-этилгексилфосфорной кислоты, ди-(2-этилгексил)фосфиновая кислота, ди-(2,4,4-триметилпентил)фосфиновая кислота формируют малые агрегаты радиусом 1.8–2.3 нм [21]. Установлено, что средние ди-(2-этилгексил)фосфаты лантаноидов (La и Eu) Ln(Д2ЭГФ)3 формируют линейные жесткоцепные координационные полимеры, где остатки ди-(2-этилгексил)фосфорной кислоты выступают в роли мостиков. Среднюю длину полимерной цепи оценивают в 800 нм. Ln(Д2ЭГФ)3 мало растворимы в алканах, они кристаллизуются в игольчатые кристаллы с гексагональной элементарной ячейкой [22].
Описано образование геля в органической фазе, состоящего из цепочечных полимеров среднего ди-(2-этидгексил)фосфата иттрия при экстракции иттрия из хлоридного раствора раствором Д2ЭГФК в керосине в условиях относительно низких концентраций H+ (0.1–0.3 моль/л) и относительно высоком содержании металла и экстрагента: концентрация металла в водной фазе (0.09 моль/л), соотношения Y(III) : Д2ЭГФК от 1 : 2.2 до 1 : 9.9 [23]. Аналогичные результаты были получены для экстракционной системы с ди-(2-этилгексил)фосфатом неодима. При низком насыщении экстрагента металлом преобладают растворимые в органической фазе ассоциаты Nd и Д2ЭГФК – хорошо известные димерная форма Д2ЭГФК и кислая соль Nd(Д2ЭГФ ⋅ Д2ЭГФК)3, а также комплексы, содержащие более чем один атом Nd и 4, 5 или 8 молекул Д2ЭГФК или групп ди-(2-этилгексил)фосфата. При высоком насыщении экстрагента неодимом наблюдается образование геля в органической фазе, состоящего из координационного полимера средней соли Nd(Д2ЭГФ)3 [24].
Связь гелеобразования в объеме органической фазы и вблизи межфазной границы. Чтобы лучше понять механизм образования структурированной пленки при экстракции лантаноидов, на примере Д2ЭГФК и соединений Tb3+ было предложено сопоставлять структурообразование в ходе массопереноса вблизи межфазной границы (т.е. в неравновесных условиях) со структурообразованием в равновесии в объеме жидких фаз при составах систем, сходных с составами, возникающими в межфазной области в неравновесных условиях. Было исследовано гелеобразование в системе гидроксид тербия–ди-(2-этилгексил)фосфорная кислота–декан–вода в объеме органической фазы и структурообразование в межфазной области в ходе экстракции тербия из его нитратного раствора раствором Д2ЭГФК в декане. Показано, что образование органогеля из частиц твердой фазы в системе Tb(OH)3–Д2ЭГФК–декан–вода происходит при соотношении молярных концентраций СД2ЭГФК/${{C}_{{{\text{Tb(OH}}{{{\text{)}}}_{{\text{3}}}}}}}$ ≤ 1.8, т.е. в области существования основных (одно- и двузамещенных) ди-(2-этилгексил)фосфатов. Электронная микроскопия высушенных образцов показала, что свежеполученный органогель образован аморфными частицами, а с течением времени происходит образование кристаллов игольчатой формы (рис. 1). Гелеобразование не наблюдалось при СД2ЭГФК/${{C}_{{{\text{Tb(OH}}{{{\text{)}}}_{{\text{3}}}}}}}$ ≥ 3.0, т.е. в области существования среднего и кислого ди-(2-этилгексил)фосфатов. В этих условиях в области границы масло–вода образуется осадок из кристаллов игольчатой формы, а при концентрации кислоты, достаточной для образования растворимой кислой соли Tb(Д2ЭГФ ⋅ Д2ЭГФК)3 – две жидкие фазы [25, 26]. Показано образование структурированного слоя толщиной до нескольких десятков микрометров вблизи межфазной границы при контакте водного раствора Tb(NO3)3 с раствором Д2ЭГФК в декане. Анализ с помощью поляризационного микроскопа показал, что в системе водный раствор нитрата тербия – раствор Д2ЭГФК в декане в межфазной области образуются как участки с преимущественно аморфной структурой и небольшой долей кристаллической фазы (рис. 2a и 2б), так и участки с преобладанием кристаллов (рис. 2в и 2г).
Рис. 1.
Микрофотографии (сканирующая электронная микроскопия) высушенного органогеля, полученного в системе Tb(OH)3–Д2ЭГФК–декан–вода. Исходная концентрация Д2ЭГФК в органической фазе 0.3 моль/л; Соотношение молярных концентраций СД2ЭГФК/${{C}_{{{\text{Tb(OH}}{{{\text{)}}}_{{\text{3}}}}}}}$: (a) и (б) – 1.4; (в) – 1.5. Органогель после получения стоял при комнатной температуре: (a) – 1 день; (б) – 8 недель; (в) – 12 недель [25, 26].

Рис. 2.
Вид межфазной области при контакте фаз 1.0 М раствора Д2ЭГФК в декане (фаза 1) с 0.3 М водным раствором Tb(NO3)3 (фаза 2): (a), (б) – 10 мин после контакта фаз; (в), (г) – 20 мин после контакта фаз; (a), (в) – поляризаторы не скрещены; (б), (г) – поляризаторы скрещены [25].
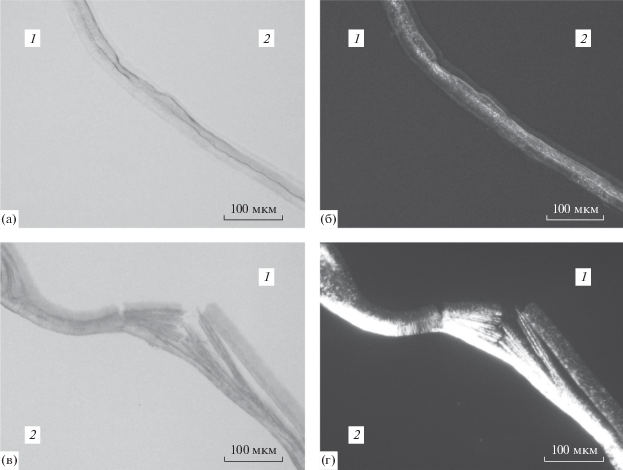
Толщина слоя, образующегося в межфазной области, достигает десятков мкм, она выше при больших концентрациях Tb(NO3)3 в водной фазе. Средние значения толщины возрастают пропорционально корню квадратному из времени. Доля межфазной границы, покрытая структурированным слоем, увеличивается от 0 до приблизительно 90% с ростом концентрации тербия. Методом сканирующей электронной микроскопии показано, что структурированный слой, возникающий в ходе экстракции тербия раствором Д2ЭГФК в декане, состоит как из участков с аморфной структурой, так и из участков с преобладанием игольчатых кристаллов. Эти участки аналогичны по строению с органогелями основных ди-(2-этилгексил)фосфатов, обладающими аморфной структурой и кристаллизующимися с течением времени, и с кристаллическим осадком средних ди-(2-этилгексил)фосфатов [25].
Аналогичные результаты были получены при изучении гелеобразования в системах, содержащих Nd(OH)3 и чистую и техническую Д2ЭГФК – наблюдалось образование органогеля и эмульсии, стабилизированной органогелем, в области существования основных ди-(2-этилгексил)фосфатов. Дисперсионной средой в таких эмульсиях является органогель, в нем распределены капли водной фазы. Образование органогелей из твердых частиц и эмульсий, стабилизированных органогелем, показано также для системы Cu(OH)2–Д2ЭГФК (техническая)–декан–вода в области существования основных солей. В этом случае структурообразование объясняется наличием примеси моно-(2-этилгексил)фосфорной кислоты и формированием органогеля из частиц среднего и основного моно-(2-этилгексил)фосфата меди [26, 27].
Образование третьей фазы в экстракционных системах. Еще одним осложнением при экстракции металлов является расщепление органической фазы на две – более тяжелую, обогащенную экстрагируемым соединением, и более легкую, обогащенную органическим растворителем. В экстракционной технологии третьей (средней) фазой принято назвать более тяжелую из двух органических фаз. Образование третьей фазы нарушает нормальную работу экстракторов, которые рассчитаны на присутствие двух гомогенных фаз – водной и органической [1].
Образование третьей фазы часто отмечалось в экстракционных системах с три-н-бутилфосфатом (ТБФ) при высоких концентрациях экстрагента и извлекаемого вещества. Основной причиной образования третьей фазы в системах с трибутилфосфатом считают ограниченную растворимость сольвата экстрагируемого вещества с ТБФ в органическом растворителе. Например, изучено образование третьей фазы при определенных соотношениях компонентов в системах ТБФ–додекан–U(IV)–HNO3–вода, водный раствор UO2(NO3)2 и Th(NO3)4–раствор ТБФ в додекане и других практически важных экстракционных системах с трибутилфосфатом [28, 29]. Чтобы избежать образования третьей фазы при экстракции, в состав органической фазы обычно вводят модификатор, который повышает растворимость экстрагируемых веществ [30]. Для предотвращения выделения третьей фазы в последнее время вместо три-н-бутилфосфата для экстракции актиноидов и лантаноидов предлагаются новые экстрагенты, например три-втор-бутилфосфат [31], N,N,N',N'-тетраалкил-3-оксапентандиамиды (дигликоламиды) различного строения [30, 32], тетраалкилкарбамиды с длинной (больше, чем бутил) углеводородной цепью [33].
Вероятнее всего, третья фаза в классических экстракционных системах с ТБФ не является микроэмульсией. Установлено, что третья фаза в экстракционной системе водный раствор UO2(NO3)2 и Th(NO3)4–раствор ТБФ в додекане, содержащая высокие концентрации нитратов уранила или тория, проявляет упорядоченность, аналогично жидким кристаллам [34]. При определенных соотношениях компонентов в экстракционной системе ТБФ–керосин–серная кислота–вода в третьей фазе обнаружена ламеллярная структура, образованная агрегатами комплексов ТБФ ⋅ H2SO4 [35].
В отличие от систем с ТБФ, в экстракционных системах с Д2ЭГФК и солями металлов возможно появление третьей фазы в форме микроэмульсии (микроэмульсионная система Винзор III). Более подробно о микроэмульсиях и других структурах, образующихся в экстракционных системах при ассоциации амфифильных молекул, изложено в следующих разделах.
СТРУКТУРООБРАЗОВАНИЕ ЗА СЧЕТ АССОЦИАЦИИ АМФИФИЛЬНЫХ МОЛЕКУЛ
Мицеллы в экстракционных системах. Многие экстрагенты, применяемые для жидкостной экстракции металлов, имеют в составе молекулы полярную и неполярную часть и обладают поверхностной активностью. Например, площадь, приходящаяся на одну молекулу Д2ЭГФК на межфазной границе, для растворов Д2ЭГФК в алканах в равновесии с 0.1 М раствором HCl увеличивалась с уменьшением длины углеводородной цепи алкана от 82 Å2 для гексадекана до 123 Å2 для октана [36]. Исследовано межфазное натяжение в экстракционной системе раствор Д2ЭГФК в гексане–водные растворы хлоридов Na, Mg, Ca, Sr, Ba, Co, Ni и Cu при различных концентрациях Д2ЭГФК и ионов металлов и разных величинах рН равновесной водной фазы, определены значения критической концентрации мицеллообразования (ККМ). Показано, что в присутствии катионов металлов Д2ЭГФК на межфазной границе вода–масло и в составе обратных мицелл не димеризована, как в объеме органической фазы, и образует с катионами двухвалентных металлов средние соли состава Me(Д2ЭГФ)2 [37].
Было показано существование обратных мицелл ди-(2-этилгексил)фосфата натрия (Д2ЭГФNa) в бензоле и в циклогексане в присутствии воды, для бензола значение ККМ составило 8 × 10–3 М, среднее число агрегации 12 ± 1, площадь, занимаемая одной молекулой на межфазной границе, была 64 Å2 [38]. Обнаружено, что Д2ЭГФNa в бензоле при малом содержании воды (соотношение молярных концентраций воды и ПАВ W = = СВ/СПАВ < 3.0) образует стержнеобразные кристаллиты порядка 300 нм длиной, при более высоких значениях W в системе существуют несферические обратные мицеллы [39]. Гигантские стержнеобразные мицеллы Д2ЭГФNa обнаружены в безводном гептане, введение воды приводит к уменьшению их размера и снижению вязкости системы, а при высоких концентрациях Д2ЭГФNa – к образованию микроэмульсии [40]. Описаны стержнеобразные обратные мицеллы ди-(2-этилгексил)фосфата аммония в безводном циклогексане, введение воды приводит к уменьшению длины мицелл, при W > 5 в системе образуется микроэмульсия со сферическими каплями [41].
Известны стержнеобразные обратные мицеллы средних ди-(2-этилгексил)фосфатов двухвалентных катионов Ca, Co, Ni, Cu, Mn в циклогексане [42]. Показано образование цилиндрических обратных мицелл, содержащих ди-(2-этилгексил)фосфат никеля и небольшое количество Д2ЭГФNa при экстракции никеля из нитратной среды раствором Д2ЭГФК в гептане [43]. Однако средние ди-(2-этилгексил)фосфаты трехвалентных катионов – La3+, Pr3+, Nd3+, Eu3+ в гептане и в смеси гептана с 20% октанола [44] и Al3+ в циклогексане [42] не образуют мицеллы при комнатной температуре. Трехвалентные катионы в составе таких ди-(2-этилгексил)фосфатов со всех сторон окружены шестью неполярными “хвостами” 2-этилгексила, что не способствует образованию мицелл.
Обобщенная модель агрегации комплексов металл–экстрагент в экстракционных системах с фосфорорганическими кислотами была предложена в работе [45]. Согласно этой модели при низком насыщении экстрагента извлекаемым металлом в органической фазе образуются кислые ди-(2-этилгексил)фосфаты, такие как Me(Д2ЭГФ ⋅ Д2ЭГФК)2 для двухвалентных катионов. При постепенном насыщении экстрагента происходит формирование и рост линейных агрегатов (координационных полимеров), аналогично образованию предмицеллярных ассоциатов ПАВ. При превышении определенной критической концентрации (порядка 10–3–10–2 моль/л для Д2ЭГФК, находящейся в равновесии с водным раствором соли металла) происходит реорганизация структуры агрегатов и формирование обратных мицелл, что сопровождается солюбилизацией воды. В зависимости от состава и условий могут формироваться как сферические, так и цилиндрические мицеллы.
Микроэмульсии и лиотропные жидкие кристаллы в экстракционных системах. Соли экстрагентов-кислот и одновалентных катионов могут формировать микроэмульсии. Например, показаны микроэмульсии с широкой областью существования в системах Д2ЭГФNH4–вода–гептан, пентан, нонан, циклогексан и изооктан [41]. Описана обратная микроэмульсия в системе натриевая соль нафтеновых кислот–смесь 80 об. % н-гептана и 20 об. % 2-октанола–вода, при введении солей Ln3+ микроэмульсия разрушается [44]. Обратная микроэмульсия образуется в экстракционной системе с частично нейтрализованным концентрированным раствором аммиака коммерческим экстрагентом Versatic 10 (смесь высокоразветвленных изомеров С10 монокарбоновых кислот); однофазная область с максимальной солюбилизационной емкостью по воде наблюдалась при степени нейтрализации 50% [46].
Наиболее подробно изучены микроэмульсии ди-(2-этилгексил)фосфата натрия. Для системы Д2ЭГФNa–гептан–вода исследован переход от обратных мицелл к бинепрерывной и прямой микроэмульсии, на фазовой диаграмме определена область существования микроэмульсии [40]. Изучена фазовая диаграмма системы Д2ЭГФNa–гептан–водный раствор NaCl, показано существование обратной микроэмульсии [47]. Описано образование обратных микроэмульсий в системах Д2ЭГФNa–изооктан–вода и Д2ЭГФNa–толуол–вода при добавлении длинноцепочечных алифатических спиртов [48]. Расширение, последующее сужение и исчезновение однофазной области микроэмульсии с ростом концентрации Д2ЭГФК в смеси Д2ЭГФNa + Д2ЭГФК показано для системы Д2ЭГФNa–Д2ЭГФК–толуол–вода, для этой же системы определена область существования жидких кристаллов [49]. На фазовой диаграмме системы Д2ЭГФNa–декан–вода показаны области существования микроэмульсии, жидких кристаллов и равновесий с участием этих фаз (рис. 3) [50]. Подробно изучено влияние экстрагента Д2ЭГФК на область существования, свойства и структурную организацию микроэмульсии Д2ЭГФNa в декане [51].
Рис. 3.
Фазовая диаграмма системы Д2ЭГФNa–декан–вода при температуре 20°С. Области существования: 1 – обратной микроэмульсии (закрашена), 2 – жидких кристаллов, 3 – микроэмульсии в равновесии с органическим растворителем, 4 – микроэмульсии в равновесии с жидкими кристаллами, 5 – равновесия трех фаз, 6 – органического растворителя в равновесии с жидкими кристаллами [50].

Влияние мицелл и микроэмульсий на основные параметры экстракции. Образование мицелл и микроэмульсий в органической фазе при экстракции металлов может влиять на основные параметры экстракционного процесса – коэффициенты распределения и скорость экстракции.
В работе [52] теоретически обосновано влияние обратных мицелл и микроэмульсий на коэффициент распределения металла. При формировании мицелл за счет введения ПАВ наблюдаемый коэффициент распределения Dobs представляет собой сумму вкладов от распределения в органическую фазу комплекса металл–ПАВ (т.е. распределения в отсутствие экстрагента) и комплекса металл–экстрагент–ПАВ:
где D0 – коэффициент распределения металла в отсутствие экстрагента, но в присутствии ПАВ; при постоянном значении рН зависимость логарифма D0 от логарифма концентрации ПАВ представляет собой возрастающую прямую линию; Dm – коэффициент распределения комплекса металл–экстрагент–ПАВ; при постоянном рН с ростом концентрации ПАВ значение логарифма Dm проходит через максимум.Таким образом, было теоретически обосновано и показано экспериментально наличие локального максимума на зависимости наблюдаемого коэффициента распределения металла от концентрации ПАВ в экстракционной системе [52].
Известны примеры значительного роста коэффициента распределения кальция(II), цинка(II), Ni(II) и Co(II) при образовании обратных мицелл ди-(2-этилгексил)фосфатов этих металлов [45]. Показано увеличение коэффициента распределения кальция, лантана и циркония при реализации мицеллярного механизма экстракции этих металлов Д2ЭГФК за счет добавления в органическую фазу определенных количеств октанола [53]. При экстракции Al(III) и Zn(II) в обратную микроэмульсию, содержащую экстрагент Д2ЭГФК, ПАВ дидодецилбензолсульфонат и соПАВ бутанол в керосине, наблюдали десятикратный рост извлечения Al и снижение извлечения Zn по сравнению с раствором Д2ЭГФК [54].
Влияние мицелл и микроэмульсий на кинетику экстракции металлов проанализировано в обзорной работе [55]. При рассмотрении влияния ПАВ (как специально введенных в экстракционную систему, так и поверхностно-активных экстрагентов и их соединений с металлами) на кинетику экстракции нужно учитывать следующие явления: модификацию межфазной границы за счет адсорбции молекул ПАВ; катализ массопереноса через межфазную границу при образовании промежуточного комплекса с веществом, более гидрофильным, чем экстрагент; образование прямых и обратных мицелл; образование микроэмульсии; спонтанную поверхностную конвекцию в результате градиента межфазного натяжения (эффект Марангони); т.е. влияние ПАВ на кинетику может быть сложным и неоднозначным. В этой же работе приведены многочисленные примеры повышения скорости экстракции металлов при образовании обратных мицелл и микроэмульсий за счет введении ПАВ или ПАВ + соПАВ в экстракционную систему, однако в некоторых случаях увеличения скорости экстракции не наблюдалось [55]. Влияние обратных мицелл и капель обратных микроэмульсий на скорость массопереноса между водной и органической фазами объясняют их высокой удельной поверхностью и их участием в переносе ионов металлов из водной в органическую фазу за счет взаимодействия с межфазной границей масло–вода и обмена содержимым между водным ядром мицелл (или капель микроэмульсии) и водной фазой [55, 56].
Применение обратных микроэмульсий и обратных мицелл для жидкостной экстракции металлов. Было предложено использовать в жидкостной экстракции обратные микроэмульсии, находящиеся в равновесии с водной фазой, из которой идет извлечение (микроэмульсионные системы типа Винзор II). Органическую фазу (раствор экстрагента, ПАВ и/или соПАВ) приводят в контакт с исчерпываемым водным раствором, при этом в органической фазе формируется обратная микроэмульсия, которая находится в равновесии с водной фазой. При таком подходе достигается более высокое извлечение металла в органическую фазу. В одних системах роль ПАВ и экстрагента выполняет одно и то же вещество, в другие системы наряду с экстрагентом вводят одно или несколько ПАВ. Недавние примеры экстракции металлов в микроэмульсионных системах представлены в табл. 1.
Таблица 1.
Примеры экстракции металлов в микроэмульсионных системах Винзор II
| № | Извлекаемый металл | Экстрагент | Микроэмульсионная система | Год | Литера- турный источник |
|---|---|---|---|---|---|
| 1 | V(V) | Aliquat 336 (хлорид триоктилметиламмония) | Aliquat 336–изоамиловый спирт–гептан–водный раствор NaCl и NaOH | 2020 | 57 |
| 2 | Co(II), Mn(II) | додеканоат натрия, олеат натрия |
Додеканоат натрия–н-пентанол–гептан–водный раствор NaCl, CoCl2 и MnCl2; олеат натрия–н-пентанол–гептан–водный раствор NaCl, CoCl2 и MnCl2 |
2019 | 58 |
| 3 | Co(II) | Д2ЭГФК + Д2ЭГФNa, Д2ЭГФК + Д2ЭГФNH4 | Д2ЭГФNa–Д2ЭГФК–толуол–водный раствор CoSO4; Д2ЭГФNH4–Д2ЭГФК–толуол–водный раствор CoSO4; |
2019 | 59 |
| 4 | Mn(II) | Олеат натрия | Олеат натрия–н-пентанол–гептан–водный раствор NaCl и MnCl2 | 2018 | 60 |
| 5 | V(V) | N263 (хлорид метилтриоктил-аммония) | N263–изоамиловый спирт–гептан–водный раствор NaCl и Na3VO4 | 2018 | 61 |
| 6 | Re(VII) и его отделение от Mo(VI) | N263 (хлорид метилтриоктил-аммония) | N263–ТБФ–гептан–водный раствор NaCl, NH4ReO4 и HCl (в том числе в присутствии MO(VI)) | 2016 | 62 |
| 7 | Pd(II) и его отделение от Cu(II), Co(II), Ni(II), Fe(III), Al(III), Zn(II), Ce(III), Li(I), Mg(II), Sn(IV) |
[Si4mim]Cl (хлорид 1-метил-3-[три-(триметилсилокси)]силил-пропил имидазолия, ионная жидкость) | [Si4mim]Cl–н-гексанол–гептан–водный раствор NaCl, PdCl2 и HCl (в том числе в присутствии хлоридов Cu(II), Co(II), Ni(II), Fe(III), Al(III), Zn(II), Ce(III), Li(I), Mg(II), Sn(IV)) |
2016 | 63 |
| 8 | Re(VII) и его отделение от Mo(VI) | N235 (триалкил-амин) | Triton X-100–N235–изоамиловый спирт–гептан–водный раствор NaCl, NH4ReO4 и HCl (в том числе в присутствии MO(VI)) | 2015 | 64 |
| 9 | Co(II) | АОТ (бис-2-этилгексил) сульфо-сукцинат натрия | АОТ–н-пентанол–гептан–водный раствор NaCl и CoCl2 | 2012 | 65 |
| 10 | Th(IV) | Д2ЭГФК + Д2ЭГФNa, Д2ЭГФК + АОТ |
Д2ЭГФNa–Д2ЭГФК–н-октанол–гептан–водный раствор Th(NO3)4; AOT–Д2ЭГФК–н-октанол–гептан–водный раствор Th(NO3)4 |
2012 | 66 |
| 11 | Eu(III) | Олеат натрия | Олеат натрия–пентанол–гептан–водный раствор NaCl и EuCl3 | 2012 | 67 |
| 12 | Au(III) и его отделение от Cu(II), Cd(II), Co(II), Ni(II), Sb(III), Fe(III), Al(III), Sn(IV)) |
[C14mim]Br (бромид 1-н-тетрадецил-3-метилимид-азолия, ионная жидкость) | [C14mim]Br–гексанол–циклогексан–водный раствор HCl и HAuCl4 (в том числе в присутствии хлоридов Cu(II), Cd(II), Co(II), Ni(II), Sb(III), Fe(III), Al(III), Sn(IV)) | 2012 | 68 |
| 13 | Au(III) | CTAB (бромид цетилтриметил аммония) | CTAB–изоамиловый спирт–гептан–водный раствор Na2SO3, HAuCl4 и HCl | 2011 | 69 |
Аналогично обратным микроэмульсиям, для экстракции металлов можно использовать обратные мицеллы. Например, изучено экстракционное извлечение из кислых сульфатно-хлоридных растворов анионных комплексов Pt(IV) и Au(III) с помощью обратных мицелл оксиэтилированных ПАВ, таких как Triton N-42 в декане, и смешанных мицелл нескольких ПАВ [70, 71].
Нужно отметить, что для извлечения органических веществ, в том числе белков, обратные мицеллы и микроэмульсии получили существенно большее распространение, чем для экстракции металлов. Солюбилизация белковых молекул в обратных мицеллах или каплях обратной МЭ и последующая стадия реэкстракции позволяет выделять их из водной среды с высокой степенью извлечения и с сохранением активности ферментов [72, 73]. Тот факт, что применение обратных мицелл и микроэмульсий для экстракции металлов не получило широкого распространения, объясняется, вероятно, сложностью предлагаемых систем. В отличие от экстракции металлов, при извлечении белков не происходит химической реакции, т.е. это более простые системы с точки зрения их описания. Для экстракционной системы с химической реакцией и со структурированной органической фазой (мицеллы или микроэмульсия) становится довольно сложно предсказать поведение, особенно в условиях реального технологического процесса, в присутствии различных примесей. Возможно, микроэмульсии и мицеллы, образующиеся в экстракционных системах, могут быть более востребованы не в жидкостной экстракции металлов, а в смежных областях.
ДРУГИЕ ПУТИ ПРИМЕНЕНИЯ СТРУКТУРООБРАЗОВАНИЯ В ЭКСТРАКЦИОННЫХ СИСТЕМАХ
Микроэмульсионное выщелачивание. Был предложен новый метод извлечения металлов из частиц твердой фазы с помощью экстрагентсодержащих микроэмульсий (микроэмульсионного выщелачивания) [74]. Метод микроэмульсионного выщелачивания предполагает извлечение металлов из природного или техногенного сырья (рудных концентратов, шламов, зол, пылей и т.д.) путем его контакта с экстрагентсодержащей микроэмульсией. После выщелачивания твердая фаза отделяется и целевые компоненты из микроэмульсии реэкстрагируются (рис. 4).
Главным достоинством микроэмульсионного выщелачивания является селективное извлечение целевых компонентов и их включение в капли микроэмульсии (экстракция) уже на стадии обработки твердой фазы (выщелачивания), то есть совмещение выщелачивания и экстракции в одном аппарате. Таким образом, микроэмульсионное выщелачивание можно отнести к группе активно исследуемых в настоящее время совмещенных процессов, таких как, например, реакционная дистилляция или экстрактивная дистилляция [75–77].
На модельной системе с оксидом меди и микроэмульсией Д2ЭГФNa, содержащей Д2ЭГФК, было изучено влияние концентрации экстрагента и условий выщелачивания на извлечение металла [74, 78]. Показано [79], что извлечение меди идет с образованием среднего ди-(2-этилгексил)фосфата согласно уравнению реакции
(2)
$\begin{gathered} {\text{Cu}}{{{\text{O}}}_{{{\text{(S)}}}}} + 2{\text{DEHP}}{{{\text{A}}}_{{{\text{(ME)}}}}} = \\ = \,\,{\text{Cu}}{{\left( {{\text{DEHP}}} \right)}_{{{\text{2(ME)}}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{(ME)}}}}}, \\ \end{gathered} $Селективность извлечения целевых компонентов при микроэмульсионном выщелачивании обеспечивается за счет селективности экстрагента, входящего в состав микроэмульсии. Поэтому можно избежать перехода в жидкую фазу при выщелачивании веществ, которые плохо извлекаются соответствующим экстрагентом, например соединений кальция, железа, кремния. Например, было исследовано выщелачивание меди, кобальта, никеля и железа из окисленного кобальтово-медного концентрата с помощью обратных микроэмульсий Д2ЭГФNa, содержащих в качестве экстрагента Д2ЭГФК или смесь ТБФ и уксусной кислоты. Микроэмульсия, содержащая в органической фазе 0.3 моль/л Д2ЭГФК и 1.6 моль/л Д2ЭГФNa, показала сочетание высокой степени извлечения Cu (72.1%) с селективностью выщелачивания; степень извлечения Fe не превышала 0.5% [79].
В процессе микроэмульсионного выщелачивания можно применять микроэмульсии на основе ПАВ, которые промышленно производятся в больших объемах. Например, показана возможность применения микроэмульсии додецилсульфата натрия, содержащей экстрагенты капроновую кислоту, Д2ЭГФК, смесь ТБФ и уксусной кислоты, для выщелачивания цветных металлов из оксидного сырья. Наиболее высокие степени извлечения меди достигались при содержании в микроэмульсии 2.0 моль/л капроновой кислоты или 0.25 моль/л ди-(2-этилгексил)фосфорной кислоты [80].
Отметим, что микроэмульсионное выщелачивание может служить альтернативой развивающемуся в последние годы методу извлечения металлов из частиц твердой фазы (в том числе из рудного и вторичного сырья) за счет селективного растворения их оксидов в глубоких эвтектических растворителях [81, 82].
Химическое полирование металлов с помощью обратных микроэмульсий Д2ЭГФNa, содержащих кислоту и ТБФ. Микроэмульсии в качестве наноструктурированных носителей реагентов могут использоваться не только для выщелачивания, но и для разработки и усовершенствования других процессов, происходящих в системах жидкость–твердая фаза. Обратная микроэмульсия, как носитель реагента, растворяющего металл, может применяться для снижения шероховатости поверхности (химического полирования) металлов. Механизм такого полирования, вероятно, заключается в ограничении диффузии полирующего реагента (кислоты) к ровным участкам и углублениям на поверхности металла и преимущественному растворению выступов за счет локализации кислоты в каплях с размером порядка 10 нм [83].
На примере алюминия было исследовано химическое полирование металла с помощью обратных микроэмульсий Д2ЭГФNa в керосине. Показана возможность снижения шероховатости поверхности алюминиевой фольги при ее обработке микроэмульсией Д2ЭГФNa, содержащей соляную, уксусную или азотную кислоту и ТБФ. Трибутилфосфат вводили в состав микроэмульсии, чтобы он образовал аддукт с кислотой, что позволяет увеличить количество кислоты, которое может солюбилизироваться в микроэмульсии. При времени полирования 2 ч среднеарифметическая шероховатость поверхности алюминия снижалась с 54 до 29–30 нм для микроэмульсий, содержавших указанные кислоты в концентрации 0.026 моль/л; концентрации ТБФ и Д2ЭГФNa в микроэмульсии составляли 0.15 и 1.22 моль/л соответственно. При этом составы, не образующие микроэмульсии (водный раствор соляной кислоты, раствор аддукта трибутилфосфата с соляной кислотой в керосине, дисперсия Д2ЭГФNa в водном растворе соляной кислоты), не обладали полирующим действием [83].
Получение металлических и оксидных наночастиц. Для синтеза наночастиц можно использовать процесс образования твердых частиц при химической реакции, происходящей вблизи границы раздела двух жидких фаз, аналогично образованию межфазных пленок и медуз в экстракционных системах. Предложены новые методы получения микро- и наночастиц оксида цинка и оксида железа (магнетита) в двухфазных водных экстракционных системах, содержащих полиэтиленгликоль. Одна из фаз содержала исходную соль (или соли) металла, другая – осадитель (NaOH или NH4OH), в межфазной области наблюдалось образование твердых частиц [84, 85]. Были синтезированы наночастицы серебра в двухфазной водной системе с полиэтиленгликолем и цитратом натрия [86].
Можно синтезировать наночастицы, используя мицеллы и микроэмульсии в экстракционных системах. Например, изучено образование наночастиц золота в обратных мицеллах неионного ПАВ Triton N-42 в декане восстановлением гидразином ${\text{AuCl}}_{4}^{ - }$ после его экстракции из кислых сульфатно-хлоридных растворов [87]. После экстракции в обратные мицеллы бис-(2-этилгексил)сульфосукцината натрия были синтезированы наночастицы серебра и CdS [88].
В качестве темплата для синтеза наночастиц и наноматериалов можно применять структурированную третью фазу, образующуюся в экстракционных системах с нейтральными фосфорорганическими экстрагентами. Описано получение наночастиц TiO2 размером 20 нм в форме анатаза при воздействии раствора аммиака на третью фазу, образующуюся в экстракционной системе трибутилфосфат–керосин–водный раствор H2SO4–TiOSO4 [89]. Показан синтез мезопористого ZrO2 при осаждении раствором аммиака Zr(IV) в третьей фазе в экстракционной системе триоктилфосфиноксид или триалкилфосфиноксид–керосин–водный раствор ZrOCl2 и HCl [90]. Полые микросферы из CeF3, допированного Tb3+, были получены в экстракционной системе, содержащей комплекс из экстрагентов Cyanex 272 (бис(2,4,4-триметилпентил)фосфиновая кислота) и Aliquat 336 (хлорид метилтриоктиламмония) в н-гептане и водный раствор Ce3+, Tb3+ и HNO3, при обработке третьей фазы раствором NaBF4 [91]. Синтезированы цветочноподобные наноструктуры CePO4 на границе двух жидких фаз при контакте третьей фазы экстракционной системы, насыщенной Ce(III), и водного раствора, содержащего фосфат-ионы [92].
Как метод, в котором для синтеза наночастиц используются экстракционные системы, можно рассматривать экстракционно-пиролитический. Для получения неорганических частиц сложного состава проводят экстракцию металлов из водных растворов, смешивание экстрактов различных металлов в нужных соотношениях, отгонку под вакуумом органического растворителя и избытка экстрагента и затем термическую обработку (пиролиз). При этом после испарения растворителя и избытка экстрагента образуется аморфный осадок (паста) карбоксилатов или ди-(2-этилгексил)фосфатов металлов, а после прокаливания формируются кристаллические частицы [93, 94].
Использование прямых мицелл для извлечения металлов из водной фазы. Предложено использовать прямые мицеллы, содержащие подходящий ПАВ, экстрагент или комплексообразователь, для извлечения металлов из водной фазы. В отличие от жидкостной экстракции, органический растворитель в систему не вносится. Ионы металла распределяются из водного раствора в прямые мицеллы, которые затем отделяются. Такой метод позволяет концентрировать выделяемый металл в небольшом объеме мицеллярной псевдофазы. Этот подход можно применять для очистки сточных вод, где загрязнитель находится в малых концентрациях, и для предварительного концентрирования металла в аналитической химии. Мицеллы можно отделить от водного раствора с помощью ультрафильтрации, используя мембрану с порами нужного размера – этот метод известен как мицеллярно-усиленная ультрафильтрация (англ. micellar enhanced ultrafiltration). Другой способ основан на осаждении обогащенной ПАВ и выделяемым металлом фазы (коацервата) при изменении температуры или добавлении соли – это метод экстракции в точке помутнения (англ. cloud point extraction) [95–97].
В качестве примеров использования прямых мицелл для экстракции металлов можно привести недавно опубликованные работы по извлечению иона ${\text{UO}}_{2}^{{2 + }}$ мицеллами неионного ПАВ Triton X-100, содержащего экстрагент Д2ЭГФК [98], по экстракции хлорокомплексов Au(III), Pd(II), Pt(IV) из раствора HCl с помощью мицелл Triton X-100, содержащих ионную жидкость хлорид три(гексил)тетрадецилфосфония [99], извлечение Co смешанными мицеллами неионного ПАВ моно-н-додецилового эфира октаэтиленгликоля и додецилсульфата натрия, содержащими экстрагент Cyanex 272 (бис-2,4,4-триметилпентилфосфиновую кислоту) [100], отделение ${\text{UO}}_{2}^{{2 + }}$ от Th4+ и Ln3+ при помощи мицелл неионного ПАВ Triton X-114, содержащих экстрагент Cyanex 301 (бис-2,4,4-триметилпентил)дитиофосфинат) [101].
Таким образом, развитие научных основ по применению самоорганизующихся наноструктур поверхностно-активных веществ в процессах гидрометаллургии позволяет решать крайне актуальную в настоящее время задачу разработки энергоресурсоэффективных химико-технологических процессов [102 ] .
ЗАКЛЮЧЕНИЕ
Структурообразование в экстракционных системах с солями металлов может происходить за счет образования координационных полимеров и частиц твердой фазы, формирующих осадки и гели, которые, в свою очередь, могут стабилизировать эмульсии, и при ассоциации амфифильных молекул с образованием мицелл, микроэмульсий и лиотропных жидких кристаллов. Структурообразование может протекать как в области границы раздела водной и органической фаз, так и в объеме одной из жидких фаз.
Структурообразование в экстракционных системах может иметь как отрицательные, так и положительные стороны (рис. 5).
В одних случаях структурообразование нежелательно, оно приводит к уменьшению скорости экстракции при образовании межфазных пленок, ухудшает разделение фаз за счет формирования стабильных эмульсий, гелей и межфазных взвесей (медуз). Еще одним осложнением процесса экстракции является образование третьей (средней) фазы. В других случаях самопроизвольно образующиеся наноструктуры, например обратные мицеллы или микроэмульсии, могут повышать степень извлечения веществ, повышать скорость извлечения, что дает возможность улучшать существующие процессы жидкостной экстракции.
Использование самоорганизующихся наноструктур перспективно для разработки новых технологий извлечения и разделения веществ, таких как процесс экстракции с использованием обратных мицелл или микроэмульсий. Структурообразование в экстракционных системах можно применять в смежных областях, например для синтеза наночастиц и для выщелачивания металлов с помощью экстрагентсодержащих микроэмульсий. Такой подход позволит создавать новые энерго- и ресурсосберегающие процессы разделения веществ, в том числе совмещенные, при которых несколько процессов объединены в одном аппарате.
ОБОЗНАЧЕНИЯ
| С | молярная концентрация, моль/л |
| D | коэффициент распределения металла |
| W | соотношение молярных концентраций воды и ПАВ |
ИНДЕКСЫ
Список литературы
Sole K.C. Solvent extraction in the hydrometallurgical processing and purification of metals // Solvent Extraction and Liquid Membranes: Fundamentals and Applications in New Materials / Eds. Aguilar M., Cortina J.L. Boca Raton, Fla.: CRC, 2008. P. 141.
Narbutt J. Solvent Extraction for Nuclear Power // Liquid-Phase Extraction (Handbooks in Separation Science) / Ed. Poole C.F. Amsterdam: Elsevier, 2020. P. 725.
Ritcey G.M. Crud in solvent extraction processing – a review of causes and treatment // Hydrometallurgy. 1980. V. 5. № 2–3. P. 97.
Zimmer E., Borchardt J. Crud formation in the Purex and Thorex processes // Nucl. Technol. 1986. V. 75. № 3. P. 332.
Sugai H. Crud in solvent washing process for nuclear fuel reprocessing // J. Nucl. Sci. Technol. 1992. V. 29. № 5. P. 445.
Sperline R.P., Song Y., Ma E., Freiser H. Organic constituents of cruds in Cu solvent extraction circuits. I. Separation and identification of diluents-soluble compounds // Hydrometallurgy. 1998. V. 50. № 1. P. 1.
Taghizadeh M., Ghasemzadeh R., Ghanadi Maragheh M., Ashrafizadeh S.N. Crud formation in the solvent extraction system Zr(IV), HNO3-D2EHPA // Miner. Process. Extr. Metall. Rev. 2009. V. 30. P. 260.
Zagorodnyaya A.N., Abisheva Z.S., Sadykanova S.E. et al. The characterisation and origins of interphase substances (cruds) in the rhenium solvent extraction circuit of a copper smelter // Hydrometallurgy. 2010. V. 104. P. 308.
Ning P., Cao H., Xiao Lin X., Zhang Y. The crud formation during the long-term operation of the V(V) and Cr(VI) extraction // Hydrometallurgy. 2013. V. 137. P. 133.
Matyushina V.A., Kolmachikhina O.B., Vakula K.A. Centrifugation of interphase suspension with the use of surfactants // Solid State Phenom. 2020. V. 299. P. 1075.
Wang C. Crud formation and its control in solvent extraction // Proc. International Solvent Extraction Conference ISEC'2005 / Eds. Fei W., Liu H., Yan Ch. Beijing, 2005. P. 1066.
Yagodin G.A., Tarasov V.V., Ivakhno S.Yu. Condensed interfacial films in metal extraction systems // Hydrometallurgy. 1982. V. 8. № 3. P. 293.
Yagodin G.A., Tarasov V.V. Interfacial phenomena in liquid-liquid extraction // Solvent Extr. Ion Exch. 1984. V. 2. № 2. P. 139.
Kizim N.F., Nesterova O.P., Davydov Yu.P. Rheological properties of interface in extraction systems with organophosphorus acids // Russ. J. Appl. Chem. 1998. V. 71. № 9. P. 1537. [Кизим Н.Ф., Нестерова О.П., Давыдов Ю.П. Реологические свойства межфазного слоя в экстракционных системах с фосфорорганическими кислотами // Ж. прикл. хим. 1998. Т. 71. № 9. С. 1444.]
Tomita A., Kanki T., Asano T., Sano N. Formation of crystal film at interface in process of extraction of rare earth metals by D2EHPA // J. Chem. Eng. Jpn. 2000. V. 33. № 4. P. 661.
Golubina E.N., Kizim N.F., Chekmarev A.M. Properties of the material of interphase formations based on lanthanide di-(2-ethylhexyl)phosphate // Russ. J. Phys. Chem. A. 2014. V. 88. № 9. P. 1594. [Голубина Е.Н., Кизим Н.Ф., Чекмарев А.М. Свойства межфазных образований на основе ди-(2-этилгескил)фосфата лантаноида // Журн. физ. хим. 2014. Т. 88. № 9. С. 1429.]
Golubina E.N., Kizim N.F., Sinyugina E.V., Chernyshev I.N. Self-assembled structures based on rare earth element salts in the interfacial layer of a liquid / liquid system // Mendeleev Commun. 2018. V. 28. № 1. P. 110.
Sinegribova O.A., Chizhevskaya S.V., Glagolenko I.Yu., Klimenko O.M. Effect of silicic acid on mass transfer in extraction of mineral acids and zirconium nitrate to TBP // Russ. J. Inorg. Chem. 1996. V. 41. № 11. P. 1801. [Синегрибова О.А., Чижевская С.В., Глаголенко И.Ю., Клименко О.М. Влияние кремниевой кислоты на массопередачу при экстракции неорганических кислот и нитрата циркония в ТБФ // Журн. неорг. хим. 1996. Т. 41. № 11. С. 1898.]
Stoyanov E.S. IR spectroscopic investigation of the structure of polymeric uranyl di(2-ethylhexyl)phosphate molecules in C6H6 and CCl4 solutions // J. Struct. Chem. 1994. V.35. №6. P.804. [Стоянов Е.С. О строении полимерных молекул ди-(2-этилгексил)фосфата уранила в растворах C6H6 и CCl4 по данным ИК-спектроскопии // Журн. структ. хим. 1994. Т. 35. № 6. С. 60.]
Stoyanov E.S., Mikhailov V.A., Petrukhin O.M. et al. A study of complexes yielded by HNO3 Fe(III) and Eu(III) extraction from nitrate media with acidic Zr(IV) and Hf(IV) di-2-ethylhexylphsphates // Solvent Extr. Ion Exch. 1991. V. 9. № 5. P. 787.
Thiyagarajan P., Diamond H., Danesi P.R., Horwitz E.P. Small-angle neutron-scattering studies of cobalt(II) organophosphorus polymers in deuteriobenzene // Inorg. Chem. 1987. V. 26. № 25. P. 4209.
Suglobov D.N., Trifonov Yu.I., Legin E.K., Tutov A.G. DEHP complexes of lanthanides (III) and actinides (III) // J. Alloys Compd. 1994. V. 213–214. P. 523.
Antico E., Masana A., Hidalgo M. et al. Solvent extraction of yttrium from chloride media by di(2-ethylhexyl)phosphoric acid in kerosene. Speciation studies and gel formation // Anal. Chim. Acta. 1996. V. 327. P. 267.
Scharf C., Ditze A., Schwerdtfeger K. et al. Investigation of the structure of neodymium–di-(2-ethylhexyl) phosphoric acid combinations using electrospray ionization and matrix-assisted laser desorption ionization mass spectrometry and nuclear magnetic resonance spectroscopy // Metall. Mater. Trans. B. 2005. V. 36. P. 429.
Yurtov E.V., Murashova N.M., Datsenko A.M. Gel formation in extraction of terbium by bis(2-ethylhexyl) hydrogen phosphate // Russ. J. Inorg. Chem. 2006. V. 51. № 4. P. 670. [Юртов Е.В., Мурашова Н.М., Даценко А.М. Гелеобразование при экстракции тербия ди-(2-этилгексил)фосфорной кислотой // Ж. неорг. хим. 2006. Т. 51. № 4. С. 728.]
Yurtov E.V., Murashova N.M. Gels, emulsions, and liquid crystals in extraction systems with di(2-ethylhexyl)phosphoric acid // Theor. Found. Chem. Eng. 2007. V. 41. № 5. P. 738. [Юртов Е.В., Мурашова Н.М. Гели, микроэмульсии и жидкие кристаллы в экстракционных системах с ди-(2-этилгексил)фосфорной кислотой // Хим. технол. 2006. Т. 7. № 6. С. 26.]
Yurtov E.V., Murashova N.M. Gelation in extraction systems with basic copper(II) and neodymium(III) alkyl phosphates // Russ. J. Appl. Chem. 2002. V. 75. № 7. P. 1064. [Юртов Е.В., Мурашова Н.М. Гелеобразование в экстракционных системах с алкилфосфатами меди (II) и неодима (III) // Журн. прикл. хим. 2002. Т. 75. № 7. С. 1081.]
Rao P.R.V., Kolarik Z. A review of third phase formation in extraction of actinides by neutral organophosphorus extractants // Solvent Extr. Ion Exch. 1996. V. 14. № 6. P. 955.
Durain J., Bourgeois D., Bertrand M., Meyer D. Comprehensive Studies on Third Phase Formation: Application to U(VI)/Th(IV) Mixtures Extracted by TBP in N-dodecane // Solvent Extr. Ion Exch. 2019. V. 37. № 5. P. 328.
Rama Swami K., Venkatesan K.A., Antony M.P. Role of Phase Modifiers in Controlling the Third-phase Formation During the Solvent Extraction of Trivalent Actinides // Solvent Extr. Ion Exch. 2019. V. 37. № 7. P. 500.
Chandrasekar A., Sivaraman N., Ghanty T.K., Suresh A. Experimental evidence and quantum chemical insights into extraction and third phase aggregation trends in Ce(IV) organophosphates // Sep. Purif. Technol. 2019. V. 217. P. 62.
Wesling P., Mullich U., Guerinoni E. et al. Solvent extraction of An(III) and Ln(III) using TODGA in aromatic diluents to suppress third phase formation // Hydrometallurgy. 2020. V. 192. № 3. Article number 105248.
Berger C., Marie C., Guillamont D. et al. Extraction of Uranium(VI) and Plutonium(IV) with Tetra-Alkylcarbamides // Solvent Extr. Ion Exch. 2019. V. 37. № 2. P. 111.
Zilberman B.Ya., Fedorov Yu.S., Borovikov E.A. et al. Extraction of uranium inro a third phase of thorium nitrate – tributyl phosphate // J. Radioanal. Nucl. Chem. 1991. V. 150. № 2. P. 363.
Fu X., Xiaopeng H., Zuhua Z. et al. Three phase extraction study. I. Tri-butyl phosphate-kerosene/ H2SO4–H2O extraction system // Colloids Surf., A. 1999. V. 152. P. 335.
Szymanowski J., Cote G., Blondet I. Interfacial activity of bis(2-ethylhexyl) phosphoric acid in model liquid-liquid extraction systems // Hydrometallurgy. 1997. V. 44. № 1–2. P. 163.
Gaonkar A.G., Neuman R.D. Interfacial activity, extractant selectivity, and reversed micellization in hydrometallurgical liquid/liquid extraction systems // J. Colloid Interface Sci. 1987. V. 119. № 1. P. 251.
Faure A., Tistcheko A.M., Zemb T., Chachaty C. Aggregation and dynamical behavior in sodium diethylhexyl phosphate/water/benzene inverted micelles // J. Phys. Chem. 1985. V. 89. № 15. P. 3373.
Feng K.I., Schelly Z.A. Equilibrium properties of crystallites and reverse micelles of sodium bis(2-ethylhexyl)phosphate in benzene // J. Phys. Chem. 1995. V. 99. № 47. P. 17207.
Yu Z.-J., Neuman R.D. Reversed micellar solution-to-bicontinuous microemulsion transition in sodium bis(2-ethylhexyl)phosphate/n-heptane/water system // Langmuir. 1995. V. 11. № 4. P. 1981.
Steytler D.C., Sargeant D.L., Welsh G.E. et al. Ammonium bis(ethylhexyl) phosphate: a new surfactant for microemulsions // Langmuir. 1996. V. 12. № 22. P. 5312.
Steytler D.C., Jenta T.R., Robinson B.H. Structure of reversed micelles formed by metal salts of bis(ethylhexyl) phosphoric acid // Langmuir. 1996. V. 12. № 6. P. 1483.
Neuman R.D., Park S.J. Characterization of association microstructures in hydrometallurgical nickel extraction by di(2-ethylhexyl)phosphoric acid // J. Colloid Interface Sci. 1992. V. 152. № 1. P. 41.
Zhou N., Wu J., Yu Z. et al. Investigation of aggregation in solvent extraction of lanthanides by acidic extractants (organophosphorus and naphthenic acid) // Sci. China, Ser. B: Chem. 1997. V. 40. № 1. P. 61.
Neuman R.D., Zhou N., Wu J. et al. General model for aggregation of metal-extractant complexes in acidic organophosphorus solvent extraction systems // Sep. Sci. Technol. 1990. V. 25. № 13–15. P. 1655.
Jääskeläinen E., Paatero E. Properties of the ammonium form of Versatic 10 in a liquid–liquid extraction system // Hydrometallurgy. 1999. V. 51. № 1. P. 47.
Shioi A., Harada M., Tanabe M. X-ray and light scattering from oil-rich microemulsions containing sodium bis(2-ethylhexyl) phosphate // Langmuir. 1996. V. 12. № 13. P. 3201.
Bukar N.V., Kim V., Chekmarev A.M. et al. Phase equilibria in the four-component aqueous-organic systems containing sodium di-2-ethylhexyl phosphate and nonelectrolytes // Colloid J. 1996. V. 58. № 4. P. 423. [Букарь Н.В., Ким В., Чекмарев А.М. и др. Фазовые равновесия в четырехкомпонентных водно-органических системах, содержащих ди-(2-этилгексил)фосфат натрия и неэлектролиты // Коллоидн. журн. 1996. Т. 58. № 4. С. 445.]
Lopian T., Dourdain S., Kunz W., Zemb T. A formulator’s cut of the phase prism for optimizing selective metal extraction // Colloids Surf., A. 2018. V. 557. № 1. P. 2.
Yurtov E.V., Murashova N.M. Phase equilibria and nonequilibrium structures in the sodium di-2-ethylhexyl phosphate – decane – water system // Colloid J. 2004. V. 66. № 5. P. 629. [Юртов Е.В., Мурашова Н.М. Фазовые равновесия и неравновесные структуры в системе ди-(2-этилгексил)фосфат натрия – декан – вода // Коллоидн. журн. 2004. Т. 66. № 5. С. 702.]
Murashova N.M., Polyakova A.S., Yurtov E.V. The influence of di-(2-ethylhexyl)phosphoric acid on the properties of microemulsion in the sodium di-(2-ethylhexyl)phosphate–di-(2-ethylhexyl)phosphoric acid–decane–water system // Colloid J. 2018. V. 80. № 5. P. 513. [Мурашова Н.М., Полякова А.С., Юртов Е.В. Влияние ди-(2-этилгексил)фосфорной кислоты на свойства микроэмульсии в системе ди-(2-этилгексил)фосфат натрия – ди-(2-этилгексил)фосфорная кислота – декан – вода // Коллоидн. журн. 2018. Т. 80. № 5. С. 541.]
Osseo-Asare K. Enhanced solvent extraction with water-in-oil microemulsions // Sep. Sci. Technol. 1988. V. 23. № 12–13. P. 1269.
Bukar N.V., Kim V., Olenicheva O.O. et al. Effect of octanol-1 on extraction of metals by di-2-ethylhexylphosphoric acid // Russ. J. Inorg. Chem. 1999. V. 44. № 7. P. 1147. [Букарь Н.В., Ким В., Оленичева О.О. и др. Влияние октанола-1 на экстракцию металлов ди-2-этилгексилфосфорной кислотой // Журн. неорг. хим. 1999. Т. 44. № 7. С. 1215.]
Brejza E.V., Perez de Ortiz E.S. Phenomena affecting the equilibrium of Al(III) and Zn(II) extraction with Winsor II microemulsions // J. Colloid Interface Sci. 2000. V. 227. № 1. P. 244.
Szymanowski J., Tondre C. Kinetics and interfacial phenomena in classical and micellar extraction systems // Solvent Extr. Ion Exch. 1994. V. 12. № 4. P. 873.
Nitsch W., Plucinski P., Ehrlenspiel J. Connection of ion and water exchange between an aqueous and a microemulsion phase // J. Phys. Chem. B. 1997. V. 101. № 20. P. 4024.
Guo Y., Li H.-Y., Yuan Y.-H. et al. Microemulsion extraction: An efficient way for simultaneous detoxification and resource recovery of hazardous wastewater containing V(V) and Cr(VI) // J. Hazard. Mater. 2020. V. 386. Article number 121948.
Yang X., Jie F., Wang B., Bai Z. High-efficient synergistic extraction of Co(II) and Mn(II) from wastewater via novel microemulsion and annular centrifugal extractor // Sep. Purif. Technol. 2019. V. 209. P. 997.
Sun M., Liu S., Zhang Y. Insights into the saponification process of di(2-ethylhexyl) phosphoric acid extractant: Thermodynamics and structural aspects // J. Mol. Liq. 2019. V. 280. P. 252.
Jie F., Bai Z., Yang X. Extraction of Mn(II) from NaCl solution by NaCl/sodium oleate/n-pentanol/n-heptane microemulsion system // Sep. Sci. Technol. 2018. V. 55. № 9. P. 1351.
Guo Y., Li H.-Y., Lin M.-M., Xie B. Extraction of Vanadium from Vanadium-Containing APV-Precipitated Wastewater by W/O Microemulsion System // Rare Metal Technology 2018 (The Minerals, Metals & Materials Series) / Eds. Kim H., Wesstrom B., Alam S., Ouchi T., Azimi G., Neelameggham N.R., Wang S., Guan X. Cham: Springer, 2018. P. 309.
Lou Z., Gui X., Zang S. et al. Extraction of Re(VII) from hydrochloric acid medium by N263/TBP/n-heptane/NaCl microemulsion // Hydrometallurgy. 2016. V. 165. P. 329.
Zheng Y., Fang L., Yan Y. et al. Extraction of palladium (II) by a silicone ionic liquid-based microemulsion system from chloride medium // Sep. Purif. Technol. 2016. V. 169. P. 289.
Lou Z., Guo C., Feng X. et al. Selective extraction and separation of Re(VII) from Mo(VI) by TritonX-100/N235/iso-amyl alcohol/n-heptane/NaCl microemulsion system // Hydrometallurgy. 2015. V. 157. P. 199.
Shang K., Yang Y. Z., Guo J. X. et al. Extraction of cobalt by the AOT microemulsion system // J. Radioanal. Nucl. Chem. 2012. V. 291. № 3. P. 629.
Gao S., Shen X., Chen Q., Gao H. Solvent extraction of thorium(IV) using W/O microemulsion // Sci. China: Chem. 2012. V. 55. № 9. P. 1712.
Wang W., Yang Y.Z., Zhao H. et al. Extraction of europium by sodium oleate/pentanol/heptane/NaCl microemulsion system // J. Radioanal. Nucl. Chem. 2012. V. 292. № 3. P. 1093.
Tong Y., Han L., Yang Y. Microemulsion extraction of gold(III) from hydrochloric acid medium using ionic liquid as surfactant and extractant // Ind. Eng. Chem. Res. 2012. V. 51. № 50. P. 16438.
Lu W., Lu Y., Liu F. et al. Extraction of gold(III) from hydrochloric acid solutions by CTAB/n-heptane/iso-amyl alcohol/Na2SO3 microemulsion // J. Hazard. Mater. 2011. V. 186. № 2–3. P. 2166.
Bulavchenko A.I., Podlipskaya T.Yu., Arymbaeva A.T. Extraction-Electrophoretic Concentration of Gold by Reverse Mixed Micelles of Triton N-42 and AOT // Sep. Sci. Technol. 2010. V. 46. № 1. P. 54.
Podlipskaya T.Yu., Bulavchenko A.I., Sheludyakova L.A. Study of water properties during Pt(IV) and Au(III) extraction by Triton N-42 reverse micelles from acid sulphate-chloride solutions // J. Struct. Chem. 2011. V. 52. № 5. P. 980. [Подлипская Т.Ю., Булавченко А.И., Шелудякова Л.А. Исследование свойств воды при экстракции Pt(IV) и Au(III) обратными мицеллами Triton N-42 из кислых сульфатно-хлоридных растворов // Журн. структ. хим. 2011. Т. 52. № 5. С. 1006.]
Tonova K., Lazarova Z. Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion // Biotechnol. Adv. 2008. V. 26. P. 516.
Sun X., Bandara N. Applications of reverse micelles technique in food science: A comprehensive review // Trends Food Sci. Technol. 2019. V. 91. P. 106.
Yurtov E.V., Murashova N.M. Leaching of metals with extractant-containing microemulsions // Theor. Found. Chem. Eng. 2011. V. 45. № 5. P. 726. [Юртов Е.В., Мурашова Н.М. Выщелачивание металлов экстрагент-содержащими микроэмульсиями // Хим. технол. 2010. Т. 11. № 8. С. 479.]
Kulov N.N. Some problems of separation of mixtures // Theor. Found. Chem. Eng. 2007. V. 41. № 1. P. 1. [Кулов Н.Н. О некоторых проблемах разделения смесей // Теор. осн. хим. технол. 2007. Т. 41. № 1. С. 3.]
Lupachev E.V., Polkovnichenko A.V., Kvashnin S.Y. et al. Batch reactive distillation in bromodifluoroacetic acid synthesis technology // Theor. Found. Chem. Eng. 2019. V. 53. № 1. P. 1. [Лупачев Е.В., Полковниченко А.В., Квашнин С.Я. и др. Технология периодической реакционной дистилляции на примере получения бромдифторуксусной кислоты // Теор. осн. хим. технол. 2019. Т. 53. № 1. С. 3.]
Lotkhov V.A., Kvashnin S.Y., Kulov N.N. Effect of separating agent in extractive distillation // Theor. Found. Chem. Eng. 2020. V. 54. № 1. P. 172. [Лотхов В.А., Квашнин С.Я., Кулов Н.Н. Эффект разделяющего агента в экстрактивной дистилляции // Теор. осн. хим. технол. 2020. Т. 54. № 1. С. 45.]
Murashova N.M., Levchishin S.Yu., Yurtov E.V. Effect of bis-(2-ethylhexyl)phosphoric acid on sodium bis-(2-ethylhexyl)phosphate microemulsion for selective extraction of non-ferrous metals // J. Surfactants Deterg. 2014. V. 17. № 6. P. 1249.
Murashova N.M., Levchishin S.Yu., Yurtov E.V. Leaching of metals with microemulsions containing bis-(2-ethyhexyl)phosphoric acid or tributylphosphate // Hydrometallurgy. 2018. V. 175. P. 278.
Polyakova A.S., Murashova N.M., Yurtov E.V. Microemulsions in sodium dodecyl sulphate – 1-butanol – extractant – kerosene – water systems for extracting nonferrous metals from oxide raw materials // Russ. J. Appl. Chem. 2020. V. 93. № 2. P. 244. [Полякова А.С., Мурашова Н.М., Юртов Е.В. Микроэмульсии в системах додецилсульфат натрия – бутанол-1 – экстрагент – керосин – вода для извлечения цветных металлов из оксидного сырья // Журн. прикл. хим. 2020. Т. 93. № 2. С. 249.]
Smith E.L., Abbott A.P., Ryder K.S. Deep Eutectic Solvents (DESs) and Their Applications // Chem. Rev. 2014. V. 114. № 21. P. 11060.
Farooq M.Q., Abbasi N.M., Anderson J.L. Deep eutectic solvents in separations: Methods of preparation, polarity, and applications in extractions and capillary electrochromatography // J. Chromatogr. A. 2020. V. 1633. Article number 461613.
Murashova N.M., Levchishin S.Yu., Subcheva E.N. et al. Chemical Polishing of Aluminum Using Acid-Containing Reverse Microemulsions // Prot. Met. Phys. Chem. Surf. 2020. V. 56. № 3. P. 560. [Мурашова Н.М., Левчишин С.Ю., Субчева Е.Н. и др. Химическое полирование алюминия с помощью обратных микроэмульсий, содержащих кислоту // Физикохим. поверхн. защ. матер. 2020. Т. 56. № 3. С. 309.]
Voshkin A.A., Zakhodyaeva Y.A., Shkinev V.M. A new extraction method for the preparation of zinc oxide nanoparticles in aqueous two-phase systems // Russ. J. Phys. Chem. A. 2017. V. 91. № 2. P. 226. [Вошкин А.А., Шкинев В.М., Заходяева Ю.А. Новый экстракционный метод получения наночастиц оксида цинка в двухфазных водных системах // Журн. физ. хим. 2017. Т. 91. № 2. С. 227.]
Shkinev V.M., Zakhodyaeva Y.A., Dzhenloda R.Kh. et al. Synthesis of magnetic iron oxide nanoparticles at the interface of the polyethylene glycol–ammonium sulfate–water extraction system // Mendeleev Commun. 2017. V. 25. № 5. P. 485.
Kinhal K.V., Sinha S., Ravisankar A. et al. Simultaneous synthesis and separation of nanoparticles using aqueous two-phase systems // ACS Sustainable Chem. Eng. 2020. V. 8. № 7. P. 3013.
Bulavchenko A.I., Arymbaeva A.T., Bulavchenko O.A. et al. The preparation of gold nanoparticles in Triton N-42 reverse micelles after preliminary concentration from acid sulphate-chloride solutions // Russ. J. Phys. Chem. A. 2006. V. 80. № 12. P. 1980. [Булавченко А.И., Арымбаева А.Т., Булавченко О.А. и др. Получение наночастиц золота в обратных мицеллах Triton N-42 после предварительного концентрирования из кислых сульфатно-хлоридных растворов // Журн. физ. хим. 2006. Т. 80. № 12. С. 2220.]
Bulavchenko A.I., Podlipskaya T.Yu., Demidova M.G. et al. The formation of Me(AOT)n micelles as nanoreactors, crystallizers, and charging agents: cation-exchange solvent extraction versus direct injection solubilization // Solvent Extr. Ion Exch. 2020. V. 38. № 4. P. 455.
Hu Z., Hu X., Cui W. et al. Three phase extraction study II TBP-kerosene/H2SO4–TiOSO4 system and the preparation of ultrafine powder of TiO2 // Colloids Surf., A. 1999. V. 155. № 2–3. P. 386.
Yu L., Gu G., Yang J. et al. Preparation of mesoporous ZrO2 with the middle phase formed in a trioctyl (or alkyl) phosphinic oxide–kerosene/HCl–ZrOCl2 extraction system // J. Colloid Interface Sci. 2003. V. 265. № 1. P. 101.
Zhang Y., Chen J. Controllable preparation of CeF3:Tb3+ nanostructures with different morphologies from an ionic liquid-based extraction system // Colloids Surf., A. 2015. V. 470. P. 130.
Zhang Y., Chen J. Interface mechanism of a rapid and mild aqueous–organic method to prepare CePO4 nanostructures // Colloids Surf., A. 2014. V. 444. P. 246.
Khol’kin A.I., Patrusheva T.N. The Extraction-Pyrolytic Method Is 25 Years Old: Results and Prospects // Theor. Found. Chem. Eng. 2016. V. 50. № 5. P. 785. [Холькин А.И., Патрушева Т.Н. Экстракционно-пиролитическому методу 25 лет. Результаты и перспективы // Хим. технол. 2015. Т. 16. № 10. С. 576.]
Patrusheva T.N., Kirik S.D., Mikhlin Yu.L., Khol’kin A.I. Structural Study of Li–Fe–P–O Powder Synthesized by the Extraction-Pyrolytic Method // Theor. Found. Chem. Eng. 2019. V. 53. № 4. P. 615. [Патрушева Т.Н., Кирик С.Д., Михлин Ю.Л., Холькин А.И. Структурные исследования порошка Li-Fe-P-O, полученного экстракционно-пиролитическим методом // Хим. технол. 2018. Т. 19. № 5. С. 194.]
Tondre C. Surfactant-based colloidal particles as the extracting phase for the removal of metal ions from aqueous environments: kinetic and applied aspects // Surfactant-Based Separations (ACS Symposium Series. V. 740). Washington, DC: American Chemical Society, 2000. Ch. 10. P. 139.
Szymanowski J. Surfactant enhanced non-classical extraction // J. Radioanal. Nucl. Chem. 2000. V. 246. № 3. P. 635.
Yamini Y., Feizi N., Moradi M. Surfactant-based extraction systems // Liquid-Phase Extraction (Handbooks in Separation Science) / Ed. Poole C.F. Amsterdam: Elsevier, 2020. P. 209.
Verma G., Paliwal P., Kumar S. et al. Effect of di-(2-ethylhexyl) phosphoric acid on microstructure, cloud point and uranyl ion binding competence of Triton X-100 micelles // Colloids Surf., A. 2015. V. 468. P. 262.
Nguyen V.T., Lee J., Kim M. et al. Sustainable extraction and separation of precious metals from hydrochloric media using novel ionic liquid-in-water microemulsion // Hydrometallurgy. 2017. V. 171. P. 344.
Xiao F., Wang Y., Shen X. et al. Effect of SDS on kinetics for Co-Cyanex 272 complex in a neutral micellar phase // Hydrometallurgy. 2017. V. 167. P. 36.
Liang H., Chen Q., Xu C., Shen X. Selective cloud point extraction of uranium from thorium and lanthanides using Cyanex 301 as extractant // Sep. Purif. Technol. 2019. V. 210. P. 835.
Gulyaev Yu.V., Belgorodskii V.S., Kosheleva M.K. Review of Papers Presented at the “Second International Kosygin Readings: Energy- and Resource-Efficient Environmentally Safe Technologies and Equipment,” an International Scientific and Technical Symposium Celebrating the 100th Anniversary of the Kosygin State University of Russia // Theor. Found. Chem. Eng. 2020. V. 54. № 3. P. 522. [Гуляев Ю.В., Белгородский В.С., Кошелева М.К. Обзор материалов симпозиума “Вторые международные Косыгинские чтения “Энергоресурсоэффективные экологически безопасные технологии и оборудование”, приуроченные к 100-летию РГУ имени А.Н. Косыгина” // Теор. осн. хим. технол. 2020. Т. 54. № 3. С. 392.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии




