Теоретические основы химической технологии, 2022, T. 56, № 1, стр. 48-55
Экстракционное разделение пары Co/Ni глубоким эвтектическим растворителем Aliquat 336/тимол
Н. А. Милевский a, И. В. Зиновьева a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 28.09.2021
После доработки 29.09.2021
Принята к публикации 30.09.2021
- EDN: KJYWGZ
- DOI: 10.31857/S0040357122010080
Аннотация
В настоящей работе представлены результаты исследования физических свойств гидрофобного глубокого эвтектического растворителя (HDES) на основе Aliquat 336 и тимола. Построена фазовая диаграмма твердое–жидкость по значениям температур стеклования смеси Aliquat 336/тимол в разном мольном соотношении. Впервые изучены зависимости плотности, вязкости и показателя преломления данного HDES от температуры. Проведено исследование экстракции ионов Co(II) и Ni(II) при различных условиях с использованием HDES Aliquat 336/тимол в качестве экстрагента: изучено влияние концентрации соляной кислоты, концентрации хлоридов аммония/лития/натрия и объемного соотношения фаз. Установлен механизм экстракции ионов Co(II) предложенным HDES. На основании полученных экспериментальных данных показана возможность разделения пары Co/Ni из солянокислых растворов с использованием предложенного HDES.
ВВЕДЕНИЕ
Темпы производства литий-ионных аккумуляторов (LIB) неуклонно растут. Данный тип химических источников тока повсеместно используется в электронике и электрических транспортных средствах [1]. Учитывая небольшую продолжительность срока службы LIB, которая редко превышает 10 лет, существует проблема роста все большего количества отработанных батареек. Состав LIB весьма разнообразен: туда входят такие металлы как Fe, Mn, Co, Li, Ni, Al [2]. Кобальт, содержащийся в катоде LIB в форме кобальтата лития, является весьма токсичным металлом с канцерогенными свойствами, в связи с чем недопустимо его неправильное хранение и попадание в почву и сточные воды [3]. Не менее важна ценность этого металла в стратегическом и экономическом плане, но при этом, комплексного пути переработки таких источников тока все еще не разработано.
Одной из ключевых проблем в схемах переработки LIB является этап разделения сложной смеси вышеупомянутых металлов. В настоящее время в химической технологии все чаще находит применение жидкостная экстракция как метод для решения таких задач. Жидкостная экстракция применима для разделения смесей цветных [4, 5], редкоземельных [6, 7] и благородных [8, 9] металлов, а так же проста в аппаратурном оформлении. Основным предметом исследований в области экстракции является поиск и изучение новых экстрагентов с целью повышения экологичности, экономичности и безопасности на производстве. К настоящему времени уже предложено несколько типов новых экстрагентов: двухфазные водные системы [10], ионные жидкости [11], бинарные экстрагенты [12].
Сравнительно недавно так же появился новый класс гидрофобных глубоких эвтектических растворителей, которые совмещают в себе все достоинства упомянутых экстракционных систем: простота приготовления, легкодоступность и сравнительно низкая цена исходных компонентов, низкая вязкость, а также простота реэкстракции. Глубокие эвтектические растворители уже нашли широкое применение в процессах переработки отходов электроники как на стадии выщелачивания [13], так и на этапе экстракционного разделения [14] ионов металлов. Однако разработка систем такого класса требует широкого изучения их физико-химических свойств, таких как плотность, вязкость, гидрофобность. Анализ этих свойств позволяет в полной мере оценить применимость HDES в технологических схемах для реализации на существующем экстракционном оборудовании, а так же их стабильность, и как следствие общий экономический эффект от их применения.
Для создания ранее не описанного HDES нами предложен Aliquat 336, как эффективный промышленный экстрагент в комбинации с тимолом. Выбор тимола обусловлен несколькими факторами: высокая доступность и низкая цена данного вещества, а также его природное происхождение, что в совокупности положительно сказывается на экономичности и экологичности HDES. Таким образом, целью данной работы стало описание физико-химических свойств и изучение в качестве экстрагента нового HDES на основе Aliquat 336 и тимола. В качестве модельной системы для изучения экстракционных свойств использовали пару Co/Ni ввиду того, что она является одной из самых трудноразделимых смесей. Необходимость в ее разделении возникает в том числе и при переработке LIB.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Aliquat 336 (Acros Organics, чистота 99%) и тимол квалификации “х. ч.” были использованы без дополнительной очистки. Хлориды кобальта(II) и никеля(II) (Химмед) использовали со степенью чистоты >99%.
Температуры фазовых переходов для смеси донора (HBD) и акцептора (HBA) водородной связи измерены на дифференциальном сканирующем калориметре Mettler Toledo DSC 3+ (Швейцария). Все температуры стеклования HDES определяли в диапазоне температур от –100 до +50°C при скорости нагрева и охлаждения 1°C/мин. Спектры 1H записаны в DMSO-D6 на спектрометре Bruker Fourier 300 HD (USA). ИК-Фурье-спектры в диапазоне 4000–600 см–1 регистрировали на спектрометре Shimadzu IRTracer-100 (Япония). Плотность HDES определяли на прибое Anton Paar DMA 1001 (Австрия) с точностью измерения плотности ±0.0001 г/см3. Вязкость HDES измеряли с помощью TA HR30 discovery series (США).
В качестве экстрагента был использован HDES на основе Aliquat 336 и тимола эвтектического состава в мольном соотношении 0.55 : 0.45, соответственно. Взвешенные на аналитических весах AND HR-100AZ (Япония) реагенты помещали в стеклянные виалы объемом 10 мл. Для образования глубокого эвтектического растворителя виалы помещали в термостатированный шейкер Enviro-Genie SI-1202 (США) при температуре 70°C и перемешивали при 35 об./мин в течение 30 мин до образования жидкой смеси.
Все эксперименты по изучению экстракции проводили при температуре 25°C и атмосферном давлении ~100 кПа в градуированных центрифужных пробирках с использованием термостатированного шейкера. Объемное соотношение водной фазы и фазы HDES составило 1 : 5, за исключением экспериментов по его варьированию. Градуированные пробирки помещали в шейкер и перемешивали при постоянной температуре в течение всего процесса со скоростью вращения 35 об/мин до установления термодинамического равновесия (30 мин). Образцы после перемешивания центрифугировали при 2500 об/мин в течение 10 мин до полного разделения фаз на центрифуге CM-6MT (SIA ELMI, Латвия). Затем фазы разделяли в делительных воронках. Концентрацию металлов в исходном растворе и в водной фазе после экстракции определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплексы с металлами, которые поглощают в видимой области спектра на следующих длинах волн, нм: Ni (495), Co (510) относительно холостых растворов. Концентрацию ионов металлов в фазе HDES определяли по разности между концентрациями в исходном растворе и в водной фазе после экстракции. Определение значений оптической плотности проводили на приборе Экросхим ПЭ-5400УФ (Россия) в стеклянных кюветах l = 10 мм.
Для установления механизма экстракции спектры поглощения в видимой области чистого HDES и после экстракции регистрировали на спектрофотометре Agilent Technology Cary-60 (США) в кварцевых кюветах l = 1 мм.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характеризация HDES. В данной работе показана возможность применения тимола – легкодоступного природного соединения – в качестве HBD в паре с Aliquat 336, состав которого представляет собой триоктилметиламмоний хлорид с небольшой примесью тридецилметиламмоний хлорида, для создания нового HDES. Экстракционные свойства Aliquat 336 хорошо изучены в большом количестве работ [15–17]. Однако для его применения в классической жидкостной экстракции необходим разбавитель, который чаще всего представляет собой органический растворитель, токсичность и горючесть которого ведет к повышенным рискам на производстве. Тимол снижает токсичность экстрагента и общую вязкость системы относительно чистого Aliquat 336, при этом сохраняются отличные экстракционные свойства.
Точка эвтектики является основной определяющей характеристикой глубокого эвтектического растворителя. Для ее поиска были получены температуры стеклования серия смесей Aliquat 336 и тимола в различном мольном соотношении. На рис. 1 представлена фазовая диаграмма, построенная по полученным данным о температуре стеклования смесей. Точка эвтектики соответствует мольному соотношению HBA и HBD равному 0.55 : 0.45. При этом на диаграмме присутствует плато в области мольной доли тимола равной 0.6–0.8. Такой характер кривой может быть связан с наличием небольшой примеси тридецилметиламмоний хлорида в Aliquat 336.
Полученный глубокий эвтектический растворитель представляет собой желтоватую текучую гидрофобную жидкость. Анализ 1Н ЯМР и ИК-Фурье спектров полученного HDES (рис. 2 и 3) показывает отсутствие новых пиков для HDES. Все пики исходных веществ соответствуют пикам на спектре HDES. При этом пик на ИК-спектре HDES, характерный для гидроксильной группы тимола, сдвигается с 3164.35 на 3124.28 см–1. Это указывает на механизм формирования HDES через связывание гидроксильной группы тимола с анионом Cl–, входящим в состав Aliquat 336. Схожий эффект возникает на спектре 1Н ЯМР: характерный пик гидроксильной группы на спектре тимола после образования HDES сдвигается с 9.07 на 9.27 ppm.
Для определения возможности применения данного HDES на практике нами были изучены его важные физические свойства. Плотность является основным физическим параметром при изучении экстракционных систем, поскольку от нее в значительной степени зависит скорость расслоения фаз. На рисунке 4 представлена зависимость плотности HDES от температуры в диапазоне от 15 до 60°C. При стандартной температуре проведения экстракции HDES имеет плотность 0.90 г/см3, что согласуется с литературными данными, где указано, что зачастую плотность гидрофобных эвтектических растворителей варьируется в диапазоне от 0.88 до 0.97 г/см3 в зависимости от компонентов [18, 19].
Еще одним физическим свойством, влияющим на организацию технологического процесса, является вязкость. На рисунке 5 приведен график зависимости вязкости HDES от температуры. Как упоминалось ранее [20, 21] Aliquat 336 практически невозможно использовать в чистом виде из-за его высокой вязкости 1502.04 сП при 25°C. Исследуемый HDES имеет вязкость в 1.5 раза меньше, относительно чистого Aliquat, что делает возможным его применение на классическом экстракционном оборудовании.
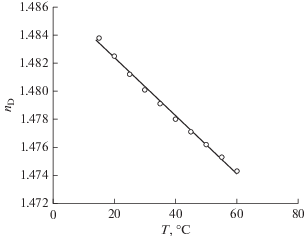
Показатель преломления – это параметр, характеризующий электронную поляризуемость молекулы и важный для понимания межмолекулярных взаимодействий или поведения молекул в растворе. Изучена зависимость показателя преломления глубокого эвтектического растворителя на основе Aliquat 336 и тимола от температуры (рис. 6). Как видно из рисунка, значения показателя преломления HDES линейно уменьшаются с увеличением температуры в диапазоне от 15 до 60°С, что коррелирует с характером зависимости плотности от температуры.
Экспериментальные данные плотности и показателя преломления позволяют рассчитать молярную рефракцию (Rмол), молярный объем (Vмол) и свободный молярный объем (Vсв) исследуемого HDES (рис. 7). Молярная рефракция HDES рассчитана по следующему уравнению
(1)
$\begin{gathered} {{R}_{{{\text{мол}}}}} = ({{{{M}_{{{\text{HDES}}}}}} \mathord{\left/ {\vphantom {{{{M}_{{{\text{HDES}}}}}} \rho }} \right. \kern-0em} \rho })[(n_{D}^{2}--1)(n_{D}^{2} + 2)] = \\ = \,\,{{V}_{{{\text{мол}}}}}[(n_{D}^{2}--1)(n_{D}^{2} + 2)], \\ \end{gathered} $Рис. 7.
Зависимость (а) – молярного объема; (б) – молярной рефракции; (в) – свободного молярного объема HDES от температуры.

Зная молярную рефракцию, можно рассчитать свободный молярный объем HDES по уравнению
Изучение экстракционных возможностей. Объектом данного исследования является смесь ионов Co(II) и Ni(II), которые входят в состав катода LIB. Задача разделения данной пары металлов представляет наибольший интерес к изучению, поскольку Co(II) и Ni(II) имеют схожий характер при экстракции, что вызывает трудности в их разделении. Для разработки технологической схемы и оптимизации условий проведения экстракции были исследованы зависимости степени извлечения металлов от различных параметров: времени перемешивания, концентрации NaCl, LiCl, NH4Cl, HCl и объемного соотношения фаз. Температура и атмосферное давление во всех экспериментах соответствовали стандартным условиям. Объем водной фазы и фазы HDES был равен 1 и 0.2 мл соответственно. В случае проведения экстракции в условиях, не требующих добавления HCl, ее концентрация поддерживалась постоянной 0.01 моль/л для предотвращения выпадения осадков.
Для изучения зависимости степени извлечения от времени контакта фаз в качестве модельного объекта был выбран 0.01 моль/л раствор хлорида Co(II) с концентрацией HCl, равной 6 моль/л. Результаты исследования показали, что время установления равновесия составляет 30 мин. Все дальнейшие эксперименты проводили при данном условии. Главным параметром, влияющим на степень извлечения металлов, является концентрация HCl. На рис. 8 приведены зависимости степени извлечения для индивидуальных металлов в зависимости от концентрации кислоты.
Как видно из графика, разделение кобальта и никеля происходит уже при концентрации HCl, равной 3 моль/л, при этом эффективность разделения растет при дальнейшем увеличении концентрации кислоты.
Для установления механизма экстракции нами были проведены исследования по определению состава экстрагируемых соединений на примере Co(II) в исследуемой экстракционной системе. Были получены электронные спектры поглощения фазы HDES после экстракции ионов металлов из солянокислых растворов в диапазоне от 0 до 6 моль/л в видимой области спектра (рис. 9).
Рис. 9.
Электронные спектры поглощения фазы HDES после экстракции Co(II) из раствора HCl различных концентраций, моль/л: 1 – 6; 2 – 4; 3 – 2; 4 – 0.

Из полученных результатов видно, что Co(II) в фазе глубокого эвтектического растворителя существует только в виде анионного хлорокомплекса, что подтверждается максимумами поглощения при 635, 670 и 700 нм, характерным для комплекса [CoCl4]2– [22]. При этом на всех спектрах отсутствует максимум поглощения при 510 нм, относящемуся к гексакоординированому аквакомплексу [Co(H2O)6]2+. С увеличением концентрации HCl в водной фазе доля анионных форм Co(II) увеличивается, что обуславливает резкое возрастание его степени извлечения.
Исходя из полученных результатов можно сделать вывод, что механизм экстракции предполагает анионообменную реакцию между Cl– в HDES и анионами ${\text{CoCl}}_{4}^{{2 - }}.$ При этом экстракция ионов Ni(II) не происходит, так как хлоридный комплекс ${\text{NiCl}}_{4}^{{2 - }}$ появляется в водных растворах в очень небольшом количестве лишь при высокой концентрации хлорид-ионов [23].
Основываясь на предполагаемом механизме, нами предложен метод увеличения эффективности разделения пары Co/Ni без повышения концентрации HCl больше 3 моль/л: дополнительное введение хлоридов в систему сместит равновесие в водной фазе в сторону образования экстрагируемого комплекса [CoCl4]2–. Для того, чтобы выяснить влияние ионов Cl– вне зависимости от концентрации ионов H+ на эффективность экстракции отдельных ионов были проведены эксперименты по варьированию концентрации иона Cl– путем добавления хлоридов натрия, лития и аммония до насыщения раствора. Существенное влияние на степень извлечения это оказало только в случае Co(II) (рис. 10). Для иона Ni(II) переход в фазу HDES был зафиксирован только в случае использования насыщенного до 7 моль/л раствора LiCl, и степень извлечения составила 32.31%.
Для подтверждения эффективности выбранного нами объемного соотношения HDES и водной фазы была построена зависимость степени извлечения Co(II) в системе 3 моль/л раствора HCl и 2.5 моль/л NaCl (рис. 11).
Рис. 10.
Зависимость степени извлечения Co(II) от исходной концентрации хлоридов: 1 – натрия; 2 – аммония; 3 – лития.

С ростом объемной доли HDES до соотношения О/В 1 : 1 эффективность экстракции возрастает лишь на 9.5%, при увеличении расхода экстрагента в 5 раз. Таким образом, соотношение О/В 1/5 является оптимальным для проведения экстракции исследуемым HDES, что подчеркивает экономическую целесообразность его применения.
ЗАКЛЮЧЕНИЕ
В настоящей работе предложен новый гидрофобный глубокий эвтектический растворитель Aliquat 336/тимол в качестве экстрагента для разделения пары Co/Ni из солянокислого раствора. Изучены его физико-химические свойства: построена фазовая диаграмма твердое–жидкость, получены зависимости плотности, показателя преломления и вязкости от температуры. Проведено исследование экстракции ионов Co(II) и Ni(II) в экстракционной системе с HDES Aliquat 336/тимол при варьировании концентрации HCl, хлоридов натрия/лития/аммония и объемного соотношения фаз. Установлен механизм извлечения ионов Co(II). Полученные результаты иллюстрируют возможность потенциального применения предложенного HDES для эффективного разделения исследуемых ионов металлов из солянокислых растворов переработки катодов литий-ионных аккумуляторов.
Исследование выполнено за счет гранта Российского научного фонда (проект № 20-13-00387).
Список литературы
Xie J., and Lu Y.-C. A retrospective on lithium-ion batteries, Nat. Comm., 2020, vol. 11, p. 2499. https://doi.org/10.1038/s41467-020-16259-9
Thompson, D., Hartley, J., Lambert, S., Shiref, M., Harper, G., Kendrick, E., and Abbott, A.P. The Importance of Design in Lithium Ion Battery Recycling – A Critical Review, Green Chem., 2020, vol. 22, pp. 7585–7603. https://doi.org/10.1039/D0GC02745F
Leyssens L., Vinck B., Van Der Straeten C., Wuyts F., and Maes L., Cobalt toxicity in humans – A review of the potential sources and systemic health effects, Toxicology, 2017, vol. 387, pp. 43–56. https://doi.org/10.1016/j.tox.2017.05.015
Zakhodyaeva Y.A., Zinov’eva I.V., Tokar E.S., and Voshkin A.A. Complex Extraction of Metals in an Aqueous Two-Phase System Based on Poly (Ethylene Oxide) 1500 and Sodium Nitrate, Molecules, 2019, vol. 24, p. 4078. https://doi.org/10.3390/molecules24224078
Zhang L., Ji L., Li L., Shi D., Xu T., Peng X., and Song X., Recovery of Co, Ni, and Li from solutions by solvent extraction with β-diketone system. Hydrometallurgy, 2021, vol. 204, p. 105718. https://doi.org/10.1016/j.hydromet.2021.105718
Belova V.V., Voshkin A.A., Kholkin A.I., and Payrtman A.K., Solvent extraction of some lanthanides from chloride and nitrate solutions by binary extractants, Hydrometallurgy, 2009, vol. 97, pp. 198–203. https://doi.org/10.1016/j.hydromet.2009.03.004
Fedorova, M.I., Zakhodyaeva, Y.A., Zinov’eva, I.V., and Vosjkin, A.A., Recovery of rare-earth elements from nitrate solutions using polyethylene glycol 1500, Russ. Chem. Bull., 2020, vol. 69, pp. 1344–1348. https://doi.org/10.1007/s11172-020-2908-2
Milevskiy, N.A., Boryagina, I.V., Karpukhina, E.A., Kuznetsov, V.N., and Kabanova, E.G., Effect of Sodium Chloride and pH on the Composition of the Equilibrium Phases and the Partition of Palladium(II) in the Aqueous Two-Phase System PEG1500–Na2SO4–Water, J. Chem. Eng. Data, 2021, vol. 66, pp. 1021–1031. https://doi.org/10.1021/acs.jced.0c00832
Xing, W.D., and Lee, M.S., A Process for the Separation of Noble Metals from HCl Liquor Containing Gold(III), Palladium(II), Platinum(IV), Rhodium(III), and Iridium(IV) by Solvent Extraction, Process., 2019, vol. 7, p. 243. https://doi.org/10.3390/pr7050243
Bulgariu, L., and Bulgariu, D., Selective extraction of Hg(II), Cd(II) and Zn(II) ions from aqueous media by a green chemistry procedure using aqueous two-phase systems, Sep. Purif. Tech., 2013, vol. 118, pp. 209–216. https://doi.org/10.1016/j.seppur.2013.07.007
Shi, C., Jing, Y., Xiao, J., Wang, X., Yao, Y., and Jia, Y., Solvent extraction of lithium from aqueous solution using non-fluorinated functionalized ionic liquids as extraction agents, Sep. Purif. Tech., 2017, vol. 172, pp. 473–479. https://doi.org/10.1016/j.seppur.2016.08.034
Belova, V.V., Voshkin, A.A., Kholkin, A.I., and Payrtman, A.K., Solvent extraction of some lanthanides from chloride and nitrate solutions by binary extractants, Hydrometallurgy, 2009, vol. 97, pp. 198–203. https://doi.org/10.1016/j.hydromet.2009.03.004
Zinov’eva, I.V., Fedorov, A.Y., Milevskii, N.A., Zakhodyaeva, Y.A., Voshkin A.A., A Deep Eutectic Solvent Based on Choline Chloride and Sulfosalicylic Acid: Properties and Applications, Theor. Found. Chem. Eng., 2021, vol. 3, pp. 371–379. https://doi.org/10.1134/S0040579521030246
Liu, R., Geng, Y., Tian, Z., Wang, N., Wang, M., Zhang, G., and Yang, Y., Extraction of platinum(IV) by hydrophobic deep eutectic solvents based on trioctylphosphine oxide, Hydrometallurgy, 2020, vol. 199, p. 105521. https://doi.org/10.1016/j.hydromet.2020.105521
Nayl, A.A., Extraction and separation of Co(II) and Ni(II) from acidic sulfate solutions using Aliquat 336, J. Hazard. Mater., 2010, vol. 173, pp. 223–230. https://doi.org/10.1016/j.jhazmat.2009.08.072
Salazar, Ernesto, Ortiz, M. Inmaculada, Urtiaga, Ane M., and Irabien, J. Angel, Equilibrium and kinetics of chromium(VI) extraction with Aliquat 336, Ind. Eng. Chem. Res., 1992, vol. 31, pp. 1516–1522. https://doi.org/10.1021/ie00006a014
Mishra, R.K., Rout, P.C., Sarangi, K., and Nathsarma, K.C., Solvent extraction of Fe(III) from the chloride leach liquor of low grade iron ore tailings using Aliquat 336, Hydrometallurgy, 2011, vol. 108, pp. 93–99. https://doi.org/10.1016/j.hydromet.2011.03.003
Florindo, C., Romero, L., Rintoul, I., Branco, L., and Marrucho, I.M., From Phase Change Materials to Green Solvents: Hydrophobic Low Viscous Fatty Acid-based Deep Eutectic Solvents, ACS Sustain. Chem. Eng., 2018, vol. 6, pp. 3888–3895. https://doi.org/10.1021/acssuschemeng.7b04235
Cao, J., and Su, E., Hydrophobic deep eutectic solvents: the new generation of green solvents for diversified and colorful applications in green chemistry, J. Clean. Prod., 2021, vol. 314, p. 127965. https://doi.org/10.1016/j.jclepro.2021.127965
Amit Keshav, and Kailas L. Wasewar; Shri Chand. Reactive extraction of propionic acid using tri-n-octylamine, tri-n-butyl phosphate and aliquat 336 in sunflower oil as diluent. J. Chem. Technol. Biotechnol., 2009, vol. 84, pp. 484–489. https://doi.org/10.1002/jctb.2066
Kailas L. Wasewar, Diwakar Shende, and Amit Keshav, Reactive Extraction of Itaconic Acid Using Quaternary Amine Aliquat 336 in Ethyl Acetate, Toluene, Hexane, and Kerosene, Ind. Eng. Chem. Res., 2011, vol. 50, pp. 1003–1011. https://doi.org/10.1021/ie1011883
Chaverra, D.E., Restrepo-Baena, O.J., and Ruiz, M.C., Cobalt Extraction from Sulfate/Chloride Media with Trioctyl(alkyl)phosphonium Chloride Ionic Liquids, ACS Omega, 2020, vol. 5, pp. 5643–5650. https://doi.org/10.1021/acsomega.9b03266
Экстракция галогенидных комплексов металлов. Золотов Ю.А., Иофа Б.З., Чучалин Л.К. Изд-во “Наука”, 1973.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии