Теоретические основы химической технологии, 2022, T. 56, № 6, стр. 686-689
Способ получения оксихлорида висмута
Б. С. Абжалов a, *, Э. Ж. Тулешова a, **, А. Б. Баешов b
a Университет Ахмеда Ясави
Туркестан, Казахстан
b АО “Институт топлива, катализа и электрохимии им. Д.В. Сокольского”
Алматы, Казахстан
* E-mail: bagdat.abzhalov@ayu.edu.kz
** E-mail: elmira.tuleshova@ayu.edu.kz
Поступила в редакцию 18.07.2022
После доработки 20.07.2022
Принята к публикации 30.07.2022
- EDN: KYITQW
- DOI: 10.31857/S004035712206001X
Аннотация
Представлены результаты исследования процессов электрохимического окисления-восстановления висмута в водных растворах хлорида калия методом снятия потенциодинамических поляризационных кривых. Изучено влияние концентрации и температуры электролита, скорости развертки на электрохимическое поведение висмута. Изучены особенности влияния состава электролита на формирование оксихлорида висмута. Выявлены оптимальные параметры электролиза для получения оксихлорида висмута.
ВВЕДЕНИЕ
Порошковая металлургия – область науки и техники, охватывающая производство металлических порошков, а также изделий из них или их смесей с неметаллическими порошками. Металлический порошок представляет собой совокупность частиц металла, сплава или металлоподобного соединения, находящихся во взаимном контакте и не связанных между собой. Порошковая металлургия всегда играла значительную роль в техническом прогрессе, поскольку позволяла получать новые материалы и изделия, которые невозможно изготовить с помощью других традиционных технологий. В последние десятилетия значимость порошковой металлургии существенно возрастает, поскольку на ее основе создаются принципиально новые материалы с микрокристаллической, наноразмерной и аморфной структурой. Уникальная структура позволяет значительно повысить физико-механические и функциональные свойства изделий [1].
Из литературных источников известно, что в нейтральной среде висмут пассивируется поверхностными окисями и замедляется растворение [2–4]. По результатам наших исследований известно, что под действием переменного тока в результате периодического восстановления поверхностных окислов активируется растворение висмута.
Цель работы – изучение закономерностей растворения висмута в растворе хлорида калия путем снятия потенциодинамических поляризационных кривых и исследование процесса формирования оксихлорида висмута.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электрохимическое поведение висмута изучено методом снятия потенциодинамических вольтамперных кривых на потенциостате СВА-1БМ. Основные поляризационные вольтамперные кривые снимались при скорости развертки 10 мВ/с и записывались на планшетном двухкоординатном потенциометре Н 301/1. Для проведения исследований при постоянной температуре использовали специальную электролитическую ячейку марки ЯСЭ-2, монтированную в термостат марки IТЖ-0-03.
Измерения проводились в трехэлектродной ячейке относительно хлорсеребряного электрода (E° = +0.203 В). Вспомогательным служил хлорсеребряный электрод.
Для исследования электрохимического поведения висмута под действием переменного тока в водных растворах основные опыты проводили в электролизере объемом 100 мл. Рабочие электроды изготовлены в виде пластинки из металлического висмута с площадью рабочей поверхности 0.001 м2 и стержня из титана. Электроды перед экспериментами тщательно зачищали, обезжиривали и промывали дистиллированной водой.
Для удобства работы во время эксперимента участки висмутовых и титановых электродов кроме рабочей поверхности были покрыты органическим стеклом. Это позволяет полностью погружать электроды в электролит. Электроды располагались на расстоянии 20 мм друг от друга.
Источником синусоидального переменного тока служил источник питания В–24 (в упрощенной форме представляющий собой понижающий трансформатор с плавной регулировкой напряжения), имеющий клеммы переменного тока. Ток в цепи измеряли многопредельным амперметром марки Э59/104. За изменениями формы синусоидального переменного тока в ходе электролиза наблюдали с помощью электронного осциллографа С1–77. Осциллографом контролировали также соотношение величин амплитуд анодного и катодного полупериодов переменного тока.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
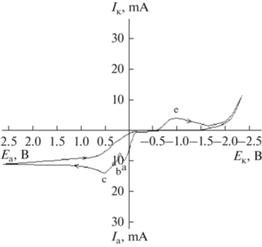
Результаты экспериментов в гальваностатических условиях показали преимущества электродных процессов, протекающих на висмутовых электродах при поляризации промышленным переменным током частотой 50 Гц. Для выяснения механизма электродных процессов, протекающих под действием переменного тока, были сняты анодно-катодные и катодно-анодные циклические поляризационные кривые (рис. 1).
Рис. 1.
Анодно–катодные потенциодинамические циклические поляризационные кривые в растворе хлорида калия: C = 2.5 моль/л; скорость развертки оптенциала – 10 мВ/с.

Исходя из значения стандартных электродных потенциалов [5, 6 ] , известно, что окисление висмута в анодном пространстве в анодно-катодной поляризационной кривой происходит по следующим реакциям:
(1)
$\begin{gathered} {\text{Bi}} + {{{\text{H}}}_{2}}{\text{O}} + {\text{C}}{{{\text{l}}}^{ - }} \leftrightarrow {\text{BiOCl}} + 2{{{\text{H}}}^{ + }} + 3{{\bar {e}}}~ \\ ~E^\circ = + 0.16{\text{ B,}} \\ \end{gathered} $(2)
${\text{Bi}} + 4{\text{C}}{{{\text{l}}}^{ - }} \leftrightarrow {{\left[ {{\text{BiC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{ - }} + 3\bar {e}~\,\,\,\,E^\circ = + 0.16{\text{ B,}}$(3)
${\text{Bi}} \leftrightarrow {\text{B}}{{{\text{i}}}^{{3 + }}} + 3{{\bar {e}}}\,\,\,\,~E^\circ = + 0.215{\text{ B}}{\text{.}}$При анодной поляризации висмут окисляется в основном по реакции (1). Редко встречается, что на границе соприкосновения фаз (1) электродная реакция протекает в одной стадии [7], а в ряде наших исследований электродной кинетики многовалентных металлов установлено, что образуются промежуточные валентные ионы металлов, и в некоторых случаях проведена их идентификация и исследованы свойства [8]. В связи с этим при анодной поляризации висмут поступенчато окисляется до трехвалентного висмута по реакциям Ві0 – ē = Bi+рис. 1 (максимум а) и Ві+ – 2ē = Bi3+рис. 1 (максимум b).
При смещении потенциала от анодного к катодному направлению на вольтамперных кривых в области катодных потенциалов наблюдается максимум тока – с, обусловленный восстановлением Bi(ІІІ) до Bi(І), максимум – d характеризует восстановление Bi(І) до металлического висмута.
При снятии катодно-анодных циклических поляризационных кривых в области катодных потенциалов после волны выделения водорода основные процессы повторяются (рис. 2).
Рис. 2.
Катодно–анодные потенциодинамические циклические поляризационные кривые в растворе хлорида калия: C = 2.5 моль/л; скорость развертки – 10 мВ/с.
Изучено влияние концентрации хлорида калия на скорость растворения висмута (рис. 3). Чем больше концентрация KCl, тем больше максимум тока растворения висмута смещается в область положительных потенциалов.
Рис. 3.
Анодные поляризационные кривые висмута при различных концентрациях хлорида калия, М: 1 – 0.5; 2 – 1.0; 3 – 1.5; 4 – 2.0; 5 – 2.5; 6 – 3.0.

Анодные поляризационные кривые висмута при различных скоростях развертки потенциала 5–100 мB/c были сняты в 2.5 М растворе хлорида калия (рис. 4). С увеличением скорости развертки потенциала высота максимума тока возрастает. Зависимость пика тока от скорости развертки потенциала пропорционально растет, что показывает на увеличение скорости окисления висмута.
Рис. 4.
Анодные поляризационные кривые висмута в растворе хлорида калия при различной скорости развертки потенциала $v$, мВ/с: 1 – 5; 2 – 10; 3 – 20; 4 – 50; 5 – 100.

При повышении температуры раствора увеличение высоты максимума тока закономерно (рис. 5). Энергия активации, рассчитанная температурно-кинетическим методом при ∆Е = 0.0 В равна 15.5 кДж/моль, при ∆Е = 0.05 В равна 14.9 кДж/моль, при ∆Е = 0.1 В равна 16.8 кДж/моль, среднее значение 15.7 кДж/моль. Это свидетельствует о протекании электрохимического процесса в диффузионно-кинетическом режиме.
Рис. 5.
Анодные поляризационные кривые висмута в растворе хлорида калия при различной температуре раствора, °С: 1 – 20; 2 – 30; 3 – 40; 4 – 50; 5 – 60; 6 – 70.

С целью дальнейшего изучения данной ситуации был продолжен процесс электролиза в присутствии переменного тока. Изучено влияние плотности тока на висмутовом и титановом электродах, концентрации и температуры электролита, продолжительности электролиза и частоты переменного тока на электрохимические процессы.
По результатам исследований были определены оптимальные параметры растворения висмутового электрода в водных растворах под действием переменного тока (іТі = 75–125 кА/м2, iBi = 100 А/м2, С = 2.0–2.5 М, t = 25–30°C, ν = 50 Гц, τ = 0.5–1.0 ч). Установлено, что в оптимальных условиях выход по току составляет 98.7%.
Полученный электрохимическим путем оксихлорид висмута исследовали методом рентгенофазового анализа. Рентгенофазовый анализ кристаллов, полученных в растворе хлорида калия, показал образование соединения BiOCl. Образец показал наличие на рентгенограмме аналогичных дифракционных линий с параметрами межплоскостных расстояний: 1.53; 1.57; 1.688; 1.84; 1.94; 2.20; 2.68; 2.74; 3.42; 3.70 Å. Значения расстояний (d/n) между следующими плоскостями для оксихлорида висмута соответствуют значениям картотеки ASTM. Рентгенограмма полученного электрохимическим путем оксихлорида висмута приведена на рис. 6.
ЗАКЛЮЧЕНИЕ
Таким образом, методом снятия циклических потенциодинамических поляризационных кривых показано, что в растворе хлорида калия на висмутовом электроде протекают достаточно сложные электрохимические реакции. Эти и другие данные, полученные нами в предыдущих исследованиях служат теоретическими основами электродных процессов, протекающих при поляризации висмута и других металлов переменным током, а также являются предпосылкой создания новых способов извлечения металлов из отработанных растворов и сточных вод, способов синтеза ряда соединений, находящих широкое применение в различных отраслях промышленности.
ОБОЗНАЧЕНИЯ
Список литературы
Гиршов В.Л., Котов С.А., Цеменко В.Н. Современные технологии в порошковой металлургии. СПб.: Политехн. Ун-т, 2010.
Lust K., Perkson E., Lust E. Electroreduction of peroxodisulfate anion at Bi(111) single-crystal plane electrode // Russ. J. Electrochem. 2000. V. 36. № 11. P. 1195. https://doi.org/10.1007/BF02757694
Архипов П.А., Холкина А.С., Зайковa Ю.П., Молчанова Н.Г. Электродные потенциалы висмута в смеси хлоридов калия и свинца // Электрохимия. 2018. Т. 54. № 9. С. 774. https://doi.org/10.1134/S0424857018090025 [Arkhipov P.A., Kholkina A.S., Zaikov Yu.P., Molchanova N.G. Electrode Potentials of Bismuth in a Mixture of Potassium and Lead Chlorides // Russ. J. Electrochem. 2018. V. 54. № 9. P. 672. https://doi.org/10.1134/S1023193518090021].
Yang M., Zhongbo H. Elecrtodeposition of bismuth onto glassy carbon electrodes from nitrate solution // J. Electroanal. Chem. 2005. V. 583. № 1. P. 46. https://doi.org/10.1016/j.jelechem.2005.04.019
Нечаев А.В. Основы электрохимии. Екатеринбург: УрФУ, 2010.
Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. М.: Химия, Колос, 2006.
Емец В.В., Дамаскин Б.Б. Двойной электрический слой на жидком сплаве Bi-Ga в водных растворах // Электрохимия. 2004. Т. 40. № 1. С. 67 [Emets V.V., Damaskin B.B. The electrical double layer at the Bi-Ga liquid alloy in the acetonitrile electrolyte solutions // Russ. J. Electrochem. 2004. V. 40 № 10. P. 1066. https://doi.org/10.1023/B:RUEL.0000046492.05309.81]
Mamyrbekova A., Abzhalov B., Mamyrbekova Aizhan. Composition and Particle Size of Electrolytic Copper Powders Prepared in Water-containing Dimethyl Sulfoxide Electrolytes // Russian J. Physical Chemistry A. 2017. V. 91. № 7. P. 1332. https://doi.org/10.1134/S0036024417070226.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии



