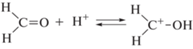Теоретические основы химической технологии, 2022, T. 56, № 6, стр. 690-695
Влияние температурно-временных параметров и состава системы на кинетику реакции ацеталирования при получении пенополивинилформаля из раствора поливинилового спирта
А. А. Акимова a, *, В. А. Ломовской b, И. Д. Симонов-Емельянов a
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: akimova@mirea.ru
Поступила в редакцию 08.06.2022
После доработки 07.07.2022
Принята к публикации 10.07.2022
- EDN: AQIIMB
- DOI: 10.31857/S0040357122060021
Аннотация
В работе изучено влияние температурно-временных параметров и состава реакционной системы на кинетику реакции ацеталирования при получении пенополивинилформаля из водных растворов поливинилового спирта. Приведен механизм реакции ацеталирования и приведены уравнения для описания превращения поливинилового спирта в поливинилформаль в присутствии формальдегида и кислотных катализаторов гомогенной и гетерогенной области реакции. Показано, что с увеличением концентрации поливинилового спирта степень превращения по реакции ацеталирования практически не изменяется (0.85–0.87), однако время достижения максимального превращения возрастает в ~2.5 раза (с 11 до 26 мин). Установлены оптимальные концентрации формальдегида и серной кислоты (катализатор) на кинетику реакции ацетилирования поливинилового спирта в водном растворе: концентрация формальдегида – $C_{a}^{0}$ = 3.3 моль/л, серной кислоты – $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$ = 3.5 моль/л. Повышение температуры способствует увеличению скорости реакции ацеталирования и сокращению времени синтеза поливинилформаля из водных растворов поливинилового спирта. Показано, что повышать температуру синтеза более 50°С нецелесообразно. Оптимальной температурой получения поливинилформаля из водных растворов поливинилового спирта можно считать ~40–45°С. Полученные данные доказывают, что реакция ацеталирования завершается за время, при котором обеспечивается устойчивость пены из водного раствора поливинилового спирта (не менее 20–30 мин).
ВВЕДЕНИЕ
Получение пористых фильтров для избирательной сорбции воды из углеводородных топлив основано на использовании в качестве исходного сырья пены из поливинилового спирта (ПВС), с последующим проведением химической реакции и образованием поливинилформаля (ППВФ) с выделением новой фазы.
Благодаря наличию в структуре пены из ППВФ развитой поверхности из сообщающихся пор, а также большого количества гидрофильных полярных групп пенополивинилформаль способен избирательно поглощать воду из углеводородных топлив. Поглощение воды может достигать до ~300%, при этом ППВФ практически инертен к углеводородам, входящим в состав топлив (парафиновые, нафталевые и ароматические углеводороды), и не растворим в абсорбируемой воде [1–3]. При фильтрации и поглощении из углеводородных топлив воды материал фильтра набухает, становится эластичным, однако обладает достаточной прочностью и поэтому фильтр можно многократно регенерировать.
Целью работы является исследование влияния температурно-временных параметров процесса формирования структуры открыто пористого материала на основе ППВФ из ПВС – пены в процессе химической реакции ацеталирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения пены из ПВС использовали порошок поливинилового спирта марки Mowiol 26-88 (“Kuraray”, Япония) с молекулярной массой (Мw) 68 000. Для удаления крупных агрегатов и слипшихся при хранении частиц порошок ПВС просеивали через сита и отбирали фракцию со средним диаметром частиц ~1.0 мм.
Ранее в работе [4] было показано, что для синтеза ППВФ и получения устойчивых пен рекомендуется использовать ~10-ый об. % водный раствор ПВС с молекулярной массой ~68 000.
Полученный после растворения 10 об. % водный раствор ПВС охлаждается до 40°С при непрерывном перемешивании со скоростью 800–1200 об/мин. Для образования пористой структуры ППВФ водный раствор поливинилового спирта вспенивают и далее проводят реакционный процесс, путем добавления водометанольного раствора формальдегида (формалин технический ГОСТ 1625-2016) при постоянном перемешивании в течение 5 минут. Затем добавляют при перемешивании ~1 об. % поверхностно-активное вещество марки ОП-10, которое обеспечивает достаточную устойчивость пены из ПВС во времени для формирования ППВФ. Затем раствор термостатируют до температуры синтеза ППВФ равной 40°С, после чего приливают необходимое количество 25%-ного раствора серной кислоты, которая является катализатором реакции, при непрерывном перемешивании реакционной смеси.
Синтез материала на конечной стадии получения ППВФ можно осуществлять в формах различной геометрии (пластина, цилиндр, куб, шар и д.т.) в зависимости от заданных требований. Сформованное изделие выгружают из формы и тщательно промывают сначала проточной, а затем дистиллированной водой до нейтральной реакции промывных вод (рН ≈ 8).
Промытые пористые изделия сушат при температуре не выше 70°С в течении 24 ч.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По реакции ацеталирования при взаимодействии ПВС с альдегидами в присутствии кислотных катализаторов получают поливинилацетали [5, 6].
В качестве катализаторов реакции ацеталирования применяют сильные минеральные и органические кислоты. В растворах альдегидов в присутствии веществ, отщепляющих протон, быстро устанавливается равновесие типа:
Ацеталирование ПВС протекает в одну стадию – протонированный альдегид C+H2OH реагирует одновременно с парой смежных гидроксилов участка цепи ПВС, замыкая ацетальное кольцо:
Кинетику процесса ацеталирования на начальном этапе с достаточной точностью можно описать уравнением [7]:
где ${{C}_{p}}$ – концентрация гидроксильных групп полимера, способных вступать в реакцию ацеталирования, ${{C}_{a}}$ – концентрация альдегида, ${{h}_{0}}$ – функция кислотности Гамметта – $\frac{{{{\gamma }_{B}}{{\alpha }_{{{{{\text{H}}}^{ + }}}}}}}{{{{\gamma }_{{B{{{\text{H}}}^{ + }}}}}}}$ (${{\alpha }_{{{{{\text{H}}}^{{\text{ + }}}}}}}$ – активность ионов водорода, ${{\gamma }_{B}}$ – коэффициент активности нейтрального основания, ${{\gamma }_{{B{{{\text{H}}}^{ + }}}}}$ – коэффициент активности протонированного основания в данной среде), ${{k}_{a}} = k{{k}_{0}}$ (k – константа скорости прямой реакции, ${{k}_{0}}$ – термодинамическая константа равновесия взаимодействия альдегида с ионом водорода, равная $\frac{{\left[ {{{{\text{C}}}^{{\text{ + }}}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}} \right]}}{{{{h}_{0}}{{C}_{a}}}}$), $t$ – время, или:(2)
$\frac{{d{{\alpha }_{p}}}}{{dt}} = {{k}_{a}}{{h}_{0}}C_{p}^{0}\left( {\frac{{2C_{a}^{0}}}{{C_{p}^{0}}} - {{\alpha }_{p}}} \right)\left( {1 - {{\alpha }_{p}}} \right),$Энергия активации реакции ацеталирования при взаимодействии ПВС с формальдегидом составляет ~72.9 кДж/моль.
Существенным фактором, влияющим на процесс, является образование изолированных гидроксильных групп, не способных к дальнейшему замещению ацетальными группами [8]. Этот эффект, как показал Флори, приводит к снижению максимальной степени замещения (α∞) и ее значение не может превышать:
Расчеты показывают, что доля изолированных гидроксильных групп $\beta $ при процессах попарного замещения функциональных групп цепных макромолекул является функцией общей степени замещения ${{\alpha }_{p}}$, т. е., доли общего числа функциональных групп, замещенных к данному моменту времени:
Поправка на образование изолированных гидроксильных групп, которую необходимо ввести в уравнения кинетики ацеталирования, сводится к изменению выражения для действующей концентрации гидроксильных групп:
выражением(6)
$\begin{gathered} {{C}_{p}} = C_{p}^{0}\left( {1 - {{\alpha }_{p}} - \beta } \right) = \\ = C_{p}^{0}\left( {1 - {{\alpha }_{p}}} \right)\left[ {1 - \frac{1}{4}{{{\ln }}^{2}}\left( {1 - {{\alpha }_{p}}} \right)} \right] \\ \end{gathered} $(7)
$\begin{gathered} \frac{{d{{\alpha }_{p}}}}{{dt}} = {{k}_{a}}{{h}_{0}}C_{p}^{0}\left( {\frac{{2C_{a}^{0}}}{{C_{p}^{0}}} - {{\alpha }_{p}}} \right) \times \\ \times \,\,\left( {1 - {{\alpha }_{p}}} \right)\left[ {1 - \frac{1}{4}{{{\ln }}^{2}}\left( {1 - {{\alpha }_{p}}} \right)} \right]. \\ \end{gathered} $Решение приведенного дифференциального уравнения целесообразно представить в следующей форме:
или где $V\left( {{{\alpha }_{p}},b} \right)$ – функция от степени замещения гидроксильных групп полимера ${{\alpha }_{p}}$ и от параметра $b = \frac{{2C_{a}^{0}}}{{C_{p}^{0}}}$ (отношение начальной концентрации формальдегида к начальной концентрации функциональных групп ПВС), которое можно рассчитать как:(10)
$V({{\alpha }_{p}},b) = \int\limits_0^{{{\alpha }_{p}}} {\frac{{d{{\alpha }_{p}}}}{{(b - {{\alpha }_{p}})(1 - {{\alpha }_{p}})\left[ {1 - \frac{1}{4}{{{\ln }}^{2}}(1 - {{\alpha }_{p}})} \right]}}} .$На основе проведенных расчетов была построена зависимость степени превращения ${{\alpha }_{p}}$ от величины, пропорциональной времени взаимодействия компонентов $V\left( {{{\alpha }_{p}},b} \right) = {{k}_{a}}{{h}_{0}}C_{p}^{0}t$ (рис. 1).
Рис. 1.
Зависимость степени превращения ${{\alpha }_{p}}$ функциональных групп ПВС от величины $bV\left( {{{\alpha }_{p}},b} \right) = 2{{k}_{a}}{{h}_{0}}C_{a}^{0}t$ при различных значениях $b = \frac{{2C_{a}^{0}}}{{C_{p}^{0}}}$: 1 – 1.00; 2 – 1.25; 3 – 2.00; 4 – 3.00; 5 – 6.00; 6 – ∞.
Как видно из рис. 1, с ростом параметра b процесс ацеталирования идет с большей скоростью, при этом максимальная степень превращения практически достигает ~87%. Поскольку, параметр b характеризует отношение начальной концентрации альдегида к начальной концентрации функциональных групп полимера, можно утверждать, что избыток альдегида является положительным фактором при синтезе поливинилформаля (ПВФ).
При синтезе ПВФ после смешения раствора ПВС с формальдегидом и серной кислотой система при критической степени замещения (~85 мол. %) гидроксильных групп поливинилового спирта ацетальными становится нерастворимой, стабильный раствор превращается в метастабильный, пересыщенный и происходит расслоение системы с образованием двух фаз, представляющих собой разбавленный (фаза 1) и растворенный в нем концентрированный раствор (фаза 2). Стремясь к равновесному состоянию, капли концентрированного раствора из высоковязкой жидкости превращаются в эластичный студень, из которого формируется микрогетерогенная волокнисто-пористая пространственная структура из ППВФ – конденсационная структура.
Таким образом, реакция ацеталирования вначале протекает в гомогенной среде, а затем переходит в гетерогенную.
В этих условиях реакция протекает в гетерогенной структуре и ее кинетику можно описать уравнением вида [7]:
(11)
$\frac{{d{{\alpha }_{p}}}}{{dt}} = {{k}_{a}}{{h}_{0}}\chi \left( {b - {{\alpha }_{p}}} \right)\left( {1 - {{\alpha }_{p}}} \right)\left[ {1 - \frac{1}{4}{{{\ln }}^{2}}\left( {1 - {{\alpha }_{p}}} \right)} \right].$Уравнение (11) отличается от уравнения (7) для гомогенной системы наличием параметра
где χ – коэффициент, характеризующий замедление реакции в полимерной фазе, λ – коэффициент распределения фаз, не изменяющийся в ходе реакции ацеталирования, $\upsilon $ – объемная доля полимерной фазы (ПВС) в первоначальном общем объеме полимерного раствора.Дифференциальное уравнение кинетической реакции в гетерогенной структуре (11) может быть представлено в виде:
(12)
$V({{\alpha }_{p}},b) = V({{\alpha }_{{p1}}},b) + {{k}_{a}}{{h}_{0}}\chi C_{p}^{0}(t - {{t}_{1}})$(13)
$bV({{\alpha }_{p}},b) = bV({{\alpha }_{{p1}}},b) + 2{{k}_{a}}{{h}_{0}}\chi C_{a}^{0}(t - {{t}_{1}})$Отметим, что реакция ацеталирования в гомогенной фазе раствора проходит с большей скоростью, по сравнению с гетерогенной системой.
Из данных работы [7, 9] известно, что исходная концентрация полимера (ПВС) при прочих равных условиях практически не оказывает влияния на кинетику реакции ацеталирования в гетерогенной среде.
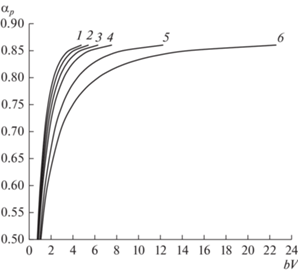
На рис. 2. приведена зависимость степени ацеталирования ПВС от времени взаимодействия с формальдегидом при различных начальных концентрациях ПВС ($C_{p}^{0}$) в водном растворе.
Рис. 2.
Зависимость степени ацеталирования от времени реакции взаимодействия ПВС с формальдегидом при различных начальных концентрациях ПВС в водном растворе $C_{p}^{0}$, г-экв/л: 1 – 0.98; 2 – 1.42; 3 – 1.83; 4 – 1.97. $C_{a}^{0}$ = 2.62 моль/л, $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$ = 2.52 моль/л, 40°С.

Установлено, что увеличение концентрации ПВС практически не влияет на степень превращения – 0.84–0.86. Однако время превращения возрастает с увеличением концентрации ПВС в растворе (рис. 2) с 12 до 24 мин. При степени ацеталирования αр ≈ 0.75 происходит выделение новой фазы, формируется гетерогенная среда и скорость реакции ацеталирования снижается. Оптимальная начальная концентрация ПВС в водном растворе для получения поливинилформаля составляет ~1.42–1.97 г-экв/л.
Ниже приведены данные о влиянии концентрации формальдегида на кинетику реакции ацетилирования ПВС в водном растворе. На рис. 3 приведены зависимости степени ацеталирования ПВС при взаимодействии с формальдегидом при различных начальных концентрациях альдегида от времени.
Рис. 3.
Зависимость степени ацеталирования ПВС от времени взаимодействия с формальдегидом при различных начальных концентрациях альдегида $C_{a}^{0}$ (моль/л): 1 – 1.00; 2 – 2.00, 3 – 2.62; 4 – 3.30. $C_{p}^{0}$ = = 1.83 г-экв/л, $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$= 2.52 моль/л, 45°С.
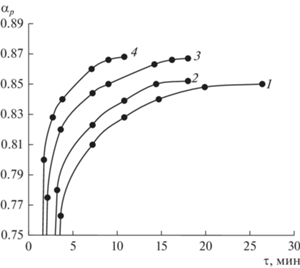
С увеличением концентрации формальдегида в водном растворе ПВС с 1.0 до 3.3 моль/л максимальная степень превращения возрастает с 0.73 до 0.86, а время превращения уменьшается с ~26 до 11 мин (в ~2.5 раза).
Оптимальная концентрация альдегида для синтеза ППВФ составляет ~2.62–3.3 моль/л. При этом достигается степень превращения ПВС при взаимодействии с формальдегидом 0.86.
Существенное влияние на кинетику реакции ацеталирования оказывает введение катализатора (серная кислота) и его начальная концентрация.
На рис. 4 приведены зависимости степени ацеталирования ПВС от времени взаимодействия водного раствора ПВС с формальдегидом при 45оС и различных концентрациях серной кислоты.
Рис. 4.
Зависимость степени ацеталирования ПВС от времени взаимодействия с формальдегидом при различных концентрациях 25%-ного серной кислоты $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$ (моль/л): 1 – 2.00; 2 – 2.52; 3 – 2.80; 4 – 3.50; $C_{p}^{0}$ = 1.83 г-экв/л, $C_{a}^{0}$ = 3.30 моль/л; 45°С.

Увеличение концентрации серной кислоты с 2 до 3.50 моль/л приводит к ускорению реакции ацеталирования ПВС при взаимодействии с формальдегидом в ~3 раза и повышению максимальной степени превращения с ~0.82 до 0.85.
Из полученных данных можно сделать вывод, что оптимальная концентрация катализатора (25%-ный раствор серной кислоты) для получения ПВФ из водного раствора ПВС составляет ~3.50 моль/л, а необходимое время для завершения синтеза соответственно – 10–20 мин. Следует отметить, что в данном временном интервале сохраняется устойчивость пены ПВС в воде, что соответствует оптимальному времени проведения синтеза.
На кинетику реакции ацеталирования ПВС альдегидом, несомненно, будет оказывать влияние температура. На рис. 5. приведены зависимости степени ацеталирования ПВС от времени реакции при взаимодействии с формальдегидом при различных температурах.
Рис. 5.
Зависимость степени ацеталирования от времени взаимодействия с формальдегидом при различных температурах: 1 – 35; 2 – 40; 3 – 45; 4 – 50. $C_{p}^{0}$ = = 1.83 г-экв/л, $C_{a}^{0}$ = 3.3 моль/л; $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$ = 3.5 моль/л.

С повышением температуры с 35 до 50°С возрастает скорость реакции ацеталирования, несколько повышается степень превращения – с 0.85 до 0.87 и уменьшается время синтеза с 25 до 11 мин.
Таким образом, можно считать, что необходимая температура для получения поливинилформаля по реакции ацеталирования водного раствора ПВС составляет 40–45оС.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований были оптимизированы температурно-временные параметры реакции ацеталирования и определены концентрации исходных компонентов и температура для получения ППВФ из водных растворов ПВС: концентрация формальдегида – $C_{a}^{0}$ = 3.3 моль/л, серной кислоты – $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{0}$ = 3.5 моль/л и температура синтеза – 40–45оС.
ОБОЗНАЧЕНИЯ
| ${{C}_{p}}$ | концентрация гидроксильных групп полимера, способных вступать в реакцию ацеталирования, г-экв/л |
| ${{C}_{a}}$ | концентрация альдегида, моль/л |
| ${{h}_{0}}$ | функция кислотности Гамметта |
| ${{\alpha }_{{{{{\text{H}}}^{{\text{ + }}}}}}}$ | активность ионов водорода |
| ${{\gamma }_{B}}$ | коэффициент активности нейтрального основания |
| ${{\gamma }_{{B{{{\text{H}}}^{ + }}}}}$ | коэффициент активности протонированного основания в данной среде |
| k | константа скорости прямой реакции |
| ${{k}_{0}}$ | термодинамическая константа равновесия взаимодействия альдегида с ионом водорода |
| $t$ | время, мин |
| ${{\alpha }_{p}}$ | степень замещения гидроксильных групп ацетальными |
| α∞ | максимальная степень замещения |
| $V\left( {{{\alpha }_{p}},b} \right)$ | функция от степени замещения гидроксильных групп полимера ${{\alpha }_{p}}$ и от параметра b |
| b | отношение начальной концентрации формальдегида к начальной концентрации функциональных групп ПВС |
| χ | коэффициент, характеризующий замедление реакции в полимерной фазе |
| λ | коэффициент распределения фаз, не изменяющийся в ходе реакции ацеталирования |
| $\upsilon $ | объемная доля полимерной фазы (ПВС) в первоначальном общем объеме полимерного раствора |
Список литературы
Ломовской В.А., Абатурова Н.А., Ломовская Н.Ю., Хлебникова О.А., Саков Д.М., Галушко Т.Б., Бартенева А.Г. 5-ая Научная конференция “Физическая химия поверхностных явлений и адсорбции”. 1–6 июля 2013г. Плес: Труды конференции / ФБГОУ ВПО Иван. гос. хим.-технол. ун-т. Иваново, 2014. С. 52.
Лысаков В.Н. Методы получения и исследования свойств пенных составов, перспективных для создания звукоизоляционных покрытий // Молекулярные технологии. 2008. № 2.С. 61–79.
Панов Ю.Т. Научные основы создания пенопластов второго поколения: монография. Владимир: Ред.-издат. комплекс ВлГУ, 2003. 176 с. ISBN 5-89368-379-Х.
Акимова А.А., Ломовской В.А., Симонов-Емельянов И.Д. Кратность вспенивания и устойчивость пен на основе водных растворов поливинилового спирта с разной вязкостью // Полимерные материалы и технологии. 2021. Т. 7. № 3. С. 74–79.
Ушаков С.Н., Поливиниловый спирт и его производные: в 2 т. М.Л.: Изд. АН СССР, 1960. Т. 1. 552 с.
Nagarkar R., Patel J. Polyvinyl Alcohol: A Comprehensive Study // Acta Scientific Pharmaceutical Sciences 3.4 (2019): 34–44.
Синицына Г.М., Влодавец И.Н. Кинетика гомогенного взаимодействия поливинилового спирта с формальдегидом в водных растворах // Докл. АН СССР. 1963. Т. 150. № 5. С. 1087–1090.
Влодавец И.Н. Влияние образования уединенных групп на кинетику попарного замещения функциональных групп линейного полимера // 1967. Т. А(IX). № 12. С. 2687–2692.
Синицына Г.М., Влодавец И.Н. Кинетика гетерогенного ацеталирования конденсационных структур поливинилформаля // 1968. Т. А(Х). № 6. С. 1240–1250.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии