Успехи современной биологии, 2022, T. 142, № 6, стр. 591-602
О периодических колебаниях численности клеток микроорганизмов в природе и в чистой культуре: к третьему закону популяционной экологии в микробиологии
А. М. Семенов 1, *, А. А. Шаталов 2, Е. В. Семенова 1
1 Московский государственный университет им. М.В. Ломоносова,
биологический факультет
Москва, Россия
2 Groundwork BioAG
Mazor, Israel
* E-mail: amsemenov@list.ru
Поступила в редакцию 11.04.2022
После доработки 19.05.2022
Принята к публикации 19.05.2022
- EDN: NGIWEA
- DOI: 10.31857/S0042132422060084
Аннотация
Экспериментально и теоретически обоснована объективность явления волнообразного изменения численности клеток микробных популяций и сообществ в природе или в чистой культуре микроорганизмов и значимость понимания этого феномена для экологии и биотехнологии. Обсуждена краткая история проблемы. Приведены три основных общих закона популяционной экологии. Предложена математическая модель, которая, на основании включенных в уравнения параметров, позволяет описать волнообразную динамику роста популяции чистой культуры бактерий. Эта модель является математическим выражением третьего закона популяционной экологии, отражающим динамику существования чистой культуры микроорганизмов: dX/dt = (µ(S) − D(S)) × X; dS/dt = −X × µ(S)/Y + Kr × X × D(S). Предложенный экспериментальный и теоретический материал представляет интерес для микробиологов, биотехнологов – теоретиков и практиков в области культивирования микроорганизмов, а также специалистов в области популяционной экологии.
ВВЕДЕНИЕ
Знание основных законов популяционной экологии – непременное условие успеха в микробной экологии и биотехнологии микроорганизмов.
Динамика роста популяций любых организмов подчиняется трем общим законам популяционной экологии: закону экспоненциального роста, закону самоограничения роста любой популяции и закону волнообразного роста в системе ресурс–потребитель (Турчин, 2002). Эти законы имеют следующие формулировки.
Закон экспоненциального роста: численность популяции растет экспоненциально, если условия для роста и размножения оптимальны, а окружающая среда по отношению к каждой особи в этой популяции остается неизменной. В отношении микроорганизмов говорят о популяции, а не о каждой особи, то есть: пока окружающая среда по отношению к этой популяции остается неизменной.
Закон самоограничения роста популяции: рост любой популяции не может продолжаться бесконечно, существует верхний предел, выше которого популяционная плотность не увеличивается. Для микроорганизмов обычно говорят о лимитировании или ингибировании роста.
Закон волнообразного роста в системе ресурс–потребитель: в системе ресурс–потребитель неизбежно возникают нестабильные колебания. Под нестабильными колебаниями подразумеваются такие колебания, которые не сводятся постепенно к точке равновесия. В системе ресурс–потребитель удельная скорость роста популяций жертвы и хищника не зависит от их собственной плотности. Классическая трактовка закона под потребителем подразумевает хищника, а под ресурсом – популяцию жертвы (Турчин, 2002). Однако в микробиологии известно, что сама популяция микроорганизмов может выступать как потребителем, так и питательным субстратом – ресурсом.
Волнообразная динамика популяции микроорганизмов наблюдается в условиях лимитированного роста. В природных условиях, где практически постоянно имеет место недостаток субстрата, это явление особенно актуально. В эксперименте оно проявляется при длительном выращивании чистых культур. Причем, если справедливость двух первых законов для оценки поведения популяции микроорганизмов принимается безоговорочно, то третий закон многими микробиологами до сих пор не рассматривается как присущий микроорганизмам. Вместе с тем литература наполнена информацией о волнообразном развитии микробных популяций в природных условиях. Причем причины и движущие силы этого волнообразного процесса не рассматриваются или сводятся к взаимоотношению хищник–жертва. Более того, существует мнение практиков, что в условиях экспериментального или производственного выращивания чистой культуры микроорганизмов проявление третьего закона популяционной экологии не наблюдается.
Цель работы – представление и обсуждение собственных экспериментальных результатов волнообразной динамики развития Pseudomonas fluorescens 32 gfp, полученных при длительном лабораторном культивировании этой бактерии, данных литературы о феномене волнообразного роста популяций и сообществ микроорганизмов в природе, а также обоснование справедливости третьего закона популяционной экологии для динамики роста микробных популяций в чистой культуре.
К ИСТОРИИ НАБЛЮДЕНИЙ И ОБЪЯСНЕНИЙ ВОЛНООБРАЗНОГО РАЗВИТИЯ МИКРОБНЫХ ПОПУЛЯЦИЙ
Описания волнообразной динамики при ежедневном учете численности микроорганизмов в почве появились еще в 1920–30-х гг. (Cutler et al., 1922; Thornton, Taylor, 1935; Taylor, 1936). Попытка объяснить волнообразную динамику развития сообществ микроорганизмов при длительном ежедневном учете численности бактерий в виде колонии образующих единиц (КОЕ) была предпринята в 1950-е гг. Я.П. Худяковым. Он предложил гипотезу для объяснения возникновения волнообразной численности КОЕ образованием бактериями гипотетического вещества – периодина, то есть саморегуляцией. Однако гипотеза не нашла экспериментального подтверждения (Худяков, 1958, 1972).
В 1970-е гг. в рамках международной биологической программы под руководством Т.В. Аристовской проведены широкие исследования численности бактерий в почве и ризосфере путем длительного ежедневного учета количества клеток под микроскопом в почвенных образцах и подсчетом в виде КОЕ. Учет был проведен в разных почвенно-климатических зонах Советского Союза (Аристовская, 1974; Домрачева, 1974; Егорова, 1974; Евдокимова, 1974; Ефремова, 1974; Зыкина, 1974). В исследованиях показана волнообразная динамика развития бактериальных сообществ в почве. К сожалению, на момент публикации этих данных авторы не смогли применить соответствующей статистической обработки, которая уместна для анализа длинных рядов данных. В результате эта объемная и кропотливая работа не получила заслуженного внимания и оценки.
К проблеме изучения динамики численности микроорганизмов – бактерий, в частности актинобактерий и микромицетов, – путем длительного ежедневного учета клеток микроорганизмов в почве неоднократно обращались сотрудники кафедры биологии почв факультета почвоведения МГУ и Института физико-химических и биологических проблем почвоведения РАН (Звягинцев, 1987; Горбенко, Паников, 1989; Полянская, 1996; Ларионова и др., 2001). Этими исследованиями показана волнообразная динамика роста микробных сообществ и эмиссии СО2 из почвы. Однако авторами не была использована соответствующая статистическая обработка длинных рядов данных, которая позволила бы продемонстрировать справедливость третьего закона популяционной экологии для микроорганизмов.
При изучении пространственной динамики численности микроорганизмов в ризосфере вдоль корня растений пшеницы обнаружена (Semenov et al., 1999; Zelenev et al., 2000) волнообразная динамика общей численности КОЕ гетеротрофных бактерий и микромицетов. Важно отметить, что волнообразная динамика численности микромицетов, учитываемых по КОЕ, наблюдалась как у интродуцированных в ризосферу растений пшеницы Rhizoctonia solani AG8, так и обитающих в почве диких штаммов гриба Pythium spp. (van Bruggen et al., 2002). Волнообразная динамика роста микроорганизмов была достоверно подтверждена не только при учете численности клеток и КОЕ микроорганизмов, но и их функциональной активности в виде эмиссии СО2, целлюлитической активности и азотфиксирующей активности (Лаврентьева и др., 2009; Семенов и др., 2013; Эмер и др., 2014; He et al., 2017; van Bruggen et al., 2017). Факт волнообразного развития природных микробных сообществ и популяций у исследователей не вызывал сомнения, но в интерпретации этого факта не было единодушия. Для объяснения этого факта выдвигались разные гипотезы. Наиболее распространенная гипотеза хищник–жертва не могла удовлетворительно объяснить все проявления феномена (Семенов, 2001; Zelenev at al., 2004).
Вместе с тем на осцилляцию роста популяции бактерий в лабораторных условиях при длительном периодическом режиме выращивания или не обращали внимания вообще, или объясняли ошибками измерения (Волкова и др., 2006; Herman, 2002). При длительном периодическом культивировании Pseudomonas aeruginosa в лаборатории на углеводородах без дополнительного внесения питательных веществ в среду, что характерно для естественных мест обитания бактерий, обнаружена (Милько, Милько, 2017) в поздней стационарной фазе волнообразная динамика роста клеток. В этих экспериментах показаны также и колебания концентрации редуцирующих сахаров в среде культивирования, полученные путем пересчета на глюкозу, что можно объяснить только лизисом части клеток. Таким образом, факты волнообразной динамики роста чистой культуры микроорганизмов при длительном периодическом культивировании некоторые экспериментаторы также отмечали, но авторы этих наблюдений (Волкова и др., 2006; Милько, Милько, 2017; Herman, 2002) не разобрались в причинах волнообразной динамики в чистой культуре, как ранее не разобрались в причинах волнообразной динамики природных микробных сообществ (Худяков, 1958; Аристовская, 1974).
ЭКСПЕРИМЕНТАЛЬНОЕ ИЗУЧЕНИЕ ДИНАМИКИ РОСТА Pseudomonas fluorescens 32 gfp В СТАЦИОНАРНОЙ ФАЗЕ ПРИ ДЛИТЕЛЬНОМ ПЕРИОДИЧЕСКОМ КУЛЬТИВИРОВАНИИ
Авторы настоящей публикации исследовали динамику роста Pseudomonas fluorescens штамм 32 gfp в условиях длительного периодического культивирования в лаборатории с целью выявления возможных осцилляций в стационарной фазе. Использовали спонтанно устойчивый к рифампицину мутант штамма 32 Pseudomonas fluorescens, который был трансформирован плазмидой pVSP61TIR. Эта плазмида содержала конститутивно экспрессируемый ген, ответственный за синтез зеленого флуоресцирующего белка GFP (green fluorescent protein), и ген устойчивости к канамицину (Miller, Lindow, 1997).
Культуру выращивали в жидкой и на агаризованной среде.
Состав жидкой среды для культивирования бактерий включал (г/л): протеозо-пептон – 2; K2HPO4 – 1.5; MgSO4⋅7H2O – 1.5; глицерин – 15 мл/л; pH среды 7.0; добавляли антибиотики канамицин и рифампицин по 50 мг/л каждого.
Для приготовления агаризованной использовали готовую для культивирования бактерий рода Pseudomonas среду F (Difco 0.48–17), содержащую (г/л): бакто-триптон – 10; бактопротеозо-пептон – 10; K2HPO4 – 1.5; MgSO4⋅7H2O – 1.5; бакто-агар – 15; pH среды 7.0; добавляли те же антибиотики.
Культивирование в жидкой среде проводили в стационарных условиях при 25°С в колбах объемом 3 л с одним литром среды в течение 60 сут. Учет количества бактерий осуществляли прямым подсчетом клеток под люминесцентным микроскопом и по количеству колоний, выросших на агаризованной среде. Подсчитывали количество зеленых светящихся клеток в поле зрения микроскопа “Микмед-2” РПО-11 (ЛОМО, СПб, Россия) при длине возбуждающего света 450–480 нм (барьерный фильтр 520–560 нм), объектив ×100, окуляр ×10. Для учета КОЕ в мл культуры проводили посев 100 МКл из разведений 10–5 и 10–6 на агаризованную среду в трех повторностях. Чашки Петри инкубировали при 25°С в течение 48 ч. Колонии подсчитывали при освещении синим светом (450–490 нм). Концентрацию растворенного органического вещества (РОВ) в культуральной жидкости после ее многократного разведения определяли бихроматным методом. Эксперименты повторяли дважды в разные сезоны, результаты которых обозначены как варианты (а) и (б) (рис. 1). Коэффициент корреляции между прямым учетом и учетом КОЕ составил 0.83 в варианте (а) и 0.76 – в варианте (б).
Рис. 1.
Динамика роста численности бактерии Pseudomonas fluorescenc 32 gfp при длительном периодическом культивировании. Количество клеток определено прямым подсчетом под микроскопом и методом посева в экспериментах (а) и (б) соответственно.

Согласно результатам наиболее чувствительного метода – микроскопического учета клеток, продолжительность экспоненциальной стадии роста P. fluorescens длилась до 10 сут. После экспоненты, без периода замедления роста, отсутствие которого можно объяснить особенностями использованной среды (неоднородность углеродного субстрата и др.) для выращивания бактерий, начиналась длительная стационарная фаза. Эта фаза характеризовалась резкими изменениями как динамики роста клеток, так и динамики концентрации РОВ. Сравнивая динамики численности клеток и концентрации РОВ, даже при визуальной оценке легко заметить явное несовпадение пиков на графиках во времени (рис. 1 и 2). В начале стационарной фазы численность клеток снижалась, а концентрация РОВ возрастала. Визуальный анализ стационарной фазы выявляет несколько пиков возрастания количества клеток с последующим их убыванием. Наиболее ярко выраженные пики численности на кривых роста при анализе обоих экспериментов наблюдались на 11, 28–30, 44, 53–55 сут. Анализ графиков концентрации РОВ также выявляет волнообразную динамику с пиками концентраций на 11, 21–23, 30–32, 38, 50–53, 56 сут. При этом концентрации РОВ имеют заметный тренд к снижению. Итак, с одной стороны, в динамиках роста клеток и концентрации РОВ не наблюдается четкой противофазности осцилляций, но с другой стороны, нет и совпадения пиков количества клеток и концентрации РОВ во времени. Вместе с тем, четкая волнообразная динамика численности клеток проявляется лишь только с 20-х суток, что объясняется перестройкой метаболизма культуры при ее росте в условиях глубокого лимитирования в длительном стационаре (Перт, 1978). Четкость выявления противофазных колебаний в динамиках количества клеток и концентрации РОВ может быть достигнута увеличением повторностей в эксперименте, частотой определения этих параметров, повышением чувствительности используемых методов определения, автоматизацией промеров и др.
Рис. 2.
Динамика количества растворенного органического вещества (РОВ) в периодической культуре Pseudomonas fluorescens 32 gfp в экспериментах (а) и (б) соответственно.

На графиках восходящие стороны пиков количества клеток, как правило, более крутые, а ниспадающие – более пологие (рис. 1). Это связано с разницей в скоростях роста и отмирания бактерий. Возрастание количества клеток идет по экспоненциальному закону, а отмирание чаще всего не носит экспоненциального характера (Перт, 1978). При этом нужно учитывать явление гетерогенности популяции, которое заключается в разном физиологическом состоянии клеток, что и выражается в отличиях скоростей роста клеток. В динамике пиков РОВ, наблюдается обратное явление: снижение концентрации РОВ происходит медленнее, а накопление – быстрее (рис. 2). Это можно объяснить тем, что процесс появления РОВ, доступных для определения, отстает во времени от процесса гибели клеток. При этом общее содержание субстрата, выраженное концентрацией РОВ, имеет тенденцию к убыванию (рис. 2).
В нашем случае отсутствие противофазных осцилляций могло быть следствием ряда причин: определение численности клеток и концентрации РОВ проводили не ежедневно, а через сутки; возможная инициация стадий подготовительного метаболизма для потребления ряда компонентов оставшегося в среде субстрата; разные скорости потребления компонентов оставшегося субстрата, возникающие в фазах роста в трофофазе и идеофазе (Madigan et аl., 1997).
Тем не менее, визуальная оценка результатов показывает наличие осцилляционной динамики количества клеток и концентрации РОВ.
Для обработки экспериментальных данных был применен статистический гармонический Фурье-анализ (Смирнов, 1974; Горбенко, Крышев, 1985). Как известно, этот анализ используют для выявления периодичности в динамических процессах, и в частности он позволяет выявить периодичность в динамике роста микробных популяций. На рис. 3 и 4 приведены результаты гармонического анализа роста культуры с 20-го по 60-й день, то есть поздней стационарной фазы, так как именно после 20-х суток роста обнаружены более четкие гармонические колебания численности клеток бактерий и органического углерода. Гармонический анализ позволяет получить следующие характеристики волнообразного роста: количество колебаний (гармоник), их амплитуды, фазы и периоды (табл. 1 и 2). Достоверность приведенных в таблице характеристик для роста численности клеток P. fluorescens и значений РОВ подтверждена расчетом F-критерия (табл. 1 и 2). Отметим, что достоверные колебания численности КОЕ были обнаружены также и при анализе результатов чашечного учета (результаты анализа не приводятся).
Рис. 3.
Гармонический анализ результатов динамики роста Pseudomonas fluorescens 32 gfp в поздней стационарной фазе в экспериментах (а) и (б) соответственно.
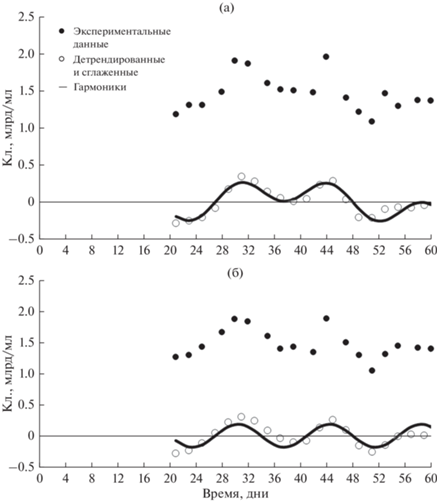
Рис. 4.
Гармонический анализ результатов динамики РОВ в культуре Pseudomonas fluorescens 32 gfp в поздней стационарной фазе в экспериментах (а) и (б) соответственно.

Таблица 1.
Характеристики гармоник периодического роста культуры Pseudomonas fluorescens 32 gfp в поздней стационарной фазе, полученные с помощью гармонического Фурье-анализа при p ≤ 0.1 и p ≤ 0.05
| № эксперимента | 1 | 2 | |
|---|---|---|---|
| Изучаемый объект | клетки | клетки | |
| Номер гармоники | 1* | 3 | 3 |
| Амплитуда, млрд | 1.713 | 1.649 | 1.88 |
| Фаза, дни | 37.4 | 16.5 | 16.5 |
| Период, дни | 42 | 14 | 14 |
| Частота | 0.02 | 0.07 | 0.07 |
| Коэффициент вариации, % | 42.5 | 39.4 | 59.7 |
| Fэкспер. | 4.25 | 3.94 | 5.97 |
| Fтаб., p = 0.1 | 2.59 | 2.59 | 2.59 |
| Количество анализируемых точек | 21 | 21 | 21 |
| Fтаб., p = 0.05 | 3.5 | 3.5 | 3.5 |
Примечание: * – на графиках приведены гармоники только высоких порядков (номеров), так как метод анализа предполагает поглощение гармониками более высоких порядков гармоник более низких порядков; Fэкспер. – коэффициент Фишера; Fтаб. – табличное значение уровня достоверности. Здесь и в табл. 2.
Таблица 2.
Характеристики гармоник значения РОВ периодического роста культуры Pseudomonas fluorescens 32 gfp в поздней стационарной фазе, полученные с помощью гармонического Фурье-анализа при p ≤ 0.1 и p ≤ 0.05
| № эксперимента | 1 | 2 | |
|---|---|---|---|
| Изучаемый объект | РОВ | РОВ | |
| Номер гармоники | 1* | 3 | 3 |
| Амплитуда, мкг | 174.6 | 159.2 | 179.1 |
| Фаза, дни | 7.49 | 0.83 | 0.82 |
| Период, дни | 41.4 | 13.8 | 13.8 |
| Частота | 0.02 | 0.07 | 0.07 |
| Коэффициент вариации, % | 46 | 38.2 | 57.3 |
| Fэкспер. | 3.91 | 3.25 | 4.87 |
| Fтаб., p = 0.1 | 2.59 | 2.59 | 2.59 |
| Количество анализируемых точек | 21 | 21 | 21 |
| Fтаб., p = 0.05 | 3.5 | 3.5 | 3.5 |
Таким образом, достоверные колебания численности клеток микроорганизмов имеют место в однородной популяции при отсутствии хищников. Ни хищничеством, ни традиционно понимаемым каннибализмом невозможно объяснить осцилляционную динамику популяции чистой культуры бактерий, которые являются осмотрофами и поглощают лишь растворенные вещества. Этот феномен может быть объяснен только лишь процессом отмирания части клеток популяции, автолизом этих клеток и ростом другой части популяции за счет появившегося субстрата. То есть одна и та же популяция микроорганизмов одновременно является и ресурсом, и потребителем.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ВОЛНООБРАЗНОГО РАЗВИТИЯ МИКРОБНОЙ ПОПУЛЯЦИИ В СИСТЕМЕ ПОТРЕБИТЕЛЬ–СУБСТРАТ
Ранее обнаружены (Semenov et al., 1999) достоверные колебания численности КОЕ микроорганизмов вдоль корней пшеницы в ризосферном эксперименте. Наблюдаемые волнообразные закономерности в популяциях бактерий объяснены внутренними особенностями функционирующей системы, состоящей из бактериального сообщества и его субстрата. Такая система должна включать корневую экссудацию, субстрат от переработки мертвой биомассы и субстрат от разложения органического вещества почвы с последующим потреблением всех этих веществ микроорганизмами, что обеспечивает их рост. При временном истощении субстрата часть микроорганизмов погибает (Semenov et al., 1999). На основании своих исследований авторы предложили математическую модель, адекватно описывающую волнообразное развитие микробной популяции в системе потребитель–субстрат, без включения в модель явления хищник–жертва (Zelenev et al., 2004). Модель представляет собой систему дифференциальных уравнений, описывающих динамику роста и отмирания микроорганизмов и волнообразную динамику субстрата (Zelenev et al., 2000):
Авторы настоящей публикации полагают, что приведенная модель может быть адаптирована к описанию динамики роста чистой бактериальной культуры при длительном периодическом выращивании в лаборатории или на производстве. Такая адаптированная математическая модель должна объяснять возникновение осцилляций в динамике роста популяции и динамике концентрации субстрата в стационарной фазе чистой культуры потреблением субстрата бактериями с последующим его пополнением за счет отмирания части популяции клеток, что и было продемонстрировано в представленном экспериментальном материале.
После удаления из вышеприведенной модели константы скорости подтока субстрата из почвы, параметров, учитывающих процессы экссудации, и параметра влажности почвы получены уравнения, приведенные ниже. Эти уравнения позволяют описать микробно-субстратные взаимодействия, которые приводят к волнообразной динамике популяции бактерий и субстрата в чистой культуре (рис. 3 и 4):
В модифицированной математической модели возникновение осцилляций в динамике численности клеток и концентрации субстрата в стационарной фазе чистой культуры объясняется потреблением субстрата бактериями с последующим его пополнением за счет отмершей части популяции клеток, что наблюдается в представленном экспериментальном материале.
ОБСУЖДЕНИЕ
Феномен волнообразной динамики развития сообществ и популяций микроорганизмов в естественных условиях отмечен многими исследователями. Для объяснения этого феномена в литературе можно найти более полудюжины гипотез, большинство из которых и фантастичны, и не доказуемы (Звягинцев, 1987; Горбенко, Паников, 1989). Таким образом, отмечаем объективный и важный факт существования волнообразной динамики роста чистой культуры микроорганизмов при длительном периодическом культивировании. Еще раз подчеркнем, что экспериментаторы наблюдали такую динамику (Волкова и др., 2006; Милько, Милько, 2017; Herman, 2002), но по каким-то причинам не разобрались в сути этого явления, как ранее не разобрались в причинах волнообразной динамики природных микробных сообществ и другие ученые (Худяков, 1958; Аристовская, 1974).
Недавние исследования позволяют выдвинуть еще одну гипотезу, которая тоже может объяснять осцилляции роста популяции микроорганизмов и даже микробных сообществ. Это переход части популяции из активного состояния в состояние “переживания”, когда клетки остаются живыми, но не проявляют физиологической активности, которую можно обнаружить известными методами. Такие клетки являются живыми, но не культивируемыми – VBNC (viable but nonculturable) (Kapreylants, Kell, 1993; Haldeman et al., 1995). Однако такое состояние клеток можно выявить только одновременным применением сразу двух методов: высевом на твердые среды для учета КОЕ и общим учетом клеток, помеченных красителем и выявленных под микроскопом.
Для обозначения периодических или апериодических колебаний численности организмов в природных популяциях используется понятие популяционных волн (Четвериков, 1926). Такие колебания объясняются отношением хищник–жертва. Явление хищник–жертва среди высших животных можно выявить только многолетними наблюдениями, что делает их более трудными, но и более убедительными. В первой половине ХХ в. предложена (Lotka, 1925; Volterra, 1926) математическая модель взаимодействия популяций двух разных видов хищник–жертва. Модель Лотки–Вольтерры позволяет показать основную тенденцию в отношениях хищник–жертва, которая выражается возникновением колебаний в численностях популяций. Эта модель положила начало описанию взаимодействия живых существ математическими уравнениями, что позже привело к использованию математических моделей для выражения законов популяционной экологии.
В микробиологии математическое моделирование получило активное развитие с 1950-х гг. Динамика роста чистой культуры микроорганизмов в периодическом режиме хорошо изучена экспериментально, разделена на фазы и описана математически. В первую очередь это касается экспоненциальной фазы роста популяции, которая описана уравнением: x = x0 × eµt. Приведенное уравнение является математическим выражением первого закона популяционной экологии, который справедлив и для популяции микроорганизмов в том числе.
Второй общий закон популяционной экологии – закон ограничения роста популяций – тоже первоначально был обнаружен и описан специалистами в области общей экологии (Турчин, 2002). Для микроорганизмов он проявляется через лимитирование или ингибирование роста. Математически этот закон выражается уравнениями:
лимитирования роста субстратом (уравнение Моно):
ингибирования роста продуктами метаболизма (уравнение Иерусалимского):
Как отмечено выше, длительные колебания численности популяций – популяционные волны в общей экологии пытались математически выразить Лотка и Вольтерра (Lotka, 1925; Volterra, 1926). Предложенная ими математическая модель выглядит следующим образом:
Данная модель нашла широкое распространение и признание, но подверглась критике с точки зрения современной популяционной экологии (Турчин, 2002).
Применение в наших исследованиях гармонического анализа для обработки данных ежедневного учета микроорганизмов и количества субстрата доказало наличие закономерных и статистически достоверных колебаний количества клеток и концентрации субстрата в стационарной фазе роста чистой культуры. Рассчитанные параметры гармоник подтвердили соответствие волнообразного роста гармоническому закону, где причины волнообразных колебаний количества клеток в популяциях микроорганизмов – рост и отмирание, а механизмы – это потребление субстрата клетками и восполнение субстрата за счет лизиса отмершей части популяции. Предложенная в данной публикации модель для описания динамики численности монокультуры микроорганизмов в длительной стационарной фазе роста представлена двумя уравнениями:
Предлагаемая модель, в отличие от модели Лотки–Вольтерры, не предусматривает хищника, а причиной колебаний является периодичность процессов роста и отмирания клеток популяции как следствие взаимодействий ресурс–потребитель, где микроорганизмы попеременно играют роль и потребителя, и ресурса.
ЗАКЛЮЧЕНИЕ
Первый общий закон популяционной экологии – закон экспоненциального роста любых организмов – описан наиболее простым уравнением, тем самым подчеркивается отсутствие всяких ограничений для роста. Имеется не ограниченный субстрат, поступающий из вне, не производящийся самим организмом или популяцией организмов, а любые другие ограничения отсутствуют. Такие условия возникают в природе кратковременно, но постоянно. Живая система всегда развивается, а если нет ограничений, развивается не ограниченно. П.В. Турчин совершенно правомерно сравнил этот закон роста с первым законом Ньютона, в котором постулируются отсутствие ограничивающих влияний на процесс.
Второй закон представлен уже более сложным уравнением, так как в нем учтены возникшие условия, ограничивающие безудержный рост популяций, это, в первую очередь, субстрат или какие-то другие ключевые для роста ограничения. Для микроорганизмов такие ограничения идентифицируются несравненно легче и понятней. Введение в уравнение параметров, обозначающих возникающие ограничения в виде или дефицита субстрата (Monod, 1949), или накопления токсичного продукта (Иерусалимский, 1963), образуемого самим экспоненциально растущим организмом, хорошо соответствует экспериментальным данным.
Третий закон наиболее сложный. В этом законе разрешаются противоречия между первым и вторым законами – стремление к неограниченному росту и наличие ограниченного количества субстрата или других ключевых ограничений, относящихся к категории узких мест, по Либиху. Для его соответствия экспериментальным результатам, наблюдаемым в микробиологии при культивировании одновидовой популяции в полузакрытой системе, и для выполнения необходимых условий уже требуются параметры двух уравнений.
По существу, противоречия разрешаются образованием замкнутой системы, популяция замыкается сама на себя, временно образуя замкнутый пищевой цикл. Интересно предположить, как долго могла бы так существовать биосистема из экстремально анаэробных бактерий.
Предложенные объяснения и их выражение в параметрах уравнений не противоречат экспериментальным результатам. Тем самым проинтерпретировано одно из объективно существовавших, но долгое время не понятных явлений – волнообразное колебание численности организмов или их метаболитов в чистых культурах. При этом проявления жизни и закон сохранения вещества и энергии выполняются.
Прикладное, технологическое значение этого открытия и понимания явления волнообразного развития микробных популяций и сообществ уже нашло свое применение – был разработан способ определения параметров здоровья почвенной экосистемы (Семенов и др., 2011; Семенов, Семенова, 2018).
Список литературы
Аристовская Т.В. О некоторых итогах работ по международной биологической программе в области почвенной микробиологии // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 5–14.
Волкова М.А., Кононова Л.И., Филатова Л.Б. Изучение роста Rhodococcus ruber на гидрофобном субстрате // Современное состояние и перспективы развития микробиологии и биотехнологии / Мат. междунар. конф. (26–28 мая 2004, Минск). Минск: НАН РБ, 2006. С. 120–124.
Горбенко Ю.А., Крышев И.И. Статистический анализ динамики морской экосистемы микроорганизмов. Киев: Наукова думка, 1985. 144 с.
Горбенко А.Ю., Паников Н.С. Количественное описание динамики роста гетеротрофных микроорганизмов в почве в связи с первичным продукционным процессом в биогеоценозе // Журн. общ. биол. 1989. Т. 50. № 1. С. 38–59.
Домрачева Л.И. Динамика развития водорослей в дерново-подзолистой почве при ежесуточном определении // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 38–51.
Евдокимова Г.А. Продуктивность микроорганизмов в ризосфере многолетних злаков в заполярье // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 87–104.
Егорова С.В. Изучение размеров биомассы бактерий в почвах лесов // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 70–76.
Ефремова Т.Н. Динамика кратковременных колебаний численности бактерий в некоторых почвах полупустыни // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 77–86.
Звягинцев Д.Г. Почва и микроорганизмы. М.: МГУ, 1987. 256 с.
Зыкина Л.В. Ежедневная динамика численности бактерий в дерново-подзолистых почвах под луговыми угодьями // Закономерности развития почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Зоол. ин-т АН СССР, Центр. музей почвоведения, 1974. С. 168–177.
Иерусалимский Н.Д. Основы физиологии микробов. М.: АН СССР, 1963. 244 с.
Лаврентьева Е.В., Семенов А.М., Зеленев В.В. и др. Ежедневная динамика целлюлазной активности в пахотной почве в зависимости от обработки // Почвоведение. 2009. № 8. С. 952–961.
Ларионова А.А., Розанова Л.Н., Демкина Т.С. и др. Годовая эмиссия СО2 из серых почв южного Подмосковья // Почвоведение. 2001. № 1. С. 72–80.
Милько Е.С., Милько Д.М. Значение гетерогенности популяции бактерий при решении биотехнологических задач на примере r-, s- и m-вариантов (диссоциантов) Pseudomonas aeruginosa // Экол. промышл. России. 2017. Т. 21. № 9. С. 53–57.
Перт С.Дж. Основы культивирования микроорганизмов и клеток. М.: Мир, 1978. 331 с.
Полянская Л.М. Сукцессия микробов в почве: Автореф. дис… докт. биол. наук. М.: МГУ, 1996. 96 с.
Семенов А.М. Осцилляции микробных сообществ в почве // Перспективы развития почвенной биологии / Тр. Всерос. конф. (22 февраля 2001, Москва). М.: МАКС Пресс, 2001. С. 57–72.
Семенов А.М., Семенова Е.В. Почва как биологическая система и ее новая категория – здоровье // Успехи соврем. биол. 2018. Т. 138. № 2. С. 115–125.
Семенов А.М., Бубнов И.А., Семенов В.М. и др. Ежедневная динамика численности бактерий и эмиссии СО2 почвы и связь их волнообразных колебаний с сукцессией микробного сообщества // Почвоведение. 2013. № 8. С. 963–979.
Семенов А.М., ван Бругген А.Х.К., Бубнов И.А., Семенова Е.В. Способ определения параметра здоровья у образцов почвы, компостов и других твердых субстратов. Пат. № 2 408 885. Госреестр изобр. РФ 10.01.2011.
Смирнов В.И. Курс высшей математики. Т. 2. М.: Наука, 1974. 655 с.
Турчин П.В. Есть ли общие законы в популяционной экологии? // Журн. общ. биол. 2002. Т. 63. № 1. С. 3–14.
Худяков Я.П. Периодичность микробиологических процессов в почве // Журн. общ. биол. 1958. Т. 40. № 3. С. 448.
Худяков Я.П. Периодичность микробиологических процессов в почве и ее причины // Вопросы численности, биомассы и продуктивности почвенных микроорганизмов / Ред. Т.В. Аристовская. Л.: Наука, 1972. С. 20–37.
Четвериков С.С. О некоторых моментах эволюционного процесса с точки зрения современной генетики // Журн. экспер. биол. Сер. А. 1926. Т. 2. № 1. С. 3–54.
Эмер Н.Р., Семенов А.М., Зеленев В.В. и др. Ежесуточная динамика численности и активности азотфиксирующих бактерий на участках залежной и интенсивно возделываемой почвы // Почвоведение. 2014. № 8. С. 963–970.
Cutler D.W., Crump L.M., Sandon H.A. Quantitative investigation of the Bacterial and Protozoan population of the soil with an account of the Protozoan fauna // Phylos. Trans. Roy. Soc. Ser. B. 1922. V. 211. P. 317.
Haldeman D.L., Amy P.S., Ringelberg D. et al. Microbial growth and resuscitation after community structure after perturbation // FEMS Microbiol. Ecol. 1995. V. 17. P. 27–38.
He M., Ma W., Zelenev V.V. et al. Short-term dynamics of greenhouse gas emissions and cultivable bacterial populations in response to induced and natural disturbances in organically and conventionally managed soils // Appl. Soil Ecol. 2017. V. 119. P. 294–306.
Herman P.K. Stationary phase in yeast // Curr. Opin. Microbiol. 2002. V. 5. P. 602–607.
Kapreylants A.S., Kell D.B. Dormancy in stationary-phase cultures of Micrococcus luteus: flow cytometric analysis of starvation and resuscitation // Appl. Environ. Microbiol. 1993. V. 59. P. 3187–3196.
Lotka A. Elements of physical biology. Baltimore: Williams and Wilkins Co., 1925. 460 p.
Madigan M.T., Martinko J.M., Parker J. Brock biology of microorganisms. 8th edition. US: Pearson Education, 1997. 986 p.
Miller W.G., Lindow S.E. An improved GFP cloning cassette designed for prokaryotic transcriptional fusions // Gene. 1997. V. 191. P. 149–152.
Monod J. The grows of bacterial cultures // Ann. Rev. Microbiol. 1949. V. 3. P. 371–394.
Semenov A.M., van Bruggen A.H.C., Zelenev V.V. Moving waves of bacterial populations and total organic carbon along roots of wheat // Microb. Ecol. 1999. V. 37. P. 116–128.
Taylor C.B. Short-period fluctuations in the numbers of bacterial cells in soil // Proc. Roy. Soc. B. 1936. V. 119. P. 269–295.
Thornton H.G., Taylor C.B. Short-period fluctuations in bacterial numbers in soil // Trans. Third Int. Congr. of Soil Sci. 1935. V. 1. P. 175–179.
van Bruggen A.H.C., Semenov A.M., Zelenev V.V. Wavelike distributions of infections by an introduced and naturally occurring root pathogen along wheat roots // Microb. Ecol. 2002. V. 44. P. 30–38.
van Bruggen A.H.C., He M., Zelenev V.V. et al. Relationships between greenhouse gas emissions and cultivable bacterial populations in conventional, organic and long-term grass plots as affected by environmental variables and disturbances // Soil Biol. Biochem. 2017. V. 114. P. 145–159.
Volterra V. Fluctuations in the abundance of a species considered mathematically // Nature. 1926. V. 118. Iss. 2972. P. 558–560.
Zelenev V.V., van Bruggen A.H.C., Semenov A.M. “BACWAVE”, a spatial-temporal model for traveling waves of bacterial populations in response to a moving carbon source in soil // Microb. Ecol. 2000. V. 40. P. 260–272.
Zelenev V.V., Berkelmans R., van Bruggen A.H.C. et al. Daily changes in bacterial-feeding nematode populations oscillate with similar periods as bacterial populations after a nutrient impulse in soil // Appl. Soil Ecol. 2004. V. 26. P. 93–106.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


