Журнал аналитической химии, 2019, T. 74, № 8, стр. 588-594
Селективность разделения изомерных хлорогеновых кислот в условиях обращенно-фазовой ВЭЖХ
В. И. Дейнека a, *, Е. Ю. Олейниц a, И. П. Блинова a, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет,
Институт инженерных технологий и естественных наук
308015 Белгород, ул. Победы, 85, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 15.03.2018
После доработки 20.04.2018
Принята к публикации 09.02.2019
Аннотация
Исследована селективность разделения часто встречающихся в природных объектах изомерных хлорогеновых кислот (3-, 4- и 5-кофеолилхинных кислот, 3CQA, 4CQA и 5CQA соответственно) в условиях обращенно-фазовой хроматографии на стационарных фазах различных марок: Kromasil (С18, С8 и С4), Symmetry C18, Reprosil-Pur C18-AQ, Nucleosil RPC18 и Диасфер С18. Полученные результаты свидетельствуют в пользу механизма удерживания с преимущественно поверхностной сорбцией. Изменение селективности разделения пары 5CQA и 4CQA коррелирует с изменением активности остаточных силанольных групп. При их низкой активности порядок элюирования 3CQA < 5CQA < 4CQA не зависит от режима (изократический или градиентный), типа органического модификатора и добавки кислоты (муравьиная, ортофосфорная) в подвижную фазу. При росте активности силанольных групп разделение пары 5CQA и 4CQA ухудшается вплоть до инверсии времен удерживания. Для надежного разделения трех кислот в растительных объектах (растворимый кофе, сок, чай “Мате”) выбрана колонка (250 × 4.6 мм) Kromasil 100-5C18.
Хлорогеновые кислоты (ХК), синтезируемые во многих растениях [1, 2], благодаря присутствию в структуре орто-гидроксильных групп [3] обладают высокой антиоксидантной активностью, что и определяет интерес к данным соединениям и к источникам их происхождения [4]. Существуют серьезные разночтения в названиях этих соединений не только в отечественной, но и в иностранной литературе [5, 6]. Во-первых, под ХК в широком смысле понимают не одно соединение, а группу эфиров хинной кислоты с замещенными коричными кислотами, хотя во множестве публикаций под хлорогеновой кислотой подразумевается только 5-кофеоилхинная кислота (5CQA). Во-вторых, по правилам ИЮПАК [7] нумерация атомов углерода в хинной кислоте определена однозначно (схема), но в ряде публикаций применяется нумерации атомов углерода в обратном порядке. Так, известнейший поставщик реактивов фирма SIGMA-ALDRICH присваивает 5CQA название 3-O-(trans-3,4-dihydroxycinnamoyl)-D-quinic acid, trans-3-O-caffeoylquinic acid [8], что, возможно, и является причиной путаницы.
Среди монокофеоилхинных кислот должно существовать 4 изомера: 1CQA, 3CQA, 4CQA и 5CQA. Только три из них обычно обнаруживают в растениях (и не обязательно вместе), благодаря чему они получили специфические названия 3CQA – неохлорогеновая кислота, 4CQA – криптохлорогеновая, а самую распространенную в природе 5CQA называют просто хлорогеновая. Имеются сведения об обнаружении 1CQA [5], для которой предложено название псевдохлорогеновая. 3CQA, 4CQA и 5CQA одновременно синтезируются в семенах кофе (до 14% в пересчете на сухой материал в зеленом кофе [6]), сохраняются в обжаренных семенах, правда, к ним при обжарке добавляется группа лактонов [7].
Порядок нумерации атомов углерода в циклогексановом цикле хинной кислоты – (1S,3R,4S,5R)-1,3,4,5-тетрагидроксициклогексанкарбоновой кислоты.
При разделении хлорогеновых кислот методом обращенно-фазовой хроматографии (ОФ ВЭЖХ) порядок элюирования 3CQA, 4CQA и 5CQA неодинаков для различных условий [9–21] (табл. 1). Обращение порядка элюирования при изменении состава подвижной фазы довольно часто встречается в ОФ ВЭЖХ, хотя разделение изомеров нехарактерно для этого метода. В случае указанных трех соединений во всех работах удерживание 3CQA всегда существенно меньше, чем 4CQA и 5CQA. Времена удерживания в большинстве опубликованных работ возрастают в ряду: 3CQA < 5CQA < 4CQA. В некоторых исследованиях указывалась последовательность 3CQA < < 4CQA < 5CQA, известны также работы, в которых 4CQA и 5CQA не разделяются.
Таблица 1.
Порядок удерживания изомерных хлорогеновых кислот в различных хроматографических системах с градиентным режимом элюирования
| Стационарная фаза | Подвижная фаза | Литература |
|---|---|---|
| 3CQA < 4CQA < 5CQA | ||
| Synergi Polar-RP (4 мкм) | 5–25% CH3CN, 1% HCOOH, вода | [8] |
| Spherisorb 5-ODS | CH3OH, цитратный буферный раствор (pH 2.5) | [9] |
| Hypersil ODS | 25% CH3OH, 2% СH3COOH, вода* | [10] |
| 3CQA < 4CQA = 5CQA | ||
| Superspher 100 RP 18 | СH3OH, H3PO4, вода | [11] |
| 3CQA < 5CQA < 4CQA | ||
| Capcell Pak C18 ACR | СH3CN, CH3COOH, CH3OH, HEDP**, вода | [12] |
| Venusil MP C18 | СH3CN, HCOOH, вода | [13] |
| Lichrosphere 100, C18 | СH3CN, фосфатный буферный раствор (рН 2.7) | [14] |
| Kinetex C18 | СН3CN, трифторуксусная кислота, вода | [15] |
| Accucore C18 | СH3CN, H3PO4, вода | [16] |
| Hypersil-ODS | СH3OH, CH3COOH, вода | [17] |
| Rexchrom, ODS-C18 | СH3OH, цитратный буферный раствор (рН 2.5) | [18] |
| Inertsil ODS-3 | СH3OH (+CH3CN), H3PO4, вода | [19] |
| Magic C30 | СH3OH (+CH3CN), HCOOH, вода | [20] |
Цель настоящей работы – выявление факторов, способствующих изменению селективности разделения изомерных ХК (3CQA, 4CQA и 5CQA) в ОФ ВЭЖХ, и нахождение условий их надежного разделения и определения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 5CQA (chlorogenic acid hemihydrate, Aldrich). Смесь трех изомерных кислот (3CQA, 4CQA и 5CQA) выделяли из экстракта зерен зеленого кофе. Для этого экстракт, полученный настаиванием размолотых зерен в 0.1 М HCl, очищали на патронах Диапак С18 (БиоХимМак СТ, Москва), пропуская 20 мл экстракта через два последовательно соединенных патрона (для исключения проскока 3CQA). Сумму кислот элюировали 4 мл водного раствора, содержащего 10 об. % ацетонитрила и 1 об. % муравьиной кислоты. Все три изомерные кислоты имеют близкие УФ-спектры (λmax 325–326 нм) и идентичные масс-спектры (m/z = 353.0 для отрицательно заряженных ионов). Правильность отнесения пика 3CQA подтверждали сопоставлением времен удерживания кислоты из смеси и основной фенольной кислоты сока вишни [22]. Для отнесения пика 4CQA сопоставляли относительные времена удерживания (tR) и порядок элюирования с данными [13, 23].
При определении ХК в образцах растворимого кофе навески кофе растворяли в подвижной фазе и фильтровали через фильтр Phenex с диаметром пор 0.45 мкм. Экстракт чая “Мате” получали настаиванием измельченного материала в подвижной фазе с последующим отделением растительного остатка фильтрованием. Образцы сока разбавляли подвижной фазой в соотношении 1 : 1 по объему.
Мертвое время колонки определяли по удерживанию щавелевой кислоты, характеризующейся меньшим значением параметра липофильности (Clog P = –1.19 ± 0.58) по сравнению с урацилом (Clog P = –0.71 ± 0.29) (параметры липофильности рассчитывали с помощью программы ChemSketch 12.0).
Хроматографическое поведение ХК исследовали в изократических режимах с использованием хроматографической системы Agilent 1260 Infinity с диодно-матричным и масс-спектрометрическим детекторами на хроматографических колонках: К18 – (100 × 4.6 мм) Kromasil 100-5C18; К8 – (100 × 4.6 мм) Kromasil 100-5C8, К4 – (100 × × 4.6 мм) Kromasil 100-5C4; 2K18 – (250 × 4.6 мм) Kromasil 100-5C18; S18 – (150 × 4.6 мм) Symmetry C18 (3.5 мкм); R18 – (150 × 4.6 мм) Reprosil-Pur 5C18-AQ; 1Д18 – (250 × 4.6 мм) Диасфер-110-5C18; 2Д18 – (100 × 4.0 мм) Диасфер-110-5C18 и N18 – (250 × 4.0 мм) Nucleosil RP-C18. Масс-спектры записывали в режиме ионизации электрораспылением при сканировании отрицательно заряженных ионов.
Хлорогеновые кислоты определяли в образцах растворимого кофе, напитка (чая) “Мате”, вишневого и яблочного соков на колонке К18, защищенной предколонкой (10 × 4.6 мм), Kromasil 100-5C18 в градиентном режиме с подвижными фазами А (10 об. % ацетонитрила и 1 об. % муравьиной кислоты в воде) и Б (40 об. % ацетонитрила и 1 об. % муравьиной кислоты в воде). Программа градиента: 0 мин – 0% Б, 10 мин – 0% Б, 20 мин – 100% Б, 21 мин – 0% Б, 30 мин – 0% Б. Хроматограммы записывали при 325 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для дифференциации распределительного и адсорбционного (гидрофобного выталкивания на поверхность) механизмов в условиях ОФ ВЭЖХ удобно воспользоваться сопоставлением удерживания сорбатов на силикагелях (желательно одной марки) с различной длиной привитого углеводородного радикала. Для веществ, удерживающихся предпочтительно по механизму распределения, удерживание сильно зависит от объема привитой фазы, и времена удерживания резко уменьшаются в ряду tR(C18) $ \gg $ tR(C8) $ \gg $ tR(C4) [13].
Для каждого из изомеров по данным для нескольких различных составов подвижных фаз в соответствии с подходом [24] факторы удерживания описали зависимостями типа:
(1)
${\text{lg}}k{\text{(}}i,x{\text{) = }}a{\text{lg}}k{\text{(}}i{\text{,}}\,\,{\text{C18)}} + b{\text{,}}$Таблица 2.
Параметры уравнения (1) для относительного удерживания изомерных хлорогеновых кислот на трех стационарных фазах для двух систем элюирования
| Стационарная фаза |
3CQA | 4CQA | 5CQA | |||
|---|---|---|---|---|---|---|
| a | b | a | b | a | b | |
| Ацетонитрил–муравьиная кислота–вода | ||||||
| С18 | 1 | 0 | 1 | 0 | 1 | 0 |
| С8 | 0.821 | 0.070 | 0.863 | 0.067 | 0.886 | 0.073 |
| С4 | 0.719 | 0.092 | 0.794 | 0.100 | 0.813 | 0.099 |
| Метанол–муравьиная кислота–вода | ||||||
| С18 | 1 | 0 | 1 | 0 | 1 | 0 |
| С8 | 0.847 | –0.011 | 0.872 | –0.024 | 0.896 | 0.004 |
| С4 | 0.803 | –0.011 | 0.866 | –0.041 | 0.913 | –0.040 |
Абсолютные времена удерживания 5CQA на трех стационарных фазах С18, С8 и С4 в элюенте, содержащем 10 об. % ацетонитрила и 1 об. % муравьиной кислоты в воде, почти совпадают. При этом в элюентах с меньшей элюирующей силой удерживание оказывается немного больше на фазе С18, уменьшаясь последовательно при переходе к фазам С8 и С4. В элюентах же с бóльшей элюирующей силой (в левой части) ситуация обратна указанной выше. Но по логарифмам факторов удерживания (из-за различия в мертвых объемах) при переходе от фазы С18 к С8 и далее к С4 удерживание всех трех изомеров несколько уменьшается (табл. 2). Общая тенденция – уменьшение наклонов линий трендов от фазы С18 к С4, но это уменьшение несопоставимо с изменениями для веществ, удерживающихся по механизму распределения [24]. Следовательно, большое число гидроксильных групп в структурах ХК препятствует их полному свободному проникновению вглубь привитой фазы, т.е. механизм удерживания ближе к гидрофобному выталкиванию на поверхность сорбента.
Анализ селективности разделения изомеров удобнее проводить по картам разделения [24] (рис. 1). Для построения таких карт в нескольких составах подвижных фаз определили факторы удерживания изомерных ХК и получили зависимости удерживания каждого из изомеров относительно одного, выбранного в качестве реперного соединения. В качестве реперного соединения выбрали 5CQA как наиболее часто встречающийся в природе изомер. Уравнения относительного удерживания имеют вид:
где i – исследуемый изомер (5СQA, 4QCA или 3CQA), х – тип обращенной фазы.Рис. 1.
Карта разделения хлорогеновых кислот на стационарных фазах марки Kromasil с подвижными фазами ацетонитрил–муравьиная кислота–вода. 1 – 3CQA, 2 – 5CQA, 3 – 4CQA. Стационарные фазы: (⚫) – С18, (◼) – С8, (▲) – С4.
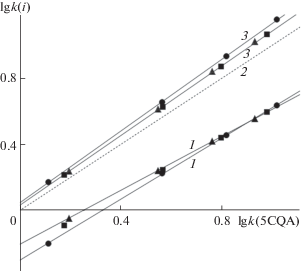
Анализируя карту разделения, можно утверждать, что для всех исследованных составов подвижных фаз системы вода–ацетонитрил–муравьиная кислота и всех использованных в работе стационарных фаз порядок элюирования ХК остается постоянным: tR(3CQA) < tR(5QCA) < < tR(4CQA). Хотя наклон линии тренда на карте разделения для 4CQA немного меньше, чем для 5CQA, обращение порядка элюирования этих двух веществ не может произойти за счет изменения состава подвижной фазы как для изократических, так и для градиентных режимов. При этом переход от фазы С18 к С4 (что соответствует бóльшей доступности полярных групп сорбента) приводит лишь к небольшому уменьшению степени разделения пары изомеров 4CQA и 5CQA.
Замена ацетонитрила на метанол может повлиять на селективность разделения изомерных ХК, поскольку при этом исключаются π-взаимодействия между сорбатами и подвижной фазой. Однако в нашем случае такая замена привела только к относительному уменьшению удерживания 3CQA при незначительных изменениях селективности разделения пары 4CQA и 5CQA не только для фазы С18 (табл. 2), но и для остальных фаз. Судя по корреляционным зависимостям удерживания по уравнению (1), механизм сорбции ХК также не изменяется при замене органического растворителя подвижной фазы.
Замена муравьиной кислоты в подвижной фазе на ортофосфорную также не приводит к заметным изменениям селективности разделения изомерных ХК. Таким образом, для изменения селективности разделения хлорогеновых кислот необходимо использовать стационарные обращенные фазы со специфическими свойствами.
На рис. 2 представлена карта разделения ХК на стационарных фазах Kromasil 100-5C18 (K2), Symmetry C18 (S18) и Reprosil-Pur C18-AQ (R18). Факторы удерживания ХК на стационарных фазах 2K18 и S18 близки по абсолютной величине при всех составах подвижной фазы ацетонитрил–уксусная кислота–вода; еще меньше различий наблюдали на линиях трендов относительного удерживания. Но для стационарной фазы R18 удерживание 4CQA и 3CQA заметно уменьшилось, затрудняя разделение пары изомеров 4CQA и 5CQA. Стационарная фаза R18 (по сведениям производителей) отличается устойчивостью к коллапсу за счет специфического гидрофильного эндкеппинга. Эта особенность фазы и привела к изменению селективности разделения изомерных ХК.
Рис. 2.
Карта разделения хлорогеновых кислот на стационарных фазах Kromasil 100-5С18 (⚫), Symmetry C18 (◼) и Reprosil-Pur C180AQ (▲) с подвижными фазами ацетонитрил–муравьиная кислота–вода. 1 – 3CQA, 2 – 5CQA, 3 – 4CQA.

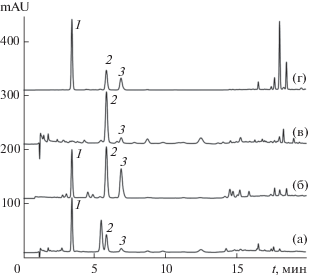
Предполагая, что именно свойства подложки, а не привитой фазы определяют селективность разделения ХК, изучено их разделение на двух стационарных фазах одного производителя, различие свойств которых может быть связано с изменением активности остаточных силанольных групп. Для этого использовали новую колонку, заполненную фазой Диасфер-110-С18 (2К18), и колонку с той же стационарной фазой после длительного использования, включая определение антоцианов при высокой концентрации муравьиной кислоты (10 об. %), которая способствует гидролизу привитых групп. И, действительно, степень разделения пары 4CQA и 5CQA заметно уменьшилась (рис. 3). Более того, на колонке Nucleosil RP-C18 после продолжительной эксплуатации обнаружено обращение порядка элюирования изомеров указанной пары (рис. 3).
Рис. 3.
Разделение хлорогеновых кислот с подвижной фазой, содержащей 10 об. % ацетонитрила и 1 об. % муравьиной кислоты, на стационарных фазах 1К18 (а), 2К18 (б) и N18 (в): 1 – 3CQA, 2 – 5CQA, 3 – 4CQA. Расход подвижной фазы 1 мл/мин (а) и (в), 0.8 мл/мин (б); длина волны детектора 325 нм.
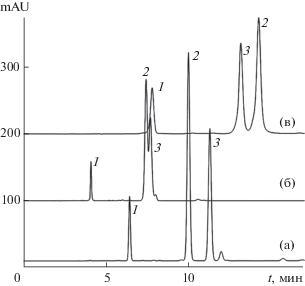
Повышенная активность остаточных силанольных групп стационарных фаз с измененной селективностью разделения 4CQA и 5CQA подтверждена тестом по ранее предложенной методике [26], в которой исследована корреляция между удерживанием п-толуидина (п-Т) относительно п-крезола (п-К) в элюентах, содержащих 20–40 об. % ацетонитрила в 0.001 М фосфатном буферном растворе с рН 7.
(3)
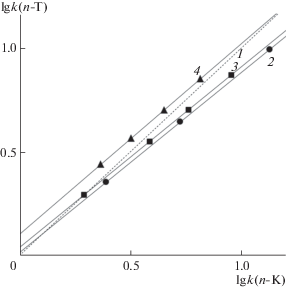
${\text{lg}}k\left( {n{\text{ - T}}} \right) = a{\text{lg}}k\left( {n{\text{ - K}}} \right) + b.$Для фазы N18 удерживание n-T превысило удерживание n-K; повышение активности силанольных групп фазы 2Д18 (по сравнению с новой фазой 1Д18) оказалось также весьма заметным (рис. 4).
Рис. 4.
Карта разделения п-толуидина относительно п-крезола: 1 – п-К, 2–4 – п-Т, 2 – точки для удерживания на колонке 1К18, 3 – на колонке 2К18, 4 – на колонке N18.
Экспериментально обнаруженное влияние силанольных групп на удерживание приповерхностной сорбции ХК можно объяснить состоянием привитого слоя при низком содержании органического модификатора в подвижной фазе. Поверхность силикагеля в этих условиях может быть покрыта хаотично прижатыми к ней октадецильными радикалами, что увеличивает доступность силанольных групп для сорбатов.
С использованием селективной для разделения изомерных ХК стационарной фазы К18 проанализировали несколько различных образцов, результаты представлены в табл. 3. Для надежного количественного определения ХК в растительных объектах использовали градиентный режим (рис. 5). Это необходимо для устранения влияния сольватохромного эффекта на электронные спектры веществ при использовании одного стандартного образца – 5CQA – вместо трех изомеров [13] в методе внешнего стандарта. Изомерные хлорогеновые кислоты разделяли на первом изократическом отрезке. На втором отрезке использовали быстрый градиент для удаления из колонки веществ с большим удерживанием. В исследованных образцах растворимого кофе обнаружили все три изомерные ХК, хотя и в различных соотношениях. Они же были найдены и в чае “Мате”, который по высокому содержанию ХК скорее напоминает кофе, а не чай, основными компонентами которого должны быть производные флаванолов [26]. В яблочном и вишневом соках детектируется 5CQA. Основной ХК в вишневом соке оказалась 3CQA, однако этой кислоты практически нет в яблочном соке; в последнем образце также обнаружена 4CQA в небольшом количестве.
Таблица 3.
Результаты определения хлорогеновых кислот в 8 объектах (n = 3)
| Объект анализа | Суммарное содержание, мг/г | Доля изомера, мол. % (±0.5) | ||
|---|---|---|---|---|
| 3CQA | 5CQA | 4CQA | ||
| Растворимый кофе “Кофейня на паях. Арабика” | 38.1 ± 0.4 | 26.4 | 42.8 | 30.9 |
| Растворимый кофе “Jardin” | 23.3 ± 0.7 | 27.8 | 38.3 | 34.0 |
| Растворимый кофе “Nescafe classic” | 18.7 ± 0.6 | 27.4 | 36.3 | 36.3 |
| Растворимый кофе “Jacobs Monarch” | 13.5 ± 0.4 | 27.5 | 36.8 | 35.7 |
| Смесь растворимого кофе с молотым “Egoiste” | 14.8 ± 0.6 | 29.4 | 37.0 | 33.6 |
| Чай “Mate” (Ilex paraguariensis) | 45 ± 1 | 57.3 | 24.4 | 18.3 |
| Яблочный сок | 0.019 ± 0.001 | 0 | 90.8 | 9.2 |
| Вишневый сок | 0.050 ± 0.001 | 59.0 | 31.7 | 9.3 |
* * *
Таким образом, основной фактор, влияющий на порядок элюирования и степень разделения изомерных ХК в условиях ОФ ВЭЖХ, – активность остаточных силанольных групп. При низкой активности силанольных групп порядок элюирования сохраняется неизменным: 3CQA < < 5CQA < 4CQA с полным (до базовой линии) разделением изомеров вне зависимости от состава водно-метанольных или водно-ацетонитрильных подвижных фаз, подкисленных муравьиной или ортофосфорной кислотами. Это обеспечивает надежное определение всех трех изомеров.
Список литературы
Lallemand L.A., Zubieta C., Lee S.G., Wang Y., Acajjaoui S., Timmins J., McSweeney S., Jez J.M., McCarthy J.G., McCarthy A.A. A structural basis for the biosynthesis of the major chlorogenic acids found in coffee // Plant Physiol. 2012. V. 160. P. 249.
Upadhyay R., Rao L.J.M. An outlook on chlorogenic acids − Occurrence, chemistry, technology, and biological activities // Crit. Rev. Food Sci. Nutr. 2013. V. 53. P. 968.
Bendary E., Francis R.R., Ali H.M.G., Sarwat M.I., El Hady S. Antioxidant and structure–activity relationships (SARs) of some phenolic and anilines compounds // Ann. Agric. Sci. 2013. V. 58. P. 173.
Marques V., Farah A. Chlorogenic acids and related compounds in medicinal plants and infusions // Food Chem. 2009. V. 113. P. 1370.
Дейнека В.И., Хлебников В.А., Сорокопудов В.Н., Анисимович И.П. Хлорогеновая кислота плодов и листьев некоторых растений семейства Berberidaceae // Химия растительного сырья. 2008. № 1. С. 57.
Kremr D., Bajer T., Bajerová P., Surmová S., Ventura K. Unremitting problems with chlorogenic acid nomenclature: a review // Quim. Nova. 2016. V. 39. P. 530.
Farah A., Donangelo C.M. Phenolic compounds in coffee // Braz. J. Plant Physiol. 2006. V. 18. P. 23.
C3878 Chlorogenic acid https://www.sigmaaldrich. com/catalog/product/aldrich/c3878?lang=en®ion =RU (15.03.2018)
Stalmach A., Mullen W., Nagai C., Crozier F. On-line HPLC analysis of the antioxidant activity of phenolic compounds in brewed, paper-filtered coffee // Braz. J. Plant Physiol. 2006. V. 18. P. 253.
Trugo L.C., Macrae R. Chlorogenic acid composition of instant coffees // Analyst. 1984. V. 109. P. 263.
Bennat C., Engelhardt U.H., Kiehne A., Wirries F.-M., Maier H.G. HPLC Analysis of chlorogenic acid lactones in roasted coffee // Z. Lebensm. Unters. Forsch. 1994. V. 199. P. 17.
Ky C.-L., Noirot M., Hamon S. Comparison of five purification methods for chlorogenic acids in green coffee beans (Cofea sp.) // J. Agric. Food Chem. 1997. V. 45. P. 786.
Kohno Y.-i., Fujita K. Analysis of chlorogenic acids and total phenols in coffee beans // Bunseki Kagaku. 2016. V. 65. P. 331.
Shan Y., Jin X., Cheng Y., Yan W. Simultaneous determination of chlorogenic acids in green coffee bean extracts with effective relative response factors // Int. J. Food Prop. 2017. V. 20. P. 2028.
Tfouni S.A.V., Carreiro L.B., Teles C.R.A., Furlani R.P.Z., Cipolli K.M.V.A., Camargo M.C.R. Caffeine and chlorogenic acids intake from coffee brew: Influence of roasting degree and brewing procedure // Int. J. Food Sci. Technol. 2014. V. 49. P. 747.
Craig A.P., Fields C., Liang N., Kitts D., Erickson A. Performance review of a fast HPLC-UV method for the quantification of chlorogenic acids in green coffee bean extracts // Talanta. 2016. V. 154. P. 481.
Jeon J.-S., Kim H.-T., Jeong I.-H., Hong S.-R., Oh M.-S., Park K.-H., Shim J.-H., AbdEl-Aty A.M. Determination of chlorogenic acids and caffeine in homemade brewed coffee prepared under various conditions // J. Chromatogr. B. Anal. Technol. Biomed. Life Sci. 2017. V. 1064. P. 115.
Schrader K., Kiehne A., Engelhardt U.H., Maier H.G. Determination of chlorogenic acids with lactones in roasted coffee // J. Sci. Food Agric. 1996. V. 71. P. 392.
Farah A., de Paulis T., Trugo L.C., Martin P.M. Effect of roasting on the formation of chlorogenic acid lactones in coffee // J. Agric. Food Chem. 2005. V. 53. P. 1505.
Yılmaz P.K., Kolak U. SPE-HPLC determination of chlorogenic and phenolic acids in coffee // J. Chromatogr. Sci. 2017. V. 55. P. 712.
Perrone D., Farah A., Donangelo C.M., de Paulis T., Martin P.R. Comprehensive analysis of major and minor chlorogenic acids and lactones in economically relevant Brazilian coffee cultivars // Food Chem. 2008. V. 106. P. 859.
Möller B., Herrmann K. Quinic acid esters of hydroxycinnamic acids in stone and pome fruits // Phytochemistry. 1983. V. 22. P. 477.
Clifford M.N., Johnston K.L., Knight S., Kuhnert N. Hierarchical scheme for LC-MSn identification of chlorogenic acids // J. Agric. Food Chem. 2003. V. 51. P. 2900.
Дейнека В.И. “Распределение или адсорбция” как основная дилемма ОФ ВЭЖХ // Журн. физ. химии. 2008. Т. 82. С. 1028. (Deineka V.I. Distribution or adsorption: the major dilemma in reversed-phase HPLC // Russ. J. Phys. Chem. A. Focus Chem. 2008. V. 82. P. 902.)
Дейнека В.И. Карта хроматографического разделения и инкрементные зависимости в методе относительного анализа удерживания в ВЭЖХ // Журн. физ. химии. 2006. Т. 80. № 3. С. 511. (Deineka V.I. Chromatographic separation map and incremental relationships in the method of relative analysis of retention under HPLC conditions // Russ. J. Phys. Chem. 2006. V. 80. P. 429.)
Дейнека В.И. Новый метод оценки влияния остаточных силанольных групп на суммарное удерживание в обращено-фазовой ВЭЖХ. // Журн. аналит. химии 2007. Т. 62. № 7. С. 740. (Deineka V.I. A new method for assessing the effect of residual silanol groups on total retention in reversed-phase HPLC // J. Analyt. Chem. 2007. V. 62. P. 665.)
Мареева Д.О., Цюпко Т.Г., Милевская В.В., Темердашев А.З. Определение галловой кислоты, катехина, эпикатехина и кофеина в экстрактах черного чая // Аналитика и контроль. 2015. Т. 19. С. 323.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии