Журнал аналитической химии, 2019, T. 74, № 9, стр. 691-702
Хромато-масс-спектрометрическая идентификация продуктов окисления алкилфенолов хлоридом железа(III)
И. Г. Зенкевич a, *, Т. И. Пушкарева a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 28.12.2017
После доработки 23.06.2018
Принята к публикации 06.11.2018
Аннотация
В результате анализа продуктов окисления алкилфенолов (орто-, мета, пара-крезолов и 4-изопропилфенола) хлоридом железа(III) в водных растворах методом ВЭЖХ с ионизацией электрораспылением и масс-спектрометрическим детектированием с регистрацией отрицательно заряженных ионов установлено, что основные продукты образуются путем нуклеофильного присоединения исходных алкилфенолов к промежуточно образующимся реакционноспособным интермедиатам – хинонметидам. Получающиеся аддукты способны к дальнейшему окислению, что в результате нескольких циклов окисления/присоединения приводит к появлению серий соединений с молекулярными массами, принадлежащими последовательностям значений 108, 214, 320, 426, 536, 638, … для крезолов и 136, 270, 404, 538, 672, … в случае 4-изопропилфенола. Отмечены аналогии таких процессов с окислением алкилфенолов кислородом воздуха в водных растворах и с их электрохимическим окислением, которое приводит к образованию димерных и олигомерных продуктов.
Взаимодействие фенолов (ArOH) с хлоридом железа(III) относят к наиболее известным в аналитической химии качественным реакциям на соединения этого класса [1, 2]. Так, при действии такого реагента водный раствор фенола приобретает интенсивную красно-фиолетовую окраску (λмакс = 558 нм) [3], исчезающую в кислой среде. Для замещенных фенолов возможны вариации окраски: красная, пурпурная, голубая или зеленая. По современным представлениям появление окраски связано с образованием комплексных ионов вида [Fe(OAr)6]3– [2]. Из соединений иных классов этому цветному тесту удовлетворяют оксимы, гидроксамовые кислоты, енолы и некоторые другие.
С другой стороны, в синтетической органической химии соли железа(III) (как правило, хлорид железа и гексацианоферрат калия) используют как реагенты для окисления фенолов. Такое окисление часто приводит к димерным продуктам [4–6], в том числе с образованием новых связей С–С [5]. Возможность окисления определяется достаточно высоким значением окислительно-восстановительного потенциала процесса Fe3+(водн) + е– → Fe2+(водн) + хН2О (+0.77 В). Основному продукту окисления п-крезола хлоридом железа(III) приписывают структуру 4,4а-дигидро-8,9b-диметилдибензофуран-3-она (I, кетон Пуммерера), а 2,6-ксиленола – 3,5,3',5'-тетраметилдифениленхинона (II) (схема 1):
Схема 1.
Для окисления не только фенолов, но и других органических соединений, применяют растворы FeCl3 в органических растворителях (например, в хлороформе [7]), комплексы с органическими лигандами (например, комплекс с диметилформамидом, ДМФА, [Fe(ДМФА)3Cl2]+[FeCl4]–) [8, 9], а также твердый хлорид железа [10]. Один из предложенных для таких процессов механизмов включает промежуточное образование катион-радикальных интермедиатов типа ArO+..
Обращает на себя внимание “неэквивалентность” описаний аналитических и препаративных аспектов действия хлорида железа(III) на фенолы. Однако они не противоречат друг другу: при непосредственном смешении растворов фенолов и FeCl3 действительно образуются окрашенные продукты, но спустя несколько часов растворы обесцвечиваются и из них выпадают бесцветные осадки продуктов окисления. Задачей настоящей работы является уточнение состава таких продуктов методом ВЭЖХ с масс-спектрометрическим детектированием (ВЭЖХ-МС) на примерах о-, м-, п-крезолов и 4-изопропилфенола, что представляет интерес для объяснения образования димерных продуктов окисления природных флавоноидов в водных растворах растворенным кислородом воздуха [11, 12], а также необычных электрохимических реакций фенолов [13].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. В работе использовали фенол х. ч. (Реахим, Москва), о-, м-, п-крезолы и 4-изопропилфенол (Merck, Дармштадт, Германия) с содержанием основного компонента 99%; ацетофенон, пропиофенон и бутирофенон (Merck, Дармштадт, Германия) с содержанием основного компонента 99%; FeCl3 · 6H2O х. ч. (ГОСТ 4147-74, Реахим, Москва); хлороформ х. ч. (Реахим, Москва), ацетонитрил сорт 1 (Криохром, Санкт-Петербург), муравьиную кислоту х. ч. (Merck, Дармштадт, Германия).
Приготовление водных растворов фенолов и их окисление хлоридом железа(III). Готовили водные растворы фенола (50 мкг/мл), о- , м- и п- крезолов (20 мкг/мл), 4-изопропилфенола (1 мг/мл) и хлорида железа(III) (60 мг/мл). К 2 мл раствора каждого из фенолов прибавляли раствор хлорида железа(III): 1.6 мл к раствору фенола, по 334 мкл к растворам крезолов и 20 мкл к раствору 4-изопропилфенола. Каждый из растворов приобретал характеристичную яркую окраску: растворы фенола и м-крезола – фиолетовую, о-крезола – зеленую, а п-крезола и 4-изопропилфенола – синюю. После выдерживания растворов при комнатной температуре в течение приблизительно двух суток их окраска исчезала, выпавшие осадки отделяли декантацией или фильтрованием, растворяли их в 1 мл хлороформа, разбавляли в 100 раз смесью вода–ацетонитрил–муравьиная кислота (50 : 50 : 0.1, по объему) и анализировали.
Для хроматографического анализа приготовленных образцов использовали хроматограф Agilent 1290 Infinity с масс-спектрометрическим детектором и колонкой (150 × 2.1 мм) Zorbax Eclipse XDB-C8 (размер частиц сорбента 3.5 мкм), защищенной предколонкой, заполненной таким же сорбентом. Расход элюента 200 мкл/мин. Объeм дозируемых проб 10 мкл. Температура термостата колонки 30°С. Использовали три режима градиентного элюирования: фаза А (вода–ацетонитрил–муравьиная кислота 99 : 1 : 0.1, по объему) и фаза В (вода–ацетонитрил–муравьиная кислота 10 : 90 : 0.1, по объему), рН элюента ~2–3 (табл. 1).
Таблица 1.
Условия градиентного элюирования
| Время, мин |
Содержание фазы В в элюенте, об. % | Время, мин |
Содержание фазы В в элюенте, об. % | |
|---|---|---|---|---|
| градиент 1 | градиент 2 | градиент 3 | ||
| 0 | 5 | 0 | 20 | 50 |
| 20 | 80 | 20 | 90 | 100 |
| 22 | 80 | 24 | 90 | 100 |
| 23 | 5 | 25 | 20 | 50 |
| 25 | 5 | 27 | 20 | 50 |
Для определения индексов удерживания (ИУ) продуктов окисления фенолов в идентичных условиях анализировали смесь трех реперных н‑алкилфенилкетонов C6H5COCnH2n+ 1 (n = 1–3); времена удерживания (tR) приведены в табл. 2. В качестве времени удерживания несорбируемого компонента (t0) принимали время удерживания тиомочевины. Для вычисления ИУ использовали программу QBasic и программное обеспечение Microsoft Excel (версия 2007 г.).
Таблица 2.
Времена удерживания (мин) реперных н-алкилфенилкетонов
| Вещество | Градиент | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Тиомочевина (t0) | 2.0 | 1.9 | 1.8 |
| Ацетофенон | 13.0 | 9.1 | 4.2 |
| Пропиофенон | 15.7 | 12.1 | 5.8 |
| Бутирофенон | 17.9 | 14.5 | 7.5 |
Условия масс-спектрометрического детектирования. В качестве детектора в ВЭЖХ использовали масс-спектрометр с ионной ловушкой Bruker amaZON ETD (Германия) с ионизацией электрораспылением в режиме детектирования отрицательных ионов. Напряжение на капилляре –4.5 кВ, газ-осушитель азот, температура 250°С, поток 9 л/мин. Диапазон сканируемых масс 70–1000 Да. Каждый спектр получен в результате усреднения пяти последовательных сканов. Детектирование проводили по полному ионному току (режим AutoMS).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
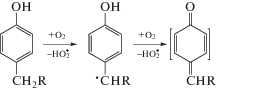
Общие закономерности окисления алкилфенолов и представление масс-спектрометрической информации. Специальное рассмотрение состава продуктов окисления 4-изопропилфенола в водных растворах растворенным кислородом воздуха при рН ≈ pKa, а также продуктов, образующихся в условиях его электрохимического окисления [13], предпринятое для объяснения закономерностей окисления природных флавоноидов [11, 12], показало, что основные продукты этой реакции согласуются с образованием таких интермедиатов, как хинонметиды (схема 2):
Схема 2.
Сами хинонметиды среди продуктов окисления не обнаружены из-за их высокой реакционной способности. Их важнейшим химическим свойством является сопряженное присоединение нуклеофильных реагентов (NuH) [14, 15], которое может протекать в положения 2-, 3- и 5-относительно карбонильной группы (схема 3):
Схема 3.
Нуклеофильное присоединение исходного 4‑изопропилфенола приводит к формально димерным продуктам окисления. В отсутствие других нуклеофильных реагентов могут получаться продукты присоединения воды. Присоединение хинонметидами нуклеофильных реагентов, аналогичное свойствам хинонов и хинониминов [16, 17], объясняет легкость образования так называемых “димерных” продуктов окисления природных флавоноидов даже в разбавленных водных растворах. Следует заметить, что аналогичные реакции (восстановление хинонов и хинониминов бисульфитом натрия) составляют основу химии фотографических процессов [18].
Оптимальным по чувствительности и селективности способом масс-спектрометрического детектирования соединений фенольной природы в методе ВЭЖХ-МС представляется электрораспылительная ионизация с регистрацией отрицательно заряженных ионов. Однако даже в таких условиях масс-спектры могут быть сильно искажены сигналами фона прибора и примесей в образцах. По этой причине в современной практике при их представлении (см., например, [12]) принято указывать не все регистрируемые сигналы, а ограничиваться лишь частью наиболее характеристичных из них. Для более детального рассмотрения мы использовали хроматограммы по полному ионному току в сочетании с масс-фрагментограммами по массовым числам ионов [M – 1] ожидаемых соединений, приведенные на рис. 1 для продуктов окисления п-крезола и на рис. 2 для продуктов окисления 4-изопропилфенола.
Рис. 1.
Хроматограммы продуктов окисления п-крезола по полному ионному току (а) и по выделенным ионам с массовыми числами m/z 213 (б), 319 (в), 425 (г), 531 (д) и 637 (е) в режиме элюирования № 3.
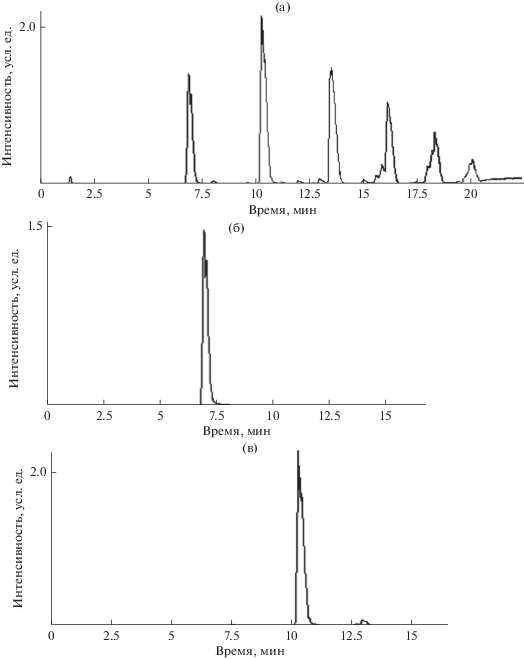

Рис. 2.
Хроматограммы продуктов окисления 4-изопропилфенола по полному ионному току (а) и по выделенным ионам с массовыми числами m/z 269 (б), 403 (в), 537 (г), 671 (д) и 419 (е) в режиме элюирования № 3.


В табл. 3 сопоставлены времена и ИУ главных продуктов окисления хлоридом железа(III) охарактеризованных алкилфенолов, детектируемых в различных режимах градиентного элюирования по приведенным значениями m/z ионов [M – H]–. Помимо указанных, в каждой из реакционных смесей обнаружено несколько минорных компонентов с такими же значениями m/z, относящихся, скорее всего, к изомерам. В качестве реперных компонентов при вычислении ИУ использовали три алкилфенилкетона с ИУ в диапазоне 800–1000, так что бóльшую часть ИУ (до 2000) продуктов вычисляли экстраполяцией. Точность такой операции по мере увеличения ИУ закономерно уменьшается, так что большие значения ИУ следует рассматривать как сугубо ориентировочные. Сравнение состава всех реакционных смесей показывает, что наибольшие количества продуктов окисления, детектируемых в режиме электрораспылительной ионизации по массовым числам ионов [M – H]–, наблюдаются для пара-замещенных алкилфенолов, что согласуется с концепцией промежуточного образования хинонметидов.
Таблица 3.
Времена и индексы удерживания главных продуктов окисления алкилфенолов хлоридом железа(III) в различных режимах элюирования
| m/z | Градиент 1 | Градиент 2 | Градиент 3 | RI ± sRI | |||
|---|---|---|---|---|---|---|---|
| tR, мин | RI | tR, мин | RI | tR, мин | RI | ||
| о-Крезол | 775 ± 17* | ||||||
| 213 | 18.5** | 1029** | 15.2** | 1031** | 7.6** | 1006** | 1022 ± 14** |
| 319 | 18.6 | 1034 | 15.2 | 1031 | 7.6 | 1006 | 1024 ± 15 |
| 19.3 | 1070 | 16.0 | 1068 | 8.5 | 1057 | 1065 ± 11 | |
| 21.0 | 1160 | 17.8 | 1155 | 10.7 | 1181 | 1065 ± 21 | |
| 18.3 | 1179 | 11.2 | 1209 | 1194 ± 21 | |||
| 23.0 | 1273 | 19.9 | 1260 | 13.3 | 1324 | 1286 ± 34 | |
| 425 | 19.8 | 1095 | 16.6 | 1097 | 9.2 | 1097 | 1096 ± 1 |
| 20.3 | 1123 | 17.0 | 1116 | 9.7 | 1125 | 1121 ± 5 | |
| 21.5 | 1188 | 18.3 | 1179 | 11.5 | 1225 | 1197 ± 24 | |
| 22.2 | 1227 | 19.0 | 1214 | 12.4 | 1275 | 1239 ± 32 | |
| 21.1 | 1322 | 13.7 | 1346 | 1334 ± 17 | |||
| 23.5 | 1450 | 15.0 | 1417 | 1434 ± 23 | |||
| 531 | 20.9 | 1155 | 17.8 | 1155 | 10.7 | 1181 | 1164 ± 15 |
| 21.3 | 1177 | 18.1 | 1170 | 11.3 | 1214 | 1187 ± 24 | |
| 22.3 | 1233 | 19.3 | 1230 | 12.6 | 1286 | 1250 ± 32 | |
| 22.7 | 1256 | 19.7 | 1250 | 13.2 | 1319 | 1275 ± 38 | |
| 22.4 | 1391 | 17.0 | 1526 | 1526*** | |||
| 637 | 14.0 | 1363 | 1363 | ||||
| м-Крезол | 760 ± 15 | ||||||
| 213 | 16.4 | 930 | 12.8 | 928 | 5.5 | 882 | 913 ± 27 |
| 17.8 | 995 | 14.4 | 996 | 7.0 | 971 | 987 ± 14 | |
| 319 | 13.0 | 936 | 5.3 | 870 | 870 | ||
| 17.3 | 971 | 13.8 | 970 | 6.0 | 912 | 951 ± 34 | |
| 18.5 | 1029 | 15.0 | 1022 | 7.4 | 994 | 1015 ± 18 | |
| 19.3 | 1070 | 15.9 | 1064 | 8.3 | 1046 | 1060 ± 12 | |
| 19.9 | 1101 | 16.5 | 1092 | 9.3 | 1102 | 1098 ± 6 | |
| 20.7 | 1144 | 17.5 | 1140 | 10.3 | 1159 | 1148 ± 10 | |
| 425 | 19.0 | 1055 | 15.7 | 1054 | 8.2 | 1040 | 1050 ± 8 |
| 21.5 | 1188 | 18.3 | 1179 | 11.3 | 1214 | 1194 ± 18 | |
| п-Крезол | 760 ± 23 | ||||||
| 213 | 17.9 | 1000 | 14.5 | 1000 | 7.0 | 971 | 990 ± 17 |
| 319 | 20.8 | 1150 | 17.5 | 1140 | 10.4 | 1164 | 1151 ± 12 |
| 22.7 | 1256 | 19.6 | 1245 | 13.0 | 1308 | 1270 ± 34 | |
| 425 | 22.0 | 1216 | 18.9 | 1209 | 1212 ± 5 | ||
| 23.3 | 1291 | 20.0 | 1265 | 13.2 | 1319 | 1292 ± 27 | |
| 15.9 | 1466 | 1466 | |||||
| 531 | 22.8 | 1262 | 22.0 | 1370 | 16.2 | 1482 | 1482 |
| 23.6 | 1308 | 23.5 | 1450 | 18.3 | 1596 | 1596 | |
| 637 | 23.6 | 1456 | 18.3 | 1596 | 1596 | ||
| 25.8 | 1576 | 20.0 | 1687 | 1687 | |||
| 4-Изопропилфенол | 973 ± 14 | ||||||
| 269 | 19.5 | 1240 | 12.1 | 1258 | 1249 ± 13 | ||
| 403 | 23.7 | 1461 | 17.9 | 1574 | 1574 | ||
| 20.3 | 1703 | 1703 | |||||
| 537 | 22.0 | 1794 | 1794 | ||||
| 24.0 | 1901 | 1901 | |||||
| 671 | 25.9 | 2003 | 2003 | ||||
| 419 | 17.7 | 1150 | 10.1 | 1147 | 1148 ± 2 | ||
| 18.3 | 1179 | 10.7 | 1181 | 1180 ± 1 | |||
| 553 | 21.8 | 1359 | 15.7 | 1455 | 1455 | ||
| 22.5 | 1397 | 16.5 | 1498 | 1498 | |||
* Для исходных фенолов приведены статистически обработанные справочные значения индексов удерживания [20, 21]. ** Жирным шрифтом здесь и далее выделены значения для основных компонентов реакционных смесей. *** Если стандартные отклонения средних значений ИУ в разных режимах разделения превышают 40, то вместо средних величин указаны только значения ИУ в режиме № 3.
Идентификация продуктов окисления п-крезола хлоридом железа(III). На хроматограмме по полному ионному току (рис. 1а) в условиях наиболее “жесткого” градиентного элюирования (режим № 3, табл. 1) регистрируются шесть основных пиков с временами удерживания 7.0, 10.4 (максимальный), 13.2, 16.2, 18.3 и 20.0 мин. Первое предположение о химической природе этих продуктов можно сделать в результате использования такого математического (хемометрического) приема, как рассмотрение первых и вторых конечных разностей [19] их времен удерживания:
| tR, мин | 7.0 | 10.4 | 13.2 | 16.2 | 18.3 | 20.0 |
| Первые разности | 3.4 | 3.2 | 3.0 | 2.9 | 2.7 | |
| Вторые разности | –0.2 | –0.2 | –0.1 | –0.2 |
Математический смысл постоянства вторых разностей состоит в том, что рассматриваемый набор значений tR может быть аппроксимирован полиномом второй степени [19]. Однако этому факту можно придать и химический смысл, а именно: все регистрируемые продукты относятся к соединениям одинаковой химической природы, например, к структурным аналогам. С учетом результатов окисления 4-изопропилфенола в иных условиях [13] и литературных данных среди продуктов окисления фенолов хлоридом железа(III) можно было ожидать присутствия аналогов кетона Пуммерера либо продуктов превращения хинонметидов. Молекулярные массы этих изомерных соединений равны 2M – 2, где М – молекулярная масса исходного фенола. Заметим, что уже по этому критерию можно исключить образование аналогов дифениленхинона с массами 2M – 4, так как они соответствуют бóльшей степени окисления исходных фенолов.
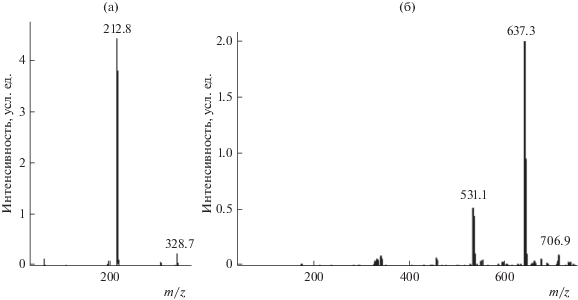
Таким образом, если молекулярная масса первичного “димерного” продукта окисления п-крезола равна 108 – 2 + 108 = 214, то он должен регистрироваться на масс-фрагментограмме по массовому числу иона [M – H]– c m/z 213, что иллюстрирует рис. 1б. Фрагмент масс-спектра этого компонента приведен на рис. 3а. В нем присутствует достаточно интенсивный сигнал молекулярных ионов с m/z 214 и максимальный сигнал ионов [M – H]– c m/z 212.8 ≈ 213. Такое сочетание сигналов типично для сопряженных ароматических соединений. Однако, учитывая низкую структурную специфичность масс-спектров отрицательных ионов, полученных в условиях ионизации электрораспылением, на этом этапе рассмотрения результатов невозможно отдать предпочтение ни структурам типа I, ни аддуктам хинонметидов (схема 3).
Рис. 3.
Фрагменты масс-спектров продуктов окисления п-крезола в режиме разделения № 3 с временами удерживания 7.0 мин (а) и 18.3 мин (б): (а) – димер с молекулярной массо1 214, (б) – гексамер с молекулярной массой 638.
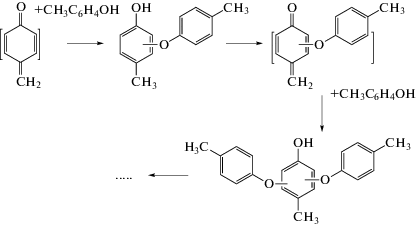
Для кетона I трудно предположить какие-либо приемлемые направления его дальнейших превращений, так как он не содержит активных атомов водорода, в отличие от аддуктов исходного п‑крезола и промежуточно образующихся хинонметидов. Такие аддукты сохраняют способность к последующему окислению с образованием более сложных хинонметидных интермедиатов, которые снова могут присоединять исходные алкилфенолы. В случае п-крезола это позволяет объяснить образование как более гидрофобного продукта с временем удерживания 10.4 мин, так и всех остальных компонентов в результате последовательных циклов окисление/присоединение исходного п-крезола (схема 4):
Схема 4.
В результате молекулярные массы серии олигомерных продуктов взаимодействия п-крезола с FeCl3 оказываются равными 108 – 2 + 108 = 214 (димер, детектируемый по массовому числу ионов [M – H]– c m/z 213, рис. 1б); 214 – 2 + 108 = 320 (тример, m/z 319, рис. 1в); 320 – 2 + 108 = 426 (тетрамер, m/z 425, рис. 1г); 426 – 2 + 108 = 532 (пентамер, m/z 531, рис. 1д) и 532 – 2 + 108 = 638 (гексамер, m/z 637, рис. 1е). Фрагмент масс-спектра гексамера с молекулярной массой 638, приведенный на рис. 3б, аналогичен спектру димера (рис. 3а) с тем лишь отличием, что в нем присутствует заметный сигнал ионов [M – 107] = [M – CH3C6H4O]– с m/z 531, совпадающий по положению с ионами [M – H]– предыдущего олигомера (пентамера). Аналогичные сигналы регистрируются на всех масс-фрагментограммах (рис. 1б–1е), причем их интенсивность увеличивается при переходе к каждому последующему продукту окисления. Тем не менее, масс-спектрометрические данные не позволяют однозначно провести структурно-химическое отнесение таких сигналов изомеров с бóльшими временами удерживания. Во-первых, они могут принадлежать ионам [M – 107] = = [M – CH3C6H4O]– олигомеров с бóльшими молекулярными массами, однако в этом случае положения их максимумов должны точно совпадать с временами удерживания таких олигомеров. Во-вторых, они могут относиться к изомерам, образующимся в меньших количествах. Если полагать, что основной компонент соответствует присоединению нуклеофильного реагента в положение 3 относительно карбонильной группы, то изомер с большим временем удерживания может отвечать более гидрофобному (за счет образования внутримолекулярной водородной связи) продукту присоединения в положение 2 (схема 3). В случае п-крезола значения фактора гидрофобности (lg P) составляют для 4-метил-3-(4-метилфенокси)фенола и 4-метил-2-(4-метилфенокси)фенола 5.94 ± 0.33 и 6.33 ± 0.32 соответственно (расчетные значения получены с использованием программного обеспечения ACD). Наиболее гидрофильным из возможных продуктов присоединения п-крезола к хинонметиду является 4-[(4-метилфенил)метил]фенол (lgP = 5.09 ± 0.25), и если основной сигнал принадлежит этому изомеру, то минорный может относиться к какому-либо из двух других.
Во всех этих случаях положения максимумов таких пиков на разных хроматограммах не должны совпадать. Наблюдаемые незначительные отличия времен удерживания не позволяют однозначно говорить о присутствии в реакционной смеси продуктов каждого типа. Более того, на рис. 1б–1г отчетливо наблюдается перекрывание нескольких сигналов, что допускает оба варианта интерпретации результатов.
За гексамером с временем удерживания 18.3 мин на хроматограмме (рис. 1а) регистрируется сигнал еще одного компонента с tR = 20.0 мин, фрагмент масс-спектра которого представлен на рис. 4а. Судя по времени удерживания, он должен принадлежать гептамеру с молекулярной массой 744, а не 638, что подтверждается отсутствием в нем сигналов с m/z 638 – 107 = 531. Другим отличием его масс-спектра (рис. 4а) от масс-спектров предыдущих олигомеров является незначительная интенсивность пиков молекулярных ионов (неотличимы от фоновых сигналов). Можно предположить, что он принадлежит соединению с вероятной структурой, изображенной на рис. 4в, для которой фрагментация с образованием ионов [M – 107] = = [M – CH3C6H4O]– с m/z 637 становится преобладающей.
Рис. 4.
Фрагмент масс-спектра продукта окисления п-крезола в режиме разделения № 3 с временем удерживания 20.0 мин (соответствует гептамеру с молекулярной массой 744) (а) и наиболее вероятные структуры гексамера с М = 638 (б) (масс-спектр приведен на рис. 3б) и гептамера с М = 744 (в).
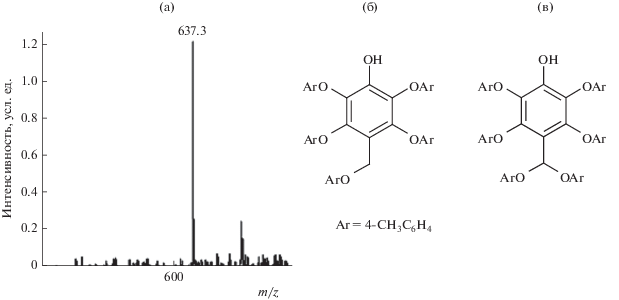
Помимо олигомерных продуктов, молекулярные массы которых в случае крезолов принадлежат последовательности 108, 214, 320, 426, 536, 638, …, в реакционных смесях обнаруживаются несколько продуктов с другими массовыми числами. Так, один из продуктов окисления п-крезола (М = 442) образуется в результате окисления тетрамера с последующим присоединением воды: 426 – 2 + 18 = 442.
Индексы удерживания являются более информативной характеристикой аналитов чем их времена удерживания [20, 21]. В нашем случае точность ИУ ограничена использованием всего трех реперных компонентов (ацето-, пропио- и бутирофеноны), что для гидрофобных аналитов приводит к необходимости вычисления индексов путем экстраполяции в область больших значений времен удерживания. Тем не менее, значения ИУ (RI) продуктов с М = 214, 320 и 426, разности которых составляют ∼164 ± 25, характеризуются неплохой аддитивностью и только для двух последних наблюдаются заметные отклонения, обусловленные как “удаленной” экстраполяцией ИУ, так и, возможно, их соответствием присоединению арильных фрагментов не в бензольное кольцо, а в α-положение к нему (рис. 4б и 4в):
Особенности состава продуктов окисления 4‑изопропилфенола хлоридом железа(III). Последовательность циклов окисление/присоединение исходного 4-изопропилфенола, аналогичная изображенной на схеме 4, приводит к образованию продуктов с молекулярными массами 136 – 2 + 136 = = 270 (димер, детектируемый по массовому числу ионов [M – H]– c m/z 269, рис. 2б), 270 – 2 + 136 = = 404 (тример, m/z 403, рис. 2в), 404 – 2 + 136 = = 538 (тетрамер, m/z 537, рис. 2г) и 538 – 2 + 136 = = 672 (пентамер, m/z 671, рис. 2д), принадлежащих последовательности 136, 270, 404, 538, 672, … . Помимо этого среди минорных продуктов окисления обнаружены соединения с молекулярными массами 286 (детектируется по массовому числу ионов [M – H]– c m/z 285), 420 (по массовому числу ионов [M – H]– c m/z 419, рис. 2е), а также 420 – 2 + 136 = 554 (m/z 553). Они представляют собой продукты присоединения воды к димеру (270 – 2 + 18 = 286), тримеру (3 × 134 + 18 = 420) и тетрамеру (4 × 134 + 18 = 554) соответственно. Такой состав соответствует наборам продуктов окисления 4-изопропилфенола в водных растворах как растворенным кислородом воздуха при рН ≈ рКа, так и в условиях его электрохимического окисления [13].
Как отмечено при рассмотрении продуктов окисления п-крезола, основной причиной неопределенности состава является сложность структурного отнесения минорных сигналов на масс-фрагментограммах. Замена метильной группы в п-крезоле изопропильным фрагментом позволила установить, что по крайней мере для рассматриваемого 4-изопропилфенола речь идет не о сигналах [M – 135] = [M – C3H7C6H4O]– более сложных олигомеров, а о сигналах разных изомеров. Действительно, на фрагментограмме тримера регистрируется сигнал с tR = 20.3 мин, тогда как основной компонент тетрамера имеет время удерживания 22.0 мин. Аналогично примесь в тетрамере имеет tR = 24.0 мин, а для пентамера tR = 25.9 мин. Таким образом, можно утверждать, что при окислении алкилфенолов FeCl3 каждая группа продуктов превращения хинонметидов содержит несколько изомеров.
Закономерности формирования состава продуктов окисления о- и м-крезолов аналогичны рассмотренным на примерах п-крезола и 4-изопропилфенола.
* * *
Таким образом, на основании результатов идентификации продуктов окисления алкилфенолов хлоридом железа(III) можно утверждать, что их состав аналогичен составу продуктов окисления алкилфенолов кислородом воздуха в водных растворах и их электрохимического окисления. Основные из них соответствуют присоединению исходных фенолов к промежуточно образующимся реакционноспособным интермедиатам – хинонметидам.
Авторы благодарят руководство ФГУП “НИИ ГПЭЧ” ФМБА России (Санкт-Петербург) за возможность использования оборудования при выполнении настоящей работы.
Список литературы
Химическая энциклопедия / Под ред. Зефирова Н.С. Т. 5. М.: Большая Российская энциклопедия, 1998. С. 71.
Gilbert J.C., Martin S.F. Experimental Organic Chemistry. A Miniscale and Microscale Approach. 5th ed. Boston: Cengage Learning, 2011. 966 p.
Wesp E.F., Brode W.R. The absorption spectra of ferric compounds. I. The ferric chloride – phenol reaction // J. Am. Chem. Soc. 1934. V. 56. № 5. P. 1037.
Trahanovski W. Oxidation in Organic Chemistry. Amsterdam: Elsevier, 2012. 262 p.
Sarham A.A.O., Bolm C. Iron(III) chloride in oxidative C–C coupling reactions // Chem. Soc. Rev. 2009. V. 38. № 9. P. 2730.
The Chemistry of Phenols / Ed. Rappoport Z. Chichester: J. Wiley & Sons, 2003. 1506 p.
Soloway S., Wilen S.H. Improved ferric chloride test for phenols // Anal. Chem. 1951. V. 24. № 6. P. 979.
Tobinaga S. A review: synthesis of alkaloids by oxidative phenol and nonphenol coupling // Bioorg. Chem. 1975. V. 4. P. 110.
Tobinaga S., Kotani E. Intramolecular and intermolecular oxidative coupling reactions by a new iron complex [Fe(DMF)3Cl2][FeCl4] // J. Am. Chem. Soc. 1972. V. 94. P. 309.
Toda F., Tanaka K., Iwata S. Oxidative coupling reactions of phenols with iron(III) chloride in the solid state // J. Org. Chem. 1989. V. 54. P. 3007.
Zenkevich I.G., Eschenko A.Yu., Makarova S.V., Vitenberg A.G., Dobryakov Yu.G., Utsal V.A. Identification of the products of oxidation of quercetin by air oxygen at ambient temperature // Molecules. 2007. V. 12. № 3. P. 654.
Зенкевич И.Г., Пушкарева Т.И. Систематизация результатов хромато-масс-спектрометрической идентификации продуктов окисления кверцетина кислородом воздуха в водных растворах // Журн. аналит. химии. 2017. Т. 72. № 10. С. 890. (Zenkevich I.G., Pushkareva T.I. Systematization of the results of the chromatography-mass spectrometry identification of the products of quercetin oxidation by atmospheric oxygen in aqueous solutions// J. Analyt. Chem. 2017. V. 72. № 10. P. 1062.)
Зенкевич И.Г., Пушкарева Т.И. Хромато-масс-спектрометрическая идентификация необычных продуктов окисления 4-изопропилфенола в водных растворах // Журн. общей химии. 2018. Т. 87. № 1. С. 9. (Zenkevich I.G., Pushkareva T.I. Chromato-mass-spectral identification of unusual products of 4‑isopropylphenol oxidation in aqueous solutions // Russ. J. General Chem. 2018. V. 87. № 1. P. 7.)
Шевченко С.М., Апушкинский А.Г. Хинонметиды в химии древесины // Успехи химии. 1992. Т. 61. № 1. С. 195. (Shevchenko S.M., Apushkinskii A.G. Quinone methides in the chemistry of wood // Russ. Chem. Rev. 1992. V. 61. № 1. P. 105.)
Freccero M. Quinone methides as alkylating and cross-linking agents // Mini-Rev. Org. Chem. 2004. V. 1. № 4. P. 403.
Katritzky A.R., Fedoseenko D., Mohapatra P.P., Steel P.J. Reactions of p-benzoquinone with sulfur nucleophyles // Syntheses. 2008. № 5. P. 777.
Gulaborski R., Bogeski I., Mirceski V., Saul S., Pasieka B., Haeri H.H., Stefova M., Stanoeva J.P., Mitrev S., Hoth M., Kappl R. Hydroxilated derivatives of dimethoxy-1,4-benzoquinone as redox switchable earth-alkaline metal ligands and radical scavengers // Sci. Rep. 2013. V. 3. Art. № 1865.
Яштолд-Говорко В.А. Фотосъемка и обработка. М.: Искусство, 1964. 444 с.
Демидович Б.П., Марон И.А., Шувалова Э.З. Численные методы анализа. М.: Наука, 1967. 368 с.
Зенкевич И.Г., Кочетова М.В., Ларионов О.Г., Ревина А.А. Индексы удерживания как наиболее воспроизводимые хроматографические параметры для характеристики фенольных соединений в обращено-фазовой ВЭЖХ // Журн. аналит. химии. 2005. Т. 60. № 7. С. 734. (Zenkevich I.G., Kochetova M.V., Larionov O.G., Revina A.A. Retention indices as the best reproducible chromatographic parameters for the characterization of phenolic compounds in reversed-phase high performance liquid chromatography // J. Analyt. Chem. 2005. V. 60. № 7. P. 655.)
Zenkevich I.G., Kochetova M.V., Larionov O.G., Revina A.A., Kosman V.M. Retention indices as the most reproducible retention parameters in reversed phase HPLC. Calculation for hydrophylic phenolic compounds using reference n-alkyl phenyl ketones // J. Liq. Chromatogr. Rel. Technol. 2005. V. 28. P. 2141.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии