Журнал аналитической химии, 2020, T. 75, № 11, стр. 1021-1029
Управление селективностью разделения и определение антоцианов плодов растений семейства Vaccinium с применением элюентов состава ацетонитрил–муравьиная кислота–вода
В. И. Дейнека a, *, Е. Ю. Олейниц a, Я. Ю. Кульченко a, И. П. Блинова a, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет
Институт фармации, химии и биологии
308015 Белгород, ул. Победы, 85, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 03.02.2020
После доработки 02.03.2020
Принята к публикации 20.03.2020
Аннотация
Показано, что управлять селективностью разделения 15 антоцианов из экстракта плодов черники (3-галактозидов, 3-глюкозидов и 3-арабинозидов пяти основных антоцианидинов – цианидина, пеонидина, дельфинидина, петунидина и мальвидина) с применением элюентов, содержащих ацетонитрил и 10 об. % НСООН в воде, можно за счет варьирования концентрации ацетонитрила и температуры разделения. Предложен градиентный режим при температуре разделения 25°С для быстрого разделения всех компонентов без введения метанола в подвижную фазу. Разработанный метод применен для определения антоцианов в ряде коммерческих продуктов переработки плодов растений семейства Vaccinium: черники, голубики, клюквы и брусники. Предложен хроматографический вариант исключения абсорбции полимерных антоцианов при определении мономерных соединений в сложных смесях, альтернативный дифференциальному спектрофотометрическому методу.
В настоящее время препараты на основе антоцианов плодов черники предлагаются в аптеках для лечения и профилактики офтальмологических заболеваний [1]. Хотя эффективность применения плодов черники и препаратов на ее основе в данном случае научно не подтверждена [2], задача установления качества и подлинности препаратов на основе черники актуальна [3–5]. Кроме того, на рынке часто встречаются также продукты переработки плодов трех других растений этого же семейства (Vacciniaceae) – голубики, клюквы и брусники, что расширяет сферу объектов исследования.
Контроль антоцианового состава черники (как и голубики) осложнен многокомпонентностью [3]: в плодах синтезируются по три моногликозида: 3-галактозиды (3Gala), 3-глюкозиды (3Glu) и 3-арабинозиды (3Ara) пяти агликонов (антоцианидинов): трех основ дельфинидинового ряда – дельфинидина (Dp), петунидина (Pt) и мальвидина (Mv) и двух производных цианидинового ряда – цианидина (Cy) и пеонидина (Pn) (схема 1 ).
Удерживание (tR) однотипных гликозидов (3Gly) производных этих антоцианидинов существенно различается, возрастая в ряду:
(1)
$\begin{gathered} {{t}_{{\text{R}}}}\left( {{\text{Dp3Gly}}} \right) < {{t}_{{\text{R}}}}\left( {{\text{Cy3Gly}}} \right) < {{t}_{{\text{R}}}}\left( {{\text{Pt3Gly}}} \right) < \\ < {{t}_{{\text{R}}}}\left( {{\text{Pn3Gly}}} \right) < {{t}_{{\text{R}}}}\left( {{\text{Mv3Gly}}} \right). \\ \end{gathered} $При этом разделения всех 15 компонентов добиться не просто. Так в большинстве опубликованных работ удерживание некоторых компонентов совпадает. Условия, при которых достигнуто разделение всех 15 компонентов [4–12], представлены в табл. 1.
Таблица 1.
Условия ВЭЖХ-определения антоцианов черники при полном разделении 15 компонентов
| № | Объекты анализа | Основная хроматографическая колонка | Подвижная фаза | Литература |
|---|---|---|---|---|
| 1 | Пищевая добавка на основе черники | 250 × 2 мм Synergi Hydro-RP 80 Å, 4 мкм | Градиентный режим. Фаза A: CH3COOH–CF3COOH–CH3CN–вода (10.0 : 0.2 : 5.0 : 84.8, по объему), фаза Б: CH3CN; 25°C | [4] |
| 2 | Экстракты черники | 250 × 4.6 мм Zorbax Extend C-18, 5 мкм | Градиентный режим. Фаза A: 8.5% HCOOH в воде; фаза Б: HCOOH–CH3CN–CH3OH–H2O (8.5 : 22.5 : 22.5 : 41.5, по объему); 30°C | [5] |
| 3 | Соки черники и черной смородины | 250 × 4.6 мм LiChroCart Purospher Star RP-18e, 5 мкм | Градиентный режим. Фаза A: 10% HCOOH в воде, фаза Б: CH3CN−CH3OH (85 : 15, по объему) | [6] |
| 4 | Черника | 150 × 4.6 мм Phenomenex Gemini C-18, 5 мкм | Градиентный режим. Фаза A: CH3CN−CH3OH (85 : 15, по объему), фаза Б: 8.5% HCOOH в воде | [7] |
| 5 | Экстракты некоторых ягод | 150 × 4.6 мм, Acclaim1 120 C-18, 5 мкм | Градиентный режим. Фаза A: 20% CH3OH с 0.5% CF3COOH; фаза Б: CH3OH; 40°C | [8] |
| 6 | Черника | 150 × 4.6 мм, Develosil ODS-HG, 5 мкм | Изократический режим: водный раствор с 20% CH3OH и с 0.5% CF3COOH; 40°C | [9] |
| 7 | Сухой экстракт черники | 250 × 4.6 мм Zorbax Extend C-18, 5 мкм | Градиентный режим. Фаза A: 10.0% HCOOH в воде, фаза Б: CH3OH–CH3CN–HCOOH–H2O (22.5 : 22.5 : 10 : 40, по объему); 30°C | [10] |
| 8 | Черника, голубика и их соки | 250 × 4.60 мм Luna 3 мкм C18(2) 100 Å | Градиентный режим. Фаза A: 87% CH3CN, 3% вода, 10% HCOOH (по объему); фаза Б: 50% CH3CN, 40% вода, 10% HCOOH (по объему) | [11] |
| 9 | Препараты на основе черники | 150 × 4.6 мм, Диасфер 110-С18, 3.5 мкм | Градиентный режим. Фаза A: HCOOH–H2O, 8.5 : 91.5 (по объему), фаза Б: HCOOH–CH3OH–CH3CN–H2O, (8.5 : 22.5 : 22.5 : 41.5, по объему); 35°С | [12] |
Схема 1 . Упрощенная схема биосинтеза гликозидов пяти основных антоцианидинов.
Соединения на схеме: 3-гликозиды I –цианидина (Cy), II –пеонидина (Pn), III –дельфинидина (Dp), IV –петунидина (Pt), V –мальвидина (Mv); MT – фермент метилтрансфераза.
При переходе от черники к клюкве разделение антоцианов упрощается, поскольку в плодах не происходит биосинтез производных дельфинидинового ряда. Наиболее простой оказывается задача определения подлинности продуктов переработки брусники, в которой обнаружены только производные цианидина [13].
В большинстве работ по разделению различных соединений (в том числе и антоцианов) влияние компонентов подвижных фаз или свойств стационарной фазы на удерживание не рассматривается. Это создает неудобства при практическом использовании метода, поскольку смена торговой марки октадецилсилановых сорбентов, замена старой колонки на новую того же производителя или смена партий компонентов растворителей может сказаться (и сказывается) на эффективности разделения.
Цель настоящей работы – управление селективностью разделения сорбатов для контроля состава антоцианов плодов черники и других родственных растений с использованием обращенно-фазовой ВЭЖХ и системы ацетонитрил–муравьиная кислота–вода в качестве подвижной фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали: чернику быстрозамороженную “4 сезона” (Россия), чернику быстрозамороженную “Вологодская ягода” (Россия) и чернику быстрозамороженную (Китай).
Антоцианы экстрагировали из растительного материала настаиванием в 0.1 М водной HCl до исчерпывающей экстракции. Порции экстрактов объединяли и после фильтрования концентрацию антоцианов определяли дифференциальным спектрофотометрическим методом [14]. Для ВЭ-ЖХ-определения видового состава антоцианов экстракты очищали твердофазной экстракцией на концентрирующих патронах ДИАПАК С18.
Хроматографическое поведение антоцианов исследовали в изократических и градиентных режимах с использованием хроматографической системы Agilent 1260 Infinity с диодно-матричным и масс-спектрометрическим детекторами на хроматографической колонке: (150 × 4.6 мм) Symmetry C18 (3.5 мкм). Масс-спектры регистрировали в режиме ионизации электрораспылением при сканировании положительно заряженных ионов. Подвижные фазы готовили смешиванием 10 об. % НСООН, заданного объема СН3CN и дистиллированной воды. В работе предложены градиентные режимы при температуре термостата колонок 40°С и при расходе подвижной фазы 0.8 мл/мин.
Градиент 1 (Г1): элюент А: 0 об. % СН3CN и 10 об. % НСООН в воде; элюент Б: 30 об. % СН3CN и 10 об. % НСООН в воде. Режим: 0 мин – 0% Б; 50 мин – 50% Б; 51 мин – 0% Б; рекондиционирование колонки – 10 мин.
Градиент 2 (Г2): элюент А: 0 об. % СН3CN и 10 об. % НСООН в воде; элюент Б: 20 об. % СН3CN и 10 об. % НСООН в воде. Режим: 0 мин – 20% Б; 10 мин – 40% Б; 35 мин – 100% Б; 36 мин – 20% Б, рекондиционирование колонки – 10 мин. Отметим, что рекондиционирование колонки необходимо для уравновешивания стационарной фазы со стартовой подвижной фазой градиентных режимов; только в этом случае пики аналитов совпадают при наложении хроматограмм.
Градиент 3 (Г3) при температуре термостата колонок 25°С при расходе подвижной фазы 0.8 мл/мин: элюент А: 6 об. % СН3CN и 10 об. % НСООН в воде; элюент Б: 30 об. % СН3CN и 10 об. % НСООН в воде. Режим: 0 мин – 0% Б; 10 мин – 0% Б; 30 мин – 40% Б; 60 мин – 40% Б; 61 мин – 0% Б; для рекондиционирования колонки достаточно 9–10 мин.
Хроматограммы записывали при λ(det) 515 нм с регистрацией спектров в диапазоне 400–700 нм.
Определение дифференциальным спектрофотометрическим методом выполняли в соответствии с данными работы [14]. Из суммарного поглощения экстракта при рН 1, A(Σ, pH 1), вычитали поглощение при изменении рН до 4.5, A(Σ, pH 4.5), которое относили к поглощению “полимерных” форм антоцианов:
Поглощение измеряли при длине волны, соответствующей максимуму в спектре. При регистрации спектров на спектрофотометре Shimadzu UV2550 вычитание фона за счет рассеивания на коллоидных частицах (при λ = 700 нм) выполняется автоматически.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Управление селективностью разделения антоцианов. Концентрация муравьиной кислоты. Систему СH3CN–HCOOH–H2O наиболее часто применяют в качсетве элюента для разделения антоцианов. При этом концентрацию муравьиной кислоты желательно поддерживать на достаточно высоком уровне – 10 об. % (рН около 1.5) для возможно более полного перевода всех антоцианов во флавилиевую форму (определяемую форму в ВЭЖХ) [15], учитывая, что рН подвижных фаз для стационарных фаз марки Symmetry C18 должен находиться в пределах 2–8 для стабильной работы колонки.
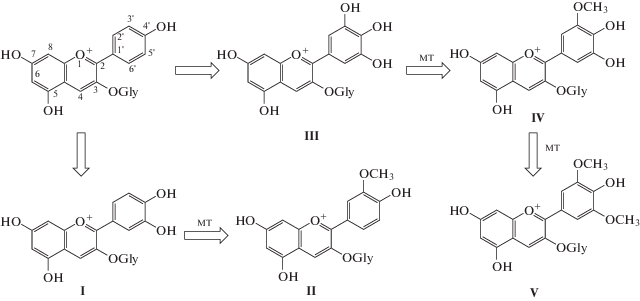
Влияние концентрации ацетонитрила в изократическом режиме. Карта разделения. Влияние концентрации СH3CN в подвижной фазе на селективность разделения антоцианов велико в случае, когда кроме моногликозидов в исследуемом образце находятся ди- и тригликозиды [15]. Разделение отдельных смесей 3-галактозидов, 3-глюкозидов или 3-арабинозидов осуществляется легко при любых концентрациях ацетонитрила в подвижной фазе в указанном выше порядке (1). Однако разделение всех пятнадцати компонентов антоцианового комплекса плодов черники проблематично. Так, например, при содержании СH3CN 6 об. % на хроматограмме удается обнаружить 13 пиков вместо пятнадцати – Dp3Ara и Cy3Gala, как и пара Pn3Gala и Pt3Ara не разделяются (рис. 1).
Рис. 1.
Разделение 15 антоцианов экстракта плодов черники в изократических условиях. Антоцианы: 1 – Dp3Gala; 2 – Dp3Glu; 3 – Dp3Ara; 4 – Cy3Gala; 5 – Cy3Glu; 6 – Pt3Gala; 7 – Cy3Ara; 8 – Pt3Glu; 9 – Pn3Gala; 10 – Pt3Ara; 11 – Pn-3Glu; 12 – Mv3Gala; 13 – Pn3Ara; 14 – Mv3Glu; 15 – Mv3Ara. Элюент: 6 об. % CH3CN, 10 об. % HCOOH в воде; расход элюента 0.8 мл/мин, 40°С. Длина волны детектора 515 нм.
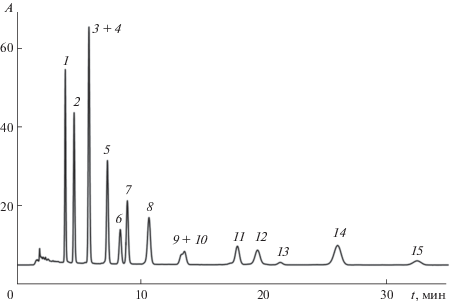
Для отыскания возможности разделения всех 15 гликозидов следует проанализировать карту разделения в варианте относительного удерживания [16] (рис. 2). Для ее построения использовали несколько различных составов подвижной фазы (по содержанию СH3CN) в изократическом режиме, выбрав в качестве реперного соединения цианидин-3-глюкозид.
Рис. 2.
Карта разделения антоцианов экстракта плодов черники при использовании системы CH3CN–HCOOH (10 об. %)–Н2О в качестве элюента. Обозначения 1–15 см. в подписи к рис. 1.
Очевидно, что для разделения первой из выше указанных пар антоцианов необходимо использовать подвижные фазы с небольшим содержанием ацетонитрила, но при этом появляются новые проблемные пары вследствие множественных сближений и пересечений линий трендов на рис. 2. Следовательно, для разделения следует подобрать градиентный режим с низким содержанием ацетонитрила в стартовом составе.
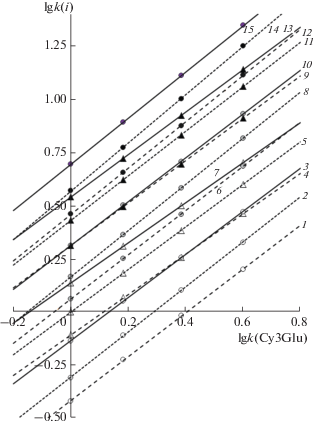
Выбор градиентного режима. Можно предложить несколько различных режимов градиентного элюирования, обеспечивающих разделение всех 15 компонентов, начиная с подвижных фаз с относительно небольшой элюирующей способностью (с содержанием 4 об. % ацетонитрила и даже без него в стартовом элюенте) (рис. 3).
Рис. 3.
Разделение антоцианов плодов черники в градиентных режимах Г1 (а) и Г2 (б) при 40°С. Обозначения 1–15 см. в подписи к рис. 1.
Таким образом, существует возможность разделения всех антоцианов экстракта плодов черники за счет выбора состава стартового элюента в режиме градиентного элюирования, хотя полного разделения всех компонентов (до Rs > 1) в предложенных режимах достичь не удается.
Влияние температуры термостата колонок на селективность разделения. В рассмотренных выше изократических и градиентном составах подвижных фаз использовали температуру 40°С, выбор которой никак не обосновывался, хотя температура может быть одной из величин, влияющих на селективность разделения компонентов сложных смесей.
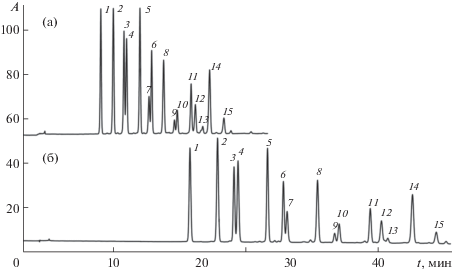
Установлено, что при росте температуры термостата колонки удерживание 3-галактозидов уменьшается в большей степени по сравнению с удерживанием соответствующих 3-арабинозидов, а при уменьшении температуры порядок элюирования должен измениться на противоположный. Это подтверждено экспериментально – при 25°С все 15 компонентов разделяются даже в изократическом режиме, например, в элюенте, содержащем 6 об. % СH3CN и 10 об. % HCOOH в воде (рис. 4). Для уменьшения продолжительности записи хроматограммы можно применять градиентный режим Г3.
Рис. 4.
Разделение антоцианов плодов черники в изократическом и градиентном режимах при 25°С. (а) – изократический режим, элюент – 6 об. % СH3CN и 10 об. % HCOOH в воде; (б) – градиентный режим Г3. Обозначения 1–15 см. в подписи к рис. 1.
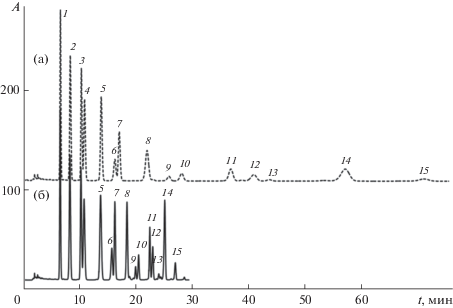
Таким образом, разделение всех 15 антоцианов экстракта плодов черники возможно при использовании системы СH3CN–HCOOH–H2O в качестве элюента.
Качественный и количественный анализ плодов. Для качественного анализа получали масс-спектры в условиях частичной фрагментации [17], с подтверждением по электронным спектрам поглощения (табл. 2). Для каждого из агликонов определили по два 3-гексозида и по одному пентозиду; первый из гексозидов определили как 3-галактозид, а второй – как 3-глюкозид по совпадению удерживания с компонентами экстрактов плодов винограда, содержащих только 3-глюкозиды тех же агликонов [18]. Третий компонент в каждой из групп определили как 3-арабинозид – по наименьшему времени удерживания среди 3-пентозидов, поскольку время удерживания возможных изомеров (3-ксилозиды) существенно больше [19]. Такое отнесение полностью подтверждают параметры электронных спектров, свидетельствующие о том, что гликозидный заместитель находится именно в положении 3 агликонов (по наличию слабой полосы поглощения в диапазоне 420–440 нм [20]), и отсутствуют различия в спектрах обоих 3-гексозидов при небольшом (около 0.5 нм) батохромном сдвиге основной полосы поглощения при переходе от 3-гексозида к 3-пентозиду.
Таблица 2.
Антоцианы, найденные в плодах растений семейства Vaccinium и в продуктах их переработки
| №1 | Антоциан | tR, мин2 | λ, нм3 | m/z | Доля антоциана в их сумме, моль %, ± 0.3% (n = 3) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| голубика | черника | свежие плоды черники | клюква | брусника | |||||||||||
| пор.4 | джем | пор. | джем | Вол.5 | 4 сез.6 | Китай | пор. | джем | пор. | джем | |||||
| 1 | Dp3Gala | 6.41 | 524 | 465 (303) | 9.6 | 5.1 | 11.6 | 11.7 | 13.8 | 11.6 | 18.0 | н/д7 | н/д | н/д | н/д |
| 2 | Dp3Glu | 8.14 | 524 | 465 (303) | 12.2 | 11.4 | 13.5 | 11.3 | 13.5 | 10.9 | 11.4 | н/д | н/д | н/д | н/д |
| 3 | Cy3Gala | 10.10 | 515 | 449 (287) | 6.0 | 3.2 | 9.2 | 11.8 | 10.8 | 10.4 | 1.6 | 24.3 | 26.3 | 85.1 | 95.0 |
| 4 | Dp3Ara | 10.66 | 524 | 435 (303) | 10.5 | 4.6 | 9.6 | 8.5 | 11.0 | 9.7 | 11.8 | н/д | н/д | н/д | н/д |
| 5 | Cy3Glu | 13.58 | 515 | 449 (287) | 10.2 | 4.9 | 12.4 | 11.9 | 11.7 | 11.8 | 1.8 | 3.2 | 3.2 | 3.4 | 2.3 |
| 6 | Pt3Gala | 15.57 | 525 | 479 (317) | 4.0 | 2.8 | 3.8 | 4.3 | 3.7 | 4.2 | 8.5 | н/д | н/д | н/д | н/д |
| 7 | Cy3Ara | 16.11 | 516 | 419 (287) | 6.3 | 2.0 | 7.7 | 8.1 | 8.2 | 7.9 | 1.6 | 21.4 | 19.6 | 10.1 | 2.1 |
| 8 | Pt3Glu | 18.26 | 525 | 479 (317) | 9.7 | 12.1 | 9.2 | 6.2 | 6.3 | 8.0 | 9.3 | н/д | н/д | н/д | н/д |
| 9 | Pn3Gala | 19.79 | 516 | 463 (301) | 1.4 | 1.1 | 1.3 | 1.4 | 2.1 | 0.8 | 1.0 | н/д | н/д | н/д | н/д |
| 10 | Pt3Ara | 20.33 | 526 | 449 (317) | 2.6 | 2.0 | 2.6 | 4.0 | 3.2 | 3.2 | 4.0 | 29.1 | 29.2 | н/д | н/д |
| 11 | Pn3Glu | 22.31 | 516 | 463 (301) | 5.7 | 4.5 | 4.7 | 5.1 | 3.8 | 5.8 | 0.8 | 8.2 | 7.7 | н/д | н/д |
| 12 | Mv3Gala | 22.83 | 527 | 493 (331) | 4.5 | 6.4 | 3.6 | 4.5 | 2.1 | 3.2 | 12.3 | н/д | н/д | н/д | н/д |
| 13 | Pn3Ara | 23.90 | 516 | 433 (301) | 0.7 | 0.7 | 0.8 | 0.7 | 0.4 | 0.6 | 0.4 | 13.8 | 13.9 | н/д | н/д |
| 14 | Mv3Glu | 24.96 | 527 | 493 (331) | 14.2 | 35.4 | 7.9 | 8.6 | 8.2 | 9.9 | 12.5 | н/д | н/д | н/д | н/д |
| 15 | Mv3Ara | 26.83 | 528 | 463 (331) | 2.5 | 3.7 | 2.2 | 2.02 | 1.2 | 1.9 | 5.2 | н/д | н/д | н/д | н/д |
1 Нумерация антоцианов как на рис.1; 2, 3 условия записи хроматограммы в режиме Г3; 4 порошок (производство порошков и джемов – Карелия); 5 Вологодская ягода, 6 4 сезона, 7 не детектируется.
Для количественного анализа использовали два подхода.
Определение соотношения между компонентами в смеси антоцианов. Определяли площади пиков S(i) и долю антоциана по уравнению для внутренней нормировки с поправочными коэффициентами:
где S(i) – площадь пика i–го компонента при записи хроматограммы при длине волны λ(det); поправочный коэффициент k(i) определяли как соотношение интенсивностей поглощения при длине волны, соответствующей максимуму поглощения, λ(max), к интенсивности поглощения при λ(det) для каждого из пиков. Такой подход согласован с определением суммы антоцианов, выраженной через эквивалент цианидин-3-глюкозида хлорида [14].Определение суммы антоцианов дифференциальным спектрофотометрическим и предложенным хроматографичеким методами. Дифференциальный спектрофотометрический метод [14] можно использовать в условиях, когда при рН 4.5 единственным определяющим процессом является переход флавилиевой формы в форму полуацеталя без заметного вклада реакции депротонирования флавилиевого иона с переходом в хиноидную форму. Возможность выполнения этого требования подтверждена в настоящей работе на примере компонентов экстрактов свежих (или свежезамороженных) плодов черники путем контроля электронных спектров при повышении рН от 1 до 4.5. Полученные результаты представлены в (табл. 3). Как видно, содержание антоцианов в джемах оказалось довольно низким с большой долей “полимерных” форм, что указывает на использование производителем технологии, не учитывающей нестабильность антоцианов. Так, например, при содержании антоцианов в исходных плодах черники на уровне 400 мг в 100 г свежих плодов при варке джема даже с двукратным количеством сахара концентрация антоцианов в продукте должна была бы составлять 100–133 мг на 100 г в зависимости от количества оставшейся при варке воды. Реальный результат 56 мг на 100 г джема примерно вдвое меньше. Высокая доля абсорбции, приходящаяся на “полимерные” формы антоцианов, полученная для всех исследованных образцов джемов и высушенных образцов, указывает на несовершенство технологии приготовления продукции.
Таблица 3.
Результаты дифференциального спектрофотометрического и хроматографического способов исключения полимерных антоцианов при анализе продуктов переработки плодов растений семейства Vaccinium
| Объект анализа | Содержание, антоцианов, г/100 г1 | Вклад в абсорбцию “полимерных” форм, % | |
|---|---|---|---|
| СФ | ВЭЖХ | ||
| Черника, джем | 0.056 ± 0.005 | 15.6 ± 0.8 | 14.0 |
| Черника, порошок | 1.45 ± 0.02 | 12.6 ± 0.7 | 11.5 |
| Голубика, джем | 0.028 ± 0.004 | 21.8 ± 0.5 | 42.6 |
| Голубика, порошок | 1.53 ± 0.02 | 12.3 ± 0.5 | 14.3 |
| Клюква, джем | 0.0032 ± 0.0005 | 38.5 ± 4.0 | 60.7 |
| Клюква, порошок | 0.132 ± 0.006 | 26.5 ± 3.0 | 33.0 |
| Брусника, джем | 0.0011 ± 0.0007 | 43.9 ± 5.0 | 90.9 |
| Брусника, порошок | 0.232 ± 0.005 | 17.9 ± 3.0 | 14.7 |
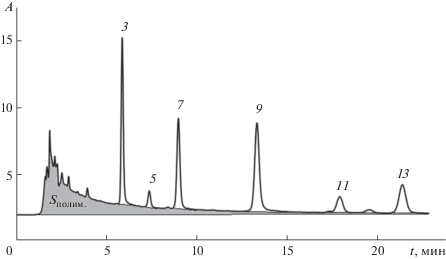
Следует также учесть, что дифференциальный спектрофотометрический метод определения концентрации “мономерных” антоцианов (по нашим данным) не имеет строгого научного обоснования, нет доказательств того, что поглощение “полимерной” формы антоцианов одинаково при двух используемых в расчете значениях рН – 1 и 4.5. С другой стороны, по нашим наблюдениям рост концентрации “полимерных” форм антоцианов в исследуемых образцах при ВЭЖХ-определении антоцианов в условиях обращенно-фазовой хроматографии всегда сопровождается пиком с очень широким шлейфом, начинающимся от времени, близкого ко времени выхода неудерживаемых компонентов (рис. 4), который может соответствовать проявлению “полимерных” антоцианов. В таком случае можно оценить вклад “полимерных” форм в суммарную абсорбцию антоцианов при рН, близком к 1 (точнее к 1.5) – как разность суммы площадей пиков с ожидаемой “нулевой” линией (т.е. площади пиков с включением окрашенной в серый цвет части хроматограммы на рис. 5) и площадей пиков, определенных по началу и концу каждого из пиков “мономерных” антоцианов. В таком случае доля, приходящаяся на “полимерные” формы, заметно больше, чем определенная спектрофотометрическим методом (табл. 3), особенно при высоком содержании этих форм.
Рис. 5.
Пики полимерных и мономерных форм антоцианов на хроматограмме. Условия разделения и нумерация пиков см. в подписяи к рис. 1.
Список литературы
Wang Y., Zhao L., Lu F., Yang X., Deng Q., Ji B., Huang F. Retinoprotective effects of bilberry anthocyanins via antioxidant, anti-inflammatory, and anti-apoptotic mechanisms in a visible light-induced retinal degeneration model in pigmented rabbits // Molecules. 2015. V. 20. P. 22395.
Ulbricht C., Basch E., Basch S., Bent S., Boon H., Burke D., Costa D., Falkson C., Giese N., Goble M., Hashmi S., Mukarjee S., Papaliodis G., Seamon E., Tanguay-Colucci S., Weissner W., Woods J. An evidence-based systematic review of bilberry (Vaccinium myrtillus) by the Natural Standard Research Collaboration // J. Diet. Suppl. 2009. V. 6. P. 162.
Gardana C., Ciappellano S., Marinoni L., Fachechi C., Simonetti P. Bilberry adulteration: Identification and chemical profiling of anthocyanins by different analytical methods // J. Agric. Food Chem. 2014. V. 62. P. 10 998.
Lee J. Anthocyanin analyses of Vaccinium fruit dietary supplements // Food Sci. Nutr. 2016. V. 4. P. 742.
Govindaraghavan S. Pharmacopeial HPLC identification methods are not sufficient to detect adulterations in commercial bilberry (Vaccinium myrtillus) extracts. Anthocyanin profile provides additional clues // Fitoterapia. 2014. V. 99. P. 124.
Buchert J., Koponen J.M., Suutarinen M., Mustranta A., Lille M., Törrönen R., Poutanen K. Effect of enzyme-aided pressing on anthocyanin yield and profiles in bilberry and blackcurrant juices // J. Sci. Food Agric. 2005. V. 85. P. 2548.
Lätti A.K., Riihinen K.R., Kainulainen P.S. Analysis of anthocyanin variation in wild populations of bilberry (Vaccinium myrtillus L.) in Finland // J. Agric. Food Chem. 2008. V. 56. P. 190.
Ştefănuţ M.N., Căta A., Pop R., Moşoarcă C., Zamfir A.D. Anthocyanins HPLC-DAD and MS characterization, total phenolics, and antioxidant activity of some berries extracts // Anal. Lett. 2011. V. 44. P. 2843.
Ichiyanagi T., Hatano Y., Matsugo S., Konishi T. Structural dependence of HPLC separation pattern of anthocyanins from bilberry (Vaccinium myrtillus L.) // Chem. Pharm. Bull. 2004. V. 52. P. 628.
Cassinese C., de Combarieu E., Falconi M., Fuzatti N., Pace R., Sardone N. New liquid chromatography method with ultraviolet detection for analysis of anthocyanins and anthocyanidines in Vaccinium myrtillus fruit dry extracts and commercial preparations // J. AOAC Int. 2007. V. 90. P. 911.
Müller D., Schantz M., Richling E. High performance liquid chromatography analysis of anthocyanins in bilberries (Vaccinium myrtillus L.), blueberries (Vaccinium corymbosum L.), and corresponding juices // J. Food Sci. 2012. V. 77. P. C340.
Васияров Г.Г., Дробь А.А., Титова Е.В., Староверов С.М. Количественный кластерный ВЭЖХ анализ антоцианов // Сорбционные и хроматографические процессы. 2017. Т. 17. № 2. С. 243.
Дейнека В.И., Григорьев А.М., Дейнека Л.А., Шапошник Е.И., Староверов В.М. Исследование антоцианов черники в плодах и препаратах на ее основе // Заводск. лаборатория. Диагностика материалов. 2006. № 3. С. 16.
Lee J., Rennaker C., Wrolstad R.E. Correlation of two anthocyanin quantification methods: HPLC and spectrophotometric methods // Food Chem. 2008. V. 110. P. 782.
Дейнека В.И., Григорьев А.М. Исследование удерживания антоцианов в элюентах системы ацетонитрил – муравьиная кислота – вода // Журн. физ. химии. 2005. Т. 79. № 5. С. 900.
Дейнека В.И. Карта хроматографического разделения и инкрементные зависимости в методе относительного анализа удерживания в ВЭЖХ // Журн. физ. химии. 2006. Т. 80. № 3. С. 511. (Deineka V.I. Chromatographic separation map and incremental relationships in the method of relative analysis of retention under HPLC conditions // Russ. J. Phys. Chem. 2006. V. 80. P. 429.)
Дейнека В.И., Сидоров А.Н. Чулков А.Н., Дейнека Л.А. Особенности масс-спектрометрического детектирования антоцианов в высокоэффективной жидкостной хроматографии // Масс-спектрометрия. 2017. Т. 14. № 2. С. 119 (Deineka V.I., Sidorov A.N., Chulkov A.N., Deineka L.A. Peculiarities of the mass spectrometric detection of anthocyanins in high-performance liquid chromatography // J. Analyt. Chem. 2017. V. 72. № 14. P. 1441.)
Kallithraka S., Aliaj L., Makris D.P. Kefalas P. Anthocyanin profiles of major red grape (Vitis vinifera L.) varieties cultivated in Greece and their relationship with in vitro antioxidant characteristics Stamatina // Int. J. Food Sci. Technol. 2009. V. 44. P. 2385.
Oszmianski J., Sapis J.C. Anthocyanins in Fruits of Aronia melanocarpa (chokeberry) // J. Food Sci. 1988. V. 53. P. 1241.
Harborne J.B. Spectral methods of characterizing anthocyanins // Biochem. J. 1958. V. 70. P. 22.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии