Журнал аналитической химии, 2020, T. 75, № 11, стр. 1030-1039
Идентификация и определение компонентов эфирных масел шалфея лекарственного (Salvia officinalis L.), выделенных различными экстракционными способами
З. А. Темердашев a, *, В. В. Милевская a, Л. П. Рябоконь a, Н. Н. Латин b, Н. В. Киселева a, М. В. Нагалевский a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b ООО “Компания Караван”
350921 пос. Белозерный, а/я 2006, Краснодар, Россия
* E-mail: temza@kubsu.ru
Поступила в редакцию 18.03.2020
После доработки 12.05.2020
Принята к публикации 28.05.2020
Аннотация
Рассмотрен компонентный состав эфирного масла шалфея лекарственного (Salvia officinalis L.), полученного различными экстракционными способами. Изучены эфирные масла, полученные гидродистилляцией, докритической, сверхкритической флюидной и субкритической экстракцией с твердофазным и жидкостно-жидкостным способами концентрирования. Компоненты идентифицировали путем сопоставления полученных масс-спектров со спектрами индивидуальных соединений и данными библиотек NIST07, WILEY8. Исследования экстрактов шалфея лекарственного показали, что при всех способах экстракции мажорными эфирномасличными компонентами являются 1,8-цинеол, камфора, α-туйон, β-туйон, борнеол, 4-терпинеол, β-кариофиллен, β-кариофиллен оксид, веридифлорол. Содержание аналитов в экстрактах варьирует в зависимости от способа извлечения. В общей сложности в экстрактах идентифицированы 104 компонента, из которых 30 извлекаются гидродистилляцией, 32 – докритической СО2-экстракцией, 14 – сверхкритической флююдной экстракцией, 46 и 62 соединения – субкритической экстракцией с твердофазным и жидкостно-жидкостным извлечением в органическую фазу. Увеличение числа компонентов в случае более жестких способов экстракции по сравнению с гидродистилляцией показало, что в экстрактах, возможно, протекает более глубокое разложение макрокомпонентов, исключение составляет камфора.
Лекарственные растения семейства Яснотковые (Lamiaceae) активно используют в фитотерапии. Типичный представитель этого семейства шалфей лекарственный (Salvia officinalis L.) применяется наиболее широко. Эфирные масла, полученные из шалфея лекарственного, обладают антимикробным, антисептическим, противовоспалительным, противопаразитарным действием, положительно влияют на общий метаболизм, на работу сердечно-сосудистой и центральной нервной систем [1–4]. Биологически активные вещества (БАВ), входящие в состав эфирных масел, обладают антиоксидантными свойствами, благодаря чему находят широкое применение, в частности, в пищевой промышленности для предотвращения окисления и продления срока годности продуктов [1, 2].
Для извлечения эфирномасличных компонентов (ЭМК) из лекарственного растительного сырья Фармакопея России рекомендует способ гидродистилляции (ГД) [5], основанный на проникновении паров воды в клетки растения, высвобождении эфирномасличной эссенции и отгонке вместе с водяным паром с использованием, как правило, аппарата Клевенджера [6]. С другой стороны, ГД имеет ряд недостатков. Во-первых, низкая степень насыщения паровой фазы эфирным маслом обусловливает малую скорость его извлечения. Во-вторых, имеют место большие потери извлекаемых компонентов, связанные с неполнотой экстрагирования сырья и отделения масла от водной фазы из-за высокого сродства полярных соединений к воде. Состав экстракта, полученного способом ГД, непостоянен, например, из-за деградации некоторых терпеновых спиртов, поэтому метод непригоден для извлечения термолабильных соединений [7–9]. Ценность эфирных масел определяется наличием в них БАВ, их стабильностью в процессе получения и хранения.
Совершенствование методов идентификации компонентов позволяет разнообразить области практического применения экстрактов и расширить круг определяемых соединений в эфирных маслах, полученных различными способами экстракционного извлечения. Для извлечения эфирных масел наиболее часто применяют экстрагирование растворителем в аппарате Сокслета, жидкостно-жидкостную, субкритическую (СЭ), докритическую (СО2) и сверхкритическую флюидную (СФЭ) экстракцию, а также извлечение под воздействием микроволновых и ультразвуковых (УЗ) полей [10–14].
Основными способами извлечения эфирных масел из шалфея лекарственного являются ГД в аппаратах Дина-Старка [15], Клевенджера [16–18], СФЭ [19–21] и мацерация в сочетании с твердофазной (ТФЭ) и жидкостно-жидкостной (ЖЖЭ) экстракцией [17]. Идентификацию компонентного состава после извлечения эфирных масел, в основном, проводят газохроматографическим способом после перевода аналитов в органическую фазу.
В табл. 1 приведены данные по идентификации и установлению компонентного состава экстрактов эфирного масла шалфея лекарственного, полученные различными экстракционными способами. Следует отметить, что во многих исследованиях использовали образцы, собранные на различных территориях; в некоторых работах приведены данные специализированных исследований, при этом полноценная идентификация компонентов в них не проводилась.
Таблица 1.
Идентифицированные эфирномасличные компоненты шалфея лекарственного, полученные различными способами экстракции
| № | ЭМК* | ГД | Нативное сырье | СО2- экстракция (шрот) |
СЭ с ТФЭ | СЭ с ЖЖЭ |
|
|---|---|---|---|---|---|---|---|
| СО2- экстракция |
СФЭ** | ||||||
| 1 | α-Пинен | + [18, 22] | + | [18] | – | + | – |
| 2 | β-о-Цимен | – | + | – | + | – | – |
| 3 | 5-Метилфуран-2-карбальдегид | – | – | – | – | + | – |
| 4 | 6,6-Диметил-2- метиленбицикло[3.1.1] гептан | – | – | – | – | + | + |
| 5 | Камфен | + [18, 22] | + | [18–20] | – | + | + |
| 6 | (Е)-2-Октен-1-ол | [18] | – | – | – | + | – |
| 7 | β-Пинен | + [18, 22] | + | [18, 19] | – | – | – |
| 8 | β-Мирцен | + [22] | + | [20] | – | + | + |
| 9 | 4-Метилдекан | – | – | – | – | – | + |
| 10 | 3,7-Диметил-1-октен | – | – | – | – | – | + |
| 11 | 2,6-Диметилнонан | – | – | – | – | – | + |
| 12 | γ-Терпинен | + [18, 22] | + | – | – | – | + |
| 13 | 1-Пентин-5-ол | – | – | – | – | + | – |
| 14 | 3-Октин-2-ол | – | – | – | – | + | – |
| 15 | α-Толуальдегид | – | – | – | – | + | – |
| 16 | P–Цимен | + | + | [20] | – | + | – |
| 17 | 1,8–Цинеол | + [15, 16, 18–22] | + | [18–20] | – | + [23] | + [23] |
| 18 | 3,7-Диметилундекан | – | – | – | – | – | + |
| 19 | 5-Этил-2-метилоктан | – | – | – | – | – | + |
| 20 | 7-Метил-1-ундекан | – | – | – | – | – | + |
| 21 | Изопинокамфеол | – | – | – | – | – | + |
| 22 | 4,6,8-Триметил-1-нонен | – | – | – | – | – | + |
| 23 | α-Терпинен | + [18] | + | – | – | + | – |
| 24 | 4-Туйонол | – | + | – | – | – | – |
| 25 | α-Диметилстирен | – | – | – | – | + | – |
| 26 | Линалоол оксид | – | + | – | – | – | – |
| 27 | α-Терпинолен | [18, 22] | – | – | – | + | – |
| 28 | β-Линалоол | + | + | – | – | + | – |
| 29 | 4-Метилундекан | – | – | – | – | – | + |
| 30 | 4-Метил-1-ундекен | – | – | – | – | – | + |
| 31 | Камфора | + [15–18, 21, 22] | + | [18–20] | + [18–20] | + [23] | + [23] |
| 32 | α-Туйон | + [15–18, 21, 22] | + | [18–20] | – | + [23] | + [23] |
| 33 | β-Туйон | + [15–17, 21, 22] | + | [18–20] | – | + [23] | + [23] |
| 34 | Изотуйол | – | – | – | – | + | + |
| 35 | 3-Туйонол | + | + | – | – | + | + |
| 36 | Изотуйонол | + | + | – | – | + | – |
| 37 | Борнеол | + [15–18, 21, 22] | + | [18–20] | – | + [23] | + [23] |
| 38 | Изоборнил формиат | – | – | – | – | + | – |
| 39 | Изоборнил трицианоацетат | – | – | – | – | – | + |
| 40 | 4-Терпинеол | + [15–18, 21, 22] | + | [18, 19] | – | – | + |
| 41 | Бензилдиметилкарбинол ацетат | – | – | – | – | + | – |
| 42 | 4-Эпидиокси-р-мент-2-ен | – | – | – | – | – | + |
| 43 | α-Деценаль | – | – | – | – | – | + |
| 44 | α-Терпинеол | + [18] | + | – | – | + | + |
| 45 | Изооктилвинил эфир | – | – | – | – | – | + |
| 46 | 2,6,11-Триметилдодекан | – | – | – | – | + | |
| 47 | 5-Оксо-камфор | – | + | – | – | – | – |
| 48 | 2,3,6,7-Тетраметилоктан | – | – | – | – | – | + |
| 49 | 2,6,6-Триметилбицикло[3.1.1] гептан-3-ол |
– | – | – | – | – | + |
| 50 | Аскаридол эпоксид | – | – | – | – | + | – |
| 51 | 3,7-Диметилдекан | – | – | – | – | – | + |
| 52 | R(+)-Лимонен | [22] | – | – | – | + | – |
| 53 | 1,3,3-Триметил-2-оксобицикло[2.2.2]октан-6-ол | – | – | – | – | + | – |
| 54 | L-Карвеол | – | – | – | – | + | – |
| 55 | Карватанацетон | – | – | – | – | + | – |
| 56 | Е-Анетол | – | – | – | – | + | – |
| 57 | 1,7,7-Триметилбицикло[2.2.1] гепт-2-ил ацетат |
+ | + | – | – | + | + |
| 58 | 1,7,7-Триметилбицикло[2.2.1] гептан-2,5-диол |
+ | + | – | – | + | – |
| 59 | P-Винилгваякол | – | – | – | – | + | – |
| 60 | 3-Метил-2-декен | – | + | – | – | + | + |
| 61 | 2,3,5,8-Тетраметилдекан | – | – | – | – | – | + |
| 62 | 2-Аллил-1,7,7-триметилбицикло[2.2.1] гептан-2- ол |
– | + | – | + | + | – |
| 63 | 1,7,7-Триметил-5-оксобицикло[2.2.1]-гепт-2-ил ацетат | + | – | – | – | + | – |
| 64 | 5-Кетоборнил ацетат | – | + | – | – | – | + |
| 65 | 4-Метилдодекан | – | – | – | – | – | + |
| 66 | N-Тетрадекан | – | – | – | – | – | + |
| 67 | α-Оцимен | – | – | – | – | + | – |
| 68 | Гвайоль | – | – | – | – | + | + |
| 69 | β-Кариофиллен | + [18, 21–26] | + | [21, 23] | – | – | + [23] |
| 70 | 5-Изопропил-6-метилгепта-3,5-диен-2-ол | – | – | – | – | – | + |
| 71 | 4,4-Диметил-1-[1,7-октадиенил]-1-циклобутен | – | – | – | – | + | – |
| 72 | α-Кариофиллен | + [18, 22] | + | [18] | – | – | – |
| 73 | β-Кариофиллен оксид | + [15, 16, 19, 21, 22] | + | [19, 20] | – | – | – |
| 74 | Веридифлорол | + [15, 16, 19, 21] | + | [18–20] | + [18–20] | – | – |
| 75 | Лимонен оксид | + | + | – | + | – | – |
| 76 | эпи-1,3-Манул | – | + | – | – | – | – |
| 77 | Фенхол | + | – | – | – | – | – |
| 78 | Изомиокорен | + | – | – | – | – | – |
| 79 | α-Гумулен | [18, 22] | – | – | – | – | + [23] |
| 80 | 4-Метилтридекан | – | – | – | – | – | + |
| 81 | 11-(3-Пентил)-генейкозан | – | – | – | – | – | + |
| 82 | Гексодекан | – | – | – | – | – | + |
| 83 | 1-Тридеканол | – | – | – | – | – | + |
| 84 | Эйкозан | – | – | – | – | – | + |
| 85 | 2-Гексил-1-деканол | – | – | – | – | – | + |
| 86 | 2-Гексил-1-октанол | – | – | – | – | – | + |
| 87 | транс-Лонгипинокарвеол | – | – | – | – | – | + |
| 88 | N-Докозан | – | – | – | – | – | + |
| 89 | Нонодекан | – | – | – | – | – | + |
| 90 | Изотридециловый спирт | – | – | – | – | – | + |
| 91 | 4-Метилтетрадекан | – | – | – | – | – | + |
| 92 | N-Октадекан | – | – | – | – | – | + |
| 93 | Изобутил фталат | – | – | – | – | – | + |
| 94 | Кроцетан | – | – | – | – | – | + |
| 95 | Склареол | + | – | – | + | – | – |
| 96 | Бисаболол | – | – | – | + | – | – |
| 97 | Аромадендрен | + [18, 22] | – | – | – | + | – |
| 98 | Биформен | – | – | – | – | + | + |
| 99 | 9-Фенил-3-акридинол | – | – | – | – | + | – |
| 100 | 4,5,6,7-Тетрагидрокси-1,8,8,9-тетраметил-8,9-дигидро-3Н-фенолено[1,2-b]-фуран-3-он | – | – | – | – | + | + |
| 101 | Сугиол | – | – | – | – | + | + |
| 102 | Изокарнозол | – | – | – | – | + | + |
| 103 | Антиоксидант BKF | – | – | – | – | – | + |
| 104 | α-Монопальмитин | – | – | – | – | – | + |
| Общее число соединений | 30 | 32 | 14 | 7 | 46 | 62 | |
Авторы работы [19] изучали влияние УЗ-экстракции и СФЭ на выход терпеновых соединений из шалфея лекарственного (собран в сентябре/октябре 2008 г. при поздней стадии цветения в регионе Конавле, южная часть Хорватии), а также сочетание УЗ-экстракции 70%-ным этанолом и последующей СФЭ. На этих же образцах проводили сравнительное исследование ГД и СФЭ при извлечении терпеновых соединений [20]. Показано, что при СФЭ увеличивается количество экстрагируемых компонентов и повышается их выход по сравнению с ГД. В работе [21] проведена оценка антимикробной активности терпеновых соединений по степени их извлечения способами ГД в аппарате Клевенджера и СФЭ из шалфея лекарственного (собран в Эстонии в июле 2002 г., сырье сушили при комнатной температуре без доступа прямого света).
В работе [23] приведен компонентный состав эфирного масла шалфея лекарственного (собран в марте 2013 г. в La Marsa, губернаторство Туниса в Тунисе, растительный материал сушили и хранили на воздухе), полученного в процессе ГД в аппарате Дина-Старка. Химический состав эфирного масла шалфея (регион Шотт Марием, центральный восток Туниса, март 2015 г., сырье сушили на воздухе), полученного в процессе ГД в аппарате Клевенджера, устанавливали для оценки его антиоксидантной, антимикробной, инсектицидной и аллелопатической активности [15]. Определяли в основном мажорные компоненты шалфея: камфору, α-туйон, 1,8-цинеол, виридифлорол, β-туйон и β-кариофиллен.
Сравнительный анализ экстрактов шалфея лекарственного (Ботанический сад Медицинского университета в Люблине, июнь 2008 г., образцы сушили на воздухе и измельчали в порошок), полученных методом ГД в аппарате Деринга и Клевенджера, а также твердофазной микроэкстракцией (ТФМЭ), проводили по выходу компонентов [16]. Отмечено, что ГД не позволяет в полной мере выделить легколетучие компоненты (монотерпены) по сравнению с ТФМЭ.
Компонентный состав шалфея лекарственного, полученного методом ГД и мацерацией с последующей ЖЖЭ или ТФЭ компонентов на сорбенте С18, устанавливали методом хромато-масс-спектрометрии [17]. Наиболее эффективным способом извлечения легколетучих компонентов из растительной матрицы оказалась мацерация в сочетании с ТФЭ. В работе [24] выполнен сравнительный анализ компонентного состава эфирных масел шалфея лекарственного (восточная Польша, 2008 г., сушили на воздухе и хранили при +4°С), полученных дисперсионной твердофазной микроэкстракцией (ТФДМЭ), паровой дистилляцией и СЭ. Показано, что общее количество и состав эфирного масла оказались приблизительно одинаковым.
Цель настоящей работы – идентификация и сравнение компонентного состава эфирного масла шалфея лекарственного (Salvia officinalis L.), полученного различными экстракционными способами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реактивы. Объектами исследования были образцы шалфея лекарственного (Salvia officinalis L.), собранные с территории биостанции Кубанского госуниверситета “Камышанова поляна” им. проф. В.Я. Нагалевского, расположенной в восточной части Лагонакского нагорья (Северо-Западный Кавказ) на высоте 1250 м над уровнем моря. Перед экстрагированием ЭМК исходное сырье предварительно сушили воздушно-теневым способом при 30–40°С, затем измельчали и просеивали, выделяя фракции 0.5–1.0 мм, после чего усредняли путем перемешивания.
Для экстракционного извлечения компонентов использовали гексан ос. ч. (Криохром, Россия) и хлороформ ос. ч. (Экос 1, Россия) в качестве экстрагентов, азот газообразный высокой чистоты для удаления растворенного кислорода из растворителей, безводный сульфат натрия х. ч. (Вектон, Россия) для удаления воды из экстрактов. Деионированную воду получали на установке Milli-Q-UV (Millipore, Франция). Для перевода аналитов из водной фазы в органическую использовали картриджи для ТФЭ: Strata C18-E и Strata X (Phenomenex, США), Oasis HLB (Waters, США) с массой сорбента 100 мг и объемом 3 мл.
Для идентификации аналитов использовали стандартные образцы камфена (≥95%), α-туйона (≥96%), β-линалоола (≥97%) и камфоры (≥95%) (Sigma-Aldrich, США).
Извлечение эфирных масел. Зависимости компонентного состава эфирных масел от способа экстракционного извлечения изучали способом ГД в аппарате Гинзберга, докритической CO2-экстракцией и СЭ в сочетании с техникой ТФЭ и ЖЖЭ извлечения эфирных масел в органическую фазу с последующим хроматографическим определением аналитов. Полученные данные включены в табл. 1.
Экстракцию компонентов эфирного масла способом ГД проводили по методике [5]. Навеску измельченного сырья (30.0 г) помещали в круглодонную колбу емк. 1000 мл, добавляли 300 мл очищенной воды. Колбу с образцом присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в течение 120 мин. Эфирное масло собирали в приемник Гинзберга. Остатки воды удаляли добавлением безводного сульфата натрия. Перед проведением анализа при необходимости пробу разбавляли гексаном.
Докритическую СО2-экстракцию эфирномасличных компонентов проводили в ООО “Компания Караван” (Краснодар, Россия) на экспериментальной установке, подробная схема которой описана в работе [25], под давлением 58 атм при 31°С из 200 г лекарственного сырья. По окончании экстракции сбрасывали давление в системе. После улетучивания СО2 собирали экстракт. Перед ВЭЖХ-анализом 150 мг экстракта растворяли в 1 мл ацетонитрила или метанола, обрабатывали ультразвуком, центрифугировали и фильтровали через полипропиленовый фильтр Whatman с диаметром пор ~0.2 мкм. Из образца шрота после СО2-экстракции извлекали БАВ путем экстрагирования 70%-ным метанолом c УЗ-воздействием, как описано выше.
Субкритическая экстракция эфирномасличных компонентов, совмещенная с твердофазной и жидкостно-жидкостной экстракцией. Для динамического извлечения БАВ при повышенных температуре и давлении использовали экспериментальную установку, состоящую из термостата с электронагревателем, температуру в которой поддерживали с помощью электронного блока и термоэлектрического преобразователя. Более подробное описание установки дано в работе [26]. Навеску измельченного сырья (0.2000 г) набивали в ячейку-экстрактор. До проведения процедуры экстракции бидистиллированную воду, используемую в качестве экстрагента, предварительно продували азотом в течение 10 мин до полного удаления растворенного кислорода и помещали в емкость для растворителя. С помощью насосной системы заполняли экстракционную ячейку экстрагентом, нагревали систему до заданной температуры, после чего собирали 5 мл экстракта при скорости потока растворителя 1 мл/мин.
Аналиты из экстрактов, полученных при повышенных температуре и давлении, извлекали в органическую фазу с использованием УЗ-ванны УЗВ – 4.0/1 ТТЦ (Сапфир, Россия), а также картриджей для ТФЭ: Strata C18-E, Strata X (Phenomenex, США), Oasis HLB (Waters, США). Выбор картриджей для ТФЭ определяется природой экстрагируемых соединений; наибольшее распространение получили сорбенты на основе силикагеля с привитыми октадецильными группами [27–29].
Для оптимизации условий СЭ компонентов эфирных масел из шалфея лекарственного изучали влияние температуры и состава растворителя. Влияние температуры на СЭ изучали в диапазоне температур от 100 до 250°С. В качестве экстрагентов использовали воду и этанол. Для извлечения аналитов способом СЭ в органическую фазу и очистки водный экстракт пропускали через картриджи для ТФЭ Strata C18-E, Strata X или Oasis HLB, затем их элюировали с картриджа для ТФЭ хлороформом. Процесс ТФЭ состоял из трех стадий: кондиционирования картриджа для ТФЭ с целью его активации, заполнения картриджа для ТФЭ экстрактом и элюирования целевых компонентов хлороформом со скоростью 1 мл/мин. В органическую фазу для осушения добавляли несколько кристаллов безводного сульфата натрия.
Возможность извлечения аналитов из экстракта в органическую фазу изучали способом ЖЖЭ в хлороформе или гексане с использованием 0.5 мл органического растворителя и 1 мл экстракта, полученного субкритическим способом. Пробирку со смесью водного экстракта и органического растворителя (2 : 1) помещали в УЗ-ванну на 30 мин, а затем центрифугировали в течение 2 мин при 10 000 об/мин, отбирая супернатант, который затем сушили безводным сульфатом натрия. Эффективность извлечения контролировали методом газовой хромато-масс-спектрометрии.
Хроматографическое определение ЭМК в экстрактах шалфея проводили методом газовой хромато-масс-спектрометрии (ГХ–МС) на хроматографе Shimadzu GC-2010 с масс-спектрометрическим детектором GCMS-QP2010 Plus. Разделение аналитов осуществляли на кварцевой капиллярной колонке HP-ULTRA 1 (50 м × 0.20 мм, 0.33 мкм) (Agilent Technologies, США) с использованием программируемого режима нагрева колонки: 50°C (0–3 мин), линейный подъем температуры до 290°C со скоростью 8 град/мин (3–30 мин) и ее стабилизация в течение 10 мин. Объем вводимой пробы 1 мкл. Температура термостата колонки составляла 50°С, температура инжектора – 260°С. В качестве газа-носителя использовали гелий, линейная скорость потока 25.1 см/мин. Коэффициент деления 1 : 5. Оптимизированные параметры работы масс-спектрометра: температура ионного источника 200°С, температура интерфейса 280°С, напряжение на детекторе 1.2 кВ, скорость сканирования масс-спектра 1250 а. е. м./с, диапазон сканируемых масс 34–600 m/z.
Экстракты шалфея лекарственного, полученные различными способами, анализировали газохроматографически с масс-спектрометрическим детектированием. Эфирномасличные компоненты идентифицировали сопоставлением полученных масс-спектров со спектрами индивидуальных соединений и данными библиотек NIST07, WILEY8. Количественная оценка содержаний ЭМК в экстрактах, полученных различными способами, затруднена из-за отсутствия стандартных образцов или индивидуальных соединений для построения градуировочных графиков. В связи с этим применили широко используемый в области химии растительного сырья метод внутренней нормировки по площадям пиков [22]. Помимо этого для оценки правильности полученных результатов проводили верификацию по данным анализа модельных смесей имеющихся в нашем распоряжении индивидуальных соединений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хроматографическое исследование экстрактов шалфея лекарственного показало, что при всех способах экстракции мажорными ЭМК являются 1,8-цинеол, камфора, α-туйон, β-туйон, борнеол, 4-терпинеол, β-кариофиллен, β-кариофиллен оксид, веридифлорол. В качестве иллюстрации на рис. 1 приведена хроматограмма водного экстракта шалфея, полученного субкритическим извлечением ЭМК. В табл. 2 приведены содержания ЭМК в экстрактах, полученных способами ГД, СО2-экстракцией и СЭ. Как видно из табл. 2, содержание аналитов в исследуемых экстрактах варьирует в зависимости от способа извлечения. Концентрация 1,8-цинеола колеблется от 3.72 до 9.76%, камфоры – в диапазоне 29.4–41.3%, α-туйона 10.7–21.9%, β-туйона 2.4–8.2%, борнеола 3.7–3.9%, 4-терпениола 0.1–0.5% и β‑кариофиллена 0.3–0.8%. В шроте шалфея лекарственного макрокомпоненты практически отсутствуют, что свидетельствует о полном их извлечении из нативного сырья на стадии СО2-экстракции.
Рис. 1.
Хроматограмма экстракта после субкритического извлечения водой и последующей жидкостно-жидкостной экстракции хлороформом.
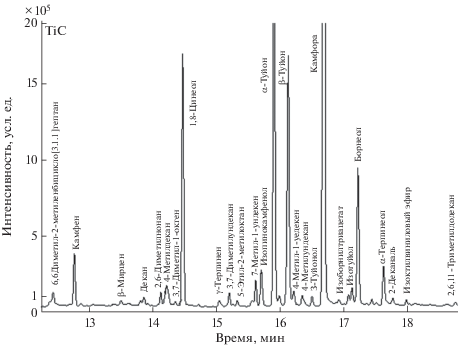
Таблица 2.
Содержание (%) эфирномасличных компонентов в экстрактах шалфея лекарственного
| ЭМК | ГД | СО2-экстракция | СЭ с ТФЭ | СЭ с ЖЖЭ | |
|---|---|---|---|---|---|
| (нативное сырье) | (шрот) | ||||
| 1,8-Цинеол | 9.76 | 3.72 | н/о | 7.32 | 6.45 |
| Камфора | 37.29 | 29.35 | 0.69 | 41.26 | 31.82 |
| α-Туйон | 21.87 | 10.68 | н/о | 12.63 | 10.15 |
| β-Туйон | 8.19 | 2.37 | н/о | 7.4 | 6.93 |
| Борнеол | 3.79 | 3.11 | н/о | 3.93 | 3.67 |
| 4-Терпениол | 0.5 | н/о | н/о | н/о | 0.14 |
| β-Кариофиллен | 0.8 | 3.46 | н/о | н/о | 0.29 |
Анализ данных по ЭМК, выделенным различными способами экстракции (табл. 1), показал, что в состав экстрактов входят 104 компонента, из которых 30 извлекаются ГД, 32 – докритической СО2-экстракцией, 46 и 62 соединения – СЭ, совмещенной соответственно с твердофазным и жидкостно-жидкостным способами концентрирования. Увеличение количества компонентов в случае применения более жестких способов экстракции по сравнению с ГД свидетельствует о том, что в экстрактах происходит более глубокое разложение макрокомпонентов, исключение составляет камфора. Ниже обсуждаются результаты экстракционного извлечения макрокомпонентов различными способами.
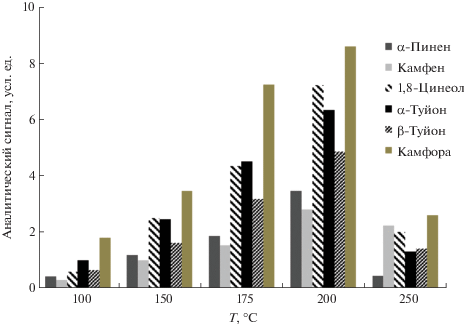
Субкритическая экстракция компонентов эфирных масел из шалфея лекарственного. Строили диаграмму извлечения ЭМК из шалфея лекарственного при различных температурах в условиях СЭ. Оптимальным экстрагентом ЭМК шалфея лекарственного в диапазоне температур от 100 до 250°С при 12.1 МПа при СЭ является вода. Диаграмма извлечения ЭМК шалфея лекарственного при различных температурах приведена на рис. 2. Оптимальный выход ЭМК из шалфея лекарственного при СЭ достигается при 200°С с использованием воды в качестве растворителя.
Рис. 2.
Значения уровней извлечения эфирномасличных компонентов шалфея лекарственного в условиях субкритической экстракции (экстрагент – вода, давление 12.1 МПа) при различных температурах.
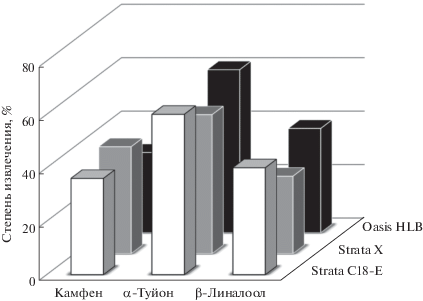
Твердофазная экстракция компонентов эфирных масел из шалфея лекарственного. Эффективность ТФЭ аналитов на картриджах для ТФЭ Strata C18-E, Strata X или Oasis HLB контролировали по степени извлечения ЭМК, при этом в водные экстракты шалфея на стадии заполнения картриджа добавляли индивидуальные вещества (рис. 3). Из рис. 3 видно, что степень извлечения ЭМК практически сопоставима для всех изучаемых сорбентов и в выбранных условиях сорбции и десорбции не превышает 60%.
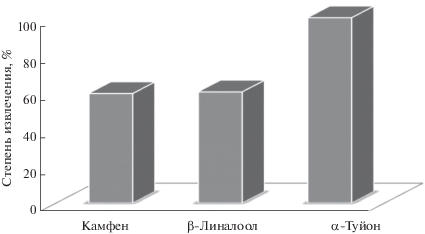
Жидкостно-жидкостная экстракция компонентов эфирных масел из шалфея лекарственного. Сравнение эффективности гексана и хлороформа при ЖЖЭ аналитов проводили на примере модельных смесей, состоящих из камфена, α-туйона и β-линалоола (рис. 4). Данные газохроматографического анализа экстрактов показали, что использование гексана в качестве экстрагента значительно повышает выход ЭМК по сравнению с хлороформом. Кроме того, применение ЖЖЭ гексаном эфиромасличных компонентов из субкритического водного извлечения повысило степень извлечения аналитов по сравнению с ТФЭ до 60% (рис. 5).
Рис. 4.
Степени извлечения эфирномасличных компонентов после жидкостно-жидкостной экстракции смесями различных экстрагентов.
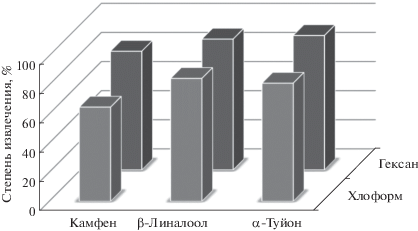
Рис. 5.
Степени извлечения эфирномасличных компонентов из экстракта при субкритическом извлечении водой и последующей жидкостно-жидкостной экстракции гексаном.
Изменение в широком диапазоне содержаний исследуемых соединений в экстрактах, полученных ГД, СО2-экстракцией и СЭ, свидетельствует о разной степени воздействия этих способов на исходное сырье.
Исследования проводили при финансовой поддержке РФФИ (проект № 18-33-20009-мол_а_вед) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Amorati R., Foti M.C., Valgimigli L. Antioxidant activity of essential oils // J. Agric. Food Chem. 2013. V. 61. № 46. P. 10835.
Hüsnü K., Başer K., Demirci F. Chemistry of essential oils / Flavours and Fragrances. Chemistry, Bioprocessing and Sustainability. Ch. 4 / Ed. Berger R.B. Berlin: Springer-Verlag Berlin, 2007. P. 43.
Dziurzynski T., Ludwiczuk A., Glowniak K. Biological activities of Salvia L. species // Curr. Iss. Pharm. Med. Sci. 2013. V. 26. № 3. P. 326.
Bahadori M.B., Salehi P., Sonboli A. Comparative study of the essential oil composition of Salvia urmiensis and its enzyme inhibitory activities linked to diabetes mellitus and Alzheimer’s disease // Int. J. Food Prop. 2017. V. 20. № 12. P. 2974.
ОФС.1.5.3.0010.15. Определение содержания эфирного масла в лекарственном растительном сырье и лекарственных растительных препаратах / Государственная Фармакопея РФ. XIV издание. Т. II. М., 2018.
Ефремов А.А. Метод исчерпывающей гидропародистилляции при получении эфирных масел дикорастущих растений // Успехи современного естествознания. 2013. № 7. С. 88.
Wei Z.F., Zhao R.N., Dong L.J., Zhao X.Y., Su J.X., Zhao M., Li L., Bian Y.J., Zhang L.J. Dual-cooled solvent-free microwave extraction of Salvia officinalis L. essential oil and evaluation of its antimicrobial activity // Ind. Crops Prod. 2018. V. 120. P. 71.
Manouchehri R., Saharkhiz M.J., Karami A., Niakousari M. Extraction of essential oils from damask rose using green and conventional techniques: Microwave and ohmic assisted hydrodistillation versus hydrodistillation // Sustain. Chem. Pharm. 2018. V. 8. P. 76.
Hashemi S.M.B., Nikmaram N., Esteghlal S., Mousavi Khaneghah A., Niakousari M., Barba F.J., Roohinejad S., Koubaa M. Efficiency of Ohmic assisted hydrodistillation for the extraction of essential oil from oregano (Origanum vulgare subsp. viride) spices // Innov. Food Sci. Emerg. Technol. 2017. V. 41. P. 172.
Veličković D.T., Milenović D.M., Ristić M.S., Veljko-vić V.B. Ultrasonic extraction of waste solid residues from the Salvia sp. essential oil hydrodistillation // Biochem. Eng. J. 2008. V. 42. P. 97.
Okoh O.O., Sadimenko A.P., Afolayan A.J. Comparative evaluation of the antibacterial activities of the essential oils of Rosmarinus officinalis L. obtained by hydrodistillation and solvent free microwave extraction methods // Food Chem. 2010. V. 120. P. 308.
Dawidowicz A.L., Rado E., Wianowska D., Mardarowicz M., Gawdzik J. Application of PLE for the determination of essential oil components from Thymus vulgaris L. // Talanta. 2008. V. 76. № 4. P. 878.
Deng C., Yao N., Wang A., Zhang X. Determination of essential oil in a traditional Chinese medicine, Fructus amomi by pressurized hot water extraction followed by liquid-phase microextraction and gas chromatography-mass spectrometry // Anal. Chim. Acta. 2005. V. 536. P. 237.
Bendif H., Adouni K., Miara M.D., Baranauskienė R., Kraujalis P., Venskutonis P.R., Nabavi S.M., Maggi F. Essential oils (EOs), pressurized liquid extracts (PLE) and carbon dioxide supercritical fluid extracts (SFE-CO2) from Algerian Thymus munbyanus as valuable sources of antioxidants to be used on an industrial level // Food Chem. 2018. V. 260. P. 289.
Ben Khedher M.R., Ben Khedher S., Chaieb I., Tounsi S., Hammami M. Chemical composition and biological activities of salvia officinalis essential oil from Tunisia // EXC-LI J. 2017. V. 16. P. 160.
Baj T., Ludwiczuk A., Sieniawska E., Skalicka-Woźniak K., Widelski J., Zieba K., Głowniak K. GC−MS analysis of essential oils from Salvia officinalis L.: Comparison of extraction methods of the volatile components // Acta Pol. Pharm. 2013. V. 70. № 1. P. 35.
Radulescu V., Chiliment S., Oprea E. Capillary gas chro-matography–mass spectrometry of volatile and se-mi-volatile compounds of Salvia officinalis // J. Chromatogr. A. 2004. V. 1027. № 1–2. P. 121.
Asamenew G., Asres K., Bisrat D., Mazumder A., Lindemann P. Studies on Chemical Compositions, Antimicrobial and Antioxidant Activities of Essential Oils of Salvia officinialis Linn. Grown in Two Locations of Ethiopia // J. Essent. Oil Bear. Pl. 2017. V. 20. № 2. P. 426.
Glisic S.B., Ristic M., Skala D.U. The combined extraction of sage (Salvia officinalis L.): Ultrasound followed by supercritical CO2 // Ultrason. Sonochem. 2011. V. 18. № 1. P. 318.
Glisic S., Ivanovic J., Ristic M., Skala D. Extraction of sage (Salvia officinalis L.) by supercritical CO2: Kinetic data, chemical composition and selectivity of diterpenes // J. Supercrit. Fluids. 2010. V. 52. № 1. P. 62.
Menaker A., Kravets M., Koel M., Orav A. Identification and characterization of supercritical fluid extracts from herbs // C. R. Chim. 2004. V. 7. № 6-7. P. 629.
Ozel M.Z., Gogus F., Lewis A.C. Subcritical water extraction of essential oils from Thymbra spicata // Food Chem. 2003. V. 82. № 3. P. 381.
El Euch S.K., Hassine D.B., Cazaux S., Bouzouita N., Bouajila J. Salvia officinalis essential oil: Chemical analysis and evaluation of anti-enzymatic and antioxidant bioactivities // S. Afr. J. Bot. 2019. V. 120. P. 253.
Dawidowicz A.L., Rado E. Matrix solid-phase dispersion (MSPD) in chromatographic analysis of essential oils in herbs // J. Pharm. Biomed. Anal. 2010. V. 52. № 1. P. 79.
Стасьева О.Н., Латин Н.Н., Касьянов Г.И. СО2-экстракты Компании Караван – новый класс натуральных пищевых добавок. Краснодар: КНИ-ИХП, 2008. 324 с. https://drive.google.com/file/d/ 0B5zeZO90J3tySGhJVDFfSE84aUU/view (05.05.2020).
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Бутыльская Т.С., Шилько Е.А. Экстракция и определение биологически активных компонентов зверобоя и препаратов на его основе // Журн. аналит. химии. 2016. Т. 71. № 7. С. 768. (Milevskaya V.V., Temerdashev Z.A., Kiseleva N.V., Butyl’skaya T.S., Shil’ko E.A., Statkus M.A. Extraction and determination of biologically active components of st. John’s wort and its pharmaceutical preparations // J. Analyt. Chem. 2016. V. 71. № 7. P. 741.)
Kutlular O., Ozel M.Z. Analysis of essential oils of origanum onites by superheated water extraction using GCxGC-TOF/MS // J. Essent. Oil Bear. Pl. 2009. V. 12. № 4. P. 462.
Ozel M.Z., Kaymaz H. Superheated water extraction, steam distillation and Soxhlet extraction of essential oils of Origanum onites // Anal. Bioanal. Chem. 2004. V. 379. № 7−8. P. 1127.
Байкова Е.В., Королюк Е.А., Ткачев А.В. Компонентный состав эфирных масел некоторых видов рода SALVIA L., выращенных в условиях Новосибирска (Россия) // Химия растительного сырья. 2002. № 1. С. 37.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии