Журнал аналитической химии, 2020, T. 75, № 5, стр. 458-465
Тиоцианат-селективный электрод и его аналитическое применение
Ю. В. Матвейчук *
Белорусский государственный университет, химический факультет
220030 Минск, ул. Ленинградская, 14, Беларусь
* E-mail: Yu_Matveychuk@mail.ru
Поступила в редакцию 18.01.2019
После доработки 13.02.2019
Принята к публикации 03.12.2019
Аннотация
Изучена анионообменная экстракция тиоцианат-ионов различными четвертичными аммониевыми солями. Определены константы обмена $\left( {\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}} \right)$ тиоцианат-ионов на хлорид-ион. Так, при переходе от бромида 3,4,5-трис(додецилокси)бензилтриметиламмония к бромиду 3,4,5-трис(додецилокси)бензилтрилауриламмония $\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ увеличивается практически в десять раз. На основе трилаурильной четвертичной аммониевой соли разработан пленочный (ПВХ) тиоцианат-селективный электрод (пластификатор – 1-бромнафталин). Определены его основные аналитические характеристики (наклон электродной функции, предел обнаружения, коэффициенты селективности, рабочий диапазон рН). Электрод использован для определения тиоцианат-ионов в слюне курящих и некурящих людей.
Тиоцианат-ионы поступают в окружающую среду как при биоразложении соединений серы и биомассы, так и за счет антропогенных источников. Тиоцианаты сравнительно малотоксичны [1], хотя по данным [2] они относятся к ионам, губительно влияющим на обитателей водной среды. Предельно допустимая концентрация KNCS в питьевой воде составляет 0.1 мг/л [2, 3], в водоемах рыбохозяйственного значения – 0.15 мг/л [2]; допустимое содержание в сточных водах, использующихся для орошения сельскохозяйственных земель – 2 мг/л [2].
Тиоцианаты применяют в производстве тиомочевины, ядохимикатов, ингибиторов коррозии, редких и рассеянных элементов, стабилизаторов горения взрывчатых веществ, в процессе крашения тканей, в производстве полиакрилонитрильных волокон, а также как индикатор при исследовании распределения нефтяных месторождений и др. [4]. Основными объектами для определения тиоцианат-ионов являются промышленные сточные воды. Кроме того, тиоцианаты найдены в слюне (в большей концентрации у курильщиков), крови, моче человека, в желудочном соке животных, в соке лука и корнях некоторых растений. У курильщиков часто появляются проблемы с щитовидной железой, так как тиоцианаты изменяют поступление и усвоение иода в щитовидной железе, а также способствуют его утечке из нее. Тиоцианаты образуются также при переваривании капусты, репы, сыра, молока [1, 3, 5–7].
К настоящему времени разработано несколько десятков тиоцианат-селективных электродов (SCN–-СЭ) на основе различных ионофоров: краун-эфиров [8, 9], производных имидпиридина [10], полиаминов [11], 1-бензил-3-(4-нитрофенил)тиоуретана [12] и др. Однако основными переносчиками для SCN–-СЭ являются металлокомплексные соединения: комплексы фталоцианинов с Zn, Ni(II), Fe(III), Rh(II); порфиринов с Fe(III), Mn(III), Co(II); сульфамидные комплексы Fe(III), Cu(II), Ag(I), а также комплексы Cd, Cu(II), Zn с основаниями Шиффа, Cu(II) с этилендиаминбис(салицилальдегидом), Mn(II) с N,N'-бис(4-фенилазосалицилиден)-о-фенилендиамином, бис(N-3-метилфенилсалицилиденаминатом) Cu(II) и др. [13–20]. Описанные ионселективные электроды (ИСЭ), несомненно, обладают рядом достоинств – высокой селективностью и низкими пределами обнаружения, однако зачастую требуют применения дорогостоящих и сложно синтезируемых ионофоров, ряда дополнительных компонентов в мембранных композициях, причем их приготовление занимает много времени. Создание простых, дешевых и надежных сенсоров, обладающих низкими пределами обнаружения, высокой селективностью и хорошей воспроизводимостью для определения неорганических анионов остается актуальной задачей.
Одной из добавок в мембранах SCN–-СЭ являются четвертичные аммониевые соли (ЧАС) (хлорид триоктилметиламмония, иодид додецилтриоктиламмония, хлорид гексадецилтриметиламмония, хлорид тридодецилметиламмония) [8–20], назначение которых, как считается, состоит в обеспечении только анионной функции. Однако ранее отмечено [21, 22], что при обмене однозарядных ионов на однозарядные прослеживается явная взаимосвязь между размерами обменивающихся ионов и их анионообменным сродством к ЧАС (константой обмена).
В данной работе показана возможность создания ИСЭ на основе стерически затрудненных ЧАС, которые не требуют добавки специфичных ионофоров. Определены численные значения констант обмена тиоцианат-ионов на хлорид-ион для ряда ЧАС. Разработанные сенсоры использовали для определения тиоцианат-ионов в биологических жидкостях (слюне курящих и некурящих людей).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
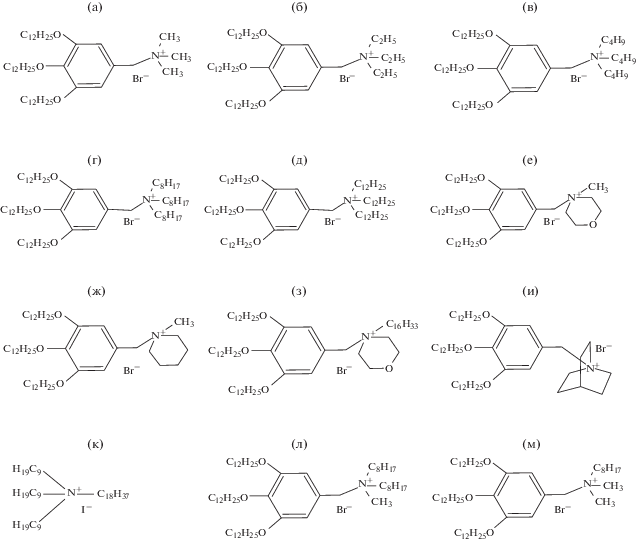
Реактивы. Использовали толуол х. ч., соляную кислоту (фиксанал), гидроксид натрия (фиксанал), тиоцианат калия (фиксанал), хлорид натрия ч. д. а., тиоцианат калия ч. д. а., 2,4-динитрофенол (2,4-ДНФ) ч. д. а., поливинилхлорид (ПВХ), 1-бромнафталин (1-БН, ч. д. а.). На рис. 1 представлены графические структурные формулы использованных в работе ЧАС.
Рис. 1.
Графические структурные формулы четвертичных аммониевых солей: (а) – 3,4,5-трис(додецилокси)бензилтриметиламмония (ТМ) бромид; (б) – 3,4,5-трис(додецилокси)бензилтриэтиламмония (ТЭ) бромид; (в) – 3,4,5-трис(додецилокси)бензилтрибутиламмония (ТБ) бромид; (г) – 3,4,5-трис(додецилокси)бензилтриоктиламмония (ТО) бромид; (д) – 3,4,5-трис(додецилокси)бензилтрилауриламмония (ТЛ) бромид; (е) – 3,4,5-трис(додецилокси)бензилметилморфолиния (МО) бромид; (ж) – 3,4,5-трис(додецилокси)бензилметилпиперидиния (МП) бромид; (з) – 3,4,5-трис(додецилокси)бензилгексадецилморфолиния (ЦМ) бромид; (и) – 3,4,5-трис(додецилокси)бензилхинуклидиния (ХИН) бромид; (к) – тринонилоктадециламмония (ТНОДА) иодид; (л) – 3,4,5-трис(додецилокси)бензилдиоктилметиламмония (ДОМ) бромид; (м) – 3,4,5-трис(додецилокси)бензилдиметилоктиламмония (ДМО) бромид.
Методика изготовления мембран ионселективных электродов стандартная и изложена в работе [23]. Перед началом работы ИСЭ вымачивали в 0.5 М растворе KNCS в течение 1 сут, внутрь заливали 0.01 М раствор KNCS. Между измерениями электрод хранили в 0.001 М растворе KNCS.
Выполнение анионообменной экстракции. ЧАС переводили в динитрофенолятную форму (ЧАС+ДНФ–)следующим образом: готовили исходные 0.01 М толуольные растворы ЧАС, затем 100 мл раствора ЧАС обрабатывали 500 мл водного раствора ДНФ–Na+, взятого в избытке.
Для определения констант обмена ранее предложен метод промежуточного аниона [24, 25], в качестве которого применяют подходящий кислотный краситель, например 2,4-ДНФ, в солевой (натриевой) форме.
Для изучения анионообменной экстракции использовали 0.001 М раствор ЧАС+ДНФ–, 1 М раствор NaCl и 0.01 М раствор KNCS (в табл. 1 представлены их соотношения), которые вносили в пробирки с пришлифованными пробками. Эксперименты проводили при 21 ± 1°С. Полученные системы термостатировали в течение 15 мин, встряхивая каждые 2–3 мин. Затем отделяли органическую и водную фазы, которые при необходимости разбавляли толуолом или дистиллированной водой соответственно. Оптическую плотность измеряли при длине волны 410 нм на спектрофлуориметре Solar СМ2203 (l = 10 мм).
Таблица 1.
Изученные анионообменные системы
| № | V(КNCS) или V(NaCl), мл | V(H2O), мл | V(ЧАС+ДНФ–), мл |
|---|---|---|---|
| 1 | 5 | 0 | 5 |
| 2 | 3 | 2 | 5 |
| 3 | 2 | 3 | 5 |
| 4 | 1 | 4 | 5 |
| 5 | 0 | 5 | 5 |
Для ионометрических измерений использовали иономер И-160.1МП со вспомогательным хлоридсеребряным электродом ЭВЛ-1М3.1, для определения рН – стеклянный электрод ЭСЛ-43-07СР.
Расчет констант ионного обмена. Равновесную концентрацию красителя рассчитывали по закону Бугера–Ламберта–Бера (ε = 9600) в соответствии с протекающей ионообменной реакцией:
(1)
${\text{ЧА}}{{{\text{С}}}^{ + }}{\text{ДН}}{{{\text{Ф}}}^{{--{\text{ }}}}} + {\text{A}}{{{\text{n}}}^{--}} \leftrightarrow {\text{ЧА}}{{{\text{С}}}^{ + }}{\text{A}}{{{\text{n}}}^{--}} + {\text{ДН}}{{{\text{Ф}}}^{--}}.$Концентрационные константы обмена ДНФ-иона на хлорид- или тиоцианат-ион рассчитывали по уравнениям:
(2)
$К_{{{\text{ДНФ}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} = \frac{{\left( {с_{{{\text{ЧАС}}\,{\text{org}}}}^{{\text{0}}} - {{с}_{{{\text{ДНФ}}\,{\text{org}}}}}} \right){{с}_{{{\text{ДНФ}}\,{\text{aq}}}}}}}{{{{с}_{{{\text{ДНФ}}\,{\text{org}}}}}с_{{{\text{KNCS}}}}^{{\text{0}}}}},$(3)
$К_{{{\text{ДНФ}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}} = \frac{{с_{{{\text{ДНФ}}\,{\text{aq}}}}^{2}}}{{{{с}_{{{\text{ДНФ}}\,{\text{org}}}}}с_{{{\text{NaCl}}}}^{{\text{0}}}}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анионообменная экстракция. Свободная энергия обмена тиоцианат-ионов на хлорид-ион $\Delta g_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ может быть рассчитана следующим образом:
(4)
$\begin{gathered} \Delta g_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} = \left( {\Delta g_{{{\text{гидр}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} - \Delta g_{{{\text{гидр}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}} \right) - \\ - \,\,\left( {\Delta g_{{{\text{сольв}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} - \Delta g_{{{\text{сольв}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}} \right) - \left( {\Delta g_{{{\text{асс}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} - \Delta g_{{{\text{асс}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}} \right), \\ \end{gathered} $Первое слагаемое $\Delta g_{{{\text{гидр}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} - \Delta g_{{{\text{гидр}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}$ может быть рассчитано на основании данных [26]: $\Delta g_{{{\text{гидр}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ – – $\Delta g_{{{\text{гидр}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}$ = (–57.3) – (–78.6) = 21.3 ккал/моль.
Данные по свободным энергиям сольватации тиоцианат- и хлорид-ионов отсутствуют. Но очевидно, что $\Delta g_{{{\text{сольв}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ > $\Delta g_{{{\text{сольв}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}$ и соответственно разность $\Delta g_{{{\text{сольв}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ – $\Delta g_{{{\text{сольв}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}$ > 0, т.е. второе слагаемое всегда будет уменьшать $\Delta g_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ и приводить к нивелированию анионообменного сродства, хотя величину второго слагаемого можно рассчитать, используя инертные растворители, например алифатические углеводороды. Тем не менее, ни первое, ни второе слагаемое не зависят от природы и размера четвертичного аммониевого катиона. Свободные энергии ассоциации рассчитываются по уравнению:
(5)
$\Delta g_{{{\text{асс}}}}^{{{\text{A}}{{{\text{n}}}^{ - }}}} = - 2.3RT\lg {{K}_{{{\text{асс}}}}}.$При этом из уравнения Айгена–Денисона–Рамзи–Фуосса
(6)
$\lg {{K}_{{{\text{асс}}}}} = - 2.6 + 3\lg \left( {{{r}^{ + }} + {{r}^{ - }}} \right) + 243\frac{{{{z}^{ + }}{{z}^{ - }}}}{{{\varepsilon }\left( {{{r}^{ + }} + {{r}^{ - }}} \right)}}$Важно, что параметр ближайшего подхода зависит от стерической доступности катионного центра. Причем чем крупнее катион, тем сильнее экранирован четвертичный атом азота, и тем более близкими оказываются значения параметров ближайшего подхода для анионов, размер которых невелик. В конечном итоге это приведет к снижению $\Delta g_{{{\text{асс}}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ – $\Delta g_{{{\text{асс}}}}^{{{\text{C}}{{{\text{l}}}^{ - }}}}$ и росту константы обмена тиоцианат-иона на хлорид. В табл. 2 представлены данные по константам обмена для ЧАС различного строения.
Таблица 2.
Значения логарифмов констант обмена тиоцианат-ионов на хлорид-ион для четвертичных аммониевых солей различного строения
| ЧАС | $\lg {\kern 1pt} K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{ДНФ}}}}$* | $\lg {\kern 1pt} K_{{{\text{SC}}{{{\text{N}}}^{ - }}}}^{{{\text{ДНФ}}}}$* | $\lg {\kern 1pt} K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ | $\lg {\kern 1pt} K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}} \pm s$ |
|---|---|---|---|---|
| ТЛ | 5.40 | 1.26 | 4.14 | 4.14 ± 0.07 |
| ТНОДА** | – | – | – | 4.48 ± 0.07 |
| 3,4,5-ТО | 5.32 | 1.32 | 4.00 | 4.00 ± 0.06 |
| 2,3,4-ТО** | – | – | – | 4.33 ± 0.08 |
| ТБ | 5.12 | 1.38 | 3.74 | 3.7 ± 0.2 |
| ТЭ | 4.91 | 1.41 | 3.50 | 3.50 ± 0.09 |
| ДОМ** | – | – | – | 3.63 ± 0.06 |
| ДМО** | – | – | – | 3.2 ± 0.1 |
| 3,4,5-ТМ | 4.75 | 1.46 | 3.29 | 3.29 ± 0.07 |
| 2,3,4-ТМ** | – | – | – | 2.57 ± 0.07 |
| МО | 4.59 | 1.05 | 3.54 | 3.5 ± 0.1 |
| МП | 4.86 | 1.31 | 3.55 | 3.6 ± 0.1 |
| ЦМ | 4.89 | 1.23 | 3.68 | 3.7 ± 0.1 |
| ХИН | 4.84 | 1.24 | 3.60 | 3.60 ± 0.09 |
Исходя из полученных данных, можно построить график зависимости константы обмена от длины углеводородного радикала при анионообменном центре 3,4,5-трис(додецилокси)бензилтриалкиламмония (рис. 2).
Рис. 2.
Зависимость логарифмов констант обмена тиоцианат-иона на хлорид-ион в системе вода–толуол от длины алкильных радикалов четвертичных аммониевых солей.
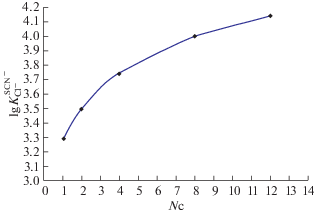
Эта зависимость описывается уравнением ln K = 0.345 ln NC + 3.274 (R2 = 0.9985), которое выведено с помощью прикладной программы Excel (NC – число атомов углерода в радикале при четвертичном атоме азота, K – константа обмена). Она хорошо согласуется с полученными нами аналогичными зависимостями для других анионов (рис. 3).
Рис. 3.
Зависимость логарифмов констант обмена от длины алкильных радикалов четвертичных аммониевых солей для нитрат-ионов (1) и перхлорат-ионов (2).
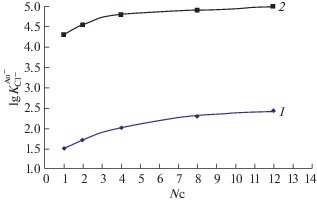
Для МО, МП, ЦМ, ХИН наблюдается иная зависимость (табл. 3). Так, численные значения констант обмена $\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{An}}}}$ достаточно близки к константе для ТЭ, несмотря на значительное различие в строении ЧАС. Это указывает на то, что решающее значение имеет близость размеров пиперидинового и морфолинового колец и хинуклидиновой структуры по сравнению со значительно отличающимися по длине линейными радикалами триалкильных ЧАС.
Таблица 3.
Значения логарифмов констант обмена перхлорат-, тиоцианат-, нитрат-ионов на хлорид-ион для различных четвертичных аммониевых солей
| ЧАС | $\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{NO}}_{{\text{3}}}^{ - }}}$ | $\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{SC}}{{{\text{N}}}^{ - }}}}$ | $\lg K_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{{{\text{ClO}}_{{\text{4}}}^{ - }}}$ |
|---|---|---|---|
| ТЦ | 2.42 | 4.14 | 5.19 |
| ТНОДА* | 2.34 | 4.48 | 5.18 |
| 3,4,5-ТО | 2.29 | 4.00 | 5.08 |
| 2,3,4-ТО | 2.20 | 4.33 | 5.24 |
| ТБ | 2.03 | 3.74 | 4.82 |
| ТЭ | 1.76 | 3.50 | 4.63 |
| ДОМ* | 1.71 | 3.63 | 4.34 |
| ДМО* | 1.22 | 3.20 | 3.97 |
| 3,4,5-ТМ | 1.46 | 3.29 | 4.27 |
| 2,3,4-ТМ* | 0.81 | 2.57 | 3.20 |
| МО | 2.08 | 3.54 | 4.48 |
| МП | 1.79 | 3.55 | 4.55 |
| ЦМ | 1.80 | 3.68 | 4.32 |
| ХИН | 1.67 | 3.60 | 4.74 |
Из табл. 2 и 3 видно, что направление изменения констант обмена с увеличением числа метильных заместителей зависит от размеров обменивающихся анионов. При обмене хлорид-ионов на более крупные анионы (тиоцианат-, перхлорат-) константы обмена снижаются.
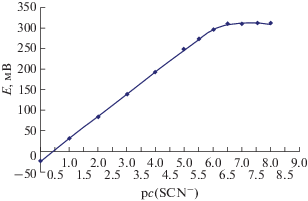
Тиоцианат-селективный электрод. На основании полученных значений констант обмена изготовлен пленочный тиоцианат-селективный электрод на основе ТЛ, в качестве пластификатора мембран использовали 1-БН. Электродная функция такого ИСЭ представлена на рис. 4.
Нижняя граница определяемых концентраций для данного ИСЭ составляет 5.6 × 10–7 М, линейный диапазон – 1.0 × 10–6–1 М, наклон функции 53.9 мВ/рс(SCN–).
Ниже приведены значения логарифмов коэффициентов селективности –lg KPot(SCN–, i) для тиоцианат-селективного электрода по отношению к тем мешающим анионам, которые наиболее широко распространены в реальных объектах, – нитратам, хлоридам, бромидам, гидрокарбонатам, сульфатам.
| Cl– | ${\text{NO}}_{3}^{ - }$ | Br– | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{HCO}}_{3}^{ - }$ |
| 4.7 ± 0.1 | 2.8 ± 0.1 | 3.8 ± 0.1 | 5.4 ± 0.1 | Менее –6 |
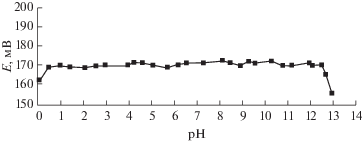
В табл. 4 дан краткий сравнительный анализ разработанного сенсора и известных ранее тиоцианат-селективный электродов. Видно, что разработанный сенсор превосходит по селективности, пределу обнаружения и широте диапазона рН указанные в табл. 4 электроды. Зависимость потенциала разработанного тиоцианат-селективного электрода от рН раствора представлена на рис. 5.
Таблица 4.
Сравнительный анализ разработанного сенсора и описанных ранее тиоцианат-селективных электродов
| Характеристика | [28]* | [29]** | [12]*** | [9]**** | Данная работа |
|---|---|---|---|---|---|
| Предел обнаружения, М | 5.0 × 10–6 | 2.5 × 10–6 | 8.9 × 10–6 | 6 × 10–6 | 5.6 × 10–7 |
| Наклон электродной функции, мВ/рс | 57.2 | 51.8 | 59.2 | 59.4 | 53.9 |
| Рабочий диапазон рН | 3.0–10.0 | – | 3–7 | 6.7 (фосфатный буферный раствор) | 0.5–12.5 |
| –lg KPot(SCN–, i) | I– 1.3; ${\text{ClO}}_{4}^{ - }$ 0.44; Cl– 2.53; ${\text{SO}}_{4}^{{2 - }}$ 4.83; ${\text{NO}}_{3}^{ - }$ 2.68; Br– 2.34 | Cl– 2.2; Br– 1.2; I– 0.7; ${\text{NO}}_{3}^{ - }$ 1.95; ${\text{ClO}}_{4}^{ - }$ 0.36 | ${\text{ClO}}_{4}^{ - }$ 0.33; I– 1.02; ${\text{NO}}_{3}^{ - }$ 2.11; Cl– 2.65; Br– 2.70; ${\text{SO}}_{4}^{{2 - }}$ 4.24 | ${\text{SO}}_{4}^{{2 - }}$3.77; Cl– 2.66; Br– 1.89; ${\text{NO}}_{3}^{ - }$ 1.62; I– 0.72; ${\text{ClO}}_{4}^{ - }$ 0.12 | Cl– 4.65; ${\text{SO}}_{4}^{{2 - }}$ 5.35; ${\text{NO}}_{3}^{ - }$ 2.80; Br– 3.75; ${\text{HCO}}_{3}^{ - }$ менее –6 |
* Состав мембраны ИСЭ: Fe(III)–фталоцианин, ПВХ, диоктилфталат. ** Состав мембраны ИСЭ: 2,2',2"-салицилидениминотриэтиламиножелезо(III) в нитробензоле (жидкостный электрод). *** Состав мембраны ИСЭ: ПВХ, тридодецилметиламмония хлорид, о-нитрофенилоктиловый эфир, 1-бензил-3-(4-нитрофенил)тиоуретан. **** Состав мембраны ИСЭ: тридодецилметиламмония хлорид, натрия тетракис[3,5-бис(трифторометил)фенил]борат, о‑нитрофенилоктиловый эфир, бис(2-краун-4).
Определение концентрации тиоцианат-ионов в слюне (cx) проводили методом стандартной добавки. Стандартный раствор тиоцианата калия готовили из фиксанала. Для определения брали по 8 мл слюны курящего и некурящего человека, разбавляли до 25 мл дистиллированной водой (Vх) и измеряли потенциал электрода, а затем вносили добавку стандартного раствора (с = 1 × 10–4 М) по каплям (V) с помощью пипетки так, чтобы изменение потенциала (ΔE) составило не менее 30 мВ. Концентрацию тиоцианат-ионов в образцах слюны рассчитывали по формуле:
В работе [7] сообщается, что повышенное содержание тиоцианатов в слюне курильщиков – это следствие превращения синильной кислоты, содержащейся в табачном дыме, который выводится из организма со слюной.
Список литературы
Sulistyarti H., Kolev S.D., Lim S. Development of flow injection method for online determination of thiocyanate based on oxidation by permanganate // Indones. J. Chem. 2010. V. 10. № 2. P. 167.
Аглюкова Э.Р., Биктимирова Н.Р., Аликина Е.Н. Исследование влияния катионов и анионов при определении тиоцианат-ионов в пробах сточных вод методом капиллярного электрофореза // Вестн. Пермского ун-та. 2015. Т. 17. № 117. С. 15.
Данилина Е.И., Абдулзалилова Р.Р. Модификации кинетического метода определения тиоцианат-иона по реакции Ландольта метилоранжа с броматом калия // Вестник ЮУрГУ. Серия “Химия”. 2013. Т. 5. № 3. С. 18.
Басова Е.М., Иванов В.М., Апендеева О.К. Спектрофотометрическое определение тиоцианат-ионов в пластовых водах // Вестн. Моск. ун-та. Сер. 2. Химия. 2014. Т. 55. № 1. С. 15.
Brown D.V., Chaniotakis N.A., Lee I.H., Ma S.C., Park S.B., Meyerhoff M.E., Nick R.J., Groves J.T. Mn(III)-porphyrin-based thiocyanate-selective membrane electrodes: characterization and application in flow injection determination of thiocyanate in saliva // Electroanalysis. 1989. № 1. P. 477.
Amini M.K., Shahrokhian S., Tangestaninejad S. Thiocyanate-selective electrodes based on nickel and iron phthalocyanines // Anal. Chim. Acta. 1999. V. 402. № 1–2. P. 137.
Абрамова Н.А., Фадеев В.В., Герасимов Г.А., Мельниченко Г.А. Зобогенные вещества и факторы (обзор литературы) // Клиническая и экспериментальная тиореоидология. 2013. Т. 2. № 1. С. 21.
Arvand M., Zanjanchi M.A., Heydari L. Novel thiocyanate-selective membrane sensor based on crown ether cetyltrimethyl ammonium thiocyanate ion-pair as a suitable ionophore // Sens. Actuators B. 2007. V. 122. № 1. P. 301.
Tossanaitada B., Masadome T., Imato T. Sequential injection analysis of thiocyanate ions using a microfluidic polymer chip with an embedded ion-selective electrode // Anal. Sci. 2014. V. 30. P. 507.
Hassan S.S.M., Ghalia M.H.A., Amr Abdel-Galil E., Mohamed A.H.K. Novel thiocyanate-selective membrane sensors based on di-, tetra-, and hexaimidepyridine ionophores // Anal. Chim. Acta. 2003. V. 482. № 1. P. 9.
Seguí M.J., Lizondo-Sabater J., Martínez-Máñez R., Sancenón F. Soto J. Linear polyamines as carriers in thiocyanate-selective membrane electrodes // Talanta. 2006. V. 68. № 4. P. 1182.
Lee K., Kang D.H., Choe J.E., Yun M., Jung-Min You, Go M.J., Lee J., Jeon S. The novel SCN– ion-selective electrode based on the 1-benzyl-3-(4-nitrophenyl)thio-urea ionophore // Bull. Korean Chem. Soc. 2014. V. 35. № 11. P. 3175.
Bühlmann Ph., Yahya L., Enderes R. Ion-selective electrodes for thiocyanate based on the dinuclear zinc(II) complex of a bis-N,O-bidentate Schiff base // Electroanalysis. 2004. V. 16. № 12. P. 973.
Vlascici D., Fagadar-Cosma E., Bizerea-Spiridon O. A new composition for Co(II)-porphyrin-based membranes used in thiocyanate-selective electrodes // Sensors. 2006. V. 6. № 8. P. 892.
Wen-Ju Xu, Chai Y.Q., Yuan R., Liu S.L. A novel thiocyanate-selective electrode based on a zinc-phthalocyanine complex // Anal. Bioanal. Chem. 2006. V. 385. № 5. P. 926.
Shehab O.R., Mansour A.M. New thiocyanate potentiometric sensors based on sulfadimidine metal complexes: experimental and theoretical studies // Biosens. Bioelectron. 2014. V. 57. P. 77.
Xu G., Dong W., Ren L. Research and application of thiocyanate-selective electrodes based on copper(II) complex with ethylene-diamine-bis-(salicylaldehyde) base as carrier // Adv. Mat. Res. 2012. V. 396–398. P. 2230.
Han W.-S., Hong T.-K., Lee Y.-H. Thiocyanate ion selective solid contact electrode based on Mn complex of N,N'-bis-(4-phenylazosalicylidene)-o-phenylene diamine ionophore // Am. J. Anal. Chem. 2011. V. 2. P. 731.
Benvidi A., Ghanbarzadeh M.T., Dehghan M., Mazloum-Ardakani M., Vafazadeh R. Thiocyanate ion selective electrode based on bis(N-3-methylphenyl salicylidenaminato)copper(II) ionophore // Chin. Chem. Lett. 2014. V. 25. № 12. P. 1639.
Popa I., Sorescu S.-L., Fagadar-Cosma E., Vlascici D. Determination of thiocyanate using an ironporphyrin-based sensor // Annals of West University of Timisoara. Series of Chemistry. 2011. V. 20. № 2. P. 105.
Рахманько Е.М., Егоров В.В., Окаев Е.Б., Помеленок Е.В. Высшие четвертичные аммониевые соли с повышенной стерической доступностью обменного центра – селективные обменники двухзарядных анионов // Доклады НАН Беларуси. 2003. Т. 47. № 6. С. 50.
Егоров В.В., Рахманько Е.М., Помеленок Е.В. Влияние стерической доступности обменного центра высших четвертичных аммониевых солей на анионообменную экстракцию однозарядных анионов // Вестн. БГУ. Серия 2. 2004. № 3. С. 3.
Корыта И., Штулик К. Ионоселективные электроды. М.: Мир, 1989. 268 с.ю
Старобинец Г.Л., Рахманько Е.М., Сорока Ж.С. Применение кислотных красителей для определения констант анионообменных экстракционных равновесий // Журн. неорг. химии. 1978. Т. 23. № 6. С. 1628.
Цыганов А.Р., Рахманько Е.М., Старобинец Г.Л. Анионообменная экстракция кислотных красителей солями тринонилоктадециламмония // Весцi акадэмii навук Беларусi. 1997. № 4. С. 9.
Краткий справочник физико-химических величин / Под ред. Мищенко К.П., Равделя А.А. Л.: Химия. Ленингр. отд-ние, 1967. 182 с.
Egorov V.V., Rakhman’ko E.M. Ion association effects of lipophilic quaternary ammonium salts in ion-exchange and potentiometric selectivity / Chemical Problems of the Development of New Materials and Technologies: Сб. статей. Вып. 1 / Под ред. Ивашкевича О.А. Минск: БГУ, 2003. С. 340.
Amini M.K., Shahrokhian S., Tangestaninejad S. Thiocyanate-selective electrodes based on nickel and iron phthalocyanines // Anal. Chim. Acta. 1999. V. 402. P. 137.
Aslan N., Kenar A., Atakol O., Kiliç E. Iodide, thiocyanate and perchlorate-selective liquid membrane electrodes based on tris(2,2',2"-salicylidene-imino)triethylamine-iron(III) // Erciyes Üniversitesi Fen Bilimleri Enstitüsü Dergisi. 2009. V. 25. № 1–2. P. 237.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии