Журнал аналитической химии, 2020, T. 75, № 5, стр. 422-429
Идентификация примесей в высокочистом арсине методом хромато-масс-спектрометрии
А. Ю. Созин a, *, О. Ю. Чернова a, Т. Г. Сорочкина a, А. П. Котков a, b, Н. Д. Гришнова a, b, Д. М. Полежаев b, Г. В. Пушкарев b, А. А. Буланова c
a Институт химии высокочистых веществ имени Г.Г. Девятых Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
b АО “НПП “Салют”
603950 Нижний Новгород, ул. Ларина, 7, Россия
c Нижегородский государственный университет имени Н.И. Лобачевского, химический факультет
603600 Нижний Новгород, просп. Гагарина, 23, Россия
* E-mail: Sozin@ihps.nnov.ru
Поступила в редакцию 20.02.2019
После доработки 02.04.2019
Принята к публикации 04.12.2019
Аннотация
Метод хромато-масс-спектрометрии применили для исследования примесного состава арсина, синтезированного по реакции хлорида мышьяка с боргидридом натрия. Для разделения примесей использовали капиллярные адсорбционные колонки с сорбентами: модифицированным силикагелем и политриметилсилилпропином. Примеси идентифицировали путем сравнения их масс-спектров с данными базы NIST, с литературными данными, а также восстановлением их структуры по осколочным ионам. В арсине идентифицировали примеси постоянных газов, предельных и непредельных углеводородов С1–С6, хлорсодержащих, кислородсодержащих, ароматических углеводородов, летучих неорганических гидридов, алкилпроизводных арсина, триметилфторсилана, серооксида углерода, диметилсульфида. Впервые получены масс-спектры примесей C2H3AsH2, CH3AsHC2H5, C2H5As2H3.
Высокочистый арсин – основной исходный материал для выращивания из паровой фазы эпитаксиальных слоев и гетероэпитаксиальных структур на основе полупроводниковых соединений А3В5 – арсенидов галлия, алюминия и индия, широко используемых в полупроводниковых приборах [1, 2]. Технические характеристики приборов, изготовленных из эпитаксиальных и гетероэпитаксиальных структур, полученных с использованием высокочистого арсина, во многом определяются природой и концентрацией остаточных примесей. Согласно современным требованиям, уровень чистоты арсина, применяемого в электронике, должен составлять не менее 99.99994%, а содержание в нем электрически активных летучих примесей, содержащих серу, германий, кремний и другие элементы второй и шестой групп таблицы Менделеева, не должно превышать уровня (1–2) × 10–7%.
Основным методом получения арсина является восстановление соединений мышьяка водородом [3]. В таком арсине установлены примеси постоянных газов, углеводородов С1–С6, бензола, хлорсодержащих углеводородов, гидридов элементов 3–6 групп Периодической системы [4–16]. Для получения высокочистого арсина, а также совершенствования технологии его глубокой очистки важно располагать наиболее полной информацией о его примесном составе.
Для определения молекулярных примесей в арсине применяют газовую хроматографию, ИК-спектроскопию, масс-спектрометрию, хромато-масс-спектрометрию [14]. Наиболее перспективным методом является хромато-масс-спектрометрия. Ее использование в сочетании с капиллярными колонками даст возможность достичь высокоэффективного хроматографического разделения примесей и обеспечить их надежную идентификацию. Использованию хромато-масс-спектрометрии для анализа арсина посвящены работы [6, 13]. Отмечено, что ее применение позволило идентифицировать новые примеси и достичь высокой чувствительности их определения. Расширить информацию о составе примесей в высокочистом арсине возможно за счет применения капиллярных колонок с различной селективностью и анализа различных фракций, выделенных при его очистке и содержащих сконцентрированные примеси.
Цель настоящей работы – идентификация примесей в арсине с использованием метода хромато-масс-спектрометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследовали примесный состав арсина, полученного по реакции хлорида мышьяка(III) AsCl3 в виде водного раствора и тетрагидридобората натрия (NaBH4) [3, 17]. Исследовали образцы после синтеза, очищенные низкотемпературной ректификацией, и фракции, содержащие сконцентрированные в процессе очистки примеси. Использовали хромато-масс-спектрометр Agilent 6890/MSD 5973N с квадрупольным масс-анализатором. Арсин из баллонов вводили в прибор с помощью разработанной нами вакуумной системы, выполненной из трубок из нержавеющей стали марки 12Х18Н10Т внутренним диаметром 4 мм и включающей мембранные краны Hy-Lok ВВ-55С (ТУ 9В4.463.263). Пробы дозировали в хроматографическую колонку с помощью автоматического крана-дозатора Valco Instruments Cо. Inc.. Объем пробы составлял 50 мкл.
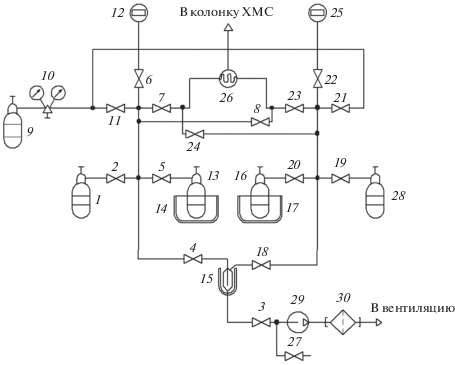
Система пробоотбора приведена на рис. 1. Она разработана с учетом возможности применения независимых газовых линий для дозирования проб как очищенного арсина, так и содержащего сконцентрированные примеси. Это необходимо для снижения влияния “памяти” установки на результаты анализа. Система также позволяет оставшийся после дозирования в системе напуска арсин конденсировать в отдельный приемный баллон, не разбавляя его образцами другого качества, что важно при его дальнейшей переработке.
Рис. 1.
Система дозирования арсина в хромато-масс-спектрометр: 1 – баллон с очищенным арсином; 2–8, 11, 18, 19, 20–24 – вентили; 9 – баллон с промывочным газом; 10 – редуктор; 12, 25 – датчики давления; 13, 16 – баллоны для конденсации арсина; 14, 17 – сосуды Дьюара с жидким азотом; 26 – кран-дозатор; 27 – вентиль для напуска воздуха в насос; 28 – баллон с арсином, содержащим сконцентрированные примеси; 29 – форвакуумный насос 2НВР-5ДМ (ТУ 26-04-604-79); 30 – коробка противогазная БКФ.
Для хроматографического разделения примесей с невысокими относительно арсина температурами кипения и молекулярными массами использовали капиллярную адсорбционную колонку GS-GasPro 60 м × 0.32 мм с сорбентом модифицированным силикагелем (Agilent Technologies, Inc., США). Для определения примесей с более высокими температурами кипения и молекулярными массами использовали колонку с сорбентом политриметилсилилпропином (ПТМСП) 25 м × × 0.26 мм, df = 0.25 мкм, полученную авторами работы [18].
Условия разделения примесей следующие: в случае колонки GS-GasPro начальная температура составляла 30°С (8 мин), затем ее повышали до 100°С со скоростью 10 град/мин; в случае колонки c ПТМСП начальная температура составляла 30°С (8 мин), затем ее повышали со скоростью 10 град/мин до 130°С. Во время выхода максимальной концентрации арсина питание детектора отключали для предотвращения перегорания катода. При использовании колонки GS-GasPro время отключения зависело от давления напуска пробы. Для определения примесей фосфина и этилена напускаемое давление составляло 0.1 атм. Его превышение ведет к перекрыванию этих примесей пиком основного компонента, т.е. делает их определение невозможным [13]. В остальных случаях давление напускаемой пробы в хроматографические колонки составляло до 1.0 атм. При давлении 0.1 атм время отключения составляло 7.10–9.00 мин, при давлении 1.0 атм – 6.20–9.00 мин. При использовании колонки с ПТМСП детектор включали через 2.20 мин после начала анализа.
В качестве газа-носителя использовали высокочистый гелий марки 7.0 (ТУ 0271-001-45905715-02). Чтобы сохранить его чистоту по пути в хромато-масс-спектрометр, в наиболее критическом месте его подачи использовали специальный редуктор фирмы “Restek” (модель № 20662), который не содержит полимерных газопроницаемых прокладочных материалов. Линейная скорость газа-носителя в колонках составляла 30 см/с. Масс-спектры примесей регистрировали в режиме ионизации электронами с энергией 70 эВ. Диапазон сканирования масс составлял 12–350 а. е. м. Температура источника ионов составляла 150°С, квадрупольного фильтра масс – 106°С, интерфейса – 200°С. Примеси идентифицировали путем компьютерного автоматического сравнения экспериментальных масс-спектров с библиотечными из базы данных NIST или с опубликованными в литературе [13, 19–24]. Для исключения появления в пробе арсина ложных примесей перед его анализом выполняли холостые опыты. Для этого напускали в прибор высокочистый гелий, используемый для промывки системы дозирования. В тех случаях, когда в базе данных NIST и в литературных источниках отсутствовали масс-спектры исследуемых соединений, их идентифицировали на основании закономерностей фрагментации при ионизации [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2, 3 приведены примеры хроматограмм арсина, содержащего сконцентрированные примеси, полученные с помощью используемых нами колонок. Установленные примеси и соответствующие им времена удерживания в колонках GS-GasPro и с ПТМСП приведены в табл. 1 и 2. Из приведенных хроматограмм и данных по временам удерживания примесей видно, что большинство установленных веществ элюируется в виде отдельных хроматографических пиков, что существенно упрощает их идентификацию.
Рис. 2.
Хроматорамма арсина, полученная с использованием колонки GS-GasPro. Давление пробы 0.1 атм: 1 – N2, 2 – O2, 3 – Ar, 4 – CH4, 5 – C2H6, 6 – GeH4, 7– N2O, 8 – CO2, 9 – C2H4, 10 – РН3, 11 – C2H2, 12 – COS, 13 – C3H8, 14 – H2S, 15 – CCl2F2, 16 – C3H6, 17 – CH3AsH2.
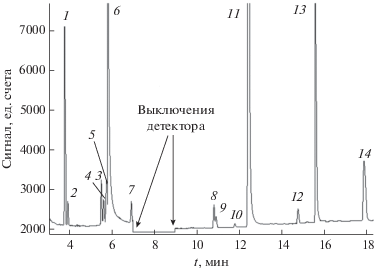
Рис. 3.
Хроматорамма арсина, полученная с использованием колонки с политриметилсилилпропином: 1 – С3Н6, 2 – СH3OH, 3 – С3Н8, 4 – CCl2F2, 5 – C2H5Cl, 6 – C2H3Cl, 7 – CH3AsH2, 8 – C4H8 (1-пропен-2-метил), 9 – изо-C4H10, 10 – C4H8 (1-бутен), 11 – CH2Cl2, 12 – н-C4H10, 13 – (CH3)2S, 14 – (CH3)2O (ацетон), 15 – C2H3AsH2, 16 – C3H5Cl (1‑пропен-3-хлор), 17 – C3H7Cl (2-хлорпропан), 18 – (CH3)3SiF, 19 – (CH3)2AsH, 20 – C2H5AsH2, 21 – C2H2Cl2 (1,2-транс-дихлорэтилен), 22 – C2H2Cl2 (1,2-цис-дихлорэтилен), 23 – C5H12 (2-метилбутан), 24 – CHCl3, 25 – н-C5H12, 26 – C2H4Cl2 (1,2-дихлорэтан), 27 – As2H4, 28 – изо-C3H7AsH2, 29 – С4H8O2 (этилацетат), 30 – C3H5AsH2 (пропенарсин), 31 – C6H6, 32 – CH3AsHC2H5, 33 – C3H7AsH2 (пропиларсин), 34 – C2HCl3, 35 – C6H12 (2-метил-1-пентен), 36 – C6H14 (2-метилпентан), 37 – н-C6H14, 38 – As2H3CH3 (метилдиарсин), 39 – C2H3Cl3 (1,1,2-трихлорэтан), 40 – C7H8 (толуол), 41 – C2Cl4, 42 – C6H5Cl, 43 – C2H5As2H3 (этилдиарсин).

Таблица 1.
Примеси, идентифицированные с использованием колонки GS-GasPro 60 м × 0.32 мм и их времена удерживания
| Примесь (номер на хроматограмме рис. 2) | Время удерживания, мин | Примесь (номер на хроматограмме) | Время удерживания, мин |
|---|---|---|---|
| N2 (1) | 3.84 | РН3 (10) | 7.02 |
| O2 (2) | 3.85 | C2H2* (11) | 10.79 |
| Ar (3) | 3.85 | COS* (12) | 10.87 |
| CH4 (4) | 3.98 | C3H8 (13) | 11.79 |
| C2H6 (5) | 5.57 | H2S (14) | 12.44 |
| GeH4 (6) | 5.65 | CCl2F2* (15) | 14.74 |
| N2O* (7) | 5.77 | C3H6 (16) | 15.60 |
| CO2 (8) | 5.83 | CH3AsH2* (17) | 17.87 |
| C2H4 (9) | 6.96 |
Таблица 2.
Примеси, идентифицированные с использованием колонки с политриметилсилилпропином 25 м × × 0.26 мм (df = 0.25 мкм) и их времена удерживания
| Примесь (номер на хроматограмме рис. 3) | Время удерживания, мин | Примесь (номер на хроматограмме) | Время удерживания, мин |
|---|---|---|---|
| С3Н6 (1) | 2.25 | C5H12, 2-метилбутан* (23) | 13.04 |
| СH3OH* (2) | 2.47 | CHCl3 (24) | 13.18 |
| С3Н8 (3) | 2.50 | н-C5H12 (25) | 13.64 |
| CCl2F2* (4) | 2.76 | C2H4Cl2, 1,2-дихлорэтан (26) | 13.92 |
| C2H5Cl* (5) | 2.83 | As2H4 * (27) | 14.38 |
| C2H3Cl* (6) | 2.85 | изо-C3H7AsH2* (28) | 14.78 |
| CH3AsH2* (7) | 3.85 | С4H8O2, этилацетат* (29) | 15.00 |
| C4H8, 1-пропен-2-метил (8) | 5.40 | C3H5AsH2, пропенарсин* (30) | 15.14 |
| изо-C4H10 (9) | 5.65 | С6H6 (31) | 15.31 |
| C4H8 1-бутен* (10) | 6.31 | CH3AsHC2H5* (32) | 15.45 |
| CH2Cl2 (11) | 6.54 | C3H7AsH2, пропиларсин* (33) | 15.59 |
| н-C4H10 (12) | 7.22 | C2HCl3* (34) | 16.04 |
| (CH3)2S* (13) | 8.90 | C6H12, 2-метил-1- пентен* (35) | 16.20 |
| (CH3)2O, ацетон* (14) | 9.19 | C6H14, 2-метилпентан* (36) | 16.41 |
| C2H3AsH2* (15) | 9.24 | н-C6H14 (37) | 16.89 |
| C3H5Cl, 1-пропен-3-хлор* (16) | 10.61 | As2H3CH3* (38) | 17.30 |
| C3H7Cl, 2-хлорпропан* (17) | 10.87 | C2H3Cl3, 1,1,2-трихлорэтан* (39) | 17.47 |
| (CH3)3SiF* (18) | 10.90 | C7H8, толуол (40) | 18.51 |
| (CH3)2AsH* (19) | 11.01 | C2Cl4* (41) | 19.14 |
| C2H5AsH2* (20) | 11.17 | C6H5Cl* (42) | 19.69 |
| C2H2Cl2, 1,2-транс-дихлорэтилен (21) | 11.51 | C2H5As2H3, этилдиарсин* (43) | 21.01 |
| C2H2Cl2, 1,2-цис-дихлорэтилен (22) | 12.06 |
Примеси постоянных газов, диоксида углерода, углеводородов С1–С3, серооксида углерода, летучих неорганических гидридов, дихлордифторметана разделяли с помощью колонки GS-GasPro. При использовании колонки с ПТМСП эти вещества, за исключением С3Н6 и С3Н8, не отделяются от основного компонента, поэтому для их определения использовали только колонку GS-GasPro. Времена удерживания менее летучих веществ в ней достаточно велики, поэтому для их разделения более подходящей является колонка с ПТМСП.
Некоторые пики на хроматограммах являются составными и включают несколько веществ. Например, пик 1 на рис. 2 образован примесями N2, O2, Ar, которые между собой не делятся. Их идентифицировали по характеристическим ионам с m/z 28 (N2), 32 (O2) и 40 (Ar). Времена удерживания примесей C2H4 и РН3 (колонка GS-GasPro), СH3OH и С3Н8, C2H5Cl и C2H3Cl, (CH3)2O и C2H3AsH2, C3H7Cl и (CH3)3SiF, C3H7AsH2 и C2HCl3 (колонка с ПТМСП) близки. Разница времен их удерживания не превышает 0.06 мин. Получение индивидуальных масс-спектров этих примесей и отнесение их к конкретным веществам проводили путем вычитания пиков ионов, принадлежащих соседнему мешающему компоненту. Идентификация этих веществ не вызвала затруднений ввиду существенного отличия их масс-спектров.
При сравнении экспериментальных масс-спектров примесей с данными из базы NIST коэффициенты их подобия составили 0.87–0.95, что обеспечило высокую надежность идентификации. Коэффициенты подобия масс-спектров примесей с временами удерживания 5.65 и 17.87 мин в колонке GS-GasPro и 3.85, 9.24, 11.01, 11.17, 14.38, 14.78, 15.14, 15.45, 15.59, 17.30 и 21.01 мин в колонке ПТМСП с библиотечными не превышали 0.38. Это указывало на их отсутствие в библиотеке NIST. В качестве таких возможных веществ рассматривали соединения мышьяка, которые могли образовываться как побочные продукты при синтезе арсина. Другими возможными примесями могли являться соединения элементов, являющихся соседями мышьяка по Периодической системе.
Эти вещества идентифицировали сравнением полученных масс-спектров и времен удерживания соединений As, Ge, Se, P со справочными и литературными данными [13, 19–24]. Таким способом идентифицировали примеси с временами удерживания 5.65 мин (GS-GasPro) – GeH4, 17.87 мин (GS-GasPro) и 3.85 мин (ПТМСП) – CH3AsH2, 11.01 мин (ПТМСП) – (CH3)2AsH, 11.17 мин (ПТМСП) – C2H5AsH2, 14.38 мин (ПТМСП) – As2H4, 15.14 мин (ПТМСП) – C3H5AsH2, 15.59 мин (ПТМСП) – C3H7AsH2, 17.30 мин (ПТМСП) – As2H3CH3.
В масс-спектрах остальных примесей отметили группу пиков с m/z 75–78, характерных для AsH3 [19], что указывало на возможную принадлежность их к производным арсина.
Масс-спектр примеси с временем удерживания 14.78 мин совпал с масс-спектром примеси C3H7AsH2 [22] с временем удерживания 15.59 мин. Эффективность их хроматографического разделения составила 6395 и 31830 тт/м соответственно. Вероятно, данная примесь является изомером соединения C3H7AsH2 и имеет формулу изо-C3H7AsH2. Этот вывод сделан на основе того, что на сорбенте ПТМСП, как показано в работах [18, 26, 27], размывание хроматографической зоны для разветвленных изоструктур существенно больше, чем для их неразветвленных аналогов.
Масс-спектры примесей c временами удерживания 9.24, 15.45, и 21.01 мин в колонке с ПТМСП в литературе не найдены. Их идентифицировали восстановлением структуры по осколочным ионам [25] и сравнением с известными масс-спектрами алкилпроизводных арсина.
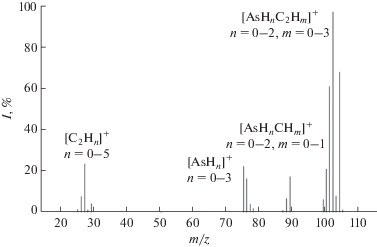
Масс-спектр примеси с временем удерживания 9.24 мин (рис. 4) близок по составу и относительной интенсивности пиков к масс-спектру C2H5AsH2 [22]. Имеющиеся отличия заключаются в отсутствии в рассматриваемом масс-спектре пиков с m/z 90 в группе с m/z 87–89 и 106, 107 в группе с m/z 99–105. Это может быть обусловлено отсутствием двух атомов водорода в молекуле C2H5AsH2. Таким образом, данная примесь имеет состав AsH2C2H3.
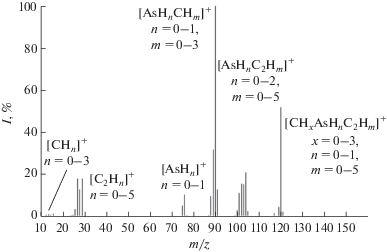
На рис. 5 приведен масс-спектр примеси с временем удерживания 15.45 мин. В нем есть пики с m/z 12–15, 75, 76, 87–91, 99–106, которые могут соответствовать ионам [СНn]+, [As]+, [AsH]+, [AsHnCHm]+ и [AsHnC2Hm]+. В нем также присутствуют две группы пиков с m/z 24–29 и 111–121, которые могут соответствовать ионам [С2Нn]+ (n = 0–5) и [AsC3Hn]+ (n = 0–9). Отсутствие в данном масс-спектре пиков с m/z 36–43, которые могли бы быть образованы ионами [C3Hn]+ (n = = 0–7), позволяет предположить, что неизвестным веществом является метилэтиларсин.
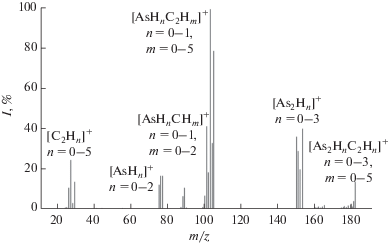
Масс-спектр примеси с временем удерживания 21.01 мин приведен на рис. 6. В нем имеются пики с m/z 75–77 и 150–153, соответствующие фрагментным ионам с одним и двумя атомами мышьяка. Группа пиков с m/z 24–29 свидетельствует о наличии в молекуле фрагмента С2H5. Пики с m/z 174–182 соответствуют ионам, содержащим два атома мышьяка и этильную группу. Следовательно, данная примесь является этилдиарсином.
Все идентифицированные в арсине примеси приведены в табл. 1 и 2. Это – постоянные газы, летучие неорганические гидриды, углеводороды С1–С6, хлор- и кислородсодержащие углеводороды, триметилфторсилан, диметилсульфид, серооксид углерода, толуол, хлорбензол, алкилпроизводные арсина и диарсина.
* * *
Таким образом, применение метода хромато-масс-спектрометрии в сочетании с капиллярными адсорбционными колонками позволило эффективно разделить и идентифицировать в арсине 56 примесных веществ. Сравнение полученных данных с известными из литературы [4–16] позволяет сделать вывод о том, что в арсине впервые идентифицировано 32 новых примесных вещества. Эти примеси попадают в арсин, скорее всего, из исходных веществ при его синтезе. Аналогичный вывод сделан в работах [6, 17]. Так, например, по данным [28, 29] примеси хлорсодержащих углеводородов в арсине также присутствуют в хлориде мышьяка(III). Алкилпроизводные арсина, диарсина и диарсин также могут образовываться на стадии синтеза арсина при участии исходных веществ и присутствующих в них примесей.
Работа выполнена в соответствии с Программой фундаментальных научных исследований государственных академий наук на 2019−2021 годы, № темы 0095-2019-0001.
Список литературы
Бланк Т.В., Гольдберг Ю.А. Полупроводниковые фотоэлектропреобразователи для ультрафиолетовой области спектра // Физика и техника полупроводников. 2003. Т. 37. № 9. С. 1025.
Бузынин Ю.Н., Гусев С.А., Данильцев В.М., Дроздов М.Н., Дроздов Ю.Н., Мурель А.В., Хрыкин О.И., Шашкин В.И. Монокристаллические слои GaAs, AlGaAs и InGaAs, полученные методом газофазной эпитаксии их металлоорганических соединений арсенида галлия // Письма в журн. техн. физики. 2000. Т. 26. № 7. С. 64.
Жигач А.Ф., Стасиневич Д.С. Химия гидридов. Л.: Химия, 1969. 676 с.
Девятых Г.Г., Крылов В.А., Ковалев И.Д., Осипова Л.И., Яньков С.В., Волкова Е.Н. Примесный состав образцов выставки-коллекции веществ особой чистоты // Высокочистые вещества. 1991. № 4. С. 7.
Девятых Г.Г., Засавицкий И.И., Ильин В.М., Максимов Г.А., Надеждинский А.И., Соловьев Ю.А., Хоршев В.А., Щапин С.М. ИК-спектрометр на перестраиваемых диодных лазерах для молекулярного анализа высокочистых веществ // Высокочистые вещества. 1990. № 6. С. 106.
Иванова Н.Т., Вислых Н.А., Воеводина В.В. Источник примесей при получении арсина и фосфина // Высокочистые вещества. 1990. № 5. С. 198.
Крылов В.А., Красотский С.Г., Малышев В.М., Салганский Ю.М. Криогенный метод концентрирования примесей водорода, аргона, кислорода и азота при их газохроматографическом определении в летучих неорганических гидридах // Журн. аналит. химии. 2001. Т. 56. № 11. С. 1137.
Иванова Н.Т. Аналитический контроль производства гидридов As, P, Si, B и смесей на их основе // Высокочистые вещества. 1989. № 6. С. 102.
Ежелева А.Е., Снопатин Г.Е., Малыгина Л.С. Применение пламенно-фотометрического детектора при хроматографическом анализе летучих неорганических гидридов особой чистоты // Журн. аналит. химии. 1979. Т. 34. № 12. С. 2308.
Девятых Г.Г., Зорин А.Д., Фролов И.Ф., Руновская И.В. Определение микропримесей некоторых летучих гидридов в моносилане, моногермане и арсине хроматографическим методом // Анализ полупроводниковых материалов. 1968. Т. 16. С. 159.
Ежелева А.Е., Малыгина Л.С., Крылов В.А. Применение фотоионизационного детектора при газохроматографическом определении летучих неорганических гидридов и некоторых органических веществ // Высокочистые вещества. 1987. № 3. С. 214.
Крылов В.А., Чернова О.Ю., Салганский Ю.М., Малыгина Л.С., Котков А.П. Высокочувствительное определение примесей углеводородов в арсине методом реакционной газовой хроматографии // Журн. аналит. химии. 2003. Т. 58. № 8. С. 841.
Крылов В.А., Чернова О.Ю., Созин А.Ю., Котков А.П. Хромато-масс-спектрометрический анализ арсина высокой чистоты // Заводск. лаборатория. Диагностика материалов. 2010. Т. 76. № 3. С. 13.
Крылов В.А. Анализ высокочистых летучих веществ // Журн. аналит. химии. 2002. Т. 57. № 8. С. 790.
Зайков А.А., Зырянов С.М., Пульников И.И., Скорынин Г.М., Власов В.А. Определение содержания газообразных примесей в высокочистом арсине при его очистке на газовых центрифугах // Известия Томского политехнического университета, 2006. Т. 309. № 3. С. 81.
Ежелева А.Е., Снопатин Г.Е., Чурбанов М.Ф., Приписнова Т.П., Второв Б.Г. Определение содержания постоянных газов в гидридах элементов IV–VI групп периодической системы // Журн. аналит. химии 1978. Т. 33. № 11. С. 2151.
Девятых Г.Г., Зорин А.Д. Летучие неорганические гидриды особой чистоты. М.: Наука, 1974. 206 с.
Березкин В.Г., Королев А.А., Хотимский В.С. Политриметилсилилпропин как адсорбент в капиллярной газовой хроматографии // Доклады Академии наук. 2000. Т. 370. С. 200.
Агафонов И.Л., Девятых Г.Г. Масс-спектрометрический анализ газов и паров особой чистоты. М.: Наука, 1980. 336 с.
Крылов В.А., Чернова О.Ю., Созин А.Ю. Хроматомасс-спектрометрическая идентификация примесей в изотопно-обогащенном силане // Масс-спектрометрия. 2007. № 2. С. 125.
Cheng C.N., Focht D.D. Production of arsine and methylarsine in soil and in culture // Appl. Environ. Microbiol. 1979. V. 38. № 3. P. 494.
Крылов В.А, Чернова О.Ю., Чернова О.Ю., Созин А.Ю., Котков А.П., Пушкарев Г.В. Хромато-масс-спектрометрическая идентификация примесей в фосфине высокой чистоты // Аналитика и контроль. 2012. Т. 16. № 2. С. 196.
Pantsar-Kallio M., Korpela A. Analysis of gaseous arsenic species and stability studies of arsine and trimethylarsine by gas chromatography-mass spectrometry // Anal. Chim. Acta. 2000. V. 410. P. 65.
Kösters J., Diaz-Bone R.A., Planer-Friedrih B., Rothweiler B., Hirner A.V. Identification of organic arsenic, tin, antimony and tellurium compounds in environmental samples by GC-MS // J. Mol. Struct. 2003. V. 661–662. P. 347.
Лебедев А.Т. Масс-спектрометрия в органической химии. М.: БИНОМ, Лаборатория знаний, 2003. 493 с.
Крылов В.А., Березкин В.Г., Чернова О.Ю., Салганский Ю.М., Созин А.Ю. Применение капиллярной газовой хроматографии для анализа высокочистого силана на содержание углеводородов // Журн. аналит. химии. 2005. Т. 60. № 9. С. 958.
Крылов В.А, Чернова О.Ю., Созин А.Ю. Хромато-масс-спектрометрическая идентификация примесей в силане природного изотопного состава и обогащенном изотопом 28Si //Аналитика и контроль. 2011. Т. 15. № 4. С. 421.
Крылов В.А. Газохроматографический анализ высокочистых летучих хлоридов. Дис. … докт.химени наук. Н. Новгород: ИХВВ РАН, 1991. 518 с.
Девятых Г.Г., Карпов Ю.А., Осипова Л.И. Выставка-коллекция веществ особой чистоты. М.: Наука, 2003. 236 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии