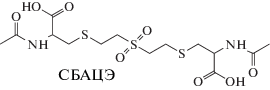Журнал аналитической химии, 2020, T. 75, № 8, стр. 714-720
Совместное определение аддуктов сернистого иприта с гуанином и ацетилцистеином в моче методом высокоэффективной жидкостной хроматографии–тандемной масс-спектрометрии высокого разрешения
О. И. Орлова a, *, Г. В. Каракашев a, Е. И. Савельева a
a Научно-исследовательский институт гигиены, профпатологии и экологии человека Федерального медико-биологического агентства России
188663 г.п. Кузьмоловский 3, Всеволожский район, Ленинградская область, ст. Капитолово, корп. № 93, Россия
* E-mail: orlolga@yandex.ru
Поступила в редакцию 23.04.2019
После доработки 08.08.2019
Принята к публикации 25.12.2019
Аннотация
Предложена методика совместного определения биомаркеров воздействия сернистого иприта (СИ, 2,2'-дихлордиэтилсульфид) – депуринизированного аддукта с ДНК (N7-гидроксиэтилтиоэтил гуанина) и аддукта с ацетилцистеином (АЦЦ) (1,1'-сульфонилбис[2-S-(N-ацетилцистеинил)этана]) в моче методом ВЭЖХ–тандемной масс-спектрметрии высокого разрешения с электрораспылительной ионизацией. Достигнутый предел количественного определения для обоих аналитов составляет 10 нг/мл. Градуировочные графики линейны в диапазоне 10–200 нг/мл. Методика апробирована при анализе образцов мочи, полученных после подкожного введения крысам СИ в нелетальной дозе (2 мг/кг) как в отсутствие терапии, так и при использовании АЦЦ в качестве скавенджера (антидота). Впервые на молекулярном уровне установлено положительное влияние терапии АЦЦ на кинетику выведения СИ из организма в первые часы после отравления и обосновано защитное влияние АЦЦ на ДНК при поражении сернистым ипритом.
Хотя механизмы действия отравляющих веществ на организм изучают на протяжении многих лет, открытыми до сих пор остаются многие вопросы, касающиеся их молекулярного действия при остром или хроническом отравлении [1]. Существует общий подход, который состоит в выявлении изменений клеточного метаболизма при воздействии отравляющих веществ и характеристик отставленной токсичности, однако он пока не нашел широкого применения. Появление высокочувствительных аналитических приборов и методик создало условия для развития новой научной области, занимающейся изучением образования, устойчивости, репарации аддуктов различных химических соединений с ДНК. Понимание этих процессов способствует установлению закономерностей метаболических процессов и механизма действия токсичных веществ, в том числе канцерогенов.
Аддукты с ДНК представляют собой важную категорию биомаркеров воздействия потенциальных канцерогенных и генотоксичных соединений. Изучение строения и содержания аддуктов в биопробах важно не только для целей биомониторинга воздействия токсичных химикатов и установления самого факта воздействия, но также вносит существенный вклад в получение фундаментальных знаний о механизме токсического действия химических соединений.
Механизм токсического действия сернистого и азотистого ипритов связывают с их высокой растворимостью в липидах, способностью проникать через клеточные мембраны и алкилировать пуриновые основания, входящие в состав ДНК и РНК. В результате повреждаются структуры нуклеиновых кислот, нарушаются биохимические процессы, обеспечивающие общую реактивность организма, регенерацию тканей, передачу наследственных признаков. Наиболее чувствителен к иприту гуанин [2].
Поскольку опасность поражения СИ продолжает оставаться актуальной в связи с угрозой террористических актов, локальных военных конфликтов, непреднамеренного контакта с затопленным или захороненным химическим оружием, актуальной остается и проблема идентификации продуктов распада СИ, установления факта поражения людей, находившихся в месте инцидента. Кроме того, остаются неясными способы эффективной терапии поражений ипритом. Поскольку к иприту не разработано специфических антидотов, помощь пострадавшим ограничивается стандартной терапией ожоговых поражений, симптоматической терапией при поражении органов дыхания. В последние годы активно исследуют, так называемые “чистильщики” или скавенджеры, содействующие быстрому выведению отравляющих веществ из организма. При этом распределение и сроки существования биомаркеров в организме меняются, что необходимо учитывать при разработке и применении биоаналитических методик.
Классическими биомаркерами СИ, принятыми в качестве аналитов при установлении факта его воздействия на организм, являются тиодигликоль (кровь, моча), β-лиазные метаболиты (моча), 1,1'-сульфонилбис[2-S-(N-ацетилцистеинил)этан] (моча) [3]. Представляют интерес работы, в которых предприняты попытки объединить определение нескольких биомаркеров в одной методике, создавая, таким образом, инструмент для однозначной интерпретации как факта воздействия СИ, так и для выяснения сущности процессов, протекающих в организме после отравления [4]. Несмотря на то, что механизмы патологического действия СИ изучают уже в течение многих лет [5], недавние работы показали, что ответ организма на действие СИ значительно сложнее, чем это считалось ранее [6]. Реагируя с нуклеофильными центрами молекулы ДНК, СИ вызывает ее алкилирование и, как следствие, опасные мутации. Идентификация и количественное определение аддуктов СИ с ДНК имеют важное значение для оценки степени повреждения генетического материала и установления связи между образованием аддуктов и биологическим конечными показателями (мутациями, разрывами нитей ДНК и т.д.) [7–9]. В то же время для подбора эффективной терапии при поражениях как СИ, так и другими алкилирующими агентами, к которым относятся, например, противораковые препараты, важным аспектом является изучение степени и характера химических взаимодействий между алкилирующим агентом, антидотом и внутренними системами организма. Разработке методик определения аддуктов СИ с ДНК разными способами и в разных матрицах посвящены работы [10–17].
1,1'-Сульфонилбис[2-S-(N-ацетилцистеинил)-этан] (СБАЦЭ) является продуктом взаимодействия СИ с белками и β-лиазой. Это экзогенное соединение, присутствие которого однозначно говорит об имевшем место факте воздействия СИ на организм человека. Попытки определения СБАЦЭ методом газовой хроматографии–масс-спектрометрии не увенчались успехом из-за его термической нестабильности. Методом ВЭЖХ с детектированием тандемной масс-спектрометрией (ВЭЖХ–МС/МС) с ионизацией термораспылением достигнут предел обнаружения 25 нг/мл для диметилпроизводного [18]. Существенно более низкий предел обнаружения (1 нг/мл) получен при использовании ВЭЖХ–МС/МС с ионизацией электрораспылением для недериватизированного коньюгата [19]. В последнем случае аналит концентрировали из подкисленной мочи на полимерных патронах для твердофазной экстракции (ТФЭ) и детектировали в режиме регистрации отрицательных ионов с мониторингом заданных реакций. В работе [20] предложена методика определения СБАЦЭ в плазме и моче крыс, включающая ТФЭ и анализ методом ВЭ-ЖХ–МС/МС с ионизацией электрораспылением в режиме ионизации отрицательных ионов. Авторам удалось достичь предела обнаружения 0.05 нг/мл, при этом значимые количества СБА-ЦЭ удалось обнаружить в моче даже спустя 22 дня после экспозиции.
Отмечено [21, 22], что АЦЦ является скавенджером (поглотителем), введение которого позволяет значительно снизить повреждения, возникающие при воздействии СИ. Хотя введение АЦЦ позволяет снизить проявление симптомов интоксикации у пострадавших от воздействия СИ, до конца не выяснено, обусловлен ли этот эффект лишь физиологическими процессами или также и химическими взаимодействиями. В опытах in vitro введение АЦЦ не способствовало снижению концентрации иприта в сыворотке крови после инкубирования в течение 2 ч при 37°С [21]. Авторы данных работ делают вывод о том, что имеющий место защитный эффект связан скорее с физиологическими процессами, например, со связыванием активных форм кислорода, чем с прямым химическим взаимодействием СИ со скавенджерами. Той же точки зрения придерживаются авторы работы [23], изучившие действие антиоксидантов в эндотелиальных клетках, экспонированных хлорамбуцилом, являющимся производным азотистого иприта. Данные о влиянии введения АЦЦ на содержание СБАЦЭ в биоматрицах в литературе не обнаружены.
Особый интерес представляет изучение кинетики выведения обоих аддуктов как в ситуации без лечения АЦЦ, так и в случае применения антидотной терапии. В литературе отсутствуют данные эксперимента in vivo, демонстрирующие влияние скавенджера на кинетику выведения аддукта N7-гидроксиэтилтиоэтил гуанина (N7-HETEG) и СБАЦЭ. Авторы работы [21] изучали образование и структуру аддуктов с альбумином, образующихся при инкубировании сыворотки крови с СИ в сочетании с различными дозами АЦЦ в формате in vitro, не уделяя внимания аддуктам с ДНК. В то же время для оценки защитного потенциала АЦЦ, а также изменения кинетических параметров, необходимо исследовать процессы, протекающие in vivo. Эта информация может оказаться весьма полезной не только для понимания биохимии протекающих процессов, прогнозирования лечения, но и для оценки возможных сроков установления факта воздействия СИ.
Цель настоящей работы – исследование кинетики выведения биомолекулярных аддуктов СИ при терапии скавенджерами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы: В работе использовали сернистый иприт (2,2'-дихлордиэтилсульфид) (ГСО 8248-2003); ацетонитрил (ТУ 6-09-5497-91); муравьиную кислоту (ос. ч., CAS 64-18-6); патроны для ТФЭ: Supelclean ENVI-8 (500 mg) фирмы “Supelco” (США), кат. № 57231; OASIS HLB (60 mg) фирмы “Waters” (США), кат. № WAT094226; Supelco HLB кат. № 54182-U; Supelco C18, Sep-Pack C18 фирмы “Supelco” кат. № 55284-U; ацетилцистеин фирмы “Sigma” кат. № A9165-5G. Коньюгат АЦЦ и сульфона иприта (1,1'-сульфонилбис[2-S-(N-ацетилцистеинил)этан]) синтезирован в лаборатории 27 Научного центра МО РФ, 8-(1-гидроксибутан-2-иламино)-1,3,7-триметил-1-пурин-2,6(3Н,7Н) и N7-гидроксиэтилтиоэтил гуанин синтезированы в лаборатории химического моделирования НИИ ГПЭЧ.
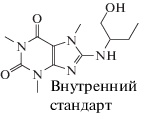
Условия хромато-масс-спектрометрического анализа. При анализе холостой пробы мочи, содержащей искусственные добавки N7-HETEG в различных концентрациях, установлено, что на площадь пика иона-предшественника существенно влияют матричные эффекты. Таким образом, для получения достоверных результатов необходимо проводить расчеты только по площади пика иона-продукта и использовать нормировку по внутреннему стандарту. В качестве внутреннего стандарта использовали 8-(1-гидроксибутан-2-иламино)-1,3,7-триметил-1-пурин-2,6(3Н,7Н). Это заведомо экзогенное соединение обладает близким к целевому веществу строением и дает четкие характеристичные пики в масс-спектре.
В работе использовали тандемный масс-спектрометр высокого разрешения LTQ Orbitrap Velos с электрораспылительной ионизацией при атмосферном давлении и программным обеспечением для управления и обработки данных Xcalibur. Регистрацию N7-HETEG и СБАЦЭ проводили по массовым числам ионов-предшественников (m/z 445.07675 и m/z 256.07924) и ионов-продуктов (m/z 403.06454 и m/z 105.03690) соответственно. Разрешение по массам 70 000.
Хроматографическое разделение проводили на колонке Agilent SB-C8 (150 мм × 4.6 мм × 1.8 мкм) в режиме градиентного элюирования. Состав подвижной фазы: элюент A – вода с добавкой 0.1% HCOOH, элюент Б – ацетонитрил с добавкой 0.1% HCOOH, расход подвижной фазы 400 мкл/мин, температура термостата колонки 35°С. Установлен следующий режим элюирования: 0 мин – 90% А, 2 мин – 90% А, 7 мин – 10% А, 9 мин – 10% А, 9.1 мин – 90% А, 12 мин – 90% А.
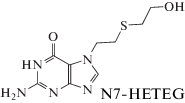
Структурные формулы аналитов и полученные масс-спектральные характеристики представлены в табл. 1.
Таблица 1.
Структурные формулы и молекулярные массы аналитов
| Название метаболита СИ, его структурная формула | m/z иона-продукт | Характеристичные переходы | tR, мин |
|---|---|---|---|
| 357.0607 | 445.07675 → 403.06454*; 445.07675 → 357.0607 | 4.84 ± 0.1 | |
| 257.07924 | 256.07924 → 105.03690* | 3.98 ± 0.1 | |
| 281.14879 | 282.15607 → 210.09855* | 7.252 ± 0.1 |
Подготовка проб к анализу. Оптимальная схема подготовки проб к анализу включала кондиционирование патрона ENVI-8 двукратной промывкой 1 мл ацетонитрила с последующей трехкратной промывкой 1 мл воды, загрузку 1 мл мочи, содержащей 10 нг внутреннего стандарта, элюирование аналитов двумя порциями по 1 мл 60%-ного ацетонитрила в 5%-ной муравьиной кислоте (v/v), перерастворение объединенного элюата в 100 мкл смеси равных объемов ацетонитрила и воды, центрифугирование и разбавление 100 мкл воды. Схема приведена на рис. 1. Промывку патронов после загрузки образца из процедуры ТФЭ пришлось исключить, поскольку на этой стадии не удалось избежать потерь N7-HETEG, в то же время именно при определении N7-HETEG в моче крыс наблюдали значительные матричные эффекты, которые удалось несколько снизить путем разбавления экстракта 100 мкл воды, а также при оптимизации условий хроматографирования.
Градуировочные характеристики. Для получения градуировочных графиков приготовили и проанализировали серию проб мочи крыс с внесением N7-HETEG и СБАЦЭ с концентрациями 1, 10, 50, 100 и 200 нг/мл и добавкой внутреннего стандарта с концентрацией 10 нг/мл. На основании полученных данных вычислили относительные площади пиков N7-HETEG и СИ-АЦЦ и построили графики зависимости относительной площади пика от концентрации аналитов, которые описываются уравнениями у = 0.0021х (R2 = = 0.9951) и у = 0.0007х (R2 = 0.9884), соответственно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
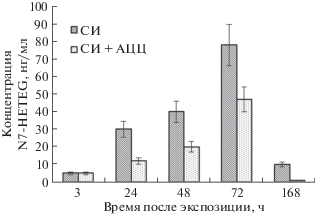
Ранее нами разработана методика [24] определения аддукта N7-HETEG, образующегося в результате воздействия СИ по положению N7 гуанина в молекуле ДНК, в моче методом ВЭЖХ–МС/МС высокого разрешения с применением внутреннего стандарта и исследован профиль экскреции N7-HETEG с мочой крыс, получивших СИ подкожно в дозе 1/4 LD50. В реальных условиях лицам, пострадавшим от воздействия СИ, скорее всего, будет оказана первая помощь, возможно, с применением известных средств, снижающих токсичность иприта. В условиях введения скавенджера профиль экскреции может измениться, что повлечет за собой возможное возникновение проблем либо неточностей при установлении факта и времени воздействия СИ. В рамках исследования представляла интерес не только оценка содержания N7-HETEG в моче крыс, но также сравнение количества аддукта СБАЦЭ в группах крыс, получавших терапию и без нее.
Для решения этих задач нами был поставлен эксперимент in vivo с использованием двух групп подопытных животных, в котором одной группе крыс вводили СИ (2 мг/кг), а второй группе крыс – СИ в той же дозе и АЦЦ (200 мг/кг). Выбор именно АЦЦ в качестве скавенджера объясняется его доступностью и низкой токсичностью. Кроме того, известно, что применение АЦЦ способствует смягчению симптомов воздействия как СИ [21, 22], так и ряда медицинских препаратов на основе азотистого иприта, применяющихся в химиотерапии онкобольных и обладающих аналогичным действием [25–27]. Для оценки содержания N7-HETEG и СБАЦЭ в моче разработали методику их совместного определения, включающую пробоподготовку методом ТФЭ на патроне, перерастворение и анализ методом ВЭЖХ–МС/МС высокого разрешения. Определение нескольких биомаркеров в рамках одной методики является прогрессивным подходом, поскольку не только экономит все виды ресурсов, но и позволяет с максимальной точностью фиксировать соотношение биомаркеров, отражающих связанные между собой метаболические процессы, в одной и той же пробе и в один и тот же момент времени.
Некоторые трудности возникли при разработке процедуры подготовки проб, что было вполне ожидаемо, так как для анализа выбрали вещества с сильно различающимися свойствами. Так, Родиным показано [28], что “высокая полярность СБАЦЭ и существование в заряженной форме не позволяют добиться высоких степеней извлечения определяемого вещества, таким образом твердофазная экстракция на удерживание не подходит для проведения пробоподготовки”. N7-HETEG существенно менее полярное соединение, его извлечение и концентрирование из мочи, в отличие от СБАЦЭ, проводят в режиме удерживания, а не пропускания. В нашу задачу входило модифицировать разработанную нами ранее методику пробоподготовки мочи [24] таким образом, чтобы обеспечить удовлетворительное извлечение и концентрирование обоих интересующих веществ. Взяв за основу схему ТФЭ из работы [29], мы опробовали несколько вариантов ее модификации, включая подбор патронов для ТФЭ и условий элюирования. Для отработки методики приготовили серию проб мочи крыс с внесением N7-HETEG и СИ-АЦЦ. Для разработки методики совместного определения аддуктов СИ с ДНК и АЦЦ требовалось подобрать способ очистки и извлечения, оптимальный для обоих компонентов. С этой целью опробовали следующие виды коммерчески доступных патронов для ТФЭ: OASIS HLB, Supelco HLB, Supelclean ENVI-8, Supelco C18, Sep-Pack C18. На патроны наносили по 1 мл мочи крыс, содержащей искусственные добавки обоих аналитов в концентрации 100 нг/мл, и варьировали элюенты и режимы элюирования. Эффективность извлечения аналитов оценивали по площадям пиков ионов-продуктов N7-HETEG (m/z 105.03690) и СБАЦЭ (m/z 403.06454). В качестве элюентов изучали различные системы растворителей (метанол–вода, ацетонитрил–вода) в разных объемных соотношениях. Для дальнейшей работы выбрали патрон ENVI-8 и элюирование подкисленной смесью ацетонитрил–вода (60 : 40, по объему).
Поскольку аналиты регистрируют по ионам-продуктам, методика обладает высокой селективностью, эффект переноса отсутствует. Предел количественного определения для обоих аналитов равен 10 нг/мл, погрешность определения каждого составляет 15%.
Следует отметить значительный матричный эффект для N7-HETEG. Заметно снизить его влияние не удалось ни за счет варьирования условий пробоподготовки, ни подбором условий элюирования. Добиться небольшого снижения матричного эффекта удалось путем разбавления уже готовой для ввода пробы равным объемом воды. Возможно, такое значительное проявление матричного эффекта связано с наличием в моче крыс соединения, значения m/z которого совпадают c ионом-предшественником N7-HETEG (256.08), в связи с чем идентифицировать аддукт следует только по иону-продукту. В целом при использовании внутреннего стандарта большое количество проведенных опытов позволяет добиться удовлетворительных значений относительного стандартного отклонения (0.15) и воспроизводимости разработанной методики.
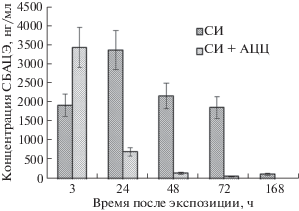
Апробация разработанной методики в опыте in vivo. Условия работы с экспериментальными животными соответствовали “Правилам лабораторной практики в Российской Федерации (GLP)” (утверждены Приказом Министерства здравоохранения Российской Федерации 19.06.2003 № 267). Для апробации разработанной методики провели токсикологический эксперимент с двумя группами крыс, одна из которых получала внутрибрюшинно СИ в дозе 1/4 LD50 (2 мг/кг), другая – ту же дозу СИ в сочетании с терапией АЦЦ. Раствор АЦЦ вводили двукратно за 3 и за 0.5 ч до введения СИ в дозе 200 мг/кг. Предварительно у всех задействованных в эксперименте крыс отбирали образцы мочи (контрольная проба). В опыте использовали 10 крыс (5 крыс экспонировали СИ и 5 крыс – СИ и АЦЦ). Мочу крыс отбирали с использованием метаболических камер через 3 ч, 1, 2, 3, 7 сут после экспозиции. Полученные пробы анализировали согласно разработанной методике. Мочу каждой крысы анализировали отдельно и затем усредняли полученный результат.
На основе полученных данных построили диаграммы, иллюстрирующие кинетику выведения аддуктов с мочой. Диаграмма на рис. 2 описывает кинетику выведения N7-HETEG с мочой. Видно, что в пробах мочи крыс, получавших терапию АЦЦ, содержание аддукта N7-HETEG значительно ниже, что свидетельствует о защитном действии скавенджера, препятствующего повреждению ДНК.
Диаграмма на рис. 3 иллюстрирует кинетику выведения аддукта СИ–АЦЦ с мочой. Видно, что при использовании скавенджера выведение аддукта происходит более активно в быстрой фазе элиминации, период его выведения у крыс, получавших лечение, значительно сокращен по сравнению с особями, которым не вводили АЦЦ. Таким образом, разработанная методика позволила на молекулярном уровне продемонстрировать влияние скавенджера на скорость выведения токсиканта из организма и позволила сделать обоснованное предположение о защитном действии АЦЦ от поражающего действия СИ на ДНК.
* * *
Таким образом, разработанная методика позволяет совместное определять N7-HETEG (аддукта СИ с ДНК) и СБАЦЭ, подобраны условия концентрирования и очистки пробы мочи, хроматографического разделения, определены характеристичные ионы для масс-спектрометрического детектирования. Следует отметить важность использования внутреннего стандарта, так как матричные влияния, особенно при работе с большой выборкой животных, могут значительно искажать результаты определений. В целом исследование механизмов действия скавенджеров и антидотов на молекулярном уровне перспективно для разработки схемы лечения не только в случаях применения химоружия, но также в медицине для подбора оптимальной терапии при длительной химиотерапии.
Список литературы
Everley P.A., Dillman J.F. Genomics and proteomics in chemical warfare agent research: Recent studies and future applications // Toxicol Lett. 2010 V. 198(3). P. 297.
Большая Медицинская энциклопедия. http://xn–90aw5c.xn–c1avg/index.php/ (22.11.2018).
Black R.M. An overview of biological markers of exposure to chemical warfare agents // J. Anal. Toxicol. 2008. V. 32. P. 2.
Xua H., Nie Z., Zhang Y., Li C. Four sulfur mustard exposure cases: Overall analysis of four types of biomarkers in clinical samples provides positive implication for early diagnosis and treatment monitoring // Toxicol. Reports. 2014. V. 1. P. 533.
Kehe K., Balszuweit F., Steinritz D., Thiermann H. Molecular toxicology of sulfur mustard-induced cutaneous inflammation and blistering // Toxicology. 2009. V. 263. P. 12.
Kehe K., Balszuweit F., Emmler J., Kreppel H., Jochum M., Thiermann H. Sulfur mustard research–strategies for the development of improved medical therapy // Eplasty. 2008. V. 8. P. e32.
Tarantini A., Maitreb A., Lefebvre E., Marques M., Marie C. Relative contribution of DNA strand breaks and DNA adducts to the genotoxicity of benzo[a]pyrene as a pure compound and in complex mixtures // Mutat. Res. 2009. V. 671. P. 67.
Martinez G.R., Loureiro A.P.M., Marques S.A., Miyamoto S., Yamaguchi L.F. Oxidative and alkylating damage in DNA // Mutat. Res. 2003. V. 544. P. 115.
Garner R.C. The role of DNA adducts in chemical carcinogenesis // Mutat. Res. 1998. V. 402. P. 67.
Wei Y., Yue L., Liu Q., Chen J., Xie J. A sensitive high performance liquid chromatography-positive electrospray tandem mass spectrometry method for N7-[2-[(2-hydroxyethyl)thio]-ethyl]guanine determination // J. Chromatogr. B. 2011. V. 879. P. 1707.
Batal M., Boudry I., Cléry-Barraud C., Mouret S., Douki T. Relative yields of monomeric and dimeric adducts induced by Sulphur mustard in isolated and cellular DNA as determined by HPLC/tandem mass spectrometry // Toxicol. Environ. Chem. 2013. V. 95. P. 260.
Fidder A., Noort D., de Jong L.P.A., Benschop H.P., Hulst A.G. N7-(2-hydroxyethylthioethyl)-guanine: a novel urinary metabolite following exposure to sulphur mustard // Arch. Toxicol.1996. V. 70. P. 854.
van der Schans G.P., Mars-Groenendijk R., de Jong L.P.A., Benschop H.P., Noort D. Standard operating procedure for immunuslotblot assay for analysis of DNA/sulfur mustard adducts in human blood and skin // J. Anal. Toxicol. 2004. V. 28. P. 316.
Niu T.Q., Matijasevic Z., Austin-Ritchie P., Stering A., Ludlum D.B. A 32P-postlabeling method for the detection of adducts in the DNA of human fibroblasts exposed to sulfur mustard // Chem.-Biol. Interact. 1996. V. 100. P. 77.
Singh R., Farmer P. B. Liquid chromatography-electrospray ionization-mass spectrometry: the future of DNA adduct detection // Carcinogenesis. 2006. V. 27. P. 178.
Ludlum D.B., Austinritchie P., Hagopian M., Niu T.Q., Yu D. Detection of sulfur mustard-induced DNA modifications // Chem.-Biol. Interact. 1994. V. 91. P. 39.
Yue L., Wei Y., Chen J., Shi H. Abundance of four sulfur mustard-DNA adducts ex vivo and in vivo revealed by simultaneous quantification in stable isotope dilution-ultrahigh performance liquid chromatography-tandem mass spectrometry // Chem. Res. Toxicol. 2014. V. 27. P. 490.
Black R.M., Jakubowski R.W. Biological fate of sulphur mustard, 1,1'-thiobis(2-chloroethane): identification of beta-lyase metabolites and hydrolysis products in human urine // Xenobiotica. 1995. V. 25. P. 167.
Read R. W., Black R. M. Analysis of the sulfur mustard metabolite 1,1'-sulfonylbis[2-S-(N-acetylcysteinyl)etha-ne] in urine by negative ion electrospray liquid chromatography-tandem mass spectrometry // J. Anal. Toxicol. 2004. V. 28. P. 352.
Rodin I., Braun A., Savelieva E., Rybalchenko I., Ananieva I., Shpigun O. Rapid method for the detection of metabolite of sulfur mustard 1,1'-sulfonylbis[2-s-(n-acetylcysteinyl)ethane] in plasma and urine by liquid chromatography-negative electrospray-tandem mass spectrometry // J. Liq. Chromatogr. Relat. Technol. 2011. V. 34. № 16. P. 1676.
Siegert M., Kranawetvogl A., Thiermann H., John H. N‑Acetylcysteine as a chemical scavenger for sulfur mustard: New insights by mass spectrometry // Drug Test Anal. 2018. V. 10. № 2. P. 243.
Shohrati M., Karimzadeh I., Saburi A., Khalili H. The role of N-acetylcysteine in the management of acute and chronic pulmonary complications of sulfur mustard: A literature review // Inhal. Toxicol. 2014. V. 26. № 9. P. 507.
Steinritz D., Schmidt A., Simons T. Ibrahim M., Morguet C., Balszuweit F., Thiermann H., Kehe K. Chlorambucil (nitrogen mustard) induced impairment of early vascular endothelial cell migration – Effects of a-linolenic acid and N-acetylcysteine // Chem.-Bio. Interact. 2014. V. 219. P. 143.
Орлова О.И., Каракашев Г.В., Шмурак В.И., Абзианидзе В.В., Савельева Е.И. Определение N7-[2-[(2-гидроксиэтил)-тио]-этил]-гуанина в моче крыс как маркера воздействия сернистого иприта // Вестник СПбГУ. Физика и химия. 2017. Т. 4(62). № 3. С. 313. (Orlova O. I., Karakashev G.V., Shmurak V.I., Abzianidze V.V., Savelieva E.I. Determination of N7-[2-[(2-hydroxyethyl)thio]-ethyl]guanine in urine as biomarker of exposure of sulfur mustard // Vestnik SPbSU. Phys. Chem. 2017. V. 4(62). № 3. P. 313.)
Mansour H.H., Shereen M. El Kiki, Hasan H.F. Protective effect of N-acetylcysteine on cyclophosphamide-inducedcardiotoxicity in rats // Health Environ. Toxicol. Pharm. 2015. V. 40. P. 417.
Experimental and Clinical Progress in Cancer Chemotherapy / Ed. Muggia F.M. New York, USA: University Medical Center, 1985.
Kurauchi K., Nishikawa T., Miyahara E., Okamoto Y., Kawano Y. Role of metabolites of cyclophosphamide in cardiotoxicity // BMC Res. Notes. 2017. V. 10. P. 406.
Родин И.А. Дис. … докт. хим. наук. М.: Московский государственный университет имени М.В. Ломоносова, 2016. 277 с.
Zhang Y., Nie Z., Chen J., Guo L., Wu B. Simultaneous determination of four sulfur mustard-DNA adducts in rabbit urine after dermal exposure by isotope-dilution liquid chromatography-tandem mass spectrometry // J. Chromatogr. B. 2014. V. 961. P. 29.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии