Журнал аналитической химии, 2020, T. 75, № 8, стр. 692-701
Дисперсионная жидкостно-жидкостная микроэкстракция пестицидов с применением в качестве экстрагентов ионных жидкостей
Е. А. Бессонова a, В. А. Деев a, *, Л. А. Карцова a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Петродворец, Университетский просп., 26, Россия
* E-mail: hitcherv@mail.ru
Поступила в редакцию 22.11.2019
После доработки 17.01.2020
Принята к публикации 21.02.2020
Аннотация
Установлено, что ионные жидкости (ИЖ) на основе имидазола можно применять в качестве экстрагентов в дисперсионной жидкостно-жидкостной микроэкстракции комбинированных препаратов пестицидов (имидаклоприда, бифентрина, циперметрина, карбофоса, фозалона и диазинона) с последующим их определением методом ВЭЖХ с тандемным масс-спектрометрическим детектированием с электрораспылительной ионизацией. Изучено влияние природы ИЖ (1-гексил-3-метилимидазолия тетрафторборат, 1-гексил-3-метилимидазолий бис(трифторметилсульфонил)имид, 1-бутил-3-метилимидазолий гексафторфосфат, [C4MIM][PF6]) и объема диспергирующего растворителя (ацетонитрил, метанол, ацетон), времени экстракции, рН раствора пробы и высаливающего эффекта на эффективность извлечения аналитов. Установлено, что максимальные степени извлечения (86–99%) пестицидов достигаются при использовании ацетонитрила в качестве диспергирующего растворителя и ионной жидкости [C4MIM][PF6] в качестве экстрагента. Отсутствие влияния величины рН на распределение аналитов между водной и органической фазами подтверждает распределительный механизм экстракции. Оценено влияние ионной жидкости на ионизацию пестицидов, для ее снижения предложены условия реэкстракции пестицидов в гексан.
В экологическом мониторинге природных объектов одной из важных задач является определение следовых количеств пестицидов в водных объектах, что обусловлено их повышенной устойчивостью к внешним воздействиям в сочетании с высокой токсичностью для живых организмов как самих пестицидов, так и продуктов их разложения. Определяющими этапами являются очистка анализируемого образца и концентрирование исследуемых аналитов. Твердофазная экстракция (ТФЭ) наиболее востребована для подготовки водных объектов к хроматографическому или электрофоретическому анализу. Однако длительное время извлечения, сложные многостадийные процедуры и дорогие картриджи в ряде случаев ограничивают применение этого варианта. В последние годы получил широкое распространение простой и эффективный способ пробоподготовки – дисперсионная жидкостно-жидкостная микроэкстракция (dispersive liquid−liquid microextraction, DLLME, ДЖЖМЭ). Данный режим проведения экстракции требует небольших объемов (порядка мкл) экстрагирующих растворителей и позволяет достигать высоких степеней концентрирования аналитов. Суть метода состоит в следующем: небольшой объем смеси диспергирующего и экстрагирующего растворителей быстро впрыскивают в водный раствор образца с помощью шприца. В результате экстрагент диспергируется в водном образце в виде мелких капель с большой площадью поверхности, что способствует значительному увеличению скорости массообмена и эффективному извлечению аналитов в капли экстрагирующего растворителя.
Поиск новых экологически чистых и безопасных экстрагентов по-прежнему актуален. В качестве экстрагентов для извлечения и концентрирования различных органических и неорганических соединений в водных образцах успешно зарекомендовали себя ионные жидкости (ИЖ) [1–10], нашедшие широкое применение в хроматографических и электрофоретических методах разделения [11–14]. Ионные жидкости характеризуются низким давлением паров, негорючестью, высокой химической и термической стабильностью и, что наиболее существенно для экстракции, легко изменяемыми физико-химическими свойствами путем различных сочетаний катионов и анионов в их составе. Это позволяет влиять на селективность извлечения аналитов. Ионные жидкости эффективно применяли в качестве экстрагентов для ДЖЖМЭ ионов металлов из водных и биологических образцов [15], остаточных лекарственных препаратов из биологических объектов [16, 17].
В работе [16] исследовано 11 коммерчески доступных ИЖ в качестве экстрагентов для эффективного извлечения бензодиазепинов из крови с последующим их определением методом ВЭЖХ с тандемным масс-спектрометрическим детектированием (ВЭЖХ–МС/МС). Отмечено, что использование в этом случае ИЖ с длинными алкильными радикалами нецелесообразно из-за стерических затруднений при взаимодействии с аналитами, а наличие катионов имидазолия и пиридиния более эффективно по сравнению с аммонийными и пирролидиниевыми ИЖ. Применению ионных жидкостей 1-гексил-3-метилимидазолий гексафторфосфата ([C6MIM][PF6]), 3-метил-1-октилимидазолий гексафторфосфата ([C8MIM][PF6]) в качестве экстрагентов при ДЖЖМЭ некоторых пестицидов (паратион-метил, фоксим, диэтофенкарб, хлорбензурон, альфа-циперметрин, меперфлутрин, тетраметрин), инсекцтицидов и фунгицидов посвящены публикации [17–25].
Возможна реализация двух механизмов экстракции с участием ИЖ: распределительного и ионообменного [26–29]. Нейтральные аналиты экстрагируются ИЖ в основном по распределительному механизму [27], а заряженные (например, ионы металлов) – по механизму ионного обмена [28, 29].
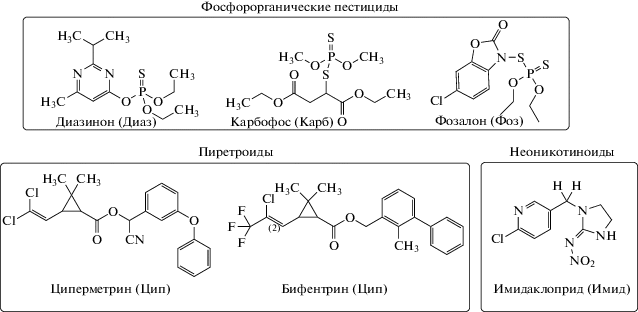
Комбинирование пестицидов (включая азот-, серо- и фосфорсодержащие соединения) – важный резерв повышения биологической и экономической эффективности применения химических средств защиты растений [30, 31]. При их совместном использовании возникает синергетический эффект, способствующий снижению адаптации вредных организмов к применяемым препаратам и уменьшению вводимой дозы данных соединений. В качестве исследуемых веществ в данной работе взяты имидаклоприд из класса неоникотиноидов, синтетические пиретроиды бифентрин и циперметрин и инсектициды из группы фосфорорганических пестицидов карбофос, фозалон и диазинон (рис. 1). Такой выбор обусловлен наличием большого числа коммерческих препаратов для защиты растений от вредителей, в составе которых содержатся смеси данных аналитов.
Цель исследования – выявление аналитических возможностей имидазолиевых ионных жидкостей для селективной экстракции и концентрирования аналитов, относящихся к разным классам пестицидов, из водных объектов с применением дисперсионной жидкостной микроэкстракции и последующее определение аналитов методом обращено-фазовой (ОФ) ВЭЖХ с тандемным масс-спектрометрическим детектированием с электрораспылительной ионизацией.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты. Соляная кислота ос. ч.; NaOH ч. д. а.; H3PO4 х. ч; NaH2PO4 ⋅ 2H2O х. ч.; хлорид натрия х. ч.; ацетат аммония (Реахим, Россия), уксусная кислота х. ч. (Реахим, Россия), муравьиная кислота для ВЭЖХ (Acros organics, США); растворители гексан, дихлорметан, хлороформ, ацетон х. ч., метанол для ВЭЖХ (Acros organics, США), ацетонитрил для ВЭЖХ (Baker, Польша). Ионные жидкости 1-бутил-3-метилимидазолий гексафторфосфат ([C4MIM][PF6]), 1-гексил-3-метилимидазолий бис(трифторметилсульфонил)имид ([C6MIM][NTf2]), 1-гексил-3-метилимидазолия тетрафторборат ([C6MIM][BF4]) (Acros organics, США). Стандарты пестицидов имидаклоприд (Имид), циперметрин (Цип), бифентрин (Биф), карбофос (Карб), диазинон (Диаз), фозалон (Фоз) (Sigma-Aldrich, Германия).
Исходные растворы аналитов (2.0 мг/мл) получали растворением точных навесок пестицидов в метаноле. Рабочие растворы готовили путем последовательного разбавления исходных растворов деионизированной водой (удельное сопротивление 18 МОм см). Растворы хранили при –20°С.
Оборудование. Эксперименты проводили на хромато-масc-спектрометре LCMS8030 (Shimadzu, Япония) с тройным квадрупольным массспектрометрическим детектором. Для сбора и обработки хроматографических данных использовали программное обеспечение LabSolution.
Применяли центрифугу СМ-50М (Elmi, Латвия), весы аналитические Pioneer (OHAUS, США) 0.1 мг с пределом взвешивания 210 г, автоматические дозаторы BIOHIT (5–50 мкл, 50–200 мкл, 200–1000 мкл), систему деионизации Milli Q Synthesis, систему для твердофазной экстракции для 12 патронов (CHROMABOND, MACHEREY-NAGEL), рН-метр HI 2210-2216 (Hanna, Румыния), микропробирки для микропроб Эппендорфа полипропиленовые емк. 1.5 мл, пробирки центрифужные емк. 10 мл (полипропиленовые, конические, градуированные, с винтовой крышкой).
Приготовление растворов стандартов и рабочих растворов. Для приготовления растворов стандартов точную навеску каждого из пестицидов массой 0.0020 ± 0.0001 г растворяли в 1 мл метанола. Растворы стандартов хранили в морозильной камере до хроматографического анализа при –4°С. Рабочие растворы готовили разбавлением растворов стандартов.
Условия хромато-масс-спектрометричеcкого определения пестицидов. Пестициды определяли методом ОФ ВЭЖХ. Хроматографическая колонка Zorbax BonusRP 3.5мкм, 2.1 × 100 мм. Подвижная фаза: фаза А – 40 мМ ацетат аммония, фаза В – СН3OH. Градиентный режим элюирования 20–85% фаза В (8 мин), 85% фаза В (8–15 мин), 85–95% фаза В (15–15.5 мин), 95% фаза В (15.5–18 мин), 95–20% фаза В (18.0–18.5 мин). Скорость подвижной фазы 0.3 мл/мин. Объем вводимой пробы 20 мкл.
Условия масс-спектрометрического детектирования: электрораспылительная ионизация при положительной полярности, напряжение на капилляре +4.5 кВ, скорость распыляющего газа 3 л/мин, скорость потока и температура осушающего газа 15 л/мин и 250°С соответственно. Условия фрагментации в режиме мониторинга выбранных реакций (multiple reaction monitoring, MRM) при масс-спектрометрическом детектировании определяемых пестицидов приведены в табл. 1. Самые интенсивные MRM-переходы (фрагмент материнского иона) выбраны для количественного анализа (табл. 1). Пределы обнаружения аналитов (ПО) рассчитывали по отношению сигнал/шум 3 : 1.
Таблица 1.
Значения MRM-переходов пестицидов
| Соединение | MRM-переход, m/z | Энергия соударения (СЕ), эВ |
|---|---|---|
| Диазинон [М + H] + |
305.0 → 169.00 | –20 |
| 305.0 → 153.10 | –20 | |
| 305.0 → 97.05 | –35 | |
| Карбофос [М + H] + |
331.00 → 127.10 | –15 |
| 331.00 → 99.15 | –25 | |
| 331.00 → 285.00 | –10 | |
| Циперметрин [М + NH4] + |
433.10 → 191.00 | –15 |
| Бифентрин [М + NH4] + |
440.15 → 181.15 | –15 |
| 440.15 → 166.20 | –45 | |
| Фозалон [М + H] + |
368.00 → 182.05 | –15 |
| 368.00 → 111.05 | –40 | |
| 368.00 → 138.05 | –30 | |
| Имидаклоприд [М + H] + |
256.05 → 175.20 | –19 |
| 256.05 → 209.10 | –15 | |
| 256.05 → 210.10 | –10 |
Выбор условий экстракции пестицидов методом дисперсионной жидкостно-жидкостной микроэкстракции. Влияние природы ионных жидкостей и диспергирующих растворителей на эффективность извлечения пестицидов из водных сред. Водный раствор смеси пестицидов (2 мл), содержащий 0.005 мг/мл каждого из аналитов, помещали в пробирку емк. 10 мл с завинчивающейся крышкой с коническим дном. Готовили отдельно раствор диспергирующего растворителя (400 мкл), содержащего 0.0500 ± 0.0001 г ионной жидкости. В качестве диспергирующего растворителя испытали метанол, ацетонитрил и ацетон, а в качестве экстрагента – три имидазолиевые ИЖ – [C4MIM][PF6], [C6MIM][NTf2], [C6MIM][BF4]. Приготовленный раствор экстрагента в диспергирующем растворителе быстро вводили с помощью микрошприца в раствор образца, затем в течение 2 мин обрабатывали ультразвуком в ультразвуковой ванне, далее смесь охлаждали при –4°С в течение 10 мин и центрифугировали в течение 10 мин при 3500 об/мин без охлаждения для отделения ИЖ в отдельную фазу. Мелкие капли диспергированной ИЖ осаждались на дне пробирки. Верхнюю водную фазу собирали дозатором в отдельную пробирку и проводили хроматографический анализ. Нижнюю фазу с ИЖ также отбирали в микропробирку и хранили при –4°С для дальнейшего анализа. После экстракции 25 мкл фазы с ИЖ растворяли в 50 мкл метанола, из которых 20 мкл вводили в хроматографическую колонку.
В серии предварительных экспериментов установили, что максимальная степень извлечения пестицидов достигается при использовании в качестве экстрагента ионной жидкости [C4MIM][PF6] и диспергирующего растворителя – ацетонитрила. Именно их использовали в дальнейшем при оптимизации условий ДЖЖМЭ. Варьировали массу ИЖ (0.06–0.20 г), объем выбранного диспергирующего растворителя (0.2–1.0 мл), pH анализируемого образца (2.0–7.0), концентрацию соли (0–10 мас. %), время экстракции (1–6 мин) и соотношение (по объему) ИЖ–метанол (от 1 : 1 до 1 : 4) при разбавлении раствора ИЖ перед вводом образца в хроматографическую колонку.
Выбор массы ионной жидкости и объема диспергирующего растворителя. В экспериментах по выбору массы ИЖ использовали 0.4 мл ацетонитрила, содержащего различные навески ИЖ [C4MIM][PF6] (0.060, 0.080, 0.100, 0.150, 0.200 г), и 2 мл водных растворов стандартов (0.005 мг/мл). Для выбора объема ацетонитрила к 0.2, 0.3, 0.4, 0.5, 0.6, 1.0 мл добавляли 0.2000 ± 0.0001 г ИЖ [C4MIM][PF6] и вводили в водный раствор стандартов пестицидов объемом 2 мл.
Влияние pH раствора образца на степень извлечения пестицидов. Готовили два раствора стандартов пестицидов: в дистиллированной воде (рН 5.4) и в 1%-ном водном растворе муравьиной кислоты (pH 2.2).
Влияние концентрации соли на степень извлечения. К 2.0 мл водного раствора пестицидов добавляли 0.040, 0.080, 0.120, 0.160 и 0.200 г NaCl. Проводили дисперсионную жидкостно-жидкостную микроэкстрацию по описанной выше схеме с учетом условий, выбранных в предыдущих экспериментах. Использовали раствор, содержащий 300 мкл ацетонитрила и 0.200 г ИЖ [C4MIM][PF6]. После экстракции аналитов в ИЖ органическую фазу отбирали, разбавляли метанолом и проводили анализ методом ВЭЖХ–МС/МС.
Условия реэкстракции пестицидов из раствора ионной жидкости. В качестве экстрагента для реэкстракции пестицидов выбрали н-гексан. К раствору ИЖ, содержащей пестициды, добавляли гексан в разных объемных соотношениях ИЖ–гексан (1 : 2, 1 : 4, 1 : 6, 1 : 8). Смесь помещали в ультразвуковую ванну на 10 мин, затем центрифугировали, отбирали слой гексана в пробирку Эппендорф и выпаривали раствор досуха под током воздуха. Сухой остаток вновь растворяли в 50 мкл метанола. Полученный раствор центрифугировали и вводили 20 мкл образца в хроматографическую колонку
Оценка влияния ионной жидкости в составе пробы в условиях ВЭЖХ–МС. Для уменьшения влияния ИЖ на ионизацию пестицидов образец разбавляли по следующей схеме: к 25 мкл ИЖ [C4MIM][PF6], содержащей пестициды после экстракции, добавляли метанол в соотношении (по объему) ИЖ–СH3OH 1 : 1, 1 : 2, 1 : 3, 1 : 4.
Влияние ИЖ рассчитывали по следующей формуле:
Оценку степени извлечения (Ri) пестицидов проводили следующим образом:
а) при анализе водных растворов пестицидов до и после экстракции:
где Si – площадь пика аналита после экстракции в водной фазе, S0 – площадь пика аналита в исходном водном растворе;б) при анализе водного раствора пестицидов до экстракции и органической фазы после экстракции:
где Sk – площадь пика аналита в органической фазе после экстракции; S0 – площадь пика аналита в водном растворе до экстракции; Vi – объем органической фазы после экстракции, мл; V0 – объем водного раствора до экстракции, мл.Оценку степени реэкстракции пестицидов проводили по формуле:
где Sj – концентрация аналита после реэкстракции, мкг/мл; Vi – объем фазы после реэкстракции, мл; S0 – концентрация аналитов в ионной жидкости до реэкстракции, мкг/мл; V0 – объем ионной жидкости до реэкстракции, мл.Расчет коэффициента концентрирования (Кк) пестицидов проводили по формуле:
где So – площадь пика аналита в исходном растворе до экстракции, а SИЖ – площадь пика аналита после экстракции (измеренная в фазе ионной жидкости).РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определяемые пестициды – ароматические карбоциклические и гетероциклические соединения, содержащие в качестве заместителей электроноакцепторные и электронодонорные группы: имидаклоприд, бифентрин, циперметрин, карбофос, фозалон и диазинон. Значения предельно допустимых концентраций (ПДК) в природных водах и коэффициенты распределения аналитов в системе октанол–вода (lg P), характеризующие их гидрофобность, приведены в табл. 2.
Таблица 2.
Логарифмы коэффициентов распределения определяемых пестицидов в системе октанол–вода (lg P) при рН 7 (20°C) и значения их ПДК в воде водоемов [28]
| Пестицид | lg P | ПДК, мг/л |
|---|---|---|
| Имидаклоприд | 0.57 | 0.03 |
| Циперметрин | 5.3 | 0.006 |
| Бифентрин | 6.6 | 0.005 |
| Карбофос | 2.75 | 0.05 |
| Диазинон | 3.69 | 0.004 |
| Фозалон | 4.01 | 0.001 |
На модельных системах пестицидов методом ОФ ВЭЖХ с масс-спектрометрическим детектированием с электрораспылительной ионизацией в градиентном режиме элюирования с подвижной фазой 40 мМ ацетат аммония–СН3OH найдены условия разделения 6 пестицидов (рис. 2).
Рис. 2.
Хроматограмма модельной смеси пестицидов (обращено-фазовая ВЭЖХ–МС/МС в режиме мониторинга выбранных реакций). Хроматографическая колонка Zorbax Bonus RP 3.5 мкм, 2.1 × 100 мм. Подвижная фаза: 40 мМ ацетат аммония–СН3OH. Градиентный режим элюирования. Скорость подвижной фазы 0.3 мл/мин. Объем вводимой пробы 20 мкл.
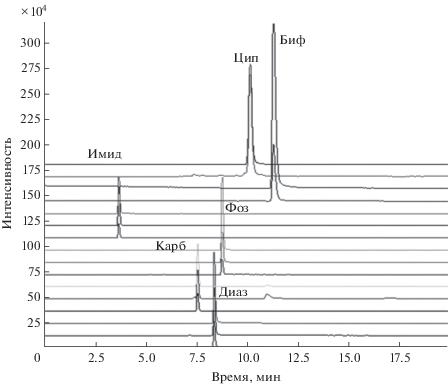
Пределы обнаружения пестицидов в водных растворах составили: диазинон – 5 нг/мл, карбофос – 5 нг/мл, фозалон – 10 нг/мл, имидаклоприд – 10 нг/мл, бифентрин – 50 нг/мл, циперметрин – 40 нг/мл.
Для снижения пределов обнаружения выявлены возможности ДЖЖМЭ с участием ИЖ на основе имидазола в качестве экстрагента. Для получения высоких значений коэффициентов концентрирования в условиях ДЖЖМЭ важен выбор как экстрагирующего агента, так и диспергирующего растворителя. С этой целью на модельных водных растворах пестицидов изучено влияние различных имидазолиевых ионных жидкостей ([C4MIM][PF6], [C6MIM][BF4] и [C6MIM][NTf2]) (табл. 3) и диспергирующих растворителей (метанол, ацетонитрил и ацетон) [16–18] на степень извлечения определяемых пестицидов.
Таблица 3.
Характеристики имидазолиевых ИЖ, выбранных в качестве экстрагентов [22]
| Ионная жидкость | Структурная формула | Tпл, °C | Вязкость, сП (20–25°C) | Плотность, г/мл (20–25°C) |
|
|---|---|---|---|---|---|
| катион | анион | ||||
| 1-Бутил-3-метилимидазолий гексафторфосфат | 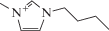 |
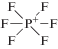 |
–8 | 267 | 1.37 |
| 1-Гексил-3-метилимидазолий бис(трифторметилсульфонил)имид | 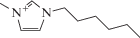 |
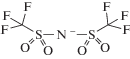 |
–9 | 68 | 1.37 |
| 1-Гексил-3-метилимидазолий тетрафторборат | 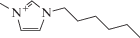 |
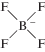 |
–82 | 102 | 1.15 |
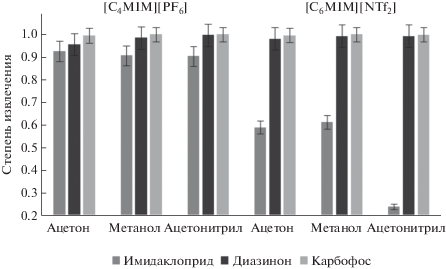
Степени извлечения соединений контролировали по их остаточному содержанию в водной фазе после экстракции. Гидрофобные пестициды циперметрин и бифентрил извлекаются в ионную жидкость со степенями извлечения 98–99%. В связи с этим влияние природы экстрагента и диспергирующего растворителя исследовали с более гидрофильными пестицидами в смеси (имидаклоприд, карбофос и диазинон) (рис. 3). Лучшие результаты достигнуты в случае ИЖ [C4MIM][PF6] как экстрагента и ацетонитрила в качестве дипергирующего ратворителя (рис. 3). Ионная жидкость [C6MIM][BF4] не формирует отдельную фазу в этих условиях, поскольку имеет близкую к воде плотность (табл. 3).
Рис. 3.
Влияние природы диспергирующего растворителя (ацетонитрил, ацетон, метанол) и ионной жидкости ([C4MIM][PF6] и [C6MIM][BF4]) на степень извлечения пестицидов имидаклоприда, диазинона и карбофоса.
Изучено влияние массы ионной жидкости [C4MIM][PF6] и объема ацетонитрила на эффективность извлечения аналитов. При малом содержании ИЖ происходит ее частичное растворение в водном растворе образца, что приводит к низким степеням извлечения соединений (рис. 4а). С увеличением массы ИЖ степень извлечения пестицидов возрастает до 85–99%. При массе ИЖ более 0.150 г она практически не изменяется, за исключением имидаклоприда и диазинона. В связи с этим для более полного извлечения имидаклоприда и диазинона выбрали 0.20 г ИЖ.
Рис. 4.
(а) Влияние массы ИЖ [C6MIM][PF6] на степень извлечения пестицидов. (б) Влияние объема диспергирующего растворителя на степень извлечения пестицидов: 1 – имидаклоприд, 2 – диазинон, 3 – фозалон, 4 – карбофос, 5 – циперметрин, 6 – бифентрин.
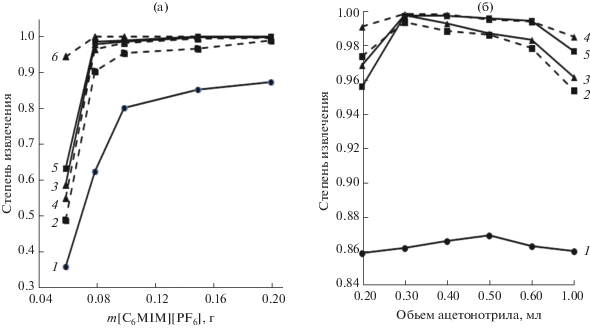
Для уменьшения разбавления пробы необходимо выбрать минимальный объем диспергирующего растворителя. При изменении объема ацетонитрила до 0.3 мл степени извлечения пестицидов увеличиваются, а затем снова снижаются (рис. 4б). Это обусловлено возрастанием растворимости пестицидов и ИЖ в воде с увеличением содержания ацетонитрила, что уменьшает коэффициенты распределения пестицидов. Таким образом, для дальнейших экспериментов выбрали объем диспергирующего растворителя 0.3 мл.
Известно, что от величины рН зависит стабильность определяемых пестицидов. Так, в щелочной среде они подвергаются гидролизу. Эксперименты в кислой (рН 2) и нейтральной (рН 7) средах показали, что эффективность извлечения аналитов не изменяется, что подтверждает распределительный механизм их экстракции.
Использование ультразвукового эмульгирования позволяет увеличить степень извлечения аналитов. Влияние продолжительности ультразвуковой обработки на извлечение аналитов оценивали в интервале 1–10 мин при сохранении остальных параметров. Показано, что 5-минутной обработки ультразвуком достаточно для достижения максимальных значений степеней извлечения пестицидов.
На примере карбофоса изучили влияние добавок хлорида натрия в анализируемый раствор (эффект высаливания) на степень его извлечения. Наблюдается незначительное увеличение степени извлечения пестицида при содержании соли 0.08 г (4 мас. %). Дальнейший рост концентрации соли приводит к увеличению растворимости ионной жидкости в водной фазе из-за протекающих процессов ионного обмена и к снижению степени извлечения.
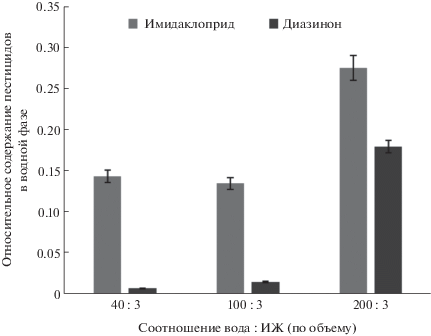
Коэффициент концентрирования аналитов зависит от соотношения объемов экстрагента и анализируемого раствора. Варьировали соотношение фаз VИЖ : Vводный раствор в пределах 3 : 40, 3 : 100, 3 : 200, 3 : 400. С увеличением объема водной фазы изменяется распределение пестицидов и происходит частичное растворение ИЖ, что приводит к уменьшению степени извлечения аналитов, причем в большей степени для имидаклоприда и диазинона (рис. 5). Однако при соотношении фаз 3 : 100 удалось достичь более высоких коэффициентов концентрирования пестицидов (28.7–33).
Рис. 5.
Зависимость степени извлечения имидаклоприда и диазинона в фазу ионной жидкости от соотношения объемов воды и ионной жидкости.
В выбранных условиях степени извлечения пестицидов составили 86–99% (n = 3, P = 0.95):
При оптимизации схемы экстракции ИЖ-ДЖЖМЭ необходимо не только учесть степень извлечения, но и оценить влияние ИЖ в составе пробы на интенсивность ионизации в условиях ВЭЖХ с тандемным масс-спектрометрическим детектированием с электрораспылительной ионизацией. Известно, что высокая вязкость ИЖ может затруднять процессы электрораспылительной ионизации [16, 30]. При анализе фазы ИЖ с пестицидами после экстракции наблюдали значительное подавление ионизации всех пестицидов, искажение формы пиков, причем в большей степени для наиболее полярного имидаклоприда, что объясняется наличием интенсивного сигнала ИЖ в начале хроматограммы. Одним из способов уменьшения влияния ИЖ в составе пробы в условиях ВЭЖХ–МС является разбавление раствора пробы [16, 32]. Показано, что разбавление образцов пробы в 3 раза метанолом после экстракции недостаточно для снижения влияния ИЖ на хроматографическую систему. Для оценки использовали метод постэкстракционной добавки: эффект ИЖ составил от 37.3 до 84.5% с коэффициентом вариации 8.5–17.8%, а дальнейшее разбавление пробы приводит к значительному снижению чувствительности. Ниже проиллюстрировано влияние ИЖ на площадь пика и значения коэффициентов вариации (CV) для проб, разбавленных метанолом в 3 раза:
| Пестицид | Имид | Цип | Биф | Карб | Диаз | Фоз |
|---|---|---|---|---|---|---|
| Влияние ИЖ, % | 37.3 | 67.5 | 69.8 | 80.2 | 84.5 | 61.3 |
| СV, % | 17.8 | 13.2 | 10.8 | 8.5 | 12.1 | 14.1 |
В связи с этим исследовали возможность обратного извлечения пестицидов из ИЖ в н-гексан – реэкстракцию. Гексан, в отличие от хлороформа, дихлорметана и этилацетата, не смешивается с раствором ИЖ. Для подбора объема экстрагента: варьировали соотношение ИЖ–гексан (от 1 : 2 до 1 : 10, по объему). Экстракты в гексане выпаривали под током воздуха, сухой остаток вновь растворяли в 50 мкл метанола. Степень реэкстракции при этом оказалась низкой.
Оценили метрологические характеристики разработанного варианта определения пестицидов с использованием ИЖ (табл. 4). Пределы обнаружения пестицидов составили от 0.07 до 0.19 нг/мл, воспроизводимость площадей пиков – 3.16–5.44.
Таблица 4.
Метрологические характеристики разработанного варианта определения пестицидов в воде методом ВЭЖХ–МС (n = 3, P = 0.95)
| Характеристика | Диаз | Карб | Фоз | Имид | Биф | Цип |
|---|---|---|---|---|---|---|
| Предел обнаружения, нг/мл | 0.07 | 0.19 | 0.06 | 0.08 | 0.03 | 0.06 |
| Линейный диапазон, нг/мл | 1–3000 | |||||
| Воспроизводимость, % | 4.2 | 3.3 | 4.1 | 5.4 | 3.2 | 4.8 |
Таким образом, выбраны условия эффективного извлечения пестицидов с участием ИЖ в качестве экстрагента в ИЖ−ДЖЖМЭ: раствор экстрагента, содержащий 0.2000 г ИЖ [C6MIM][PF6] в диспергирующем растворителе ацетонитриле (0.3 мл) вводят в анализируемый водный раствор объемом 5 мл с добавкой 0.0800 г NaCl. Смесь перемешивают в течение 1 мин и затем помещают в ультразвуковую ванну на 5 мин и далее проводят вымораживание ИЖ (10 мин) при –4°С с последующим центрифугированием в течение 10 мин.
* * *
Таким образом, показаны возможности ионной жидкости [C6MIM][PF6] в качестве экстрагента для извлечения пестицидов (имидаклоприда, бифентрина, циперметрина, карбофоса, фозалона и диазинона) из водных объектов методом дисперсионной жидкостно-жидкостной микроэкстракции. Предложена схема процедуры ИЖ–ДЖЖМЭ в сочетании с ВЭЖХ–МС/МС для определения пестицидов в водных объектах. Изучено влияние природы ИЖ и диспергирующего растворителя, количества ИЖ и ацетонитрила, времени экстракции, рН и концентрации соли в растворе пробы на степени извлечения аналитов, которые составили 86–98%, что сопоставимо с результатами, полученными с применением ТФЭ и жидкостно-жидкостной экстракции, но в отличие от данных методов требуют меньших затрат времени. Найдены условия реэкстракции пестицидов с использованием гексана.
Работа выполнена при финансовой поддержке проекта РФФИ 18-53-80010 BRICS_t. Выражаем благодарность Ресурсному образовательному центру по направлению “Химия” СПбГУ за предоставленное оборудование.
Список литературы
Wang Q., Chen R., Shatner W., Cao Y., Bai Y. State-of-the-art on the technique of dispersive liquid-liquid microextraction // Ultrason. Sonochem. 2019. V. 51. P. 369.
Saraji M., Boroujeni M.K. Recent developments in dispersive liquid−liquid microextraction // Anal. Bioanal. Chem. 2014. V. 406. № 8. P. 2027.
Смирнова С.В., Плетнев И.В. Новые ионные жидкости для экстракционного концентрирования // Журн. аналит. химии. 2019. Т. 74. № 1. С. 3. (Smirnova S.V., Pletnev I.V. New ionic liquids for extraction preconcentration // J. Analyt. Chem. 2019. V. 74. № 1. P. 1.)
Pletnev I.V., Smirnova S.V., Shvedene N.V. New directions in using ionic liquids in analytical chemistry. 1: Liquid–liquid extraction // J. Anal. Chem. 2019. V. 74. № 7. P. 625.
Spietelun A., Marcinkowski L., de la Guardia M., Namiesnik J. Green aspects, developments and perspectives of liquid phase microextraction techniques // Talanta. 2014. V. 119. № 15. P. 34.
Escudero L.B., Grijalba A.C., Martinis E.M., Wuilloud R.G. Bioanalytical separation and preconcentration using ionic liquids // Anal. Bioanal. Chem. 2013. V. 405. № 24. P. 7597.
Trujillo-Rodríguez M.J., Rocio-Bautista P., Pino V., Afonso A.M. Ionic liquids in dispersive liquid-liquid microextraction // Trends Anal. Chem. 2013. V. 51. P. 87.
Han D., Tang B., Lee Y.R., Row K.H. Application of ionic liquid in liquid phase microextraction technology // J. Sep. Sci. 2012. V. 35. № 21. P. 2949.
Ventura S.P.M., e Silva F.A., Quental M.V., Mondal D., Freire M.G., Coutinho J.A.P. Ionic-liquid-mediated extraction and separation processes for bioactive compounds: Past, present, and future trends // Chem. Rev. 2017. V. 117. № 10. P. 6984.
Rykowska I., Ziemblinska J., Nowak I. Modern approaches in dispersive liquid-liquid microextraction (DLLME) based on ionic liquids: A review // J. Mol. Liq. 2018. V. 259. P. 319.
Kolobova E.A., Kartsova L.A., Kravchenko A.V., Bessonova E.A. Imidazolium ionic liquids as dynamic and covalent modifiers of electrophoretic systems for determination of catecholamines // Talanta. 2018. V. 188. P. 183.
Berthod A., Ruiz-Angel M.J., Carda-Broch S. Ionic liquids in separation techniques // J. Chromatogr. A. 2008. V. 1184. № 1–2. P. 6.
Колобова Е.А., Карцова Л.А., Бессонова Е.А., Кравченко А.В. On-line концентрирование биогенных аминов методом капиллярного электрофореза с иcпользованием синтезированных ковалентных покрытий на основе ионных жидкостей // Аналитика и контроль. 2017. Т. 21. № 1. С. 57.
Shashkov M.V., Sidel’nikov V.N. Properties of columns with several pyridinium and imidazolium ionic liquid stationary phases // J. Chromatogr. A. 2013. V. 1309. № 27. P. 56.
Patel D.D., Lee J.M. Applications of ionic liquids // Chem. Rec. 2012. V. 12. № 3. P. 329.
De Boeck M., Damilano G., Dehaen W., Tytgat J., Cuypers E. Evaluation of 11 ionic liquids as potential extraction solvents for benzodiazepines from whole blood using liquid-liquid microextraction combined with LC-MS/MS // Talanta. 2018. V. 184. P. 369.
Li Z., Chen F., Wang X., Wang C. Ionic liquids dispersive liquid–liquid microextraction and high-performance liquid chromatographic determination of irbesartan and valsartan in human urine // Biomed. Chromatogr. 2012. V. 27. № 2. P. 254.
Liu Y., Zhao E., Zhu W., Gao H., Zhou Z. Determination of four heterocyclic insecticides by ionic liquid dispersive liquid-liquid microextraction in water samples // J. Chromatogr. A. 2009. V. 1216. № 6. P. 885.
He L., Luo X., Xie H., Wang C., Jiang X., Lu K. Ionic liquid-based dispersive liquid−liquid microextraction followed high-performance liquid chromatography for the determination of organophosphorus pesticides in water // Anal. Chim. Acta. 2009. V. 655. № 1–2. P. 52.
Cruz-Vera M., Lucena R., Cardenas S., Valcarcel M. One-step in-syringe ionic liquid-based dispersive liquid−liquid microextraction // J. Chromatogr. A. 2009. V. 1216. № 37. P. 6459.
Ravelo-Perez L.M., Hernandez-Borges J., Asensio-Ramos M., Rodríguez-Delgado M.A. Ionic liquid based dispersive liquid-liquid microextraction for the extraction of pesticides from bananas // J. Chromatogr. A. 2009. V. 1216. № 43. P. 7336.
Zhou Q., Bai H., Xie G., Xiao J. Trace determination of organophosphorus pesticides in environmental samples by temperature-controlled ionic liquid dispersive liquid-phase microextraction // J. Chromatogr. A. 2008. V. 1188. № 2. P. 148.
Zhou Q., Zhang X., Xie G., Xiao J. Temperature-controlled ionic liquiddispersive liquid-phase microextraction for preconcentration of chlorotoluron, diethofencarb and chlorbenzuron in water samples // J. Sep. Sci. 2009. V. 32. № 22. P. 3945.
Zhang J., Gao H., Peng B., Li S., Zhou Li. Comparison of the performance of conventional, temperature-controlled, and ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction combined with high-performance liquid chromatography in analyzing pyrethroid pesticides in honey samples // J. Chromatogr. A. 2011. V. 1218. № 38. P. 6621.
Li S., Gao H., Zhang J., Li Y., Peng B., Zhou Z. Determination of insecticides in water using in situ halide exchange reaction-assisted ionic liquid dispersive liquid-liquid microextraction followed by high-performance liquid chromatography // J. Sep. Sci. 2011. V. 34. № 22. P. 3178.
Berthod A., Ruiz-Ángel M.J., Carda-Broch S. Recent advances on ionic liquid uses in separation techniques // J. Chromatogr. A. 2018. V. 1559. P. 2.
Колобова E.A., Карцова Л.A. Применение дисперсионной жидкостно-жидкостной микроэкстракции с использованием в качестве экстрагента 3-метил-1-октил-имидазолий тетрафторбората для электрофоретического определения стероидных гормонов в образцах мочи // Аналитика и контроль. 2018. Т. 22. № 3. С. 284.
Jensen M.P., Neuefeind J., Beitz J.V., Skanthakumar S., Soderholm L. Mechanisms of metal ion transfer into room-temperature ionic liquids: II. The role of anion exchange // J. Am. Chem. Soc. 2003. V. 125. № 50. P. 15 466.
Dietz M.L., Stepinski D.C. Anion concentration-dependent partitioning mechanism in the extraction of uranium into room-temperature ionic liquids // Talanta. 2008. V. 75. № 2. P. 598.
De Boeck M., Missotten S., Dehaen W., Tytgat J., Cuypers E. Development and validation of a fast ionic liquid-based dispersive liquid−liquid microextraction procedure combined with LC-MS/MS analysis for the quantification of benzodiazepines and benzodiazepine-like hypnotics in whole blood // Forensic Sci. Int. 2017. V. 274. P. 44.
Ярошенко Д.В., Карцова Л.А. Матричный эффект и способы его устранения в биоаналитических методиках, использующих хромато-масс-спектрометрию // Журн. аналит. химии. 2014. Т. 69. № 4. С. 351. (Yaroshenko D.V., Kartsova L.A. Matrix effect and methods for its elimination in bioanalytical methods using chromatography-mass spectrometry // J. Analyt. Chem. 2014. V. 69. № 4. P. 311.)
Schwanz T.G., Carpilovsky C.K., Weis G.C.C., Costabeber I.H. Validation of a multi-residue method and estimation of measurement uncertainty of pesticides in drinking water using gas chromatography–mass spectrometry and liquid chromatography–tandem mass spectrometry // J. Chromatogr. A. 2019. V. 1585. P. 10.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии