Журнал аналитической химии, 2020, T. 75, № 9, стр. 799-805
Сорбционное концентрирование и определение о-ксилола и полициклических ароматических углеводородов в атмосферных осадках методом газовой хромато-масс-спектрометрии
К. С. Гутенев a, Т. И. Тихомирова a, *, В. Н. Беляев b, **
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
b Институт органической химии им. Н.Д. Зелинского Российской академии наук,
Международный аналитический центр
119991 Москва, Ленинский просп., 47, Россия
* E-mail: tikhomirova-tatyana@yandex.ru
** E-mail: vn_belyaev@mail.ru
Поступила в редакцию 24.12.2019
После доработки 05.02.2020
Принята к публикации 11.03.2020
Аннотация
Разработаны условия сорбционного концентрирования в динамическом режиме о-ксилола и полициклических ароматических углеводородов (ПАУ) на сверхсшитом полистироле. Предложена методика определения о-ксилола и ПАУ в талом снеге, основанная на сорбционном концентрировании этих соединений и дальнейшем их определении методом газовой хромато-масс-спектрометрии. Проанализированы образцы талого снега, отобранные на территории парка МГУ.
В результате деятельности человека в окружающую среду попадает огромное количество веществ различной степени токсичности. Для большинства природных объектов регламентированы нормы содержания экотоксикантов, однако для атмосферных осадков они отсутствуют. Это обусловлено небольшим количеством данных, позволяющих делать выводы о влиянии состава атмосферных осадков на другие природные объекты и человека. Известно, что в атмосферных осадках могут содержаться следующие органические вещества: алканы до С36, алкены, жирные кислоты (пальмовая и стеариновая кислоты) [1], толуол, этилбензол, ксилолы, трихлорэтан, тетрахлорэтан [2, 3], бифенил [1, 3], дибензофуран, флуорен, антрацен, дибензотиофен [1, 2], нафталин, фенантрен, пирен [1–3], аценафтен [2], α-гексахлорциклогексан [2, 4], бензапирен [2, 3].
Содержание многих соединений в атмосферных осадках слишком мало для их прямого определения и достигает уровня следовых количеств (пг/л). Для определения столь малых концентраций веществ необходимо использовать предварительное концентрирование и высокочувствительные методы анализа. Для концентрирования экотоксикантов при анализе атмосферных осадков в большинстве случаев применяют жидкостную экстракцию. В качестве основных методов анализа используют газовую и жидкостную хроматографию с масс-спектрометрическим детектированием.
Наиболее распространенное экстракционное концентрирование характеризуется рядом существенных недостатков. Как правило, коэффициенты распределения микрокомпонентов невысоки, требуется применение токсичных органических растворителей, процесс сложно автоматизировать. Так, при экстракции по методу 8270 Агентства по охране окружающей среды CША на 1 л пробы необходимо затратить 60 мл дихлорметана, причем извлечение повторяют трижды, что делает этот метод трудозатратным и длительным [5, 6].
Многих указанных недостатков лишены сорбционные методы концентрирования. Литературные данные по использованию сорбции при анализе атмосферных осадков немногочисленны. В основном этот метод пробоподготовки применяют метеорологи [1–4], при этом в большинстве случаев отсутствуют данные о полноте сорбции и десорбции определяемых соединений. В некоторых работах дана только качественная оценка состава осадков [1], а выбор сорбента для концентрирования – кремнезема, модифицированного октадецильными группами (ХМК-С18) – обусловлен рекомендациями фирмы-производителя.
При сорбционном концентрировании органических веществ из водных растворов чаще всего используют неполярные сорбенты, такие как гидрофобизированные кремнеземы, органополимерные, а также углеродные сорбенты [7]. При выборе сорбента, как правило, руководствуются параметром гидрофобности веществ (lgP). При lg P > 3 для извлечения используют в основном кремнеземы с низким углеродным покрытием, а для менее гидрофобных соединений – высокосшитые полимерные сорбенты. Так, для определения полициклических ароматических углеводородов (ПАУ) в водах разработан проточный сорбционно-хроматографический способ определения с использованием для концентрирования сорбента ХМК-С18 [8, 9] или специально полученного иммуносорбента [10]. Поскольку при построении градуировочных графиков используют ту же процедуру пробоподготовки, что и для проб, авторы не приводят данных о степенях извлечения.
В атмосферных осадках присутствует большое число органических веществ, которые сильно различаются по гидрофобности. Для их эффективного группового концентрирования веществ необходим сорбент, при использовании которого коэффициенты распределения будут высокими и достаточно близкими по значению.
Цель данной работы – систематическое изучение сорбционного концентрирования о-ксилола, нафталина, фенантрена, антрацена и пирена на различных сорбентах и последующее их определение методом газовой хромато-масс-спектрометрии (ГХ–МС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты, растворы и сорбенты. Использовали ацетонитрил х.ч. (Компонент-реактив, Россия); дихлорметан пестицидный ос. ч. (Lecbiopharm, Россия); этанол х. ч.; нафталин, фенантрен, антрацен, пирен (98%, Sigma-Aldrich, Германия).
Исходные растворы о-ксилола, нафталина (2 мг/мл) и пирена (0.25 мг/мл) в этаноле готовили по точной навеске. Водные растворы готовили разбавлением этанольных, содержание этанола в этих растворах составляло 5%.
Исходные растворы смеси о-ксилола, фенантрена, антрацена, пирена в этаноле с концентрацией 250 мкг/мл готовили по точной навеске, растворы с концентрацией 5 мкг/мл и водные растворы готовили разбавлением исходного этанольного раствора.
Сорбцию органических веществ исследовали на кремнеземе, химически модифицированном алкильными радикалами, Диасорб-60-C16 (ХМК-С16) (Sуд = 250 м2/г, диаметр пор 13 нм, размер частиц 63–200 мкм), а также на сверхсшитом полистироле (ССПС) (Sуд = 900–1000 м2/г, диаметр пор 1 и 100 нм, размер частиц 75–125 мкм). Все сорбенты производства “БиоХимМак СТ” (Россия).
Экстракция смеси о-ксилола и ПАУ. В делительную воронку помещали 200 мл вводного раствора смеси веществ, добавляли 5 мл гексана и встряхивали в течение 5 мин. Процедуру повторяли 3 раза, полученные экстракты объединяли и упаривали до 3 мл, затем сушили безводным сульфатом натрия, фильтровали и проводили ГХ–МС-анализ.
Сорбция в динамическом режиме. Пропускали 10–500 мл растворов веществ через колонку с сорбентом с помощью перистальтического насоса со скоростью 1–4 мл/мин. Элюирование проводили 3 раза по 1–3 мл ацетонитрила или дихлорметана.
Отбор пробы. Образцы снега отбирали на расстоянии не менее 50 см друг от друга стеклянными банками емк. 500 мл, которые предварительно тщательно промывали раствором карбоната натрия и высушивали. Пробоотбор проводили на территории парка МГУ. Снег растапливали при комнатной температуре, а талую воду фильтровали через бумажные фильтры “синяя лента”. Пробы хранили в стеклянной посуде с добавлением ацетонитрила (5%-ный раствор).
ГХ-МС анализ. Изучаемые соединения определяли на газовом хромато-масс-спектрометре Маэстро ГХ-2. Энергия ионизации составляла 70 эВ, сканируемые массы – 33–550 Да. В режиме мониторинга выбранных ионов (selected ion monitoring, SIM) сканировали следующие массы: о-ксилол – 91, 106; нафталин – 128; фенантрен, антрацен – 178; пирен – 202; бенз(а)пирен – 152, 252 Да. Для газовой хроматографии применяли капиллярную колонку Agilent HP-5MS (0.25 мм × 30 м × 0.25 мкм) в температурном режиме: 80°С (без выдержки) – 20 град/мин – 200°С (без выдержки) – 30 град/мин – 310°С (без выдержки) – 10 град/мин – 290°С (без выдержки). Образцы объемом 3 мкл вводили в инжектор хроматографа без деления потока при 280°С. При идентификации веществ использовали библиотеку масс-спектров NIST08.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для предварительного изучения процессов сорбции и десорбции на различных сорбентах выбрали вещества, достаточно отличающиеся по параметрам гидрофобности: о-ксилол (lg P = 3.12) и пирен (lg P = 4.88).
Установлено, что сорбция о-ксилола зависит от природы сорбента: при извлечении из 100 мл водного раствора сорбция на кремнеземном сорбенте менее эффективна по сравнению со ССПС, в то время как сорбция пирена на этих сорбентах одинакова (табл. 1). Для группового концентрирования в дальнейшем использовали ССПС. Для десорбции достаточно 1–2 мл ацетонитрила или дихлорметана. Для удобства проведения ГХ–МС-анализа в работе использовали дихлорметан.
Таблица 1.
Степени извлечения (R, %) о-ксилола и пирена на сорбенте ХМК-С16 и сверхсшитом полистироле (mсорбента = 0.1 г, Vпробы = 100 мл, со-ксилол = 2 мкг/мл, спирен = 0.05 мкг/мл, n = 3, P = 0.95)
| Вещество | ХМК-С16 | ССПС |
|---|---|---|
| о-Ксилол | 50 ± 8 | 92 ± 12 |
| Пирен | 100 ± 9 | 102 ± 10 |
Определение о-ксилола и ПАУ в талом снеге с предварительным экстракционным концентрированием. Для установления качественного состава проб атмосферных осадков органические соединения идентифицировали с использованием стандартной методики экстракционного концентрирования [11].
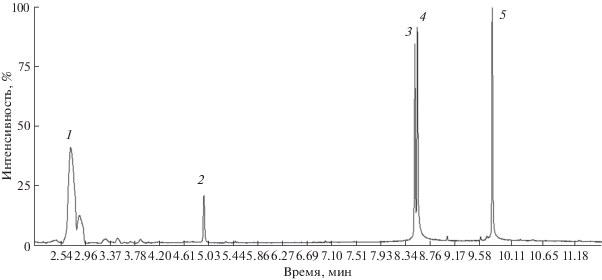
Для количественного масс-спектрометрического определения исследуемых веществ выбрали режим SIM. В экстрактах обнаружили все исследуемые соединения (рис. 1) В связи с высокой токсичностью бенз(а)пирена сканировали ионы, которые могли бы свидетельствовать о его присутствии в пробах. Ни в одном из масс-спектров характерные ионы не были обнаружены.
Рис. 1.
Хроматограмма талого снега с предварительным экстракционным концентрированием из 100 мл пробы: 1 – о‑ксилол, 2 – нафталин, 3 – фенантрен, 4 – антрацен, 5 – пирен. Режим SIM.
Для градуировки получили зависимости площади хроматографического пика от концентраций о-кислола, нафталина, фенантрена, антрацена и пирена с использованием приготовленных в дихлорметане стандартов с концентрациями 0.05, 0.25, 0.5 мг/л (внешний стандарт).
Проанализировали образцы талого снега; а также те же образцы с введением на стадии пробоподготовки добавки стандартных растворов исследуемых веществ определенной концентрации. Рассчитали степени извлечения всех соединений по формуле:
(1)
$R,\,\,{\text{\% }} = \frac{{{{S}_{{{\text{доб}}}}}}}{{{{S}_{{{\text{внешн}}.{\text{ст}}.}}}}}{\text{\;}} \times 100\% ,$Для вычисления площади, эквивалентной добавленному к пробам стандарту (Sдоб), из общей площади пика вещества с известной добавкой этого вещества (Sобщ) вычитали площадь, приходящуюся на ту же пробу без добавки (Sв-ва в снеге):
Степени извлечения исследуемых соединений приведены в табл. 2. Рассчитали концентрации всех исследуемых веществ, найденных в атмосферных осадках (табл. 3), по внешнему стандарту с учетом степеней извлечения каждого вещества.
Таблица 2.
Степени извлечения (R, %) органических веществ из 200 мл талого снега жидкостной экстракцией (n = 3, P = 0.95)
| Вещество | R, % |
|---|---|
| о-Ксилол | 74 ± 10 |
| Нафталин | 75 ± 12 |
| Фенантрен | 88 ± 11 |
| Антрацен | 98 ± 14 |
| Пирен | 76 ± 8 |
Таблица 3.
Результаты (мкг/л) определения о-ксилола и ПАУ в талом снеге с предварительным экстракционным концентрированием (n = 3, P = 0.95)
| Дата отбора пробы | Условия | о-Ксилол | Нафталин | Фенантрен | Антрацен | Пирен |
|---|---|---|---|---|---|---|
| 08.12.17 | 200 мл талого снега, 3 раза по 5 мл гексана, упарили до 3 мл | 15 ± 2 | 1.4 ± 0.2 | 3.4 ± 0.4 | 4.2 ± 0.5 | 4.4 ± 0.6 |
| 01.02.18 | 200 мл талого снега, 3 раза по 5 мл гексана, упарили до 3 мл | 18 ± 2 | 2.8 ± 0.4 | 0.98 ± 0.15 | 0.30 ± 0.07 | 0.43 ± 0.09 |
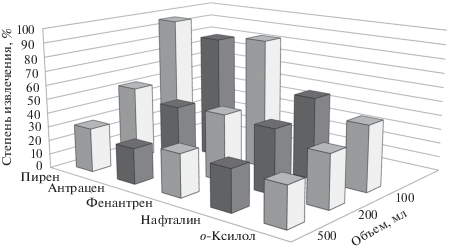
Определение о-ксилола и ПАУ с предварительным сорбционным концентрированием. На основании проведенного ранее исследования для сорбционного концентрирования использовали ССПС. Установлено, что при увеличении объема проб до 200 мл и снижении уровня концентрации веществ до 7.5 мкг/л на навеске сорбента 0.1 г степени извлечения всех изученных веществ в 2–4 раза ниже по сравнению с жидкостной экстракцией. Увеличение навески сорбента приводит к росту степени извлечения (рис. 2), однако увеличение объема проб снижает степень извлечения (рис. 3). Для эффективного концентрирования органических веществ на сорбенте необходимо подобрать оптимальный объем проб. Снижения предела обнаружения можно добиться пропусканием через сорбент максимально возможного объема пробы; при этом количество извлеченного вещества будет наибольшим, но степень извлечения не обязательно должна быть максимальной. По данным авторов работы [12], эффективность извлечения органических соединений мало зависит от концентрации, а в основном зависит от объема пробы. В работах [12–14] описан метод определения оптимального объема пробы, индивидуального для каждого компонента. Таким образом, степень извлечения должна снижаться по мере увеличения объема пробы, но при этом на сорбенте окажется большее количество сорбируемого вещества. В случае, когда скорости роста массы сорбированного вещества и еe потерь одинаковы, объем считается оптимальным.
Рис. 2.
Зависимость степени извлечения веществ из 200 мл водных растворов от навески сверхсшитого полистирола (с = 7.5 мкг/л).
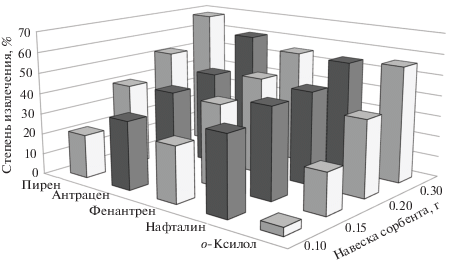
Рис. 3.
Зависимость степени извлечения веществ от объемов проб на 0.2 г сверхсшитого полистирола (масса каждого введенного аналита 1.5 мкг).
Для определения оптимального объема использовали степени извлечения веществ из 100, 200 и 500 мл водных растворов. Из уравнения, предложенного авторами работы [12], следует:
где x – степень извлечения, %; y – объем пропущенной пробы, мл; m и b – коэффициенты в уравнении регрессии,Как следует из уравнения (3), произведение xy определяет количество экстрагированного компонента. Для определения максимального значения xy приравняем первую производную к нулю:
и получимТаким образом рассчитали оптимальный объем пробы для всех исследованных веществ. Полученные данные представлены в табл. 4. Как видно, в качестве оптимального можно использовать объем пробы, близкий к 300 мл.
Таблица 4.
Рассчитанные оптимальные объемы проб исследуемых веществ
| Вещество | Зависимость lg Vпробы (мл)–R (%) | Оптимальный объем, мл |
|---|---|---|
| о-Ксилол | y = –0.0392x + 3.788 | 2200 |
| Нафталин | y = –0.0246x + 3.403 | 900 |
| Фенантрен | y = –0.0105x + 2.921 | 300 |
| Антрацен | y = –0.0107x + 2.893 | 300 |
| Пирен | y = –0.0109x + 2.969 | 350 |
Проанализировали образцы талого снега, отобранные на территории парка МГУ. Для этого предварительно отфильтрованные пробы талого снега с содержанием ацетонитрила 5% для предотвращения осаждения органических веществ на стенках сосудов и шлангов прокачивали через колонку, заполненную ССПС, с помощью перистальтического насоса. Сорбент в колонке предварительно активировали 1–2 мл этилового спирта или ацетонитрила. Скорость пропускания 2–4 мл/мин. После удаления воды продуванием воздуха на сорбент наносили несколько капель ацетонитрила для улучшения контакта фаз с элюентом. Для элюирования использовали 3 мл дихлорметана с последующим удалением воды безводным сульфатом натрия. После фильтрации осадка сульфата натрия проводили ГХ–МС-анализ. Для расчета содержаний компонентов использовали метод добавок. Полученные данные (табл. 5) согласуются с результатами анализа тех же образцов с использованием стандартного метода жидкостной экстракции.
Таблица 5.
Результаты (мкг/л) определения о-ксилола и ПАУ в талом снеге (01.02.18) с предварительным сорбционным и экстракционным концентрированием (n = 3, P = 0.95)
| Метод* | Условия | о-Ксилол | Нафталин | Фенантрен | Антрацен | Пирен |
|---|---|---|---|---|---|---|
| ЖЖЭ | 200 мл талого снега, 3 раза по 5 мл | 18 ± 2 | 2.8 ± 0.4 | 0.98 ± 0.15 | 0.30 ± 0.07 | 0.43 ± 0.09 |
| ТФЭ | 200 мл талого снега; mсорбента= 0.2 г | 16 ± 2 | 3.1 ± 0.4 | 1.1 ± 0.2 | 0.23 ± 0.07 | 0.50 ± 0.08 |
В табл. 6 приведены рассчитанные по 3s-критерию пределы обнаружения исследуемых соединений прямым методом, а также с предварительным сорбционным и экстракционным концентрированием. Пределы обнаружения с различными вариантами концентрирования сопоставимы, однако сорбционное концентрирование менее трудоемко и его использование не требует применения больших объемов органических растворителей. Применение концентрирования позволяет снизить предел обнаружения на два порядка.
Таблица 6.
Пределы обнаружения (мкг/л) при определении исследуемых веществ
| Вещество | Определение методом ГХ–МС | Определение с экстракционным концентрированием (200 мл пробы) | Определение с сорбционным концентрированием (200 мл пробы) |
|---|---|---|---|
| о-Ксилол | 1.2 | 0.024 | 0.012 |
| Нафталин | 2.5 | 0.050 | 0.030 |
| Фенантрен | 3.6 | 0.061 | 0.035 |
| Антрацен | 5.0 | 0.077 | 0.043 |
| Пирен | 4.5 | 0.089 | 0.050 |
Проанализированы образцы талого снега, отобранные в различное время. Результаты приведены в табл. 7. Полученные нами содержания ПАУ согласуются с данными [15]. Авторы отмечают, что при анализе снега установлен более высокий уровень концентраций фенантрена по сравнению с другими ПАУ.
Таблица 7.
Результаты (мкг/л) определения о-ксилола и ПАУ в талом снеге с предварительным сорбционным концентрированием (n = 3, P = 0.95)
| Дата отбора | о-Ксилол | Нафталин | Фенантрен | Антрацен | Пирен |
|---|---|---|---|---|---|
| 01.02.18 | 16 ± 2 | 3.1 ± 0.4 | 1.1 ± 0.2 | 0.23 ± 0.07 | 0.50 ± 0.08 |
| 15.03.18 | 0.17 ± 0.02 | 0.06 ± 0.01 | 0.09 ± 0.02 | –* | – |
| 22.03.18 | 2.49 ± 0.33 | 0.13 ± 0.02 | 0.21 ± 0.03 | 0.09 ± 0.01 | 0.09 ± 0.01 |
| 29.03.18 | 0.12 ± 0.02 | – | 0.07 ± 0.01 | – | – |
В отличие от других объектов окружающей среды, ПДК экотоксикантов в снеге отсутствуют. Для оценки реальной опасности этих соединений сравнивают полученные величины с ПДК для рыбохозяйственных водоемов. Можно считать, что со временем все токсичные соединения вместе с талыми водами попадут в водоемы [15]. Из исследуемых нами соединений в России нормативные значения имеются только для нафталина (4 мкг/л). Как видно из табл. 7, найденные концентрации нафталина в снеге ниже этого значения.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-03-00289).
Список литературы
Krawczyk W.E., Skret U. Organic compounds in rainfall at Hornsund, SW Spitsbergen: Qualitative results // Pol. Polar Res. 2005. V. 26. P. 65.
Ligocki M.P., Leuenberger C., Pankow J.F. Trace organic compounds in rain – II. Gas scavenging of neutral organic compounds // Atmos. Environ. 1985. V. 19. № 10. P. 1609.
Czuczwa J., Leuenberger C., Giger W.A. Seasonal and temporal changes of organic compounds in rain and snow // Atmos. Environ. 1988. V. 22. № 5. P. 907.
Yuuya T., Hitoshi M., Hideko M. Persistent organic pollutants in rain at Niigata, Japan // Atmos. Environ. 2003. V. 37. P. 4077.
Method 8270E (SW-846): Semivolatile Organic Compounds by Gas Chromatography/ Mass Spectrometry (GC/MS). U.S. EPA, Washington, DC. 2014.
Mazur D.M., Polyakova O.V., Artaev V.B., Lebedev A.T. Novel pollutants in the Moscow atmosphere in winter period. Gas chromatography-high resolution time-of-flight mass spectrometry study // Environ. Pollut. 2017. V. 222. P. 242.
Филиппов О.А., Тихомирова Т.И., Цизин Г.И., Золотов Ю.А. Динамическое концентрирование органических веществ на неполярных сорбентах // Журн. аналит. химии. 2003. Т. 58. № 5. С. 454. (Filippov O.A., Tikhomirova T.I., Tsizin G.I., Zolotov Yu.A. Dynamic preconcentration of organic substances on nonpolar adsorbents // J. Analyt. Chem. 2003. V. 58. № 5. P. 398.)
Hogenboom A.C., Malmqvist U.K., Nolkrantz K., Vreuls J.J., Th. Brinkman U.A. Rapid analysis of organic microcontaminants in environmental water samples by trace enrichment and liquid chromatography on a single short column // J. Chromatogr A. 1997. V. 759. P. 55.
Renner T., Baumgarten D., Unger K.K. Analysis of organic pollutants in water at trace levels using fully automated solid-phase extraction coupled to high-performance liquid chromatography // Chromatographia. 1997. V. 45. P. 199.
Pichon V.Â., Bouzige M., Hennion M.-C. New trends in environmental trace-analysis of organic pollutants: class-selective immunoextraction and clean-up in one step using immunosorbents // Anal. Chim. Acta. 1998. V. 376. P. 21.
МУК 4.1.739-99 Хромато-масс-спектрометрическое определение бензола, толуола, хлорбензола, этилбензола, о-ксилола, стирола в воде. Минздрав России, 1999.
Saner W.A., Jadamec J. R., Sager R.W. Trace enrichment with hand-packed CO:PELL ODS guard columns and Sep-Pak C18 cartridges // Anal. Chem. 1979. V. 51. № 13. P. 2180.
Хрящевский А.В., Тихомирова Т.И., Фадеева В.И., Шпигун О.А. Концентрирование фенола и его нитропроизводных на химически модифицированных кремнеземах // Журн. аналит.химии. 1996. Т. 51. № 6. С. 586. (Khryashchevskii A.V., Tikhomirova T.I., Fadeeva V. I., Shpigun O.A. Concentration of phenol and its nitro derivatives on chemically modified silicas // J. Analyt. Chem. 1996. V. 51. № 6. P. 536.)
Гончаров В.В., Горюнова В.Б., Тульчинский В.М. Предварительное концентрирование и фракционирование фенолов методом твердофазной экстракции // Заводск. лаборатория. 1992. Т. 58. № 9. С. 10.
Полякова О.В., Лебедев А.Т. Атропогенные органические соединения в атмосфере Москвы // Лаборатория и производство. 2019. Т. 9. № 5. С. 104.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


