Журнал аналитической химии, 2021, T. 76, № 12, стр. 1123-1136
Нанокластеры рения как модификаторы иммуносенсоров при определении трициклических антидепрессантов
Э. П. Медянцева a, *, Э. Р. Газизуллина a, Д. В. Брусницын a, М. А. Зиганшин a, Ю. Г. Елистратова b, А. Р. Мустафина b, К. А. Брылев c, Г. К. Будников a
a Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, Кремлевская ул., 18, Россия
b Институт органической и физической химии им. А.Е. Арбузова, Федеральный исследовательский центр
“Казанский научный центр Российской академии наук”
420008 Казань, ул. Академика Арбузова, 8, Россия
c Институт неорганической химии им. А.В. Николаева Сибирского отделения Российской академии наук
630090 Новосибирск, просп. Академика Лаврентьева, 3, Россия
* E-mail: emedyant@gmail.com
Поступила в редакцию 20.05.2021
После доработки 18.06.2021
Принята к публикации 21.06.2021
Аннотация
Методами вольтамперометрии, спектроскопии электрохимического импеданса, атомно-силовой микроскопии, спектрофотометрии исследованы свойства и проведен скрининг гексарениевых халькогенидных нанокластеров (K4[{Re6S8}(OH)6]·8H2O и K4[{Re6S8}(CN)6]·8H2O) в сочетании с углеродными наноматериалами (углеродные нанотрубки и оксид графена) для использования их как гибридных модификаторов печатных графитовых электродов в составе иммуносенсоров для улучшения аналитических характеристик. Высокий отрицательный заряд нанокластеров можно рассматривать в качестве движущей силы адсорбции кластеров при формировании модифицированных гибридных наноматериалами электродов. Установлено, что гексарениевые халькогенидные нанокластеры обладают электрохимической активностью, что впервые использовано для регистрации иммунохимических взаимодействий. Изменение сопротивления переноса электрона позволило выбрать лучшие гибридные наноматериалы. Оценены параметры шероховатости поверхности модифицированных электродов, связанные с высотными свойствами неровностей. Использование гексарениевых халькогенидных нанокластеров в сочетании с углеродными наноматериалами в качестве гибридных наномодификаторов позволило разработать высокочувствительные и селективные амперометрические и импедиметрические иммуносенсоры для определения трициклических антидепрессантов (амитриптилина, дезипрамина, имипрамина) в фармацевтических препаратах и урине. Нижняя граница определяемых содержаний на уровне (4–7) × 10–11 М. Относительное стандартное отклонение не превышает 0.050.
В настоящее время актуальной задачей является контроль качества и выявление фальсифицированной продукции, определение лекарственных веществ, в том числе и следовых количеств, в фармацевтических препаратах и в биологических жидкостях и использование полученных данных для оценки эффективности терапевтических назначений при различных заболеваниях [1–3]. Для этих целей представлены различные методики [4–7] определения трициклических антидепрессантов (ТЦА) – сильнодействующих лекарственных препаратов, используемых для эффективного лечения главным образом депрессий. В основном используют хроматографические методы, однако они требуют длительной и сложной пробоподготовки и больших объемов высокочистых и достаточно токсичных растворителей [8–10].
В качестве альтернативы перспективно применение биосенсорных устройств для доступных, экспрессных и относительно несложных вариантов анализа, не уступающих по чувствительности и селективности хроматографическим методикам [11–14]. Ранее показано, что модификация поверхности трансдьюсера как основы сенсора различными наноматериалами, в том числе углеродными (углеродные нанотрубки, фуллерен, оксиды графена) и наночастицами металлов, способствует формированию и значительному усилению аналитического сигнала [12, 13]. Люминесцетные свойства гексарениевых комплексов успешно использованы для создания сенсоров и клеточных маркеров [15–17].
Для лучшей иммобилизации наномодификаторов на поверхности трансдьюсеров использовали полимерные соединения, в частности хитозан, который хорошо зарекомендовал себя в этом плане [17]. Единичные работы посвящены использованию для этих целей полиэфирополиолов [18, 19].
Цель настоящего исследования заключалась в разработке электрохимических иммуносенсоров на основе печатных графитовых электродов, модифицированных гибридными наноматериалами (углеродные нанотрубки (УНТ) или оксид графена (ГО)) в сочетании с гексарениевыми халькогенидными кластерами (K4[{Re6S8}(OH)6]·8H2O и K4[{Re6S8}(CN)6]·8H2O), для использования в контроле качества лекарственных веществ в соответствующих фармацевтических препаратах и определения их остаточных количеств в урине на примере ТЦА.
Перспективность применения гексарениевых кластеров в качестве компонентов электрохимических иммуносенсоров обусловлена их электрохимической активностью [20–22] и высоким отрицательным зарядом, который в свою очередь можно рассматривать в качестве движущей силы адсорбции кластеров на УНТ и ГО при получении гибридных наноматериалов [19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Основа иммуносенсора представляет собой печатные графитовые электроды конструкции “3 в 1”, включающие рабочий, вспомогательный (графитовые чернила; Gwent Electronic Materials, США) электроды и электрод сравнения (паста Ag/AgCl). Планарные графитовые электроды изготовлены на полимерной подложке методом печатных технологий на кафедре аналитической химии КФУ. Для электрохимических измерений использовали потенциостат/гальваностат 204N со встроенным модулем FRA32M (Autolab, Нидерланды), позволяющим работать в различных режимах вольтамперометрии и спектроскопии электрохимического импеданса. Условия получения диаграмм Найквиста: частота 0.04–105 Гц, амплитуда 5 мВ. Для получений дисперсий углеродных наноматериалов применяли ультразвуковую ванну модели S30H (Elmasonic, Германия) с частотой 37 кГц. В ходе приготовления растворов лекарственных препаратов использовали центрифугу марки “MiniSpin” (Eppendorf, Германия). На атомно-силовом микроскопе (АСМ) “Titanium” [23, 24] (НТ-МДТ, Россия) регистрировали АСМ-изображения. Измерения проводили на воздухе в полуконтактном режиме со скоростью сканирования 0.8–1 Гц и разрешением 512 точек на линию. Использовали стандартные кремниевые кантилеверы NSG-10 с резонансной частотой 279 кГц (НТ-МДТ, Россия). Все АСМ-изображения получали при комнатной температуре. Полученные изображения обрабатывали и анализировали с помощью программы “Image Analysis” (НТ-МДТ, Россия).
Фосфатные буферные растворы (ФБ) с рН 6.0–7.5 и боратный буферный раствор с рН 8.0 готовили из препаратов х. ч. и ч. д. а. (ЗАО “Лаверна”, Россия).
Гексарениевые халькогенидные кластеры K4[{Re6S8}(OH)6]·8H2O и K4[{Re6S8}(CN)6]·8H2O синтезированы, охарактеризованы и предоставлены лабораторией “Синтеза кластерных соединений и материалов” Института неорганической химии им. А.В. Николаева СО РАН. Кластеры синтезировали по ранее опубликованным методикам, а именно: (K4[{Re6S8}(CN)6]) [20] и (K4[{Re6S8}(OH)6]) [21]. Использовали водные растворы кластеров (1 × 10–3 М).
В качестве компонентов модификаторов поверхности использовали УНТ и ГО (Sigma-Aldrich, США). Для более прочного закрепления на поверхности электрода углеродных модификаторов их наносили в составе аминопроизводного на платформе полиэфирополиола второй генерации (Н20-NH2) (модифицированы на кафедре неорганической химии КФУ, Россия) и хитозана, раствор которого готовили в 2%-ной уксусной кислоте марки х. ч.
Адсорбцию кластерных анионов [{Re6S8}(OH)6]4– и [{Re6S8}(CN)6]4– на УНТ и ГО проводили по следующей методике. Раствор кластерных комплексов (0.035 мМ) в воде смешивали с растворами УНТ (0.04 г/л) или ГО (0.02 г/л) в хитозане. Смесь перемешивали с помощью шейкера Hei-MIX Multi Reax в течение 10 мин и обрабатывали ультразвуком в течение 10 мин с дальнейшим разделением фаз центрифугированием при 4°C (15 000 об/мин), чтобы избавиться от избыточных кластерных единиц. Адсорбцию кластерных единиц из водной фазы оценивали путем сопоставления спектров люминесценции водных растворов кластера до смешивания с УНТ и ГО в хитозане и после фазового разделения. Спектры люминесценции регистрировали на флуоресцентном спектрофотометре Hitachi F-7100; образцы возбуждали при 380 нм.
Поликлональные антитела (Ат) против ТЦА (предоставлены проф. Ереминым С.А., МГУ) иммобилизовали на поверхность модифицированных электродов, используя в качестве матричного компонента Н20-NH2. Сшивающий реагент – 1%-ный водный раствор глутарового альдегида (ICN Biomedicals Ins., США).
Объекты анализа: лекарственные вещества амитриптилин, дезипрамин, имипрамин (Sigma-Aldrich, США) и содержащие их фармацевтические препараты “Амитриптилин” (ЗиО-Здоровье, Подольск, Россия), “Петилил” (AWD, Германия), “Мелипрамин” (Фармацевтический завод “ЭГИС”, Венгрия) соответственно. Серию стандартных растворов лекарственных веществ с концентрациями в диапазоне от 10–10 до 10–5 М готовили по точной навеске.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для разработки электрохимических иммуносенсоров на основе печатных графитовых электродов, модифицированных гибридными наноматериалами, необходимо подобрать условия применения гексарениевых халькогенидных кластеров и наиболее подходящие варианты сочетания их с углеродными наноматериалами. С этой целью изучали предполагаемые модификаторы электродной поверхности в различных комбинациях.
Характеристика гексарениевых халькогенидных кластеров. Поскольку использовали водные растворы гексарениевых халькогенидных кластеров, представляли интерес сведения о форме существования этих соединений в изучаемых условиях. Согласно данным спектрофотометрии, при длинах волн 431 и 435 нм наблюдаются полосы плазмонного поглощения, которые свидетельствует о наличии соответственно K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] в изучаемых растворах, что согласуется с данными [25]. Кроме того, в водных растворах K4[Re6S8(CN)6] существует в виде четырехзарядных анионов [{Re6S8}(CN)6]4–, которые не претерпевают никаких превращений в воде и водных растворах хитозана за счет высокой термодинамической и кинетической устойчивости данного кластера [20]. Образующийся при диссоциации K4[Re6S8(OH)6] четырехзарядный анион [{Re6S8}(OH)6]4– в водных растворах при рН 7.0 находится в равновесии с двузарядным анионом [{Re6S8}(OH)4(H2O)2]2– за счет кинетической лабильности шести апикальных гидроксил-анионов, претерпевающих в нейтральной области рН частичное протонирование [16].
Модификация поверхности печатных графитовых электродов гексарениевыми халькогенидными кластерами в присутствии хитозана или полиэфирополиола Н20-NH2. На поверхность электрода послойно наносили Н20-NH2 (1 мг/мл) или хитозан (0.75%), затем K4[{Re6S8}(OH)6] или K4[{Re6S8}(CN)6] (1 × 10–3 М). Каждый слой высушивали. После чего регистрировали дифференциально-импульсные вольтамперограммы в диапазоне потенциалов от 0.0 до 1.0 В при скорости 10 мВ/с. На фоне ФБ с pH 7.0 наблюдаются пики одноэлектронного окисления K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] при потенциалах 310 или 525 мВ (хитозан) и 305 или 575 мВ (полиэфирополиол) соответственно (табл. 1), что согласуется с экспериментальными результатами и с данными [26]:
Таблица 1.
Влияние на аналитический сигнал модификатора поверхности иммуносенсора, его состава и рН раствора
| E, мВ | I, мкА | Модификатор |
|---|---|---|
| Модификация кластерами рения в хитозане, ФБ с рН 7.0 | ||
| 310 | 1.3 | Хитозан/K4[{Re6S8}(ОН)6] (1 : 1) |
| 305 | 2.4 | Хитозан/K4[{Re6S8}(OH)6] (1 : 2) |
| 575 | 1.9 | Хитозан/K4[{Re6S8}(CN)6] (1 : 1) |
| 575 | 2.8 | Хитозан/K4[{Re6S8}(CN)6] (1 : 2) |
| Модификация кластерами рения в полиэфирополиоле, ФБ с рН 7.0 | ||
| 310 | 3.3 | Полиэфирополиол/K4[{Re6S8}(ОН)6] (1 : 1) |
| 325 | 11.2 | Полиэфирополиол/K4[{Re6S8}(OH)6] (1 : 2) |
| 525 | 4.7 | Полиэфирополиол/K4[{Re6S8}(CN)6] (1 : 1) |
| 534 | 9.2 | Полиэфирополиол/K4[{Re6S8}(CN)6] (1 : 4) |
| Зависимость от pH (модификатор – хитозан/K4[{Re6S8}(ОН)6]) | ||
| 383 | 0.2 | Буферный раствор pH 6.0 |
| 310 | 1.3 | Буферный раствор pH 7.0 |
| 504 | 0.6 | Буферный раствор pH 8.0 |
| Зависимость от pH (модификатор – полиэфирополиол/K4[{Re6S8}(CN)6]) | ||
| 589 | 3.8 | Буферный раствор pH 6.0 |
| 525 | 4.7 | Буферный раствор pH 7.0 |
| 524 | 0.3 | Буферный раствор pH 8.0 |
Таким образом, матричный материал незначительно влияет на электрохимическое поведение кластеров.
Изучение влияния рН среды (значения, близкие к рН крови и мочи) на электрохимическое поведение гексарениевых халькогенидных кластеров показало, что максимальный аналитический сигнал по величине и его сдвиг в менее положительную область потенциалов наблюдаются для обоих кластеров при рН 7.0 (табл. 1).
Рассмотрено влияние на аналитический сигнал последовательности нанесения компонентов на поверхность электрода: (а) предварительное смешивание хитозана с K4[{Re6S8}(OH)6] (1 : 1) с последующим нанесением смеси на поверхность трансдьюсера; (б) послойное нанесение: K4[{Re6S8}(OH)6] и далее хитозан (1 : 1); (в) послойное нанесение: хитозан и затем K4[{Re6S8}(OH)6] (1 : 1). Для вариантов (а) и (б) характерно уширение пика и уменьшение тока (до 0.4 мкА) в три раза в сравнении с вариантом (в) (1.3 мкА).
Максимальные значения тока окисления характерны для кластеров в составе композитов хитозан/ K4[{Re6S8}(OH)6] (1 : 2), хитозан/K4[{Re6S8}(CN)6] (1 : 2), полиэфирополиол/K4[{Re6S8}(OH)6] (1 : 2), полиэфирополиол/K4[{Re6S8}(CN)6] (1 : 4) (табл. 1).
Особенности получения биочувствительной части иммуносенсоров. Для получения биочувствительной части на поверхность модицифированного наноструктурированными материалами печатного графитового электрода наносили смесь для иммобилизации, содержащую Ат (разведение 1 : 10), ФБ с pH 7.5, полиэфирополиол H20-NH2 (1 мг/мл) и глутаровый альдегид (1%). Полученные иммуносенсоры оставляли на ночь в закрытой чашке Петри при 4°С [27]. Включение в состав смеси для иммобилизации сшивающего агента – глутарового альдегида – способствует прочному закреплению биорецептора на поверхности сенсора и снижению активности Ат [28]. Для предотвращения последнего в смесь добавляют H20-NH2 (часть альдегида связывается с аминогруппами полиола, не инактивируя при этом активные центры рецептора).
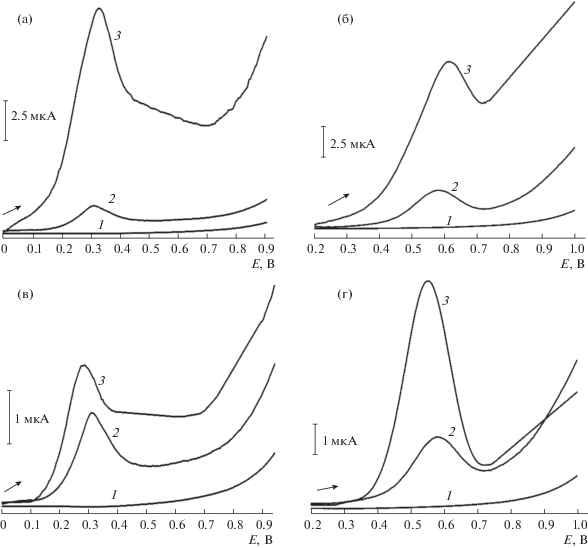
Модификация поверхности печатных графитовых электродов гибридными наноматериалами. K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] в присутствии углеродных нанотрубок. На поверхность электрода наносили дисперсию УНТ в полиэфирополиоле или хитозане (1 мг/мл), затем K4[{Re6S8}(OH)6] или K4[{Re6S8}(CN)6] (1 × 10–3 М). Каждый слой высушивали, после чего регистрировали дифференциально-импульсные вольтамперограммы в диапазоне потенциалов от 0.0 до 1.0 В при скорости развертки 10 мВ/с. На фоне ФБ с pH 7.0 в отсутствие или в присутствие УНТ наблюдаются пики электрохимического окисления K4[{Re6S8}(OH)6] в области потенциалов 310–320 мВ (рис. 1а) и K4[{Re6S8}(CN)6] в области потенциалов 570–600 мВ (рис. 1б). Таким образом, УНТ при послойном нанесении в присутствии хитозана способствуют увеличению тока окисления K4[{Re6S8}(OH)6] в семь раз (от 1.3 до 9.2 мкА) и K4[{Re6S8}(CN)6] в три раза (от 1.9 до 5.7 мкА) (рис. 1а и 1б, кривые 3).
Рис. 1.
Дифференциально-импульсные вольтамперограммы: фосфатный буферный раствор с pH 7.0 (кривые 1) (а), (б), (в), (г); K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] (кривые 2) (а), (б), (в), (г); УНТ–хитозан/K4[{Re6S8}(OH)6] (кривая 3) (а); УНТ–хитозан/K4[{Re6S8}(CN)6] (кривая 3) (б); ГО/хитозан/K4[{Re6S8}(OH)6] (кривая 3) (в); ГО/хитозан/K4[{Re6S8}(CN)6] (кривая 3) (г).
Связывание отрицательно заряженных кластеров с хитозановым слоем УНТ и ГО основано на их электростатическом притяжении к аммонийным группам на поверхности хитозана. Очевидно, что такое связывание должно приводить к равновесию, при котором кластеры могут находиться как в составе коллоидной фазы на основе УНТ и ГО, так и в растворе.
Люминесцентный анализ водной фазы, основанный на соответствующих свойствах кластеров, может быть использован для оценки распределения кластеров между фазами. Спектры люминесценции водных растворов кластеров до и после смешения с коллоидной фазой и последующего фазового разделения приведены на рис. 2.
Рис. 2.
Спектры люминесценции водных растворов K4[{Re6S8}(OH)6] (1) (а) и K4[{Re6S8}(CN)6] (1) (б) до фазового разделения и после фазового разделения K4[{Re6S8}(OH)6] + ГО (2) (а), K4[{Re6S8}(OH)6] + УНТ (3) (а), K4[{Re6S8}(CN)6] + ГО (2) (б), K4[{Re6S8}(CN)6] + УНТ (3) (б). ${{с}_{{{{{\text{K}}}_{{\text{4}}}}[\{ {\text{R}}{{{\text{e}}}_{{\text{6}}}}{{{\text{S}}}_{{\text{8}}}}\} {{{\left( {{\text{ОН}}} \right)}}_{{\text{6}}}}],{{{\text{K}}}_{{\text{4}}}}[\{ {\text{R}}{{{\text{e}}}_{{\text{6}}}}{{{\text{S}}}_{{\text{8}}}}\} {{{({\text{CN}})}}_{{\text{6}}}}]}}}$ = 0.035 мМ, сГО = = 0.02 мг/мл, сУНТ = 0.04 мг/мл.
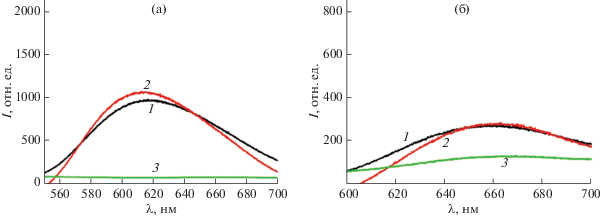
Так как оба кластера эффективно адсорбируются на УНТ, частицы, скорее всего, солюбилизируются за счет инкапсуляции внутрь агрегатов, образованных молекулами хитозана, в то время как амино/аммонийные группы остаются экспонированными на поверхности, что является предпосылкой адсорбции анионных кластеров.
K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] в присутствии оксида графена. На поверхность электрода послойно наносили водную дисперсию ГО (1 мг/мл), затем полиэфирополиол (1 мг/мл) или хитозан (0.75%) и K4[{Re6S8}(OH)6] или K4[{Re6S8}(CN)6] (1 × 10–3 М). Каждый слой высушивали, после чего регистрировали дифференциально-импульсные вольтамперограммы в диапазоне потенциалов от 0.0 до 1.0 В при скорости развертки 10 мВ/с. На фоне ФБ с pH 7.0 в отсутствие или в присутствии ГО наблюдаются пики электрохимического окисления K4[{Re6S8}(OH)6] в области потенциалов 260–300 мВ (рис. 1в) и K4[{Re6S8}(CN)6] в области потенциалов 550–570 мВ (рис. 1г). Таким образом, ГО при послойном нанесении в присутствии хитозана практически не изменяет величину тока окисления, однако происходит смещение потенциала окисления K4[{Re6S8}(OH)6] в менее положительную область, что свидетельствует о более легком протекании электрохимической реакции. Для K4[{Re6S8}(CN)6] в присутствии ГО и хитозана характерно увеличение аналитического сигнала в четыре раза (от 1.9 до 8.0 мкА).
В то время как оба кластера адсорбируются на УНТ, покрытом хитозаном, адсорбция на поверхности ГО–хитозан минимальна. Это можно объяснить различием в морфологии гибридных агрегатов УНТ–хитозан и ГО–хитозан. Следует отметить, что связывание гидрофобных УНТ с хитозаном может происходить за счет гидрофобности последнего, обусловленной наличием глюкозаминовых звеньев, что должно приводить к смешанным агрегатам с экспонированными на поверхности аммонийными группами. А гидрофильные отрицательно заряженные частицы ГО связывают молекулы хитозана прежде всего за счет электростатического взаимодействия с амино/аммонийными группами хитозана. В свою очередь, такое связывание частиц ГО с молекулами хитозана должно понижать способность амино/аммонийных групп хитозана адсорбировать анионные кластеры.
Спектроскопия электрохимического импеданса. Метод позволяет оценить сопротивление переноса электрона на границах электрод/модификатор и электрод/раствор, что дает ценную информацию при выявлении лучшего состава гибридного покрытия для модификации поверхности электродов. Согласно диаграммам Найквиста (рис. 3) лучшими гибридными наномодификаторами с наименьшими значениями сопротивления переноса электрона являются следующие наноматериалы: УНТ–хитозан (2 мг/мл)/K4[{Re6S8}(OH)6] (или K4[{Re6S8}(CN)6]), УНТ–H20-NH2 (2 мг/мл)/K4[{Re6S8}(OH)6] (или K4[{Re6S8}(CN)6]), ГО–хитозан–K4[{Re6S8}(OH)6] (или K4[{Re6S8}(CN)6]) в соотношении (1 : 2 : 2) и (1 : 2 : 1) соответственно, ГО–H20-NH2–K4[{Re6S8}(OH)6] (или K4[{Re6S8}(CN)6]) в соотношении (1 : 1 : 2) и (1 : 2 : 1) соответственно.
Рис. 3.
Диаграммы Найквиста. (а): 1 – УНТ–H20-NH2 (2 мг/мл)/K4[{Re6S8}(OH)6], 2 – УНТ–H20-NH2 (2 мг/мл)/K4[{Re6S8}(CN)6], 3 – УНТ–H20-NH2 (1.5 мг/мл)/K4[{Re6S8}(OH)6], 4 – УНТ–H20-NH2 (1 мг/мл)/K4[{Re6S8}(OH)6], 5 – УНТ–H20-NH2 (1 мг/мл)/K4[{Re6S8}(CN)6], 6 – УНТ–H20-NH2 (1.5 мг/мл)/K4[{Re6S8}(CN)6]; (б): 1 – УНТ–хитозан (2 мг/мл)/ K4[{Re6S8}(CN)6], 2 – УНТ–хитозан (2 мг/мл)/K4[{Re6S8}(OH)6], 3 – УНТ–хитозан (1 мг/мл)/ K4[{Re6S8}(OH)6], 4 – УНТ–хитозан (1 мг/мл)/K4[{Re6S8}(CN)6], 5 – УНТ–хитозан (1.5 мг/мл)/K4[{Re6S8}(CN)6], 6 – УНТ–хитозан (1.5 мг/мл)/K4[{Re6S8}(OH)6]; (в): 1 – ГО–H20-NH2–K4[{Re6S8}(CN)6] (1 : 2 : 1), 2 – ГО–H20-NH2–K4[{Re6S8}(OH)6] (1 : 1 : 2), 3 – ГО–H20-NH2–K4[{Re6S8}(OH)6] (1 : 2 : 1), 4 – ГО–H20-NH2–K4[{Re6S8}(CN)6] (1 : 2 : 2), 5 – ГО–H20-NH2–K4[{Re6S8}(CN)6] (1 : 1 : 2), 6 – ГО–H20-NH2–K4[{Re6S8}(OH)6] (1 : 2 : 2); (г): 1 – ГО–хитозан–K4[{Re6S8}(OH)6] (1 : 2 : 2), 2 – ГО–хитозан–K4[{Re6S8}(CN)6] (1 : 2 : 1), 3 – ГО–хитозан–K4[{Re6S8}(OH)6] (1 : 1 : 2), 4 – ГО–хитозан–K4[{Re6S8}(CN)6] (1 : 1 : 2), 5 – ГО–хитозан–K4[{Re6S8}(OH)6] (1 : 2 : 1), 6 – ГО–хитозан–K4[{Re6S8}(CN)6] (1 : 2 : 2).
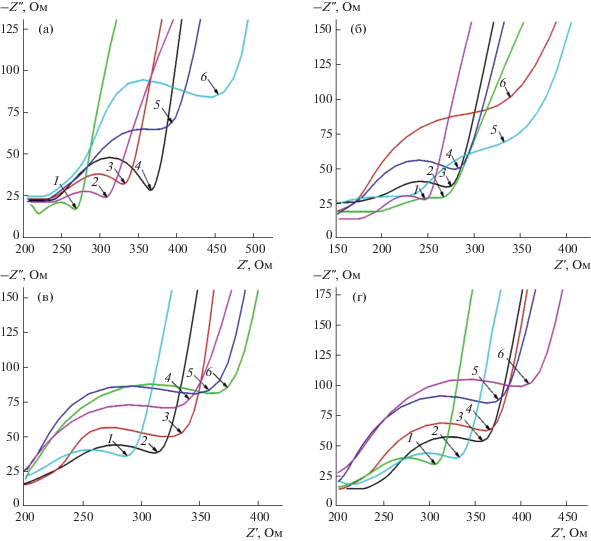
Уменьшение концентрации УНТ способствует увеличению сопротивления переноса электрона в 1.5 раза (рис. 3а, 3б), в то время как уменьшение концентрации ГО приводит к снижению сопротивления в 1.2 раза (рис. 3в, 3г).
Атомно-силовая микроскопия. Исследование морфологии получаемых покрытий электродной поверхности методом АСМ может дать ценную информацию для выбора наилучшей основы для разрабатываемых иммуносенсоров.
Как видно из представленных изображений (рис. 4), поверхность чистого электрода является развитой. Разброс по высоте на скане 3 × 3 мкм составляет 240 нм. На примере K4[{Re6S8}(CN)6] показано, что нанесение нанокластера приводит к его равномерному распределению на поверхности чистого электрода. Разброс по высоте на скане 3 × 3 мкм уменьшился до 120 нм. При этом концентрация K4[{Re6S8}(CN)6] (1 × 10–3 М) является достаточной для модификации поверхности электрода.
Рис. 4.
АСМ-изображения в режиме топографии поверхности в 2D проекциях: (а) – чистый электрод; (б) – K4[{Re6S8}(CN)6]; (в) – ГО–H20-NH2; (г) – ГО–H20-NH2–K4[{Re6S8}(CN)6] (1 : 2 : 1); (д) – УНТ–H20-NH2 (2 мг/мл); (е) – УНТ–H20-NH2(2мг/мл)/K4[{Re6S8}(CN)6].

Особенности структуры углеродных наноматериалов (ГО–H20-NH2 и УНТ–H20-NH2) позволяют им по-разному модифицировать поверхность электрода. При использовании ГО–H20-NH2 на поверхности формируются относительно крупные агломераты, по форме близкие к сферическим. Разброс по высоте на скане 3 × 3 мкм составил 250 нм. В результате модификации электрода с помощью УНТ–H20-NH2 на его поверхности сформировалась складчатая структура, а разброс по высоте даже на скане 1.6 × 1.6 мкм составил 240 нм. Используемая концентрация углеродных наноматериалов достаточна для увеличения шероховатости поверхности и использования ее в качестве основы для дальнейшего преобразования поверхности электрода.
Нанесение на поверхность углеродных наноматериалов (ГО–H20-NH2 и УНТ–H20-NH2) K4[{Re6S8}(CN)6] приводит к получению более однородной поверхности и к уменьшению разброса по высоте. В случае нанесения на поверхность УНТ K4[{Re6S8}(CN)6] происходит формирование относительно более мелких агломератов, по форме близких к сферическим по сравнению с поверхностью ГО.
Сочетание углеродных наноматериалов и нанокластеров приводит к сильному перепаду высот. В свою очередь, перепад высот может способствовать прочному закреплению Ат на поверхности электрода и их доступности для взаимодействия с антигеном (Аг) и к образованию более прочного иммунного комплекса Ат–Аг.
Результаты АСМ сопоставляли, используя параметры шероховатости, где под шероховатостью понимается совокупность неровностей поверхности с относительно малыми шагами выделенная с помощью базовой длины, связанные с высотными свойствами неровностей [29]: среднее квадратическое отклонение профиля в пределах базовой длины (Rq) и среднее арифметическое абсолютных значений отклонений профиля в пределах базовой длины (Ra). Из представленных АСМ-изображений в режиме топографии (рис. 4) следует, что добавление углеродных наноматериалов (ГО–H20-NH2 и УНТ–H20-NH2) приводит к увеличению Ra с 35.4 до 49.1 и 63.52 нм соответственно. В свою очередь, добавление углеродных наноматериалов (ГО–H20-NH2 и УНТ–H20-NH2) приводит и к увеличению Rq с 44.65 до 62.85 и 78.33 нм соответственно.
Природа формирования аналитического сигнала иммуносенсора. После нанесения гибридного наномодификатора на поверхность печатного графитового электрода наносили Ат в соответствующем разведении: (1 : 10, 1 : 50, 1 : 100, 1 : 200). Наличие Ат на модифицированной поверхности приводит к снижению тока окисления K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] (рис. 5а, кривая 2). Наименее выраженное уменьшение величины регистрируемого сигнала и наименьшее сопротивление переноса электрона обеспечивает разведение Ат 1 : 10.
Рис. 5.
(а) Дифференциально-импульсные вольтамперограммы: модификатор ГО–H20-NH2/K4[{Re6S8}(CN)6] (1), модификатор в присутствии антител (2), модификатор в присутствии антител и 1 × 10–8 М амитриптилина (3), фосфатный буферный раствор с pH 7.5 (4). (б) Зависимость логарифма тока окисления K4[{Re6S8}(CN)6] от логарифма скорости наложения потенциала. (в) Диаграммы Найквиста: модификатор УНТ–H20-NH2 (2мг/мл)/ K4[{Re6S8}(OH)6] (1), модификатор в присутствии антител (2), модификатор в присутствии антител и 1 × 10–9 М (3) и 1 × 10–8 М антигена (4).
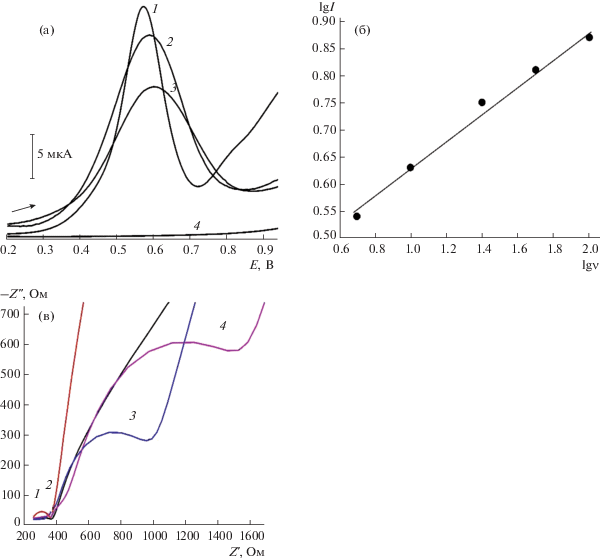
В ходе варьирования рН (6.0–8.0) установлено, что наибольшие токи окисления K4[{Re6S8}(OH)6] и K4[{Re6S8}(CN)6] регистрируются в этих условиях при рН 6.0 и 7.5. Однако смещение аналитического сигнала в более положительную область потенциалов при рН 6.0 и его уширение говорят о более затруднительном протекании электрохимической реакции в сравнении с той же реакцией при рН 7.5. Таким образом, для электроокисления кластеров в присутствии Ат наилучшим значением pH является 7.5.
Полученный иммуносенсор опускали в электрохимическую ячейку, содержащую Аг. Регистрировали дифференциально-импульсные вольтамперограммы в фоновом растворе (ФБ с pH 7.5) в диапазоне потенциалов от 0.0 до 1.0 В со скоростью сканирования 10 мВ/с (рис. 5а). Взаимодействие Ат с Аг приводит к образованию иммунного комплекса Аг–Ат на поверхности электрода, что проявляется в уменьшении аналитического сигнала (рис. 5а, кривая 3) за счет увеличения сопротивления на границе электрод/раствор. Нельзя исключить и возможность возникновения стерических препятствий за счет образования иммунных комплексов на поверхности иммуносенсоров.
Для установления природы тока рассмотрена его зависимость от скорости наложения потенциала (в режиме циклической вольтамперометрии). Критерий Семерано, рассчитанный из логарифмической зависимости величины тока окисления K4[{Re6S8}(CN)6] от скорости наложения потенциала (tg = lgI/lgν), равен 0.25 (рис. 5б), что указывает на кинетическую природу наблюдаемого тока [30].
Разработанные иммуносенсоры. По результатам исследований (электрохимическое поведение, данные спектроскопии электрохимического импеданса (СЭИ)) выбраны лучшие гибридные наноматериалы для использования их в качестве модификаторов поверхности печатных графитовых электродов (ПГЭ), взятых за основу следующих иммуносенсоров:
Иммуносенсор 1: ПГЭ, модифицированный дисперсией УНТ в полиэфирополиоле (2 мг/мл) и K4[{Re6S8}(OH)6] в соотношении 1 : 1 (УНТ–H20-NH2/K4[{Re6S8}(OH)6]/Ат).
Иммуносенсор 2: ПГЭ, модифицированный смесью дисперсии ГО в полиэфирополиоле и K4[{Re6S8}(OH)6] в соотношении 1 : 1 : 2 (ГО–H20-NH2–K4[{Re6S8}(OH)6]/Ат).
Иммуносенсор 3: ПГЭ, модифицированный дисперсией УНТ в полиэфирополиоле (1 мг/мл) и K4[{Re6S8}(CN)6] в соотношении 1 : 1 (УНТ–H20-NH2/K4[{Re6S8}(CN)6]/Ат).
Иммуносенсор 4: ПГЭ, модифицированный смесью дисперсии ГО в полиэфирополиоле и K4[{Re6S8}(CN)6] в соотношении 1 : 2 : 1 (ГО–H20-NH2–K4[{Re6S8}(CN)6]/Ат).
Аналитические характеристики импедиметрического иммуносенсора. В ходе нанесения Ат против ТЦА в присутствии Аг и образовании комплекса Ат–Аг обнаружено значительное изменение в сопротивлении переноса электрона, что использовано при разработке импедиметрического иммуносенсора (рис. 5в). Наилучшие аналитические характеристики получены в случае иммуносенсора 1, который обладает более широким диапазоном рабочих концентраций, хотя нижняя граница определяемых содержаний находится примерно на одном и том же уровне 5 × 10–11 М) (табл. 2) по отношению к иммуносенсору 2 (7 × 10–11 М). Для проверки правильности полученных результатов использовали метод введено–найдено (табл. 3). Погрешность определения (sr) не превышает 0.049.
Таблица 2.
Аналитические возможности импедиметрических иммуносенсоров при определении амитриптилина (разведение антител, 1 : 10, рН 7.5, n = 5, Р = 0.95)
| Лекарственное соединение | Область рабочих концентраций, М | Уравнение градуировочной зависимости ΔRet = (A ± δ) + (B ± δ)(–lgc) | сн, М | ||
|---|---|---|---|---|---|
| A ± δ | B ± δ | r | |||
| Иммуносенсор 1 (УНТ–H20-NH2/K4[{Re6S8}(ОН)6]/Ат) | |||||
| Амитриптилин | 1 × 10–10–1 × 10–5 | 1940 ± 136 | –196 ± 12 | 0.9978 | 5 × 10–11 |
| Дезипрамин | 1917 ± 131 | –193 ± 11 | 0.9981 | ||
| Имипрамин | 1953 ± 139 | –197 ± 12 | 0.9989 | ||
| Иммуносенсор 2 (ГО–H20-NH2–K4[{Re6S8}(ОН)6]/Ат) | |||||
| Амитриптилин | 1 × 10–10–1 × 10–6 | 1538 ± 108 | –149 ± 10 | 0.9963 | 7 × 10–11 |
| Дезипрамин | 1501 ± 104 | –145 ± 9 | 0.9983 | ||
| Имипрамин | 1525 ± 104 | –148 ± 10 | 0.9991 | ||
Таблица 3.
Результаты определения трициклических антидепрессантов иммуносенсорами (рН 7.5, n = 5, P = = 0.95)
| Лекарственное соединение | Введено, М | Найдено, М | sr |
|---|---|---|---|
| Импедиметрический иммуносенсор 1 (УНТ–H20-NH2/K4[{Re6S8}(ОН)6]/Ат) | |||
| Амитриптилин | 1 × 10–8 | (1.02 ± 0.05) × 10–8 | 0.037 |
| 1 × 10–7 | (1.00 ± 0.04) × 10–7 | 0.033 | |
| Дезипрамин | 1 × 10–8 | (1.03 ± 0.05) × 10–8 | 0.036 |
| 1 × 10–7 | (1.01 ± 0.04) × 10–7 | 0.032 | |
| Импедиметрический иммуносенсор 2 (ГО–H20-NH2–K4[{Re6S8}(ОН)6]/Ат) | |||
| Амитриптилин | 1 × 10–8 | (1.02 ± 0.06) × 10–8 | 0.049 |
| 1 × 10–7 | (1.01 ± 0.06) × 10–7 | 0.045 | |
| Имипрамин | 1 × 10–8 | (1.05 ± 0.06) × 10–8 | 0.048 |
| 1 × 10–7 | (1.04 ± 0.06) × 10–7 | 0.045 | |
| Амперометрический иммуносенсор 3 (УНТ–H20-NH2/K4[{Re6S8}(CN)6]/Ат) | |||
| Амитриптилин | 1 × 10–8 | (1.03 ± 0.04) × 10–8 | 0.031 |
| 1 × 10–7 | (1.01 ± 0.03) × 10–7 | 0.027 | |
| Дезипрамин | 1 × 10–8 | (1.02 ± 0.04) × 10–8 | 0.031 |
| 1 × 10–7 | (1.01 ± 0.03) × 10–7 | 0.027 | |
| Амперометрический иммуносенсор 4 (ГО–H20-NH2/K4[{Re6S8}(CN)6]/Ат) | |||
| Амитриптилин | 1 × 10–8 | (1.02 ± 0.04) × 10–8 | 0.029 |
| 1 × 10–7 | (1.00 ± 0.03) × 10–7 | 0.024 | |
| Имипрамин | 1 × 10–8 | (1.02 ± 0.04) × 10–8 | 0.029 |
| 1 × 10–7 | (1.01 ± 0.03) × 10–7 | 0.024 | |
Аналитические характеристики амперометрического иммуносенсора. Лучшими аналитическими характеристиками обладает иммуносенсор 4, характеризующийся более широким диапазоном рабочих концентраций с нижней границей определяемых содержаний на уровне 4 × 10–11 М (табл. 4) по отношению к иммуносенсору 3. Для проверки правильности полученных результатов использовали метод введено–найдено (табл. 3).
Таблица 4.
Аналитические возможности амперометрических иммуносенсоров при определении трициклических антидепрессантов (рН 7.5, разведение антител 1 : 10, n = 5, Р = 0.95)
| Лекарственное соединение | Область рабочих концентраций, М | Уравнение градуировочной зависимости I* = (A ± δ) + (B ± δ)(–lgc) | сн, М | ||
|---|---|---|---|---|---|
| A ± δ | B ± δ | r | |||
| Иммуносенсор 3 (УНТ–H20-NH2/K4[{Re6S8}(CN)6]/Ат) | |||||
| Амитриптилин | 1 × 10–10–1 × 10–6 | 198 ± 10 | –18.9 ± 0.8 | 0.9995 | 6 × 10–11 |
| Дезипрамин | 197 ± 9 | –18.7 ± 0.8 | 0.9994 | ||
| Имипрамин | 198 ± 10 | –18.9 ± 0.8 | 0.9996 | ||
| Иммуносенсор 4 (ГО–H20-NH2/K4[{Re6S8}(CN)6]/Ат) | |||||
| Амитриптилин | 1 × 10–10–1 × 10–5 | 204 ± 12 | –20.2 ± 1.0 | 0.9990 | 4 × 10–11 |
| Дезипрамин | 199 ± 11 | –19.8 ± 1.0 | 0.9992 | ||
| Имипрамин | 200 ± 11 | –19.9 ± 1.0 | 0.9996 | ||
Определение лекарственного вещества в лекарственной форме. На основе полученных результатов предложена методика определения амитриптилина, дезипрамина и имипрамина в соответствующих фармацевтических препаратах.
Методика определения. Таблетку препарата растирали в ступке в порошок, растворяли в дистиллированной воде (10 мл) с добавлением этилового спирта (5 мл). После центрифугирования (15 мин, 7000 об/мин) надосадочную жидкость переносили в мерную колбу емк. 25 мл. Нерастворившийся осадок обрабатывали 10 мл дистиллированной воды и центрифугировали при тех же условиях. Раствор переносили в колбу и доводили водой до метки. 20 мкл полученного раствора переносили в ячейку объемом 2 мл, добавляя ФБ с рН 7.5 до нужного объема, и регистрировали токи окисления K4[{Re6S8}(CN)6] иммуносенсором 4. По полученным значениям I* рассчитывали концентрацию активного компонента в лекарственном препарате (табл. 5).
Таблица 5.
Аналитические возможности разработанных иммуносенсоров при определении амитриптилина в урине (рН 6.0, n = 5, Р = 0.95)
| Тип иммуносенсора | Область рабочих концентраций, М | Уравнение градуировочной зависимости I*(ΔRet) = (A ± δ) + (B ± δ) × (–lgc) | сн, М | ||
|---|---|---|---|---|---|
| A ± δ | B ± δ | r | |||
| Импедиметрический иммуносенсор 1 | 1 × 10–10–1 × 10–5 | 1906 ± 131 | –185 ± 12 | 0.9972 | 5 × 10–11 |
| Импедиметрический иммуносенсор 2 | 1 × 10–10–1 × 10–6 | 1497 ± 102 | –138 ± 9 | 0.9961 | 7 × 10–11 |
| Амперометрический иммуносенсор 3 | 1 × 10–10–1 × 10–6 | 192 ± 10 | –18.0 ± 0.8 | 0.9980 | 6 × 10–11 |
| Амперометрический иммуносенсор 4 | 1 × 10–10–1 × 10–5 | 197 ± 10 | –18.8 ± 1.0 | 0.9976 | 4 × 10–11 |
Примечание: I* = ((IАт – IК)/IАт) × 100%, где IАт – величина аналитического сигнала (ток) в присутствии Ат, IК – величина аналитического сигнала (ток) при образовании иммунного комплекса; ΔRet = ((Ret(imr) – Ret(ims))/Ret(ims)) × 100%, где Ret(imr) – сопротивление переноса электрона на границе электрод/модификатор при образовании иммунного комплекса Ат–Аг, Ret(ims) – сопротивление переноса электрона на границе электрод/модификатор в присутствии Ат.
Для проверки правильности полученные результаты сопоставили с данными спектрофотометрии (максимумы поглощения: амитриптилин 239 нм, имипрамин и дезипрамин 251 нм) [31]. Экспериментально полученные значения критерия Фишера (Fэксп = 2.24) и коэффициента Стьюдента (tэксп = 1.03) (n = 5, P = 0.95) меньше табличных (Fтабл = 6.39 и tэксп = 2.78), что указывает на равноточность полученных результатов и незначимость систематической погрешности.
Определение лекарственного вещества в урине. Антидепрессанты выводятся из организма с мочой, поэтому разработанные иммуносенсоры опробовали при определении амитриптилина (табл. 5) в модельном растворе урины (pH 6.0) (рН мочи в норме от 5.0 до 6.5) состава: мочевина, NaCl, Na2SO3, KCl, KH2PO4, СаCl2, NH4Cl, креатинин [32].
Методика определения. В ячейку объемом 2 мл наливали модельный раствор урины (или модельный раствор урины и гексацианоферратов калия), опускали иммуносенсор 4 (или иммуносенсор 1) и регистрировали ток окисления K4[{Re6S8}(CN)6] (или сопротивление переноса электрона). Затем добавляли 20 мкл раствора лекарственного вещества (рабочий диапазон концентраций 1 × 10–10–1 × 10–5 М) и регистрировали аналитический сигнал. По полученным значениям I* и ΔRet (см. табл. 5) рассчитывали концентрацию амитриптилина.
Относительное стандартное отклонение определения ТЦА в модельном растворе урины импедиметрическими и амперометрическими иммуносенсорами с лучшими характеристиками не превышает 0.050 и 0.034 соответственно.
* * *
Таким образом, на основании результатов дифференциальной импульсной вольтамперометрии и спектроскопии электрохимического импеданса предложены гибридные наномодификаторы на основе углеродных наноматериалов (УНТ и ГО) в H20-NH2 или хитозане и гексарениевых халькогенидных нанокластеров для высокочувствительного и селективного иммунохимического определения ТЦА (амитриптилин, дезипрамин, имипрамин). Сведения об амперометрических и импедиметрических иммуносенсорах для определения ТЦА в литературе отсутствуют, поэтому предложенные иммуносенсоры перспективны для решения поставленных в работе задач. Предложенные методики определения трициклических антидепрессантов разработанными иммуносенсорами в фармацевтических препаратах и урине характеризуются значениями sr не более 0.050.
Список литературы
Kurbanoglu S., Unal M.A., Ozkan S.A. Recent developments on electrochemical flow injection in pharmaceuticals and biologically important compounds // Electrochim. Acta. 2018. V. 287. P. 135.
Frangu A., Pravcová K., Šilarová P., Arbneshi T., Sýs M. Flow injection tyrosinase biosensor for direct determination of acetaminophen in human urine // Anal. Bioanal. Chem. 2019. V. 411. № 11. P. 2415.
Santos A.M., Silva T.A., Vicentini F.C., Fatibello-Filho O. Flow injection analysis system with electrochemical detection for the simultaneous determination of nanomolar levels of acetaminophen and codeine // Arabian J. Chem. 2020. V. 13. № 1. P. 335.
Farnoudian-Habibi A., Massoumi B., Jaymand M. A novel strategy for spectrophotometric simultaneous determination of amitriptyline and nortriptyline based on derivation with a quinonoid compound in serum samples // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2016. V. 168. P. 235.
Safari M., Shahlaei M., Yamini Y., Shakorian M., Arkan E. Magnetic framework composite as sorbent for magnetic solid phase extraction coupled with high performance liquid chromatography for simultaneous extraction and determination of tricyclic antidepressants // Anal. Chim. Acta. 2018. V. 1034. P. 204.
Rysavá L., Dvorák M., Kubán P. The effect of membrane thickness on supported liquid membrane extractions in-line coupled to capillary electrophoresis for analyses of complex samples // J. Chromatogr. A. 2019. V. 1596. P. 226.
de Oliveira F.M., Scheel G.L., Augusti R., Tarley C.R.T., Nascentes C.C. Supramolecular microextraction combined with paper spray ionization mass spectrometry for sensitive determination of tricyclic antidepressants in urine // Anal. Chim. Acta. 2020. V. 1106. P. 52.
Feng Y., Zheng M., Zhang X., Kang K., Kang W., Lian K., Yang J. Analysis of four antidepressants in plasma and urine by gas chromatography-mass spectrometry combined with sensitive and selective derivatization // J. Chromatogr. A. 2019. V. 1600. P. 33.
Kasagic-Vujanovic I., Jancic-Stojanovic B. Quality by design oriented development of hydrophilic interaction liquid chromatography method for the analysis of amitriptyline and its impurities // J. Pharm. Biomed. Anal. 2019. V. 173. P. 86.
Karami M., Yamini Y. On-disc electromembrane extraction-dispersive liquid-liquid microextraction: A fast and effective method for extraction and determination of ionic target analytes from complex biofluids by GC/MS // Anal. Chim. Acta. 2020. V. 1105. P. 95.
Li H., Xu B., Wang D., Zhou Y., Zhang H., Xia W., Xu S., Li Y. Immunosensor for trace penicillin G detection in milk based onsupported bilayer lipid membrane modified with gold nanoparticles // J. Biotechnol. 2015. V. 203. P. 97.
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Медведева О.И., Кутырева М.П., Улахович Н.А., Фаттахова А.Н., Коновалова О.А., Будников Г.К. Гиперразветвленные полиэфирополиолы в составе амперометрических моноаминоксидазных биосенсоров на основе электродов, модифицированных наноматериалами, для определения антидепрессантов // Журн. прикл. химии. 2017. Т. 90. № 1. С. 104. (Medyantseva E.P., Brusnitsyn D.V., Varlamova R.M., Medvedeva O.I., Kutyreva M.P., Ulakhovich N.A., Fattakhova A.N., Konovalova, O.A., Budnikov H.C. Hyperbranched polyesterpolyols as components of amperometric monoamine oxidase biosensors based on electrodes modified with nanomaterials for determination of antidepressants // Russ. J. Appl. Chem. 2017. V. 90. № 1. P. 97.)
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Максимов А.А., Коновалова О.А., Будников Г.К. Модификация поверхности электродов углеродными нанотрубками и наночастицами металлов золота и серебра в моноаминоксидазных биосенсорах для определения некоторых антидепрессантов // Журн. аналит. химии. 2017. Т. 72. № 4. С. 305. (Medyantseva E.P., Brusnitsyn D.V., Varlamova R.M., Maksimov A.A., Konovalova O.A., Budnikov H.C. Surface modification of electrodes by carbon nanotubes and gold and silver nanoparticles in monoaminoxidase biosensors for the determination of some antidepressants // J. Anal. Chem. 2017. V. 72. № 4. Р. 362.)
Othman A.M., Wollenberger U. Amperometric biosensor based on coupling aminated laccase to functionalized carbon nanotubes for phenolics detection // Int. J. Biol. Macromol. 2020. V. 153. P. 855.
Fiorani A., Merino J.P., Zanut A., Criado A., Valenti G., Prato M., Paolucci F. Advanced carbon nanomaterials for electrochemiluminescent biosensor applications // Curr. Opin. Electrochem. 2019. V. 16. P. 66.
Elistratova J.G., Mustafina A.R., Brylev K.A., Petrov K.A., Shestopalov M.A., Mironov Y.V., Babaev V.M., Rizvanov I.K., Massonc P., Sinyashina O.G. Sensing activity of cholinesterases through a luminescence response of the hexarhenium cluster complex [{Re6S8}(OH)6]4– // Analyst. 2016. V. 141. № 13. P. 4204.
Patel H., Rawtani D., Agrawal Y.K. A newly emerging trend of chitosan-based sensing platform for the organophosphate pesticide detection using acetylcholinesterase – A review // Trends Food Sci. Technol. 2019. V. 85. P. 78.
Farias E.D., Passeggi M.C.G., Brunetti V. Thermal transitions in hyperbranched polyester-polyol assemblies on carbon // Eur. Polym. J. 2018. V. 102. P. 68.
Medyantseva E.P., Brusnitsyn D.V., Varlamova (Beilinson) R.M., Konovalova O.A., Budnikov H.K. Nanostructured composites based on graphene and cobalt nanoparticles in monoamine oxidase biosensors for determining antidepressants // Inorg. Mater. 2019. V. 55. № 14. P. 1390.
Krasilnikova A.A., Solovieva A.O., Ivanov A.A., Trifonova K.E., Pozmogova T.N., Tsygankova A.R., Smolentsev A.I., Kretov E.I., Sergeevichev D.S., Shestopalov M.A., Mironov Y.V., Shestopalov A.M., Poveshchenko A.F., Shestopalova L.V. Comprehensive study of hexarhenium cluster complex Na4[Re6Te8(CN)6] – In terms of a new promising luminescent and X-ray contrast agent // Nanomedicine: NBM. 2017. V. 13. № 2. P. 755.
Yarovoi S.S., Mironov Y.V., Naumov D.Y., Gatilov Y.V., Kozlova S.G., Kim S.J., Fedorov V.E. Octahedral hexahydroxo rhenium cluster complexes [Re6Q8(OH)6]4– (Q = S, Se): Synthesis, structure, and properties // Eur. J. Inorg. Chem. 2005. V. 19. № 19. P. 3945.
Ivanov A.A., Falaise C., Abramov P.A., Shestopalov M.A., Kirakci K., Lang K., Moussawi M.A., Sokolov M.N., Naumov N.G., Floquet S., Landy D., Haouas M., Brylev K.A., Mironov Y.V., Molard Y., Cordier S., Cadot E. Host–guest binding hierarchy within redox- and luminescence-responsive supramolecular self-assembly based on chalcogenide clusters and γ-cyclodextrin // Chem. Eur. J. 2018. V. 24. № 51. P. 13467.
Ziganshin M.A., Safiullina A.S., Gerasimov A.V., Ziganshina S.A., Klimovitskii A.E., Khayarov K.R., Gorbatchuk V.V. Thermally induced self-assembly and cyclization of L-leucyl-L-leucine in solid state // J. Phys. Chem. B. 2017. V. 121. № 36. P. 8603.
Ziganshin M.A., Morozova A.S., Ziganshina S.A., Vorobev V.V., Suwińska K., Bukharaev A.A., Gorbatchuk V.V. Additive and antagonistic effects of substrate and vapors on self-assembly of glycyl-glycine in thin films // Mol. Cryst. Liq. Cryst. 2019. V. 690. № 1. P. 67.
Brylev K.A., Mironov Y.V., Yarovoi S.S., Naumov N.G., Fedorov V.E., Kim S.J., Kitamura N., Kuwahara Y., Yamada K., Ishizaka S., Sasak Y. A family of octahedral rhenium cluster complexes [Re6Q8(H2O)n(OH)6 –n]n– 4 (Q = S, Se; n = 0–6): Structural and pH–dependent spectroscopic studies // Inorg. Chem. 2007. V. 46. № 18. P. 7414.
Naumov N., Ostanina E.V., Virovets A.V., Schmidtman M., Müller A., Fedorov V. Electron Re6 metal clusters: Syntheses and crystal structures of (Ph4P)3[Re6S8(CN)6], (Ph4P)2(H)[Re6Se8(CN)6]⋅8H2O, and (Et4N)2(H)-[Re6Te8(CN)6]⋅2H2O // Russ. Chem. Bull. 2002. V. 51. № 5. P. 799.
Медянцева Э.П., Брусницын Д.В., Газизуллина Э.Р., Варламова (Бейлинсон) Р.М., Коновалова О.А., Будников Г.К. Гибридные нанокомпозиты как модификаторы электродов амперометрических иммуносенсоров при определении амитриптилина // Журн. аналит. химии. 2020. Т. 75. № 4. С. 360. (Medyantseva E.P., Brusnitsyn D.V., Gazizullina E.R., Varlamova (Beilinson) R.M., Konovalova O.A., Budnikov H.C. Hybrid nanocomposites as electrode modifiers in amperometric immunosensors for the determination of amitriptyline // J. Anal. Chem. 2020. V. 75. № 4. P. 536.)
Комарова Н.В., Андрианова М.С., Савельев М.И., Кузнецов А.Е. Оптимизация процесса функционализации поверхности оксида кремния при создании рецепторного слоя биосенсора для детекции взрывчатых веществ // Вестн. Моск. ун-та. Сер. 2. Химия. 2015. Т. 56. № 6. С. 379.
ГОСТ 25142-82. Шероховатость поверхности. Термины и определения. М.: Стандартинформ, 2018. С. 8.
Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основы современного электрохимического анализа: учебник для вузов. М.: Мир, 2003. 592 с.
Государственная фармакопея Российской федерации: в 4-х тт. Т. 3. 14-е издание. М., 2018. 7019 с.
Pietrzyńska M., Voelkel A. Stability of simulated body fluids such as blood plasma, artificial urine and artificial saliva // Microchem. J. 2017. V. 134. № 6. P. 197.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


