Журнал аналитической химии, 2021, T. 76, № 12, стр. 1111-1122
Энантиоселективные вольтамперометрические сенсоры на основе аминокислотных комплексов Cu(II), Co(III), Zn(II)
Р. А. Зильберг a, *, Л. Р. Загитова a, И. В. Вакулин a, Ю. А. Яркаева a, Ю. Б. Терес a, Т. В. Берестова a
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: ZilbergRA@yandex.ru
Поступила в редакцию 25.01.2021
После доработки 07.06.2021
Принята к публикации 07.06.2021
Аннотация
Исследованы электрохимические и аналитические характеристики энантиоселективных сенсоров на основе стеклоуглеродных электродов, модифицированных хелатными комплексами (бис(L-фенилаланинат) меди(II), глицинато-L-фенилаланинат меди(II), трис(L-фенилаланинат) кобальта(II), бис(L-фенилаланинат) цинка). Установлено, что наиболее перспективным для определения энантиомеров триптофана является сенсор, модифицированный (бис)L-фенилаланинатом меди(II). При определении энантиомеров триптофана указанный сенсор обеспечивает линейный диапазон концентраций от 6.25 × 10–7 до 0.5 × 10–3 М для L-триптофана и от 5 × 10–6 до 0.5 × 10–3 М для D-триптофана. Бóльшую чувствительность сенсор проявляет к L-триптофану. Предложенный сенсор использован для распознавания и определения энантиомеров триптофана в образцах мочи и плазмы крови человека, а также в смеси энантиомеров. Статистическая оценка результатов определений методом введено–найдено свидетельствует об отсутствии значимой систематической погрешности.
Современная фармакология и медицинская химия базируются на разработке и применении хиральных молекул в качестве действующих веществ. Необходимость использования оптически активных веществ с высокой степенью оптической чистоты в фармакологии вытекает из современных представлений молекулярной биологии, генетики и физиологии о механизмах действия лекарственных препаратов. Очевидно, что широкое использование оптически активных веществ предъявляет особые требования к аналитическим методам, которые применяются на всех стадиях разработки и применения лекарственных препаратов: определение оптической чистоты, установление конфигурации, определение энантиомеров в ходе доклинических исследований, анализ качества препаратов, содержащих оптически активные вещества. Одним из перспективных методов, способным решать перечисленные задачи, является вольтамперометрия с использованием энантиоселективных сенсоров [1–4].
Современные стратегии создания энантиоселективных сенсоров предполагают использование технологии молекулярного импринтинга [5–8] или применение хиральных модификаторов различной природы [9–17], которые создают на поверхности электрода хиральный слой. Последний, собственно, и задает энантиоселективность по отношению к оптическим изомерам аналитов. В рамках второй стратегии энантиоселективные сенсоры на основе композитных стеклоуглеродных электродов выгодно отличаются простотой изготовления, доступностью и некоторой универсальностью, т.е. возможностью определения ряда аналитов одним сенсором [1]. Важным преимуществом таких сенсоров является возможность надежной идентификации и определения энантиомеров в присутствии широкого спектра посторонних компонентов [17].
Несмотря на определенные успехи в создании и применении энантиоселективных сенсоров на основе композитных стеклоуглеродных электродов, поиск оптимальных хиральных модификаторов все еще остается важной и актуальной задачей. Действительно, широко используемые в настоящее время модификаторы, такие как аминокислоты и их производные [9, 10], циклодекстрины [11–13], краун-эфиры [14], хиральные биополимеры (белки, полисахариды) [13, 15, 16], чаще всего не способны одновременно удовлетворять всем требованиям, предъявляемым к хиральным модификаторам: обладать низкой стоимостью, стабильностью, воспроизводимостью, быть простыми в изготовлении.
В данной работе изучена возможность применения хелатных комплексов переходных металлов Cu(II), Co(III), Zn(II) в качестве хиральных селекторов при создании композитных энантиоселективных вольтамперометрических сенсоров. Подобные комплексы вполне устойчивы [18–20], доступны и способны обеспечить достаточную энантиоселективность при определении хиральных органических соединений [21–25].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. Все электрохимические измерения проводили на потенциостате/гальваностате AUTOLAB PGSTAT 204 с модулем FRA 32M (Metrohm AUTOLAB, Нидерланды). Измерения проводили в стандартной термостатированной трехэлектродной ячейке при 25 ± 0.1°С. Индикаторным электродом служил модифицированный стеклоуглеродный электрод (СУЭ) (d = 3 мм), в качестве вспомогательного электрода использовали платиновую пластинку площадью 200 мм2. Все измерения проводили относительно насыщенного хлоридсеребряного электрода.
Для модифицирования СУЭ использовали композит аминокислотного комплекса переходных металлов и полиэлектролитного комплекса (ПЭК) (табл. 1) на основе гидрохлорида хитозана (ПЭК-АК) (с молекулярной массой 30 кДа и степенью деацетилирования 75%) и натриевой соли N-сукцинилхитозана (с молекулярной массой 200 кДа, полученной из хитозана со степенью деацетилирования 82%) (ЗАО “Биопрогресс”, Россия).
Таблица 1.
Состав модификаторов
| Формула комплекса | Структура комплекса |
|---|---|
| [Cu(L-Phe)2] |  |
| [Cu(L-Phe)(Gly)] |  |
| [Zn(L-Phe)2] |  |
| [Cо(L-Phe)3] |  |
| Полиэлектролитный комплекс на основе хитозана и N-сукцинилхитозана |  |
Поверхность и микроструктуру образцов пленки изучали методом сканирующей электронной микроскопии (СЭМ) с полевой эмиссией на электронном микроскопе HITACHI Regulus SU8220 (Япония). Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 1 кВ. На рис. 1 приведены СЭМ-снимки поверхности СУЭ, модифицированных ПЭК и ПЭК/[Cu(L-Phe)2]. Видно, что поверхность электрода при нанесении ПЭК формирует однородную пленку, где более темные пятна обусловлены пленкой меньшей толщины. В то же время ПЭК/[Cu(L-Phe)2] формирует на поверхности СУЭ неоднородную зернистую структуру, на поверхности которой формируются дополнительные частицы размером ~2–4 мкм, напоминающие сростки кристаллов неправильной формы.
Рис. 1.
СЭМ-изображения поверхности стеклоуглеродных электродов, модифицированных ПЭК (а) и ПЭК/[Cu(L-Phe)2] (б).

Величину pH измеряли с помощью pH-метра Seven Compact pH/Ion S220 (Mettler-Toledo AG, Швейцария).
В качестве индифферентного электролита использовали 0.1 M фосфатный буферный раствор (ФБ) с pH 6.86, содержащий Na2HPO4 и KH2PO4. Раствор [Fe(CN)6]4–/3– готовили с использованием 0.1 M раствора KCl в качестве фонового электролита. Все водные растворы приготовлены с использованием деионизованной воды с удельной проводимостью 0.1 мкСм/см.
В качестве исследуемых веществ использовали D- и L-триптофан (Trp), D- и L-тирозин (Tyr), и R- и S-пропранолол (Prp) (≥97%) (Sigma-Aldrich, США). Растворы энантиомеров (0.5 мМ) готовили растворением навески вещества в 100 мл ФБ с рН 6.86. Растворы более низких концентраций получали путем последовательного разбавления исходных растворов. Исследуемый раствор объемом 20 мл помещали в электрохимическую ячейку.
Свежезамороженную плазму крови (А(II)Rh+) человека приобретали на Республиканской станции переливания крови (Уфа), образцы мочи получали с письменного согласия донора. Образцы мочи и плазмы крови объемом 2 мл центрифугировали в течение 10 мин. В полученные растворы добавляли известные количества D- и L-Trp для получения растворов с концентрациями 0.04, 0.08, 0.3 мМ. Затем разбавляли ФБ с рН 6.86 в колбах емк. 25 мл, доводя раствор до метки.
Модифицирование стеклоуглеродного электрода. Перед каждым измерением поверхность стеклоуглеродного рабочего электрода полировали в течение 1 мин специальным материалом Spec-Cloth Adhesive black disc 200 мм с нанесенной на него деагломерированной суспензией оксида алюминия (0.3 мкм) с последующим многократным промыванием электрода деионизованной водой и высушиванием на воздухе при комнатной температуре.
Гидрохлорид хитозана получали в виде пленки из солянокислого раствора хитозана (0.25 г хитозана в 50 мл 1%-ной HCl) путем высушивания в сушильном шкафу до постоянной массы. Водные дисперсии полиэлектролитного комплекса получали путем добавления к водным растворам N-сукцинилхитозана (0.005%) по каплям водный раствор гидрохлорида хитозана (0.005%) при интенсивном перемешивании (500 об/мин) и 25°С с интервалом между введением порций 2 мин. При добавлении к полученному раствору новых порций раствора гидрохлорида хитозана происходит разделение фаз (возникает устойчивая опалесценция общей системы). Область существования дисперсий частиц полиэлектролитного комплекса указанных полисахаридов ограничивается мольным соотношением равным 1 : 10, выше которого в процессе смешения компонентов наблюдается образование осадка комплекса [26]. Полиэлектролитный комплекс хранили в течение 5 сут в холодильнике.
Бис[Cu(L-Phe)2] [27], [Zn(L-Phe)2] и разнолигандные [Cu(L-Phe)(Gly)] хелатные комплексы получали взаимодействием растворов соли металла с L-фенилаланином (L-Phe) в соотношении 1 : 2; с L-фенилаланином и глицином (Gly) в соотношении 1 : 1 : 1 на основе методики [28]. Комплекс [Cо(L-Phe)3] получали на основе методики [29].
Для синтеза комплексов использовали аминокислоты и кристаллогидраты солей Cu(II), Co(III), Zn(II) ч. д. а. (“AppliChem Panreac” ITW Companies, “авилон-компанихим”, Россия).
Твердые образцы комплексов [Cu(L-Phe)2], [Cо(L-Phe)3], [Zn(L-Phe)2], [Cu(L-Phe)(Gly)] анализировали методом Фурье-ИК-спектроскопии и рентгенофазовым анализом (дифрактометр ДРОН-4, линия CuKα 1.5406 Ǻ).
ИК (KBr), cм–1 [Cо(L-Phe)3]: 3064–3029 ср. (νas, s(–NH2)); 2840 ср. (νas, s(CH, CH2)); 1612 о.с., 1603 о.с. (νas, s(C=O)); 1368 ср. ((νas, s(C–O) + + δ(CH)); 1154 сл., 1076–1062 сл. (ν(C–N) + + δ(NH2) + δ(CH)).
ИК (KBr), cм–1 [Zn(L-Phe)2]: 3334 ср., 3258 ср., 3029 ср. (νas, s(–NH2)); 2957 ср., 2912 сл., 2871 сл. (νas, s(CH, CH2)); 1625 о.с., 1620 о.с., 1614 о.с. (νas, s(C=O)); 1409 ср., 1390 ср., 1367 сл., 1343 сл., 1324 сл. ((νas, s(C–O) + δ(CH)); 1088 ср., 1073 ср. (ν(C–N) + δ(NH2) + δ(CH)).
ИК (KBr), cм–1 [Cu(L-Phe)(Gly)]: 3331 сл., 3309 сл., 3245 ср. (νas, s(–NH2)); 2830 (νas, s(–CH, CH2)); 1620 о.с. (νas, s(C=O)); 1396 ср., 1367ср., 1328 ср. ((νas, s(C–O) + δ(CH)); 1123 ср., 1077 ср. (ν(C–N) + + δ(NH2) + δ(CH)). ИК-спектр [Cu(L-Phe)2] приведен в работе [29]. ИК-спектры поглощения регистрировали в диапазоне 450–3700 см–1 с использованием Фурье-спектрометра FTIR-8400S (Shimadzu) при комнатной температуре. Разрешение – 4 см–1, количество сканирований – 20.
Раствор композита ПЭК-АК готовили растворением точной навески (0.002 г) комплексов [Cu(L-Phe)2], [Cо(L-Phe)3], [Zn(L-Phe)2] в 10 мл готового раствора ПЭК с последующим выдерживанием в ультразвуковой ванне в течение 20 мин и фильтрованием.
С помощью автоматической пипетки отбирали 10 мкл готового раствора ПЭК-АК и наносили на поверхность предварительно отполированного СУЭ, далее сушили электрод под ИК-лампой в течение 6 мин и давали ему остыть в течение 3 мин.
Методика эксперимента. Линейные вольтамперограммы регистрировали в диапазоне потенциалов от 0.0 до 1.2 В, циклические вольтамперограммы – от 0.6 до 1.4 В, со скоростью развертки потенциала 0.1 В/с. Спектры импеданса регистрировали в диапазоне частот переменного тока от 500 кГц до 0.1 Гц с амплитудой 5 мВ.
Структуры и термодинамические параметры индивидуальных соединений и комплексов рассчитывали с использованием полуэмпирического приближения PM3 [30–33]. Структуры ассоциатов типа ${\text{M}}{{({\text{L - Phe}})}_{n}}{\text{*L - Trp}}$ определяли в два этапа из-за большого количества вариантов взаимного расположения взаимодействующих молекул. На первом этапе в программе Accelrys Material Studio v6.0 [34–36] методом молекулярной механики в приближении силового поля Compass-II [37] с использованием оптимизации по методу Монте-Карло [38] определяли предварительное наиболее выгодное взаимное расположение молекул в ассоциате. После этого для полученной структуры проводили оптимизацию и расчет энтальпии образования в приближении PM3. Энтальпию ассоциации рассчитывали по закону Гесса.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для сравнения аналитических характеристик энантиоселективных вольтамперометрических сенсоров используют общие для всех сенсоров параметры: селективность, чувствительность, предел обнаружения, рабочий диапазон, точность, время отклика, срок эксплуатации и др. Среди них самой важной характеристикой является селективность [1]. В настоящей работе изучена селективная специфичность предложенных сенсоров по отношению к энантиомерам ряда биологически активных веществ: Tyr, Prp и Trp. Схемы электроокисления аналитов представлены в табл. 2.
Из табл. 3 видно, что наибольшая разница в потенциалах окисления и коэффициентах селективности наблюдается для энантиомеров Trp для сенсора СУЭ/ПЭК-[Cu(L-Phe)2]. Таким образом, наиболее перспективным сенсором с модификатором хелатной природы для определения энантиомеров Trp является СУЭ/ПЭК, модифицированный комплексом [Cu(L-Phe)2].
Таблица 3.
Сравнение энантиоселективности сенсоров на основе стеклоуглеродного электрода, модифицированных композитами ПЭК-АК*, и расчетные значения** разностей энтальпии реакций ассоциации триптофана, тирозина, пропранолола с комплексными модификаторами
| Сенсор | Аналит | ΔEp, мВ | ipL/ipD | Δ∆Hr, кДж/моль |
|---|---|---|---|---|
| СУЭ/ПЭК-[Cu(L-Phe)(Gly)] | Trp | 20 | 1.23 | 13.7 |
| СУЭ/ПЭК-[Zn(L-Phe)2] | Trp | 10 | 1.16 | 4.3 |
| СУЭ/ПЭК-[Co(L-Phe)3] | Trp | 10 | 1.13 | 6.7 |
| СУЭ/ПЭК-[Cu(L-Phe)2] | Trp | 39 | 1.33 | 25.3 |
| СУЭ/ПЭК-[Cu(L-Phe)(Gly)] | Tyr | 28 | 1.28 | 6.7 |
| СУЭ/ПЭК-[Zn(L-Phe)2] | Tyr | 10 | 1.14 | 4.9 |
| СУЭ/ПЭК-[Co(L-Phe)3] | Tyr | 10 | 1.06 | 5.5 |
| СУЭ/ПЭК-[Cu(L-Phe)2] | Tyr | 20 | 1.30 | 29.6 |
| СУЭ/ПЭК-[Cu(L-Phe)(Gly)] | Prp | 11 | 1.24 | 3.01 |
| СУЭ/ПЭК-[Zn(L-Phe)2] | Prp | 20 | 1.07 | 6.78 |
| СУЭ/ПЭК-[Cu(L-Phe)2] | Prp | 10 | 1.15 | 2.12 |
Особенность энантиоселективных сенсоров на основе подобных комплексов, применяемых в качестве модификаторов, – возможность реализации нескольких механизмов, обеспечивающих появление различий аналитических сигналов L- и D-энантиомеров аналита. С одной стороны, аналит способен концентрироваться на поверхности хирального слоя за счет разного рода межмолекулярных взаимодействий (водородные связи, π−π и ван-дер-ваальсовы взаимодействия) [3, 43], которые по-разному проявляются для энантиомеров аналита из-за различий в конфигурации. За счет разных конфигураций могут различаться как токи пиков энантиомеров, так потенциалы. С другой стороны, комплексы металлов способны к лигандному обмену [21–25, 42], например
Замена лиганда в комплексе на энантиомер аналита вызывает изменение его электронной структуры и, как следствие, различие в формах вольтамперограмм. Очевидно, что скорость лигандного обмена и степень изменения электронной структуры будут различаться для комплексов типа [Me(L-Ligand, L-Analyte)] и [Me(L-Ligand, D-Analyte)], что приведет к появлению различий в аналитических сигналах L- и D-энантиомеров аналита. К сожалению, точного представления о вкладе указанных механизмов в формирование энантиоселективности конкретного сенсора до сих пор нет.
Мы полагаем, что первый механизм является основным, а для проявления лигандного обмена необходимы достаточная лабильность модифицирующего комплекса и способность аналита образовывать прочный комплекс, что не всегда возможно. Например, для энантиомеров Prp, который явно не способен к лигандному обмену с комплексами [Cu(L-Phe)(Gly)], [Zn(L-Phe)2], [Cu(L-Phe)2], токи пиков и потенциалы окисления различны. С другой стороны, в случае аминокислот (Trp, Tyr), способных к лигандному обмену [21, 23, 25], можно ожидать, что энантиоселективность будет формироваться в рамках двух указанных выше механизмов. Действительно, разности потенциалов окисления (табл. 3), наблюдаемые при определении D- и L-энантиомеров этих кислот на сенсорах, модифицированных комплексами Cu(II), Co(III), Zn(II), совпадают с данными [44] о лабильности комплексных соединений металлов, которая должна падать в ряду Cu > Zn > Co.
На основе расчета структур ассоциатов Trp с комплексными модификаторами можно предложить механизм формирования энантиоселективности:
Расчетные данные, полученные в приближении PM3, свидетельствуют о том, что все рассмотренные комплексы должны обеспечивать энантиоселективность сенсора по отношению к энантиомерам Trp и Tyr, причем наилучшую энантиоселективность обеспечивают комплексы меди (табл. 3), что неплохо коррелирует с экспериментальными данными.
Судя по структуре ассоциатов, основным сайтом связывания аналитов с комплексами является ароматический фрагмент лигандов. Появление отличий во взаимодействиях обеспечивается разницей в пространственном строении L- или D-конфигураций триптофана. Например, для ассоциата ${\text{Cu}}{{({\text{L - Phe}})}_{2}}{\text{*L - Trp}}$ имеет место дополнительное взаимодействие между аминогруппами аналита и лиганда, которое отсутствует в случае ${\text{Cu}}{{({\text{L - Phe}})}_{2}}{\text{*D - Trp}}{\text{.}}$
Для изучения электрохимических свойств предложенного сенсора СУЭ/ПЭК-[Cu(L-Phe)2] провели циклические вольтамперометрические и импедансометрические измерения в стандартном растворе гексацианоферрата(II/III) калия. Циклические вольтамперограммы описывают типичный одноэлектронный обратимый окислительно-восстановительный процесс (рис. 2а) редокс-пары [Fe(CN)6]3–/4–. Из рисунка видно, что после модифицирования поверхности стеклоуглеродного электрода пленкой ПЭК пики окислительно-восстановительной пары [Fe(CN)6]3–/4– уменьшаются по сравнению с немодифицированным электродом, что обусловлено увеличением сопротивления переноса заряда в результате модифицирования поверхности электрода. При введении в полиэлектролитный комплекс аминокислотного комплекса меди(II) [Cu(L-Phe)2] токи на циклических вольтамперограммах возрастают по сравнению с СУЭ, модифицированным только ПЭК.
Рис. 2.
Циклические вольтамперограммы (а) и диаграммы Найквиста (б) 5.0 мМ раствора редокс-пары [Fe(CN)6]3–/4– на различных электродах (1 – СУЭ, 2 – СУЭ/ПЭК-[Cu(L-Phe)2], 3 – СУЭ/ПЭК) на фоне 0.1 М раствора KCl при скорости развертки потенциала 0.1 В/с.
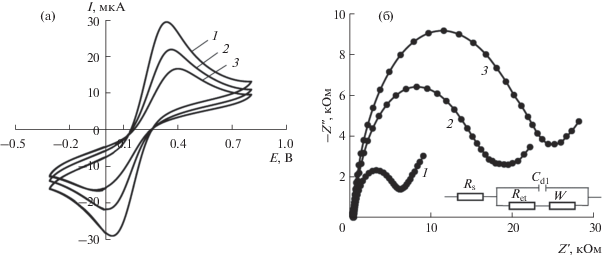
Для подтверждения полученных закономерностей параметры электронного переноса оценили методом спектроскопии электрохимического импеданса, используя для количественной характеристики эквивалентные ячейки Рэндлса. Диаграммы Найквиста (рис. 2б) показывают, что при нанесении пленки композита на поверхность электрода происходит замедление процесса переноса электронов по сравнению с немодифицированным электродом (Ret = 5.3 кОм). Наименьшую электропроводность имеет электрод, модифицированный ПЭК (Ret = 21.9 кОм). Электрод, модифицированный ПЭК-[Cu(L-Phe)2], занимает промежуточное положение (Ret = 15.8 кОм).
Рассчитанная по уравнению Рэндлса−Шевчика [45] эффективная площадь поверхности составляет 2.38 ± 0.09 мм2 для СУЭ, 1.12 ± 0.09 мм2 для СУЭ/ПЭК и 1.44 ± 0.09 мм2 для СУЭ/ПЭК-[Cu(L-Phe)2], т.е. добавление аминокислотного комплекса приводит к увеличению площади эффективной поверхности по сравнению с СУЭ/ПЭК.
Известно, что Trp необратимо окисляется в ФБ с pH 6.86 на СУЭ с переносом двух электронов [41] с образованием на вольтамперограмме одного пика в диапазоне потенциалов от 0.6 до 1.2 В. На рис. 3 представлены линейные вольтамперограммы окисления энантиомеров Trp на изученных электродах. Следует отметить, что вольтамперограммы энантиомеров Trp на немодифицированном СУЭ не отличаются друг от друга, на СУЭ, модифицированных только ПЭК, имеются небольшие различия в высоте максимальных токов пиков окисления и форме вольтамперограмм, что свидетельствует о том, что данный комплекс за счет своих функциональных групп проявляет небольшую энантиоселективность по отношению к энантиомерам Trp. При добавлении к ПЭК аминокислотного комплекса меди [Cu(L-Phe)2] (рис. 3в) возникает значительное различие между потенциалами окисления (ΔEp = 39 мВ), токами пика энантиомеров (Δip = 1.41 мкА); коэффициент селективности (ipL/ipD) составляет 1.33, что свидетельствует о хорошей энантиоселективности разработанного сенсора по отношению к энантиомерам Trp.
Рис. 3.
Линейные вольтамперограммы 0.3 мМ растворов L- и D-Тrp на СУЭ (а), СУЭ/ПЭК (б) и СУЭ/ПЭК-[Cu(L-Phe)2] (в) (фосфатный буферный раствор с рН 6.86, скорость развертки потенциала 0.1 В/c).

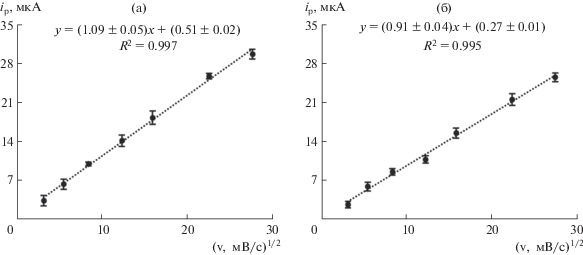
Для установления природы электрохимического процесса оценили влияние скорости изменения потенциала на токи окисления энантиомеров в 0.3 мМ растворах Trp в диапазоне от 0.01 до 0.75 В/с. Критерий Семерано [46] (коэффициент скорости электродного процесса), рассчитанный из логарифмической зависимости тока пика электроокисления энантиомеров Trp от скорости развертки потенциала (tg α = ∆lg Ip/∆lg ν) для L-Trp и D-Trp, равен 0.46 и 0.48 соответственно, в обоих случаях коэффициенты корреляции близки к 1 (0.991–0.998), следовательно, процесс окисления контролируется диффузией аналитов, что также подтверждается линейной зависимостью токов окисления от квадратного корня скорости развертки потенциала (рис. 4).
Рис. 4.
Зависимость тока пика от квадратного корня скорости развертки потенциала в диапазоне от 10 до 750 мВ/с для L-Trp (a) и D-Trp (б) (фосфатный буферный раствор с рН 6.86).
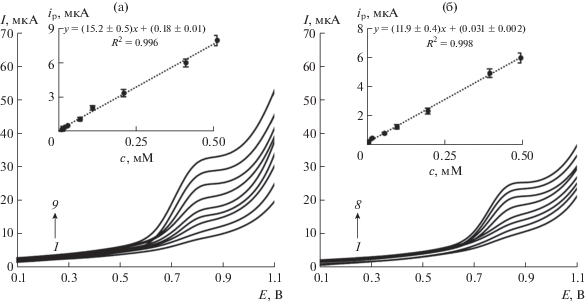
На рис. 5 представлены линейные вольтамперограммы окисления последовательно разбавленных растворов L- и D-Trp и соответствующие градуировочные графики на СУЭ, модифицированном ПЭК-[Cu(L-Phe)2]. Сенсор позволяет определять L-Trp в модельном растворе с пределом обнаружения 5.75 × 10–7 M в диапазоне определяемых концентраций 6.25 × 10–7 до 0.5 × 10–3 М, D-Trp – с пределом обнаружения 7.34 × 10–7 M в диапазоне определяемых концентраций 5 × 10–6 до 0.5 × 10–3 М. Чувствительность сенсора к L-Trp (Δip/Δc = 15.2 мкА/мМ) больше, чем к D-Trp (Δip/Δc = 11.9 мкА/мМ).
Рис. 5.
Линейные вольтамперограммы растворов L-Trp (a) и D-Trp (б) различной концентрации на СУЭ/ПЭК-[Cu(L-Phe)2]; 1 → 9 для L-Trp: 0.000625 (1), 0.005 (2), 0.01 (3), 0.02 (4), 0.06 (5), 0.1 (6), 0.2 (7), 0.4 (8), 0.5 (9) мМ; 1 → 8 для D-Trp: 0.005 (1), 0.01 (2), 0.02 (3), 0.06 (4), 0.1 (5), 0.2 (6), 0.4 (7), 0.5 (8) мМ (фосфатный буферный раствор с рН 6.86, скорость развертки потенциала 0.1 В/c). Вставки: соответствующие градуировочные графики.
Правильность результатов определения энантиомеров Trp предложенным сенсором оценивали методом введено–найдено (табл. 4). Установлено, что сенсор с высокой точностью позволяет определять содержание энантиомеров Trp в широком диапазоне концентраций. Относительное стандартное отклонение при определении энантиомеров Trp в чистом растворе колеблется в пределах 1.1–4.5%, в моче 1.5–4.8%, а в плазме крови 1.3–6.1%. В моче человека показатели правильности более стабильны по сравнению с показателями в плазме крови, что связано со сложным составом плазмы крови, в которой содержится около 7–10% органических и неорганических веществ, в том числе и аминокислот, а в моче человека содержание таких веществ не превышает 1% [47].
Таблица 4.
Результаты вольтамперометрического определения энантиомеров триптофана на СУЭ/ПЭК-[Cu(L-Phe)2] в чистых растворах и в биологических жидкостях (ФБ с рН 6.86, скорость развертки потенциала 0.1 В/с, n = 5, P = = 0.95)
| Исследуемый образец | Определяемый энантиомер | Введено, мкМ | Найдено, мкМ | sr, % | Относительная погрешность, % |
|---|---|---|---|---|---|
| Чистый раствор | L-Trp | 300 | 298.2 ± 4.1 | 1.1 | 0.4 |
| 80 | 82.3 ± 2.4 | 2.3 | 2.9 | ||
| 40 | 40.4 ± 2.2 | 4.5 | 1.0 | ||
| D-Trp | 300 | 301.9 ± 5.4 | 1.5 | 0.6 | |
| 80 | 78.8 ± 3.4 | 3.5 | 1.5 | ||
| 40 | 40.1 ± 1.9 | 3.8 | 0.3 | ||
| Моча | L-Trp | 300 | 294.9 ± 5.5 | 1.5 | 1.7 |
| 80 | 79.5 ± 2.3 | 2.4 | 0.6 | ||
| 40 | 38.0 ± 2.2 | 4.8 | 4.0 | ||
| D-Trp | 300 | 296.6 ± 5.3 | 1.4 | 1.1 | |
| 80 | 78.0 ± 3.0 | 3.1 | 2.5 | ||
| 40 | 39.8 ± 2.2 | 4.4 | 2.0 | ||
| Плазма | L-Trp | 300 | 295.8 ± 6.1 | 1.7 | 1.4 |
| 80 | 79.1 ± 4.0 | 4.1 | 1.1 | ||
| 40 | 40.9 ± 2.7 | 5.5 | 4.7 | ||
| D-Trp | 300 | 299.5 ± 4.8 | 1.3 | 0.2 | |
| 80 | 81.6 ± 5.0 | 4.9 | 2.0 | ||
| 40 | 39.4 ± 3.0 | 6.1 | 1.5 |
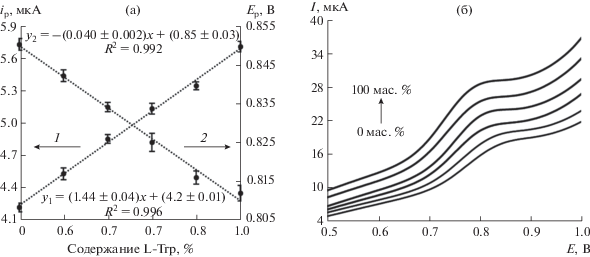
Изучена возможность использования композитного сенсора СУЭ/ПЭК-[Cu(L-Phe)2] для оценки содержания энантиомеров Trp в их смеси. На рис. 6 приведены линейные вольтамперограммы при различном содержании L-Trp (0, 20, 40, 60, 80, 100%) в 0.3 мМ растворах смеси энантиомеров Trp на СУЭ/ПЭК-[Cu(L-Phe)2]. Видно, что потенциалы пиков смещаются в сторону положительных значений, в то время как токи пиков возрастают с увеличением содержания L-Trp. Линейные зависимости изменения токов пика и потенциалов окисления, свидетельствуют о том, что сенсор на основе СУЭ/ПЭК-[Cu(L-Phe)2] с хорошими аналитическими характеристиками позволяет определять энантиомеры Trp в смесях с различным соотношением L- и D-Trp.
Рис. 6.
(а) Зависимость максимального тока пика (1) и потенциала пика (2) от содержания L-Тrp в 0.3 мМ растворе смеси энантиомеров. (б) Линейные вольтамперограммы 0.3 мМ смесей энантиомеров Trp с разным содержанием L-Тrp на СУЭ/ПЭК-[Cu(L-Phe)2] (фосфатный буферный раствор с рН 6.86, скорость развертки потенциала 0.1 В/c). Содержание L-Тrp, мас. %: 0, 20, 40, 60, 80, 100.
* * *
Изученные в работе характеристики композитных энантиоселективных вольтамперометрических сенсоров с использованием хелатных комплексов переходных металлов Cu(II), Co(III), Zn(II) в качестве хиральных селекторов показывают, что комплексы стабильны в условиях эксперимента и обеспечивают достаточную энантиоселективность при определении хиральных аналитов, например триптофана, тирозина и пропранолола. Показано, что энанантиоселективность зависит от металла комплексообразователя и структуры комплекса. Наилучшие результаты наблюдаются при использовании комплексов меди, которые согласно квантово-химическим расчетам имеют строение, близкое к планарному. Так, сенсор на основе СУЭ, модифицировнного композитом полиэлектролитного комплекса хитозан−сукцинилхитозана и бисфенилаланилата меди(II), обеспечивает определение энантиомеров триптофана с коэффициентом энантиоселективности 1.33. По результатам исследований электродных характеристик энантиоселективный сенсор на основе СУЭ/ПЭК-[Cu(L-Phe)2] представляется эффективной хиральной платформой для определения энантиомеров триптофана в широком круге объектов. По сравнению с ранее описанными хиральными сенсорами [12, 48–50] данный сенсор отличается низкой стоимостью, простотой изготовления, высокими чувствительностью и точностью определения энантиомеров триптофана как в модельных растворах, так и в искусственно приготовленных образцах биологических жидкостей. В целом можно отметить, что сенсоры, модифицированные различными аминокислотными комплексами переходных металлов, обладают перекрестной чувствительностью к энантиомерам биологически активных веществ и могут быть использованы в мультисенсорных системах не только для контроля “энантиомерной чистоты” лекарственных средств [12, 51], но и для установления их подлинности, производителя [52, 53] и срока годности [54].
Исследование выполнено за счет гранта Российского научного фонда № 21-13-00169, https://rscf.ru/project/21-13-00169/.
Список литературы
Майстренко В.Н., Евтюгин Г.А., Зильберг Р.А. Энантиоселективные вольтамперо-метрические сенсоры. Уфа: Изд-во БашГУ, 2018. 188 с.
Майстренко В.Н., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры на основе хиральных материалов// Журн. аналит. химии. 2020. Т. 75. № 12. С. 1080. (Maistrenko V.N., Zil’berg R.A. Enantioselective voltammetric sensors on the basis of chiral materials // J. Anal. Chem. 2020. V. 75. № 12. P. 1514.)
Niu X., Yang X., Li H., Liu J., Liu Z., Wang K. Application of chiral materials in electrochemical sensors // Microchim. Acta. 2020. V. 187. Article 676.
Майстренко В.Н., Сидельников А.В., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры: новые решения // Журн. аналит. химии. 2018. Т. 73. № 1. С. 3. (Maistrenko V.N., Sidel’nikov A.V., Zil’berg R.A. Enantioselective voltammetric sensors: New solutions // J. Anal. Chem. 2018. V. 73. № 1. P. 1.)
Iacob B.-C., Bodoki E., Oprean R. Chiral electrochemical sensors based on molecularly imprinted polymers with pharmaceutical applications / Handbook of Sustainable Polimers: Processing and applications / Eds. Thakur V.K., Thakur M.R. Jenny Stanford Publishing, 2016. P. 587.
Moein M.M. Advancements of chiral molecularly imprinted polymers in separation and sensor fields: A review of the last decade // Talanta. 2021. V. 224. Article 121794.
Bel Bruno J.J. Molecularly imprinted polymers // Chem. Rev. 2019. V. 119. P. 94.
Radi A.-E., Wahdan T., EL-Basiony A. Electrochemical sensors based on molecularly imprinted polymers for pharmaceuticals analysis // Curr. Anal. Chem. 2019. V. 15. P. 219.
Kingsford O.J., Zhang D., Ma Y., Wu Y., Zhu G. Electrochemically recognizing tryptophan enantiomers based on carbon black/poly-L-cysteine modified electrode // J. Electrochem. Soc. 2019. V. 166. P. B1226.
Stoian I.A., Iacob B.C., Ramalho J.P.P., Marian I.O., Chiș V., Bodoki E., Oprean R. A chiral electrochemical system based on L-cysteine modified gold nanoparticles for propranolol enantiodiscrimination: Electroanalysis and computational modeling // Electrochim. Acta. 2019. V. 326. Article 134961.
Upadhyay S.S., Gadhari N.S., Srivastava A.K. Biomimetic sensor for ethambutol employing β-cyclodextrin mediated chiral copper metal organic framework and carbon nanofibers modified glassy carbon electrode // Biosens. Bioelectron. 2020. V. 165. Article 112397.
Зильберг Р.А., Майстренко В.Н., Яркаева Ю.А., Дубровский Д.И. Энантиоселективная вольтамперометрическая сенсорная система для распознавания D и L-триптофана на основе стеклоуглеродных электродов, модифицированных композитами полиариленфталида с α-, β- и γ-циклодекстринами // Журн. аналит. химии. 2019. Т. 74. С. 941. (Zil’berg R.A., Maistrenko V.N., Yarkaeva Y.A., Dubrovskii D.I. An eantioselective voltammetric sensor system based on glassy carbon electrodes modified by polyarylenephthalide composites with α-, β-, and γ-cyclodextrins for recognizing D- and L-tryptophans // J. Anal. Chem. 2019. V. 74. P. 1245.)
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for the recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. P. 1886.
Atta N.F., Galal A., Ahmed Y.M. Highly conductive crown ether/ionic liquid crystal-carbon nanotubes composite based electrochemical sensor for chiral recognition of tyrosine enantiomers // J. Electrochem. Soc. 2019. V. 166. P. B623.
Sun Y., He J., Huang J., Sheng Y., Xu D., Bradley M., Zhang R. Electrochemical recognition of tryptophan enantiomers based on the self-assembly of polyethyleneimine and chiral peptides // J. Electroanal. Chem. 2020. V. 865. Article 114130.
Zhang Y., Liu G., Yao X., Gao S., Xie J., Xu H., Lin N. Electrochemical chiral sensor based on cellulose nanocrystals and multiwall carbon nanotubes for discrimination of tryptophan enantiomers // Cellulose. 2018. V. 25. P. 3861.
Зильберг Р.А., Яркаева Ю.А., Проворова Ю.Р., Гуськов В.Ю., Майстренко В.Н. Вольтамперометрическое определение энантиомеров пропранолола в модельных растворах лекарственных форм и биологических жидкостях // Аналитика и контроль. 2018. Т. 22. № 3. С. 292.
Ghiamati E., Oliaei S. Thermodynamic Studies on the Interaction between phenylalanine with some divalent metal ions in water and water-dioxane mixtures // SOJ Biochem. 2017. V. 3. P. 1.
Pettit L.D. Critical survey of formation constants of complexes of histidine, phenylalanine, tyrosine, L-DOPA and tryptophan // Pure Appl. Chem. 1984. V. 56 № 2. P. 247.
Ariga K., Shionoya M. Nanoarchitectonics for coordination asymmetry and related chemistry // Bull. Chem. Soc. Jpn. 2021. V. 94. P. 839.
Bao L., Dai J., Yang L., Ma J., Tao Y., Deng L., Kong Y. Electrochemical recognition of tyrosine enantiomers based on chiral ligand exchange with sodium alginate as the chiral selector // J. Electrochem. Soc. 2015. V. 162. P. H486.
Chen X., Zhang S., Shan X., Chen Z. Derivative chiral copper(II) complexes as template of an electrochemical molecular imprinting soL-gel sensor for enantiorecognition of aspartic acid // Anal. Chim. Acta. 2019. V. 1072. P. 54.
Zhou Y., Nagaoka T., Yu B., Levon K. Chiral ligand exchange potentiometric aspartic acid sensors with polysiloxane films containing a chiral ligand N-carbobenzoxy-aspartic acid // Anal. Chem. 2009. V. 81. P. 1888.
Chen Q., Zhou J., Han Q., Wang Y., Fu Y. Electrochemical enantioselective recognition of tryptophane enantiomers based on chiral ligand exchange // Coll. Surface B. 2012. V. 92. P. 130.
Zhao Y., Cui L., Ke W., Zheng F., Li X. Electroactive Au@Ag nanoparticle assembly driven signal amplification for ultrasensitive chiral recognition of D-/L-Trp // ACS Sustain Chem. Eng. 2019. V. 7. P. 5157.
Колесов С.В., Гурина М.С., Мударисова Р.Х. Об устойчивости водных нанодисперсий полиэлектролитных комплексов на основе хитозана и N-сукцинилхитозана // Высокомолекулярные соединения. Серия А. 2019. Т. 61. № 3. С. 195.
Berestova T.V., Gizatov R.R., Galimov M.N., Mustafin A.G. Influence of the absolute configuration of the ligand’s chiral center on the structure of planar-square phenyL-containing bis-(N,O)copper(II) chelates // J. Mol. Struct. 2021. V. 1236. Article 130303.
Berestova T.V., Khursan S.L., Mustafin A.G. Experimental and theoretical substantiation of differences of geometric isomers of copper(II) α-amino acid chelates in ATR-FTIR spectra // J. Spectrochim. Acta A. 2020. V. 229. Article 117950.
Alam M.M., Rahman S.M.M., Rahman M.M., Islam S.M.S. Simultaneous preparation of facial and meridional isomer of cobalt-amino acid complexes and their characterization // J. Sci. Res. 2010. V. 2. № 1. P. 91.
Stewart J.J.P. Optimization of parameters for semiempirical methods I. Method // J. Comput. Chem. 1989. V. 10. № 2. P. 209.
Stewart J.J.P. Optimization of parameters for semiempirical methods II. Applications // J. Comput. Chem. 1989. V. 10. № 2. P. 221.
Stewart J.J.P. Optimization of parameters for semiempirical methods. III Extension of PM3 to Be, Mg, Zn, Ga, Ge, As, Se, Cd, In, Sn, Sb, Te, Hg, Tl, Pb, and Bi // J. Comput. Chem. 1991. V. 12. № 3. P. 320.
Stewart J.J.P. Optimization of parameters for semiempirical methods IV: Extension of MNDO, AM1, and PM3 to more main group elements // J. Mol. Model. 2004. V. 10. № 2. P. 155.
Delley B. An all-electron numerical method for solving the local density functional for polyatomic molecules // J. Chem. Phys. 1990. V. 92. P. 508.
Delley B. From molecules to solids with the DMol3 approach // J. Chem. Phys. 2000. V. 113. P. 7756.
Materials Studio Version 6.0. Accelrys Inc. San Diego. 2011.
Sun H. COMPASS: An ab initio force-field optimized for condensed-phase applications overview with details on alkane and benzene compounds // J. Phys. Chem. B. 1998. V. 102. № 38. P. 7338.
Akkermans R.L.C., Spenley N.A., Robertson S.H. Monte Carlo codes, tools and algorithms Monte Carlo methods in materials studio molecular simulation // Mol. Simul. 2013. V. 39. 2013. P. 1153.
Cheng H., Chen C., Zhang S. Electrochemical behavior and sensitive determination of L-tyrosine with a gold nanoparticles modified glassy carbon electrode // Anal. Sci. 2009. V. 25. № 10. P. 1221.
Xuan C., Xia Q., Xu J., Wang Q., Lin X., Fu. Y. A biosensing interface based on Au@BSA nanocomposite for chiral recognition of propranolol // Anal Methods. 2016. V. 8. № 17. P. 3564.
Xu J., Wang Q., Xuan C., Xia Q., Lin X., Fu Y. Chiral recognition of tryptophan enantiomers based on β-cyclodextrin-platinum nanoparticles/grapheme nanohybrids modified electrode // Electroanalysis. 2016. V. 28. P. 868.
Gou H., He J., Mo Z., Wei X., Hu R., Wang Y., Guo R. A highly effective electrochemical chiral sensor of tryptophan enantiomers based on covalently functionalize reduced graphene oxide with L-lysine // J. Electrochem. Soc. 2016. V. 163. P. B272.
Dalgliesh C.E. The optical resolution of aromatic aminoacids on paper chromatograms // J. Chem. Soc.1952. V. 137. P. 3940.
Басоло Ф., Джонсон Р. Химия координационных соединений. М.: Мир, 1966. 196. с.
Bard A.J., Faulkner L.R. Electrochemical Methods. Fundamentals and Applications. N.Y.: Wiley, 2004. 833 p.
Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основы современного электрохимического анализа. М.: Мир: Бином ЛЗ, 2003. 592 с.
Строев Е.А. Биологическая химия. М.: Высшая школа, 1986. 479 с.
Song J., Yang C., Ma J., Han Q., Ran P., Fu Y. Voltammetric chiral discrimination of tryptophan using a multilayer nanocomposite with implemented amino-modified beta-cyclodextrin as recognition element // Microchim. Acta. 2018. V. 185. P. 230.
Tao Y., Dai J., Kong Y., Sha Y. Temperature-sensitive electrochemical recognition of tryptophan enantiomers based on beta‑cyclodextrin self-assembled on poly(L-glutamic acid) // Anal. Chem. 2014. V. 86. P. 2633.
Li Z., Mo Z., Yan P., Meng S., Wang R., Niu X., Liu N., Guo R. Chiral electrochemical recognition of tryptophan enantiomers at a multi-walled carbon nanotube-N-carboxymethyl chitosan composite modified glassy carbon electrode // New J. Chem. 2018. V. 42. P. 11635.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Y.A., Khamitov E.M., Maksutova E.I., Kornilov V.M. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. № 4. P. 619.
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for the recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. № 16. P. 1886.
Яркаева Ю.А., Дубровский Д.И., Зильберг Р.А., Майстренко В.Н. Вольтамперометрические сенсоры и сенсорная система на основе модифицированных полиариленфталидами золотых электродов для распознавания цистеина // Электрохимия. 2020. Т. 56. № 7. С. 591.
Кабирова Л.Р., Дубровский Д.И., Никонова Н.А., Косихина Ю.К., Зильберг Р.А., Майстренко В.Н. Контроль качества атенолола с помощью вольтамперометрических сенсоров на основе “умных” полимеров // Вестник Башкирского университета. 2018. Т. 23. № 4. С. 1088.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии