Журнал аналитической химии, 2021, T. 76, № 2, стр. 151-160
Оптимизация совокупности процедур и условий одновременного определения амикарбазона и его метаболитов в объектах окружающей среды и растительных матрицах методом высокоэффективной жидкостной хроматографии с УФ-детектированием
Т. Д. Черменская a, *, Е. Ю. Алексеев a
a Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург−Пушкин, шоссе Подбельского, 3, Россия
* E-mail: tchermenskaya@yandex.ru
Поступила в редакцию 13.07.2020
После доработки 05.08.2020
Принята к публикации 18.08.2020
Аннотация
Показана возможность определения амикарбазона и его двух метаболитов в одной анализируемой пробе методом ВЭЖХ с УФ-детектированием в воде, почве, зерне, масле и зеленой массе кукурузы. Установлено, что после извлечения аналитов из образцов ацетонитрилом и очистки способом твердофазной экстракции при использовании комбинации сорбентов C18ЕС и активированного угля и патрона Диапак С степень извлечения всех аналитов составляет 81–90% с погрешностью 1.1–2.5%. Предел количественного определения 0.05 мг/кг. Для извлечения веществ из образцов воды использовали патроны для твердофазной экстракции Диапак С16. Разработанная методика применима для определения амикарбазона и его метаболитов в объектах окружающей среды и сельскохозяйственной продукции.
Ежегодно на рынке средств защиты растений появляются препараты на основе новых действующих веществ, способных к проявлению пестицидной активности. Однако каким бы привлекательными ни был препарат в плане биологической эффективности, он должен соответствовать требованиям экотоксикологической безопасности. По этой причине изучение и определение остаточных количеств пестицидов в продукции растениеводства и объектах окружающей среды имеет важное значение при разработке и внедрении новых средств защиты растений [1]. Безопасными для здоровья потребителя принято считать продукты, которые или не содержат токсических веществ, или содержат их в количествах, допустимых санитарными нормами и гигиеническими нормативами.
Амикарбазон является селективным гербицидом, который действует путем ингибирования фотосинтеза. Он используется для предпосевной, предвсходовой или послевсходовой обработки кукурузы в поле для избирательного контроля широколиственных сорняков [2]. Амикарбазон – это триазолиноновый гербицид, разработанный для замены атразина на мировом рынке. Впервые зарегистрирован Агентством по охране окружающей среды США (EPA) в 2005 году. Входит в состав препаратов Amitron 700WG, содержащий 700 г/кг амикарбазона, Amicarbazone DF, Xonerate и Dinamic 70% (США). US EPA установлены максимально допустимые уровни (МДУ) содержания амикарбизона в кукурузе (кукуруза (фураж) – 0.80 мг/кг, зерне – 0.05 мг/кг, соломе – 1.0 мг/кг [3]. В России препарат с действующим веществом амикарбазон в настоящее время проходит регистрационные испытания и МДУ пока не установлены.
Амикарбазон является умеренно стойким в аэробной почве, он устойчив к прямому фотолизу, гидролизу и анаэробному водному метаболизму [4, 5]. При лабораторных и полевых исследованиях идентифицированы три основных метаболита амикарбазона (АМЗ), образующихся в почве – дезамино амикарбазон (ДА), N-метил-дезамино амикарбазон и декарбоксамид, также обладающие высокой мобильностью. Показано, что быстрее всех в почве разлагается АМЗ и с наименьшей скоростью ДА. Дезамино амикарбазон также образуется в водных системах в результате непрямого фотолиза. В растениях основными метаболитами амикарбазона считаются дезамино амикарбазон и изопропил-2-гидрокси-дезамино амикарбазон (изопр-2-ОН-ДА) [6, 7].
Первые способы выделения амикарбазона и метаболитов из сои предусматривали экстракцию либо водой, либо 0.05%-ной Н3РО4, либо смесью ацетонитрил–0.1%-ная уксусная кислота (4 : 1) при 150°С под давлением 1500 psi в присутствии оксида алюминия с последующими очисткой на катриджах для твердофазной экстракции (ТФЭ) и определением методом ВЭЖХ с масс-спектрометрическим детектированием (предел определения 0.01 ppm, полнота извлечения 85–97% с погрешностью 2–6%) [2].
В настоящее время возможно одновременное определение АМЗ, ДА и изопр-2-ОН-ДА в почве [6, 8], а также в зерне (рис, пшеница, гречка), соевых бобах, кукурузе с применением метода ВЭЖХ с масс-спектрометрическим детектированием [9, 10].
Описана методика анализа готовых форм препаратов, содержащих в качестве действующего вещества амикарбазон, методом ВЭЖХ с УФ-детектированием (ВЭЖХ-УФ) [11–13].
Сведения об использовании метода ВЭЖХ-УФ для одновременного определения амикарбазона, дезамино амикарбазона и изопропил-2-ОН-дезамино амикарбазона в объектах окружающей среды и растительных матрицах в литературе отсутствуют.
Данное исследование посвящено созданию более доступного для широкого использования способа одновременного определения амикарбазона и его метаболитов в объектах окружающей среды и растительных матрицах с применением ВЭЖХ-УФ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы. Стандартные растворы амикарбазона и его метаболитов готовили из аналитических стандартов с чистотой 99.6% (амикарбазон); 99.6% (дезамино амикарбазон); 99.9% (изопропил-2-гидрокси-дезамино амикарбазон) (Arysta Lifescience, Япония).
Для выделения определяемых веществ применяли ацетонитрил (сорт 5), гексан сорт 3 (Криохром, Россия), дихлорметан х. ч., ацетон ос. ч., метанол х. ч., этилацетат х. ч., NaCl ч. д. а., Na2SO4 безводный ч. д. а. (Вектон, Россия), NaOH х. ч. (Реахим, Россия), MgSO4 безводный 97%, натрий цитрат двузамещенный сесквигидрат 99%, натрий цитрат трехзамещенный дигидрат 98% (Sigma-Aldrich, США).
Для очистки экстрактов использовали cорбенты на основе силикагеля с привитыми эндкепированными октадецильными группами (С18Е) и с привитыми пропиламинными группами (CH2)3NH2 (PSA) (Agilent Technologies, США), флорисил 60–100 меш (Sigma-Aldrich, США), оксид алюминия, нейтральный по Брокманну II (Reanal, Венгрия), силикагель 60 (40–63 мкм) (Мerck, Германия), уголь активированный (0.5–1.5 мм) (Вектон, Россия) и патроны для ТФЭ – Диапак С16 (гидрофобный сорбент с привитыми гексадецильными группами, 3 мл, 63–200 мкм, 100 Å), Диапак С (гидрофильный слабокислотный сорбент с постоянной активностью, 3 мл, 40–63 мкм, 60 Å) и Диапак Амин (слабоосновный анионообменник с привитыми аминогруппами, 3 мл, 63–200 мкм, 100 Å) (БиоХимМак СТ, Россия).
Для приготовления подвижной фазы использовали ацетонитрил (сорт 0, Криохром, Россия), воду (бидистиллированную, деионизированную), кислоту ортофосфорную х. ч. (Вектон, Россия).
Аппаратура. Применяли высокоэффективный жидкостный хроматограф Alliance с УФ-детектором, хроматографическую колонку Sun Fire C18 (250 × 4.6 мм, 5.0 мкм) (Waters, США); аппарат для встряхивания Multi Reax (Heidolph, Германия); центрифугу 5810 (Eppendorf AG, Германия); ротационный вакуумный испаритель R‑205 (Buchi, Швейцария), вакуумный манипулятор для работы с патронами для твердофазной экстракции (Waters, США) с мембранным насосом V‑850 (Buchi, Швейцария).
Приготовление стандартных растворов. Исходный стандартный раствор амикарбазона и метаболитов с концентрацией 0.5 мг/мл готовили растворением аналитических стандартов амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона по 50.0 ± 0.5 мг в ацетонитриле в мерной колбе емк. 100 мл. Градуировочные растворы с концентрациями 0.05, 0.1, 0.2, 0.5 и 1.0 мкг/мл готовили последовательным разбавлением, используя подвижную фазу. Градуировочную кривую строили по серии стандартных растворов, содержащих от 0.05 до 1.0 мкг/мл амикарбазона и метаболитов в подвижной фазе.
Условия определения амикарбазона и метаболитов методом ВЭЖХ-УФ. Подвижная фаза – смесь ацетонитрила и 0.005 М H3PO4 (40 : 60). Скорость потока элюента 1.0 мл/мин, рабочая температура колонки 25°C, рабочая длина волны 220 нм, объем вводимой пробы 20 мкл.
В методе ВЭЖХ-УФ использовали метод абсолютной градуировки. На каждом из 5 уровней концентраций амикарбазона и метаболитов в диапазоне 0.05–1.0 мкг/мл проводили по 3 измерения. Градуировочные графики были линейны с коэффициентами корреляции (R2) 0.999538 (амикарбазон), 0.999490 (дезамино амикарбазон) и 0.999553 (изопропил-2-гидрокси-дезамино амикарбазон). Степень извлечения амикарбазона и его метаболитов определяли на четырех уровнях концентраций в пяти повторностях.
Пробоподготовка. Для выделения амикарбазона и метаболитов из воды образец воды (50 мл) вносили на патрон Диапак С16, предварительно промытый 2.5 мл ацетонитрила, затем 3 мл воды. Патрон с нанесенным образцом промывали 5 мл смеси ацетонитрил–вода (1 : 9, по объему), элюировали аналиты 6 мл смеси ацетонитрил–вода (2 : 1, по объему). Элюат упаривали досуха при температуре не выше 40°С, сухой остаток растворяли в 1 мл подвижной фазы и 20 мкл вводили в хроматограф.
Для выделения амикарбазона и метаболитов из почвы к образцу почвы (10 г), помещенному в полипропиленовую центрифужную пробирку емк. 50 мл, добавляли в качестве экстрагента 20 мл ацетона. Продолжительность экстракции с помощью аппарата для встряхивания составляла 10 мин с последующим центрифугированием в течение 10 мин при 4000 об/мин. Из экстракта отбирали аликвоту 4 мл, соответствующую 2 г почвы, которую упаривали при температуре бани не выше 40°С. Сухой остаток растворяли в 1 мл подвижной фазы и 20 мкл пробы вводили в хроматограф.
Для выделения амикарбазона и его метаболитов из зерна и масла кукурузы к 10 г образца анализируемого материала (измельченных зерна или зеленой массы) или масла в полипропиленовой центрифужной пробирке емк. 50 мл последовательно добавляли 10 мл ацетонитрила, 4 г безводного сульфата магния, 1 г хлорида натрия, 1 г цитрата натрия (трехзамещенный дигидрат) и 0.5 г цитрата натрия (двузамещенный сесквигидрат). К образцам зерна дополнительно добавляли 7 мл воды, к образцам масла – 3 мл воды. Экстракцию проводили с помощью аппарата для встряхивания в течение 10 мин с последующим центрифугированием в течение 10 мин при 4000 об/мин.
Для очистки экстракта 5 мл верхнего ацетонитрильного слоя переносили в центрифужную пробирку емк. 15 мл, содержащую 125 мг активированного угля, 250 мг сорбента С18Е и 750 мг безводного сульфата магния. Содержимое пробирки встряхивали в течение 10 мин, затем центрифугировали в течение 10 мин при 4000 об/мин. 2 мл экстракта (из верхнего ацетонитрильного слоя) упаривали досуха при температуре бани не выше 40°С. Сухой остаток растворяли в 1 мл подвижной фазы и подготовленную пробу (20 мкл) вводили в хроматограф.
Выделение амикарбазона и его метаболитов из зеленой массы осуществляли описанным выше способом, но сухой остаток, полученный после очистки экстракта с помощью активированного угля и сорбента С18Е, дополнительно очищали на патронах Диапак С. Для этого его растворяли в 1 мл смеси гексан–этилацетат (1 : 1, по объему), наносили на патрон, предварительно промытый 2 мл метанола, 2.5 мл этилацетата и затем 3 мл смеси гексан–этилацетат (1 : 1, по объему). Колбу ополаскивали еще 1 мл смеси гексан–этилацетат (1 : 1, по объему) и также наносили на патрон. Патрон с нанесенным образцом промывали 5 мл смеси гексан–этилацетат (1 : 1, по объему). Амикарбазон и метаболиты элюировали 5 мл этилацетата и 6 мл смеси этилацетат–метанол (1 : 1, по объему), элюаты объединяли и упаривали досуха на ротационном вакуумном испарителе при температуре бани не более 40°С. Сухой остаток растворяли в 1 мл подвижной фазы и 20 мкл пробы вводили в хроматограф.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При разработке способа определения амикарбазона и его двух метаболитов одновременно в одной анализируемой пробе методом ВЭЖХ-УФ необходимо было установить оптимальные условия хроматографирования и идентификации аналитов, их экстракции и очистки, обеспечивающие максимальную степень извлечения для каждого из веществ из объектов окружающей среды и растений.
Условия определения амикарбазона, дезамино амикарбазона и изопропил-2-ОН-дезамино амикарбазона методом ВЭЖХ-УФ. При оптимизации условий хроматографирования и идентификации амикарбазона и его двух метаболитов с целью обеспечения максимальной чувствительности и хорошего разделения всех трех компонентов варьировали длину волны, тип колонки и соотношение компонентов подвижной фазы.
Для решения задачи совместного определения трех веществ в одной пробе в первую очередь необходимо определить длину волны, обеспечивающую наибольшую чувствительность при определении всех трех соединений. В УФ-спектре поглощения аналитических стандартов АМЗ, ДА и изопр-2-ОН-ДА имеется только один максимум при 219.7 нм. При использовании ультраэффективного хроматографа с диодной матрицей и колонкой с фазой С18 (50 × 2.1 мм, 1.7 мкм) разделить аналиты не получилось. На данной колонке АМЗ и изопр-2-ОН-ДА выходят практически в мертвом объеме. Изменение соотношения ацетонитрила и 0.005 М H3PO4 с 60 : 40 на 40 : 60 приводит к увеличению времени удерживания с 0.72 мин до 1.05 мин для АМЗ и с 0.63 мин до 0.76 мин для изопр-2-ОН-ДА соответственно, но пики деформируются.
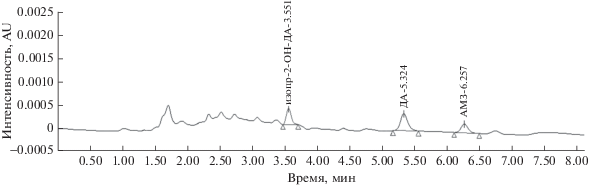
Хорошее разделение АМЗ, ДА и изопр-2-ОН-ДА достигнуто при использовании высокоэффективного жидкостного хроматографа Alliance с давлением, не превышающим 4000 psi, и колонкой С18 длиной 250 мм при составе подвижной фазы 40% ацетонитрила и 60% 0.005 М H3PO4. При длине волны 220 нм нижняя граница определяемых содержаний составила 0.05 мкг/мл (рис. 1).
Отметим, что в известных методиках нижняя граница определяемых содержаний амикарбазона методом ВЭЖХ-УФ при длинах волн 270 нм [11], 230 нм [12] и 223 нм [13] при соотношении компонентов подвижной фазы 60% ацетонитрила и 40% воды составляет 0.2–0.3 мкг/мл.
Выделение амикарбазона, дезамино амикарбазона и изопропил-2-ОН-дезамино амикарбазона из воды. Амикарбазон и его метаболиты относятся к триазолинонам (табл. 1). Амикарбазон достаточно хорошо растворяется в воде, лучше всего – в ацетоне, ацетонитриле и дихлорметане – более 250 ppm, в этилацетате – 140 ppm, неплохо растворяется в спиртах, практически нерастворим в гексане – 0.07 ppm. Метаболиты слабо растворимы в диметилсульфоксиде и метаноле [2, 4].
Таблица 1.
Основные характеристики амикарбазона и его метаболитов
| Название | Структурная формула | Молекулярная масса и брутто-формула |
|---|---|---|
| Амикарбазон (АМЗ) |
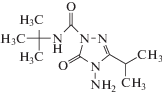 |
М = 241.3 С10Н19N5O2 |
| Дезамино амикарбазон (ДА) |
 |
М = 226.3 С10Н18N4O2 |
| Изопропил-2-гидрокси- дезамино амикарбазон (изопр-2-ОН-ДА) |
 |
М = 242.3 С10Н18N4O3 |
Исходя из химических свойств амикарбазона и его метаболитов, для их извлечения из воды опробованы экстракцию органическими растворителями, в том числе из проб воды с разными значениями рН, и ТФЭ на патроне Диапак С16 (табл. 2). Как видно, экстракция органическим растворителем не обеспечивает достаточной степени извлечения каждого из аналитов при их совместном выделении. Максимальная степень извлечения всех определяемых веществ (90–100%) достигнута при ТФЭ на патроне Диапак С16. Так как вещества элюировались последовательно при разных соотношениях ацетонитрила и воды в подвижной фазе с уменьшением ее полярности, элюат состава ацетонитрил–вода (2 : 1) в достаточном количестве позволил извлечь все три компонента (рис. 2).
Таблица 2.
Экстракция амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона (0.5 мкг) из воды (50 мл)
| Экстрагент | Степень извлечения, % | |||
|---|---|---|---|---|
| АМЗ | ДА | изопр-2-ОН-ДА | ||
| Дихлорметан | 79.4 | 100 | 19.3 | |
| Этилацетат при | рН 3 | 66.7 | 100 | 61.0 |
| рН 7 | 58.4 | 83.3 | 63.1 | |
| рН 9 | 34.3 | 45.0 | 10.0 | |
Выделение амикарбазона, дезамино амикарбазона и изопропил-2-ОН-дезамино амикарбазона из почвы. При подготовке проб почвы для количественного анализа исследовали экстракцию органическими растворителями, повторную экстракцию из водных остатков при разных значениях рН и метод QuEChERS, включающий экстракцию и очистку на сорбенте (табл. 3).
Таблица 3.
Условия выделения амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона (10 мкг) из почвы (10 г)
| Экстрагент, процедура | Степень извлечения, % | |||
|---|---|---|---|---|
| АМЗ | ДА | изопр-2-ОН-ДА | ||
| 10 мл ацетонитрила* | 68.5 | 42.3 | 16.4 | |
| 10 мл 1%-ной муравьиной кислоты в ацетонитриле (рН 3) | 67.0 | 58.5 | 39.0 | |
| QuEChERS (набор для пробоподготовки для фруктов и овощей)** | 75.0 | 46.0 | 2.0 | |
| 40 мл этилацетата, 4 мл экстракта упаривают досуха и растворяют в подвижной фазе | 67.0 | 51.0 | 37.0 | |
| 40 мл 50%-ного водного ацетона, 20 мл упаривают до воды, повторно экстрагируют этилацетатом при | ||||
| рН 3 | 34.4 | 0 | 41.0 | |
| рН 7 | 55.6 | 70.8 | 49.6 | |
| рН 9 | 73.0 | 0 | 35.0 | |
| 10 мл ацетона, 1 мл экстракта упаривают досуха и растворяют в подвижной фазе | 84.6 | 81.2 | 75.5 | |
| 20 мл ацетона, 1 мл экстракта упаривают досуха и растворяют в подвижной фазе | 89.0 | 87.5 | 79.8 | |
* Экстракцию осуществляют встряхиванием в течение 10 мин, экстракт отделяют центрифугированием при 4000 об/мин в течение 10 мин. В вариантах, где экстрагируют ацетонитрилом, перед анализом к 0.5 мл экстракта добавляют 0.5 мл 0.005 М Н3РО4. ** QuEChERS (набор для пробоподготовки для фруктов и овощей): 10 мл ацетонитрила + 5 мл воды + 4 г MgSO4 + 1 г NaCl + + 0.5 г цитрата натрия двузамещенного сесквигидрата + 1 г цитрата натрия трехзамещенного дигидрата, 5 мл экстракта подвергают очистке на сорбенте PSA.
При использовании в качестве экстрагента метанола получили отрицательные результаты (степень извлечения менее 1%). Наиболее подходящим экстрагентом оказался ацетон, использование которого позволило не только извлечь амикарбазон и метаболиты из почвы с хорошим выходом (75–85%), но и анализировать полученный экстракт без дополнительной очистки. Увеличение количества экстрагента (ацетона) позволило увеличить степени извлечения до 80–89% в зависимости от соединения (рис. 3).
Высокие степени извлечения АМЗ и ДА (88.1 и 93.5% соответственно) достигнуты при экстракции из образцов почвы смесью метанол–5%-ная уксусная кислота при нагревании до 100°С и давлении 1500 psi в течение 10 мин [6] и при экстракции АМЗ, ДА и изопр-2-ОН-ДА из почвы (84–96%), с помощью модифицированного метода QuEChERS [4]. В обоих случаях использовали хроматографию с масс-спектрометрическим детектором, что обеспечило низкий предел количественного определения 0.01 мг/кг.
Выделение амикарбазона, дезамино амикарбазона и изопропил-2-ОН-дезамино амикарбазона из растительных матриц. Экстракты растительных матриц, как правило, требуют предварительной очистки от сопутствующих примесей перед анализом, особенно в случае использования ультрафиолетового детектора. Метаболиты амикарбазона содержат в своей структуре подвижный атом водорода в положении 4 триазольного кольца, что способствует образованию водородных связей с различными реагентами. Кроме того, наличие свободной гидроксильной группы у изопр-2-ОН-ДА может приводить к образованию достаточно прочных водородных связей с сорбентами.
Для изучения поведения АМЗ, ДА и изопр-2-ОН-ДА на сорбентах разных типов, в том числе на патронах для ТФЭ, использовали стандартные растворы определяемых веществ (табл. 4).
Таблица 4.
Сравнение степени извлечения амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона при использовании разных сорбентов
| Тип сорбента | Степень извлечения, % | ||
|---|---|---|---|
| АМЗ | ДА | изопр-2-ОН-ДА | |
| Сорбенты (50 мг на 1 мл раствора амикарбазона и метаболитов с концентрацией по 0.5 мкг/мл) | |||
| Силикагель | 81.9 | 21.7 | – |
| Оксид алюминия | 90.4 | – | – |
| Флорисил | 50.8 | – | – |
| С18Е | 100 | 100 | 100 |
| PSA | 100 | 37.0 | – |
| Активированный уголь | 82.9 | 83.1 | 80.3 |
| Патроны для ТФЭ | |||
| Диапак С16 | 86.1 | 100 | 90.6 |
| Диапак С | 100 | 98.0 | 97.5 |
| Диапак Амин | 82.1 | 74.5 | 17.9 |
| Комбинации для очистки экстрактов* | |||
| Активированный уголь + Диапак С16 | 73.7 | 81.5 | 77.4 |
| С18Е + активированный уголь | 91.5 | 96.9 | 89.1 |
| Диапак С+ Диапак С16 | 52.5 | 85.0 | 57.1 |
| С18Е + активированный уголь + Диапак С | 88.6 | 83.8 | 83.1 |
* К 10 г образцов растительных матриц добавляли по 10 мкг АМЗ, ДА и изопр-2-ОН-ДА. Экстракцию органическими растворителями и очистку на сорбентах C18СЕ и активированном угле осуществляли встряхиванием в течение 10 мин, экстракт отделяли центрифугированием в течение 10 мин при 4000 об/мин. Условия промывки и элюирования на патронах для ТФЭ приведены в “Экспериментальной части”. Очищенные пробы перед анализом методом ВЭЖХ-УФ упаривали досуха, остаток растворяли в 1 мл подвижной фазы.
Оценка способности разных сорбентов (полярных и неполярных) адсорбировать изучаемые соединения показала, что наименьшей адсорбционной способностью обладают сорбент С18Е и активированный уголь. При использовании силикагеля, оксида алюминия и PSA приемлемые степени извлечения получили только для амикарбазона. Это может частично объяснить нашу неудачу при попытке использовать QuEChERS для извлечения аналитов из почвы.
Адсорбция амикарбазона и его метаболитов максимальна при использовании сорбентов Диапак С16 и Диапак С. При выбранных оптимальных условиях промывки и элюирования аналитов достигнута высокая степень извлечения (86–100%). Значительно меньшей эффективностью обладает Диапак Амин.
Для одновременного выделения, идентификации и количественного определения амикарбазона и его метаболитов в растительных матрицах исследовали разные способы извлечения определяемых веществ из образцов кукурузы и очистку экстрактов разными сорбентами (табл. 5). Проверка способов выделения АМЗ, ДА и изопр-2-ОН-ДА из образцов растительных матриц с использованием разных вариантов экстракции и очистки экстрактов на сорбентах показала неудовлетворительные результаты при экстракции ацетоном или ацетонитрилом и очистке на патронах для ТФЭ. При экстракции ацетонитрилом экстракты чище, чем в случае ацетона, но очистки на патронах недостаточно, чтобы адекватно оценить степень извлечения аналитов. Так как каждый сорбент в отдельности не обеспечивает достаточной степени чистоты независимо от использованного экстрагента, изучали комбинации сорбентов (табл. 4).
Таблица 5.
Условия выделения амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона из растительных матриц кукурузы
| Объект анализа | Экстрагент или способ экстракции | Очистка | Степень извлечения, % | ||
|---|---|---|---|---|---|
| АМЗ | ДА | изопр-2-ОН-ДА | |||
| Зеленая масса | Ацетон (40 мл) | Диапак С16 | 65.0 | 25.0 | – |
| Зеленая масса | Ацетон (40 мл) | Диапак С | 64.0 | 47.5 | – |
| Зеленая масса | Ацетонитрил (40 мл) | Диапак С16 | 65.0 | 25.0 | – |
| Зерно | 69.0 | 80.0 | 65.0 | ||
| Масло | 27.5 | 60.0 | 32.5 | ||
| Зеленая масса | Ацетонитрил (40 мл) | Диапак С | 61.0 | 50.0 | – |
| Зерно | 52.5 | 85.0 | 30.0 | ||
| Масло | 34.0 | 27.5 | 40.0 | ||
| Зерно | QuEChERS* | Активированный уголь 125 мг + + 750 мг MgSO4 | 83.0 | 58.0 | 66.0 |
| Зеленая масса | QuEChERS* | C18СЕ 250 мг + активированный уголь 125мг + 750 мг MgSO4 | 89.5 | 90.9 | 68.2 |
| Зерно | 94.4 | 91.2 | 94.4 | ||
| Масло | 100 | 80.0 | 78.9 | ||
| Зеленая масса | QuEChERS* | C18ЕС 250 мг + активированный уголь 125мг + 750 мг MgSO4 + Диапак С | 88.6 | 83.8 | 83.0 |
| Зерно | 86.4 | 87.7 | 81.2 | ||
| Масло | 86.1 | 83.2 | 85.6 | ||
Установлено, что экстракция ацетонитрилом по методу QuEChERS и очистка на сорбентах C18СЕ + активированный уголь достаточны для достижения высокой степени извлечения одновременно всех аналитов и необходимой чистоты пробы при при анализе образцов зерна и масла методом ВЭЖХ-УФ. Для обеспечения чистоты проб зеленой массы, необходимой для более точного количественного анализа, требуется дополнительная очистка адсорбционной ТФЭ на патроне Диапак С. Хотя в большинстве случаев для определения пестицидов используют QuEChERS с масс-спектрометрическим детектированием [14], этот метод может отвечать требованиям к чистоте проб и при анализе методом ВЭЖХ-УФ [15].
В результате детального изучения условий, методов и материалов, необходимых для определения амикарбазона и его метаболитов, разработали способы одновременного определения АМЗ, ДА и изопр-2-ОН-ДА в разных объектах окружающей среды и растительных матрицах методом ВЭЖХ-УФ (см. “Экспериментальную часть”). Предложенные способы апробированы при анализе разнообразных матриц (табл. 6, рис. 4).
Таблица 6.
Степени извлечения амикарбазона, дезамино амикарбазона и изопропил-2-гидрокси-дезамино амикарбазона (n = 20, Р = 0.95)
| Объект анализа | Диапазон определяемых концентраций, мг/кг (мг/л) | Степень извлечения, Хср ± ΔX, % | ||
|---|---|---|---|---|
| АМЗ | ДА | изопр-2-ОН-ДА | ||
| Вода | (0.002–0.02) | 87.7 ± 1.4 | 84.9 ± 1.5 | 80.9 ± 1.1 |
| Почва | 0.05–0.5 | 88.5 ± 2.2 | 89.3 ± 1.8 | 82.4 ± 1.5 |
| Зеленая масса кукурузы | 0.05–0.5 | 86.2 ± 1.5 | 83.7 ± 1.3 | 80.9 ± 1.6 |
| Зерно кукурузы | 0.05–0.5 | 87.6 ± 2.5 | 84.9 ± 1.7 | 81.6 ± 1.5 |
| Масло кукурузы | 0.05–0.5 | 89.5 ± 2.0 | 87.9 ± 2.4 | 84.1 ± 2.0 |
Рис. 4.
Хроматограмма экстрактов кукурузы с добавкой амикарбазона и его метаболитов по 0.05 мг/кг: (а) – зеленая масса, (б) – зерно, (в) – масло.

Описан [10] способ одновременного определения остаточных количеств амикарбазона и его метаболитов в кукурузе с использованием модифицированного метода QuEChERS, который включает экстракцию ацетонитрилом, очистку дисперсионной твердофазной экстракцией с графитизированным черным углеродом (GCB) и cорбентом октадецилсиланом C18 и последующее определение методом жидкостной хроматографии с масс-спектрометрическим детектированием. Степень извлечения в этом способе варьирует в пределах 85.1–111.0% с относительными стандартными отклонениями в диапазоне 2.3–11.0%. Предел количественного определения 5 мкг/кг.
Предлагаемый нами способ одновременного определения АМЗ, ДА и изопр-2-ОН-ДА методом ВЭЖХ с УФ-детектированием в зерне, масле и зеленой массе кукурузы с использованием для очистки дисперсионной твердофазной экстракцией комбинации сорбентов C18ЕС + активированного угля и дополнительно адсорбционной твердофазной экстракции на патроне Диапак С при анализе зеленой массы обеспечивает высокую степень извлечения всех аналитов (81–90%) с погрешностью 1.1–2.5% и достаточно низкий предел количественного определения 0.05 мг/кг.
Все известные способы определения амикарбазона и его метаболитов в биологических объектах с использованием ВЭЖХ с масс-спектрометрическим детектированием отличаются высокими чувствительностью и селективностью. Однако при их применении необходимо учитывать наличие матричного эффекта, который в значительной степени зависит от применяемой аппаратуры, способа подготовки образца к анализу, типа матрицы.
* * *
Таким образом, оптимизированный нами способ одновременного определения амикарбазона и его метаболитов в воде, почве, зеленой массе, зерне и масле кукурузы методом ВЭЖХ-УФ является надежным, статистически достоверным и точным, не требует использования дорогостоящего оборудования и доступен для широкого использования при анализе сельхозпродукции и мониторинге окружающей среды на остаточные количества гербицидов, содержащих амикарбазон.
Список литературы
Петрова М.О., Черменская Т.Д. Развитие исследований в аналитической лаборатории ВИЗР по оценке остаточных количеств пестицидов // Вестник защиты растений. 2020. Т. 103. № 2. С. 93.
Amicarbazone (MKH 3586). Summary of analytical chemistry and residue data. United States Environmental Protection Agency / HED Records Center Series 361 Science Reviews. File R110166. 2005. 306 p.
Amicarbazone. Scoping document and draft human health risk assessment / Registration Review. DP Number 426602. 2015. 53 p.
The pesticide manual / Ed. Tomlin C. Surrey: Brit. Crop. Prot. Council, 2009. 1457 p.
Griffiths M., Münks K.-W., Müller K.-H. Photosynthesis inhibitors: regulatory aspects, re-registration in Europe, market trends, and new products. Ch. 12 / Eds: Krämer W., Schirmer U., Jeschke P., Witschel M. / Modern Crop Protection Compounds. 3 Volume Set. Wiley-VCH Verlag GmbH & Co. KGaA, 2012. P. 510.
Dong M., Han W., Ediage E.N., Fan L., Tang H., Wang W., Han L., Zhao Z., Song W., Han Z. Dissipation kinetics and degradation mechanism of amicarbazone in soil revealed by a reliable LC−MS/MS method // Environ. Sci. Pollut. Res. Int. 2015. V. 22. P. 17518.
Amicarbazone: HED human health risk assessment for new food use / United States Environmental Protection Agency / HED Records Center Series 361 Science Reviews. File R112623. 2005. 86 p.
Bauer M.R. Analytical method for the determination of residues of MKH 3586 and three metabolites in soil by high-performance liquid chromatography tandem mass spectrometry (LC/MS/MS). Bayer Report N 109105. 1999. 63 p.
Dong M., Nie D., Tang H., Rao Q., Qu M., Wang W., Han L., Song W., Han Z. Analysis of amicarbazone and its two metabolites in grains and soybeans by liquid chromatography with tandem mass spectrometry // J. Sep. Sci. 2015. V. 38. № 13. P. 2245.
Dong M.-F., Bai B., Tang H.-X., Wang W.-M., Zhao Z.-H., Zheng H., Song W.-G. Determination of amicarbazone and its metabolites in corn and its plant with a modified QuEChERS by liquid chromatography tandem mass spectrometry // Chin. J. Anal. Chem. 2015. V. 43. № 5. P. 663.
Rodzinak K.J. Method Validation for Determination of Amicarbazone. Final Report. 2013. 11 p.
Jiang Y., Wu J., Zhang A. Analytical method of amicarbazone 70% WG by HPLC // Pest. Sci. Admin. 2015. № 4. P. 44.
Li X., Zhao Q., Wu T., Wang Y., Tang X. Analysis method of amicarbazone technical by HPLC // Chem. Ent. Manag. 2017. № 21. P. 1.
Петрова М.О., Черменская Т.Д. Поиск остаточных веществ пестицидов в сельскохозяйственной продукции – путь к безопасному продовольствию // Биосфера. 2019. Т. 11. № 1. С. 40.
Комарова А.С., Черменская Т.Д., Человечкова В.В. Определение аметоктрадина в растительных остатках и объектах окружающей среды методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектором // Журн. аналит. химии. 2017. Т. 72. № 10. С. 904. (Komarova A.S., Chermenskaya T.D., Chelovechkova V.V. Determination of ametoctradin in plant residues and environmental samples by HPLC with an UV Detector // J. Analyt. Chem. 2017. V. 72. № 10. P. 1077.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии