Журнал аналитической химии, 2021, T. 76, № 2, стр. 161-165
Определение золедроновой кислоты и креатинина методом гидрофильной хроматографии
Л. А. Карцова a, *, В. Д. Сомова a, Е. А. Бессонова a
a Санкт-Петербургский государственный университет
198504 Петродворец, Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: kartsova@gmail.com
Поступила в редакцию 20.07.2020
После доработки 24.08.2020
Принята к публикации 24.08.2020
Аннотация
Предложен вариант совместного определения золедроновой кислоты и креатинина в образцах сыворотки и плазмы крови методом гидрофильной хроматографии (HILIC). Установлены факторы, влияющие на определение золедроновой кислоты: состав и концентрация буферного раствора, природа стационарной фазы, наличие в элюенте винной кислоты в качестве конкурирующего агента для предотвращения процессов комплексообразования золедроновой кислоты с ионами металлов. Установлены линейные диапазоны концентраций для золедроновой кислоты и креатинина и пределы обнаружения этих аналитов. Найдены условия хроматографического анализа: амидная стационарная фаза; 5 мМ фосфатный буферный раствор, 2 мМ винная кислота (pH 7.0)/CH3CN, градиентный режим 90–70% CH3CN.
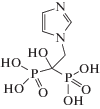
Золедроновая кислота – лекарственный препарат, ингибирующий действие остеокластов и резорбцию кости, относится к классу бифосфонатов и представляет собой азотсодержащую бисфосфоновую кислоту, широко используемую для профилактики или лечения остеопороза (схема 1 ).
Схема 1 . Структура золедроновой кислоты.
Cинтезированные в XIX веке бифосфонаты первоначально использовали в качестве умягчителей воды [1]. Потенциальная возможность предотвращения растворения гидроксиапатита, а значит и прекращение потери костной массы, обусловили первые медицинские исследования по изучению действия бифосфонатов при костных заболеваниях. Препараты на основе золедроновой кислоты подавляют активность остеокластов, которые при злокачественных новообразованиях и метастазировании разрушают здоровые клетки костей, используют для лечения остеопороза и различных заболеваний, характеризующихся хрупкостью костей. Одно из возможных побочных действий – нарушение работы почек, что контролируется содержанием сывороточного креатинина [2].
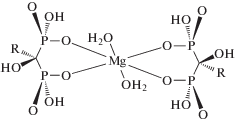
Традиционными методами определения бифосфонатов являются ион-парная [3, 4] и обращенно-фазовая ВЭЖХ-УФ или ВЭЖХ–МС/МС с предварительной дериватизацией для снижения полярности аналитов [5]. Однако большинство этих методов имеют ограничения в связи со способностью бифосфонатов к образованию прочных хелатных комплексов с ионами металлов, например магнием или железом(III) (схема 2 ), содержащимися в следовых количествах в хроматографической системе [6, 7]:
Схема. 2. Образование комплекса бифосфонатов с магнием [7].
Для предотвращения комплексообразования при ВЭЖХ-определении золедроновой кислоты в состав подвижной фазы добавляют фосфаты или пирофосфаты, а в раствор анализируемой пробы комплексообразующие агенты, например этилендиаминтетрауксусную кислоту (ЭДТА) или лимонную кислоту [3, 8].
Другой путь улучшения чувствительности ВЭЖХ–МС/МС-определения – использование аппаратного обеспечения, не содержащего металлов. Так в работе [6] хроматографическое разделение метилированных производных аледроната и внутреннего стандарта достигнуто на колонке, не содержащей металлов, с линейным градиентным элюированием.
Для определения высокополярной золедроновой кислоты и креатинина предпочтительно использовать гидрофильную хроматографию (hydrophilic interaction liquid chromatography, HILIC). В настоящей работе предложен вариант одновременного определения креатинина и золедроновой кислоты в биологических жидкостях методом HILIC с градиентным элюированием.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты. Стандарты определяемых аналитов: креатинин (>99.0%, Sigma, Германия), фармацевтическая субстанция золедроновой кислоты (standards USP). Для приготовления подвижных фаз и проведения пробоподготовки использовали ацетонитрил для ВЭЖХ, метанол для ВЭЖХ (Acros organics, США), муравьиную кислоту х. ч. (Реахим, Россия), ацетат аммония (Sigma, Германия), дигидрат дигидрофосфата натрия, дигидрат гидрофосфата натрия (AppliChem, Германия), ортофосфорную кислоту х. ч. (Реахим, Россия), воду деионизированную Milli Q Synthesis, гидрокисид натрия х. ч. (Реахим, Россия), лимонную кислоту, винную кислоту (Sigma, Германия), ЭДТА (AppliChem, Германия), пероксид водорода (Вектон, Россия).
Готовый буферный раствор фильтровали через фильтр под вакуумом водоструйного насоса, помещали в чистый стеклянный сосуд емк. 200 (500) мл, который герметически закрывали и хранили в холодильнике при +4°С.
Оборудование. Хроматографический анализ выполняли на жидкостном хроматографе LC-30 Nexera с диодно-матричным детектором. В качестве неподвижных фаз испытаны колонки с амидными, диольными и аминными фазами: XBridge Amide 150 × 2 мм, 3.5 мкм; YMC-Triat Diol HILIC 150 × 2 мм, 5 мкм; Luna NH2 250 × 4.6 мм, 5 мкм. Для обработки результатов анализа использовали программное обеспечение “LCsolution”. Деионизованную воду получали с помощью cистемы деионизации воды Деионизатор D-301 (Аквилон, Россия). рН буферных растворов для ВЭЖХ контролировали стационарным pH-метром S20-K SevenEasy (Mettler Toledo, Швейцария). Буферные растворы фильтровали под вакуумом водоструйного насоса через фильтры Nylon 66 Membranes 0.45 мкм × 47 мм (Supelco, США).
Приготовление стандартных и тестовых растворов золедроновой кислоты и креатинина. Для приготовления раствора стандарта золедроновой кислоты с концентрацией 1 мг/мл на микроаналитических весах отбирали точную навеску фармацевтической субстанции (1 мг), помещали в сухие чистые микропробирки емк. 1.5 мл и растворяли в 300 мкл деионизованной воды, затем добавляли 20 мкл 2 М раствора NaOH и 680 мкл ацетонитрила. Тестовые растворы с меньшей концентрацией (100 мкг/мл, 10 мкг/мл) получали разбавлением 60%-ным раствором ацетонитрила. Микропробирки с полученными растворами хранили при 4°C.
Тестовый раствор креатинина с концентрацией 1–2 мг/мл готовили растворением точной навески 1–2 мг аналита в водно-ацетонитрильном растворе (70 : 30, по объему) и хранили в морозильной камере до хроматографического анализа при –16°С. Рабочие растворы аналита (10, 1, 0.1 мкг/мл) готовили путем последовательного разбавления тестового раствора ацетонитрилом с помощью автоматического дозатора и хранили при +4°C в течение месяца.
Условия определения золедроновой кислоты и креатинина методом гидрофильной хроматографии. Варьировали природу буферного раствора (фосфатный, ацетатный; pH 3.0 и 7.0); хелатообразующего агента (ЭДТА, лимонная и винная кислоты) и его концентрацию (1, 2, 5, 10 мМ), режим элюирования (градиентный или изократический).
После серии предварительных экспериментов найдены требуемые хроматографические условия: колонка XBridge Amide (150 × 2 мм, 3.5 мкм); 5 мМ фосфатный буферный раствор (pH 7.0); 2 мМ винная кислота/CH3CN; градиентный режим 90–70% CH3CN; объем вводимой пробы – 20 мкл; УФ-детектирование, 205 нм.
Исследование окислительной деградации золедроновой кислоты. Отбирали 450 мкл раствора золедроновой кислоты, добавляли 50 мкл 3%-ного раствора пероксида водорода и в течение 30 мин выдерживали при комнатной температуре.
Для креатинина и золедроновой кислоты методом разбавления пробы найдены линейные диапазоны концентраций и пределы обнаружения. Предел обнаружения оценивали, как концентрацию аналита, дающую сигнал, равный утроенному уровню шума (отношение сигнал/шум 3 : 1) Линейный рабочий диапазон концентраций для креатинина 0.5–32 мкг/мл, для золедроновой кислоты – 50–800 мкг/мл.
Пробоподготовка образцов плазмы крови для хроматографического анализа. Лекарственные препараты определяли в плазме крови человека, содержащей гепарин в качестве антикоагулянта. 100 мкл плазмы крови помещали в микропробирку Эппендорфа емк. 1.5 мл, добавляли 300 мкл ацетонитрила, перемешивали в течение 2 мин. Затем пробу центрифугировали на центрифуге Eppendorf 5430 (Eppendorf, Германия) в течение 10 мин со скоростью 10 000 об/мин при 4°С, отбирали надосадочную жидкость и проводили хроматографический анализ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Золедроновая кислота – препарат, подавляющий активность остеокластов, которые при злокачественных новообразованиях и метастазировании разрушают здоровые клетки костей. Лекарства на ее основе увеличивают срок жизни онкологических больных, снимают болевой синдром, препятствуют распространению метастазов. Одно из побочных действий – возможное нарушение работы почек, что контролируется содержанием сывороточного креатинина.
Для определения высокополярных соединений в настоящее время активно востребована гидрофильная хроматография, представляющая собой вариант жидкостной хроматографии с полярной неподвижной фазой и водно-органической подвижной с небольшим (≤20%) содержанием воды. HILIC сочетает характерные особенности нормально-фазовой (полярная стационарная фаза), обращенно-фазовой (полярная подвижная фаза) и ионообменной (возможность ионообменных взаимодействий) жидкостной хроматографии [9]. Процесс формирования адсорбированного водного слоя у поверхности сорбента, благодаря которому реализуется режим гидрофильной хроматографии, определяется конкретными функциональными группами стационарной фазы [10]. Удерживание аналитов в HILIC обусловлено как распределительным механизмом между подвижной фазой и слоем воды, адсорбированным у поверхности полярного сорбента, так и адсорбционным, где важную роль могут играть электростатические взаимодействия и водородные связи. Вклад каждого из механизмов зависит от типа неподвижной фазы, рН элюента, природы и концентрации органического растворителя в подвижной фазе, а также от физико-химических свойств определяемых аналитов [11, 12]. Функциональные группы стационарной фазы в HILIC принято подразделять на нейтральные, заряженные и цвиттер-ионные [13, 14].
Несмотря на сложность механизма разделения, метод HILIC имеет ряд преимуществ по сравнению с нормально-фазовой (НФ) и обращенно-фазовой (ОФ) ВЭЖХ при разделении высокополярных водорастворимых веществ, которые в условиях ОФ и НФ ВЭЖХ либо элюируются с мертвым объемом, либо плохо растворимы в неполярных органических растворителях. Кроме того, при разделении аналитов методом HILIC не требуется введение ион-парных агентов в состав элюента. Это, в свою очередь, позволяет использовать масс-спектрометрическое детектирование.
В качестве подвижных фаз в гидрофильной хроматографии обычно используют полярные органические растворители, хорошо смешивающиеся с водой [13]. Режим градиентного элюирования в гидрофильной хроматографии отличается от ОФ ЖХ и характеризуется постепенным увеличением содержания воды. Факторы удерживания определяемых соединений тем выше, чем больше их гидрофильность [15]. Другой параметр, который приходится учитывать, – наличие буферных солей в составе элюента, снижающих электростатические взаимодействия между аналитами и активными центрами стационарной фазы [16]. Наиболее часто используют ацетаты и формиаты аммония (от 5 до 30 мМ), поскольку они достаточно летучие и не мешают масс-спектрометрическому детектированию.
Поскольку при хроматографическом определении бифосфонатов серьезным осложнением является их взаимодействие с ионами металлов с образованием прочных комплексов, провели серию экспериментов с добавлением в состав подвижной фазы конкурирующих комплексообразующих агентов (ЭДТА, винной и лимонной кислот). Наиболее эффективной оказалась добавка винной кислоты, поскольку константа устойчивости ее комплекса с железом(III), находящимся в следовых количествах в хроматографической системе, на несколько порядков выше по сравнению с лимонной кислотой и ЭДТА. Кроме того, в случае лимонной кислоты по сравнению с винной существенно выше поглощающий фон (рис. 1).
Рис. 1.
Хроматограмма фармацевтической субстанции золедроновой кислоты в присутствии винной (1) и лимонной кислоты (2) в составе подвижной фазы. Условия: 5 мМ фосфатный буфер, 5 мМ лимонной кислоты (5 мМ винной кислоты) (pH 7.0)/CH3CN, градиентный режим 90–50% CH3CN, 205 нм.
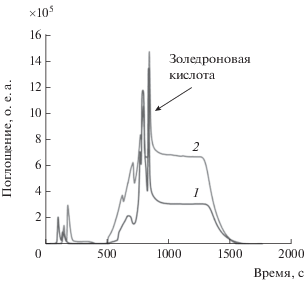
При введении хелатирующих добавок (винной, лимонной кислот, ЭДТА) непосредственно в пробу идентифицировать золедроновую кислоту не удалось. Результат достигнут лишь при введении комплексообразующего агента в состав подвижной фазы. Обнаружено, что с увеличением концентрации винной кислоты фактор селективности возрастает, однако увеличивается и уровень фона за счет ее поглощения при 205 нм (рис. 2).
Рис. 2.
Хроматограмма фармацевтической субстанции золедроновой кислоты с добавкой винной кислоты в элюент. Условия: XBridge Amide (150 × 2 мм, 3.5 мкм), п.ф.: 5 мМ фосфатный буферный раствор (pH 7.0), 2 мМ (1) и 10 мМ (2) винная кислота/CH3CN, градиентный режим 90–70% CH3CN, 205 нм.
Важными факторами, влияющими на определение золедроновой кислоты, являются состав и концентрация буферного раствора, а также природа стационарной фазы [17, 18]. Установлено, что возможно определение золедроновой кислоты при использовании фосфатного буферного раствора в связи с образованием фосфатных комплексов железа(III) и предотвращением образования комплекса железа(III) с золедроновой кислотой. Однако при концентрации фосфатного буферного раствора, превышающей 6.4 мМ, в подвижной фазе с большим содержанием ацетонитрила фосфат железа(III) выпадает в осадок. В дальнейшем использовали концентрацию фосфатного буферного раствора 5 мМ.
Испытаны различные стационарные фазы: амидная, диольная и аминная. Установлено, что золедроновая кислота практически не удерживается на неподвижной фазе с аминогруппами. При использовании диольной стационарной фазы, наоборот, золедроновая кислота хемосорбируется за счет образования водородных связей с сорбентом. Положительный результат достигнут на амидной неподвижной фазе в сочетании с фосфатным буферным раствором, содержащим 2 мМ винной кислоты в градиентном режиме элюирования. Амидная группа не заряжена в диапазоне рН элюентов, используемых в HILIC. Ионообменные взаимодействия с полярными аналитами на таких фазах практически отсутствуют, что уменьшает риск их необратимой адсорбции.
Определен линейный рабочий диапазон концентраций золедроновой кислоты (50–800 мкг/мл) и креатинина (0.5–32 мкг/мл). Пределы обнаружения составили 50 мкг/мл для золедроновой кислоты и 500 нг/мл для креатинина.
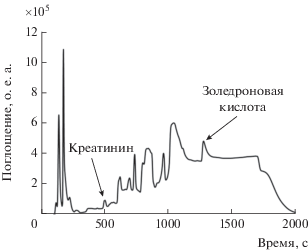
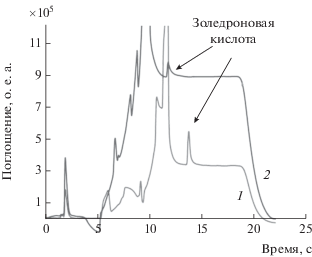
Для оценки возможности образования побочных продуктов при длительном хранении на воздухе активной фармацевтической субстанции золедроновой кислоты ее обычно подвергают стресс-тестам с использованием 3%-ного пероксида водорода. На рис. 3 представлена хроматограмма золедроновой кислоты до и после проведения тестов. Видно, что образуются несколько продуктов деградации, которые не мешают обнаружению золедроновой кислоты и могут быть независимо определены.
Рис. 3.
Хроматографическое определение золедроновой кислоты до (серый цвет) и после (черный цвет) деградации. Остальные условия см. в подписи к рис. 2.
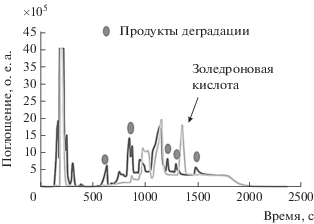
В найденных условиях HILIC проанализированы образцы сыворотки крови в присутствии золедроновой кислоты и креатинина (рис. 4).
* * *
Предложен вариант одновременного определения креатинина и золедроновой кислоты в биологических жидкостях методом гидрофильной хроматографии с УФ-детектированием с использованием амидной стационарной фазы и градиентного режима элюирования. Установлена необходимость введения в состав элюента 2 мМ винной кислоты в качестве конкурирующего комплексообразующего агента.
Работа выполнена при финансовой поддержке проекта РФФИ 18-53-80010 BRICS_t. Выражаем благодарность Ресурсному Центру МАСВ “Науч-ный парк СПбГУ” за предоставленное оборудование.
Список литературы
Zacharis C., Tzanavaras P.D. Determination of bisphosphonate active pharmaceutical ingredients in pharmaceuticals and biological material: A review of analytical methods // J. Pharm. Biomed. Anal. 2008. V. 48. P. 483.
Miller P.D. The kidney and bisphosphonates // Bone. 2011. V. 49. P. 77.
Reddy L.M., Reddy K.J., Reddy P.R. A simple RP-HPLC method for related substances of zoledronic acid in pharmaceutical products // Arabian J. Chem. 2017. V. 10. P. 196.
Warnke M., Breitbach Z.S., Dodbiba E., Crank J.A., Payagala T., Sharma P., Wanigasekara E., Zhang X., Armstrong D.W. Positive mode electrospray ionization mass spectrometry of bisphosphonates using dicationic and tricationic ion-pairing agents // Anal. Chim. Acta. 2009. V. 633. P. 232.
Veldboer K., Vielhaber T., Ahrens H., Hardes J., Streitbürger A., Karst U. Determination of zoledronic acid in human urine and blood plasma using liquid chromatography/electrospray mass spectrometry // J. Chromatogr. B. 2011. V. 879. P. 2073.
Yamada M., Lee X., Fujishiro M., Iseri K., Watanabe M., Sakamaki H., Uchida N., Matsuyama T., Kumazawaa T., Takahashi H., Ishii A., Sato K. Highly sensitive determination of alendronate in human plasma and dialysate using metal-free HPLC−MS/MS // Legal Medicine. 2018. V. 30. P. 14.
Freire E., Vega D.R., Baggio R. Zoledronate complexes. III. Two zoledronate complexes with alkaline earth metals: [Mg(C5H9N2O7P2)2(H2O)2] and [Ca(C5H9N2O7P2)2(H2O)]n // Acta Crystallogr. 2010. V. 66. P. 166.
Tanga Q., Jiangab S., Jiaa W., Shen D., Qiu Y., Zhao Y., Xue B., Lia C. Zoledronic acid, an FPPS inhibitor, ameliorates liver steatosis through inhibiting hepatic de novo lipogenesis // Eur. J. Pharm. Sci. 2017. V. 814. P. 169.
McCalley D.V. Understanding and manipulating the separation in hydrophilic interaction liquid chromatography // J. Chromatogr. A. 2017. V. 1523. P. 49.
Карцова Л.А., Бессонова Е.А., Сомова В.Д. Гидрофильная хроматография // Журн. аналит. химии. 2019. Т. 74. №. 5. С. 323. (Kartsova L.A., Bessonova E.A., Somova V.D. Hydrophilic interaction chromatography // J. Analyt. Chem. 2019. V. 74. № 5. Р. 415.)
Shi X., Qiao L., Xu G. Recent development of ionic liquid stationary phases for liquid chromatography // J. Chromatogr. A. 2015. V. 1420. P. 1.
Kowalska S., Krupczyńska K., Buszewski B. The influence of the mobile phase pH and the stationary phase type on the selectivity tuning in high performance liquid chromatography nucleosides separation // J. Sep. Sci. 2005. V. 28. P. 1502.
Olsen B.A., Pack B.W. Hydrophilic Interaction Chromatography: A Guide for Practitioners. Hoboken, NJ: Wiley, 2013. 336 p.
Qiao L., Shi X., Xu G. Recent advances in development and characterization of stationary phases for hydrophilic interaction chromatography // Trends Anal. Chem. 2016. V. 81. P. 23.
Alvareóz-Segura T., Retention X. pH profiles of acids and bases in hydrophilic interaction liquid chromatography // Anal. Chim. Acta. 2019. V. 1050. P. 176.
Alpert A.J. Effect of salts on retention in hydrophilic interaction chromatography // J. Chromatogr. A. 2018. V. 1538. P. 45.
Qiao L., Lv W., Chang M., Shi X., Xu G. Surface-bonded amide-functionalized imidazolium ionic liquid as stationary phase for hydrophilic interaction liquid chromatography // J. Chromatogr. A. 2018. V. 1559. P. 141.
Jandera P., Janas P. Recent advances in stationary phases and understanding of retention in hydrophilic interaction chromatography. A review // Anal. Chim. Acta. 2017. V. 967. P. 12.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии